-
Medical journals
- Career
Prognostické faktory renálního karcinomu
Authors: M. Čechová 1; M. Chocholatý 2; M. Babjuk 1; M. Kalousová 3; T. Zima 3
Authors‘ workplace: Urologická klinika, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Motol, Praha 1; Urologické oddělení, Fakultní nemocnice Trenčín 2; Ústav lékařské biochemie a laboratorní diagnostiky, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice, Praha 3
Published in: Rozhl. Chir., 2022, roč. 101, č. 10, s. 469-477.
Category: Review
doi: https://doi.org/10.33699/PIS.2022.101.10.469–477Overview
Renální karcinom představuje 2−3 % všech malignit v dospělém věku a jeho incidence v ČR patří k nejvyšším ve světě. Toto onemocnění probíhá často až do pozdních stadií zcela asymptomaticky, což ztěžuje jeho diagnostiku. I přes narůstající podíl malých, náhodně zjištěných tumorů při zobrazovacích vyšetřeních je i nadále přibližně jedna třetina nemocných diagnostikována s pokročilým onemocněním. K relapsu navíc dochází až u 40 % pacientů po chirurgickém výkonu pro lokalizovaný tumor. Zvýšení dostupnosti zobrazovacích vyšetření umožňujících časnou detekci renálního karcinomu a pokroky v systémové léčbě příznivě ovlivnily prognózu pacientů s tímto typem nádoru. Přesto mortalita renálního karcinomu zůstává mezi urologickými nádory nejvyšší. Individuální průběh onemocnění i odpověď na léčbu jsou obtížně predikovatelné. Byla identifikována řada prognostických faktorů renálního karcinomu, nejdůležitějšími zůstávají TNM klasifikace a grade tumoru. K přesnější predikci průběhu tohoto onemocnění je v současnosti dostupná řada multivariantních prognostických modelů. U lokalizovaného onemocnění jsou užitečné identifikace nemocných s vyšším rizikem relapsu, umožňují optimalizovat sledování po chirurgické léčbě. U metastatického onemocnění jsou rutinně užívány ke stratifikaci nemocných do rizikových skupin k volbě terapie. Dlouhodobě je snaha identifikovat vhodný biomarker, který by umožňoval časnou detekci tohoto onemocnění a byl užitečný k hodnocení prognózy. Současně by mohl přispět i ke zvýšení přesnosti prognostických systémů. Tento text poskytuje přehled prognostických faktorů renálního karcinomu včetně souhrnu potenciálních biomarkerů.
Klíčová slova:
prognostické faktory – renální karcinom – biomarker – nádorový marker – prognostické modely
ÚVOD
Renální karcinom (RCC) je nejčastější malignitou horních cest močových a představuje přibližně 2−3 % všech systémových malignit u dospělých s nejvyšším výskytem v západních zemích [1]. Incidence RCC v ČR patří dlouhodobě k nejvyšším ve světě, v roce 2018 dosahovala 29/100 000 obyvatel, kdy bylo diagnostikováno více než 3000 nových případů [2].
RCC představuje jedno z nejmalignějších urologických onemocnění s obtížně predikovatelným průběhem, které často zůstává asymptomatické až do pozdních stadií. Stále častěji je RCC zachycen jako náhodný nález při zobrazovacích vyšetřeních pro nespecifické obtíže pacienta či jiné břišní onemocnění. Klasická diagnostická triáda příznaků – hematurie, lumbalgie a hmatný tumor – je vzácná (6−10 % případů) a bývá spojena s pokročilým onemocněním a agresivním chováním nádoru. Většina pokročilých tumorů se projevuje spíše celkovými příznaky (jako jsou nechutenství, hubnutí, anemie, trombocytóza a další) či symptomy z nádorového rozsevu (kašel, dušnost, kostní bolesti a jiné). S paraneoplastickými příznaky se setkáváme až u 30 % symptomatických nemocných s RCC [3].
Přestože ve více než polovině případů je RCC zachycen jako malý incidentální tumor při zobrazovacích vyšetřeních, až u jedné třetiny nemocných se jedná o pokročilé onemocnění již v době diagnózy [3]. Ve stadiu metastatického onemocnění je diagnostikováno více než 15 % pacientů [4].
Včasné stanovení diagnózy a následné kompletní odstranění nádoru jsou v léčbě lokalizovaného RCC zásadní. Chirurgický výkon zůstává i nadále jedinou kurativní léčebnou metodou tohoto onemocnění. U stadia T1 preferujeme resekční výkon, který má excelentní funkční i onkologické výsledky. Ve vyšších stadiích je vhodným kurativním výkonem nefrektomie. K relapsu však dochází až u 20–40 % pacientů po resekci ledviny či nefrektomii pro lokalizované onemocnění [5].
Chemoterapie, radioterapie i hormonální léčba jsou u RCC typicky neúčinné. I přes velké pokroky v cílené systémové léčbě je prognóza pacientů s pokročilým či metastatickým RCC neuspokojivá a mnoho nemocných umírá pro insenzitivitu nebo toleranci na tyto léky.
Časná diagnostika a predikce individuálního průběhu onemocnění s identifikací pacientů s vysokým rizikem recidivy po chirurgickém výkonu mohou přispět ke snížení mortality tohoto onemocnění. Určení rizika recidivy je zásadní pro klinický přístup k nemocnému – volbu vhodného chirurgického výkonu a nastavení optimálního následného sledování včetně frekvence zobrazovacích vyšetření nebo k indikaci pacientů k adjuvantní léčbě v rámci klinických studií.
K predikci průběhu onemocnění se v současnosti nabízí řada prognostických modelů, které jsou založené na TNM klasifikaci tumoru (staging onemocnění) v kombinaci s dalšími běžně dostupnými klinickými či laboratorními parametry a histologickými vlastnostmi tumoru. Paralelně v posledních letech probíhá snaha o identifikaci dalších biomarkerů, které by mohly vést ke zpřesnění těchto modelů. Výzkum biomarkerů navíc může pomoci k lepšímu porozumění procesu kancerogeneze RCC a identifikaci dalších potenciálních cílových míst pro systémovou léčbu. Ovšem i přes intenzivní výzkumné snahy v posledních desetiletích nebyl do současné doby validován žádný specifický biomarker vhodný pro časnou diagnostiku, predikci průběhu onemocnění a odpovědi na léčbu ani žádný takový marker nebyl integrován do rutinní klinické praxe. Studium markerů specifických pro RCC je tedy zásadní.
Prognostické faktory
Prognostické faktory můžeme rozdělit na anatomické, histologické, klinické a molekulární. Prognostický význam anatomických a histologických faktorů je vyšší a je podložen silnějšími daty, než je použití faktorů klinických a molekulárních.
Anatomické prognostické faktory
Staging onemocnění
Nejdůležitějším prognostickým faktorem RCC je staging nádoru. Anatomické prognostické faktory jsou zahrnuty do TNM klasifikace, která zohledňuje lokální rozsah primárního tumoru, uzlinovou a žilní propagaci a výskyt vzdálených metastáz (Tab. 1). Platí, že u všech podtypů RCC se prognóza zhoršuje se vzrůstajícím T, N a M stadiem [3]. U metastatického onemocnění prognózu ovlivňují počet a lokalizace metastáz [7].
Table 1. TNM klasifikace renálního karcinomu 2017 [6]
Tab. 1: TNM classification system of renal cell carcinoma 2017 [6]![TNM klasifikace renálního karcinomu 2017 [6]<br>
Tab. 1: TNM classification system of renal cell carcinoma 2017 [6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6fba234262b074f010eaaafae7057280.jpg)
Pravidelné revize TNM klasifikace zajišťují co nejvyšší přesnost v hodnocení prognózy RCC a přínos případných změn musí být vždy adekvátně dokumentován. Aktuálně se používá verze klasifikace TNM8 (2017). V následujících bodech jsou uvedeny nejvýznamnější změny oproti předchozí verzi a komentáře ve vztahu k prognóze:
pT1 a pT2
Součástí TNM klasifikace je velikost tumoru měřená na preparátu v největším průměru s horní hranicí 4, 7 a 10 cm. Vliv velikosti tumoru na prognózu zkoumala řada studií, které potvrdily negativní korelaci mezi velikostí lokalizovaného tumoru a prognózou onemocnění [8,9]. Navíc u většiny tumorů s průměrem nad 7 cm již dochází k invazi do renálního sinu, a jsou tedy vyššího stadia s výrazně horší prognózou [10].
pT3a
Jako stadium pT3a je oproti předchozí verzi označeno jakékoli šíření tumoru do renální žíly a jejích větví. Přestože je invaze do perisinusálního tuku spojená s horší prognózou v porovnání s invazí do perirenálního tuku, jsou obě stadia hodnocena jako pT3a [8,11]. Jako pT3a je nově hodnoceno i šíření do kalichopánvičkového systému, které koreluje s horším přežitím, jež nebylo zahrnuto v předchozí verzi TNM klasifikace [8,12].
pT4
Infiltrace ipsilaterální nadledviny je spojena se špatnou prognózou a její přítomnost je nově klasifikována jako stadium pT4. Invaze do nadledviny se vyskytuje až ve 2 % případů všech RCC, zejména pak u velkých tumorů a/nebo tumorů vycházejících z horního pólu [8].
pN
TNM klasifikace rozlišuje pouze dvě N podkategorie (N0 a N1). Přestože bylo prokázáno, že přežití negativně koreluje s počtem pozitivních uzlin [8].
Histologické prognostické faktory
Histologické prognostické faktory zahrnují grade, histopatologický podtyp RCC, sarkomatoidní či rhabdoidní změny, mikrovaskulární invazi, přítomnost nekrózy v tumoru a invazi do sběracích kanálků. V prognostických modelech se nejčastěji uplatňují grade, subtyp RCC a přítomnost nekrózy.
Histologický subtyp renálního karcinomu
RCC představuje heterogenní skupinu tumorů vycházejících z renálních tubulů. Nejčastějším histologickým subtypem je světlobuněčný RCC (ccRCC), který prokazujeme až v 80 % případů. Méně časté histologické varianty představují papilární RCC (pRCC) (12 % případů), chromofobní RCC (chRCC) (5 % případů) a další vzácnější podtypy. Histologická varianta RCC je důležitým prognostickým faktorem.
Univariantní analýza prokázala lepší prognózu u nemocných s chRCC v porovnání s pRCC a ccRCC. Ovšem při rozdělení dle stadia onemocnění již prognostický v porovnání s dalšími nejčastějšími subtypy jedná již v době diagnózy o lokálně pokročilé onemocnění či jsou přítomny metastázy, což koreluje s horší prognózou. pRCC je tradičně dělen na podtyp 1 a 2, kdy podtyp 2 bývá spojován s horší prognózou. Tyto závěry však nebyly potvrzeny multivariantní analýzou [3].
Rozdíly mezi nejčastějšími histologickými subtypy dle stadia, jaderného gradu a nádorově specifického přežití (cancer specific survival, CSS) ilustruje tabulka (Tab. 2).
Table 2. Rozdíly mezi jednotlivými histologickými subtypy RCC dle stadia, jaderného gradu a CSS
Tab. 2: Differences in the stage, grade and CSS between individual histologic subtypes of RCC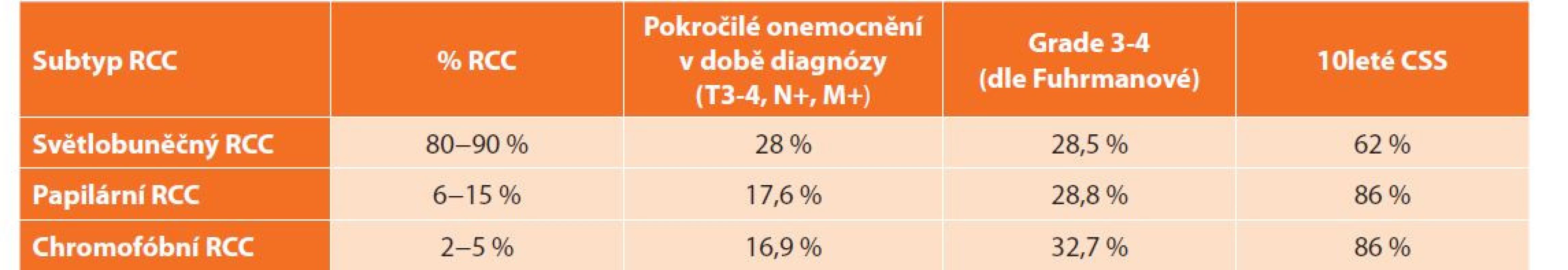
Vysvětlivky: Upraveno dle EAU Guidelines [3,14]. RCC − renální karcinom, CSS − nádorově specifické přežití (cancer specific survival) U všech histologických podtypů RCC se prognóza zhoršuje se stagem a gradem. Celkové 5leté přežití (over-all survival, OS) u RCC je 49 %. V porovnání s předchozími lety došlo k mírnému zlepšení, nejspíše v důsledku narůstajícího podílu náhodně zachycených menších tumorů a účinných možností systémové léčby [3]. Přesto i nadále patří RCC mezi urologická onemocnění s nejvyšší mortalitou.
Nádory vycházející ze sběracích kanálků a neklasifikované typy jsou tradičně spojeny s nejhorší prognózou. Špatnou prognózu lze očekávat i u raritního RCC s translokací Xp11.2, na který je třeba myslet u mladých pacientů [3].
Grade
Grading malignity představuje jeden z nejdůležitějších histologických faktorů ovlivňujících prognózu onemocnění. Hodnocení gradu je však zatíženo subjektivním mikroskopickým vyšetřením a je limitováno množstvím vyšetřované tkáně při velké histologické heterogenitě RCC.
Čtyřstupňová klasifikace jaderného gradu dle Fuhrmanové vychází z hodnocení charakteristik jádra a jadérka (velikost, tvar, obsah). Tato klasifikace byla široce akceptována a po desetiletí užívána. Ovšem její nevýhodou je výrazná variabilita mezi hodnotiteli a obtížná reprodukovatelnost při důsledném užívání všech čtyř stupňů. Proto byl International Society of Urological Pathology (ISUP) navržen nový gradingový systém, který byl následně WHO doporučen pro užití v klinické praxi. Jedná se také o čtyřstupňovou klasifikaci, kdy jaderné změny jsou hodnoceny gradem 1−3 a jako grade 4 je hodnocena přítomnost vysoce atypických pleomorfních buněk a/nebo sarkomatoidní či rhabdoidní změny. Výhodou nové WHO/ISUP klasifikace je snížení variability mezi hodnotiteli, a tedy jednodušší aplikovatelnost a reprodukovatelnost. Tato klasifikace nahradila stávající hodnocení jaderného gradu dle Fuhrmanové.
WHO/ISUP gradingový systém navíc poskytuje vyšší prognostickou přesnost v porovnání s hodnocením dle Fuhrmanové, a to zejména pro grade 2 a 3 tumory [15]. WHO/ISUP klasifikace se používá k hodnocení ccRCC a pRCC, avšak není aplikovatelná na chRCC. K hodnocení chRCC doporučuje recentní multicentrická studie autorů Ohashi, et al. dvoustupňovou klasifikaci (high - a low-grade) na základě hodnocení přítomnosti sarkomatoidních změn a/nebo nekrózy [3,16]. Ovšem používané prognostické systémy pracují s hodnocením gradu dle Fuhrmanové, použití WHO/ISUP gradingu pro tyto modely nebylo dosud validováno [3].
Přítomnost nekrózy
Přítomnost nekrózy v nádoru je zahrnuta v některých prognostických modelech. Prognosticky významná je ovšem pouze histologická přítomnost koagulační nekrózy, makroskopicky patrná nekróza je považována spíše za důsledek nádorové cévní trombózy. Předpokládá se, že ke vzniku koagulační nekrózy dochází v momentu, kdy nádory přerostou možnosti svého cévního zásobení, což odráží jejich agresivitu, rychlost proliferace a progrese [17].
Prognostický význam nekrózy byl prokázán u ccRCC a chRCC, nezávisle na stagingu a gradingu [8]. Oproti tomu pRCC vykazuje nekrózu poměrně často, její průkaz tedy postrádá příslušný prognostický význam [8]. Než pouhá přítomnost nekrózy se zdá být prognostiky významnější její rozsah [18]. Při histopatologickém hodnocení preparátu se podíl nekrózy udává v 5% přírůstcích, jednoznačná prognosticky významná hranice však nebyla jednoznačně stanovena.
Sarkomatoidní a rhabdoidní rysy
Morfologické změny typické pro high-grade nádory, jako je přítomnost rhabdoidních a zejména sarkomatoidních buněk, jsou spojeny se špatnou prognózou. 5leté CSS je u takto dediferenciovaných nádorů udáváno v rozmezí 15−22 % a ve většině případů jsou již v době diagnózy přítomny vzdálené metastázy [8]. Sarkomatoidní a rhabdoidní změny se mohou vyskytovat u všech histologických subtypů RCC, ale nejčastěji k této dediferenciaci dochází u chRCC a ccRCC. Tyto změny jsou klasifikovány podle WHO/ISUP klasifikace jako grade 4. Indikátorem špatné prognózy je zejména přítomnost sarkomatoidních změn. Současně i rozsah této morfologie má negativní prognostický vliv, ovšem není jednoznačný koncenzus na jeho přesném hodnocení [3].
Mikrovaskulární invaze
K metastazování RCC dochází hematogenní a lymfogenní cestou. Makroskopická invaze do velkých cév je zohledněna v TNM klasifikaci a je prognostickým faktorem již řadu let. Ovšem prognostický význam mikrovaskulární invaze (MVI) nebyl zcela potvrzen. Pod pojmem MVI rozumíme jak invazi do mikroskopických cév, tak do lymfatických cév. Autoři Kroger, et al. potvrdili negativní korelaci MVI s přežitím, nezávisle na velikosti, jaderném gradu a histologickém subtypu RCC, navíc popsali její prognostický význam u nízkých stadií RCC nezávisle na jaderném gradu [19]. Metaanalýza autorů Huang, et al. ukázala až trojnásobně vyšší riziko recidivy, vzniku metastáz a zkrácení CSS při průkazu MVI [20].
Chirurgické okraje
Pozitivní chirurgické okraje představují potenciální riziko vzniku lokální recidivy a metastáz. Posouzení kompletnosti excize je rutinní součástí histopatologického vyšetření preparátu a má význam především u resekčních výkonů. Pozitivní okraje bývají detekovány u 2−8 % resekátů, bez rozdílu ve vztahu ke zvolené operační technice [3].
Potenciální dopad pozitivních okrajů na onkologický výsledek však zůstává sporný. Většina retrospektivních studií na velkých souborech pacientů neprokázala vyšší riziko vzniku metastáz ani zkrácení CSS [3,21]. Ovšem jiné studie nejsou v souladu s těmito závěry, například unicentrická studie autorů Petros, et al. [22]. Dle doporučení Evropské urologické společnosti (European Association of Urology, EAU) představuje reresekce či radikální nefrektomie u většiny nemocných over-treatment a vhodné je spíše intenzivnější sledování [3].
Prognosticky významné klinické faktory
Prognosticky významné klinické faktory zahrnují především celkový stav pacienta (performance status), kachexii a přítomnost lokálních či paraneoplastických příznaků. Z běžně dostupných laboratorních hodnot s prognostickým významem se jedná o hladinu hemoglobinu, rychlost sedimentace erytrocytů (FW), počet trombocytů, neutrofilů a lymfocytů či jejich poměr, dále CRP, albumin, laktátdehydrogenázu a další rutinně dostupné indikátory. Na podkladě retrospektivních studií byly u metastatického RCC vytvořeny prognostické modely obsahující různé klinické a rutinní laboratorní parametry, které slouží k zařazení nemocných do rizikových skupin, k volbě následné terapie či do klinických studií. Jejich význam u nemetastatického onemocnění však zůstává sporný [3].
Význam trombocytózy ani její prognostický přínos u RCC nejsou zcela objasněny [23]. Trombocytóza pravděpodobně vzniká v důsledku nádorové produkce cytokinů v kombinaci se zvýšenou produkcí trombopoetinu v hepatocytech v rámci odpovědi akutní fáze. Práce autorů Bensalah, et al. prokázala prognostický význam trombocytózy jak u lokalizovaného, tak u metastatického RCC a postuluje, že odráží agresivitu a riziko progrese tumoru [24]. Retrospektivní analýza velkého souboru pacientů provedená německými autory ukazuje na spojitost trombocytózy se zkrácením CSS u nemocných po nefrektomii pro lokalizované onemocnění, vliv na CSS u metastatického onemocnění však prokázán nebyl [25].
Jako další možný prognostický faktor literatura uvádí poměr neutrofilů a lymfocytů (neutrophil-to-lymphocyte ratio, NLR), který je markerem systémové zánětlivé odpovědi. Recentní metaanalýza čínských autorů potvrdila korelaci vysokého předoperačního NLR v poměru se špatnou prognózou onemocnění [26]. Výsledky však nejsou zcela jednoznačné a nebyla stanovená jasná cut-off hodnota s prognostickým významem.
Vyšší hladina hemoglobinu a hematokritu byla naopak identifikována jako favorizující faktor pro přežití. Například autory Seda, et al. byla prokázána spojitost zvýšené hodnoty hemoglobinu v době diagnózy s nižším rizikem úmrtí [27].
Prognostický význam CRP zkoumala řada studií. K produkci tohoto proteinu akutní fáze dochází v rámci systémové odpovědi organismu na zánět, ale byla zjištěna i jeho produkce nádorovými buňkami [3]. Elevace CRP je spojena s větším objemem nádorové masy a přítomností metastáz. Zvýšená předoperační hodnota CRP byla identifikována jako nezávislý prognostický faktor CSS i OS [23]. Hodnota CRP je zavzata do řady prognostických modelů a zvyšuje jejich přesnost [28].
Obezita je jedním z rizikových faktorů vzniku renálního karcinomu, současně ovlivňuje i prognózu onemocnění. Studie naznačují, že obezita je příznivým prognostickým faktorem pro CSS u lokalizovaného i metastatického onemocnění [3,29].
Molekulární faktory – potenciální biomarkery
V současné době neexistuje žádný biomarker, který by byl schopen spolehlivě diagnostikovat přítomnost lokalizovaného či metastatického RCC. Vzhledem k často asymptomatickému průběhu RCC existuje v posledních desetiletích snaha o identifikaci nových biomarkerů, které by napomohly k časnější diagnostice RCC. Dále je cílem také najít potenciální biomarkery, které by byly schopné s jistotou určit nemocné s vysokým rizikem relapsu po chirurgické léčbě pro lokalizovaný tumor a predikovat odpověď na cílenou léčbu u metastatického onemocnění. Získání ideálního biomarkeru by navíc mělo být zatíženo co nejmenší limitací odběru – z tohoto hlediska se jeví za optimální cirkulující biomarkery, tedy markery detekovatelné z krve či moči. Ke stanovení tkáňových biomarkerů je oproti tomu již nutný vzorek tumorózní tkáně. Tkáňové markery musejí být schopny překlenout velkou histologickou heterogenitu renální tumorů a musejí být aplikovatelné i na malé množství tkáně získané biopsií, kde je při limitním počtu buněk přesné histopatologické určení mnohdy obtížné. I přes velké pokroky v porozumění procesu kancerogeneze však dosud nebyl identifikován žádný spolehlivý specifický biomarker pro časnou diagnostiku ani marker pro hodnocení prognózy RCC. Rovněž u žádného biomarkeru nebylo prokázáno zvýšení přesnosti stávajících prognostických systémů ani žádný takový biomarker nebyl integrován do běžné klinické praxe.
Jako potenciální biomarkery RCC jsou recentně v literatuře nejčastěji uváděny a zkoumány karboanhydráza IX (CaIX), HIF (hypoxia induced growth factor), VEGF (vascular endothelial growth factor), PTEN (phosphatase and tensin homolog), Ki67, p53, p21, osteopontin a další cytokiny ze skupiny růstových faktorů a proteiny regulující buněčný cyklus. Další potenciálně zajímavou skupinu možných biomarkerů představuje i nekódující RNA (miRNA, IncRNA a další). Paralelně je předmětem výzkumu genová exprese v histopatologickém vzorku tumoru [3].
Aktuální doporučení České společnosti klinické biochemie k využití nádorových markerů v klinické praxi vzhledem k absenci specifických biomarkerů pro RCC uvádí možnost využití nespecifických nádorových markerů, a sice TPA/S (tissue polypepidic antigen), CEA (carcinoembyonic antigen) a NSE (neuron-specific enolase) [30].
Von Hippel-Lindau gen
Nejčastější molekulární abnormitou RCC je ztráta tumorsupresorového genu von Hippel-Lindau (VHL), lokalizovaného na chromozomu 3p, která je prokazatelná u všech familiárních RCC a přibližně u 70 % sporadických RCC. Za normooxemie se VHL protein váže na HIF-1α a vyvolává jeho degradaci. Při absenci VHL genu, vlivem jeho mutace či delece, dochází ke kumulaci HIF-1α i za normálních podmínek (ne pouze při hypoxii) a v důsledku toho je spouštěna transkripce řady genů regulujících angiogenezi a přežití.
Z prediktivního hlediska se zdá, že mutace či promotorová methylace VHL genu má mírnou pozitivní korelaci s odpovědí na léčbu monoklonálními protilátkami proti VEGF. V této oblasti jsou nicméně zapotřebí další studie k lepšímu objasnění role tohoto genu u sporadických tumorů, zejména pak v kontextu cílené léčby [23].
HIF
Při hypoxii či při alteraci VHL genu dochází ke kumulaci HIF-1α i 2α a jeho translokaci do jádra, kde aktivuje transkripci tzv. hypoxií indukovaných genů. Dochází tak k produkci širokého spektra potenciálně poonkogenních a proangiogenních cytokinů, jako např. VEGF, PDGF, TGF-α a TGF-β či mTOR kinázy. Nadměrná exprese HIF1-α je typická pro ccRCC, u kterých je detekována až v 75 % případů, oproti tomu bývá zjištěna pouze u 38 % non-ccRCC [23]. Vyšší hladina HIF1-α je spojena s přítomností mutace VHL genu [23].
Přesto že byl HIF1-α intenzivně zkoumán, jeho prognostický význam není zcela objasněný [22]. Autoři Klatte, et al. prokázali horší prognózu u nemocných s metastatickým onemocněním s vyššími hladinami HIF1-α [31]. Ke shodným výsledkům dospěla i metaanalýza autorů Fan, et al., kteří demonstrovali spojitost vysoké jaderné exprese HIF1-α se zkrácením OS a vysoké cytoplazmatické exprese HIF2-α se zkrácením CSS [32].
VEGF
VEGF, cytokin ze skupiny destičkových růstových faktorů, kontroluje nejrůznější funkce endoteliálních buněk včetně proliferace, migrace, invaze, přežití a reguluje i buněčnou permeabilitu. Rovněž sehrává rozhodující roli v procesu nádorové angiogeneze a jeho zvýšená produkce koreluje se špatnou prognózou některých tumorů.
Zvýšená exprese VEGF je u RCC spojena s alterací VHL genu a nadprodukcí HIF-1α. Přímá inhibice VEGF nebo blokáda jeho signalizační kaskády představovala revoluci v léčbě metastatického RCC. Není překvapivé, že VEGF byl zkoumán i jako možný biomarker RCC. Korelaci vysoké exprese VEGF s horší prognózou RCC potvrdilo více autorů [23]. Navíc platí, že sérová hladina koreluje s tkáňovou expresí VEGF. Shodně pak sérové hladiny VEGF korelují s klinickým stagem a gradem nádoru, jeho velikostí a přežitím [33].
Karboanhydráza IX
CaIX představuje transmembránový protein regulovaný HIF-1α, který je spojený s kancerogenezí, neoplastickým růstem, agresivním fenotypem a špatnou prognózou u řady nádorů. CaIX je terapeutickým cílem pro monoklonální protilátky.
Předpokládá se, že se CAIX podílí na regulaci intraa extracelulárního pH v reakci na tumorovou hypoxii při následném anaerobním metabolismu. K jeho expresi dochází až u 80 % všech RCC, především pak u ccRCC, kde bývá zjištěn ve více než 90 % případů. Výhodné je, že hladinu CaIX lze detekovat i v séru.
Na výzkum tohoto biomarkeru se zaměřilo množství studií, ani zde však výsledky nejsou zcela jednoznačné [23]. Při imunohistochemické analýze vzorků ccRCC američtí autoři prokázali korelaci vyšší exprese CaIX s lepší prognózou onemocnění [34]. Shodné výsledky popsali ve své práci i Leibovich, et al., kdy ve velké retrospektivní analýze identifikovali spojitost nízké exprese CaIX s vyšším rizikem úmrtí na RCC, ovšem pouze v univariantní analýze a nepotvrdil tak význam CaIX jako nezávislého prognostického faktoru [35]. V další studii autoři postulovali spojitost progrese tumoru s nárůstem hladiny CaIX a poukazují na korelaci vysoké postoperační hladiny s rizikem recidivy [36]. Studie autorů Sim, et al. zkoumala společně prognostický význam CRP, CaIX a osteopontinu. U všech zkoumaných markerů byl v univariantní analýze prokázán prognostický význam ve vztahu k CSS i OS. Elevace CaIX a osteopontinu navíc umožňovala identifikaci nemocných, kteří by mohli profitovat z adjuvantní léčby či intenzivnějšího sledování [37]. Jiný přístup zvolili autoři Liu, et al., kteří detekovali cirkulující nádorové buňky ccRCC pomocí CaIX ligandu a prokázali spojitost jejich detekce s progresí onemocnění, histologickými charakteristikami a stagingem tumoru. Výsledky tak ukazují na korelaci mezi hladinou CaIX, přítomností cirkulujících nádorových buněk RCC, agresivitou tumoru a rizikem recidivy [38].
mTOR signální dráha
Signální dráha PI3K/Akt/mTOR je jednou z hlavních drah v regulaci buněčného růstu a její hyperstimulace má rozhodující význam v procesu kancerogeneze u řady tumorů včetně RCC. Dráha mTOR je spouštěna různými zevními stimuly včetně růstových cytokinů, jako například VEGF. Aktivací této dráhy dochází k produkci řady molekul, jmenujme pS6, 4E-BP či p27, které dále ovlivňují mRNA translaci a výsledkem je zvýšená produkce různých růstových faktorů – například VEGF, PDGF či TGF. Negativní regulace je zajištěna proteinem PTEN a analogy rapamycinu (mTOR inhibitory – temsirolimus a everolimus). Právě inhibitory mTOR představují druhý nejčastější typ cílené léčby metastatického RCC.
Prognostický význam samotného mTOR jako biomarkeru je sporný a touto problematikou se zabývalo pouze málo studií [23]. Oproti tomu řada studií se věnovala zkoumání prognostického a prediktivního významu upstream a downstream molekul, a to i v kontextu cílené léčby.
Nadměrná exprese pS6, cílového proteinu mTOR značící aktivaci této signální dráhy, byla identifikována jako prediktor kratšího přežití u nemocných s lokalizovaným i metastatickým RCC [38].
Proteinkináza B (pAkt) sehrává zásadní roli v regulaci buněčného růstu a mechanismu přežití fosforylací řady cílových molekul v cytoplazmě i jádře. Vysoká cytoplazmatická exprese pAkt u metastatického RCC koreluje s horší prognózou onemocnění, oproti tomu u lokalizovaného RCC je vyšší produkce nukleární pAkt indikátorem lepšího přežití [37]. K určení prognostického významu je tedy relevantní lokalizace pAkt. Studie dále naznačují, že vysoká exprese pAkt je prediktorem příznivé odpovědi na cílenou léčbu [23].
PTEN je tumorsupresorový protein s inhibičním účinkem na mTOR signalizační dráhu. Přesto že jsou mutace tumorsupresorového genu PTEN u RCC vzácné, jsou spojeny se špatnou prognózou [23]. Vyšší exprese PTEN koreluje oproti tomu s lepším přežitím [39].
Další potenciální biomarkery
Jako další potenciální biomarker je v literatuře uváděn protein p53. Tento transkripční faktor, který je produktem tumorsupresorového genu p53, má rozhodující vliv na regulaci buněčného cyklu – při poškození DNA zastaví buněčný cyklus a případně indukuje apoptózu. Pozitivita p53 není u RCC běžná, častěji ji lze zjistit u metastáz než u primárního tumoru. Prognostický význam p53 u RCC nebyl zcela objasněn. Dosavadní studie naznačují, že zvýšená exprese p53 u lokalizovaného RCC koreluje s horší prognózou [23].
Dalším ze zkoumaných molekul regulujících buněčný cyklus je survivin. Jedná se o inhibitor apoptózy, který je zvýšeně exprimován v procesu kancerogeneze různých tumorů včetně RCC. Vysoká exprese survivinu je spojena s nízkou diferenciací tumoru, větší agresivitou a u lokalizovaného ccRCC byl identifikován jako nezávislý prediktor progrese onemocnění [23,40].
Rovněž u proliferativního markeru Ki-67 byla zjištěna spojitost s RCC. U ccRCC jeho pozitivita ukazuje na agresivnější fenotyp tumoru s vyšším rizikem relapsu a horším přežitím [23,41].
Na procesu karcinogeneze RCC se velmi pravděpodobně podílí také dysregulace kalcium fosfátového mechanismu. Vyšší hladiny osteopontinu jako možný negativní prognostický faktor RCC jsme v textu již zmiňovali [37]. Prognostický vliv osteopontinu spolu se stanniocalcinem-1 zkoumal i kolektiv českých autorů. Byly prokázány vyšší hladiny těchto markerů u nemocných s RCC v porovnání s kontrolní skupinou a jejich negativní prognostický význam ve vztahu k OS a CSS. Současně bylo zjištěno vyšší riziko relapsu u nemocných s vysokými předoperačními hladinami stanniocalcinu - 1 [42].
Jako další slibný marker se jeví Kidney-Injury Molecule - 1 (KIM-1). KIM-1 je masivně produkován při poškození renálních tubulů, a to včetně nádorového růstu, oproti tomu ve zdravé tkáni je exprimován pouze v minimálním množství. Detekovatelný je v moči a krvi. U nemocných s RCC byly zjištěny vysoké hladiny tohoto markeru s následným poklesem po chirurgickém výkonu. KIM-1 se zdá být přínosný v časné diagnostice RCC. Autoři Scelo, et al. popsali elevaci KIM-1 prokazatelnou už 5 let před stanovením diagnózy RCC a její spojitost s horší prognózou onemocnění a kratším přežitím [43].
Několik retrospektivních studií a velkých screeningových programů identifikovalo genové mutace a chromozomální změny u RCC, ovšem s odlišnými výstupy. Jako nezávislý prognostický faktor rekurence byla identifikována exprese genů BAP1 a PBRM1, lokalizovaných na chromozomu 3p v místě, kde dochází k deleci až u 90 % ccRCC [3,44,45]. Publikované výsledky naznačují, že pacienti s mutací BAP-1 mají horší prognózu než pacienti s PBRM1 mutací. Opakovaně byla potvrzena korelace ztráty chromozomů 9p a 14q s horším přežitím. Výsledky z operačních studií naznačují, že využití typizace vybraných šestnácti genů může predikovat relaps onemocnění u nemocných s nemetastatickým onemocněním [3].
Prognostické modely
Prognostické modely slouží k hodnocení průběhu onemocnění RCC. Proměnné těchto modelů představují nezávislé prognostické faktory v různých kombinacích. TNM stage nádoru bývá doplněn o další běžně dostupné klinické faktory, jako jsou performance status, přítomnost či absence symptomů, laboratorní hodnoty (CRP, hemoglobin, LDH, počet trombocytů, neutrofilů, lymfocytů či jejich poměr a další) či histologické faktory, jako je přítomnost nekrózy.
Dostupné multivariantní modely umožňují přesnější prognostický odhad než samotný stage a grade tumoru. Další výhodou prognostických modelů je možnost přidání nového, potenciálně přínosného parametru a objektivní vyhodnocení jeho prediktivní hodnoty. Aby byl implementován nový model do praxe, nejprve musí být externě validován a musí prokázat vyšší přínos v porovnání se stávajícími systémy.
Mnoho modelů se zaměřilo na predikci komplikací, funkčních a onkologických výsledků resekčního výkonu v porovnání s nefrektomií, zatímco jiné hodnotí onkologické výsledky po nefrektomii.
K dispozici je několik prognostických modelů použitelných pro všechna stadia RCC, jako například SSIGN či Karakiewiczův nomogram. Karakiewiczův model byl vytvořen na podkladě velkých multicentrických studií k hodnocení CSS u nemocných po nefrektomii. Proměnné tohoto modelu představují věk, pohlaví, symptomy a TNM klasifikace nádoru. Model SSIGN (Stage, Size, Grade, Necrosis) hodnotí CSS u nemocných po nefrektomii pro ccRCC. Ovšem právě z důvodu hodnocení všech stadií se tyto modely jen zřídka používají v klinické praxi a vhodné jsou spíše pouze pro vědecké účely.
Prognostické modely vhodné pro lokalizované onemocnění
Mezi nejčastěji používané pooperační prognostické modely u lokalizovaného RCC patří Leibovichův model a UISS (University of California Integrated Staging System). Tyto modely mohou sloužit k určení optimálního sledování pacientů po operačním výkonu včetně stanovení frekvence zobrazovacích vyšetření či ke stratifikaci nemocných k adjuvantní léčbě v rámci klinických studií.
Prognostický model UISS je použitelný pro všechny subtypy RCC a hodnotí 5leté přežití bez recidivy (disease free survival, DFS). Zahrnuje následující proměnné: ECOG performance status, T stage, N stage a grade tumoru. Leibovichův model z roku 2003 hodnotí riziko progrese onemocnění a CSS u pacientů po nefrektomii pro lokalizovaný ccRCC. Mezi proměnné tohoto modelu patří T stage, N stage, velikost nádoru, jaderný grade a přítomnost nekrózy. Upravená verze z roku 2018 (Leibovich 2018) je aplikovatelná na všechny nejčastější histologické podtypy RCC a je použitelná pro resekční výkony i nefrektomie.
Mezi další prognostické modely vhodné pro lokalizované onemocnění patří například model GRANT (Grade, Age, Nodes and Tumour), který je vhodný k predikci DFS a OS u nemocných po nefrektomii pro všechny subtypy RCC. K hodnocení prognózy lokalizovaného pRCC lze použít systém VENUSS (VEnous extension, NUclear grade, Size, Stage).
Prognostické modely vhodné pro metastatické onemocnění
U metastatického RCC jsou prognostické modely rutinně užívaným nástrojem k rozdělení nemocných do rizikových skupin (dobrá, střední a špatná prognóza) a k výběru léčby jak v klinické praxi, tak v rámci studií. Nejčastěji se používá hodnocení dle kritérií Memorian Sloan Kettering Cancer Center (MSKCC) a International Metastatic Renal Cell Carcinoma Database Consortium (IMDC). Tyto modely se ovšem neshodnou až ve 23 % případů [46]. Oba modely pracují s výkonnostním stavem nemocného (Karnofsky index), intervalem od diagnózy k léčbě, hladinou hemoglobinu a vápníku. MSKCC dále zohledňuje hladinu LDH, oproti tomu IMDC počet neutrofilů a destiček. Ve většině randomizovaných kontrolovaných studií se aktuálně používá IMDC model, a měl by tedy být preferován v klinické praxi [3]. Autoři Massari, et al. recentně potvrdili, že přidáním sedmé proměnné, a sice přítomnosti metastáz (mozek, kosti a/nebo játra), zlepšuje prediktivní hodnotu tohoto modelu [47].
EAU doporučuje užití prognostických modelů v klinické praxi jak u lokalizovaného, tak u metastatického onemocnění, přesný typ modelu stanoven není. U všech prognostických modelů se v minulosti uskutečnila jednotlivá i konfrontační validace a žádný neprokázal svou superioritu k ostatním.
ZÁVĚR
I přes narůstající podíl náhodně zjištěných malých tumorů při zobrazovacích vyšetřeních a pokrocích v systémové léčbě zůstává RCC mezi urologickými nádory s nejvyšší mortalitou. Navíc průběh tohoto onemocnění je obtížně predikovatelný. Byla identifikována řada prognostických faktorů tohoto onemocnění, kdy nejdůležitější zůstávají stage (TNM klasifikace) a grade nádoru. V současné době je dostupná řada prognostických systémů, které umožňují přesněji než samotné anatomické a histologické faktory predikovat průběh onemocnění. Studie naznačují, že již není další prostor ke zlepšení stávajících modelů vycházejících z anatomických, histologických a klinických či rutinních laboratorních parametrů. Předpokládá se, že přidání vhodného biomarkeru či jejich kombinace by mohlo vést k dalšímu zpřesnění těchto systémů. I přes intenzivní výzkum v této oblasti ovšem dosud žádný biomarker nebyl validován pro užití v klinické praxi. Je třeba dalších studií identifikujících nové potenciální biomarkery, ať již z řad cirkulujících, či tkáňových markerů, ověření jejich prognostických vlastností a zařazení do stávajících prognostických systémů.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Marcela Čechová, FEBU
Urologická klinika 2. LF UK a FN Motol
e-mail: marcela.cechova@fnmotol.cz
Sources
1. Capitanio U, Bensalah K, Bex A, et al. Epidemiology of renal cell carcinoma. Eur Urol. 2019;75(1):74−84. doi:10.1016/j. eururo.2018.08.036.
2. Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita 2005. Available at www:
3. http://www.svod.cz. Verze 7.0 [2007], ISSN 1802-8861.
4. Ljungberg B, Albiges L, Bedke J, et al. EAU guidelines on renal cell carcinoma. Edn. presented at the EAU Annual Congress Milan 2021. ISBN 978-94-92671-13-4. EAU Guidelines Office, Arnhem, The Netherlands. Available at: https://uroweb.org/ guideline/renal-cell-carcinoma/.
5. Siegel RL, Miller KD, Jemal A. Cancer statistics 2018. CA Cancer J Clin 2018;68(1):7−30. doi:10.3322/ caac.21442.
6. Speed JM, Trinh QD, Choueiri TK, et al. Recurrence in localized renal cell carcinoma: a systematic review of contemporary data. Curr Urol Rep. 2017;18(2):15. doi:10.1007/s11934-017-0661-3.
7. Brierley JD, Gospodarowicz MK, Wittekind C (Eds.). TNM classification of malignant tumours. John Wiley & Sons 2017. Český překlad TNM verze 2011 available at: https://www.uzis.cz/index.php?pg= record&id=4577.
8. Manola J, Royston P, Elson P, et al. International Kidney Cancer Working Group. Prognostic model for survival in patients with metastatic renal cell carcinoma: results from the international kidney cancer working group. Clin Cancer Res. 2011;17(16):5443−5450. doi:10.1158/1078-0432.CCR-11-0553.
9. Warren AY, Harrison D. WHO/ISUP classification, grading and pathological staging of renal cell carcinoma: standards and controversies. World J Urol. 2018;36(12):1913−1926. doi:10.1007/ s00345-018-2447-8.
10. Delahunt B, Kittelson JM, McCredie MR, et al. Prognostic importance of tumor size for localized conventional (clear cell) renal cell carcinoma: assessment of TNM T1 and T2 tumor categories and comparison with other prognostic parameters. Cancer 2002;94(3):658−664. doi:10.1002/ cncr.10255.
11. Bonsib SM. T2 clear cell renal cell carcinoma is a rare entity: a study of 120 clear cell renal cell carcinomas. J Urol. 2005;174(4 Pt 1):1199−202. doi:10.1097/01. ju.0000173631.01329.1f.
12. Bertini R, Roscigno M, Freschi M, et al. Renal sinus fat invasion in pT3a clear cell renal cell carcinoma affects outcomes of patients without nodal involvement or distant metastases. J Urol. 2009;181(5):2027−2032. doi:10.1016/j. juro.2009.01.048.
13. Verhoest G, Avakian R, Bensalah K, et al. Urinary collecting system invasion is an independent prognostic factor of organ confined renal cell carcinoma. J Urol. 2009;182(3):854−859. doi:10.1016/j. juro.2009.05.017.
14. Patard JJ, Leray E, Rioux-Leclercq N, et al. Prognostic value of histologic subtypes in renal cell carcinoma: a multicenter experience. J Clin Oncol. 2005;23(12):2763−2771. doi:10.1200/JCO.2005.07.055.
15. Ljungberg B, Albiges L, Bensalah K, et al. EAU guidelines on renal cell carcinoma. Edn. presented at the EAU Annual Congress EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam 2020. ISBN 978-94-92671-07-3.
16. Dagher J, Delahunt B, Rioux-Leclercq N, et al. Clear cell renal cell carcinoma: validation of World Health Organization/ International Society of Urological Pathology grading. Histopathology 2017;71(6):9180−925. doi:10.1111/ his.13311.
17. Ohashi R, Martignoni G, Hartmann A, et al. Multi-institutional re-evaluation of prognostic factors in chromophobe renal cell carcinoma: proposal of a novel two-tiered grading scheme. Virchows Arch. 2020;476(3):409−418. doi:10.1007/ s00428-019-02710-w.
18. Leibovich BC, Blute ML, Cheville JC, et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003;97(7):1663−1671. doi:10.1002/ cncr.11234.
19. Klatte T, Said JW, de Martino M, et al. Presence of tumor necrosis is not a significant predictor of survival in clear cell renal cell carcinoma: higher prognostic accuracy of extent based rather than presence/absence classification. J Urol. 2009;181(4):1558−1564. doi:10.1016/j. juro.2008.11.098.
20. Kroeger N, Rampersaud EN, Patard JJ, et al. Prognostic value of microvascular invasion in predicting the cancer specific survival and risk of metastatic disease in renal cell carcinoma: a multicenter investigation. J Urol. 2012;187(2):418−423. doi:10.1016/j.juro.2011.10.024.
21. Huang H, Pan XW, Huang Y, et al. Microvascular invasion as a prognostic indicator in renal cell carcinoma: a systematic review and meta-analysis. Int J Clin Exp Med. 2015;8(7):10779−10792.
22. Antic T, Taxy JB. Partial nephrectomy for renal tumors: lack of correlation between margin status and local recurrence. Am J Clin Pathol. 2015;143(5):645−651. doi:10.1309/AJCP7LKLZ8JSJQRG.
23. Petros FG, Metcalfe MJ, Yu KJ, et al. Oncologic outcomes of patients with positive surgical margin after partial nephrectomy: a 25-year single institution experience. World J Urol. 2018;36(7):1093−1101. doi:10.1007/s00345-018-2241-7.
24. Sun M, Shariat SF, Cheng C, et al. Prognostic factors and predictive models in renal cell carcinoma: a contemporary review. Eur Urol, 2011;60(4):644−661. doi:10.1016/j.eururo.2011.06.041.
25. Bensalah K, Leray E, Fergelot P, et al. Prognostic value of thrombocytosis in renal cell carcinoma. J Urol. 2006;175(3 Pt 1):859−863. doi:10.1016/S0022 - 5347(05)00526-4.
26. Brookman-May S, May M, Ficarra V, et al. Does preoperative platelet count and thrombocytosis play a prognostic role in patients undergoing nephrectomy for renal cell carcinoma? Results of a comprehensive retrospective series. World J Urol. 2013;31(5):1309−1316. doi:10.1007/ s00345-012-0931-0.
27. Shao Y, Wu B, Jia W, et al. Prognostic value of pretreatment neutrophil-to-lymphocyte ratio in renal cell carcinoma: a systematic review and meta-analysis. BMC Urol. 2020;20(1):90. doi:10.1186/s12894 - 020-00665-8.
28. Seda CJ, Salas AS, Sánchez CG, et al. Thrombocytosis and hematocrit as prognostic factors in renal carcinoma. Arch Esp Urol. 2011;64(9):883−890.
29. Steffens S, Köhler A, Rudolph R, et al. Validation of CRP as prognostic marker for renal cell carcinoma in a large series of patients. BMC Cancer 2012;12 : 399. doi:10.1186/1471-2407-12-399.
30. Albiges L, Hakimi AA, Xie W, et al. Body mass index and metastatic renal cell carcinoma: clinical and biological correlations. J Clin Oncol. 2016;34(30):3655−3663. doi: 10.1200/JCO.2016.66.7311.
31. Springer D, Valík D, Kučera R, et al. Doporučení České společnosti klinické biochemie ČLS JEP k využití nádorových markerů v klinické praxi. Klin Biochem Metab. 2021;29 (50):41−55.
32. Klatte T, Seligson DB, Riggs SB, et al. Hypoxia-inducible factor 1 alpha in clear cell renal cell carcinoma. Clin Cancer Res. 2007;13(24):7388−7393. doi:10.1158/1078-0432.CCR-07-0411.
33. Fan Y, Li H, Ma X, et al. Prognostic significance of hypoxia-inducible factor expression in renal cell carcinoma: A PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore) 2015;94(38):e1646. doi:10.1097/ MD.0000000000001646.
34. Klatte T, Böhm M, Nelius T, et al. Evaluation of peri-operative peripheral and renal venous levels of pro - and anti-angiogenic factors and their relevance in patients with renal cell carcinoma. BJU Int. 2007;100(1):209−214. doi:10.1111/ j.1464-410X.2007.06871.x.
35. Bui MH, Visapaa H, Seligson D, et al. Prognostic value of carbonic anhydrase IX and KI67 as predictors of survival for renal clear cell carcinoma. J Urol. 2004;171(6 Pt 1):2461−2466. doi:10.1097/01. ju.0000116444.08690.e2.
36. Leibovich BC, Sheinin Y, Lohse CM, et al. Carbonic anhydrase IX is not an independent predictor of outcome for patients with clear cell renal cell carcinoma. J Clin Oncol. 2007;25(30):4757−4764. doi:10.1200/JCO.2007.12.1087.
37. Li G, Feng G, Gentil-Perret A, et al. Serum carbonic anhydrase 9 level is associated with postoperative recurrence of conventional renal cell cancer. J Urol. 2008;180(2):510−513; discussion 513−514. doi:10.1016/j.juro.2008.04.024.
38. Sim SH, Messenger MP, Gregory WM, et al. Prognostic utility of pre-operative circulating osteopontin, carbonic anhydrase IX and CRP in renal cell carcinoma. Br J Cancer 2012;107(7):1131−1137. doi:10.1038/bjc.2012.360.
39. Liu S, Tian Z, Zhang L, et al. Combined cell surface carbonic anhydrase 9 and CD147 antigens enable high-efficiency capture of circulating tumor cells in clear cell renal cell carcinoma patients. Oncotarget 2016;7(37):59877−59891. doi:10.18632/ oncotarget.10979.
40. Pantuck AJ, Seligson DB, Klatte T, et al. Prognostic relevance of the mTOR pathway in renal cell carcinoma: implications for molecular patient selection for targeted therapy. Cancer 2007;109(11):2257−2267. doi:10.1002/ cncr.22677.
41. Parker AS, Kosari F, Lohse CM, et al. High expression levels of survivin protein independently predict a poor outcome for patients who undergo surgery for clear cell renal cell carcinoma. Cancer 2006;107(1):37−45. doi:10.1002/ cncr.21952.
42. Klatte T, Seligson DB, LaRochelle J, et al. Molecular signatures of localized clear cell renal cell carcinoma to predict disease-free survival after nephrectomy. Cancer Epidemiol Biomarkers Prev. 2009;18(3):894−900. doi:10.1158/1055 - 9965.EPI-08-0786.
43. Sobotka R, Capoun O, Hanus T, et al. The importance of serum osteopontin and stanniocalcin-1 in renal cell carcinoma. Neoplasma 2018;65(6):958−964. doi:10.4149/neo_2018_171123N759.
44. Scelo G, Muller DC, Riboli E, et al. KIM-1 as a blood-based marker for early detection of kidney cancer: A prospective nested case-control study. Clin Cancer Res. 2018;24(22):5594−5601. doi:10.1158/1078-0432.CCR-18-1496.
45. Joseph RW, Kapur P, Serie DJ, et al. Clear cell renal cell carcinoma subtypes identified by BAP1 and PBRM1 expression. J Urol. 2016;195(1):180−187. doi:10.1016/j. juro.2015.07.113.
46. Minardi D, Lucarini G, Milanese G, et al. Loss of nuclear BAP1 protein expression is a marker of poor prognosis in patients with clear cell renal cell carcinoma. Urol Oncol. 2016;34(8):338.e11−8. doi:10.1016/j.urolonc.2016.03.006.
47. Okita K, Hatakeyama S, Tanaka T, et al. Impact of disagreement between two risk group models on prognosis in patients with metastatic renal-cell carcinoma. Clin Genitourin Cancer 2019;17(3):e440 − e446. doi:10.1016/j.clgc.2019.01.006.
48. Massari F, Di Nunno V, Guida A, et al. Addition of primary metastatic site on bone, brain, and liver to IMDC criteria in patients with metastatic renal cell carcinoma: A validation study. Clin Genitourin Cancer 2021;19(1):32−40. doi:10.1016/j. clgc.2020.06.003.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 10-
All articles in this issue
- Doktorský studijní program v biomedicíně − obor Experimentální chirurgie
- Prognostické faktory renálního karcinomu
- Cholangiocelulární karcinom z pohledu patologa
- Analýza pooperačních komplikací po otevřených hernioplastikách kýly v jizvě – retrospektivní analýza kohorty pacientů
- Prínos peroperačného histologického vyšetrenia lymfatických uzlín centrálneho kompartmentu v manažmente nízkorizikového diferencovaného karcinómu štítnej žľazy
- Akutní apendicitida v supraumbilikální hernii
- Defenzivní medicína
- Inflamatorní kloakogenní polyp u adolescenta – kazuistika a přehled literatury
- Brániční kýla po radiofrekvenční ablaci jaterního nádoru, kazuistika a literární přehled
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cholangiocelulární karcinom z pohledu patologa
- Akutní apendicitida v supraumbilikální hernii
- Prognostické faktory renálního karcinomu
- Inflamatorní kloakogenní polyp u adolescenta – kazuistika a přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

