-
Medical journals
- Career
Řešení kostních defektů technikou indukované membrány podle Masqueleta
Authors: M. Debnar 1,2; L. Kopp 1,2; R. Mišičko 1
Authors‘ workplace: Klinika úrazové chirurgie Fakulty zdravotnických studií Univerzity J. E. Purkyně v Ústí nad Labem a Krajské, zdravotní a. s. – Masarykovy nemocnice v Ústí nad Labem 1; Ústav anatomie, 2. lékařská fakulta Univerzity Karlovy, Praha 2
Published in: Rozhl. Chir., 2021, roč. 100, č. 8, s. 390-397.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2021.100.8.390–397Overview
Úvod: Rozsáhlé kostní defekty jsou nejčastěji způsobeny traumatem, infekcí nebo tumorem a jsou jednou z největších výzev muskuloskeletální chirurgie. V dnešní době máme při jejich řešení na výběr z několika technik ošetření. Jednou z nich je i dvoufázová rekonstrukční metoda popsaná Alainem Masqueletem, která vychází z principu cizím tělesem indukované membrány v kombinaci s autologním kostním štěpem. Membrána indukovaná cementovým spacerem oblast defektu uzavírá a brání tak nadměrnému vstřebávání autologního štěpu. V této práci sdělujeme naše zkušenosti s touto metodou.
Metody: Retrospektivně jsme zhodnotili soubor pacientů operovaných na našem pracovišti mezi roky 2012−2020. Sledovány byly kromě základních epidemiologických dat hlavně údaje týkající se mechanismu poranění, velikosti defektu, přítomnosti infektu a infekčního agens, použitého typu spaceru a doby jeho ponechání, typu stabilizace kosti, doby do plné zátěže a plného prohojení.
Výsledky: Zhodnotili jsme 10 pacientů s kostními defekty (5 traumatického a 5 infekčního původu), operovaných na našem pracovišti. Optimálního zhojení bez komplikací jsme dosáhli u 50 % pacientů, s přihlédnutím k opakovanému provedení 2. fáze pak u 70 % pacientů. Ke komplikacím, které jsme zaznamenali, patřily dvě refraktury, dva infekty a jedno zpomalené kostní hojení.
Závěr: Řešení kostních defektů modifikovanou technikou podle Masqueleta má na poli rekonstrukční chirurgie své důležité místo. V případě dodržení indikačních kritérií a správných postupů v kombinaci s motivovanými a spolupracujícími pacienty má příznivé výsledky, zvláště u neinfekčních defektů. V porovnání s dalšími možnostmi řešení kostních defektů se jedná o techniku méně náročnou, a to jak pro pacienta, tak pro operatéra.
Klíčová slova:
kostní defekt − Masquelet − indukovaná membrána − pakloub − RIA
ÚVOD
Řešení rozsáhlých kostních defektů zůstává jednou z největších výzev muskuloskeletální chirurgie. Péče o tyto pacienty bývá náročná a zdlouhavá, doprovázena značnými komplikacemi. K nejpoužívanějším technikám řešení patří metoda kalusdistrakce dle Ilizareva, dále užití vaskularizovaných kostních štěpů z fibuly či kondylů femoru či prostá spongioplastika. Obě prvně jmenované metody jsou značně náročné na techniku, vybavení pracoviště i na spolupráci pacienta [1]. Prostá spongioplastika sice dosahuje poměrně dobrých výsledků, ale pouze v případě, že kostní defekt není rozsáhlý a nepřesahuje velikost 4−5 cm [2], při použití u větších defektů se autologní spongióza nadměrně vstřebává a místo defektu tak zůstává neprostavěné.
Značnou pozornost si proto v posledních letech vysloužila technika podle Masqueleta. Ve své práci [3] Masquelet a kol. prezentovali 35 pacientů s kostními defekty rozsahu 5−25 cm a pomocí nové techniky dosáhli 89% úspěšnosti prohojení. Tato dvoufázová technika vychází z principu indukované membrány, jejíž vznik je reakcí organismu na cizí těleso v podobě spaceru, který je dočasně vložen do místa defektu. Membrána plní roli „biologické“ komory [4], která brání nadměrnému vstřebávání autologní spongiózy, ložené do lůžka defektu s určitým odstupem sekundárně. Tato technika si rychle získala na oblíbenosti pro svou jednoduchost a dnes, s určitými modifikacemi, patří mezi jednu z nejvíce užívaných metod pro řešení kostních defektů. Její úspěšnost byla potvrzena řadou prací z celého světa, a to jak v biologických, tak v klinických studiích [5,6].
V první fázi techniky popsané Masqueletem se provádí rozsáhlé debridement a do defektu se vkládá polymetylmetakrylátový spacer, jehož funkcí je na jedné straně mechanická opora a zabránění vrůstání vaziva do defektu a na druhé straně stimulace organismu k vytvoření biologické „obálky“ v podobě indukované membrány. Membrána secernuje růstové a osteindukční faktory stimulující hojení (VEGF, TGF, BMP), čímž urychluje vaskularizaci, prostavování a konsolidaci štěpu [7] a především brání jeho vstřebávání, což prokázali například ve své práci Klauke a kol. [8]. Místo defektu se stabilizuje zevním fixátorem, nitrodřeňovým hřebem či dlahou na principu vnitřního fixátoru a s odstupem několika týdnů (dle lokality 6−12) se po vytvoření membrány přistupuje k druhé fázi. V té je za šetrné manipulace s membránou spacer z defektu vyjmut a nahrazen autologním kostním štěpem. Autologní kostní štěp je získáván ze standardních odběrových míst na skeletu, nejčastěji z lopaty kyčelní kosti, horního konce stehenní kosti, kondylu stehenní kosti, horního konce holenní kosti či odsavným frézováním z diafýz dlouhých kostí. Fázovaný postup navíc umožní zklidnění měkkých tkání, takže pro fázi implantace štěpu jsou již lokální měkkotkáňové podmínky příznivé a riziko infekce je značně sníženo.
I přes dnešní modifikace původního postupu A. Masqueleta je tato technika velice oblíbená a lze ji použít na jakoukoli lokalitu na těle [4,9−10], a to jak u dětí [11], tak u dospělých. Další výhodou této metody je její užití navzdory možné infekci v defektu. Používá se tedy i pro infikované paklouby, traumatické kostní defekty nebo po tumorózních resekcích kosti [12].
V této práci prezentujeme zkušenosti s výše zmíněnou metodou u pacientů léčených na našem pracovišti.
METODY
Soubor pacientů
Náš soubor obsahuje 10 pacientů. Jedná se o 5 pacientů s posttraumatickým defektem bez infekčního ložiska a 5 pacientů s posttraumatickým infikovaným pakloubem či osteomyelitickým ložiskem. Tito pacienti byli na našem pracovišti řešeni modifikovanou technikou podle Masqueleta mezi lety 2012 a 2020. Soubor se skládá z 8 mužů a 2 žen.
Záznamy pacientů byly hodnoceny retrospektivně a sledovány byly kromě základních epidemiologických dat hlavně údaje týkající se mechanismu poranění, velikosti defektu, přítomnosti infektu a infekčního agens, použitého typu spaceru a doby jeho ponechání, typu stabilizace kosti, doby do plné zátěže a plného prohojení, komorbidit jednotlivých pacientů a počtu výkonů předcházejících vlastní techniku indukované membrány.
Skupina s traumatickým defektem je čistě mužská. Průměrný věk v souboru činil 35,8 roku (24−63, ±14,3). Lokalizací defektu byla diafýza femuru ve 4 případech a distální tibie v 1 případě. Velikost defektu byla v rozmezí 4−13 cm s průměrem 8 cm, ve dvou případech se jednalo o semicirkulární defekt. Ve dvou případech bylo přistoupeno k Masqueletově technice časně – do 1 měsíce, ve třech případech odloženě. Z toho jednou pro nehojící se jednoduchou spongioplastiku, jednou při odkladu pro prioritní osteosyntézu fraktury pánve a jednou po zhojení měkkých tkání a derotační osteotomii femuru. Druhou částí souboru byli pacienti s infekčním pakloubem či osteomyelitickým ložiskem. Zde jsme sledovali 5 pacientů, z toho 2 ženy a 3 muže. Průměrný věk činil 45,4 roku (24−69, ±16,3). Lokalizace infikovaného defektu byly: jednou infekt po vnitřní osteosyntéze proximální metafýzy tibie, jednou infikovaný potraumatický defekt diafýzy tibie, jednou infikovaný poúrazový defekt oblasti pilonu tibie, jednou infekční komplikace po TEP a déze hlezna a v jednom případě infikovaná fraktura patní kosti s defektem. Podrobný přehled sledovaných faktorů u obou skupin přináší Tab. 1.
Table 1. Přehled pacientů
Tab. 1: Patients overview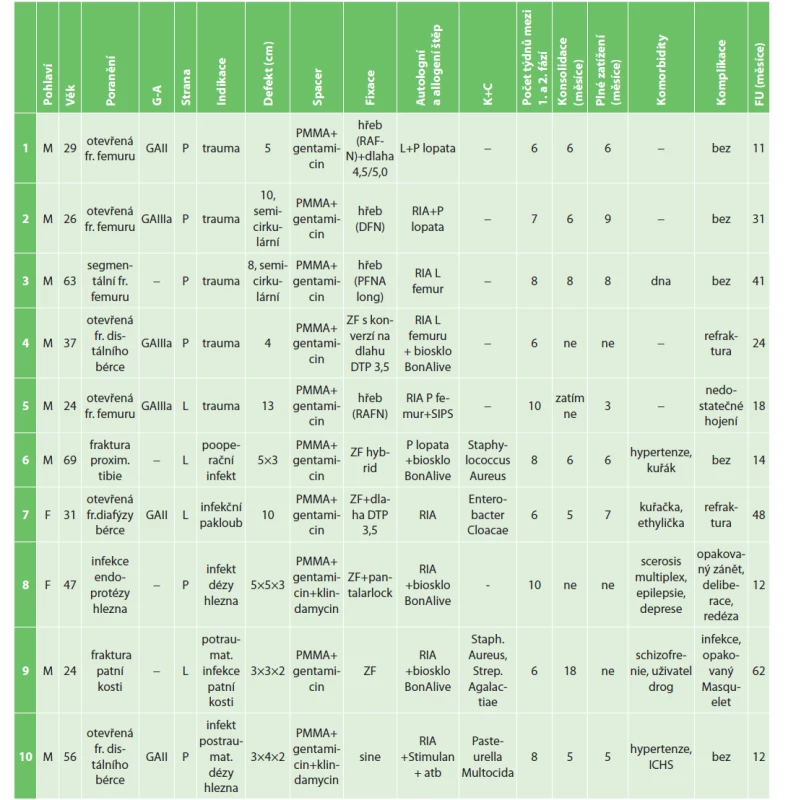
Vysvětlivky: DFN – distální femorální hřeb, DTP – distální tibiální dlaha, G–A – klasifikace otevřených zlomenin podle Gustila-Andersona, K+C – kultivace + citlivost, L – levá, P – pravá, PFNA – proximální femorální hřeb antirotační, PMMA – polymetylmetakrylát, RAFN – retrográdní/antegrádní femorální hřeb, RIA – reamer irrigator aspirator, SIPS – spina iliaca posterior superior, ZF – zevní fixátor
Notes: DFN – distal femoral nail; DTP – distal tibial plate; G–A – Gustilo-Anderson open fracture classification; K+C – bacterial culture and sensitivity; L – left; P – right; PFNA – proximal femoral nail; PMMA – polymethylmetacrylate; RAFN – retrograde/antegrade femoral nail; RIA – reamer irrigator aspirator; SIPS – superior posterior iliac spina; ZF – external fixatorNa chirurgické léčbě se podíleli celkem tři operatéři s dlouholetou erudicí v dané oblasti. Žádný z pacientů nepotřeboval plastický výkon na měkkých tkáních a všichni pacienti byli bez poškození magistrálních cév, vyžadujícího cévní výkon. Doba sledování se pohybovala od 12 do 62 měsíců s průměrem 27,3 (±16,8) měsíce.
Chirurgická technika na našem pracovišti
Oproti originální Masqueletově technice se dnes používají různé modifikace. Při první fázi je místo kostního defektu podrobeno radikálnímu debridement a jsou odstraněny veškeré avitální tkáně až do dosažení krvácení z Haverských kanálů v kosti, tzv. „paprika sign“. Z tohoto důvodu též nepreferujeme použití turniketu, který může tento znak ovlivnit. V případě infekčního defektu odebíráme peroperačně kultivaci pro přesné zacílení antibiotické pooperační terapie. Následně provádíme stabilizaci defektu hřebem, dlahou nebo zevním fixátorem, s přihlédnutím k typu a lokalizaci zlomeniny. V této fázi je třeba kontrolovat délku a osu končetiny a předcházet tak iatrogenním deformitám či zkrácením končetiny. Poté je do místa defektu vložen polymethylmetakrylátový (PMMA) spacer, na našem pracovišti vždy s minimálně jedním antibiotikem, nejčastěji gentamicinem, který zčásti přesahuje vitální kostní konce. Cementový spacer bývá v místě defektu ponechán v závislosti na lokalitě od 6 do 12 týdnů. Ve skupině s traumatickými defekty bez infektu činilo časové okno mezi fázemi v průměru 7,4 týdne. Ve skupině s infekčními defekty pak 7,6 týdne. Během této doby je končetina bez zatížení, s chůzí o berlích bez došlapu.
V průběhu druhé fáze se nejprve odebírá autologní spongióza. Na našem pracovišti preferujeme metodu odsavného frézování diafýz dlouhých kostí (reamer - irrigator-aspirator − RIA, fy. DePuy Synthes, New Brunswick, USA) nejčastěji z ipsilaterálního či kontralaterálního femuru. K ostatním lokalitám se přistupuje při kontraindikacích či již vyčerpaných možnostech odběru z dřeně stehenní kosti. Následně se původní jizvou přistupuje ke spaceru, při opatrném tnutí vytvo - řené membrány v dlouhé ose. Extrakce spaceru probíhá nejčastěji pomocí dláta s určitou opatrností (Obr. 1). Následně vzniklou komoru vyplňujeme odebranou spongiózou, kterou při nedostatku materiálu doplňujeme hydroxyapatitovými peletkami, biosklem či při infekčních pakloubech přidáváme antibiotikum přímo do spongiózy na kalcium-fosfátovém nosiči (Stimulan, fy. Biocomposities, Staffordshire, Velká Británie). Důraz klademe na suturu indukované membrány vstřebatelným materiálem. Pooperačně u infikovaných defektů pokračujeme v antibiotické terapii per os dle výsledků kultivace. Minimálně první měsíc vyžadujeme chůzi o berlích bez došlapu na operovanou končetinu, s postupným našlapováním a zatěžováním dle rtg konsolidace, stability fixace a lokálního nálezu.
Image 1. Polymethylmetakrylátový spacer umístěný v oblasti kostního defektu
Fig. 1: Polymethylmethacrylate spacer inserted into the bone defect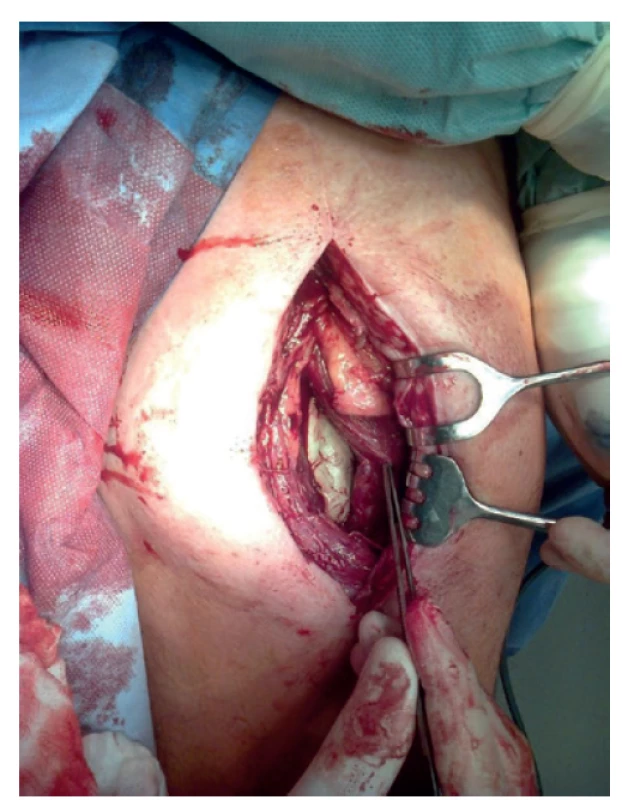
VÝSLEDKY
Ve skupině s traumatickými defekty bez infektu jsme úspěšné zhojení bez přidružených komplikací zaznamenali ve 3 případech, což představuje 60% úspěšnost. Konsolidace spongiózy bylo dosaženo průměrně po 6,6 měsíce (6−8, ±0,9). Plná zátěž byla povolena po 6,5 měsíce (3−9, ±2,3). Ve všech třech případech jsou pacienti bez výraznějších potíží či bolestivosti v místě defektu. Potíže, které u nich přetrvávají, jsou spojeny s úrazovým postižením jiných lokalit, které utrpěli v rámci polytraumatu. Nejlepšího výsledku dosáhl pacient č. 2, který navzdory svému poranění zvládá jízdu na lyžích (Obr. 2). U pacienta č. 5 jsme zaznamenali komplikaci v podobě nedostatečného a zpomaleného hojení, kvůli kterému byla zopakována 2. fáze s opětovnou spongioplastikou s odstupem 6 měsíců. Rentgenové snímky 9 měsíců po opakování 2. fáze nedosahují plné konsolidace štěpu, ale pacient končetinu již plně zatěžuje. Poslední kontroly ukazují velmi dobré prohojování. U pacienta č. 4 po fraktuře bérce došlo k refraktuře a selhání dlahy po 5 měsících od operace a po zatěžování končetiny polovinou hmotnosti. S odstupem 9 měsíců u něj byla provedena reosteosyntéza.
Image 2. 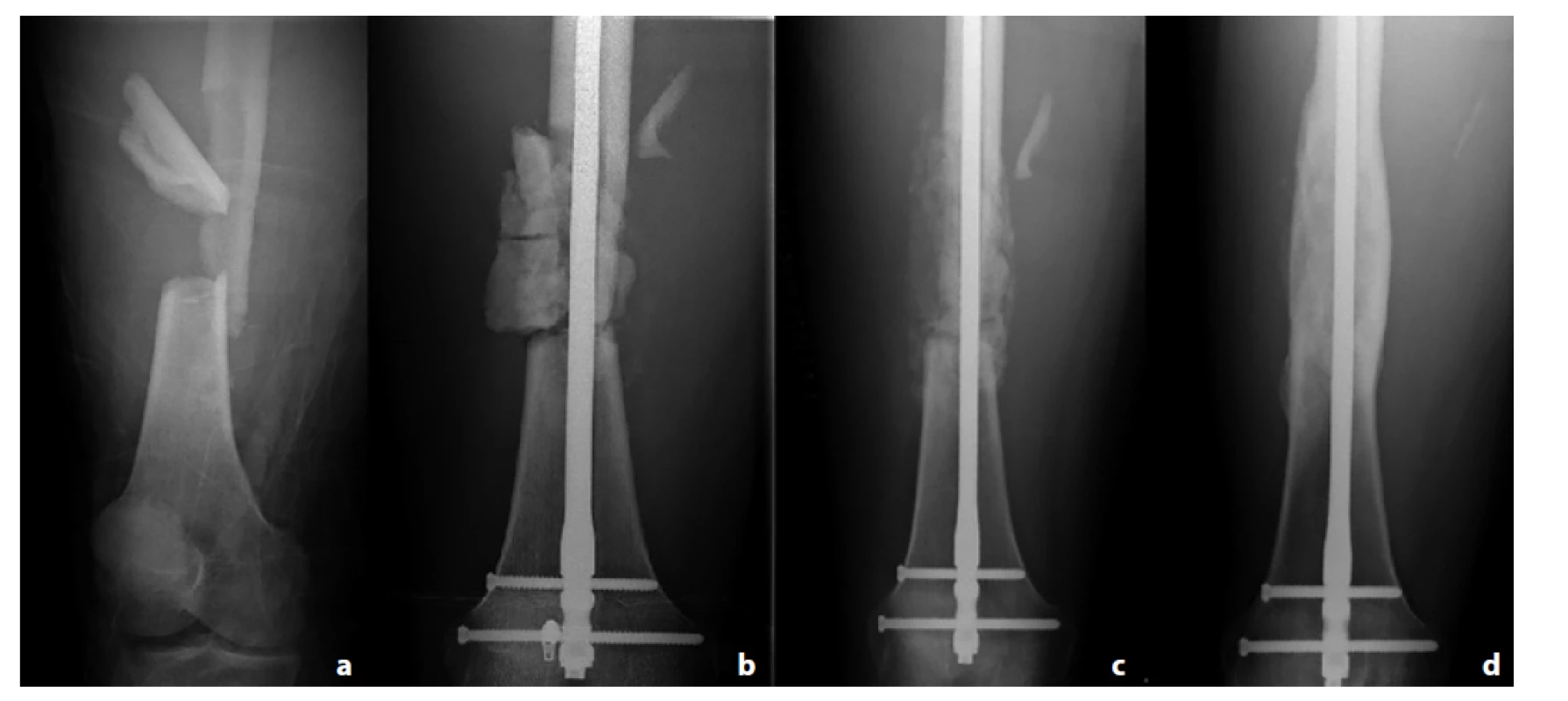
Pacient č. 2; a – úrazový snímek; b – kostní defekt s PMMA spacerem; c – defekt po 5 týdnech od spongioplastiky; d – plně prostavěný defekt po 2,5 roku
Fig. 2: Patient 2; a – initial X-ray; b – PMMA spacer inside the bone defect; c – defect 5 weeks after bone grafting; d – bone union after 2.5 yearsVe skupině infekčních defektů bylo plného prohojení bez komplikací dosaženo u 2 pacientů (40 %). Konsolidace bylo dosaženo průměrně po 8,5 měsíce (5−18, ±5,5) a plná zátěž byla povolena průměrně po 6 měsících (5−7, ±0,8). U pacienta č. 9 bylo plného prohojení dosaženo až po kompletním zopakování techniky indukované membrány. U pacientky č. 7 došlo k refraktuře, pro kterou byla provedena reosteosyntéza, která ale též neskončila úspěchem a pacientka podstoupila v rámci další léčby segmentální kostní transport (Obr. 3).
Image 3. Pacient č. 7; a – PMMA spacer v místě defektu; b – 2 měsíce od spongioplastiky; c – patrná refraktura a selhání dlahy; d – zvolena technika segmentálního kostního transportu; e – segmentální transport při dosažení kontaktu kostí
Fig. 3: Patient 7; a – PMMA spacer inside the bone defect; b – 2 months after bone grafting; c – refracture and implant failure; d – segmental bone transport applied; e – segmental bone transport after reaching the docking site.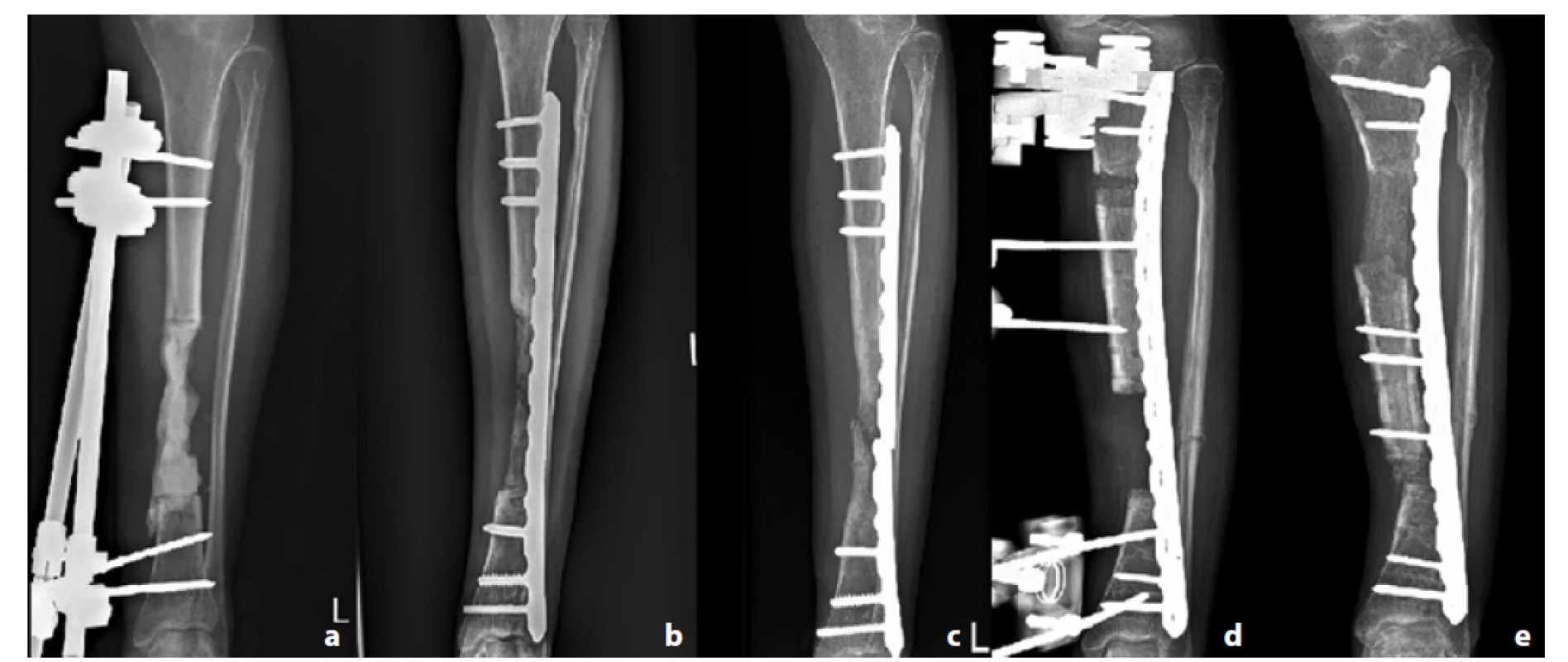
Image 4. Pacient č. 3; a – úrazový snímek; b – kostní semicirkulární defekt s PMMA spacerem; c – defekt po spongioplastice; d – plně prostavěný defekt po 2 letech
Fig. 4: Patient 3; a – initial X-ray; b – PMMA spacer inside the semicircular bone defect; c – defect after bone grafting; d – bone union after 2 years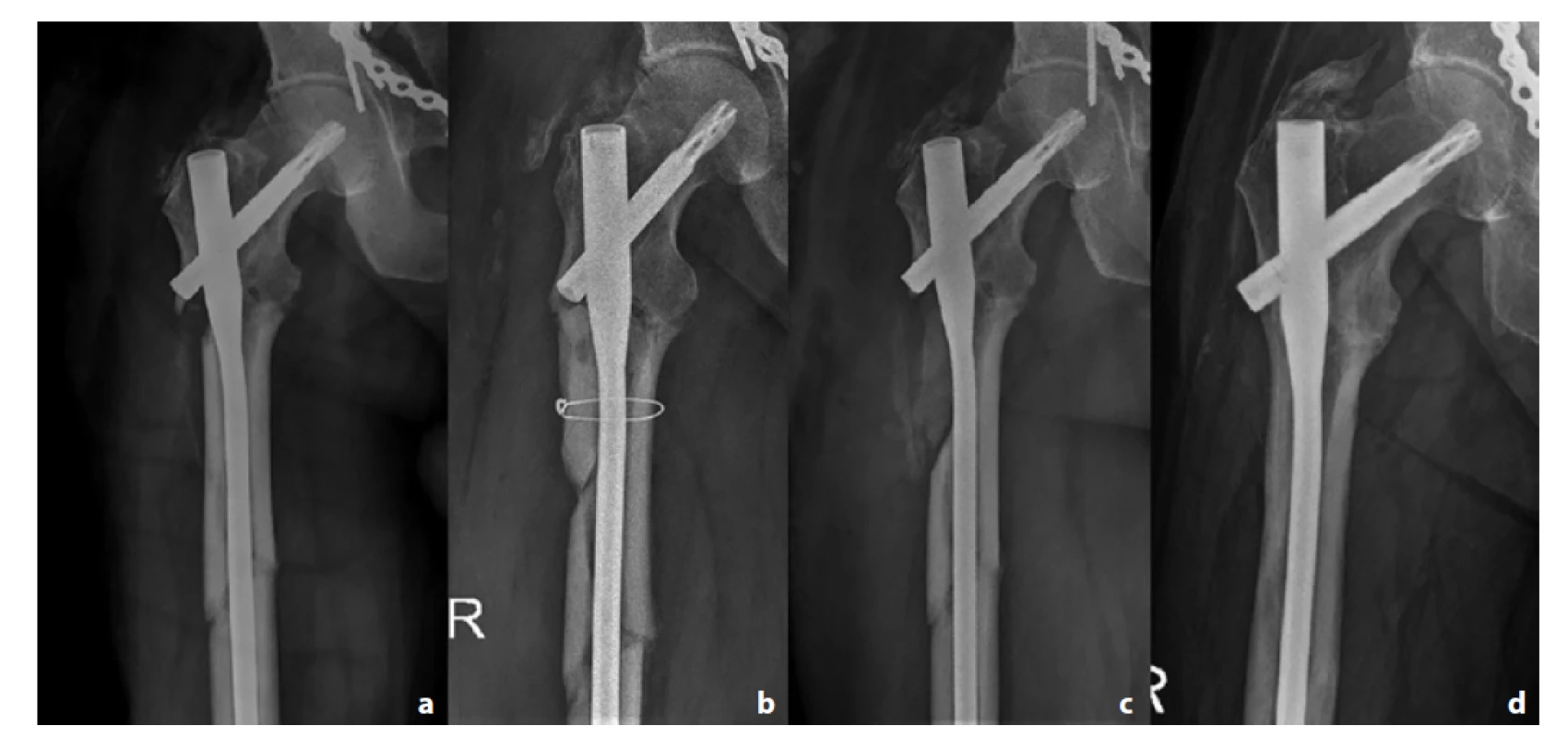
Celkově jsme optimálního zhojení bez komplikací dosáhli v 5 případech (50 %), s přihlédnutím k opakovanému provedení druhé fáze pak v 7 případech (70 %). Žádný pacient nemusel podstoupit amputaci končetiny. Výsledky dosažené v našem souboru jsou shrnuty v Tab. 1.
DISKUZE
Oproti originální Masqueletově práci se dnes tato technika užívá s jistými modifikacemi. Jedná se především o spacer, kdy v originální technice je používán výhradně bez přidaných antibiotik. Autor argumentuje možným potlačením projevů infekce a zvýšeným výskytem pozdních infekcí [13]. Některé studie též uvádějí možné ovlivnění kvality indukované membrány vlivem antibiotik [14]. Jsou ale i práce, které ukazují, že membrána není antibiotiky významně ovlivněna [15]. Na našem pracovišti vždy užíváme spacer s antibiotiky. Komplikace související s rekurentní infekcí jsou v našem souboru raritní.
Masquelet používal jako stabilizační prvek zevní fixaci. V dnešní době se pro diafyzární defekty stále více užívá nitrodřeňový hřeb. Výhodou je snížení potřebného množství spongiózy a biomechanicky mnohem odolnější konstrukce, umožňující časnější zátěž. U pacientů s hřebem jsou popisovány jak kratší celkový čas léčby [16], tak kratší doba do plného zhojení [17]. Hřeby mají též nižší riziko refraktur. Na základě našich zkušeností v jiných indikacích je zajímavé i použití hřebu s antibiotickým potahem, tato technika je ale značně finančně náročná [18]. V případě dlouhodobého sledování Masquelet zmiňuje vyšší výskyt rekurentních infekcí při použití hřebů, což jsme v našem souboru nezaznamenali [19]. Stabilizace končetiny s kostním defektem zevní fixací po dobu několika měsíců, nutných k provedení fázovaného výkonu, bývá pacienty špatně tolerována a je pro ně i ošetřující personál značně zatěžující. Rizikem je i výskyt pin tract infekce. Masquelet ve své práci [13] též upozorňuje na přílišnou rigiditu stabilizace při použití zamykacích dlah a šroubů, která může zpomalovat prohojení štěpu. Napříč literaturou je dlahová fixace těchto defektů zatížena zvýšeným výskytem refraktur, a to především díky narušení trubkovitého charakteru kosti a tím snížení její mechanické odolnosti, což dokládá i příklad naší pacientky č. 7 (Obr. 3). I z tohoto důvodu je v diafyzárních oblastech metodou volby hřeb [20].
Další odlišností je odběrové místo spongiózy. Masquelet používá především spongiózu odebranou z lopaty kosti kyčelní. Aktuální literatura ukazuje, že zlatým standardem se stává odběr pomocí odsavné frézy z dřeňové dutiny dlouhé kosti, nejčastěji femuru [21]. Její výhodou je především možnost odběru většího množství materiálu. Provedené histologické studie v takto získaném vzorku prokázaly rovněž vyšší koncentraci růstových faktorů a kmenových buněk [22]. I pro pacienty je tato technika v porovnání s odběrem z lopaty kyčelní kosti vhodnější díky menší morbiditě dárcovského místa [23]. Jako největší riziko při získání spongiózy metodou odsavného frézování se jeví možné větší krevní ztráty [24]. Naše pracoviště se řadí k těm, která tuto techniku preferují. K ostatním alternativám přistupujeme při kontraindikaci či již vyčerpané možnosti odběru z diafýzy dlouhé kosti.
V současné době existuje celá řada alogenních substituentů a doplňků, přidávaných do odebraného autotransplantátu. Jedná se o kostní morfogenetický protein (BMP), hydroxyapatitové a trikalciumfosfátové substráty či křemičité biosklo. Na našem pracovišti hojně používáme především biosklo, které je svým bakteriostatickým účinkem vhodné k výplni kostních defektů především v infekčním terénu. Jeho nevýhodou je zpomalování hojení operačních ran [25]. Při specifických potřebách zacílení atb terapie u rezistentních bakterií pak používáme kalcium-fosfátové nosiče s antibiotiky – jako v případě pacienta č. 10. Nicméně jednoznačné závěry o vhodnosti jejich použití v kombinaci s touto technikou stále nemáme a čekáme na další studie [26].
Debatě je podrobena i délka rozestupu mezi jednotlivými fázemi v souvislosti s načasováním tvorby indukčních faktorů a vyzráváním membrány. Práce Pelissiera a kol. [7] prokázala, že největší tvorba a koncentrace osteoindukčních faktorů je na vrcholu kolem čtvrtého týdne, nicméně v této době bývá membrána často velmi křehká, což ztěžuje manipulaci při výkonu [27]. Masquelet a kol. ve své praci uvádějí, že interval mezi výkony není významný [19]. Avšak histologická práce Ahoa a kol. uvádí, že indukovaná membrána časem vyzrává, kalcifikuje a enchondrální osifikací se přeměňuje na kostní tkáň. Co víc, vaskularita membrány klesá v čase, kdy dle Ahoa a kol. 3 měsíce stará membrána obsahuje o 60 % méně kapilár v porovnání s 1 měsíc starou membránou [28]. Námi dodržovaný interval se tedy, v porovnání s výše zmíněnými studiemi a napříč světovou literaturou, řadí spíše k těm delším. Nejdelší rozestup byl zaznamenán u pacienta č. 5, u kterého byl problém s nedostatečným prohojováním. Délka tohoto intervalu se jeví jako jedna z možných příčin neúspěchu. Pooperační protokol bývá v literatuře většinou obdobný, pooperačně bez povolené zátěže končetiny, s postupným zvětšováním zátěže s odstupem 8–12 týdnů. Plná zátěž napříč pracemi se doporučuje mezi 5.–9. měsícem.
Literární úspěšnost zhojení defektů technikou indukované membrány činí zhruba 60−100 % [4,5,29,30,31]. Podíl 70% úspěšnosti, zaznamenaný v našem souboru, je s těmito údaji v souladu. Při bližším pohledu na náš soubor bylo dosaženo velmi dobré úspěšnosti léčby u neinfikovaných kostních defektů, podstatně horších výsledků jsme dosáhli v souboru defektů vzniklých sanací infikovaného pakloubu či osteomyelitického ložiska. Zde hrála svoji roli předchozí přítomnost infekce, poruchy perfuze a měkkotkáňového krytu, provázející tyto patologické stavy, a celkové oslabení organismu v důsledku chronického zánětu.
Ke komplikacím, spojeným s touto technikou, patří především infekty. Dle Masqueleta jsou většinou způsobené nedostatečným debridement a nedodržením zásady resekce až do perfundované kosti („paprika sign“). Apart a kol. dokonce považují vstupní debridement za hlavní faktor finálního výsledku [17], naopak velikost defektu se nezdá být prognostickým faktorem [32]. Další komplikaci představují refraktury v místě defektu [3]. V našem souboru jsme zaznamenali dva takové případy (20 %), v jednom z nich v důsledku nespolupráce pacienta. Otázkou je též technika osteosyntézy, která byla u jednotlivých případů zvolena. K dalším problémům popisovaným v literatuře patří osové úchylky končetiny [13] a flekční deformity v oblasti hlezenního kloubu.
Studií věnujících se této technice je značné množství, nicméně stále existuje prostor pro výzkum a vývoj. Týká se to například materiálu spaceru, kde případná inovace by mohla zlepšit vlastnosti vzniklé indukované membrány. Práce Gagyiho a kol. srovnává použití 3 spacerů z rozdílných materiálů a hodnotí kvalitu a sekreční vlastnosti membrány [33]. Avšak při srovnání spaceru z polymethylmetakrylátu, titanu a polyvinylalkoholové houby nejlepších výsledků dosahuje membrána vzniklá při použití PMMA spaceru. Další výzkum je potřeba též v oblasti použití kostních substituentů a stimulátorů. Výsledky v této oblasti jsou stále bez jasných závěrů [25]. Velice zajímavá je práce Verboketa a kol., která na zvířecích modelech defektního femuru porovnává dvoufázovou techniku indukované membrány s jednofázovou technikou s použitím arteficiální membrány lidské acelulární dermis. Výsledky obou technik udává jako srovnatelné, v některých parametrech dokonce arteficiální membrána dosahuje lepších výsledků. Použití se však omezuje pouze na neinfekční defekty [34].
Tato studie má své limity. Její design je retrospektivní, soubor je značně nesourodý a s ohledem na délku sledování a počet pacientů je malý. Velké je rovněž množství různých technik osteosyntézy a užitých substituentů. Přesto však výsledky uceleně shrnují naše zkušenosti s touto technikou a popisují aktuální problematiku a trendy v této oblasti na příkladu pracoviště s dlouholetou tradicí léčby problematických následků zlomenin.
ZÁVĚR
Řešení kostních defektů modifikovanou technikou podle Masqueleta má na poli rekonstrukční chirurgie své důležité místo. V případě dodržení indikačních kritérií a správných postupů v kombinaci s motivovanými a spolupracujícími pacienty má příznivé výsledky, zvláště u neinfekčních defektů. V porovnání s dalšími možnostmi řešení kostních defektů se jedná o techniku méně náročnou, a to jak pro pacienta, tak pro operatéra. Její použití by mělo být indikováno individuálně s ohledem na konkrétního pacienta, jeho věk, lokalitu a typ defektu, míru spolupráce, komorbidity a zkušenosti chirurga. Vzhledem k rostoucí oblíbenosti a rozšířenosti by měla být v podvědomí každého chirurga, věnujícího se rekonstrukcím kostních defektů.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Lubomír Kopp, Ph.D.
Klinika úrazové chirurgie MN a UJEP
Sociální péče 3316/12A
40113 Ústí nad Labem
e-mail: lubomir.kopp@kzcr.eu
ORCID: 0000-0002-3695-2711
Sources
1. Ashman O, Phillips AM. Treatment of non-unions with bone defects: Which option and why? Injury 2013;44(1):43–45. doi:10.1016/S0020-1383(13)70010-X.
2. Romana MC, Masquelet AC. Vascularized periosteum associated with cancellous bone graft: an experimental study. Plast Reconstr Surg. 1990;85(4):587–592. doi:10.1097/00006534-199004000 - 00014.
3. Masquelet AC, Fitoussi F, Begue T, et al. Reconstruction des os longs par membrane induite et autogreffe spongieuse. [In Franch] Ann Chir Plast Esthet. 2000;45 : 346–353.
4. Giannoudis PV, Faour O, Goff T, et al. Masquelet technique for the treatment of bone defects: tips-tricks and future directions. Injury 2011;42 : 591–598. doi:10.1016/j.injury.2011.03.036.
5. Raven TF, Moghaddam A, Ermisch C, et al. Use of Masquelet technique in treatment of septic and atrophic fracture nonunion. Injury 2019;50(8):40–54. doi:10.1016/j.injury. 2019.06.018.
6. Karger C, Kishi T, Schneider L, et al. Treatment of posttraumatic bone defects by the induced membrane technique. Orthop Traumatol Surg Res. 2012;98(1):97 – 102. doi:10.1016/j.otsr.2011.11.001.
7. Pelissier P, Masquelet AC, Bareille R, et al. Induced membranes secrete growth factors including vascular and osteoinductive factors, and could stimulate bone regeneration. J Orthop Res. 2004;22 : 73–79. doi: 10.1016/S0736-0266(03)00165-7.
8. Klaue K, Knothe U, Anton C, et al. Bone regeneration in long – bone defects: tissue compartmentalisation? In vivo study on bone defects in sheep. Injury 2009;40(Suppl 4):95–102. doi:10.1016/j. injury.2009.10.043.
9. Zwetyenga N, Catros S, Emparanza A, et al. Mandibular reconstruction using induced membranes with autologous cancellous bone graft and HA-betaTCP: animal model study and preliminary results in patients. Int J Oral Maxillofac Surg. 2009;38(12):1289–1297. doi:10.1016/j. ijom.2009.07.018.
10. Flamans B, Pauchot J, Petite H, et al. Use of the induced membrane technique for the treatment of bone defects in the hand or wrist, in emergency. Chir Main. 2010;29(5):307–314. ISSN:1769-6666.
11. Felden A, Aurégan JC, Badina A, et al. The induced membrane technique for bone defects of critical size after infection in children: a report of 3 consecutive cases. JBJS case Connect. 2016;6(3):e65. doi:10.2106/JBJS.CC.15.00252.
12. Biau DJ, Pannier S, Masquelet AC, et al. Case report: reconstruction of a 16-cm diaphyseal defect after Ewing´s resection in a child. Clin Orthop Relat Res. 2009;467(2):572–577. doi:10.1007/ s11999-008-0605-9.
13. Masquelet AC. Induced membrane technique: pearls and pitfalls. J Orthop Trauma 2017;31(Suppl. 5):36–38. doi:10.1097/ BOT.0000000000000979.
14. Nau C, Seebach C, Trumm A, et al. Alteration of Masquelet’s induced membrane characteristics by different kinds of antibiotic enriched bone cement in a critical size defect model in the rat’s femur. Injury 2016;47 : 325–334. doi:10.1016/j.injury. 2015.10.079.
15. Shah SR, Smith BT, Tatara AM, et al. Effects of local antibiotic delivery from porous space maintainers on infection clearance and induction of an osteogenic membrane in an infected bone defect. Tissue Eng Part A. 2017;23(3-4):91–100. doi:10.1089/ten.TEA.2016.0389.
16. Olesen UK, Eckharft H, Bosemark P, et al. The Masquelet technique of induced membrane for healing of bone defects. A review of 8 cases. Injury 2015;46(Suppl. 8):44–47. doi:10.1016/S0020-1383(15)30054-1.
17. Apard T, Bigorre N, Cronier P, et al. Twostage reconstruction of post-traumatic segmental tibia bone loss with nailing. Orthop Traumatol Surg Res. 2010;96 : 549 – 553. doi:10.1016/j.otsr.2010.02.010.
18. Berebichez-Fridman R, Olvera PM, García RG, et al. An intramedullary nail coated with antibiotic and growth factor nanoparticles: An individualized state-ofthe - art treatment for chronic osteomyelitis with bone defects. Medical Hypotheses 2017;105(8):63–68. doi:10.1016/j. mehy.2017.06.023.
19. Masquelet AC, Kishi T, Benko PE. Very long-term results of post-traumatic bone defect reconstruction by the induced membrane technique. Orthop Traumatol Surg Res. 2019;105(1):159–166. doi:10.1016/j.otsr.2018.11.012.
20. Morwood MP, Streufert BD, Bauer A, et al. Intramedullary nails yield superior results compared with plate fixation when using the Masquelete technique in the femur and tibia. J Orthop Trauma. 2019;33(11):547–552. doi:10.1097/ BOT.0000000000001579.
21. Stafford PR, Norris BL. Reamer-irrigator - aspirator bone graft and bi Masquelet technique for segmental bone defect nonunions: a review of 25 cases. Injury 2010;41(Suppl. 2):72–77. doi:10.1016/ S0020-1383(10)70014-0.
22. Schmidmaier G, Herrmann S, Green J, et al. Quantitative assessment of growth factors in reaming aspirate, iliac crest, and preparation. Bone 2006;39(5):1156 – 1163. doi:10.1016/j.bone.2006.05.023.
23. Belthur M, Conway J, Jindal G, et al. Bone graft harvest using a new intramedullary system. Clin Orthop Relat Res. 2008;466(12):2973–2980. doi:10.1007/ s11999-008-0538-3.
24. Marchand LS, Rothberg DL, Kubiak EN, et al. Is this autograft worth it? The blood loss and transfusion rates associated with reamer irrigator aspirator bone graft harvest. J Orthop Trauma. 2017;31(4):205–209. doi:10.1097/ BOT.0000000000000811.
25. Aurégan JC, Bégué T. Bioactive glass for long bone infection: a systematic review. Injury Int. J Care Injured 2015;46(8):3–7. doi:10.1016/S0020-1383(15)30048-6.
26. Wang W, Yeung KWK. Bone grafts and biomaterials substitutes for bone defect repair: A review. Bioact Mater. 2017;2(4):224–247. doi:10.1016/j.bioactmat. 2017.05.007.
27. Yee MA, Mead MP, Alford AI, et al. Scientific understanding of the induced membrane technique. J Orthop Trauma 2017;31 : 3–8. doi:10.1097/bot.0000000000000981.
28. Aho OM, Lehenkari P, Ristiniemi J, et al. The mechanism of action of induced membranes in bone repair. J Bone Joint Surg Am. 2013;95(7):597–604. doi:10.2106/JBJS.L.00310.
29. Morelli I, Drago L, George DA, et al. Masquelet technique: myth or reality? A systematic review and meta-analysis. Injury 2016;47(Suppl 6):68–76. doi:10.1016/S0020-1383(16)30842-7.
30. Gupta G, Ahmad S, Mohd Z, et al. Management of traumatic tibial diaphyseal bone defect by „induced membrane technique“. Indian J Orthop. 2016;50(3):290 – 296. doi:10.4103/0019-5413.181780.
31. Azi ML, Teixeira A, Cotias RB, et al. Membrane induced osteogenesis in the management of post-traumatic bone defects. J Orthop Trauma 2016;30(10):545–550. doi:10.1097/BOT.0000000000000614.
32. Ristiniemi J, Lakovaara M, Flinkkilä T, et al. Staged method using antibiotic beads and subsequent autografting for large traumatic tibial bone loss: 22 of 23 fractures healed after 5–20 months. Acta Orthop. 2007;78(4):520–527. doi:10.1080/17453670710014176.
33. Gagyi SM, Toth Z, Kim D, et al. Altering spacer material affects bone regeneration in the Masquelet technique in a rat femoral defect. J Orthop Res. 2019;36(8):2228 – 2238. doi:10.1002/jor.23866.
34. Verboket RD, Leiblein M, Janko M, et al. From two stages to one: acceleration of the induced membrane (Masquelet) technique using human acellular dermis for the treatment of non-infectious large bone defects. Eur J Trauma Emerg Surg. 2020;46(2):317–327. doi:10.1007/s00068 - 019-01296-x.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 8-
All articles in this issue
- Úrazy a jejich komplikace − úrazová chirurgie dnes
- Zlomeniny patní kosti – současné trendy a problémy
- Akutní a inveterované ruptury Achillovy šlachy – současné diagnostické a terapeutické možnosti
- Retrospektivní analýza komplikací po sutuře Achillovy šlachy metodou podle Kesslera
- Řešení kostních defektů technikou indukované membrány podle Masqueleta
- Možnosti ošetření inveterované ruptury Achillovy šlachy – soubor kazuistik
- Spontánní kompartment syndrom předloktí – kazuistika
- Porucha hojení diafýzy stehenní kosti – biomechanika a biologie − kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zlomeniny patní kosti – současné trendy a problémy
- Akutní a inveterované ruptury Achillovy šlachy – současné diagnostické a terapeutické možnosti
- Řešení kostních defektů technikou indukované membrány podle Masqueleta
- Spontánní kompartment syndrom předloktí – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

