-
Medical journals
- Career
První zkušenosti s použitím jódových zrn pro lokalizaci nehmatných lézí v mamární chirurgii
Authors: O. Coufal 1,7; M. Schneiderová 2; P. Fabian 3; Š. Kozáková 4,8; Z. Řehák 5; J. Bártl 5,6; R. Bartlová 6; M. Glatzner 2,6; O. Zapletal 1; L. Gabrielová 1
Authors‘ workplace: Klinika operační onkologie, Oddělení mamokutánní a onkoplastické chirurgie, Masarykův onkologický ústav, Brno 1; Oddělení radiologie, Masarykův onkologický ústav, Brno 2; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno 3; Ústavní lékárna, Masarykův onkologický ústav, Brno 4; Oddělení nukleární medicíny, Masarykův onkologický ústav, Brno 5; Úsek radiační ochrany, Masarykův onkologický ústav, Brno 6; Klinika operační onkologie, Lékařská fakulta Masarykovy univerzity, Brno 7; Nemocniční lékárna Fakultní nemocnice Brno 8
Published in: Rozhl. Chir., 2021, roč. 100, č. 6, s. 261-265.
Category: Review
doi: https://doi.org/10.33699/PIS.2021.100.6.261–265Overview
Chirurgická léčba nehmatných lézí prsu vyžaduje jejich přesnou předoperační lokalizaci. Mezi řadou lokalizačních metod v poslední době vyniká lokalizace pomocí radioaktivního jódového zrna. Uvádíme první zkušenosti s touto metodou na našem pracovišti. Popisujeme strukturu lokalizačního jódového zrna, princip předoperačního zavedení a peroperační detekce zrna, postup při transportu resekátu, histopatologickém vyšetření, uchování a likvidaci zrna, aspekty radiační ochrany.
Klíčová slova:
prs záchovná operace – karcinom prsu – radioaktivní zrno – nehmatné léze prsu
ÚVOD
V souvislosti s mamografickým screeningem a pokroky v neoadjuvantní léčbě dochází v mamární chirurgii ke zvyšování počtu operací nehmatných lézí. Při nich je nutné užít některou z lokalizačních metod. Těch byla navržena již celá řada, od poměrně prostých, jako je označení průmětu léze značkou na kůži, až po značně sofistikované, založené na principu radaru (SAVI-SCOUT) [1] nebo radiofrekvence (RFID) [2]. Za standard bývalo nejčastěji považováno perkutánní zavedení lokalizačního drátu (Frankův vodič) do předmětné léze. V posledních letech se velmi nadějně jeví lokalizace pomocí radioaktivních jódových zrn. První randomizovaná studie byla publikována již v roce 2001 a ukázala jódová zrna jako srovnatelnou alternativu Frankova vodiče [3]. O několik let později byla u této metody ve srovnání s vodičem prokázána srovnatelná efektivita, bezpečnost a nižší četnost reoperací [4]. Později se v literatuře objevila řada dalších prací, které referují o výhodách lokalizačních zrn, převážně z USA a Nizozemska [5,6,7,8], ale i z jiných zemí [9,10,11,12].
Možným důvodem, který dosud brání rychlému a masivnímu rozšíření této metody v ČR, je skutečnost, že zrno představuje zdroj radioaktivního záření, a možná i jeho poměrně vysoká cena na tuzemské poměry. Již řadu let se jódová zrna v ČR používají pro brachyradioterapii karcinomů prostaty, nicméně v mamární chirurgii nebyla donedávna dostupná. Od října 2019 jsou v ČR k dispozici jódová zrna určená primárně k lokalizaci nehmatných lézí v chirurgii a jsou plně hrazena zdravotními pojišťovnami.
METODY
Popis lokalizačního zrna
Jódové zrno IsoAid Advantage [Obr. 1] je zdravotnickým prostředkem s CE značkou. Je dodáváno ve sterilně zabalené aplikační ocelové jehle tloušťky 18G a délky 12 cm. Samotné zrno se skládá z titanové kapsle o rozměrech 4,5×0,8 mm, ve které je adsorbovaný jód I-125 ve formě jodidu stříbrného, vydávajícího fotonové záření o energii 27,0–35,5 keV. Jedná se o uzavřený radionuklidový zdroj o aktivitě přibližně 9,5 MBq. Poločas rozpadu radioizotopu je 60 dní. Hrot jehly je uzavřen kostním voskem, který brání předčasnému vypadnutí zrna. Skladovatelnost sterilního balení jehly se zrnem je 90 dní a nelze je resterilizovat.
Image 1. IsoAid Advantage seed – schematický obrázek jodového zrna [https://www.isoaid.com]
Fig. 1: IsoAid Advantage seed – schematic figure of iodine seed [https://www.isoaid.com]![IsoAid Advantage seed – schematický obrázek jodového
zrna [https://www.isoaid.com]<br>
Fig. 1: IsoAid Advantage seed – schematic figure of iodine
seed [https://www.isoaid.com]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c57c1e40eb50f5e9c256f4e46cf59f6a.png)
Zavedení zrna
Zrno je zavedeno za sterilních kautel pod kontrolou zobrazovacími metodami (UZ, MG) do předmětné léze nebo do její bezprostřední blízkosti. Umístění zrna je po zavedení vhodné ověřit pomocí zobrazovacích metod, zpravidla mamografie. K vymezení větších lézí je možno použít i více zrn (tzv. „bracketing“), v tom případě od sebe mají být vzdálena minimálně 2 cm. Zrna by neměla být zaváděna do nervových tkání či do oblasti kardiovaskulárního systému. Jehly rovněž nelze použít v prostředí magnetické rezonance [13]. V literatuře je uvedena možnost lokalizace jódového zrna pro brachyterapii karcinomu prostaty za navigace MRI [14]. Naproti tomu, v praxi častá alergie na jód nepředstavuje kontraindikaci, neboť jód je těsně uzavřen v titanové kapsli a nepřichází do styku s tkáněmi pacienta.
Chirurgický výkon
Následný chirurgický výkon by měl být, dle údajů výrobce, proveden do 30 dnů od zavedení. Během operace je aktivita zrna detekována pomocí scintilační sondy (gama sonda) používané běžně na pracovištích mamární chirurgie k detekci sentinelové uzliny. Většina současných sond umožňuje selektivní detekci různých izotopů, jsou tedy schopny odlišit signál I-125m od izotopu technecia Tc-99m používaného k detekci sentinelové uzliny a vydávajícího záření na odlišné energetické hladině (140 keV). Pomocí sondy je realizován cílený chirurgický výkon, žádoucí je exstirpovat předmětnou lézi i s lokalizačním zrnem. Přítomnost zrna v resekátu je nutno ověřit sondou nebo pomocí peroperační radiografie resekátu [Obr. 2].
Image 2. Radiografický snímek mamárního resekátu s klipem a jodovým zrnem (PACS MOÚ Brno)
Fig.2: Radiographic image of mammary specimen with the clip and iodine seed (PACS MMCI Brno)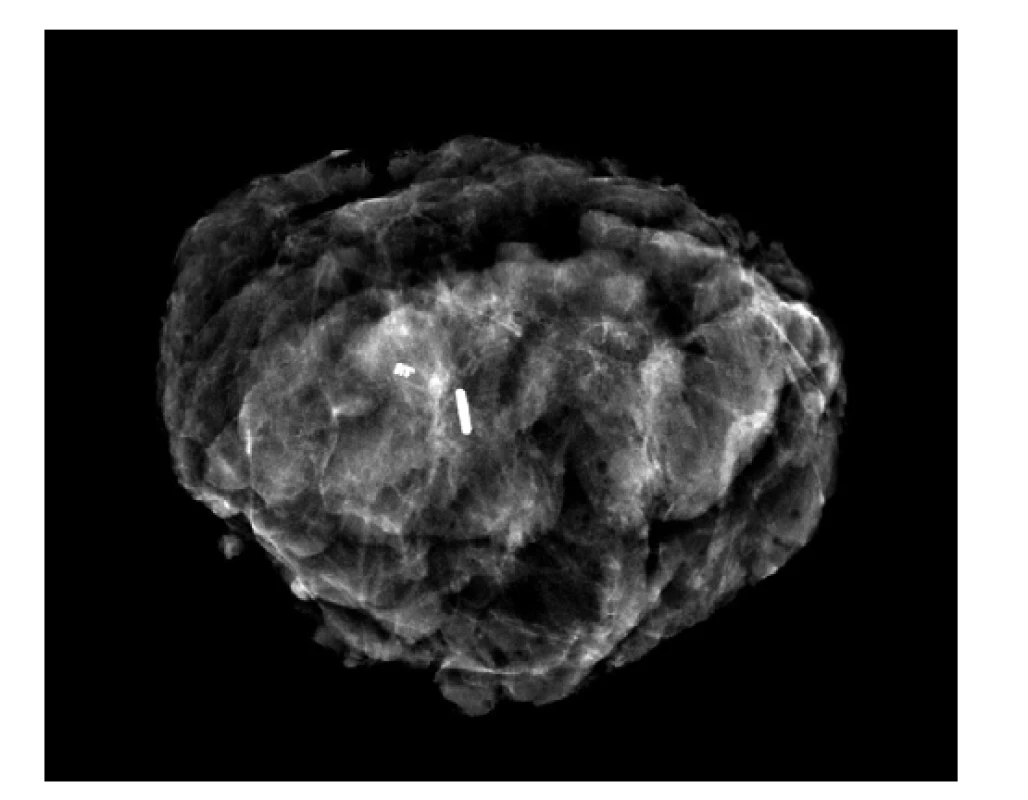
Transport resekátu a histopatologické vyšetření
Operační resekát obsahující zrno je transportován v běžně používaných nádobách na patologii. Materiál lze zpracovávat nativní, nebo standardně fixovaný. Během fixace je vhodné resekát uchovávat v odstíněném prostředí, např. v komůrce vystavěné z olověných cihel. Patolog při makroskopickém zpracování vzorku zrno vyhledá, rovněž pomocí gama sondy, a vkládá do plastové zkumavky se šroubovacím uzávěrem do 96% etanolu ke stabilizaci tkáně a zabránění případnému bakteriálnímu rozkladu. Zkumavka je umístěna do malého přenosného stíněného olověného kontejneru, který je v pravidelných intervalech odnášen na oddělení nukleární medicíny.
Uchování a likvidace zrna
Zrno je uchováváno v oddělení nukleární medicíny v místnosti pro radioaktivní odpad. Po splnění uvolňovací úrovně, kdy příkon dávkového ekvivalentu ve vzdálenosti 1 m je maximálně 0,1 μSv/hod. a povrchové kontaminace maximálně 0,4 μSv/m2 nad úrovní pozadí, je možné zrno uvolnit do komunálního odpadu.
Aspekty radiační ochrany
Jódové zrno představuje z hlediska radiační ochrany tzv. drobný zdroj ionizujícího záření. Před jeho používáním v daném zdravotnickém zařízení je třeba podat na Státní úřad pro jadernou bezpečnost (SÚJB) ohlášení, které popisuje mimo jiné proces používání a likvidace zdroje a radiační ochrany. Aktivita zrna je přibližně 9,5 MBq. Ihned po výrobě se plynule snižuje, poločas rozpadu činí 60 dní. Při přejímání drobných zdrojů ionizujícího záření dle vyhlášky č. 422/2016 Sb. se neprovádějí zkoušky přejímací ani dlouhodobé stability. Vzhledem ke způsobu použití, kdy se jedná o výrobek spotřebního charakteru, není třeba provádět ani zkoušky provozní stálosti. Dle údajů výrobce má zrno zůstat v těle pacienta maximálně 30 dní. Dávky záření pro personál jsou, dle předpokladů, velmi malé, nicméně i přes tyto poměrně malé dávky záření jsou nutná opatření, zajišťující co nejmenší expozici. Expozici lze snížit zkracováním expoziční doby, vzdáleností od zdroje ionizujícího záření a použitím stínících bariér. Tenká vrstva olova tloušťky 0,25 mm snižuje expozici o 99,9 %. Dle údajů výrobce je vhodné sledování radiační zátěže personálu. Jako nejvhodnější se jeví prstové dozimetry. Nezbytné je proškolení personálu o bezpečnosti práce a radiační ochraně při práci se zdroji ionizujícího záření dohlížejícími osobami příslušných pracovišť, o proškolení jsou vedeny písemné záznamy.
Trasování a dokumentace
Přítomnost a pohyb zrna ve zdravotnickém zařízení je třeba důsledně dokumentovat a zamezit jeho ztrátě. Ztráta radionuklidového zdroje je z hlediska radiační ochrany radiační mimořádnou událostí 1. stupně, kterou je potřeba ohlásit na SÚJB.
Dosavadní zkušenosti, diskuze
Lokalizační jódová zrna jsme začali aplikovat od října 2019. Jedná se převážně o parciální mastektomie pro nehmatné karcinomy prsu (invazivní karcinomy a duktální karcinomy in situ – DCIS). Druhou hlavní oblastí využití je lokalizace patologických uzlin při cílených axilárních disekcích (Targeted Axillary Dissection – TAD). Jedná se o postup, kdy je původně metastatická axilární uzlina označena hydroklipem. Pokud během neoadjuvantní léčby dojde k regresi, je před operací označena jódovým zrnem pro možnost cíleného odstranění. Podrobněji byl princip cílené axilární disekce v odborné literatuře již popsán [15,16].
Použití zrna je přínosné i pro histologické vyšetření. Vyhledání malých, nehmatných, a především makroskopicky neviditelných lézí ve tkáních mléčné žlázy je pro patologa obtížné. Zavedené zrno umožňuje sondou vyhledat oblast v rozsahu několika centimetrů a podstatně zúžit oblast zájmu k mikroskopickému vyšetření. Tím se nejen zrychlí a zlevní, ale také zpřesní diagnostika. Využití zrna by se nemuselo omezovat pouze na parciální mastektomie a TAD, ale z pohledu patologa by bylo výhodné i u mastektomií totálních, zvláště u velkých prsů. Značení zrnem by bylo vhodné u malých invazivních lézí pod 10 mm a in situ lézí, které na MG a UZ nemají jasný ložiskový korelát. Mikrokalcifikace nelze brát v potaz, při makroskopickém vyšetření nejsou patrné a k nalezení ložiska nepomohou.
Zavedení metody v našem ústavu předcházela jednání pracovníků zúčastněných oddělení, byly navrženy a upřesněny standardy nakládání s jódovými zrny a popsány do ohlášení na SÚJB. Dále byly vytvořeny písemné informace pro pacienty jako doplněk k informovanému souhlasu se zavedením lokalizačního zrna. Radiační pracovníci, přicházející do styku se zrnem, byli proškoleni dohlížejícími osobami příslušných pracovišť. Pro sledování radiační zátěže radiačních pracovníků (radiolog, chirurg, patolog, sestry a laboranti manipulující se zrny) jsme zvolili prstové termoluminiscenční dozimetry, jejich použití však není nezbytnou podmínkou. Vyhodnocování je měsíční a sledovací období bylo předběžně stanoveno na 1 rok. Limit pro průměrnou ekvivalentní dávku pro obyvatelstvo na každý cm2 kůže je 50 mSv za jeden kalendářní rok. Pro radiační pracovníky je ekvivalentní dávka na končetiny 500 mSv za jeden kalendářní rok. Na prstových TL dozimetrech, používaných radiology a patology, nebyla dosud zaznamenána detekovatelná dávka, výjimkou byla hodnota 0,01 mSv. Nízká měřitelná ekvivalentní dávka v jednotkách mSv za rok na prstových TL dozimetrech, používaných chirurgy, je tedy nejspíše podmíněna radioizotopem technecia, používaným současně k detekci sentinelové uzliny. Pokud se tato situace nezmění, nebude zřejmě nutné po uplynutí 1 roku prstové TL dozimetry používat.
V tabulce (Tab. 1) jsou uvedena pracoviště, na kterých je (v našem ústavu) se zrnem nakládáno, a vypsány jednotlivé úkony.
Table 1. Cesta radioaktivního zrna
Tab. 1: The path of the radioactive seed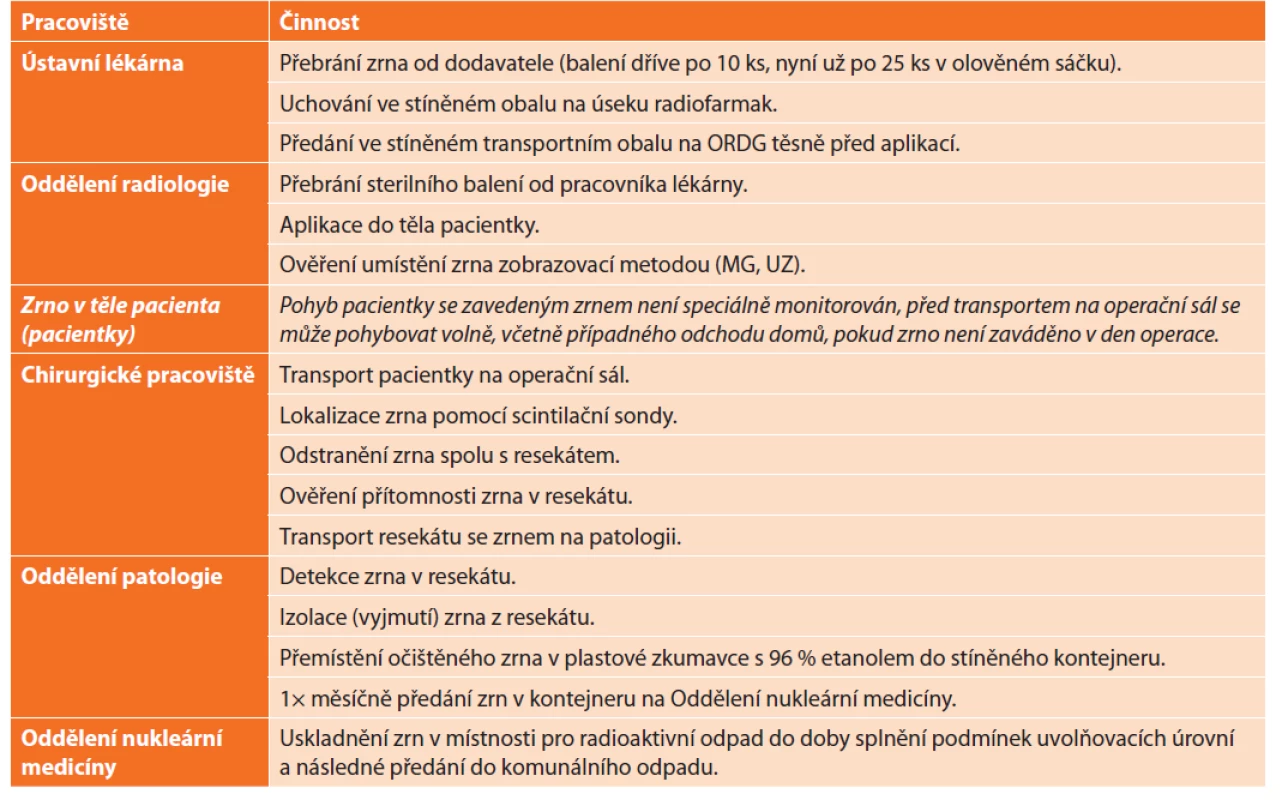
Co se týká radiační zátěže pacientek při lokalizaci nehmatných lézí prsu, dávka absorbovaná celým prsem byla kalkulována v práci Reed Aj, 2019 [17]. Pohybovala se podle velikosti léze a prsu mezi 0,0097 a 0,0477 mGy.h-1.MBq-1. V závislosti na počtu zavedených zrn, jejich aktivitě a době, po kterou zůstávala v těle pacientky, činil medián absorbované dávky v příslušné klinické studii 0,5 mGy, což je menší dávka než při jednom mamografickém vyšetření. A je to dávka cca 50 000krát nižší než při radioterapii mamárních karcinomů. Dávky osob, které přicházejí s pacientkami do běžného styku, jsou zcela zanedbatelné a nepřevyšují aktivitu běžného pozadí vzhledem k větší vzdálenosti od zdroje záření a krátké expoziční době.
Dosavadní praktické zkušenosti
Od října 2019 do září 2020 jsme jódová zrna použili u 224 pacientek (189× lokalizace primárního nádoru, 50x lokalizace uzliny, u 15 pacientek současně lokalizace primárního nádoru a uzliny). Zavedené zrno se vždy podařilo při operaci detekovat, exstirpovat a transportovat na patologii k řádné likvidaci.
Při zavádění se ojediněle vyskytly problémy, srovnatelné se zaváděním jiných, dosud běžných invazivních markerů (lokalizační klipy). Jednalo se o předčasné vypadnutí zrna z jehly mimo tělo pacientky (technická chyba). Dále naopak obtížné uvolnění zrna z jehly, kdy výsledkem byla poloha zrna ve vzdálenosti několika cm od předmětného ložiska. Problémy specifické pro jódové zrno nebyly zaznamenány.
Z pohledu chirurga stojí za zmínku několik možných komplikací, které opět převážně nejsou specifické pro jódové zrno, ale mohou nastat při použití jakéhokoli invazivního markeru:
• Zrno není v centru léze. Vzhledem k tomu doporučujeme zhotovit po zavedení zrna MG snímek ve dvou projekcích (kranio-kaudální + bočná), který ozřejmí prostorový vztah zrna a předmětné léze.
• Zavedení zrna způsobí hematom, dojde ke znepřehlednění prostorových poměrů. Zrno může „plavat“ v hematomu a vzdálit se od předmětné léze (zcela ojediněle).
• Může dojít k obnažení zrna či jeho vypadnutí z resekátu, což je však spíše způsobeno nevhodným operačním postupem (preparace směrem přímo na zrno namísto snahy o resekci s okolní tkání).
• Překrývání aktivity zrna aktivitou technecia aplikovaného při lymfoscintigrafickém vyšetření pro účely sentinelové biopsie. Příslušné scintilační sondy detekují aktivitu obou izotopů sice částečně selektivně, ovšem pokud je technecium aplikováno do bezprostřední blízkosti zrna (méně než cca 3 cm), může jeho vysoká aktivita v místě aplikace překrývat aktivitu zrna. Různé sondy se liší v detekčních schopnostech, doporučujeme vždy se předem seznámit s vlastnostmi používané sondy! V našich podmínkách aplikujeme technecium periareolárně a snažíme se o dodržení vzdálenosti minimálně 3–4 cm od zavedeného zrna, problém se tedy týká především lézí lokalizovaných v centru prsu.
Jistou nevýhodou metody je doporučení omezit dobu přítomnosti zrna v těle pacienta na maximálně 30 dní. Léze před neoadjuvantní chemoterapií, která trvá zpravidla déle, je tedy třeba značit jiným markerem (hydroklip). Zrno je potom aplikováno k hydroklipu až těsně před operací, v našich podmínkách v den operace ráno. Vzhledem k tomu jsme se nesetkali s problémem zjevné migrace správně a nekomplikovaně zavedeného zrna. Dle údajů v literatuře k migraci zrna prakticky nedochází [18]. Eventuální problém zavedení do nesprávného místa nebo ojedinělá možnost vzniku výraznějšího hematomu byla již zmíněna výše. V literatuře však existují zmínky a argumentace pro bezpečné použití zrna i po lhůtě 30 dnů, kdy je zrno zavedeno před neoadjuvantní léčbou a setrvává na svém místě až do operace, kdy je jeho aktivita stále dostatečná k úspěšné detekci [19]. S touto metodou nemáme osobní zkušenosti.
Z pohledu ekonomického je zrno plně hrazeno zdravotními pojišťovnami jako zvlášť účtovatelný materiál (ZUM), cena je 6999 Kč. Při chirurgickém výkonu je možno vykázat kód 47277 – radiačně navigovaný chirurgický výkon (327 bodů, přičítá se k běžně vykázanému výkonu).
ZÁVĚR
Na základě dosavadních zkušeností můžeme konstatovat, že použití lokalizačních zrn se velmi osvědčilo a metoda se na našem pracovišti rychle rozšířila a stala se denní samozřejmostí. Při dosavadním vy - hodnocování prstových dozimetrů nebyly u radiologů a až na jedinou výjimku ani u patologů zjištěny měřitelné hodnoty expozice. Měřitelnou minimální expozici u nezařazených radiačních pracovníků chirurgie (dosud maximálně 2,9 mSv/měsíc) nelze dokonale interpretovat, zřejmě je způsobena především aktivitou Tc-99, používaného pro detekci sentinelové uzliny. Peroperační detekce jódového zrna je pro zkušeného mamárního chirurga zcela bezproblémová. Resekce tak může být cílenější a šetrnější pro pacientku, ačkoli objektivní vyhodnocení vlastních dat zatím k dispozici nemáme. Realizace případné randomizované studie srovnávající tuto metodu s dosavadní praxí značení křížkem na kůži nebo lokalizačním vodičem považujeme eticky za nepřijatelnou, neboť výhody zrna jsou dle subjektivního hodnocení zjevné. Jódové zrno nevyžaduje použití zvláštní sondy navíc oproti scintilační sondě, potřebné pro radionavigovanou detekci sentinelové uzliny, ani speciální nástroje, ani průběžnou peroperační kalibraci sondy. Jen doporučujeme před zavedením metody prakticky ověřit (na fantomu), zda je používaná sonda skutečně schopna detekovat signál I-125, a zřetelně jej odlišit od signálu Tc-99.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Lucie Gabrielová
Klinika operační onkologie –
Oddělení mamokutánní a onkoplastické chirurgie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: gabrielova@mou.cz
Sources
1. Kasem I, Mokbel K. Savi Scout® radar localisation of non-palpable breast lesions: Systematic review and pooled analysis of 842 cases. Anticancer Res. 2020 Jul;40(7):3633−3643. doi: 10.21873/anticanres. 14352.
2. Wazir U, Tayeh S, Perry N, et al. Wireless breast localisation using radio-frequency identification tags: The first reported European experience in breast cancer. In Vivo 2020;34(1):233−238. doi:10.21873/ invivo. 11765.
3. Gray RJ, Nguyen K, DauWay E, et al. Randomized prospective evaluation of a novel technique for biopsy or lumpectomy of nonpalpable breast lesions: radioactive seed versus wire localization. Ann Surg Oncol. 2001;8(9):711−715. doi: 10.1007/s10434/001/0711/3.
4. Gray RJ, Pockaj BA, Karstaedt PJ, et al. Radioactive seed localization of nonpalpable breast lesions is better than wire localization. Am J Surg. 2004;188(4):377−380. doi: 10.1016/j.amjsurg.2004.06.023.
5. Hughes JH, Mason MC, Gray JR, et al. A multi-site validation trial of radioactive seed localization as an alternative to wire localization. Breast J. 2008;14 : 153−157. doi: 10.1111/j.1524-4741.2007.00546.x.
6. Lovrics PJ, Goldsmith CH, Hodgson N, et al. A multicentered, randomized, controlled trial comparing radioguided seed localization to standard wire localization for nonpalpable, invasive and in situ breast carcinomas. Ann Surg Oncol. 2011;18(12):3407−3414.doi: 10.1245/ s10434-011-1699-y.
7. Murphy JO, Moo TA, King TA, et al. Radioactive seed localization compared to wire localization in breast-conserving surgery: Initial 6-month experience. Ann Surg Oncol. 2013;20(13):4121–4127 doi: 10.1245/ s10434-013-3166.
8. Gobardhan PD, de Wall LL, van der Laan L, et al. The role of radioactive iodine-125 seed localization in breast-conserving therapy following neoadjuvant chemotherapy. Ann Oncol. 2013;24 : 668−667. doi: 10.1093/annonc/mds475.
9. Taylor DB, Bourke AG, Westcott E, et al. Radioguided occult lesion localisation using iodine-125 seeds (ROLLIS) for removal of impalpable breast lesions: First Australian experience. J Med Imaging Radiat Oncol. 2015;59(4):411−420. doi: 10.1111/1754-9485.12302.
10. Milligan R, Pieri A, Critchley A, et al. Radioactive seed localization compared with wire-guided localization of non-palpable breast carcinoma in breast conservation surgery – the first experience in the United Kingdom. Br J Radiol. 2018;91(1081):20170268. doi: 10.1259/ bjr.20170268.
11. Niinikoski L, Hukkinen K, Leidenius MHK, et al. Resection margins and local recurrences of impalpable breast cancer: Comparison between radioguided occult lesion localization (ROLL) and radioactive seed localization (RSL). Breast 2019;47 : 93−101. doi: 10.1016/j. breast.2019.07.004.
12. Sánchez Sánchez R, Gonález Jiménez AD, Rebollo Aguirre AC, et al. 125I radioactive seed localization for non-palpable lesions in breast cancer. Rev Esp Med Nucl Imagen Mol. 2019;38(6):343−347. doi: 10.1016/j.remn.2019.05.004.
13. Patriciu A, Petrisor D, Muntener M, et al. Automatic brachytherapy seed placement under MRI guidance. IEEE transaction on biomedical engineering. IEEE Trans Biomed Eng. 2007 Aug;54(8):1499 – 1506. doi: 10.1109/TBME 2007.900816.
14. Caudle AS, Yang WT, Krishnamutrhy S, et al. Improved axillary evaluation following neoadjuvant therapy for patients with node-positive breast cancer using selective evaluation of clipped nodes: Implementation of targeted axillary dissection. J Clin Oncol. 2016;34(10):1072−1078. doi: 10. 1200/JCO.2015.64.0094. Epub 2016 Jan 25.
15. Patriciu A, Petrisor D, Muntener M, et al. Automatic brachytherapy seed placement under MRI guidance. IEEE Trans Biomed Eng. 2007;54(8):1499−1506. doi: 10.1109/TBME.2007.900816.
16. Coufal O, Zapletal O, Gabrielová L, et al. Targeted axillary dissection and sentinel lymph node biopsy in breast cancer patients after neoadjuvant chemotherapy − retrospective study. Rozhl Chir. 2018;97(12):551−557.
17. Reed AJ, Kim JH, Burrage JW. Development and application of a similar method for calculating breast dose from radio-guided occult lesion localisation using iodine − 125 seeds (ROLLIS). Phys Med Biol. 2019;64(7):075020. doi: 10.1088/1361-6560/ab0149.
18. Alderliesten T, Loo CE, Pengel KE, et al. Radioactive seed localization of breast lesions: an adequate localization method without seed migration. Breast J. 2011;17(6):594−601. doi: 10.1111/j.1524 - 4741.2011.01155.x. Epub. 2011 Sep 12.
19. Donker M, Straver ME, Wesseling J, et al. Marking axillary lymph nodes with radioactive iodine seeds for axillary staging after neoadjuvant systemic treatment in breast cancer patients: the MARI procedure. Ann Surg. 2015;261(2):378−382. doi: 10.1097/SLA.0000000000000558.
20. McGhan LJ, McKeever SC, Pockaj BA, et al. Radioactive seed localization for nonpalpable breast lesions: review of 1,000 consecutive procedures at a single institution. Ann Surg Oncol. 2011 Oct;18(11):3096−3101. doi: 10.1245/ s10434-011-1910-1. Epub. 2011 Sep 27.
21. Kodl O, Jursíková E, Daneš J, et al. Přínos a radiační riziko při mamografickém screeningu za období 2003−2007. Ces Radiol. 2009;63(4):342−347.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 6-
All articles in this issue
- Chirurgie prsu – důležitá součást onkochirurgie
- Iodine seed localisation of non-palpable lesions in breast surgery − first experience
- Appendiceal mucocele – a radiologist’s view
- The importance of sentinel lymph node biopsy following neoadjuvant chemotherapy in patients with breast cancer: prospective multicentre trial
- Komentář k článku: Žatecký J., et al. Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
- Preoperative CT for postoperative radiotherapy planning in breast cancer
- Komentář k článku A. Hlávky a kol. Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
- Role of the radiologist during neoadjuvant systemic therapy for breast cancer
- Phyllodes tumor and its malignization into invasive ductal carcinoma − a case report
- Aneurysm of pancreaticoduodenal arcade caused by medial arcuate ligament syndrome – case report and review of literature
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Iodine seed localisation of non-palpable lesions in breast surgery − first experience
- Appendiceal mucocele – a radiologist’s view
- Phyllodes tumor and its malignization into invasive ductal carcinoma − a case report
- Aneurysm of pancreaticoduodenal arcade caused by medial arcuate ligament syndrome – case report and review of literature
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

