-
Medical journals
- Career
Chirurgická léčba karcinomu prsu po neoadjuvantní terapii
Authors: V. Petrů 1; P. Vážan 2; M. Zábojníková 3; J. Duben 1; B. Dudešek 1; P. Kosáč 1; M. Ratajský 1; P. Jančík 1; J. Gatěk 1,4
Authors‘ workplace: Chirurgické oddělení EUC Zlín 1; CGB laboratoř patologie Zlín 2; Onkologie KNTB Zlín 3; Univerzita Tomáše Bati ve Zlíně 4
Published in: Rozhl. Chir., 2020, roč. 99, č. 4, s. 172-178.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2020.99.4.172–178Overview
Úvod: Neoadjuvantní terapie (NT) aplikovaná před operací pro karcinom prsu může v příznivém případě vést ke zmenšení nebo k úplnému vymizení nádoru – kompletní patologické odpovědi (pCR). Díky downstagingu po NT může docházet také ke zmenšení rozsahu operačního výkonu. pCR představuje významný prognostický faktor přežití. Cílem této práce je zhodnotit v našem souboru operovaných pacientek pro karcinom prsu účinnost NT vedoucí k pCR a zjistit četnost výskytu lokoregionálních recidiv (LRR) v závislosti na rozsahu operačního výkonu v daném pooperačním časovém období.
Metoda: Jedná se o retrospektivní studii se souborem 96 pacientek po NT, které v období 2006–2018 podstoupily operační výkon pro karcinom prsu. Dle výsledků histologie po operaci jsme hodnotili stupeň regrese, a tím i pCR. V pooperačním období jsme pak sledovali výskyt LRR ve vztahu k operačnímu řešení jak na prsu, tak v axile.
Výsledky: pCR (Chevallier 1) byla zaznamenána v 26 případech – 27,1 %. Během sledování pacientek v pooperačním období v rámci dispenzarizace došlo ke vzniku celkem 8 LRR – 8,3 % (5,2 % po mastektomii a 2,1 % po konz. výkonu). Průměrný follow-up byl necelých 30 měsíců, medián 26,5 měsíce.
Závěr: S rozvojem nových režimů NT došlo k výraznému nárůstu pCR, především u molekulárního subtypu HER2+ a triple negativní, a tím snížení výskytu LRR. Narůstá tak počet prs záchovných výkonů s biopsií sentinelové uzliny. U vybrané skupiny pacientek je konzervativní výkon bezpečný s nízkým počtem lokoregionálních recidiv.
Klíčová slova:
karcinom prsu – neoadjuvatní terapie – kompletní patologická odpověď – lokoregionální recidiva
ÚVOD
Historicky byla neoadjuvantní chemoterapie (NT) zavedena do léčby karcinomu prsu od roku 1970 jednak s cílem převést velké neresekabilní nádory na resekabilní a také k terapii inflamatorního karcinomu prsu. V dalším období byla NT rozšířena i na pokročilé nádory vyžadující mastektomii s cílem umožnit prs záchovný výkon díky downstagingu. Nepotvrdily se obavy ze zvýšeného počtu pooperačních komplikací, z další progrese růstu nádoru během terapie a ze změn histologického typu karcinomu v souvislosti s NT [1]. Další výzkum karcinomu prsu potvrdil jeho heterogenitu, a tím různý efekt NT na daný molekulární subtyp tumoru. Dnes je NT aplikována i na léčbu časných operabilních karcinomů prsu právě v závislosti na jejich biologické povaze [2,3].
Jedna z výhod NT je možnost sledování účinnosti této léčby [4]. Účinek NT se projevuje jak na nádor v prsu, tak na lymfatické uzliny v axile (LN). Může tak dojít ke konverzi původně maligních LN na benigní, a tedy ke zmenšení radikality operačního výkonu v axile. Zvyšuje se tak přijatelnost pouhého odstranění sentinelových uzlin (SLNB) bez nutnosti disekce axily (ALND), a tím snížení operační morbidity. Dosavadní studie však prokazují, že SLNB po NT u pozitivních LN je spojena se zvýšeným rizikem falešně negativní uzliny a následně vznikem lokoregionální recidivy (LRR). Snížení počtu falešně negativních uzlin umožňuje identifikace sentinelových uzlin (SLN) duální technikou, vyšším počtem odebraných uzlin nebo značením pozitivních uzlin před terapií [5,6,7]. V případě, že SLN po NT obsahuje i minimální nález malignity, je doporučena ALND [8,9].
Hodnocení účinnosti léčby po NT slouží jako prediktor kompletní patologické odpovědi (pCR) i hodnocení prognózy onemocnění. Kompletní patologická odpověď je definována jako nepřítomnost invazivní choroby v prsu a axilárních LN. Velká metaanalýza, 11 695 pacientů ve 30 studiích, hodnotící účinnost léčby u různých subtypů ukázala pCR dle molekulárního subtypu: pCR u 8,3 % pacientů s HER2-neg. a hormon (HR) poz., dále 18,7 % HER2-poz. s HR poz., 31,1 % pro triple negativní a 38,9 % pro HER2-poz. s HR-neg. S obohacením režimů chemoterapie biologickou léčbou (např. trastuzumab a pertuzumab) se výsledky pCR v posledním desetiletí výrazně zlepšily, zejména u triple negativních a HER2-pozitivních typů karcinomu prsu, kde je účinnost nejvyšší, pCR dosahuje až 60 % [10].
pCR je silný prognostický ukazatel celkového přežití zejména u HR-negativních skupin (buď HER2-poz., či neg.). Na základě výsledků takovýchto studií jsou v přípravě další práce, které zjišťují, zda je vůbec chirurgická léčba ve vybraných skupinách po NT nutná [10].
U pokročilých karcinomů prsu (onemocnění prsu s postižením kůže nebo hrudní stěny cT4 a/nebo rozsáhlé onemocnění v LN-cN2/N3 je účinnost i moderní NT nejistá.
V metaanalýze 12 neoadjuvantních pokusů u těchto nádorů Cortazar et al. prokázali celkovou míru pCR 14,5 % a 16 % v T4a–c (n=781) a T4d (n=482) pacientů [11].
Posouzení indikace NT je individuální a měl by se k ní vyjádřit multidisciplinární tým za účasti chirurga, klinického onkologa a se souhlasem pacienta [12].
Cílem této práce je zhodnotit v našem souboru operovaných pacientek pro karcinom prsu podíl pCR jako výsledek účinnosti NT a zjistit četnost výskytu lokoregionálních recidiv v závislosti na operačním výkonu v daném pooperačním časovém období.
METODY
Retrospektivní studie zahrnuje 96 pacientek po NT, které byly operovány na chirurgickém oddělení EUC Zlín v letech 2006−2018. Průměrný věk pacientek byl 52,9 let, medián 51,5 let. Léčebný postup byl stanoven multidisciplinárním týmem individuálně v závislosti na stadiu nemoci a přidružených komorbiditách pacientek. Před aplikací první série NT byl do centra nádoru aplikován identifikační klip. NT probíhala na onkologii KNTB Zlín. Onkologická léčba vycházela ze stadia nemoci, histologie a molekulárního subtypu tumoru. Složení NT bylo stanoveno onkologem dle typu nádoru. Převažovala zejména neoadjuvantní chemoterapie kombinací antracyklinů a taxanů, hormonoterapie, nejvíce agonisty GnRH (Zoladex), dále tamoxifenem, z biologické léčby trastuzumab (Tab. 1). Účinek chemoterapie na tumor byl monitorován. Před chirurgickým výkonem byla provedena kontrolní mamografie (Obr. 1, 2) a sono prsu s axilou. Chirurgická léčba prsu zahrnovala v závislosti na rozsahu onemocnění mastektomii nebo konzervativní výkon (lumpektomie, kvadrantektomie) a v axile byla prováděna biopsie sentinelové uzliny (SLNB), disekce axily (I+II etáž) a v individuálních případech SLNB s disekcí první etáže axilárních LN. U konzervativního výkonu jsme rutinně odesílali resekát na peroperační RTG vyšetření, aby bylo potvrzeno bezpečné odstranění nádoru, což dokládala i přítomnost klipu (Obr. 3). SLNB byla provedena metodou „dvojitého značení“ (den před op. výkonem je aplikován radiokoloid značený techneciem m99, v den operace bezprostředně před výkonem aplikujeme subareolárně lymfotropní barvivo patent blau). SLN byly peroperačně odeslány k rychlému kryovyšetření (tzv. „na zmrzlo“). Pokud byly minimálně tři SLN negativní, tak jsme od ALND upustili. Naší snahou však bylo dosažení minimálního počtu pěti negativních uzlin. Proto jsme SLNB v těchto případech doplňovali o disekci I. etáže.
Image 1. Karcinom prsu s postiženými lymf. uzlinami v axile před NT
Fig. 1: Breast carcinoma with axillary lymph node metastases before NT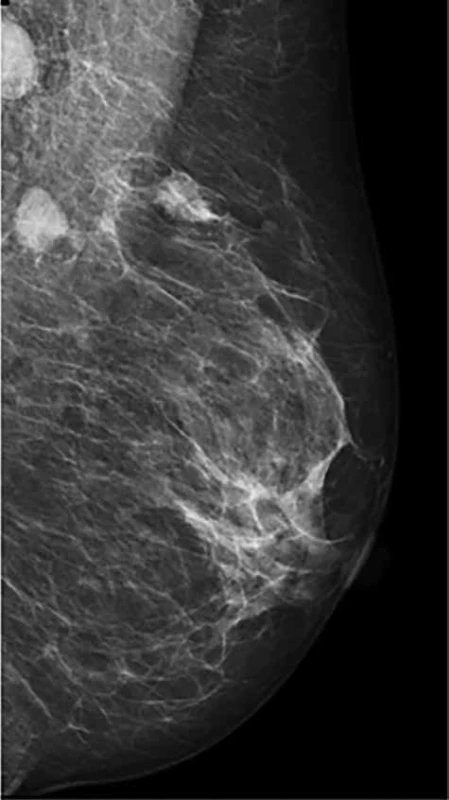
Image 2. Regrese nálezu po NT (ident. klip v místě předchozího tumoru)
Fig. 2: Regression of tumor after NT (ident. clip in the area of the previous tumor)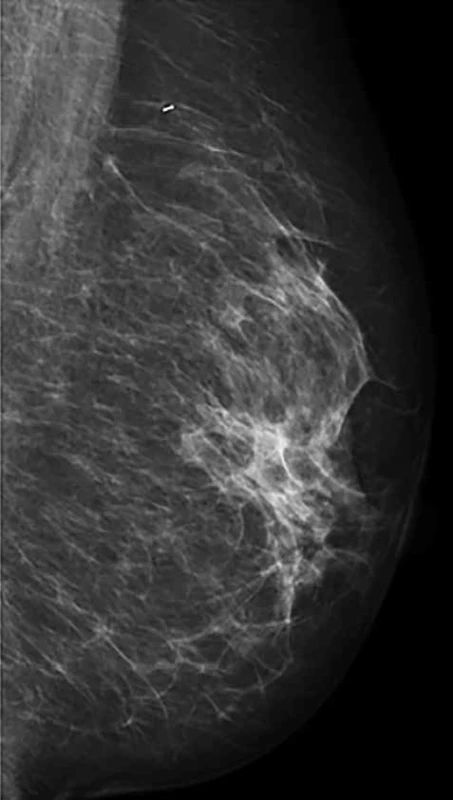
Image 3. Resekát prsu ident. klipem
Fig. 3: Resected breast tissue with the ident. clip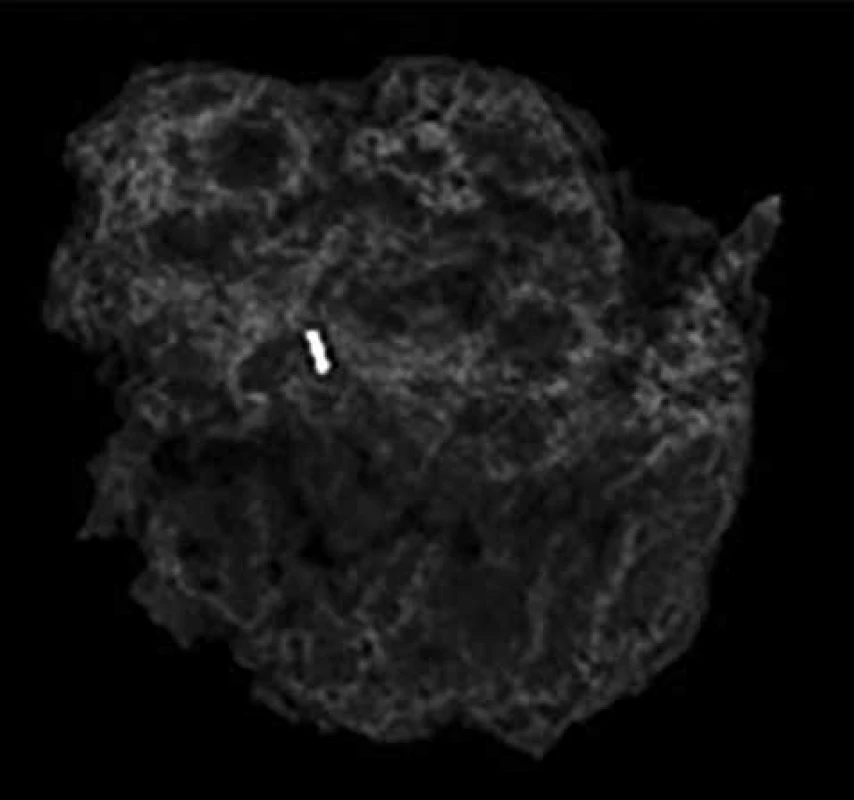
Table 1. Typ neoadjuvantní terapie
Tab. 1: Type of neoadjuvant therapy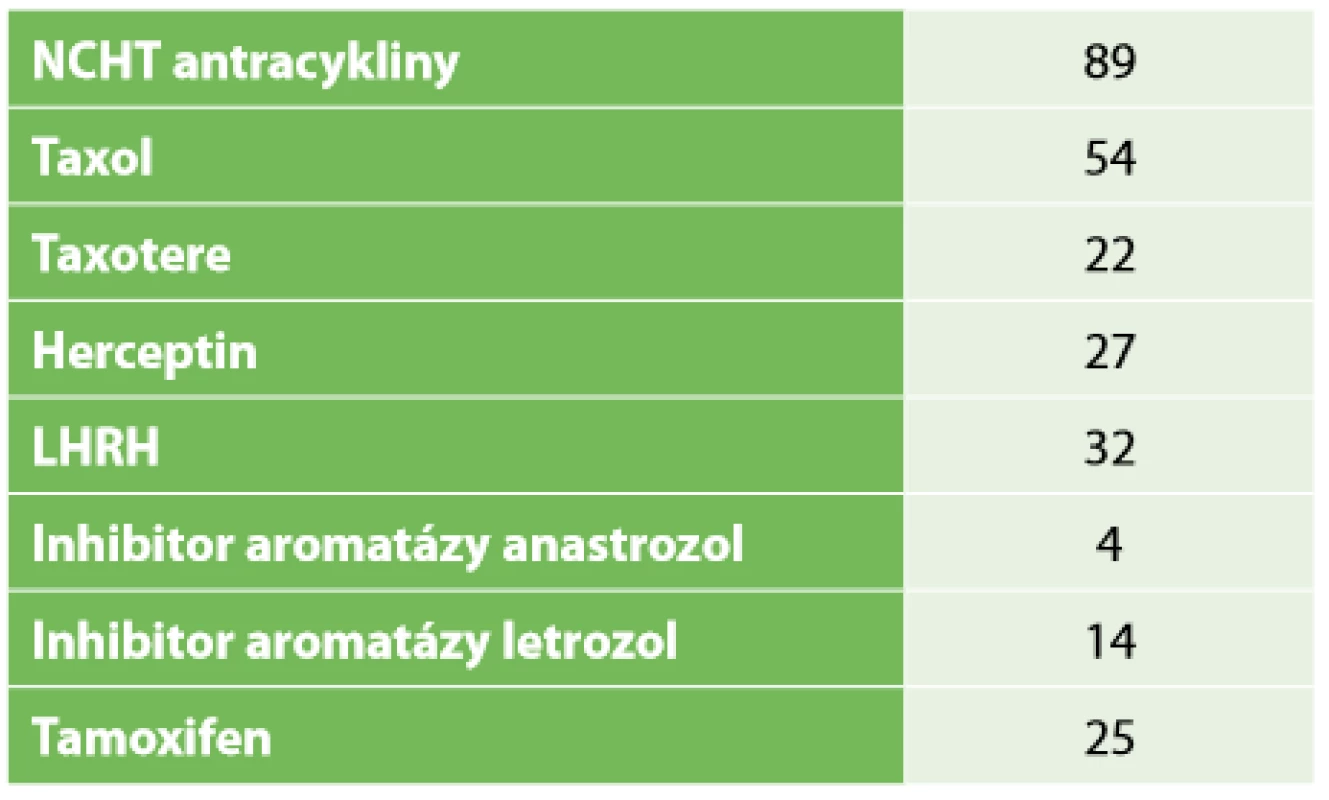
V případě pozitivního nálezu jsme pokračovali disekcí axily I. a II. etáže. ALND byla primárně indikována pouze v případě mnohočetného metastatického postižení uzlin.
Okraje tumoru byly vyšetřeny patologem pooperačně. V případě nedostatečné excize jsme v druhé době patologem označené stěny kavity tumoru reexcidovali. Při neúspěšném druhém pokusu následovala mastektomie.
Dle výsledků histologie po operaci byl hodnocen stupeň regrese včetně pCR. Obr. 4 − histologický preparát z core cut biopsie kompletně vyplněn maligními buňkami ca prsu. Obr. 5 − histologický preparát po NT u stejné pacientky, kde byla detekována kompletní patologická odpověď.
Image 4. Karcinom prsu před NT (histologický preparát)
Fig. 4: Breast carcinoma before NT (histological sample)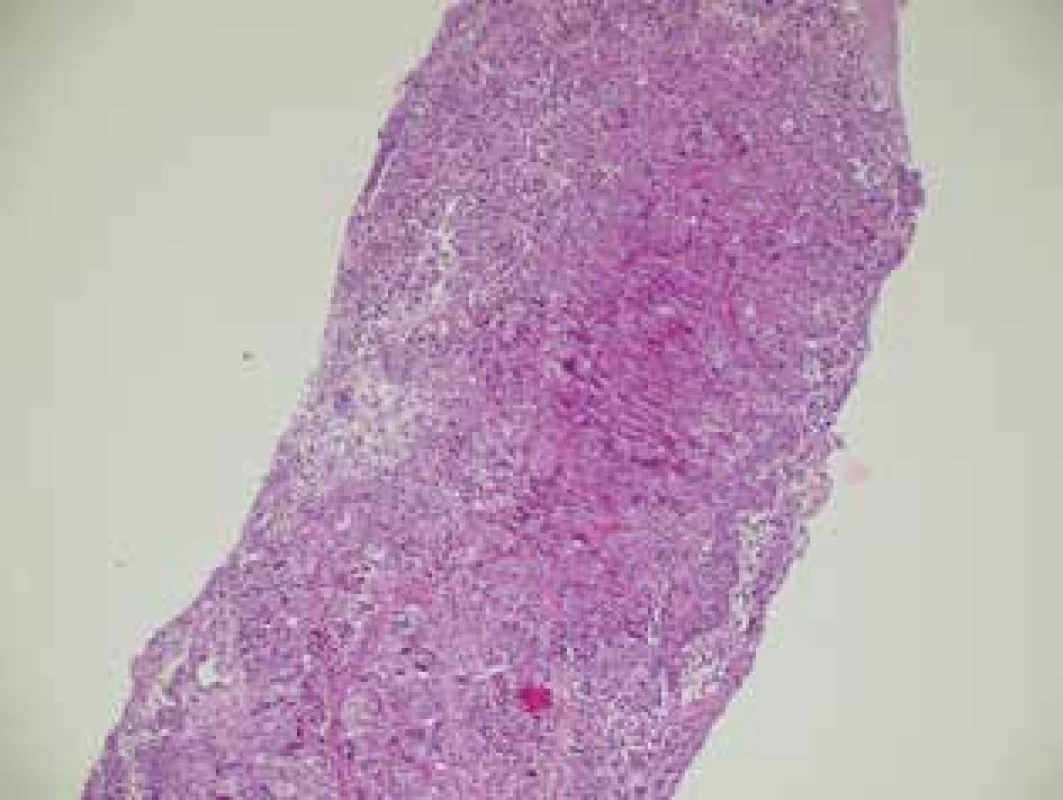
Image 5. Projizvené nádorové lůžko bez maligních buněk po NT
Fig. 5: Scarred tumor bed without any malignant cells after NT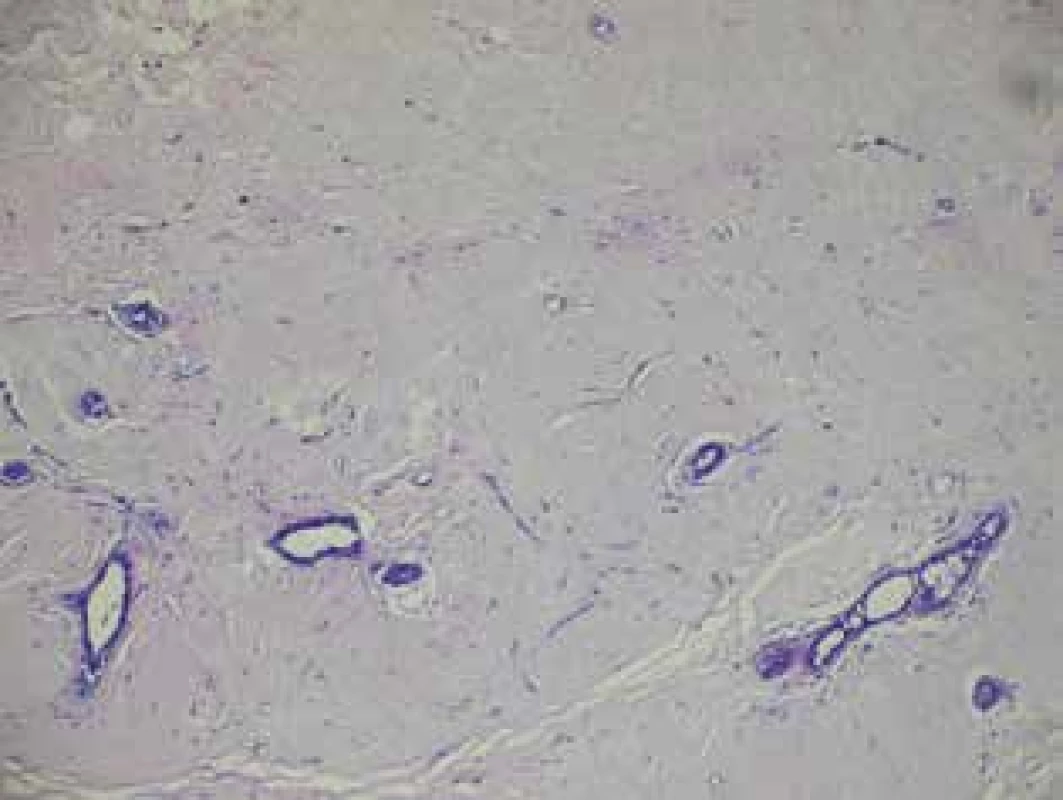
V pooperačním období jsme pak sledovali výskyt lokoregionálních recidiv (LRR) a jejich závislost na rozsahu operačního výkonu. Pacientky byly kontrolovány v mamární poradně pravidelně po 6 měsících.
VÝSLEDKY
Nejvíce byly zastoupeny pacientky s rozsahem nemoci před NT cT2-3 N1-2, tedy ve stadiu 2B až 3A (Tab. 2). Histologicky převažoval duktální karcinom 84,4 %. Luminal B v 41,7 % byl nejčastějším molekulárním subtypem. Podrobný přehled charakteru tumorů viz Tab. 3.
Table 2. TNM klasifikace před NT a po NT
Tab. 2: TNM classification before NT and after NT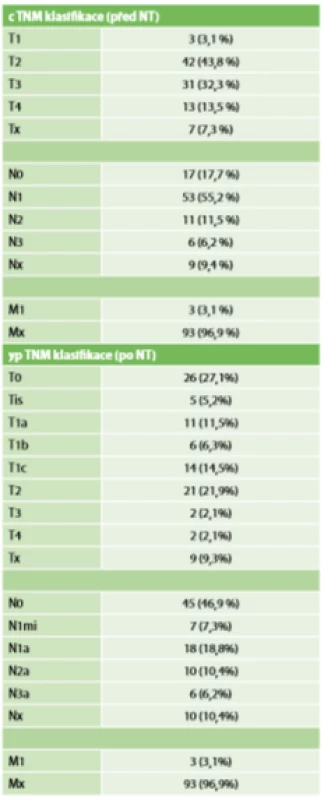
Table 3. Charakteristika tumorů
Tab. 3: Characteristics of tumors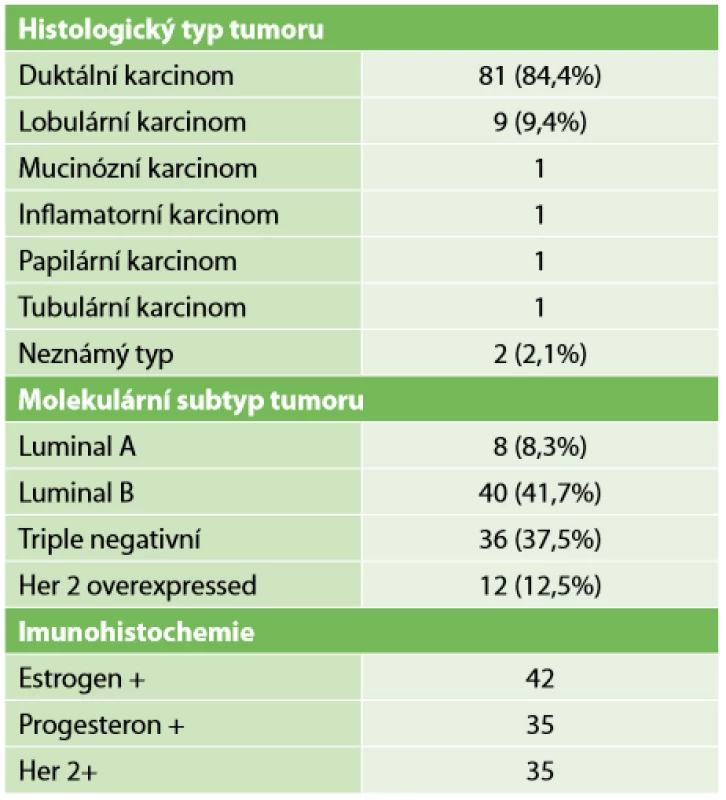
BRCA 1 mutace byla pozitivní u 6 pacientek, BRCA 2 mutace u jedné.
Z celkového počtu 96 pacientek převažovala mastektomie s disekcí axily (43,8 %). V necelých 24 % následoval konzervativní výkon s disekcí axily. Pouhá biopsie sentinelové uzliny byla provedena ve 12 případech. SLNB s částečnou disekcí první etáže LN byla ve vybraných případech uskutečněna sedmnáctkrát, dále Tab. 4. Kompletní patologická odpověď Chevallier 1 byla zaznamenána v 26 případech – 27,1 %. Inkompletní patologická odpověď v 54 případech a perzistence invazivního nádoru s min. regresivními změnami Chevallier 4 v 16 případech (Tab. 5). Přehled rozdělení tumorů dle yp TNM klasifikace viz Tab. 2. Během sledování pacientek v pooperačním období v rámci dispenzarizace došlo ke vzniku celkem 8 lokoregionálních recidiv – 8,3 %, z toho 5,2 % po mastektomii a 2,1 % po konzervativních výkonech. Průměrný follow-up byl necelých 30 měsíců, medián 26,5 měsíce. Vzdálené metastázy byly objeveny u 20 pacientek, ke generalizaci došlo celkem u 10 pacientek. V našem sledovacím období celkem zemřelo 23 pacientek. Z 8 pacientek s LRR zemřelo 5 (Tab. 6). Sledování vzdálených metastáz nebylo předmětem naší studie. Snažili jsme se zaměřit na lokoregionální recidivy, které jsme schopni na našem pracovišti chirurgicky řešit a které mohou být samy o sobě první známkou generalizace. Rozvinutí ohledně vzdálených meta (mozek, skelet atd.) by mohlo být předmětem další studie.
Table 4. Operační výkon
Tab. 4: Type of surgery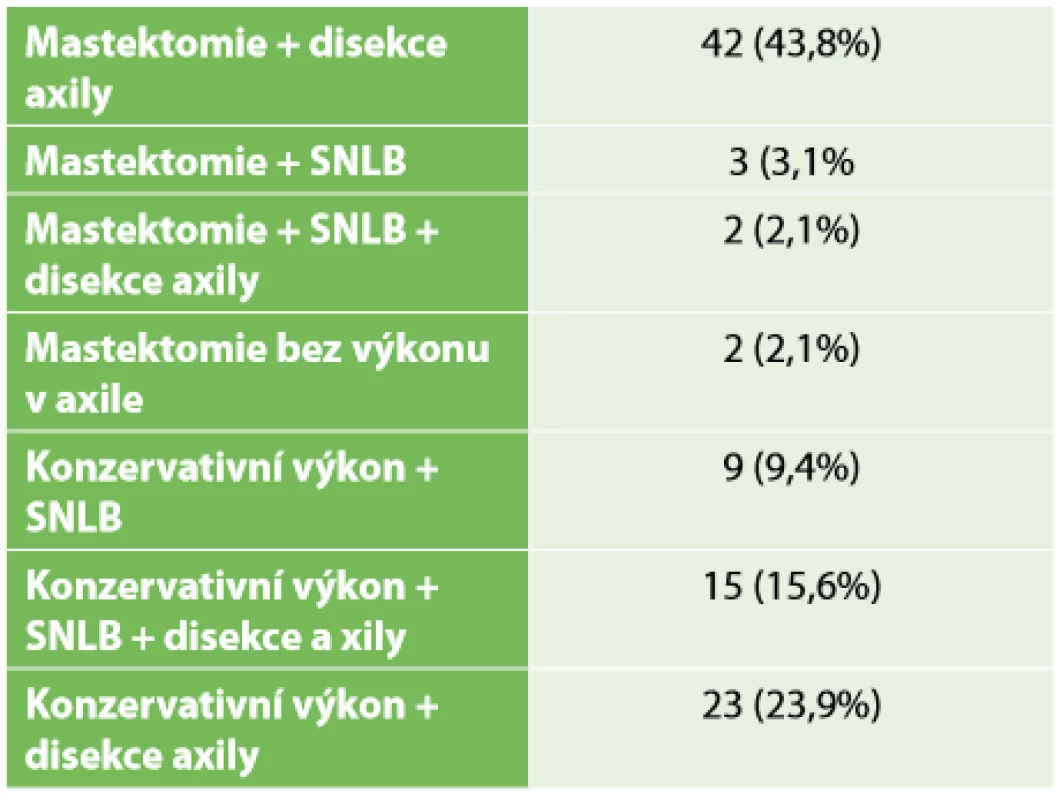
Table 5. Stupeň regrese
Tab. 5: Degree of regression
Table 6. Follow-up
Tab. 6: Follow-up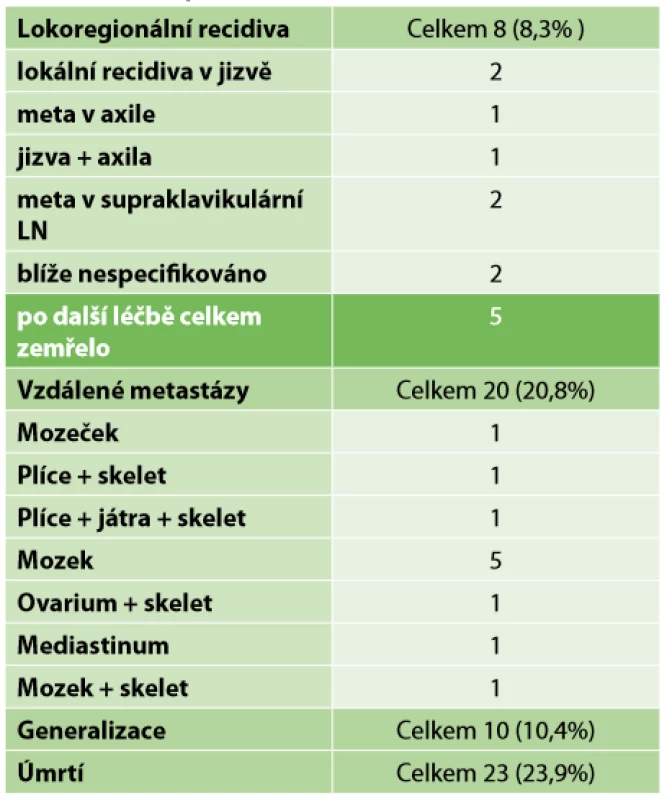
DISKUZE
Současným trendem onkochirurgické léčby karcinomu prsu je přizpůsobit rozsah chirurgického výkonu individualitě pacienta se snahou o minimalizaci rozsahu výkonu s dodržením onkologických zásad. Přestože v dlouhodobém sledování nebylo prokázáno, že NT prokazuje zásadní rozdíly v délce přežití a v bezpříznakovém období oproti adjuvantní chemoterapii, umožňuje NT sledování účinků terapie na tumor [18]. Vliv NT mění inoperabilní nádory v operabilní, čímž zvyšuje podíl konzervativních výkonů [19]. Rozsah patologických odpovědí na NT je důležitým prognostickým faktorem. Se zařazením nových preparátů do NT narůstá počet pCR [2]. V našem souboru 96 pacientek jsme dle pooperačních výsledků histologie zaznamenali celkem 26 případů pCR, tedy 27,1 %. Výsledky jsou srovnatelné se závěry současných studií. V metaanalýze zahrnující 11 695 pacientů pCR dosahuje ve vybraných skupinách 31,1 % u triple negativních karcinomů a 38,9 % u HER2 pozitivních (HER2+) a HR negativních (HR-) pacientů [10]. Další studie uvádí v těchto skupinách (TN, HER2+) pCR až v 60 % [14,15].
Baron et al. publikují v prospektivní studii 608 pacientů s pCR u 28,5 %. Z toho 6,1 % typ luminal A, 8,7 % luminal B, 37,1 % triple negativní a 55 % HER2+ [17]. Náš soubor zahrnuje poměrně dlouhé období, kdy se významně vyvíjely indikace a možnosti NT, což jistě ovlivnilo počet pCR, který je v současnosti i u našich pacientů vyšší. Lobulární karcinom, který je zastoupen v souboru devětkrát, není ideálním typem k NT. Zařazením biologické léčby do NT (inhibitory herceptinu – trastuzumab) se výsledky pCR v posledním desetiletí výrazně zlepšily, a to především u triple negativních a HER2 pozitivních skupin [2].
Změnou velikosti a charakteru nádoru po NT se také mění i podmínky pro chirurgickou léčbu. Chirurgická léčba po NT klade zvýšené nároky na práci multidisciplinárního týmu. Důležitý je vhodný výběr pacientů ke konzervativnímu výkonu a určení vlastního rozsahu resekce. Dle současných doporučení jsou odstraňovány pouze rezidua patrná při klinickém vyšetření a na zobrazovacích metodách [20,21]. Riziko LRR je vyšší, a proto je třeba výběru výkonu a rozsahu resekce věnovat zvýšenou pozornost [24]. Pro resekční linii platí, stejně jako bez NT, že nádor se nesmí dotýkat inkoustu. Širší lem je ale výhodnější [20,21]. Dlouhodobou kontrolou kvality chirurgického výkonu je sledování LRR, což bylo jedním z cílů naší studie.
Registrovali jsme celkem 8 LRR, z nichž pět pacientek zemřelo (Tab. 7). Všechny pacientky s LRR, které zemřely, měly nízkou patologickou odpověď − Chevallier III. – tzn. nepříznivý průběh onemocnění a recidivy byly projevem takového průběhu. LRR se vyskytly u šesti pacientek po mastektomii. Jednou se objevila recidiva u konzervativního výkonu v supraklavikulárních uzlinách a jedna pacientka po konzervativním výkonu zemřela s podezřením na lokální recidivu v prsu. Potvrdit, zda se objevila LRR, nebylo možné pro nedostupnost dat. Prokázaná lokální recidiva v prsu po konzervativním výkonu se dosud neobjevila, i když doba sledování byla limitovaná. U všech pacientek, kde se recidivy vyskytly, byla minimální patologická odpověď na NT a převažovala zde pokročilá stádia. To potvrzuje prognostický význam patologické odpovědi po NT v prognóze přežití. Celkem dvě LRR byly pozorovány u pacientek po konzervativním výkonu, kde bylo stadium nemoci nižší. Z těchto dvou dosáhla jedna pacientka pCR. Oběma pacientkám jsme provedli disekci axily. U pacientky s recidivou na prsu se nepodařilo peroperačně najít identifikační klip, což svědčí o obtížnosti určení rozsahu resekce, ale také o možnosti cestování klipu v prsu. Rozhodování je také komplikováno různou reakcí na NT (možnost vzniku více ložisek na rozdíl od jednoduššího svraštění tumoru). Díky downstagingu byl v našem souboru pacientů proveden konzervativní výkon v 25 %. Ataseven et al. uvádějí studii, kdy konzervativním výkonem po NT dosáhli přežití bez LRR celkem v 92,9 % pro unifokální tumor, 95,1 % pro multifokální tumor a 90,4 % pro multicentrický tumor. Avšak disease free přežití bylo u multicentrických tumorů horší než u unifokálních [13].
Table 7. Přehled pacientů s LRR
Tab. 7: Overview of patients with LRR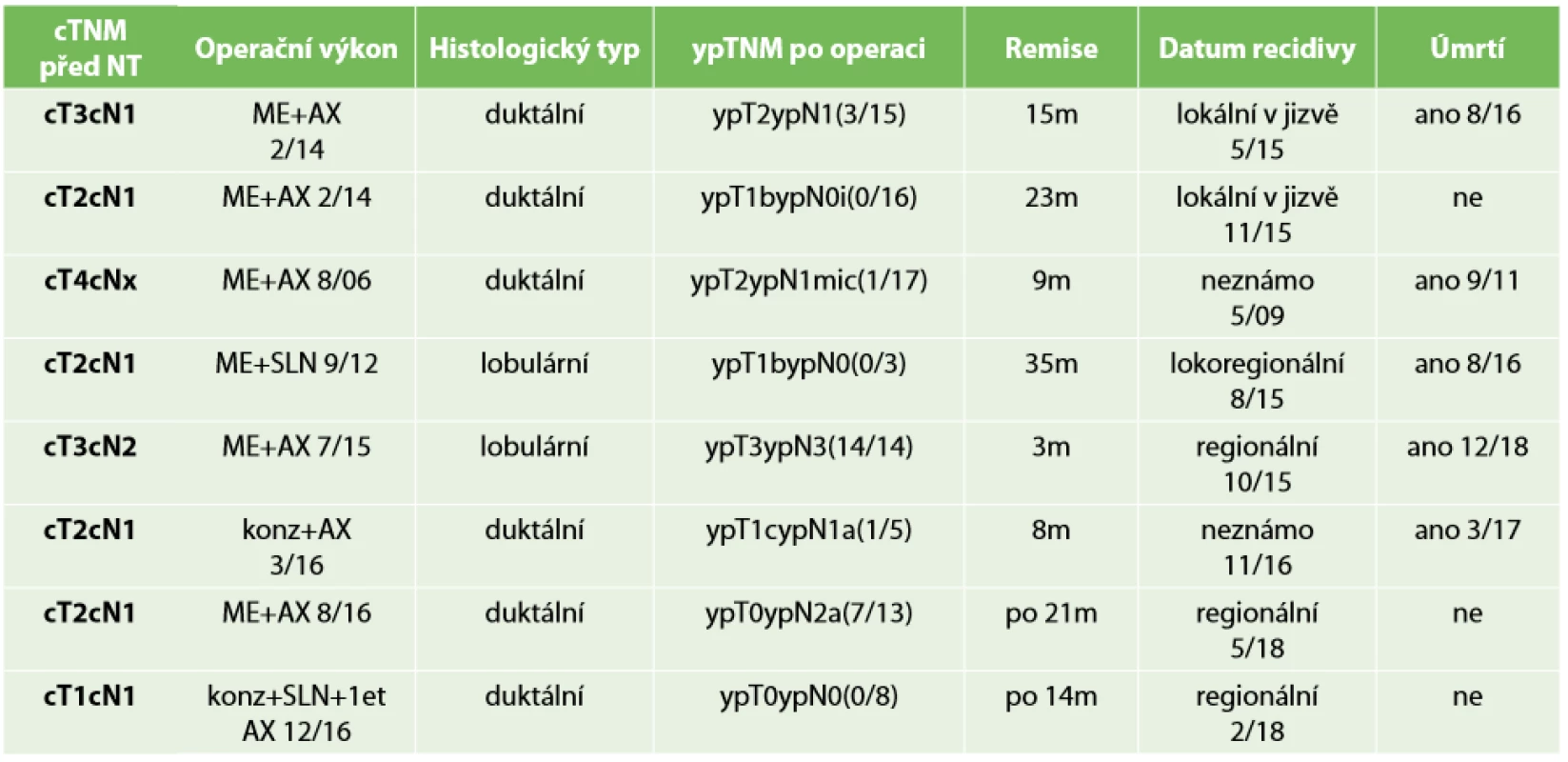
V současné době lze také sledovat posun v chirurgické léčbě karcinomu prsu i v oblasti axily. V případě NT je možné využít dva odlišné postupy. První je možnost SLNB před chemoterapií a při pozitivitě SLN doplnit ALND [7]. Převažující postup je však SLNB po NT, protože může dojít ke konverzi uzlin, a tím ušetření pacientek od ALND. U klinicky negativních uzlin je možné provést SLNB. U pozitivních uzlin však studie prokázaly vysoký počet falešně negativních uzlin, který se snižuje na přijatelnou hodnotu pod 10 % použitím duálních způsobů značení LN a odebráním většího počtu uzlin (tři až čtyři minimálně) [20,21,6]. Vycházeli jsme z doporučení ze St. Gallen 2019 a NCCN, kdy u klinicky pozitivních LU před nasazením NT s následnou konverzí na negativní LU po NT je možné při vyšetření minimálně tří SNL s negativním nálezem od ALND ustoupit. Avšak při menším počtu vyšetřených SNL (<tři) je nutná disekce axily [19]. Další možností, jak snížit počet falešně negativních uzlin, je značení pozitivních uzlin a jejich následné odstranění při SLNB. Značení je možné pomocí radioaktivních a magnetických zrn nebo také pomocí karba [22]. Studie z MD Anderson referuje, že značením pozitivních axilárních uzlin před NT a jejich následným odstraněním se SLN dochází ke snížení falešně pozitivních uzlin až na 1,4 % [23]. V našem souboru dominuje ALND ve spojení s mastektomií a konzervativním výkonem. SLNB ve spojení s NT je výkonem, který byl u nás zaveden v posledních letech, a i přesto tvoří prakticky třetinu celého souboru. SLNB ve spojení s konzervativním výkonem a mastektomií bez ALND dosahuje 12,5 % a dominuje v posledním období studie v roce 2018. Tyto pacientky byly ušetřeny ALND a jejím potenciálním komplikacím. Od roku 2016 značíme pozitivní uzliny karbem. Výsledky budou publikovány.
ZÁVĚR
S rozvojem nových režimů neoadjuvantní terapie došlo k výraznému nárůstu kompletní patologické odpovědi především u molekulárního subtypu HER2 pozitivní a triple negativní, a tím ke snížení výskytu lokoregionální recidivy. Narůstá tak počet prs záchovných výkonů s biopsií sentinelové uzliny. U vybrané skupiny pacientek je konzervativní výkon bezpečný s nízkým počtem lokoregionálních recidiv.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Václav Petrů
EUC Klinika Zlín
Třída Tomáše Bati 5135
760 01 Zlín
e-mail: petru.vaclav@seznam.cz
Sources
- Singletary SE. Neoadjuvant chemotherapy in the treatment of stage II and III breast cancer. Am J Surg. 2001;(182):341−346. doi:10.1016/s0002-9610(01)00724-3.
- Houssami N, Macaskill P, von Minckwitz G, et al. Meta-analysis of the association of breast cancer subtype and pathologic complete response to neoadjuvant chemotherapy. Eur J Cancer 2012;48(18):3342−3354. doi:10.1016/j.ejca.2012.05.023.
- Gentile LF, Plitas G, Zabor EC, et al. Tumor biology predicts pathologic complete response to neoadjuvant chemotherapy in patients presenting with locally advanced breast cancer. Ann Surg Oncol. 2017;24(13):3896−3902. doi:10.1245/s10434-017-6085-y.
- Chen AM, Meric-Bernstam F, Hunt KK, et al. Conservation after neoadjuvant chemotherapy: The MD Anderson Cancer Center experience. J Clin Oncol. 2004;15;(22):2303−2312. doi:10.1200/JCO.2004.09.062.
- Mamtani A, Barrio AV, King TA, et al. How often does neoadjuvant chemotherapy avoid axillary dissection in patients with histologically confirmed nodal metastases? Results of a prospective study. Ann Surg Oncol. 2016;23(11):3467−3474. doi:10.1245/s10434-016-5246-8.
- Boughey JC, Suman VJ, Mittendorf EA. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. 2013;310(14):1455−1461. doi:10.1001/jama.2013.278932.
- Kuehn T, Bauerfeind I, Fehm T, et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol. 2013;(14):609−618. doi: 10.1016/S1470-2045(13)70166-9.
- Moo TA, Edelweiss M, Set H, et al. Is low-volume disease in the sentinel node after neoadjuvant chemotherapy an indication for axillary dissection? Ann Surg Oncol. 2018;(25):1488–1494. doi:10.1245/s10434-018-6429-2.
- Al-Hilli Z, Hoskin TL, Day CN, et al. Impact of neoadjuvant chemotherapy on nodal disease and nodal surgery by tumor subtype. Ann Surg Oncol. 2018;25(2):482−493. doi:10.1245/s10434-017-6263-y.
- van la Parra R, Kuerer HM. Selective elimination of breast cancer surgery in exceptional responders: historical perspective and current trials. Breast Cancer Research 2016;18(1):28. doi:10.1186/s13058-016-0684-6.
- Gentile LF, Plitas G, Zabor EC, et al. Tumor biology predicts pathologic complete response to neoadjuvant chemotherapy in patients presenting with locally advanced breast cancer. Breast Cancer Ann Surg Oncol. 2017;24(13):3896−3902. doi:10.1245/s10434-017-6085-y.
- Coufal O, Fait V a kol. Chirurgická léčba karcinomu prsu. 1 vydání, Praha, Grada 2011.
- Fisher ER, Wang J, Bryant J, et al. Pathobiology of preoperative chemotherapy: findings from the National Surgical Adjuvant Breast and Bowel (NSABP) protocol B-18. Cancer 2002;(15):681−695. doi:10.1002/cncr.10741.
- Akay CL, Meric-Bernstam F, Hunt KK, et al Evaluation of the MD Anderson Prognostic Index for local-regional recurrence after breast conserving therapy in patients receiving neoadjuvant chemotherapy. Ann Surg Oncol. 2012;(19):901−917. doi:10.1245/s10434-011-200.
- Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triplenegative breast cancer. J Clin Oncol. 2008;26(8):1275−1281. doi:10.1200/JCO.2007.14.4147.
- Gianni L, Pienkowski T, Im YH, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012;13(1):25−32. doi:10.1016/S1470-2045(11)70336-9.
- Baron P, Beitsch P, Boselli D, et al. Impact of tumor size on probability of pathologic complete response after neoadjuvant chemotherapy. Ann Surg Oncol. 2016;23(5):1522−1529. doi:10.1245/s10434-015-5030-1.
- Curigliano G, Burstein HJ, Winer EP, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol. 2017;(28):1700−1712. doi:10.1093/annonc/mdx308.
- Balic M, Thomssen CH, Würstlein R, et al. St. Gallen/Vienna 2019: A brief summary of the consensus discussion on the optimal primary breast cancer treatment. Breast Care 2019;(14):103–110. doi:10.1159/000499931.
- Chen AM, Meric-Bernstam F, Hunt KK, et al Breast conservation after neoadjuvant chemotherapy. Cancer 2005;(103):689−695. doi:10.1002/cncr.20815.
- Ataseven B, Lederer B, Blohmer JU, et al. Impact of multifocal or multicentric disease on surgery and locoregional, distant and overall survival of 6,134 breast cancer patients treated with neoadjuvant chemotherapy. Ann Surg Oncol. 2015;22(4):1118−1127. doi:10.1245/s10434-014-4122-7.
- Woods RW, Camp MS, Durr NJ, et al A review of options for localization of axillary lymph nodes in the treatment of invasive breast cancer. Acad Radiol. 2019;(26):805−819. doi:10.1016/j.acra.2018.07.002.
- Caudle AS, Yang WT, Krishnamurthy S, et al. Improved axillary evaluation following neoadjuvant therapy for patients with node-positive breast cancer using selective evaluation of clipped nodes: Implementation of targeted axillary dissection. J Clin Oncol. 2016;(34):1072−178. doi:10.1200/JCO.2015.64.0094.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2020 Issue 4-
All articles in this issue
- HIPEC
- Current possibilities of minimally invasive therapy of oesophageal diverticula.
- Pseudomyxoma peritonei (PMP) and its therapy – 20 years’ experience of a single surgical department
- Results of surgical treatment of inferior vena cava tumor thrombi in renal cell carcinoma
- Surgical treatment of breast carcinoma after neoadjuvant therapy
- Circulating tumor DNA as a biomarker in metastatic colorectal carcinoma − case report
- The effects and use of negative pressure wound therapy – a set of case reports
- Complicated case of patient with cervical necrotising fasciitis and descending necrotizing mediastinitis − case report
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pseudomyxoma peritonei (PMP) and its therapy – 20 years’ experience of a single surgical department
- The effects and use of negative pressure wound therapy – a set of case reports
- Current possibilities of minimally invasive therapy of oesophageal diverticula.
- Surgical treatment of breast carcinoma after neoadjuvant therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

