-
Medical journals
- Career
Vliv průkazu cirkulujících nádorových buněk na přežívání pacientů s karcinomem pankreatu – pětileté výsledky
Authors: L. Bébarová 1; P. Skalický 1; J. Srovnal 2; A. Prokopová 2; J. Zapletalová 3; M. Hajdúch 2; M. Loveček 1
Authors‘ workplace: I. chirurgická klinika LF Univerzity Palackého a FN Olomouc 1; Ústav molekulární a translační medicíny LF Univerzity Palackého a FN Olomouc 2; Ústav lékařské biofyziky LF Univerzity Palackého a FN Olomouc 3
Published in: Rozhl. Chir., 2018, roč. 97, č. 2, s. 94-98.
Category: Original articles
Overview
Úvod:
Karcinom pankreatu (PDAC) patří mezi nejagresivnější maligní onemocnění. Jeho incidence vykazuje celosvětově vzrůstající tendenci a i přes pokroky ve výzkumu jeho mortalita neklesá. Nepříznivá prognóza tohoto onemocnění je dána mnoha faktory, především pak pozdní diagnostikou. Vzdálené metastázy a peritoneální karcinomatóza jsou způsobeny časnou diseminací nádorových buněk jak hematogenní, tak i lymfogenní cestou. Jedním z faktorů, jejichž podíl na horším přežití pacientů s PDAC je předmětem zkoumání, je přítomnost tzv. cirkulujících nádorových buněk (CTCs). Cílem naší práce bylo především zhodnocení možného vlivu přítomnosti cirkulujících nádorových buněk na přežití pacientů s PDAC.Metoda:
Do studie byli zařazeni pacienti s radikálně a paliativně chirurgicky řešeným PDAC, kteří byli na I. chirurgické klinice LF a FN UP operováni v letech 2008–2012 a byl u nich proveden odběr požadovaných vzorků k vyšetření CTCs. Pro detekci cirkulujících nádorových buněk bylo využito metody real-time RT-PCR. Výsledky byly zpracovány s použitím statistického softwaru SPSS.Výsledky:
Do studie bylo zařazeno celkem 126 pacientů, z toho 88 bylo léčeno radikálně, 38 paliativně. Věkový průměr nemocných byl 63 let u radikálně a 64 let u paliativně operovaných pacientů.
Průměrná doba přežití u radikálně léčených pacientů byla 29,6 měsíce, u paliativně léčených pacientů 8,5 měsíce. Průměrná délka přežití u radikálně léčených pacientů s prokázanou přítomností CTCs byla 27,2 měsíce, bez průkazu CTCs 33,8 měsíce.Závěr:
V rámci naší retrospektivní studie nebyl prokázán statisticky signifikantní vliv přítomnosti cirkulujících nádorových buněk na přežívání našeho souboru radikálně chirurgicky léčených pacientů s PDAC.Klíčová slova:
karcinom pankreatu – cirkulující nádorové buňky − přežitíÚVOD
Karcinom pankreatu (PDAC) patří mezi nejagresivnější maligní onemocnění. Jeho incidence vykazuje celosvětově vzrůstající tendenci a i přes pokroky v diagnostice a léčbě jeho mortalita neklesá [1]. Medián přežití u pacientů po radikálních chirurgických výkonech se pohybuje mezi 14−20 měsíci, u pacientů s lokálně pokročilým či dokonce metastatickým onemocněním jen mezi 4−8 měsíci [2]. Nepříznivá prognóza vyplývá především z pozdní diagnostiky při neexistujícím screeningu, kdy řada symptomů je vyjádřena až v pokročilých stadiích onemocnění. Vzdálené metastázy a peritoneální karcinomatóza jsou způsobeny časnou diseminací nádorových buněk, především hematogenní cestou.
Léčba PDAC je multimodální. Zahrnuje postupy kurativní a paliativní, chirurgické a onkologické. Jedinou potenciálně kurativní metodou je radikální chirurgické odstranění tumoru, tzv. R0 resekce, která je však možná pouze asi u 15−20 % pacientů [3,4,5].
Prognóza pacientů s PDAC se liší v závislosti na vstupním stadiu onemocnění, tedy jeho rozsahu, a způsobu léčby. Pacienti s lokálně pokročilým a především pacienti s generalizovaným onemocněním mají výrazně horší prognózu než pacienti s radikálně odstranitelnými tumory [6,7].
Jedním z faktorů ovlivňujících prognózu pacientů s nádorovým onemocněním ve smyslu jejího zhoršení může být přítomnost tzv. cirkulujících nádorových buněk (CTCs). Jedná se o buňky solidních tumorů cirkulující v periferní krvi, do které pronikají v rámci tumorem indukované angiogeneze. Časný hematogenní rozsev nádorových buněk je pak podkladem pro pozdější vznik vzdálených metastáz, které představují nejčastější příčinu úmrtí na maligní onemocnění [8,9,10]. Podíl CTCs v periferní krvi je extrémně nízký, pohybuje se kolem 1 nádorové buňky na 106 až 107 všech krevních buněk. Standardní zobrazovací, biochemické, cytogenetické a imunologické metody nejsou schopny detekovat CTCs s dostatečnou citlivostí. Až rozvoj nových detekčních metod umožnil zvýšit senzitivitu této diagnostiky a detekovat až 1 nádorovou buňku mezi 1 až 10 miliony buňkami nenádorovými. V současnosti se k detekci cirkulujících nádorových buněk používají metody imunohistochemické a molekulárně genetické. Imunohistochemické metody spočívají v detekci nádorových buněk prostřednictvím protilátek, které se váží na specifické antigeny exprimované na povrchu cirkulujících nádorových buněk. Výhodnější je proto využití molekulárně genetických metod, zejména polymerázové řetězové reakce (polymerase chain reaction, PCR), která umožňuje detekovat cirkulující nádorové buňky na základě exprese mRNA proteinových biomarkerů specifických pro danou nádorovou populaci. Vzhledem k absenci tumor specifické mRNA je často využívána detekce mRNA specifické pro epiteliální buňky. Tyto transkripty se však vyskytují i v krvi zdravých jedinců, proto je nejprve nutné stanovit tzv. cut-off hodnoty, tedy nejvyšší normální hladiny, které představují prahové hodnoty pro detekci CTCs [5,10,11]. Potenciálně vhodnými biomarkery pro detekci CTCs metodou PCR u PDAC se ukázaly být karcinoembryonální antigen (CEA) a lidská telomeráza (h-TERT), jejichž senzitivita umožňuje detekci jedné nádorové buňky mezi až 107 buněk nenádorových [12,13,14]. V časné fázi rozvoje PDAC se lze setkat i se zvýšenou expresí ligandů z rodiny epidermálních růstových faktorů (EGFR) [15].
Význam identifikace CTCs ze vzorku periferní krve spočívá zejména v případném umožnění tzv. tekuté biopsie, tedy stanovení typu a stadia nádorového onemocnění bez nutnosti standardně prováděné invazivní tkáňové biopsie [10,16,17].
Cílem projektu bylo zhodnocení vlivu přítomnosti cirkulujících nádorových buněk na přežívání pacientů s PDAC. Jako vedlejší parametry byly hodnoceny věk, stadium a podání onkologické léčby v obou skupinách.
METODA
Do studie byli zařazeni pacienti s PDAC, kteří byli operováni na I. chirurgické klinice LF a FN UP v letech 2008−2012 a podepsáním informovaného souhlasu umožnili odběr a zpracování materiálů z různých kompartmentů k průkazu CTCs. Pacienti byli rozděleni podle typu výkonu v závislosti na stadiu onemocnění. Do první skupiny byli zařazeni pacienti, kteří podstoupili radikální chirurgický výkon, nejčastěji tedy pravostrannou duodenohemipankreatektomii, případně levostrannou pankreatektomii se splenektomií či totální pankreatektomii, druhou skupinu tvořili pacienti s lokálně inoperabilním či generalizovaným tumorem, u nichž byl proveden pouze paliativní výkon v podobě biliodigestivní spojky nebo gastroenteroanastomózy. Diagnóza karcinomu pankreatu byla u radikálně operovaných pacientů stanovena z resekátu tumoru, u paliativně operovaných pacientů z biopsie tumoru či z jaterní nebo uzlinové metastázy. U nemocných podstoupivších radikální resekční výkon byly k vyšetření odeslány vzorky kostní dřeně, peritoneální laváže, periferní krve, portální krve a vzorky tumoru, u nemocných s neradikálním výkonem pak vzorky kostní dřeně, peritoneální laváže a periferní krve. U všech nemocných byla zpracována následující data: věk pacienta v době operace, stadium onemocnění vstupně, délka přežití a průkaz přítomnosti cirkulujících nádorových buněk.
Vzorky byly vyšetřeny v Ústavu molekulární a translační medicíny (ÚMTM). Pro detekci cirkulujících nádorových buněk bylo využito metody real-time RT-PCR za využití karcinoembryonálního antigenu (CEA), receptoru pro epidermální růstový faktor EGFR a lidské telomerázy (hTERT), pro něž byly prospektivně stanoveny cut-off hodnoty v krvi a kostní dřeni (Tab. 1). Za průkaz přítomnosti CTCs bylo považováno dosažení cut-off hodnoty daného biomarkeru alespoň v jednom z vyšetřených kompartmentů. Výsledky byly statisticky zpracovány s použitím softwaru SPSS (SPSS Inc., Chicago, IL, USA). Vliv vybraných parametrů na přežívání pacientů byl posouzen pomocí Kaplan-Meierovy analýzy a log-rank testu. Soubory pacientů s radikální operací a paliativní léčbou byly porovnány v kategoriálních parametrech pomocí Fisherova přesného testu, k porovnání věku byl použit Studentův t-test dvouvýběrový. Normalita věku byla ověřena pomocí Shapiro-Wilk testu a jako hladina signifikance byla stanovena hodnota 0,05.
Table 1. Cut-off hodnoty markerů v jednotlivých kompartmentech (počet kopií RNA/μg RNA) Tab. 1: Cut-offs of markers in particular compartments (number of RNA/μg RNA copies) 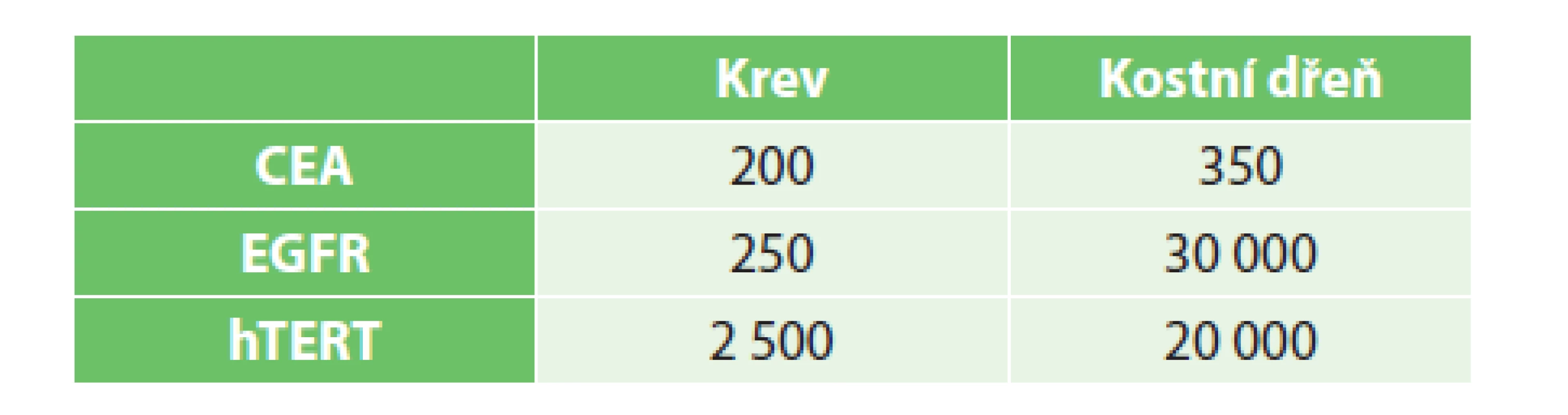
VÝSLEDKY
Do studie bylo zařazeno celkem 126 pacientů (71 mužů, 55 žen), u nichž bylo provedeno vyšetření na přítomnost CTCs, z toho 88 bylo léčeno radikálně, 38 paliativně. Radikální léčbu podstoupili převážně pacienti ve stadiu I a II dle UICC, paliativní převážně pacienti ve stadiu III a IV. Věkový průměr i medián nemocných byl 64 let u obou skupin pacientů. Průměrná délka přežití u radikálně léčených pacientů byla 29,6 měsíce a medián 17,6 měsíce. U paliativně léčených pacientů byla průměrná délka přežití 8,5 měsíce a medián 5,1 měsíce.
Ve skupině radikálně operovaných pacientů, u nichž byl odebrán biologický materiál k vyšetření CTCs, byly tyto prokázány u 70 pacientů (79,5 %), u 18 pacientů (20,5 %) přítomnost CTCs prokázána nebyla. Ve skupině paliativně operovaných pacientů, u nichž byl proveden odběr materiálu k vyšetření CTCs, byly tyto prokázány u 34 pacientů (89,5 %), u 4 pacientů (10,5 %) přítomnost CTCs prokázána nebyla.
Průměrná délka přežití u radikálně operovaných pacientů s prokázanými CTCs byla 27,2 měsíce a medián 16,9 měsíce. Průměrná délka přežití u radikálně operovaných pacientů bez průkazu CTCs byla 33,8 měsíce a medián 21,2 měsíce. Nebyl tedy prokázán statisticky signifikantní rozdíl v průměrné délce přežití u radikálně operovaných pacientů v závislosti na průkazu přítomnosti CTCs (p=0,137)(Graf 1). Vliv průkazu CTCs na přežívání paliativně chirurgicky léčených pacientů nebylo možno hodnotit vzhledem k malému počtu nemocných bez průkazu CTCs.
Graph 1. Přežívání radikálně operovaných pacientů v závislosti na průkazu CTCs Graph 1: The survival of radically treated patients depending on CTCs evidence 
Z vedlejších hodnocených parametrů bylo dle předpokladů prokázáno signifikantně vyšší přežívání ve skupině radikálně řešených pacientů (p=0,0001)(Graf 2). Nebyl prokázán statisticky signifikantní vliv věku na přežívání ani v jedné skupině (radikální p=0,598, paliativní p=0,992). Zároveň nebyl prokázán statisticky signifikantní vliv stadia onemocnění na přežívání paliativně řešených pacientů (p=0,492). Ve skupině radikálně operovaných pacientů bylo prokázáno signifikantně delší přežití pouze u pacientů ve stadiu I ve srovnání s pacienty ve stadiu III a IV (p=0,032)(Graf 3). Dále bylo zjištěno signifikantně delší přežívání u paliativně řešených pacientů s prokázanou přítomností CTCs, jimž byla podána onkologická léčba (p< 0,0001)(Tab. 2, Graf 4). U radikálně řešených pacientů s prokázanou přítomností CTCs signifikantní vliv podání onkologické léčby na přežívání prokázán nebyl (p=0,845).
Table 2. Vliv onkologické léčby na přežívání paliativně řešených pacientů s CTCs Tab. 2: The effect of oncological treatment on the survival of non-radically treated patients with CTCs 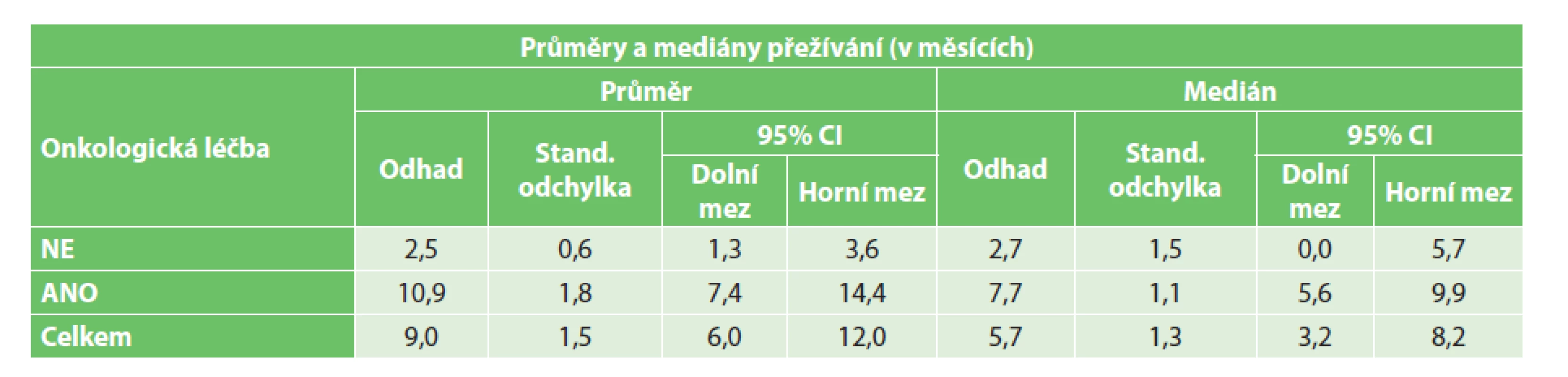
Graph 2. Přežívání pacientů s CTCs v závislosti na typu léčby Graph 2. The survival of patients with CTCs depending on treatment modality 
Graph 3. Vliv stadia onemocnění na přežívání radikálně operovaných pacientů s CTCs Graph 3: The effect of staging on the survival of radically treated patients with CTCs 
Graph 4. Vliv onkologické léčby na přežívání paliativně řešených pacientů s CTCs Graph 4: The effect of oncological treatment on the survival of non-radically treated patients with CTCs 
DISKUZE
Přítomnost metastatického postižení je faktorem výrazně zhoršujícím prognózu pacientů s PDAC. Podkladem pro tvorbu vzdálených metastáz je především hematogenní rozsev maligních buněk, tedy přítomnost CTCs. Tyto buňky jsou do krevního oběhu uvolňovány v průběhu nádorem indukované angiogeneze. Vykazují značnou heterogenitu jak u jednotlivých pacientů, tak také v populaci nádorových buněk jednoho pacienta, a také různou míru viability. Mnohé z nich nadále podléhají apoptóze a recentní studie dokazují, že pouze asi 2,5 % těchto buněk může způsobovat tvorbu mikrometastáz a pouze 0,01 % může být podkladem pro tvorbu makrometastáz. Kromě toho přítomnost CTCs úplně nekoreluje s výskytem vzdálených metastáz a neexistuje jediný stoprocentně spolehlivý biomarker [17,24]. Význam detekce CTCs v periferní krvi u PDAC není zcela probádán, různé studie však prokázaly úzkou souvislost mezi přítomností CTCs a horší prognózou pacientů s PDAC [22,23].
K průkazu přítomnosti CTCs v periferní krvi je používána řada imunohistochemických a molekulárně genetických metod, jejichž cílem je izolace řídce se vyskytujících maligních buněk od množství buněk zdravých. K detekci CTCs u PDAC se v současné době používá řada molekul, jejichž exprese souvisí s rozvojem PDAC [12,13,14,15].
Cílem projektu bylo zhodnocení vlivu přítomnosti cirkulujících nádorových buněk na přežívání pacientů s PDAC. Předpokladem je výše uvedená hypotéza, že přítomnost CTCs u PDAC je podkladem pro tvorbu vzdálených metastáz, respektive generalizaci onemocnění. Jelikož pacienti s generalizovaným PDAC mají kratší přežívání než pacienti bez generalizace, měla by rovněž přítomnost CTCs zkracovat délku přežití pacientů s PDAC.
Ačkoliv v naší studii bylo prokázáno kratší přežívání u pacientů s prokázanou přítomností CTCs oproti pacientům bez průkazu CTCs, nebyl tento výsledek statisticky signifikantní. Recentní studie dokazují, že vysoká heterogenita CTCs u PDAC a jejich velmi nízký podíl v periferní krvi je příčinou nízké senzitivity detekce CTCs. Naopak specificita CTCs je vysoká [17]. V našem souboru bylo 70 radikálně operovaných pacientů, u nichž byla prokázána přítomnost CTCs, aniž by u nich byla prokázána generalizace onemocnění, naproti tomu ve skupině 38 paliativně operovaných pacientů byli pouze 3 pacienti s generalizovaným onemocněním, u nichž CTCs prokázány nebyly. Můžeme tedy říci, že s využitím dané metodiky se nám nepodařilo dosáhnout dostatečné senzitivity, abychom mohli s jistotou určit, že přítomnost CTCs úzce souvisí s generalizací onemocnění a tím i horší prognózou pacientů s PDAC.
Signifikantně delší přežívání paliativně operovaných pacientů s prokázanou přítomností CTCs, jimž byla podána onkologická léčba, nejspíše nemá přímou souvislost s přítomností CTCs, jelikož delší přežívání těchto pacientů bylo prokázáno v naší dřívější práci i bez ohledu na průkaz CTCs [18].
V posledních letech je snaha využít detekce CTCs jako prognostického faktoru u řady solidních nádorů, například gastrointestinálních stromálních nádorů, kolorektálního karcinomu, karcinomu prsu, ale též karcinomu pankreatu [19].
Negativní vliv přítomnosti okultních nádorových buněk na prognózu pacientů s PDAC již byl prokázán. Jednalo se však o detekci buněk v peritoneální laváži, tedy za okolností, kdy u pacienta byl indikován chirurgický výkon. Za této situace již samozřejmě není možno změnit algoritmus léčby a přítomnost CTCs slouží jen jako samostatný prognostický, nikoli však už léčbu determinující faktor [20,21].
Pokud by bylo možno dosáhnout dostatečně vysoké senzitivity detekce CTCs v periferní krvi, bylo by možno tuto metodu využít především jako tzv. tekutou biopsii, která by mohla nahradit současné invazivní metody odběru nádorové tkáně. Metodu by bylo možno použít jednak k časnému záchytu PDAC u rizikových skupin pacientů, jednak ke stanovení optimálního algoritmu léčby a jejímu monitorování u pacientů s již prokázaným PDAC [16,24].
ZÁVĚR
V rámci naší retrospektivní studie nebyl prokázán statisticky významný vliv přítomnosti cirkulujících nádorových buněk na přežívání radikálně chirurgicky léčených pacientů s PDAC.
Výrazná heterogenita CTCs u PDAC a chybějící stoprocentně specifický biomarker k jejich detekci v současné době znemožňují spolehlivý průkaz CTCs v periferní krvi.
Práce byla podpořena grantem TACR TE02000058, NPU LO1304, IGA UP LF_2017_013 a IGA UP LF_2014_030
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Linda Bébarová
Studentská 27
796 01 Prostějov
e-mail: linda.bebarova@fnol.cz
Sources
1. Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, et al. Cancer incidence and mortality patterns in Europe. Estimates for 40 countries in 2012. European Journal of Cancer 2013;49 : 1374−1403.
2. Bachmann J, Michalski ChW, Martignoni ME, et al. Pancreatic resection for pancreatic cancer. HPB (Oxford) 2006;8 : 346–51.
3. Neoptolemos JP, Urrutia R, Abbruzzese JL, et al. Pancreatic cancer. Springer Science+Business Media LLC 2010. Available from: DOI 10.1007/978-0-387-77498-5.
4. Ducreux M, Cuhna A, Caramella C, et al. Cancer of the pankreas: ESMO Clinical practice guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2015;26 : 56−68.
5. Klos D, Lovecek M, Srovnal J, et al. Possibility of using the determination of minimal residual disease in pancreatic adenocarcinoma using real-time RT-PCR – a pilot study. Cas Lek Cesk 2010;149 : 69−73.
6. Berger HG, Rau B, Gansauge F, et al. Pancreatic cancer – low survival rates. Dtsch Arztebl Int 2008;105 : 255–62.
7. Lovecek M, Skalicky P, Klos D, et al. Long-term survival after resections for pancreatic ductal adenocarcinoma. Single centre study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016;160 : 280−6.
8. Wolfrum F, Vogel I, Fandrich F, et al. Detection and clinical implications of minimal residual disease in gastro-intestinal cancer. Langenbeck´s Archives of Surgery 2005;390 : 430−41.
9. Pantel K, Brakenhoff RH, Brandt B. Detection, clinical relevance and specific biological properties of disseminating tumour cells. Nature Reviews Cancer 2008;8 : 329−40.
10. Nagrath S, Jack RM, Sahai V, et al. Opportunities and challenges for pancreatic circulating tumor cells. Gastroenterology 2016;151 : 412−26.
11. Xie ZB, Yao L, Jin C, et al. Circulating tumor cells in pancreatic cancer patients: efficacy in diagnosis and value in prognosis. Discov Med 2016;22 : 121−8.
12. Zhou J, Hu L, Yu Z, et al. Marker expression in circulating cancer cells of pancreatic cancer patients. J Surg Res. 2011;171 : 631−6.
13. Uchikura K, Takao S, Nakajo A, et al. Intraoperative molecular detection of circulating tumor cells by reverse transcription-polymerase chain reaction in patients with biliary-pancreatic cancer is associated with hematogenous metastasis. Ann Surg Oncol 2002;9 : 364−70.
14. Mataki Y, Takao S, Maemura K, et al. Carcinoembryonic antigen messenger RNA expression using nested reverse transcription-PCR in the peripheral blood during follow-up period of patients who underwent curative surgery for biliary-pancreatic cancer: longitudinal analyse. Clin Cancer Res 2004;10 : 3807−14.
15. Bhat K, Wang F, Ma Q, et al. Advances in biomarker research for pancreatic cancer. Curr Pharm Des 2012;18 : 2439−51.
16. Tjensvoli K, Nordgard O, Smaaland R. Circulating tumor cells in pancreatic cancer patients: Methods of detection and clinical implications. Int J Cancer 2013;134 : 1−8.
17. Court CM, Ankety JS, Hou S, et al. Improving pancreatic cancer diagnosis using circulating tumor cells: prospects for staging and single-cell analysis. Expert Rev Mol Diagn 2015;15 : 1491−1504.
18. Bébarová L, Skalický P, Klos D, et al. Přežívání pacientů s radikálně neresekabilním karcinomem pankreatu. Rozhl Chir 2016;95 : 222−6.
19. Kiele P, Koch M. Minimal residual disease in gastrointestinal cancer. Semin. Surg Oncol 2001;20 : 282–93.
20. Havlík R, Srovnal J, Klos D, et al. Occult tumour cells in peritoneal lavage are a negative prognostic factor in pancreatic cancer. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013;157 : 233−8.
21. Vogel I, Krüger U, Marxsen J, et al. Disseminated tumor cells in pancreatic cancer patients detected by immunocytology: a new prognostic factor. Clin Cancer Res 1999;5 : 593−9.
22. Bidard FC, Huguet F, Louvry C, et al. Circulating tumor cells in locally advanced pancreatic adenocarcinoma: the ancillary CirCe 07 study to the Lap 07 trial. Ann Oncol 2013;24 : 2057−61.
23. Albuquerque A, Kubisch I, Breier G, et al. Multimarker gene analysis of circulating tumor cells in pancreatic cancer patients: a feasibility study. Oncology 2012;82 : 3−10.
24. Herreros-Villanueva M, Bujanda L. Non-invasine biomarkers in pancreatic cancer diagnosis: What we need versus what we have. Ann Transl Med 2016;4 : 134−41.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2018 Issue 2-
All articles in this issue
- Klasifikace zlomenin zadní hrany tibie u zlomenin hlezna
- Zlomeniny báze 5. metatarzu
- Anatomie zlomenin dolního úhlu lopatky
- Kvalita operačnej liečby nefrolitiázy: čo na ňu vplýva?
- Naše zkušenosti s levostranným retroperitoneálním přístupem při řešení výdutí břišní aorty
- Vliv průkazu cirkulujících nádorových buněk na přežívání pacientů s karcinomem pankreatu – pětileté výsledky
- Klasifikace zlomenin těla lopatky
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zlomeniny báze 5. metatarzu
- Klasifikace zlomenin zadní hrany tibie u zlomenin hlezna
- Klasifikace zlomenin těla lopatky
- Anatomie zlomenin dolního úhlu lopatky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

