-
Medical journals
- Career
Časné chirurgické a cévní komplikace po resekcích aneuryzmat aortoilické oblasti
Authors: M. Pirkl 1,2; F. Krampota 1; T. Daněk 1; Michal Černý 1
Authors‘ workplace: Oddělení cévní a plastické chirurgie, Chirurgická klinika, Pardubická nemocnice, NPK, a. s. 1; Fakulta zdravotnických studií, Univerzita Pardubice 2
Published in: Rozhl. Chir., 2018, roč. 97, č. 11, s. 499-503.
Category: Original articles
Overview
Úvod:
Operační zákroky pro aneuryzma aortoilického povodí (dále AAA) se řadí mezi velké výkony běžné cévní chirurgie. A to mimo jiné i z důvodu relativně častých systémových a chirurgických komplikací u mnohdy polymorbidních pacientů. Tyto komplikace po resekcích aortoilických výdutí jsou poměrně časté a vynucené reintervence se literárně pohybují kolem 14 %.
Metoda:
Ve své práci jsme retrospektivně hodnotili soubor pacientů operačně řešených pro aneuryzma aortoilické oblasti v období 1. 1. 2010 až 31. 12. 2017 na Oddělení cévní a plastické chirurgie Pardubické nemocnice NPK, a. s.
Výsledky:
V souboru 240 operovaných pacientů (205 mužů, 35 žen) jsme sledovali letalitu, která dosáhla celkově 10,4 %, přičemž u elektivních výkonů činila 3,4 % a u urgentních výkonů pak 31,1 % (u ruptur aneuryzmatu 37,5 %). V elektivní skupině jsme zaznamenali celkem 29 (16,2 %) chirurgických a/nebo cévně-chirurgických komplikací s nutností 16 (8,9 %) chirurgických, endovazálních nebo kombinovaných intervencí. Ve skupině urgencí pak tyto komplikace byly zaznamenány 30x (49 %) s nutností intervence v 19 případech (31,1 % urgentních výkonů).
Závěr:
Chirurgické resekční výkony na aortoilických aneuryzmatech jsou zatíženy vysokou četností výskytu systémových, chirurgických nebo cévně-chirurgických komplikací. Tito pacienti proto vyžadují vysokou pozornost a kvalitu perioperační péče se zaměřením na včasnou diagnostiku a následnou terapii těchto komplikací.
Klíčová slova:
aneuryzma aorty − chirurgické komplikace – krvácení − končetinová ischemie − břišní compartment syndrom
Úvod
Prevalence aortoilického aneuryzmatu v populaci je 5 % u mužů starších 60 let s rostoucí četností s přibývajícím věkem, u žen je výskyt 5x nižší. Základním parametrem hodnocení je rozměr a lokalizace postižení aorty a pánevních tepen. K chirurgické či endovaskulární léčbě jsou indikovány výdutě dosahující šíře nad 5,5 cm u mužů a 5,0 cm u žen vzhledem k vzrůstajícímu riziku ruptury. Taktéž jsou k léčbě indikována aneuryzmata s rychlým růstem (více než 5 mm za půl roku). Dalším indikačním kritériem je symptomatologie výdutě [1].
Operační výkony pro AAA se řadí mezi velké cévní operace. A to mimo jiné i z důvodu relativně častých komplikací systémových a chirurgických u polymorbidních a často urgentně operovaných pacientů. Četnost vynucených reintervencí z důvodu chirurgických a cévních komplikací se literárně pohybuje kolem 14 % [2]. V souboru pro potřeby našeho sdělení jsme sledovali časné komplikace (ve 30denním pooperačním období), i když z chirurgického hlediska jsou zajímavé a důležité i pozdní komplikace, jako jsou především incizionální hernie a případné infekty protetických náhrad.
Cílem práce není porovnávat výsledky a četnosti komplikací mezi endovaskulárními intervencemi pro aneuryzmata aortoilické oblasti (EVAR) a otevřeným chirurgickým přístupem (OR), poněvadž počty prováděných endovaskulárních intervencí pro AAA jsou na našem pracovišti nízké.
V diskuzi uvádíme pouze pro ucelení informací a pro srovnání některá data známá z problematiky EVAR.
Metoda
Retrospektivně jsme analyzovali pacienty operované na Oddělení cévní a plastické chirurgie Pardubické nemocnice, NPK, a. s., v období od 1. 1. 2010 do 31. 12. 2017 pro diagnózu aneuryzmatu abdominální aorty (AAA) nebo pánevních tepen (AAI). Zaměřili jsme se především na výskyt časných (tedy v 30denním intervalu od operace) cévních a chirurgických komplikací a letalitu po elektivních i urgentních otevřených operačních výkonech (OR) pro AAA nebo AAI. Z hodnocení našeho souboru byli vyloučeni nemocní, kteří při urgentním stavu (ruptura výdutě) a celkově infaustní prognóze nebyli operováni (celkem za sledované období 3 nemocní) a nemocní, kteří byli indikováni primárně ke stentgraftu (EVAR) – celkem se jednalo o 7 pacientů. Všichni pacienti s AAA nebo AAI, kteří byli operováni, byli retrospektivně dosledováni pomocí dat v NIS (nemocniční informační systém) v horizontu sledovaného období 30 dnů po operaci.
Soubor
Ve sledovaném období jsme na Oddělení cévní a plastické chirurgie Pardubické nemocnice, NPK, a. s, provedli celkem 240 operací (OR) pro AAA a/nebo AAI. V souboru dominovali muži – 205, proti 35 ženám.
Průměrný věk v našem souboru činil 72,9 roku (muži 72,3, ženy 75,9), medián 67,4 roku (20–91 let). Elektivně jsme realizovali 179 operací a urgentně 61 (z toho 48x pro rupturu) výkonů. Jako přidružený primární vaskulární výkon jsme třikrát přistoupili k replantaci dolní mezenterické tepny (AMI) a jedenkrát jsme replantovali levostrannou renální tepnu.
Výsledky
Smrtnost v našem souboru činila 10,4 % celkově (25 případů). U elektivních výkonů činila letalita 3,4 % (6 případů). U urgentních výkonů to přitom bylo 31,1 % (19 pacientů), přičemž u ruptur AAA nebo AAI jsme časné úmrtí zaznamenali celkem v 18 případech (smrtnost 37,5 % u rAAA, rAAI) a z toho pětkrát mors in tabula (10,4 % rAAA, rAAI).
Chirurgické, cévní a cévně-chirurgické komplikace (dále již jen komplikace) jsme zaznamenali celkem 59x, přičemž u elektivních zákroků pak 29x (16,2 % elektivních OR) a u urgencí jsme tyto komplikace zaznamenali 30x (49 % všech urgentních výkonů). Tyto komplikace vedly k pooperační intervenci (chirurgické, endovazální, kombinované…) celkem 35x (14,6 %) – po elektivních výkonech jsme reintervenovali 16x (8,9 % z elektivních OR) a po urgentních výkonech 19x (31,1 % všech urgentních výkonů).
Výskyt výše uvedených komplikací v našem souboru výrazně zhoršoval životní prognózu operovaných nemocných, a to především ve skupině elektivních výkonů. Úmrtí jsme ve skupině elektivních OR s komplikací zaznamenali 5x (z celkových šesti pacientů s komplikacemi) a ve skupině urgencí s komplikací jsme úmrtí zaznamenali celkem 8x.
Doba hospitalizace byla průměrně 11,9 dne (u urgencí 14,9 dne). U elektivních OR bez komplikací byla průměrná doba hospitalizace 10,6 dne, u urgentních OR bez komplikací pak 9,7 dne. Komplikace výrazně prodloužily dobu hospitalizace na 18,3 dne u elektivních OR a na 20,5 dne u urgentních OR. Četnost komplikací u urgentních a elektivních výkonů a jejich vztah k letalitě a délce hospitalizace shrnujeme v Tab. 1.
Table 1. Četnost komplikací a vztah k letalitě a délce hospitalizace u urgentních a elektivních resekcí aortoilických aneuryzmat
Tab. 1: Frequency of complications and their relation to mortality and length of hospitalization for urgent and elective open repairs of aortoiliac aneurysms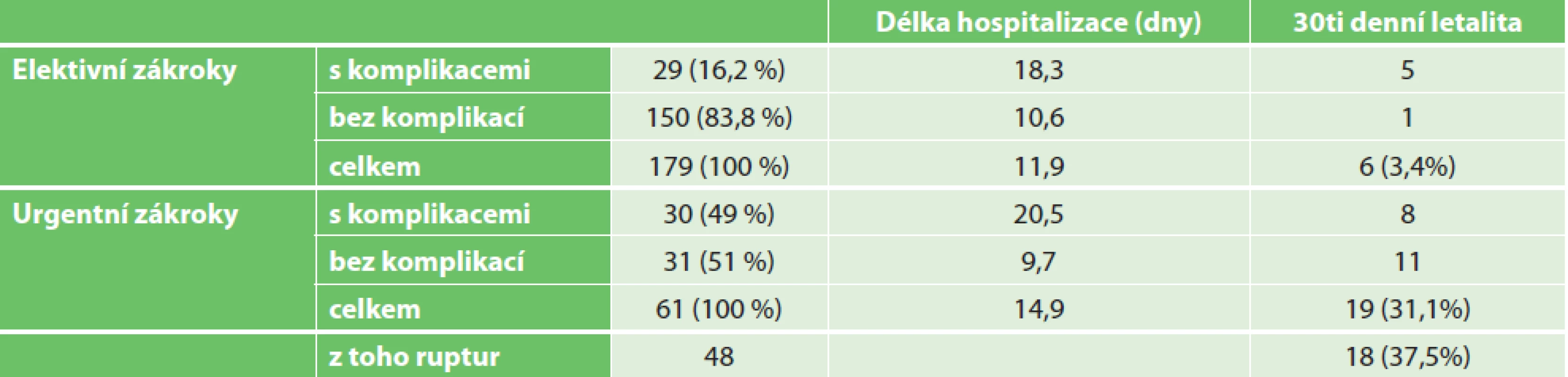
V našem souboru jsme celkem 10x sekundárně řešili krvácivé komplikace (léze horní mezenterické žíly, krvácení z omenta či sleziny, anastomotický leak, retroperitoneální krvácení bez zjevného chirurgického zdroje). Pro tyto komplikace jsme po elektivních OR revidovali 6x (3,4 %) a po urgentních OR 4x (6,6 %).
Akutní ischemii dolních končetin jsme zaznamenali celkem 21x – u elektivních výkonů 10x (5,6 %), u urgentních pak 11x (18 %). Celkem 13x jsme tuto komplikaci diagnostikovali a řešili perioperačně chirurgicky (konverze na bifurkační náhradu, extenze distální anastomózy z pánevních tepen na femorální tepny, embolektomie). Pooperačně jsme akutní končetinovou ischemii intervenovali 4x a celkem 8x jsme pro tuto komplikaci volili endovazální intervenci. Ve čtyřech z výše zmíněných případů jsme postupovali kombinovaně chirurgicky a endovazálně. Důsledkem akutní končetinové ischemie byla 2x vysoká amputace (9,5 % všech těchto příhod, 0,8 % všech operantů), 2x nízká amputace pro blue toe syndrom (mikroembolizace do pedálních a digitálních tepen) a 1x peroneální paréza. Třikrát jsme provedli fasciotomii bércových compartmentů.
Abdominální compartment syndrom nebo ischemii colon jsme zaznamenali celkem 8x (3,3 %), z toho u elektivních OR 3x (1,7 %), u urgencí pak 5x (8,2 %). Řešení této komplikace shrnujeme v Tab. 2.
Table 2. Typy chirurgických zákroků při revizi pro břišní compartment syndrom
Tab. 2: The types of surgical procedures due to abdominal compartment syndrome
Z dalších komplikací chirurgického typu je pak nutno uvést 1x akutní cholecystitidu, 1x disekci hrudní aorty typu B, 3x eventraci a 2x ileus z adhezí. Jako ne zcela chirurgickou, ale obecně aktuálně diskutovanou komplikaci je nutno zmínit i 8x zachycenou clostridiovou kolitidu – řešenou vždy konzervativně.
Diskuze
Evropské registry uvádějí ve výsledcích EVAR a OR veliké rozdíly v letalitě a morbiditě mezi jednotlivými zeměmi Evropské unie – v dánských registrech je souhrnná letalita OR 3,3 % a v britských 4,8 % u elektivních výkonů [3]. Ale i v rámci jednotlivých zemí jsou významné rozdíly mezi zdravotnickými zařízeními (high a low volume centra). Například kolektiv autorů (Trenner et al.) v Německu prezentuje rozdíly mezi low volume a high volume pracovišti v letalitě elektivních i urgentních výkonů pro aneuryzma aortoilického úseku (7,6 % vs. 4,5 % u OR, resp. 52 % vs. 39 % u OR) [4].
Krvácivé komplikace se po OR pohybují kolem 1,2 % procenta u elektivních výkonů, u ruptur pak mezi 12 % a 14 % (ve srovnání se 7–10 % po EVAR) [5,6]. Příčina krvácivých komplikací může být na straně operatéra. Jsou nicméně akcentovány u urgentních výkonů u pacientů mnohdy v kritickém stavu. Při hemorrhagickém šoku a centralizovaném oběhu nemusí být zdroj krvácení na konci operačního zákroku patrný. Teprve po stabilizaci nemocného v pooperačním období může pak dojít k rozkrvácení v operačním poli. Stejně tak šokový stav narušuje schopnost hemostázy organismu, která se považuje za první cílový „orgán“ šoku. Tyto komplikace zpravidla vedou k operační revizi s vyhledáním a ošetřením zdroje krvácení.
Ischemie dolních končetin je u výkonů na aneuryzmatech častěji vyjádřená než u ostatních cévních výkonů v této oblasti z důvodu typické přítomnosti detritu a trombu ve vaku výdutí. Manipulace s AAA včetně naložení a uvolnění aortální svorky mohou vést k embolizaci těchto hmot do periferní cirkulace. Incidence této komplikace po OR se pohybuje mezi 0,6–5 % [7]. V počátcích EVAR ischemie dolních končetin byly popisovány u 4–17 % případů [8]. Ale s dalším vývojem technik a instrumentária pro EVAR se v některých novějších pracích udává incidence pouze kolem 0,9 % [9]. Mikroembolizace jsou mnohem častější než masivní tromboembolie [7]. U ruptur AAA nebo AAI je po OR incidence ischemie dolních končetin kolem 5 %. Vyšší četnost této ischemické komplikace u ruptur výdutí nejspíše souvisí s nutností naložení aortální svorky bez systémové heparinizace. Pokud je vyjádřena významná ischemie dolní končetiny po výkonu na aneuryzmatu aortoilické oblasti, je riziko amputace 13−20 % [6].
Střevní ischemie a neokluzivní střevní ischemie (NOIC) představují potenciálně fatální komplikaci výkonů na AAA. Mezi rizikové faktory NOIC patří ruptura AAA, koagulopatie a peroperační arteriální hypotenze, přičemž v případě přítomnosti jednoho z těchto faktorů je pravděpodobnost vzniku NOIC 10 % a za přítomnosti dvou, resp. tří stoupá predikce na 50 %, resp. 90 % [10]. Nepochybně existují i další stavy a klinické situace, kdy lze rozvoj NOIC předpokládat s vyšší pravděpodobností. Stále se hojně diskutuje otázka replantace dolní mezenterické tepny (AMI) do cévní protézy. Dnes se většina odborné veřejnosti shoduje, že vzhledem k bohatému kolaterálnímu tepennému zásobení levé poloviny tlustého střeva (Drummondova a Riolanova anastomóza) je pro cévní zásobení dostačující průchodné povodí horní mezenterické tepny (AMS) a vnitřních ilických tepen (AII) – především levé. AMI se proto doporučuje reimplantovat do cévní protézy v případě exkluze vnitřních ilických tepen, jako je tomu především u aortálních aneuryzmat typu Eurostar D. Nutnost suprarenálního naložení aortální svorky (iuxta-, resp. suprarenální aneuryzmata) rovněž zvyšuje pravděpodobnost rozvoje ischemie splanchniku. Hypoperfuze colon postihuje v první řadě mukózu, která je koncovým kapilárním povodím tepenného zásobení. Při další progresi nebo při razantnějším hypoperfuzním inzultu se ischemické změny posouvají směrem k větším cévám – tedy do submukózy a serózy střeva. Incidence této komplikace je také závislá na typu operace – po aortobifemorálních náhradách dosahuje až 22 %, po aortoaortálních 4 % a po aortobilických 2,7 % [6].
Neokluzivní ischemii colon (NOIC) dělíme na tři stupně. První stupeň je definován jako mukózní ischemie, která má transientní charakter a zpravidla mírný průběh. Stupeň druhý je definován jako ischemie mukózní a muskulární a podle klinického průběhu se dělí na další dva podstupně – s, nebo bez multiorgánového selhávání (MODS). Stupeň třetí je charakterizován jako transmurální ischemie s gangrénou, až perforací trávicí trubice a je vždy doprovázen rozvojem MODS [11]. První a druhý stupeň bez MODS se doporučuje léčit konzervativně za dodržení obecně platných postupů léčby šoku a ochrany colon včetně plné parenterální výživy. Vyšší dva stupně s MODS je nutno bezprostředně po stanovení diagnózy NOIC řešit operačně – tedy resekcí ischemického úseku colon (většinou levostrannou hemikolektomií s terminální transverzostomií nebo subtotální kolektomií s terminální ileostomií) podle rozsahu gangrenózních změn. U chirurgické léčby je jednou ze zásad ponechání co nejkratšího distálního pahýlu rekta k prevenci jeho ischemické dehiscence. Primární střevní anastomóza se z této indikace po resekčních výkonech zásadně nedoporučuje. Progrese ischemie ponechaného střeva však není nikdy zcela vyloučena [11]. Menegaux et al. v prospektivní studii zachytili NOIC po 1786 resekcích AAA ve 49 případech (2,7 %), z nichž 24 bylo zprvu diagnostikováno jako první nebo druhý stupeň bez MODS, a tedy léčeno podle výše uvedených doporučení konzervativně. U tří čtvrtin nemocných z této skupiny (18 pacientů) ischemie colon progredovala a vyžádala si dodatečnou resekci trávicí trubice. V konzervativně léčené skupině s nulovou letalitou zůstalo nakonec pouhých 6 pacientů (12,2 %), kdežto 43 nemocných (87,8 %) bylo nutno operovat (ať už primárně, nebo v dalším průběhu). Letalita nemocných s druhým stupněm s MODS byla 37,5 % a u nemocných s třetím stupněm NOIC pak 57,1 % [12].
Incidence břišního compartment syndromu (ACS) po OR pro rAAA se pohybuje kolem 20 %. Letalita u nemocných po rAAA s rozvojem ACS je 5x vyšší než ve skupině bez ACS [13].
ACS je definován vzestupem nitrobřišního tlaku (IAP) nad 20 mmHg se současně vyjádřenou orgánovou dysfunkcí nebo IAP větší než 25 mmHg bez orgánové dysfunkce [14]. Rizikové faktory pro vznik ACS jsou: hemoperitoneum a retroperitoneální hematom, masivní tekutinová resuscitace (nad 5 l/24 hod.), velký počet transfuzí (víc než 10 jednotek/24 hod.), koagulopatie (trombocyty pod 55x109/l, dvojnásobná délka aPTT, INR více než 1,5), hypotermie (pod 33 °C), acidóza (pH méně než 7,2), dlouhý čas svorky, délka operačního výkonu [15].
Pokud je indikována dekompresní laparostomie pro ACS, pak letalita dosahuje až 56 % ve srovnání s 9 % u primárních uzávěrů břišní stěny. Primární indikací k open-abdomen postupu jsou: hladina hemoglobinu nižší než 100 g/l, předoperační kardiální zástava, systolický krevní tlak pod 90 torr po dobu delší než 18 minut, potřeba parenterálního přísunu tekutin nad 3,5 l/hod. operace, tělesná teplota pod 33 °C, base-deficit pod 13 mmol/l [15]. Pokud je výkon na rAAA v indikovaných případech ukončen primárně formou open-abdomen, pak tito nemocní oproti dekompresním laparostomiím při ACS mají nižší mortalitu (51 % vs. 70 %) a nižší incidenci multiorgánového selhání (MOF) (11 % vs. 70 %) [16]. Obavy z pozdního infektu protetického materiálu nejsou u open-abdomen nejspíše opodstatněné [17].
Závěr
Kromě obecně známé vysoké kardiovaskulární komorbidity cévně-chirurgických pacientů, která je právě akcentována mnohdy u pacientů s aneuryzmatem aortoilického povodí, předkládáme širší chirurgické veřejnosti i problematiku specifických chirurgických, resp. cévně-chirurgických komplikací. Tak jako ve viscerální nebo úrazové chirurgii péče o pacienta nekončí úspěšně provedenou operací, stejně tak (a možná ve větší míře) operací nekončí péče o pacienta s AAA nebo AAI. Bez větší nadsázky lze tvrdit, že operací teprve vše začíná.
Naše sdělení si nekladlo za cíl pojednávat o neméně významné problematice systémových komplikací u nemocných po operacích aortoilického aneuryzmatu. Taktéž jsme si nekladli za cíl diskutovat nebo obšírněji rozebírat problematiku EVAR, která má v dnešní době své nezastupitelné místo. Nízké počty těchto výkonů v českých podmínkách souvisejí s finančními limity i s dosud omezeným přístupem cévních chirurgů k této metodice.
Seznam zkratek
AAA – aneuryzma břišní aorty
AAI – aneuryzma pánevních tepen
ABI – index poměrů tlaků ankle/brachial
ACS – břišní compartment syndrom
AII – vnitřní pánevní tepna
AMI – dolní mezenterická tepna
AMS – horní mezenterická tepna
aPTT – aktivovaný parciální tromboplastinový čas
EVAR – endovaskulární řešení aneuryzmatu
IAH – nitrobřišní hypertenze
IAP – nitrobřišní tlak
INR – protrombinový čas
MODS – multiorgan dysfunction syndrom
MOF – multiorgan failure
NOIC – neokluzivní ischemická kolitida
OR – otevřené chirurgické řešení aneuryzmatu
pH – vodíkový exponent, kyselost
rAAA – rupturované aneuryzma břišní aorty
rAAI – rupturované aneuryzma pánevních tepen
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Miloslav Pirkl
Šafaříkova 682
534 01 Holice
e-mail: miloslav.pirkl@nempk.cz
Sources
- Opatrný V, Třeška V, Moláček J, et al. Gigantické aneuryzma abdominální aorty a pánevních tepen. Rozhl Chir 2016;95 : 123−5.
- Kieffer WKM, Sonnenberg S, Windhaber RA, et al. Complications and reintervention following elective open abdominal aortic aneurysm repair: a 10-year retrospective analysis. Ann R Coll Surg Engl 2012; 94 : 177–80.
- Motte L, Jensen LP, Vogt K, et al. Outcomes after elective aortic aneurysm repair: A nationwide Danish cohort study 2007−2010. Eur J Vasc Endovasc Surg 2013;46 : 57−64.
- Trenner M, Kuehnl A, Salvermoser M, et al. Editor´s choice – High annual hospital volume is associated with decreased in hospital mortality and complication rates following treatment of abdominal aortic aneurysm: Secondary data analysis of the nationwide German DRG statistics from 2005–2013. Eur J Vasc Endovasc Surg 2018;55 : 185−94.
- Woo YE, Damrauer SM. Abdominal aortic aneurysms: Open surgical treatment. In: Cronenwett JL, Johnston KW, et al. Rutherford´s vascular surgery. 8th edition. Elsevier Saunders 2014 : 2025−45.
- Mehta M, Byrne J. Abdominal aortic aneurysms: ruptured. In: Cronenwett JL, Johnston KW, et al. Rutherford´s vascular surgery. 8th edition. Elsevier Saunders 2014 : 2063−82.
- Toursavadkohi S, Stavros Kakkos SK, Rubinfeld I,et al. Lower extremity microembolism in open vs. endovascular abdominal aortic aneurysm repair. Front Surg 2016;3 : 1−5.
- Marin ML, Veith FJ, Cynamon J, et al. Initial experience with transluminally placed endovascular grafts for the treatment of complex vascular lesions. Ann Surg 1995,222 : 449–69.
- Maldonado TS, Rockman C, Riles TS. Ischemic complications after endo-vascular abdominal aortic aneurysm repair. J Vasc Surg 2004;40 : 703–9.
- Gerhart CD, Nicholas GG, Reed JF. Predictive model for colonic ischemia following abdominal aortic aneurysm repair. Vasc Endovas Surg 1994;28 : 161–6.
- Pirkl M, Daněk T, Šebesta P, et al. Neokluzivní ischemická kolitida po resekci aneuryzmatu abdominální aorty: zkušenosti z našeho pracoviště a shrnutí problematiky. Slov chir 2012;9 : 102–10.
- Menegaux F, Trésallet Ch, Kieffer E, et al. Aggressive management of nonocclusive ischemic colitis following aortic aeconstruction. Arch Surg 2006;141 : 678–82.
- Bozeman MC, B. Ross CB. Intra-abdominal hypertension and abdominal compartment syndrome in association with ruptured abdominal aortic aneurysm in the endovascular era: Vigilance remains critical. Crit Care Res Pract 2012. Available from: doi:10.1155/2012/151650
- WSACS Consensus Guidelines Summary. Available from: http:/www.wsacs.org.
- Moll FL, Powell JT, Fraedrich G, et al. Management of abdominal aortic aneurysms clinical practice guidelines of the European society for vascular surgery. Eur J Vasc Endovasc Surg 2011;41:S1−S58.
- Rasmussen TE, Hallett JW, Noel AA, et al. Early abdominal closure with mesh reduces multiple organ failure after ruptured abdominal aortic aneurysm repair: guidelines from a 10-year case-control study. J Vasc Surg 2002;35 : 246–52.
- Ross CB, Irwin CL, Mukherjee K, et al. Vacuum-pack temporary abdominal wound management with delayed-closure for the management of ruptured abdominal aortic aneurysm and other abdominal vascular catastrophes: absence of graft infection in long-term survivors. Am Surg 2009;75 : 565–70.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2018 Issue 11-
All articles in this issue
- Indikace k otevřené chirurgické revaskularizaci viscerálního řečiště v endovaskulární éře
- Poranenia extrakraniálnych ciev mozgu pri traume krčnej chrbtice
- Větvený pedální bypass v léčbě kritické končetinové ischemie – zkušenosti našeho centra
- Zkušenosti našeho centra v chirurgické léčbě Dunbarova syndromu
- Aneuryzma vnitřní pánevní tepny − kazuistika
- Časné chirurgické a cévní komplikace po resekcích aneuryzmat aortoilické oblasti
- Aorto-ilická endarterektomie: staro-nová metoda?
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zkušenosti našeho centra v chirurgické léčbě Dunbarova syndromu
- Aneuryzma vnitřní pánevní tepny − kazuistika
- Poranenia extrakraniálnych ciev mozgu pri traume krčnej chrbtice
- Indikace k otevřené chirurgické revaskularizaci viscerálního řečiště v endovaskulární éře
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

