-
Medical journals
- Career
Totální pánevní exenterace – strategie a rozsah operačního výkonu
: J. Šimša 1; V. Visokai 1; L. Lipská 1; M. Levý 1; R. Zachoval 2
: Chirurgická klinika 1. LF Univerzity Karlovy a IPVZ, Thomayerova nemocnice přednosta: doc. MUDr. J. Šimša, Ph. D. 1; Chirurgické oddělení Thomayerovy nemocnice primář: doc. MUDr. R. Zachoval, Ph. D. 2
: Rozhl. Chir., 2017, roč. 96, č. 6, s. 242-246.
: Review
Úvod:
Pánevní exenterace je základem komplexní léčby pokročilých nádorů malé pánve. Taktika vlastní operace je známa již řadu let a je poměrně konsenzuální. Diskutována však dodnes zůstává otázka rozsahu lymfadenektomie. Cílem práce je v přehledném sdělení shrnout strategii výkonu a potřebný rozsah lymfadenektomie.Metody:
Přehledová práce, vycházející z dostupné literatury a zkušeností z retrospektivní analýzy vlastního souboru 63 nemocných, operovaných na Chirurgické klinice 1. LF UK a TN v období let 1999–2015.Závěr:
Práce popisuje indikace k pánevní exenteraci, strategii výkonu a potřebný rozsah lymfadenektomie.Klíčová slova:
totální pánevní exenterace – pokročilý karcinom – lymfadenektomieÚVOD
Pánevní exenterace je základní součástí komplexní léčby pokročilých nádorů malé pánve původu urologického, gynekologického i kolorektálního. Exenteraci pánevních orgánů poprvé provedl v roce 1940 v Ellis Fishel State Cancer Center v USA tým pod vedením A. Brunschwiga. Ten také jako první v roce 1948 sestavu 22 nemocných po pánevní exenteraci publikoval [1]. Pro řadu nemocných s rozsáhlými nádory je pánevní exenterace dodnes jedinou nadějí na dlouhodobé přežívání. Na druhou stranu se jedná o velmi extenzivní operační výkon, zatížený vysokým rizikem perioperačních krevních ztrát, vysokou pooperační morbiditou (30−45 %) i letalitou (5−10 %). Indikace k takto extrémní a rizikové operaci proto musí být vždy velmi precizní. V dnešní době by navíc měla vycházet z rozhodnutí mezioborového indikačního týmu pracoviště, které má s uvedenou problematikou zkušenosti a je schopné řešit často se vyskytující pooperační komplikace. Pro optimální péči o nemocné je nutná úzká spolupráce chirurgů, urologů, gynekologů, anesteziologů a onkologů. Tento „základní tým“ se dnes neobejde bez specialistů řady dalších odborností, zejména z oblasti gastroenterologie, radiologie a patologie.
Indikace
K pánevní exenteraci jsou indikováni nemocní s lokálně pokročilým primárním nebo recidivujícím nádorem, vycházejícím z orgánů malé pánve. Jedná se zejména o T4 nádory, které prorůstají do okolních struktur a orgánů v malé pánvi, jejichž radikální odstranění není možné méně rozsáhlým resekčním výkonem. V případě urologických orgánů jsou k pánevní exenteraci indikováni nemocní s pokročilými nádory močového měchýře. U nádorů prostaty se spíše jedná o indikace výjimečné. V případě gynekologických orgánů jsou k exenteraci indikovány pacientky s recidivou nebo progresí karcinomu děložního hrdla, vulvy nebo pochvy po primární radioterapii. Největší skupinu nemocných tvoří osoby s primárním nebo recidivujícím kolorektálním karcinomem. Pouze kompletní odstranění nádoru, tedy R0 resekce, dává nemocným naději na dlouhodobé přežívání. U nemocných s pokročilým primárním nádorem rekta, jenž je lokalizován do vzdálenosti 15 cm od anu, kteří dosud nebyli léčeni radioterapií na oblast malé pánve, je indikována neoadjuvantní chemo/radioterapie. Pánevní exenterace se provádí až po jejím skončení a restagingu, v druhé době [2−5].
Kontraidikace
Kontraindikací pánevní exenterace je lokální inoperabilita nádoru, peritoneální rozsev nebo špatný celkový stav nemocného, který není schopen takto rozsáhlý výkon podstoupit. Naopak, u extrapelvických metastáz nádorů kolorektálního původu došlo v posledních letech ke značnému názorovému posunu. Resekabilní extrapelvické metastázy kolorektálního karcinomu u mladších nemocných v dobrém stavu již dnes nejsou kontraindikací pánevní exenterace. Přehled kontraindikací výkonu shrnuje Tab. 1 [6].
1. Kontraindikace provedení pánevní exenterace [6] Tab. 1: Contraindications of pelvic exenteration [6] ![Kontraindikace provedení pánevní exenterace [6]
Tab. 1: Contraindications of pelvic exenteration [6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6da3672d9de0012fa6f823cecc25c2c7.png)
Předoperační rozvaha
Před vlastním operačním výkonem je klíčové posouzení lokální operability nádoru a vyloučení generalizace onemocnění. Jak bylo uvedeno výše, v případě kolorektálního karcinomu nejsou již dnes resekabilní extrapelvické metastázy kontraindikací pánevní exenterace. Pro předoperační posouzení lokální operability a vztahu nádoru k hlavním nervově-cévním svazkům a skeletu pánve je klíčová počítačová tomografie − Obr. 1. Stagingové vyšetření s pomocí NMR využíváme většinou jen u primárních nádorů před neoadjuvantní terapií. V případě rozsáhlých recidiv, kde nádor zjevně invaduje do okolních orgánů, nepovažujeme NMR za nutné. Prostor pro předoperační ozáření byl u těchto nemocných většinou již vyčerpán při léčbě primárního nádoru. Problematická dostupnost NMR a bohužel stále dlouhá délka objednacích lhůt by zbytečně odkládaly pokus o radikální chirurgickou léčbu. Pro zhodnocení aktivity ložiska v malé pánvi, jeho rozsahu, detekci recidiv i pro průkaz, resp. vyloučení vzdálených metastáz je nejvhodnějším vyšetřením celotělové PET/CT − Obr. 2. Nejsou-li přítomny vzdálené metastázy nebo jsou-li tyto resekabilní, je rozhodujícím krokem posouzení lokální operability nádoru. Odstranění nádoru není možné při rozsáhlé nádorové invazi do laterálních částí skeletu pánve, invazi tumoru do nervových kořenů sakrálního plexu nebo při infiltraci ilických cév. Extenzivní invaze nádoru do společných a zevních ilických tepen a zejména pak žil jeho odstranění většinou znemožňuje. Naopak, postižení krátkého úseku tepny je možné u vysoce selektované skupiny řešit její resekcí a náhradou. Z pohledu posouzení operability ve vztahu k postižení skeletu je kontraindikací pánevní exenterace rozsáhlá invaze pánevního kruhu, zejména jeho laterálních částí. A naopak, postižení distálních částí os sacrum od úrovně S2/3 níže není kontraindikací a je radikálně řešitelné kompozitní pelvickou exenterací. Nutno však uvést, že pánevní exenterace s distální sakrektomií je i ve velkých světových centrech provázena vysokou morbiditou i frekvencí lokálních recidiv nádoru až 25 %.
1. CT vyšetření: rozsáhlý tumor malé pánve, postihující rektum, pochvu a močový měchýř – indikace k totální pelvické exenteraci (bílá šipka). Fig. 1: CT: large tumour of the small pelvis, invading the rectum, vagina and urinary bladder – indication for total pelvic exenteration (white arrow). 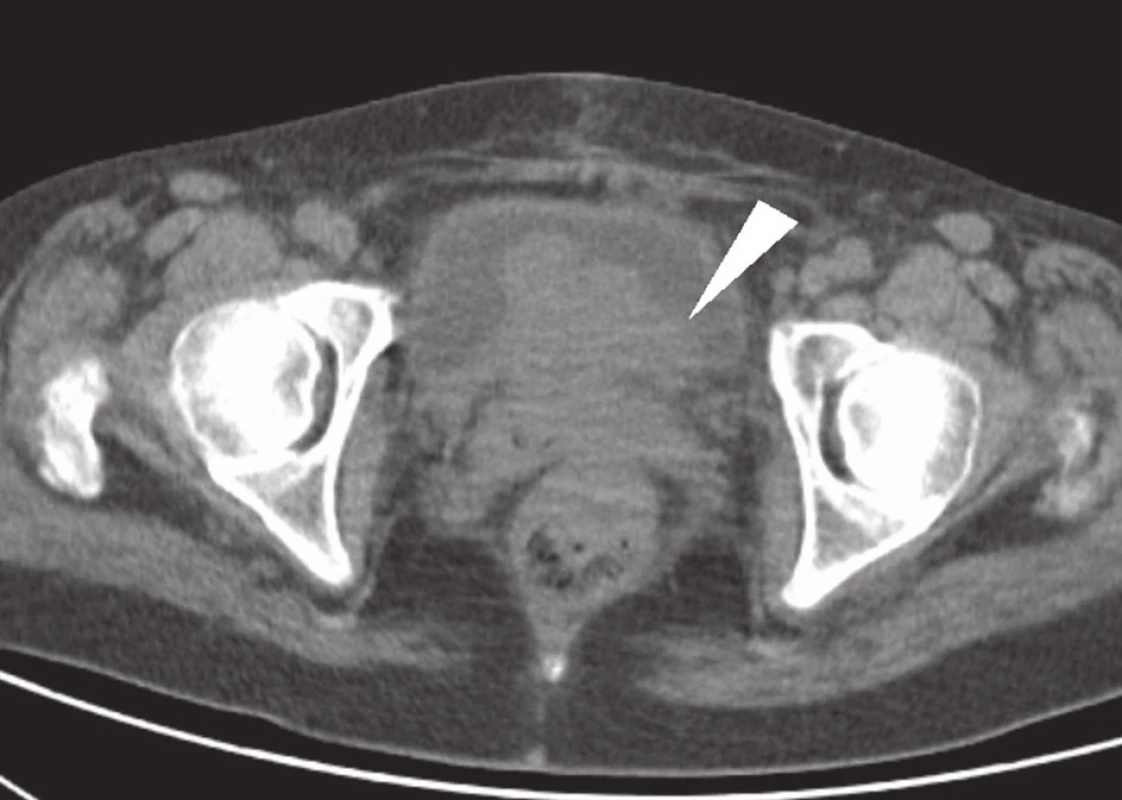
2. PET/CT vyšetření, axiální skeny: rozsáhlý tumor malé pánve, postihující rektum, pochvu a močový měchýř (bílá šipka) – předoperační vyšetření u stejné nemocné jako na Obr. 1. Fig. 2: PET/CT, axial scans: extensive tumour of the small pelvis, invading the rectum, vagina and urinary bladder (white arrow) – preoperative assessment in the same patient as in Fig. 1. 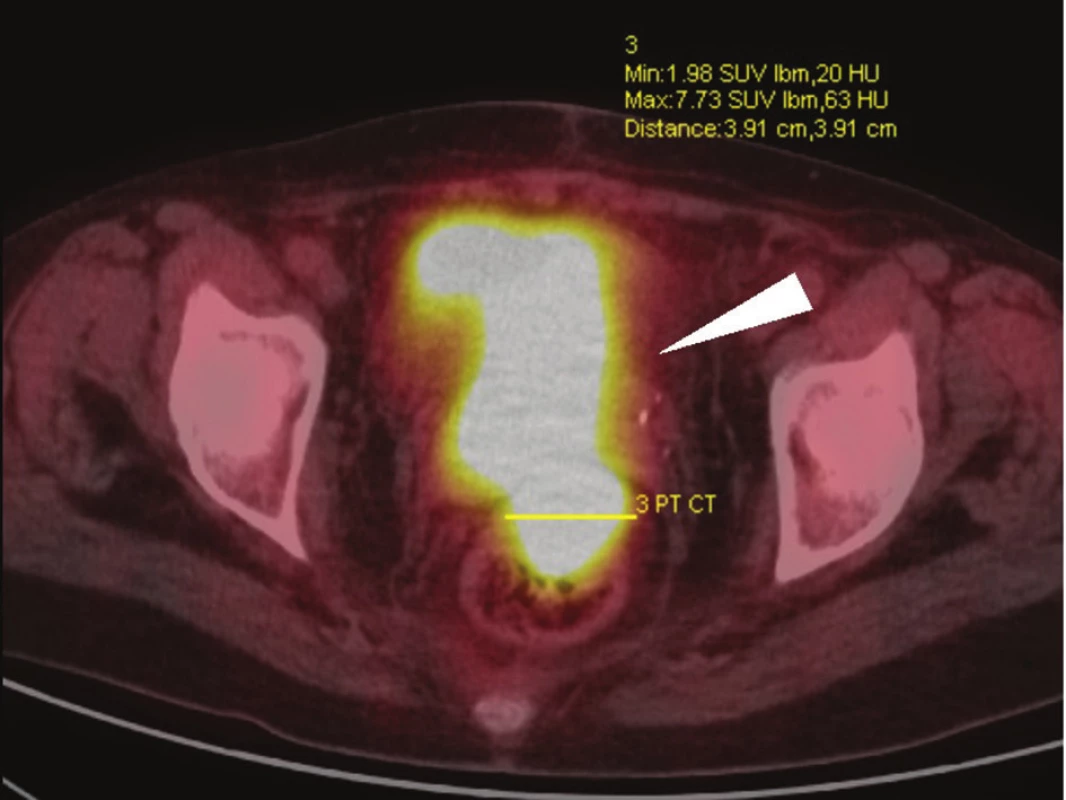
Strategie výkonu
Vlastní operační výkon začínáme dlouhou střední laparotomií od symfýzy s protažením řezu okolo pupku do epigastria. Po otevření dutiny břišní zhodnotíme místní rozsah nádoru a přítomnost event. metastáz. Peritoneální nádorový rozsev v dutině břišní, lokální neresekabilita nádoru nebo jeho šíření extrapelvicky znemožňují přibližně u 25–30 % nemocných exenterační výkon provést. V případě, že je nádor omezen na malou pánev a je radikálně odstranitelný, zahajujeme resekční fázi. Ta na našem pracovišti vždy začíná provedením paraaortální a parakavální lymfadenektomie. Následuje uvolnění nádoru v malé pánvi. Preparace postupuje od bifurkace aorty a junkce obou společných ilických žil. Ostře se proniká do presakrálního prostoru a uvolňuje se rektum s provedením totální excize mezorekta (TME). Poté vyznačujeme orální linii resekce na tračníku a protínáme mezokolon tak, aby založení terminální kolostomie ve vyznačeném místě bylo bez tahu a s dobrou trofikou. Při plánované supralevátorové exenteraci je nutné zajistit dostatečnou délku i vitalitu tračníku, který později umožní konstrukci kolorektální nebo koloanální anastomózy. Zde je rozhodující vzdálenost dolního okraje tumoru od linea dentata. Není-li zde bezpečný lem zdravé tkáně nebo nádor přímo do svěrače prorůstá, je nutná amputace konečníku s trvalou kolostomií. V další fázi pak přistupujeme k uvolnění močového měchýře, u mužů i prostaty. Zde hrozí větší krevní ztráta, zejména z oblasti žilních plexů v Retziově prostoru. Po uchopení a odtažení močového měchýře přerušujeme uretru. Distální část lze ponechat bez ligatury – zavedením močové cévky lze touto cestou v pooperačním průběhu řešit laváž či drenáž event. kolekcí v malé pánvi. U žen je součástí totální pánevní exenterace hysterektomie s adnexektomií. Jestliže tumor prorůstá ventrálně do vaginy, je nutná také dostatečně radikální resekce pochvy. Pokud nádor prorůstá až do oblasti poševního introitu, je nutná vulvektomie. En-bloc odstraněním rekta, pánevních orgánů a uzlin, zabalených do endopelvické fascie, je totální pelvická exenterace dokončena [6].
Rozsah lymfadenektomie
Při pánevní exenteraci pro pokročilý T4 nádor malé pánve se částečně mění i pohled na rozsah resekce lymfatických uzlin. Nádor, který prorůstá do okolních orgánů, „získává“ cestu také do lymfatického spádu těchto orgánů. Může se tedy šířit i do lymfatických uzlin, které leží mimo spádovou oblast orgánu výchozího. V případě primárně pokročilých nebo recidivujících T4 nádorů rekta, pro které je totální pánevní exenterace dnes prováděna nejčastěji, jsou ve vztahu k lymfadenektomii diskutovány dvě otázky. První z nich je vysoký podvaz arteria mesenterica inferior (AMI) při odstupu z aorty. Druhou otázkou je problematika laterální lymfadenektomie, tedy odstranění tukové tkáně s uzlinami z celé oblasti společných, vnitřních a zevních ilických cév včetně prostoru obturátorového.
Význam vysokého podvazu AMI při odstupu z aorty a odstranění uzlin v rozsahu N1-3 je u nádorů rekta diskutován již poměrně dlouho. McElwain ve své práci z roku 1954 popisuje v souboru 90 nemocných s karcinomem rekta výskyt uzlinových metastáz v oblasti N3 (uzliny při odstupu AMI z aorty) u 16 osob, což odpovídá 17,8 % [7]. Podobně pak Morgan a Griffiths popisují v roce 1959 v souboru 214 pacientů výskyt uzlinových metastáz v oblasti N3 u 34 osob, což odpovídá 16 % [8]. Další tři prospektivní studie se již zabývaly rozdílem v přežívání mezi skupinou nemocných s nízkou a vysokou ligaturou – Rosi (1962), Pezim a Nicholls (1984) a Buchmann (2003). V ani jedné z těchto studií se však benefit vysoké ligatury ve smyslu prodloužení přežití nepodařilo prokázat [9–10]. Existují i rizika, spojená s vysokým podvazem AMI. Za hlavní se považuje zejména ischemie střeva v oblasti anastomózy a možnost poranění nervových vláken hypogastrického plexu. Na našem pracovišti provádíme v rámci totální pánevní exenterace vysokou ligaturu AMI vždy, stav po dokončení parakavální a paraaortální lymfadenektomie ukazuje Obr. 3.
3. Operační nález: úvodní fáze pelvické exenterace s paraaortální a perikavální lymfadenektomií – žluté závěsy jsou na ureterech, červený na arteria ilica communis sinistra Fig. 3: Intraoperative finding: initial phase of pelvic exenteration demonstrating paraaortic and pericaval lymphadenectomy – yellow hanging tube – ureters, red hanging tube – left common iliac artery 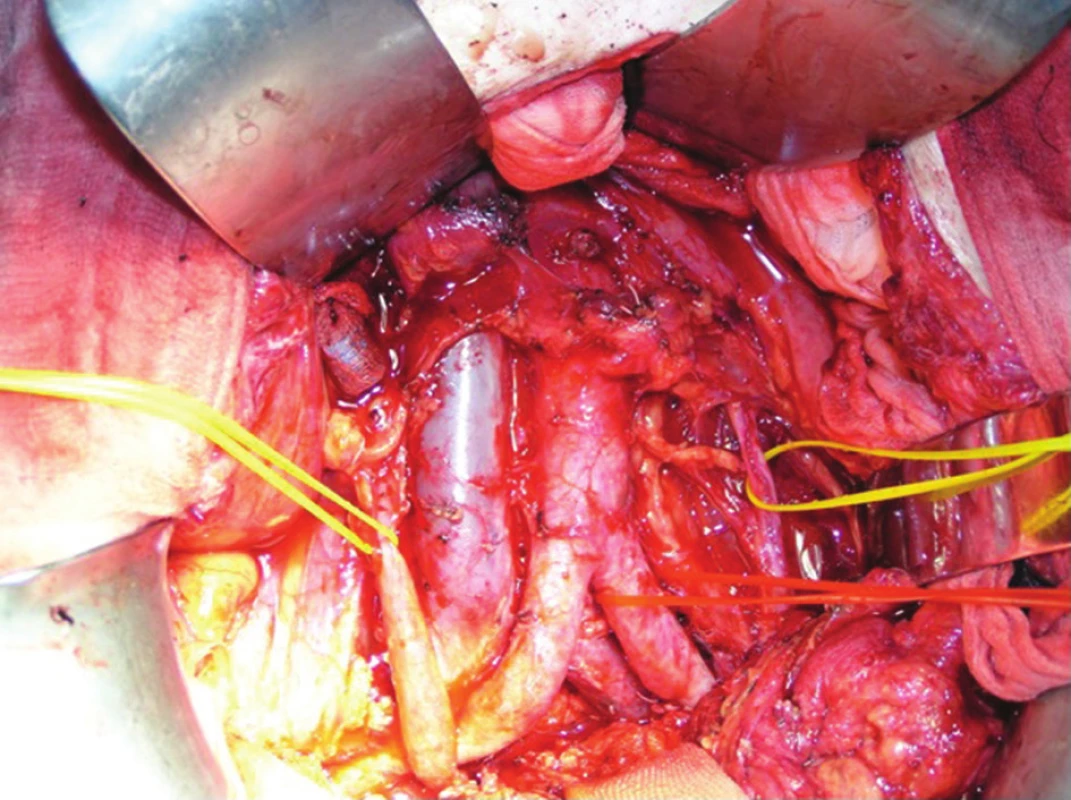
Druhou diskutovanou otázkou je problematika laterální lymfadenektomie. V užším slova smyslu je tento termín některými používán pro odstranění uzlin z oblasti vnitřních ilických cév a z prostoru obturátorového. Jiní autoři pod tento pojem zahrnují i odstranění tukové tkáně s uzlinami z oblasti společných a zevních ilických cév. Laterální lymfadenektomii lze provést buď s podvazem vnitřních ilických tepen a žil oboustranně, nebo bez něj. Zde velmi záleží na rozsahu nádoru, jeho uložení a na zkušenostech chirurga. Na našem pracovišti se v této otázce rozhodujeme individuálně. Dokončenou laterální lymfadenektomii s podvazem vnitřní ilické tepny i žíly ukazuje Obr. 4. Výskyt uzlinových metastáz v laterálních uzlinách nejlépe mapuje metanalýza 20 studií, provedených na toto téma, s celkovým náborem 5502 nemocných. V této práci z roku 2009 uvádí její hlavní autor Georgiou výskyt uzlinových metastáz v laterálních kompartmentech v rozmezí 10−25 %. Benefit v přežívání nemocných po extenzivní lymfadenektomii se však ani jemu prokázat nepodařilo. Navíc byl u podskupiny nemocných s extenzivní lymfadenektomií pozorován vyšší výskyt sexuálních a urologických dysfunkcí [11]. V současnosti probíhají obdobné studie zejména v Japonsku a v dalších asijských zemích. Zaměřují se zejména na pokročilý karcinom střední a distální 1/3 rekta. Standardně prováděnou totální mezorektální excizi rozšiřují ve studované skupině o laterální lymfadenektomii. Předběžné výsledky ukazují, že význam by mohl být zejména u nemocných, u kterých jsou v rámci předoperačního stagingu na NMR patrné zvětšené uzliny v laterálních kompartmentech, a to o velikosti minimálně 6 mm. Na výsledky těchto studií bude zajímavé si počkat.
4. Operační nález: pánevní dno po dokončení totální pelvické exenterace s laterální lymfadenektomií – patrné jsou pahýly ligovaných vnitřních ilických cév a obturátorový nerv (na peanu) Fig. 4: Intraoperative finding: pelvic floor after completing pelvic exenteration and lateral lymphadenectomy – both internal iliac arteries are ligated, the obturator nerve is visible in the “Rochester-Péan“ forceps 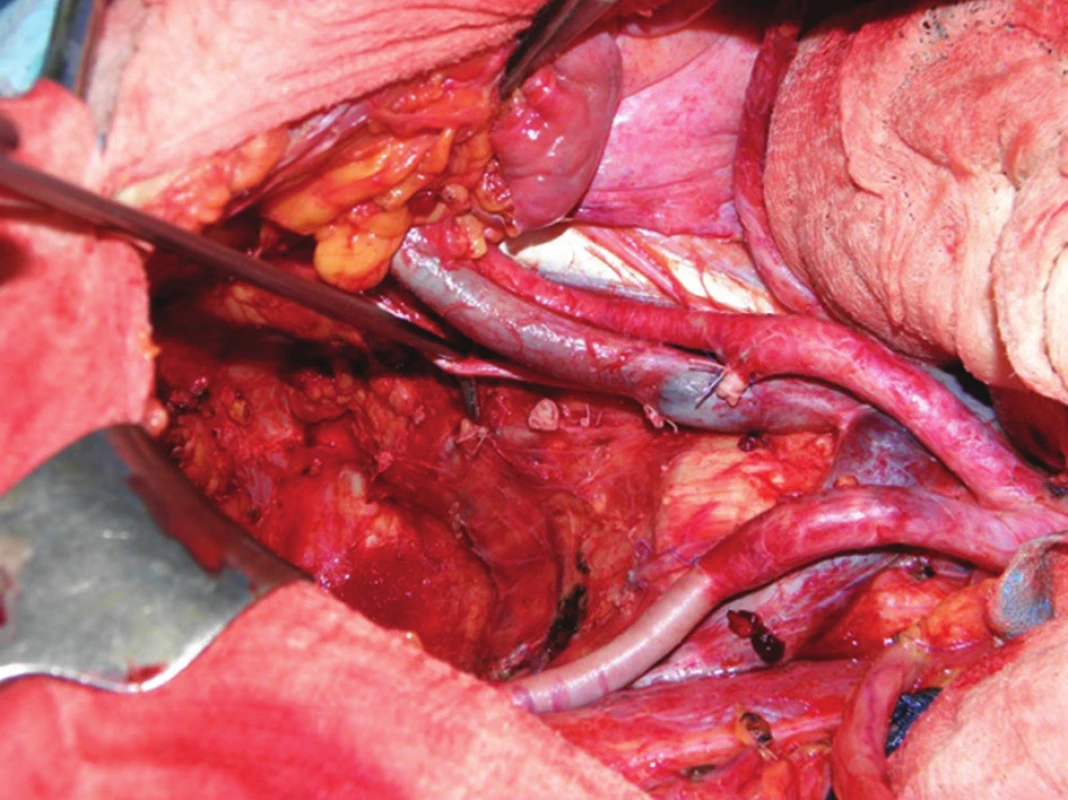
Závěrem této části lze shrnout, že jak v případě vysoké ligatury AMI, tak laterální lymfadenektomie nebyl zatím jednoznačně prokázán vliv odstranění uzlin z těchto oblastí na zlepšení přežívání nemocných. Na druhou stranu víme, že přibližně u 15−20 % nemocných se v obou těchto oblastech uzlinové metastázy vyskytují. A samozřejmě se zde také vyskytují uzlinové recidivy. Zejména pak u nemocných, kde lymfadenektomie nebyla řádně nebo vůbec provedena. Z těchto důvodů se řada center dnes přiklání k vysoké ligatuře AMI, v případě pánevních exenterací pak výběrově i k lymfadenektomii laterální.
Derivace moči po pánevní exenteraci
Součástí totální pelvické exenterace je odstranění všech orgánů malé pánve, tedy i močového měchýře. V rekonstrukční fázi výkonu je proto nutné kromě jiného zajistit i derivaci moči z obou ureterů, které byly při resekci na hranici malé pánve přerušeny. Derivačních metod bylo popsáno a do praxe uvedeno velké množství. Dělí se podle různých kritérií. Z časového hlediska je dělíme na dočasné a trvalé. Podle kontinence na kontinentní a inkontinentní – ty vyžadují nutnost použití jímacích pomůcek. Dalším z možných kritérií je lokalizace vyústění: zevní – ústí přímo na povrchu těla (např. ureteroileoanastomóza), vnitřní – ústí do dutého orgánu (např. ureterosigmoideostomie). Za určitý milník je považováno popsání techniky konduitu, vytvořeného s pomocí z pasáže exkludované kličky ilea s ureteroileoanastomózou, publikované Brickerem v roce 1950 [12]. Tato metoda je dodnes jednou z nejčastěji používaných a je metodou volby i na našem pracovišti. Pro transport moči po cystektomii se používá exkludovaný, 15−20 cm dlouhý segment terminálního ilea – Obr. 5. Do jeho orálního konce jsou společně implantovány oba uretery – Obr. 6, 7. Aborální konec kličky tenkého střeva je vyveden navenek identicky jako terminální ileostomie. Výhodou této derivace je její jednoduchost a menší množství metabolických komplikací. Nevýhodou je nutnost nošení jímacích pomůcek. Mezi dlouhodobé komplikace derivací patří problémy se stomií (striktury, parastomální hernie, úniky moči při netěsnosti pomůcek apod.). Z dalších vážných komplikací je nutné uvést zejména poškození horních močových cest (hydronefróza, recidivující pyelonefritidy a litiáza).
5. Operační nález: klička ilea exkludovaná z pasáže, ileoileální anastomóza koncem ke konci Fig. 5: Intraoperative finding: loop of the terminal ileum, excluded from the bowel passage, ileo-ileal anastomosis, constructed end to end 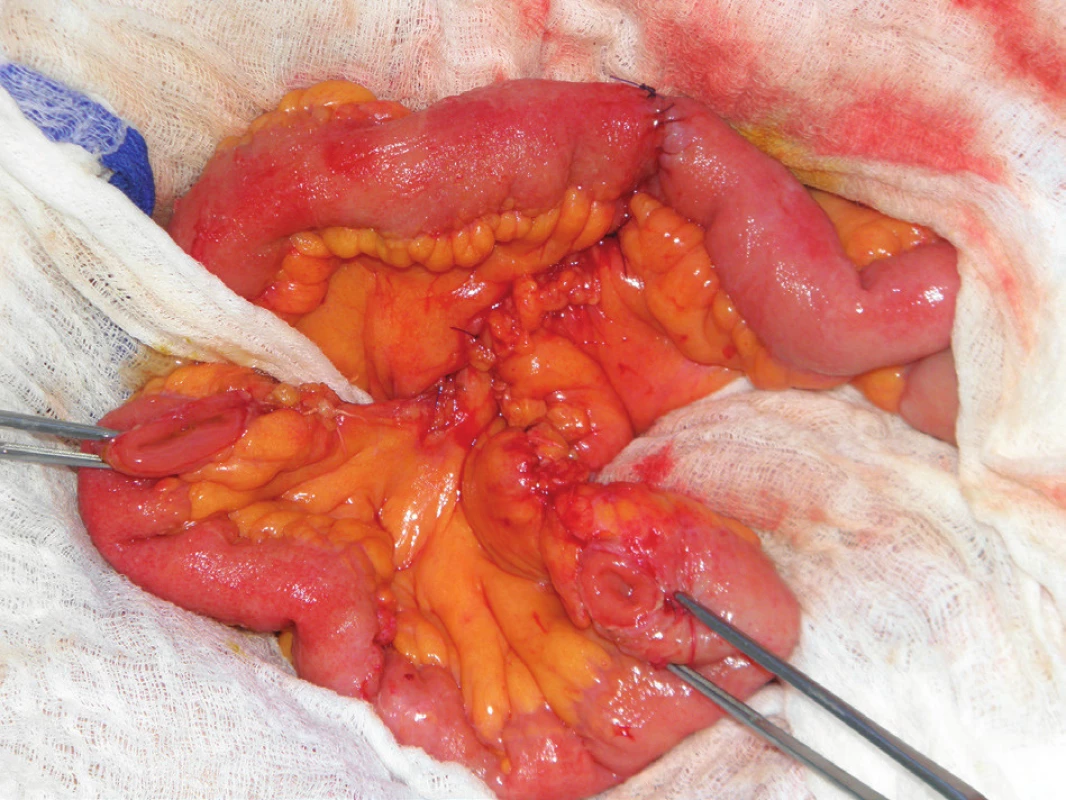
6. Operační nález: příprava společné lišty obou ureterů před uretero-ileo anastomózou – v obou ureterech jsou zavedeny splinty Fig. 6: Intraoperative finding: common “batten“ of both ureters, prepared for uretero-ileal anastomosis – splints are visible in both ureters 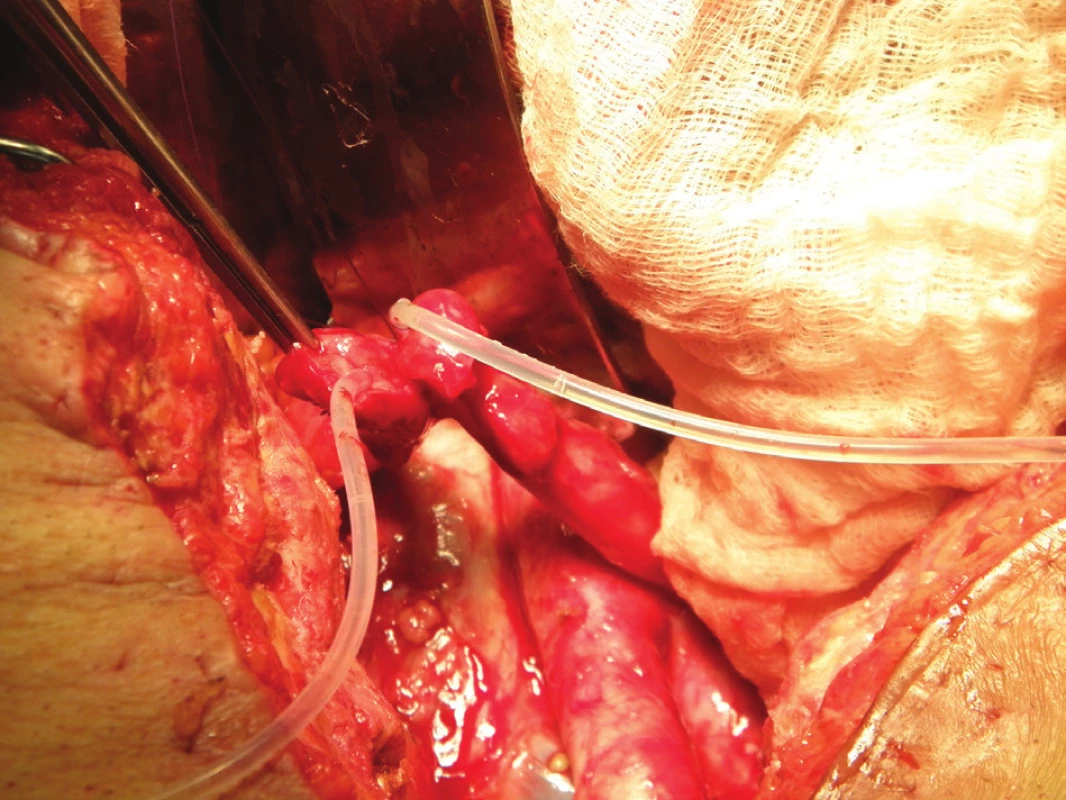
7. Operační nález: dokončená ureteroileo anastomóza (bílá šipka) Fig. 7: Intraoperative finding: completed uretero-ileal anastomosis (white arrow) 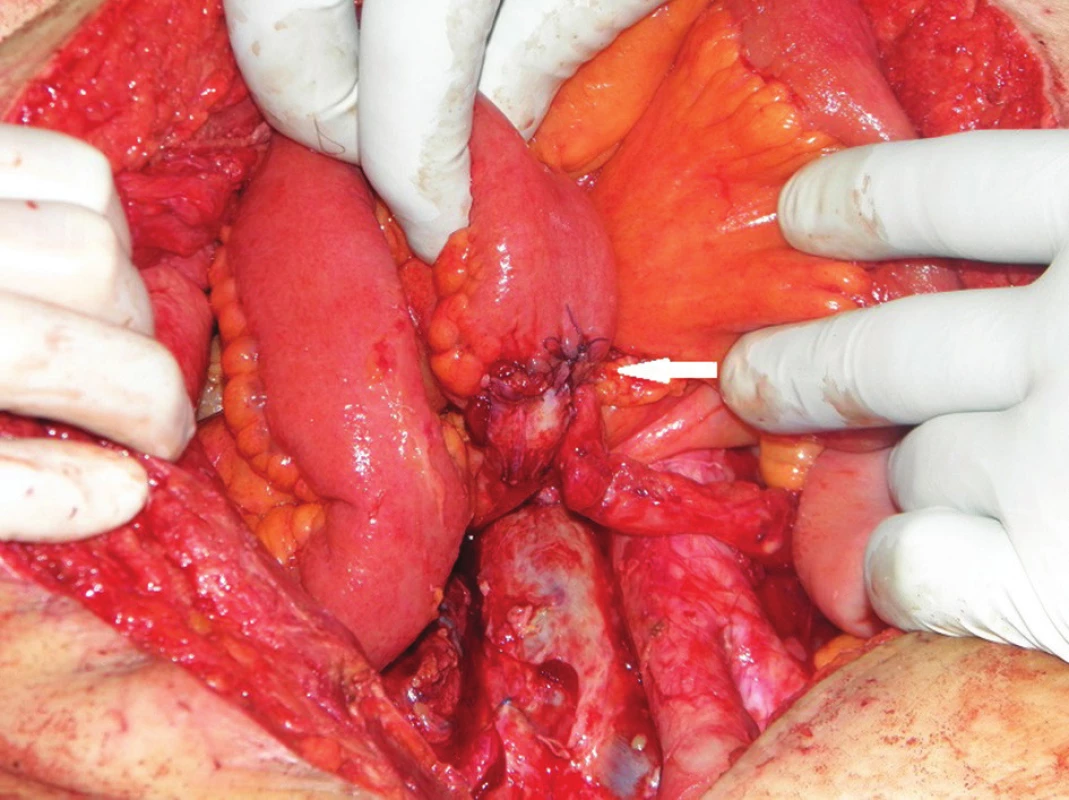
ZÁVĚR
Závěrem je nutné říci, že jedinou nadějí na dlouhodobé přežívání nemocných s místně pokročilým karcinomem rekta je radikální chirurgické odstranění nádoru. Také pro některé další nádory malé pánve urologického a gynekologického původu, zejména pak perzistující nebo recidivující po primární radioterapii, může být pánevní exenterace kurativní léčebnou variantou. Celkové pětileté přežívání v našem souboru dosáhlo 49 %, medián přežití nemocných po radikální operaci činil 4,6 roku. Z těchto výsledků lze kromě jiného usuzovat i na určité „biologicky příznivé“ charakteristiky nádorů, které mají dlouho tendenci k místnímu růstu bez generalizace. Při rozhodování o pánevní exenteraci je v neposlední řadě důležitým aspektem kvalita života nemocného. Ponechaný pokročilý nádor malé pánve, často provázený nekontrolovatelným odchodem stolice i moči, bolestmi a zápachem, je pro pacienta a jeho nejbližší okolí tristní situací s velmi nízkou kvalitou života. Pečlivé stanovení rozsahu nádoru, celkového stavu nemocného a jeho schopnosti podstoupit rozsáhlý exenterační výkon je před operací zásadní. Zhodnocení všech výše uvedených faktorů a stanovení léčebného postupu má dnes vždy vycházet z rozhodnutí mezioborového indikačního týmu.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.doc. MUDr. Jaromír Šimša, Ph.D.
Chirurgická klinika Thomayerova nemocnice
Vídeňská 800
149 00 Praha 4
e-mail: jaromir.simsa@ftn.cz
Sources
1. Brunschwig A. Complete excision of pelvic viscera for advanced carcinoma. A one-stage abdominoperineal operation with end colostomy and bilateral ureteral implantation into the colon above the colostomy. Cancer 1948;1 : 177−83.
2. Antoš F, Šerclová Z, Gilbert Z, a kol. Exenterace malé pánve a HIPEC v léčbě pokročilých kolorektálních nádorů. Bulletin HPB 2005;13 : 2.
3. Cibula D, Babjuk M, Mareš P, a kol. Exenterace pánve. Klin Onkol 2005;18 : 184 −7.
4. Gurlich R, Cibula D, Babjuk M, et al. Exenterační výkony v pánvi. Rozhl Chir 2005;84 : 403−9.
5. Vávra P, Meiner K, Guňková P, et al. Chirurgická léčba pokročilých stádií rektálního karcinomu. Rozhl Chir 2005;84 : 605−9.
6. Lipská L, Visokai V, a kol. Pelvická exenterace. In: Recidiva kolorektálního karcinomu. Praha, Grada 2009;329−52.
7. McElwain JW, Bacon HE, et al. Cancer of the rectum – a review. A Cancer Journal for Clinicians 1954;4 : 80−3.
8. Morgan N, Griffiths D. High ligation of the inferior mesenteric artery during operations for carcinoma of the distal colon and rectum. Surg Gynecol Obstet 1959;108 : 641−50.
9. Rosi P, Cahill W, Carey J, et al. A ten year study of hemicolectomy in the treatment of carcinoma of the descending and sigmoid colon and rectum. Surg Gynecol Obstet 1962;114 : 14−24.
10. Pezim M, Nicholls R. Survival after high or low ligation of the inferior mesenteric artery during curative surgery for rectal cancer. Ann Surg 1984;200 : 729−33.
11. Georgiou P, Tan E, Gouvas N, et al. Extended lymphadenectomy versus conventional surgery for rectal cancer: a meta-analysis. Lancet Oncology 2009;10 : 1053−62.
12. Bricker EM. Bladder substitution after pelvic evisceration. Surg Clin North Am 1950;30 : 1511−21.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 6-
All articles in this issue
- Surgical therapy of ovarian cancer
- Total pelvic exenteration – strategy and extent of surgery
- Obstructed defecation syndrome – review article
- Malignant tumors of the small bowel
- Salvage lymph node dissection in radical prostatectomy failure – a case study
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
- Carney triad
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obstructed defecation syndrome – review article
- Malignant tumors of the small bowel
- Surgical therapy of ovarian cancer
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

