-
Medical journals
- Career
Krvácení po pankreatektomii (PPH), prevalence, diagnostika a řešení
Authors: M. Loveček 1,2; P. Skalický 1,2; M. Köcher 3; M. Černá 3; V. Prášil 3; I. Holusková 4; H. Jugová 2; M. Chrástecká 2; T. Yogeswara 5; Č. Neoral 1,2; R. Vrba 1,2; Dušan Klos 1,2; R. Havlík 1,2
Authors‘ workplace: I. chirurgická klinika FN Olomouc, přednosta: prof. MUDr. Č. Neoral, CSc. 1; I. chirurgická klinika LF Univerzity Palackého, Olomouc, přednosta: prof. MUDr. Č. Neoral, CSc. 2; Radiologická klinika FN Olomouc, přednosta: Prof. MUDr. M. Heřman, Ph. D. 3; Transfuzní oddělení FN Olomouc, primářka: MUDr. D. Galuszková, Ph. D., MBA 4; Hywel Dda University Health Board, Glangwili General Hospital, United Kingdom 5
Published in: Rozhl. Chir., 2016, roč. 95, č. 9, s. 350-357.
Category: Original articles
Overview
Úvod:
Krvácení je považováno za nejzávažnější specifickou komplikaci po resekcích pankreatu. Na celkové pooperační mortalitě se podílí v 11−38 %. Řešení těchto komplikací patří k nejsložitějším, nejnákladnějším a vyžaduje dokonalou mezioborovou spolupráci. Cílem práce je stanovit prevalenci postpankreatektomické hemoragie (PPH) ve vlastním souboru nemocných, analyzovat diagnostiku a možnosti řešení.Metoda:
Jde o retrospektivní analýzu souboru nemocných operovaných v období 2006–2015 s klinicky relevantní PPH (typ B, C). Analyzovány byly: operační diagnóza, typ PPH a její stupeň, doba vzniku PPH, přítomnost tzv. sentinelového krvácení, způsob diagnostiky a léčby, počet podaných transfuzí, nutnost rehospitalizace, 30denní mortalita, 90denní mortalita, in-hospital mortalita a délka hospitalizace. Pro klasifikaci PPH pak byla retrospektivně použita klasifikace ISGPS. Pro statistickou analýzu byly využity metody deskriptivní statistiky.Výsledky:
V daném období bylo operováno 449 nemocných (DPE nebo PPDPE 76,4 %, LPE 19,8 %, TPE 3,8 %), 190 žen a 259 mužů, průměrný věk byl 61,5±11,1 roku, rozmezí 21−82 let. Vaskulární resekce byla provedena celkem v 17 případech (3,8 %). Žádná nebo 1 transfuzní jednotka byla podána u 43 % operovaných, 2 u 27,6 %, 3 u 4,4 % a 4 a více u 25 %. V celém souboru bylo identifikováno 23 případů PPH (5,1 %), o klinicky relevantní PPH (B, C) se jednalo ve 4,7 %. Časná PPH se objevila v 8 případech (35 %) a v 15 případech se jednalo o pozdní PPH (65 %). Pozdní PPH nastala ve 14 případech po DPE/PPDPE a jedenkrát po LPE. Sentinelové krvácení bylo zaznamenáno v 53,3 % případů pozdní PPH. U čtyř případů bylo indikováno CT/CTA s následnou DSA ve 3 případech. Jedenkrát bylo DSA průkazné – pseudoaneuryzma pahýlu gastroduodenální tepny – řešeno stentem. Ostatní tři případy si vynutily chirurgickou revizi. Šest případů PPH bylo indikováno pro rychle progredující stav do oběhové nestability přímo k chirurgické revizi. Jedenkrát byla revize pro CT prokázaný absces a hematom, dvakrát byla léčba krvácení konzervativní, dvakrát byla provedena gastroskopie s ošetřením vředové léze jako zdroje krvácení. Celková 30denní mortalita je 1,5 %, in-hospital mortalita 2,4 % a 90denní mortalita 3,1 %. Specifická mortalita ve skupině s PPH je 17,4 %, ve skupině nemocných s PPH a konstrukcí pankreatojejunální anastomózy (PJA) je 22,2 %, ve skupině pozdní PPH a PJA pak 28,6 % a v terénu pooperační pankreatické píštěle pak již 44 %. Ve skupině časných PPH bylo použito průměrně 10,1±2,5 TU krevních převodů, délka hospitalizace byla v průměru 17,5±4,8 dne, s nulovou mortalitou. Ve skupině pozdní PPH pak bylo použito v průměru 11,7±10 TU krevních převodů, průměrná délka hospitalizace byla 29,9±14,6 dne a mortalita 26,6 %.Závěr:
PPH je závažná komplikace, která sice není nejčastější, ale má vysokou mortalitu, zejména pokud k ní dojde v souvislosti s pankreatickou píštělí. V řešení PPH v současnosti dominují metody intervenční radiologie s poměrně vysokou úspěšností. K jejich většímu rozšíření je nutná včasná klinická a zobrazovací diagnostika krvácení a zjištění její příčiny. Velmi úzká intenzivní spolupráce s odborníky oboru radiodiagnostiky a intervenční radiologie je předpokladem pro větší rozšíření smysluplného využití radiologických intervenčních metod, pomocí nichž lze redukovat počet chirurgických revizí pro PPH.Klíčová slova:
krvácení – pankreas – resekce – komplikace – mortalitaÚVOD
V pankreatické resekční chirurgii bylo docíleno velmi nízké perioperační mortality – v centrech pankreatické chirurgie se pohybuje významně pod 5 %. Morbidita je však nadále vysoká a ve velkých publikovaných sériích se pohybuje mezi 23−50 % [1]. K hodnocení pooperačních komplikací je využívána Clavien-Dindo klasifikace nebo od ní odvozené podobné klasifikace [2,3,4]. Mezi specifické komplikace patří pooperační pankreatická píštěl (POPF), postpankreatektomická hemoragie (PPH) a opožděná evakuace žaludku (DGE). Tyto byly popsány a definovány v posledním desetiletí mezinárodní skupinou pro pankreatickou chirurgii – ISGPS [4,5,6,7]. Navržené definice byly též validovány různými studiemi a přes malé výhrady všeobecně přijaty [1,8]. PPH s uváděnou prevalencí 1−17,8 % není nejčastější specifickou komplikací, je však považována za nejzávažnější a na celkové mortalitě pankreatické chirurgie se podílí v 11−38 % [3]. Ze specifických komplikací pankreatické chirurgie je pak její řešení nejsložitější, nejnákladnější a vyžaduje dokonalou mezioborovou spolupráci [9]. Cílem práce je stanovit frekvenci/prevalenci PPH ve vlastním souboru nemocných, kteří podstoupili resekci pankreatu za posledních 10 let, analyzovat diagnostiku a možnosti řešení včetně výsledků a kalkulace mortality.
METODA
Prospektivně vedená databáze nemocných, kteří podstoupili resekční výkon na pankreatu v terciárním centru v období posledních 10 let, byla podrobena retrospektivní analýze. Ta byla zaměřena na identifikaci případů klinicky relevantní PPH. Vzhledem k retrospektivnímu charakteru analýzy a dřívější době vzniku souboru (dříve než byla PPH definována, prvně publikována a používána), je zřejmé, že případy nezávažné časné PPH typu A a pozdní PPH typu B, které nevyžadovaly léčbu, analýze unikly. Předmětem analýzy jsou tedy především případy klinicky relevantní časné PPH B a pozdní PPH C.
Do studie byli zařazeni všichni nemocní, kteří podstoupili resekční výkon na pankreatu (DPE, PPDPE, TPE, LPE) v období 2006–2015 na I. chirurgické klinice Fakultní nemocnice v Olomouci a Lékařské fakulty Univerzity Palackého v Olomouci.
Aktuální definici a klasifikaci PPH podle ISGPS představují Tab. 1 a 2. Pro klasifikaci je významná doba vzniku, lokalizace zdroje krvácení (intraluminální, extraluminální), závažnost a klinický dopad. Hodnocení morbidity vychází z klasifikace komplikací pankreatické chirurgie odvozené od Clavien-Dindo klasifikace [4]. Perioperační mortalita je obvykle definována jako poměr zemřelých během prvních 30 dnů od operace nebo během první hospitalizace. Na základě rozsáhlé studie National Cancer Data Base je u pankreatektomií vhodné sledovat i 90denní mortalitu, která je podle závěrů této studie dvojnásobná oproti 30denní. Vedle počtu operovaných jsou pak 30denní mortalita, 90denní mortalita a in-hospital mortalita měřítkem efektivity tzv. high volume center [10,11,12].
Table 1. Definice PPH (ISGPS) [3] Tab. 1: PPH definition (ISGPS) [3] ![Definice PPH (ISGPS) [3]
Tab. 1: PPH definition (ISGPS) [3]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9da6c8d980192a780cd680fbe5d6a38a.jpg)
Table 2. Klasifikace podle doby vzniku, závažnosti, nutné diagnostiky a léčby [3,8] Tab. 2: Classification according to time of onset, severity, diagnosis and treatment [3,8] ![Klasifikace podle doby vzniku, závažnosti, nutné diagnostiky a léčby [3,8]
Tab. 2: Classification according to time of onset, severity, diagnosis and treatment [3,8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0d2204d65f35aefd86b28b4e6a4a1ae9.jpg)
U nemocných, u nichž byla identifikována klinicky relevantní PPH, byly analyzovány: operační diagnóza, pro kterou byl proveden resekční výkon, provedení vaskulární resekce (portomesenterický žilní segment), typ PPH a její stupeň, doba vzniku PPH od operace, přítomnost tzv. sentinelového krvácení, způsob diagnostiky a léčby, počet podaných transfuzí, nutnost rehospitalizace, 30denní mortalita, 90denní mortalita, in-hospital mortalita a délka hospitalizace. Pro klasifikaci identifikovaných případů PPH pak byla retrospektivně použita klasifikace ISGPS (Tab. 2) [3,8]. Operatérem byla hodnocena struktura parenchymu pankreatu (subjektivně, objektivní hodnocení dosud není standardizováno) jako měkká či tuhá. Pomocí kalibračních sond pak diametr pankreatického vývodu.
Sentinelové krvácení je stav, který je charakterizován nově zjištěným krvácením do zažívacího traktu nebo nově zjištěným krvavým odpadem z drénů nebo zvýšením množství krvavého odpadu z drénů, které jsou doprovázeny poklesem hladiny hemoglobinu o více než 2 g/dl a objevuje se 3 a více dnů od operace [13]. Může signalizovat další závažné krvácení.
Pro statistickou analýzu byly využity metody deskriptivní statistiky.
VÝSLEDKY
Retrospektivní analýzou prospektivně vedené databáze bylo identifikováno 449 nemocných, u nichž byly provedeny tyto primární velké resekční výkony na pankreatu: DPE nebo PPDPE 76,4 %, LPE 19,8 %, TPE 3,8 %. Sestavu tvořilo 190 žen a 259 mužů (průměrný věk byl 61,5±11,1 roku, medián 63 let, rozmezí 21−82). Tabulka 3 charakterizuje celý soubor – celkový počet výkonů, výskyt klinicky relevantní PPH (časná, pozdní, typ B, C) ve vztahu k typu výkonu a diagnóze. Vaskulární resekce – segment žíly VP/VMS – byla provedena celkem v 17 případech (3,8 %). U dvou z nich vznikla PPH, krvácení nebylo v souvislosti s cévní rekonstrukcí.
Table 3. Celý soubor, stupně a typy PPH podle diagnóz a výkonů Tab. 3: Set of patients according to grades and types of PPH, diagnoses and types of operations 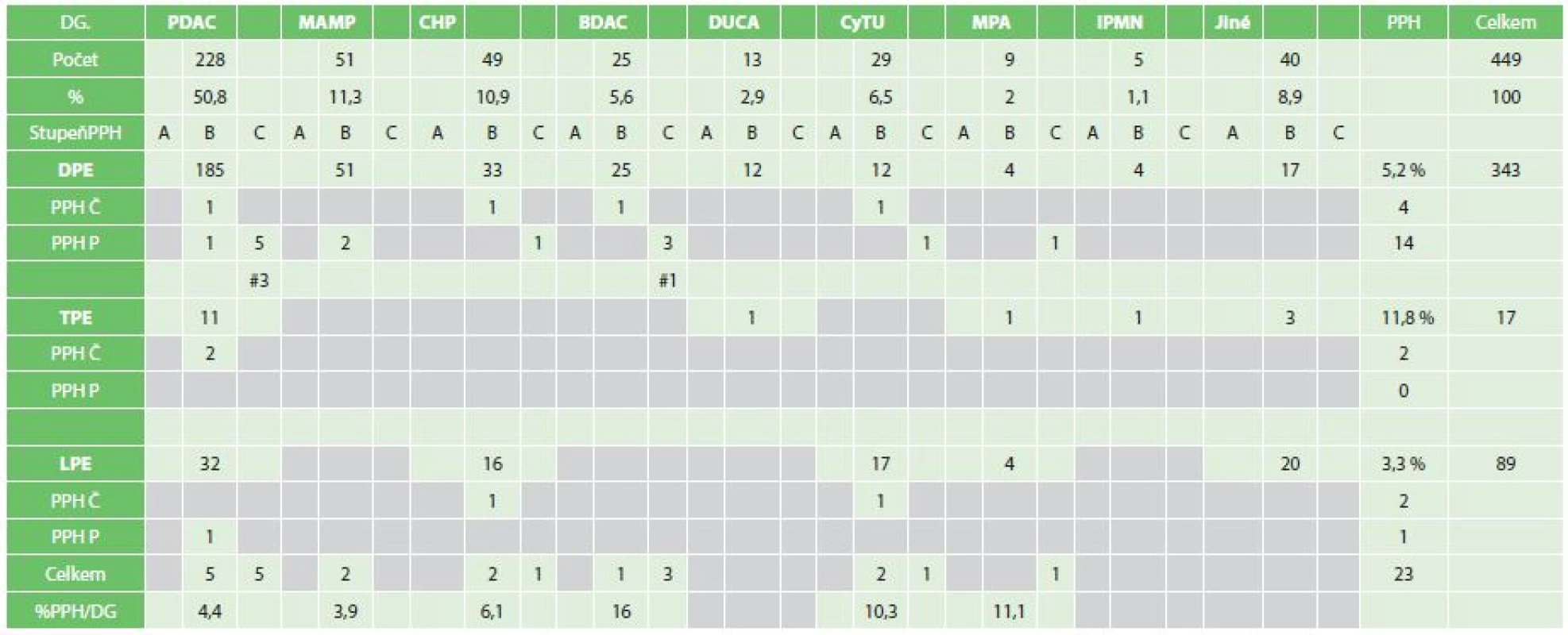
Zkratky: DG − diagnóza, PPH − postpankreatektomická hemoragie, PDAC − vývodový karcinom pankreatu MAMP − maligní ampulom, CHP − chronická pankreatitida, BDAC − karcinom žlučových cest, DC − karcinom duodena, CyT − cystické tumory, MP − metastázy do pankreatu, IPMN − intraduktální papilární mucinozní neoplazie, DPE − pravostranná pankreatoduodenektomie, TPE − totální pankreatektomie, LPE − levostranná pankreatektomie, # − úmrtí U 43 % operovaných nebyla podána žádná transfuze nebo jedna TU v průběhu výkonu. Dvě TU byly podány u 27,6 % operovaných, 3 TU u 4,4 % a 4 a více u 25 % operovaných. V celém souboru bylo identifikováno 23 případů klinicky relevantní PPH B,C − 5,1 % (časné krvácení z drénů, pozdní krvácení do GITu, z drénů). Na základě analýzy spotřeby krevních transfuzí a definice PPH by do kategorie B, C muselo být zahrnuto až 57 % všech operovaných, neboť všichni z této skupiny dostali v bezprostředním období 2−3 TU či v pozdějším období (>24 h) po operaci alespoň 1 TU krve. Předmětem analýzy tedy byly případy klinicky relevantní PPH, které si vynutily intervenci v podobě instrumentace či reoperace (4,7 %), (Tab. 4).
Table 4. Jednotlivé případy PPH Tab. 4: Individual cases of PPH 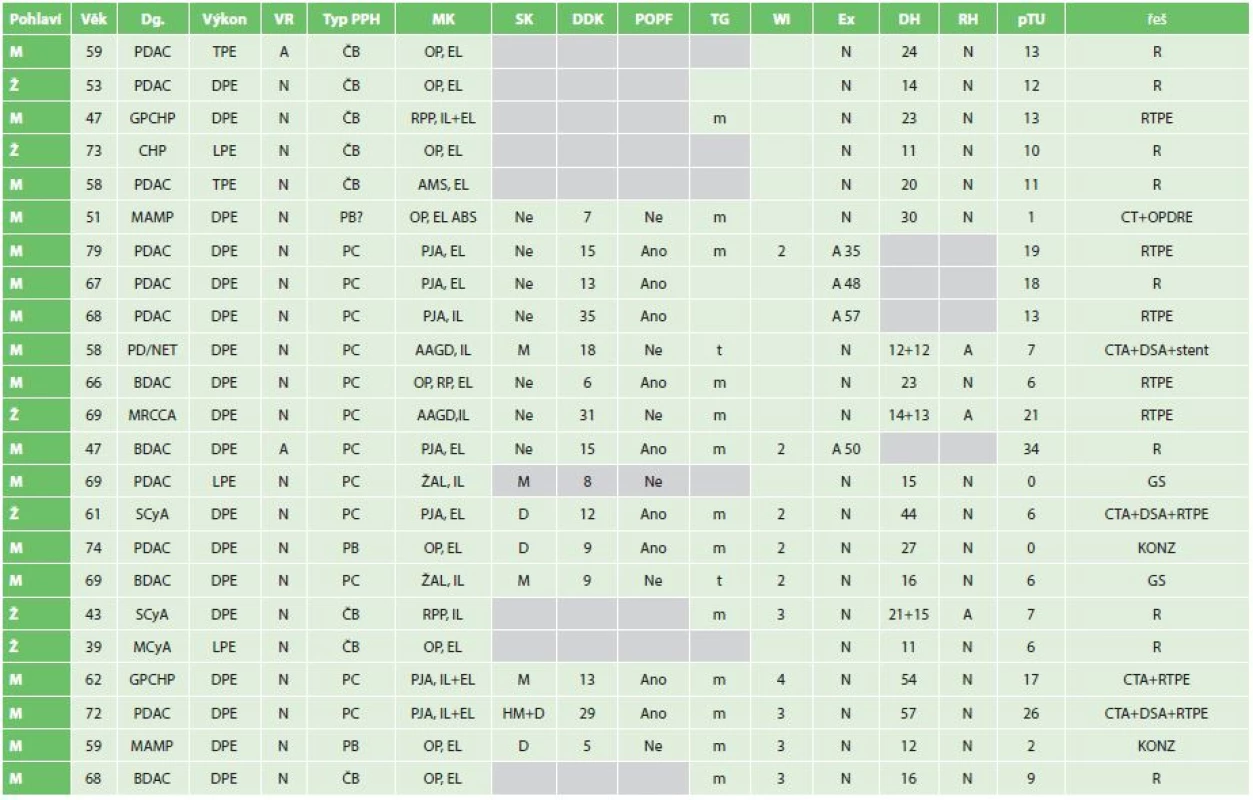
Zkratky: M muž, Ž − žena, MK − místo krvácení, SK − sentinelové krvácení, DDK − doba do krvácení ve dnech, POPF − pooperační pankreatická píštěl, TG − struktura žlázy, Wi − průměr pankreatického vývodu v mm, Ex − exitus (A − ano, pooperační den, N − ne), DH − délka hospitalizace, RH − rehospitalizace, pTU − počet transfuzních jednotek, řeš − způsob řešení, PDAC − vývodový ca pankreatu, GPCHP − groove (žlábková) chronická pankreatitida, CHP − chronická pankreatitida, MAMP− maligní ampulom, NET − neuroendokrinní tumor, BDAC − karcinom žlučových cest, MRCCA − metastáza renálního karcinomu, SCyA− serozní cystadenom, MCyA − mucinozní cystadenom, Č − časná, P − pozdní, A,B,C− stupeň závažnosti podle PPH klasifikace, OP − operační pole, EL − extraluminální, RPP− resekční plocha pankreatu, IL− intraluminální, AMS− arteria mesenterica superior, ABS − absces, PJA− pankreatikojejunální anastomóza, AAGD − aneuryzma arteria gastroduodenalis, ŽAL − žaludek, RP − retroperitoneum, R − revize, RTPE − revize a totální pankreatektomie, OPDRE − operační drenáž, DSA − angiografie, GD − gastroskopie, KONZ − konzervativní postup, D − dren, M − meléna, H − hematemeza, m − měkká, t − tuhá Podle uvedených kritérií se jednalo v 8 případech o časnou PPH (35 %) a 15 bylo pozdních (65 %). Časná PPH se vyskytla ve 4 případech po DPE a po dvou po TPE a LPE. Pozdní pak byla ve 14 případech po DPE a jedenkrát po LPE. Bližší rozbor jednotlivých případů pak přináší Tab. 4. Sentinelové krvácení bylo zaznamenáno v 53,3 % případů pozdní PPH. Ve dvou případech byl léčebný postup krvácení konzervativní, dvakrát bylo řešení endoskopické, ve čtyřech případech bylo indikováno CT/CTA s následnou DSA ve 3 případech. Jedenkrát bylo DSA průkazné – pseudoaneuryzma pahýlu a. gastroduodenalis – řešeno implantací stentu do a. hepatica, ostatní tři případy si vynutily chirurgickou revizi. Šest případů PPH bylo indikováno pro rychle progredující stav do oběhové nestability přímo k chirurgické revizi, jedenkrát byla revize pro absces a hemoperitoneum staršího data.
Součástí práce je i stanovení celkové mortality, mortality podle výkonu (DPE, TPE, LPE), mortality ve skupině s PPH, ve skupině PPH s rekonstrukcí pankreatické drenáže, pozdní PPH v souboru s rekonstrukcí pankreatické drenáže, pozdní PPH za přítomnosti POPF v souboru nemocných s rekonstrukcí pankreatické drenáže – Tab. 5. Specifická mortalita ve skupině PPH je 17,4 %, ve skupině nemocných s PPH a PJA je 22,2 %, ve skupině pozdní PPH a PJA pak 28,6 % a v terénu POPF pak již 44 %.
Table 5. Stanovení specifických mortalit Tab. 5: Calculation of specific mortality 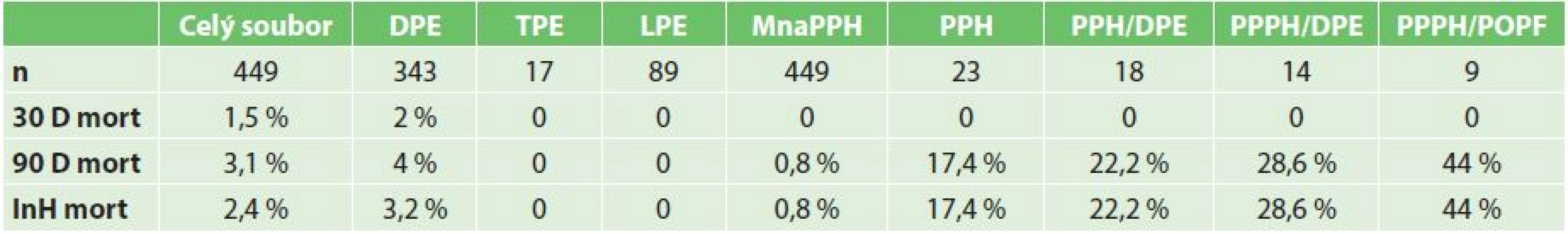
Zkratky: MnaPPH − mortalita na postpankreatektomickou hemoragii v celém souboru, PPH − mortalita ve skupině s PPH, PPH/DPE − mortalita ve skupině pacientů s PPH po DPE (s konstrukcí PJA), PPPH/DPE − mortalita ve skupině pozdní PPH po DPE (s konstrukcí PJA), PPPH/ POPF − mortalita ve skupině pozdní PPH a přítomnosti pooperační pankreatické píštěle Struktura parenchymu pankreatu byla známa u 80 % nemocných s pozdní PPH. Pokud v této skupině byla přítomna POPF, byla vždy spojena s měkkou konzistencí parenchymu pankreatu.
Ve skupině časných PPH bylo použito 6−13 TU krevních převodů, průměrně 10,1±2,5, medián je 10 TU, délka hospitalizace u těchto nemocných byla 11–24 dnů, průměrně 17,5±4,9 dne, medián je 18 dnů. Ve skupině pozdní PPH pak bylo použito 0–34 TU krevních převodů, průměrně 11,7±10, medián je 7 TU, délka hospitalizace pak 12–57 dnů, průměrně 29,9±14,6 dne, medián je 27 dnů.
DISKUZE
Pankreatická chirurgie je nadále zatížena nezanedbatelnou perioperační a pooperační morbiditou s prevalencí 23−50 % [1,14]. Klinicky relevantní morbidita, vyžadující jakoukoliv intervenci, se pohybuje okolo 15 % (CD III–V)[15]. Ta může mít vliv na opoždění či úplné znemožnění pooperační onkologické léčby, která je však nedílnou součásti komplexní léčby pankreatických malignit s prokázaným příznivým vlivem na délku přežívání [15,16,17,18,19]. PPH je příčinou úmrtí přibližně třetiny až poloviny nemocných, u nichž se vyskytne [3,20,21,22]. Je spojena s krevní ztrátou a nutností podávání krevních převodů a i samotné transfuze mohou mít nepříznivý vliv na dlouhodobé přežívání, zejména u nemocných s pankreatickými malignitami [15]. Prevalence PPH se ve velkých sestavách liší zejména podle použité definice a podle homogenity posuzovaného souboru. Velké rozdíly pak jsou mezi sestavami zahrnujícími všechny pankreatické resekce a sestavami zahrnujícími jen pravostranné resekce s konstrukcí pankreatodigestivní anastomózy. Setkáváme se tak s celkovou prevalencí v rozmezí 3−30 %, přičemž pečlivá adherence k definici PPH ISGPS v homogenním velkém souboru může vést k prevalenci přesahující 30 % (Tab. 6) [1,23]. Tyto studie tak zahrnují i stavy, které ve skutečnosti nejsou krvácením, ale z různých důvodů u nich byla v pooperačním období podána krevní transfuze. Některé studie udávají kritéria pro podání krevní transfuze: pokles hladiny hgb pod 70 g/l nebo pokles hladiny hgb pod 100 g/l u nemocných s kardiovaskulárním rizikem [1]. Je nutné přiznat, že podobná kritéria na našich pracovištích striktně dodržována nejsou. Při analýze našeho souboru také nacházíme nezanedbatelný počet pacientů, jimž byla podána krevní transfuze na základě subjektivního hodnocení ošetřujícího lékaře bez zjevné klinické nutnosti (absence krvácení do GITu, do drénů, do dutiny břišní, nedostatečné vyhodnocení léčby tekutinami v perioperačním a pooperačním období, neprovedení vyšetření KO v průběhu operace před podáním transfuze) [1,24]. Striktním použitím definice by pak skupina PPH typu A, B (podání 2−3 TU do 24 h od ukončení operace nebo 1−3 TU později než 24 od operace) zahrnovala velké množství nemocných, u nichž pooperační krvácení jako takové nenastalo. Ačkoliv je námi prezentovaná databáze vedena prospektivně, data pro využití definice PPH (ISGPS) byla doplňována retrospektivně a ne u všech nemocných mohla být natolik kompletní, že by postihla všechny případy časné PPH A a pozdní PPH B. Z tohoto důvodu tato studie věrohodně vypovídá pouze o klinicky relevantních časných PPH typu B a pozdních typu C, které jsou dokumentovány podrobně v Tab. 4.
Table 6. Přehled studií zabývajících se PPH Tab. 6: Overview of studies focused on PPH 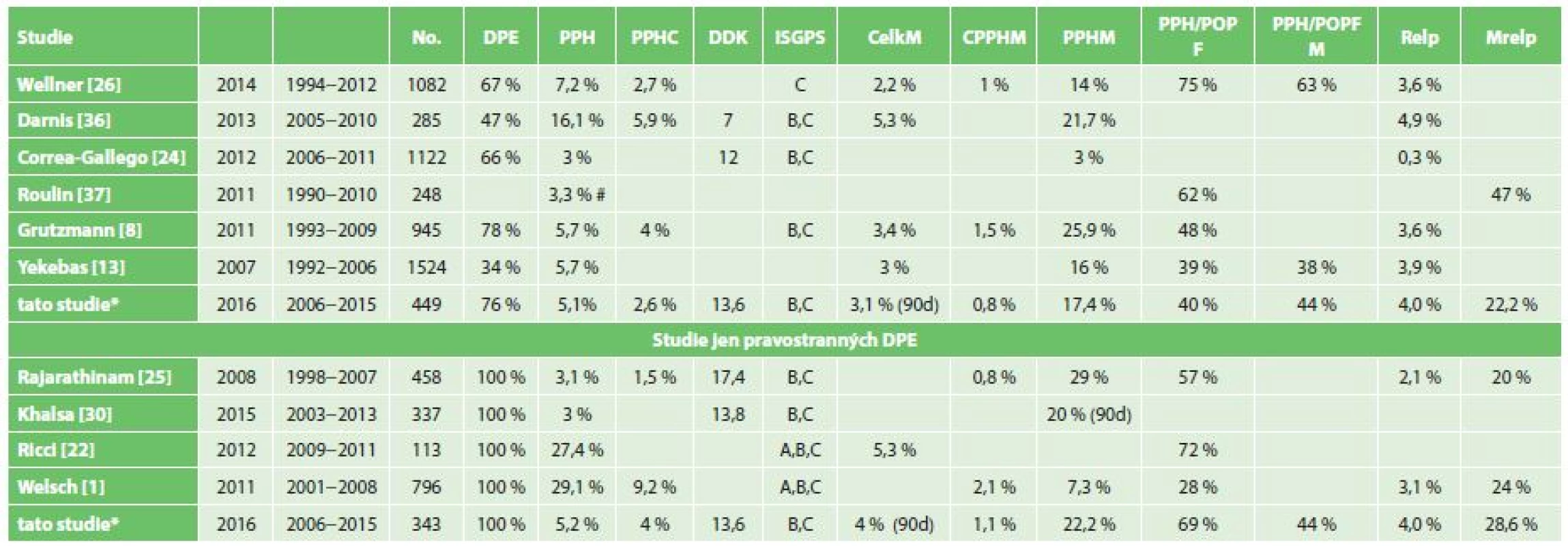
Zkratky: *− prezentovaná studie, # − jen pozdní, DPE− pravostranná pankreatoduodenektomie, PPH − postpankreatektomická hemoragie, PPHC − zastoupení PPH typu C, DDK − doba do krvácení ve dnech, CelkM − celková mortalita, CPPHM− mortalita na PPH v celém souboru, PPHM − mortalita ve skupině PPH, PPH/POPF − zastoupení pankreatické píštěle ve skupině PPH, PPH/POPFM− mortalita ve skupině PPH při POPF, Relap − poměr relaparotomií v celém souboru, MRelap − mortalita ve skupině relaparotomií Prezentovaný soubor nemocných s PPH je velmi heterogenní a pro smysluplnou analýzu vyžaduje bližší vymezení. K časným hemoragiím, které se klinicky projeví v prvních 24 hodinách po výkonu, dochází převážně v důsledku technické chyby v operačním poli, nedostatečné hemostázy či koagulopatie [3,8,21]. Diagnostika časné PPH při adekvátní monitoraci není obtížná a léčba klinicky závažné hemoragie spočívá téměř vždy v neodkladné chirurgické revizi. Výsledky léčby časné PPH jsou příznivé a mají minimální až nulovou mortalitu. Poměr časné na celkové PPH ve velkých sériích se pohybuje mezi 5−36 % (Yekebas 5,7 %, Grutzmann 11,1 %, Ricci 19,3 %, Correa-Gallego 21 %, Rajarathinam 36 %), viz Tab. 6 [8,14,23,25,26]. V celém našem souboru je výskyt časné PPH typu B v 1,8 % a na všech případech klinicky relevantní PPH se časná podílí ve 34,5 %. Jelikož nikdo z operovaných netrpěl závažnou koagulopatií, je nutné tyto hemoragie považovat za komplikace vzniklé v důsledku technické chyby či nedostatečné hemostázy peroperačně. V této skupině byli všichni nemocní neodkladně revidováni a příčina krvácení byla identifikována v operačním poli, resekční ploše pankreatu či drobné větvi arteria mesenterica superior. V této skupině nebylo zaznamenáno úmrtí v době hospitalizace, v intervalu 30 dnů ani 90 dnů.
Mnohem složitější problematikou jak diagnosticky, tak terapeuticky je pozdní PPH. Jedná se o skupinu zahrnující intra i extraluminální krvácení z mnoha možných zdrojů. Z velkých sestav podíl pozdních PPH v souboru všech PPH udává Yekebas v 94,2 %, Ricci v 80,6 %, Grutzmann v 88,9 %, Rajarathinam 64 %, viz Tab. 6 [8,14,23,26]. V našem souboru se pak pozdní PPH na celkovém počtu PPH podílí významně méně – 65,2 %. Jako nejzávažnější se však jeví pozdní PPH, ke které dochází za přítomnosti POPF či zánětlivé komplikace – nitrobřišního abscesu. Frekvenci vzniku PPH v terénu POPF udává Yekebas ve 39 %, Ricci v 72 %, Wellner v 75 % (skupina PPH C), Welsch ve 25% a naše sestava v 64 % [1,14,23,27]. Přesněji by však měl být hodnocen vztah pozdní PPH a POPF pouze ve skupině nemocných s konstruovanou pankreatodigestivní anastomózou. V této skupině je pak výskyt pozdní PPH C v souvislosti s POPF mnohem vyšší. V naší sestavě došlo k 93 % pozdní PPH ve skupině nemocných s rekonstrukcí pankreatické drenáže, tedy tam, kde byla provedena PJA. Ve dvou třetinách případů pozdní PPH pak byla jednoznačně prokázána POPF. Struktura žlázy byla známa v 80 % z nich a vždy se jednalo o měkkou/jemnou strukturu. Welsch ve svém souboru pak zjišťuje PPH v terénu POPF jen ve 25 % [1].
Na základě těchto zjištění lze předpokládat vysoké riziko vzniku PPH především v terénu POPF. Sledování odpadu z drénů a průkaz přítomnosti amyláz pak umožňuje identifikovat nemocné s POPF. V pooperačním období je nezbytné identifikovat tzv. sentinelové krvácení, které může být předzvěstí masivního krvácení [13,27]. Sentinelová krvácení se objevují ve velkém rozptylu (7−78 %) v různém odstupu od primární operace (17,8−22 dnů) [13,20,28]. V naší sestavě jsme je zaznamenali v 53,3 % případů pozdní PPH, průměrně 13,6 dne od první operace. V ostatních případech se jednalo o neidentifikované sentinelové krvácení (1x) či rovnou masivní hemoragii vyžadující laparotomii. Včasná detekce sentinelového krvácení a adekvátní diagnostika a zejména léčba jsou klíčové faktory v řešení této komplikace. Po objevení se varovného krvácení je nutná snaha o identifikaci zdroje krvácení. Studie Tiena představuje sestavu, kde u všech pacientů se sentinelovým krvácením byla provedena angiografie [13]. Při intraluminální hemoragii přichází v úvahu zdroj dosažitelný endoskopicky (vřed žaludku, pahýlu duodena, resekční plocha pankreatu). Endoskopické vyšetření může stav diagnostikovat a případně vyřešit či vyloučit příčinu krvácení v dostupné části zažívacího traktu. Negativní endoskopické vyšetření pak vyžaduje hledání jiné příčiny krvácení. CTA je další metodikou v případě intraluminální či první metodikou při extraluminální hemoragii. Nález zdroje krvácení či pseudoaneuryzmatu je pak indikací k angiografii. Úspěšnost detekce zdroje krvácení na CTA může dosahovat až 88 % [20]. Práce zabývající se diagnostikou a řešením PPH z posledních let doporučují pokračovat v diagnostickém algoritmu i v případech, kdy CTA neprokázalo zdroj krvácení či pseudoaneuryzma [20,30,31]. Stampflová ve své studii prezentuje sestavu pacientů s PPH, v níž angiografie byla přímo provedena ve 32 % případů a u ostatních na CTA ihned navázala. V 92 % případů pak byl zdroj krvácení nalezen, převážná většina využitím selektivní DSA (83 %), zbývající pak využitím superselektivní DSA. Následná superselektivní embolizace byla provedena u 92 % pacientů s 83% úspěšností zástavy krvácení [20]. Yekebas pak prezentuje úspěšnost v 80 % [14]. Uvádí i možnost embolizace naslepo, v případech DSA neprokázaného krvácení, když byla provedena embolizace místa podezřelého z krvácení [14]. Pokud embolizace není možná nebo úspěšná, pak je indikována laparotomie. V případě recidivy krvácení po úspěšné embolizaci je angiografická reintervence možná. V případech krvácení z pseudoaneuryzmat, kdy hrozí riziko úniku embolizačního materiálu (játra, slezina, tenké střevo), může přicházet v úvahu překlenutí odstupu krčku pseudoaneuryzmatu stentem [32,33,34,35].
V naší sestavě ve srovnání s jinými sériemi zjišťujeme některé významné rozdíly [1,8,14,20,23,25,27,30,31]. Poměr časné PPH převažuje ostatní sestavy a svědčí pro vyšší míru technické chyby v průběhu operace. Naopak zastoupení pozdní je pak výrazně nižší ve srovnání s podobnými velkými heterogenními sestavami [8,14]. Celá námi analyzovaná sestava pak vykazuje celkovou 30denní mortalitu 1,5 %, in-hospital mortalitu 2,4 % a 90denní pak 3,1 %. Prevalence PPH je 5,1 % a specifická mortalita na PPH (PPH related mortality) je 17,4 %. PPH se tak podílí na celkové mortalitě ve 28,5 %. Tyto výsledky jsou ve shodě s publikovanými velkými soubory (incidence 1−17,8 %, podíl na celkové mortalitě 11−38 %). Ve skupině pozdních PPH však zjišťujeme vysoké zastoupení POPF svědčící o jejím etiologickém vlivu, a tedy i možný způsob, jak ovlivnit četnost PPH. Při diagnostice a řešení PPH jsou v naší sestavě oproti velkým současným studiím významně méně zastoupeny postupy intervenční radiologie. Ačkoliv se naše celkové výsledky významně neliší od obdobných studií, bylo jich dosaženo převážně chirurgickými, a tedy invazivními postupy, které významně ovlivňují morbiditu. Srovnáním se souborem Welsche, kde je poměr relaparotomií pro PPH ve skupině operovaných s PJA (DPE+PPDPE) 3,1 %, je poměr relaparotomií v naší srovnatelné skupině (DPE+PPDPE) pro PPH 4,1 %, tedy nedosahuje ani 1,5násobku [1]. Je nutné však vzít v úvahu, že ve Welschově sestavě je zastoupení žilních resekcí v 17 % a multiviscerálních resekcí v 9 %.
Využití metod intervenční radiologie v naší sestavě je zatím velmi nízké a naopak frekvence reoperací a dokončení TPE jsou relativně vysoké. Khalsa uvádí během 10 let pokles původní 100% mortality u čistě chirurgických intervencí pro PPH až po nulovou mortalitu u nemocných řešených v posledních letech výhradně využitím metod intervenční endovaskulární radiologie [30]. Stejně tak Tol zaznamenává významný nárůst řešení ve prospěch neoperačních postupů [31]. Zlepšením operační techniky, vypracováním co nejbezpečnější konstrukce PJA, včasnou identifikací POPF a adekvátním managementem jejího řešení včetně dostatečné pozornosti při včasné diagnostice sentinelového krvácení je možné dosáhnout snížení frekvence PPH a zlepšení výsledků řešení PPH. Na tyto postupy musí navazovat změna dosud platného algoritmu (zejména v situaci, kdy není prokázán na CTA jasný zdroj krvácení – krvácející céva, pseudoaneuryzma), především v situaci zřejmého krvácení (nově zjištěný krvavý odpad z drénu, meléna či enterorhagie, pokles v krevním obraze, negativní endoskopie). Pokračování v diagnostice zvolenou angiografickou metodikou – selektivní angiografie, superselektivní angiografie, embolizace – přináší možnost snížení počtu chirurgických revizí, případně dokončených pankreatektomií [20]. Dobrá spolupráce s radiologickými intervenčními pracovišti, 24hodinová dostupnost metod intervenční radiologie včetně adekvátně zkušeného personálu je nezbytným předpokladem pro rozšíření metod intervenční radiologie v řešení komplikací po resekcích pankreatu, jak je sledovatelný trend v centrech pankreatické chirurgie [20,30,31].
Pozdní PPH u jiného výkonu než DPE je v našem souboru zcela ojedinělá, specifická prevalence pozdní PPH u DPE jsou pak 4 %, s mortalitou 28,6 % a v případě pozdní PPH za přítomnosti POPF je mortalita 44 %. Studie Yekebase pak v případě pozdní PPH/POPF uvádí mortalitu podobnou – 38 % [14].
ZÁVĚR
PPH je závažná komplikace pankreatické resekční chirurgie, která sice není nejčastější, ale má vysokou mortalitu, zejména pokud k ní dojde v souvislosti se vznikem POPF. V řešení PPH v současnosti dominují metody intervenční radiologie s poměrně vysokou úspěšností. K jejich většímu rozšíření je nutná včasná klinická a zobrazovací diagnostika krvácení a její příčiny. Velmi úzká intenzivní spolupráce s odborníky oboru radiodiagnostiky a intervenční radiologie je předpokladem pro větší rozšíření smysluplného využití radiologických intervenčních metod, pomocí nichž lze redukovat množství chirurgických revizí pro PPH.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martin Loveček, PhD.
Benýškova 6
779 00 Olomouc
e-mail: mlovecek@seznam.cz
Sources
1. Welsch T, Eisele H, Zschäbitz S, et al. Critical appraisal of the International Study Group of Pancreatic Surgery (ISGPS) consensus definition of postoperative hemorrhage after pancreatoduodenectomy. Langenbecks Arch Surg 2011;396 : 783−91.
2. Fong ZV, Correa-Gallego C, Ferrone CR, et al. Early drain removal – the middle ground between the drain versus no drain debate in patients undergoing pancreaticoduodenectomy. A prospective validation study. Ann Surg 2015;262 : 378−83.
3. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH) – an international study group of pancreatic surgery (ISGPS) definition. Surgery 2007;142 : 20−5.
4. DeOliveira ML, Winter JM, Schafer M, et al. Assessment of complications after pancreatic surgery: a novel grading system applied to 633 patients undergoing pancreaticoduodenectomy. Ann Surg 2006;244 : 931−7.
5. Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005;138 : 8−13.
6. Čečka F, Jon B, Šubrt Z, et al. Pankreatická píštěl – definice, rizikové faktory a možnosti léčby. Rozhl Chir. 2013;92 : 77−84.
7. Wente MN, Bassi C, Dervenis C, et al. Delayed gastric emptying (DGE) after pancreatic surgery: a suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2007;142 : 761−8.
8. Grützmann R, Rückert F, Hippe-Davies N, et al. Evaluation of the International Study Group of Pancreatic Surgery definition of post-pancreatectomy hemorrhage in a high-volume center. Surgery 2012;151 : 612−20.
9. Čečka F, Jon B, Čermáková E, et al. Impact of postoperative complications on clinical and economic consequences in pancreatic surgery. Ann Surg Treat Res 2016;90 : 21−8.
10. Swanson RS, Pezzi CM, Mallin K, et al. The 90-day mortality after pancreatectomy for cancer is double the 30-day mortality: more than 20,000 resections from the national cancer data base. Ann Surg Oncol 2014;21 : 4059−67.
11. Alsfasser G, Leicht H, Günster C, et al. Volume-outcome relationship in pancreatic surgery. Br J Surg 2016;103 : 136−143.
12. Finks JF, Osborne NH, Birkmeyer JD. Trends in hospital volume and operative mortality for high-risk surgery. N Engl J Med 2011;364 : 2128–37.
13. Tien YW, Wu YM, Liu KL, et al. Angiography is indicated for every sentinel bleed after pancreaticoduodenectomy. Ann Surg Oncol 2008;15 : 1855−61.
14. Yekebas EF, Wolfram L, Cataldegirmen G, et al. Postpancreatectomy hemorrhage: diagnosis and treatment: an analysis in 1669 consecutive pancreatic resections. Ann Surg 2007;246 : 269−80.
15. Loveček M, Klos D, Skalický P, et al. Resekabilní karcinom pankreatu − 5leté přežití. Rozhl Chir 2015;94 : 470−6.
16. Merkow RP, Bilimoria KY, Tomlinson JS, et al. Postoperative complications reduce adjuvant chemotherapy use in resectable pancreatic cancer. Ann Surg 2014;260 : 372−7.
17. Wu W, He J, Cameron JL, et al. The impact of postoperative complications on the administration of adjuvant therapy following pancreaticoduodenectomy for adenocarcinoma. Ann Surg Oncol 2014;21 : 2873−81.
18. Oettle H, Post S, Neuhaus P, et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA 2007;297 : 267−77.
19. Neoptolemos JP, Moore MJ, Cox TF, et al. Effect of adjuvant chemotherapy with fluorouracil plus folinic acid or gemcitabine vs observation on survival in patients with resected periampullary adenocarcinoma: the ESPAC-3 periampullary cancer randomized trial. JAMA. 2012;308 : 147−56.
20. Stampfl U, Hackert T, Sommer CM, et al. Superselective embolization for the management of postpancreatectomy hemorrhage: a single-center experience in 25 patients. J Vasc Interv Radiol 2012;23 : 504−10.
21. Limongelli P, Khorsandi SE, Pai M, et al. Management of delayed postoperative hemorrhage after pancreaticoduodenectomy: a meta-analysis. Arch Surg 2008;143 : 1001−7.
22. Santoro R, Carlini M, Carboni F, et al. Delayed massive arterial hemorrhage after pancreaticoduodenectomy for cancer. Management of a life-threatening complication. Hepatogastroenterology 2003;50 : 2199−2204.
23. Ricci C, Casadei R, Buscemi S, et al. Late postpancreatectomy hemorrhage after pancreaticoduodenectomy: is it possible to recognize risk factors? JOP 2012;13 : 193−8.
24. De Pietri L, Montalti R, Begliomini B. Anaesthetic perioperative management of patients with pancreatic cancer. World J Gastroenterol. 2014;20 : 2304–2320.
25. Correa-Gallego C, Brennan MF, D’Angelica MI, et al. Contemporary experience with postpancreatectomy hemorrhage: results of 1,122 patients resected between 2006 and 2011. J Am Coll Surg. 2012; 215 : 616–21.
26. Rajarathinam G, Kannan DG, Vimalraj V, et al. Post pancreaticoduodenectomy haemorrhage: outcome prediction based on new ISGPS Clinical severity grading. HPB, 2008;10 : 363–70.
27. Wellner UF, Kulemann B, Lapshyn H, et al. Postpancreatectomy hemorrhage – incidence, treatment and risk factors in over 1000 pancreatic resections. J Gastrointest Surg. 2014; 8 : 464–75.
28. Tien YW, Lee PH, Yang CY, et. al. Risk factors of massive bleeding related to pancreatic leak after pancreaticoduodenectomy. J Am Coll Surg. 2005;201 : 554–59.
29. De Castro SM, Kuhlmann KF, Busch OR et al. Delayed massive hemorrhage after pancreatic and biliary surgery: embolization or surgery? Ann Surg. 2005;241 : 85–91.
30. Khalsa BS, Imagawa DK, Chen JI, et al. Evolution in the treatment of delayed postpancreatectomy hemorrhage: Surgery to interventional radiology. Pancreas. 2015;44 : 953–58.
31. Tol JA, Busch OR, van Delden, et al. Shifting role of operative and nonoperative interventions in managing complications after pancreatoduodenectomy: what is the preferred intervention? Surgery. 2014;156 : 622–31.
32. Pastor J, Pádr R. Krvácení z pseudoaneuryzmatu a. hepatica po pankreatoduodenektomii řešené implantací stentgraftu. Rozhl Chir 2015;94 : 256–60.
33. Loveček M, Havlík R, Köcher M, et al. Pseudoaneurysm of the gastroduodenal artery following pancreatoduodenectomy. Stenting for hemorrhage. Wideochir Inne Tech Maloinwazyjne. 2014;9 : 297–301.
34. Wang MQ, Liu FY, Duan F, et al. Stent-grafts placement for treatment of massive hemorrhagie from ruptured hepatic artery after pancreaticoduodenenctomy. World J Gastroenterol. 2010;16 : 3716–22.
35. Lee HG, Heo JS, Choi SH, et al. Management of bleeding from pseudoaneurysms following pancreaticoduodenectomy. World J Gastroenterol. 2010;16 : 1239–44.
36. Darnis B, Lebau R, Chopin-Laly X, et. al. Postpancreatetomy hemorrhage (PPH): predictors and management from a prospective database. Langenbecks Arch Surg. 2013;398 : 441–48.
37. Roulin D, Cerantola Y, Demartines N, et al. Systematic review of delayed postoperative hemorrhage after pancreatic resection. J Gastrointest Surg. 2011;15 : 1055–62.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2016 Issue 9-
All articles in this issue
- Primární zhoubné nádory tenkého střeva
- Krvácení po pankreatektomii (PPH), prevalence, diagnostika a řešení
- Kvalita života po extenzivních pánevních operacích
- Cirkumskriptní a difuzní peritonitis: závažné komplikace po operacích bariatrické a metabolické chirurgie, specifika při jejich diagnostice a terapii
- Synchronní kolorektální karcinom a nehodgkinský lymfom – popis dvou případů
- Corpus alienum − migrující cizí těleso
- Koincidence lymfomu tračníku a biliárního ileu – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primární zhoubné nádory tenkého střeva
- Corpus alienum − migrující cizí těleso
- Cirkumskriptní a difuzní peritonitis: závažné komplikace po operacích bariatrické a metabolické chirurgie, specifika při jejich diagnostice a terapii
- Synchronní kolorektální karcinom a nehodgkinský lymfom – popis dvou případů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

