-
Medical journals
- Career
Karcinom štítné žlázy, desetiletý soubor
Authors: J. Šafránek 1; V. Třeška 1; T. Skalický 1; V. Špidlen 1; J. Doležal 1; D. Kubačková 1; J. Zeithaml 1; M. Skála 1; P. Hošek 2
Authors‘ workplace: Chirurgická klinika, Lékařská fakulta v Plzni, Univerzita Karlova v Praze, přednosta: prof. MUDr. V. Třeška, DrSc. 1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova v Praze, vedoucí manažer: doc. Ing. J. Hrabák, Ph. D. 2
Published in: Rozhl. Chir., 2016, roč. 95, č. 11, s. 394-397.
Category: Original articles
Overview
Úvod:
Karcinom štítné žlázy má celkově dobrou prognózu a nízkou mortalitu, přestože v současnosti dochází k nárůstu incidence, především časných forem onemocnění.Metoda:
Retrospektivní analýza souboru operací štítné žlázy s průkazem karcinomu v období 2006−2015.Výsledky:
Karcinom štítné žlázy jsme prokázali u 145 z celkem 1820 operovaných pacientů s tyreopatií (8,0 %), mikrokarcinom (do 10 mm) v 64 (44,1 %) případech. Nejčastěji, 70 případů (48,3 %), byl průkaz karcinomu náhodným nálezem při totální tyreoidektomii. Ve 35 případech (24,1 %) se karcinom očekával z předchozí punkce a byla provedena rovnou totální tyreoidektomie. Peroperační histologii po hemityreoidektomii jsme žádali v 31 případech (21,4 %), jen v 13 případech byla pozitivní, u ostatních jsme tyreoidektomii dokončili v druhé době. Ve 3 případech (2,1 %) byla pro pokročilý karcinom provedena pouze revize/debulking nádoru – vždy pro anaplastický karcinom. K trvalé jednostranné lézi n. laryngeus recurrens došlo ve 3 případech (2,1 %), dvakrát (1,4 %) došlo k trvalé oboustranné lézi.
Nejčastěji jsme prokázali papilární karcinom 114 (78,6 %; 83 žen/31 mužů; věk 12−84 let; průměr 50,6), pak folikulární karcinom 16 (11,0 %; 15/1; 19−69; 55,3), dále medulární karcinom 10 (6,9 %; 6/4; 25−76; 58,1). Řídce pak anaplastický karcinom 4 (2,8 %; 2/2; 64−87; 75,5), dvakrát lymfom štítné žlázy a dvakrát i karcinom z Hürtleho buněk.Závěr:
Karcinom štítné žlázy bývá převážně náhodným operačním nálezem v časné fázi onemocnění. Dokazuje to správnost trendu brzké indikace operační léčby tyreoidální patologie a kvalitu endokrinologické péče.Klíčová slov:
Karcinom štítné žlázy – tyreoidektomie – komplikaceÚvod
Karcinom štítné žlázy nepatří mezi nejčastější malignity, má s výjimkou anaplastického dobrou prognózou, nízkou mortalitu (0,5/100 000 obyvatel) a bývá převážně náhodným nálezem při tyreoidektomii. Incidentální průkaz karcinomu štítné žlázy se udává 5–12 % operací štítné žlázy [1,2]. Zhoubné nádory štítné žlázy můžeme rozdělit na skupinu epitelových a neepitelových nádorů. Z tyreocytů vznikají diferencované nádory – papilární a folikulární a nediferencovaný karcinom označovaný jako anaplastický. Z parafolikulárních buněk pochází medulární karcinom. Mezi neepitelové nádory se řadí vzácné sarkomy a lymfomy [3]. Za uplynulých 10 let jsme na našem pracovišti operaci štítné žlázy provedli 1820 nemocným, karcinom byl prokázán u 145 z nich, tedy 8,0 %.
Metoda
Retrospektivní analýza operací štítné žlázy s průkazem karcinomu, na chirurgické klinice FN Plzeň, v desetiletém období 2006−2015. Rozbor typů malignit, celkového přežití nemocných, chirurgických výkonů a komplikací. Nemocné předoperačně vyšetřil endokrinolog ultrasonograficky (USG), případně punkcí (FNA) a doporučil typ výkonu. Tím je většinou totální tyreoidektomie, rovnou, či dle výsledku peroperační histologie, případně lymfadenektomie. Týden od operace byli nemocní ještě kontrolováni chirurgem, pak předáni do péče endokrinologa, resp. onkologa.
Výsledky
Karcinom štítné žlázy jsme prokázali u 145 operovaných, 111 žen a 34 mužů, ve věku 12−87 let, průměr 52,6 roku. Nejčastěji, 70 případů (48,3 %), byl průkaz karcinomu náhodným nálezem při totální tyreoidektomii. Ve 35 případech (24,1 %) bylo na karcinom podezření z FNA a byla provedena rovnou totální tyreoidektomie. Peroperační histologii po hemityreoidektomii jsme žádali v 31 případech (21,4 %), ve 13 případech prokázala karcinom a v jedné době byla dokončena totální tyreoidektomie. Jednou jsme dokončení tyreoidektomie neindikovali (papilární mikrokarcinom, 79 let). V 17 případech byla peroperační histologie negativní a totální tyreoidektomie dokončena až ve druhé době, s výjimkou starších nemocných (72, resp. 79 let, oba papilární mikrokarcinom) a jednou v případě folikulárního mikrokarcinomu u 19letého pacienta (po konzultaci endokrinologa). V 6 případech (4,1 %) jsme po hemityreoidektomii vyčkali až na definitivní histologii a s průkazem karcinomu jsme dokončili totální tyreoidektomii ve druhé době. Ve 3 případech (2,1 %) byla provedena pouze revize, debulking nádoru a uvolnění/zajištění dýchacích cest – pro anaplastický karcinom. Lymfadenektomie centrálního krčního segmentu současně s tyreoidektomií byla provedena 12x, v 8 případech byla prokázána metastáza (papilárního karcinomu). Z těchto ve dvou případech byla s odstupem 8, resp. 2 měsíců provedena exstirpace zvětšené uzliny nadklíčku a též prokázána metastáza téhož karcinomu.
Mikrokarcinom T1a−T1b (do 10 mm) jsme prokázali celkem v 64 (44,1 %) případech: papilární v 54 (47,4 %), folikulární v 6 (37,5 %) a medulární ve 4 (40 %). Multifokální forma papilárního karcinomu byla zaznamenána ve třech případech.
Hospitalizace trvala v průměru do 3,0 pooperačního dne (1–34 dnů). V 5 případech (3,4 %) došlo v pooperačním období ke krvácení vyžadujícímu operační revizi. K trvalé jednostranné lézi n. laryngeus recurrens došlo ve 3 případech (2,1 %), dvakrát (1,4 %) došlo k trvalé oboustranné lézi. V obou případech šlo o ženy s nepokročilým folikulárním karcinomem ve věku 68, resp. 81 let, oba byly řešeny trvalou tracheostomií.
Nejčastěji jsme prokázali papilární karcinom 114 (78,6 %; 83 žen/31 mužů; věk 12−84 let; průměr 50,6 roku), pak folikulární karcinom 16 (11,0 %; 15/1; 19−69; 55,3), dále medulární karcinom 10 (6,9 %; 6/4; 25−76; 58,1). Řídce anaplastický karcinom 4 (2,8 %; 2/2; 64−87; 75,5), dvakrát lymfom štítné žlázy a dvakrát karcinom z Hürtleho buněk. Pro nízkou četnost úmrtí, bylo možné statisticky stanovit odhad celkového 5letého přežití pouze pro papilární karcinom − 92,9 %. 30denní mortalita pro anaplastický karcinom byla 50 %. Křivky přežití jednotlivých forem karcinomu v našem souboru ukazuje graf.
Graph 1. Celkové přežití Graph 1: Overall survival 
Diskuze
Karcinom štítné žlázy se řadí výskytem mezi nejrychleji přibývající malignity. V posledním století incidence narostla z 1,3/100 000 žen a 4,6/100 000 mužů v roce 1935 na 16,3/100 000 žen a 5,6/100 000 mužů v roce 2008 [4,5]. Je tomu tak mimo vlivy životního prostředí především pro průkaz časných forem karcinomu, kvalitní USG a FNA [4]. Převažuje zastoupení diferencovaného karcinomu s celkovým 10letým přežitím vyšším než 90 %. Podstatou léčby diferencovaného karcinomu je triáda tyreoidektomie, léčba radiojódem (u T2 či multifokálních ložisek, metastáz lymfatických uzlin aj.) a suprese hormonů štítné žlázy [6,7]. U medulárního karcinomu je základem léčba chirurgická, i při recidivě a u anaplastického naopak spočívá chirurgická léčba většinou pouze v zajištění dýchacích cest (debulking/tracheostomie) a je indikována léčba onkologická (radioterapie) [3]. Pokud by bylo podezření na šíření nádoru štítné žlázy do okolních struktur (trachey, hrtanu), měla by eventuální bloková resekce proběhnout na centralizovaném pracovišti, na naší klinice ji neprovádíme.
Nízká mortalita je i navzdory faktu, že jsou často prokázány metastázy do lymfatických uzlin (20−50 %) a asi u 15 % nemocných dochází k lokální recidivě po TTE a nárůstu mortality [8–10]. Soudí se, že až 90 % nemocných má mikrometastázy v uzlinách i u mikrokarcinomu [11]. Z diferencovaných forem má agresivnější chování folikulární karcinom s vyšší mortalitou než papilokarcinom, ačkoli do regionálních lymfatických uzlin metastazuje častěji papilární než folikulární karcinom (36 % vs. 16 %) [12]. Vzdálené metastázy vykazuje častěji karcinom folikulární, a to do plic a skeletu. Medulární karcinom s postižením uzlin i bez něj má prognózu horší, anaplastický velmi špatnou (v našem souboru 50 % 30denní mortalita ze 4 případů) [3].
Pro odhad prognózy karcinomu štítné žlázy byla vypracována různá skórovací schémata, ze kterých mimo jiné vyplývá faktor věku, <45 let s prognózou lepší než u starších. Spolehlivým prediktorem je i TNM klasifikace a diferencovanost karcinomu [12]. Pro papilární karcinom štítné žlázy je také negativním prognostickým faktorem zvýšená hladina plazmatického tyreoglobulinu a mužské pohlaví [13]. Mikrokarcinom (do 10 mm) má prognózu lepší, horší naopak multifokální typ karcinomu.
V současné době se doporučuje lymfadenektomie metastaticky postižených uzlin z centrálního oddílu krku, který představuje primární zónu metastatického šíření. Švédská multicentrická studie prezentovala 52% zastoupení některé formy lymfadenektomie na chirurgických pracovištích, ale i závěr, že průkaz metastáz karcinomu štítné žlázy do lymfatických uzlin neměl vliv na celkovou délku přežití, na rozdíl od lokální progrese, invaze tumoru [12]. Význam uzlinových metastáz tak není jednoznačný, ani další práce neprokazují významný vliv na tumor vázanou mortalitu [14−16]. Doporučení Americké společnosti pro onemocnění štítné žlázy nepovažuje lymfadenektomii u T1 (do 1 cm) tumorů za nutnou a provedení lymfadenektomie v laterálních kompartmentech (II−IV) doporučuje jen z terapeutických, nikoli preventivních/stagingových důvodů [17]. Všeobecně se uznává, že všechny makroskopicky zvětšené uzliny mají být v době operace štítné žlázy odstraněny a většina autorů považuje za významné jen ty metastázy uzlin, které jsou klinicky zřejmé [11]. Výhodná je orientace dle předoperačního USG nebo scintigrafického zobrazení lymfatických uzlin, pokud je provedeno. Diskutována je rovněž technika provedení lymfadenektomie, to zda provádět en-block resekci, či jednotlivý odběr uzlin („cherry/berry“ picking). Důležitost především revize centrálního krčního kompartmentu (IV) byla zmíněna, ostatních (laterální kompartmenty II–IV, zadní triangl V) až v případě průkazu metastatického postižení lymfatických uzlin [18,19]. Schéma krčních kompartmentů ukazuje obrázek. Soudíme tak, že možné komplikace krční především en-block lymadenektomie (krvácení, poranění nervů, slinné žlázy s píštělí či chylózní píštěl) nevyvažují její přínos. V našem souboru je lymfadenektomie krčních uzlin v relativně malém zastoupení (8,3 %), a přesto jsou výsledky celkového přežití dobré, srovnatelné s ostatními soubory.
Image 1. Krční kompartmenty Fig. 1: Neck compartments 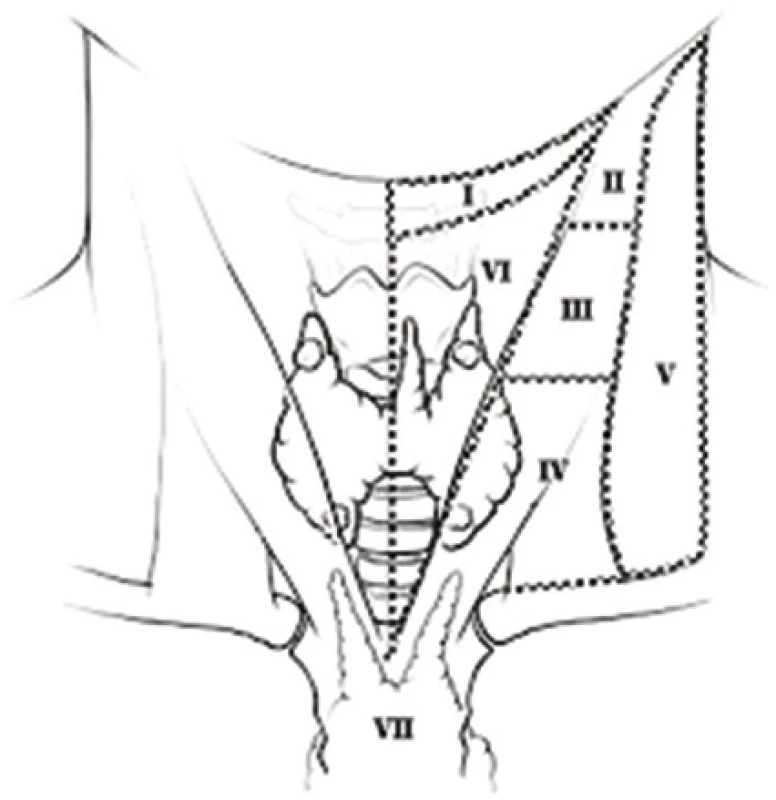
Rozporuplný je pohled na pooperační histologii, kdy chirurgové žádají patologa o peroperační hodnocení a dle výsledku volí další postup (dokončení totální tyreoidektomie, lymfadenektomie). Závěr vyšetření však nemůže být stoprocentní, zmražení tkáně štítné žlázy vede ke změně folikulárních buněk. Jádra buněk se zvětší a odbarví oproti standardnímu zpracování, což může imitovat nádorovou tkáň a naopak dochází i k falešně negativnímu závěru [20]. V našem souboru specificita peroperační histologie nebyla ani 50% a v posledních letech od ní ustupujeme.
Závěr
Karcinom štítné žlázy bývá i v současných zobrazovacích možnostech nejčastěji náhodným operačním nálezem v časné fázi onemocnění. Dokazuje to správnost trendu brzké indikace operační léčby a kvalitu endokrinologické péče. Prognóza a přežití karcinomu štítné žlázy s výjimkou anaplastické formy zůstává dobrá, operační riziko, zejména poranění zvratného nervu, úměrné povaze onemocnění.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Doc. MUDr. Jarmil Šafránek, Ph.D
Čechova 535
337 01 Rokycany
e-mail: safranek@fnplzen.cz
Sources
1. Staniforth JUL, Erdirimanne S, Eslick GD. Thyroid carcinoma in Graves’ disease: A meta-analysis. International Journal of Surgery 2016;27 : 118−25.
2. Jin J, Wilhelm SM, McHenry CR. Incidental thyroid nodule: patterns of diagnosis and rate of malignancy. The American Journal of Surgery 2009;197 : 320−4.
3. Bavor P, Neumann J, Smutný S, et al. Anaplastický karcinom štítné žlázy. Rozhl Chir 2012;91 : 550−3.
4. Choi H, Kasaian K, Melck A, et al. Papillary thyroid carcinoma: prognostic significance of cancer presentation. The American Journal of Surgery 2015;210 : 298−301.
5. McConahey WM, Hay ID, Woolner LB, et al. Papillary thyroid cancer treated at the Mayo Clinic, 1946 through 1970: initial manifestations, pathologic findings, therapy, and outcome. Mayo Clin 1986;61 : 978−96.
6. Cooper DS, Doherty GM, Haugen BR, et al. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2006;16 : 109−42.
7. Vlček P, Nováková D, Vejvalka J, et al. Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy. Vnitř Lék 2015;61 : 769−77.
8. Polistena A, Monacelli M, Lucchini R, et al. Thyroid anaplastic carcinoma: the impact of multi modality treatment on survival. the experience of a referral centre for endocrine surgery, Minerva Chir 2014;69 : 261−9.
9. Conzo G, Avenia N, Bellastella G, et al. The role of surgery in the current management of differentiated thyroid cancer. Endocrine 2014;47 : 380−8.
10. Conzo G, Calo PG, Sinisi AA, et al. Impact of prophylactic central compartment neck dissection on locoregional recurrence of differentiated thyroid cancer in clinically node-negative patients: A retrospective study of a large clinical series. Surgery 2014;155 : 998−1005.
11. Dvořák J. Chirurgická anatomie a technika operací štítné žlázy. Praha 1995;168−70.
12. Lundgren CI, Hall P, Dickman PW, et al. Clinically significant prognostic factors for differentiated thyroid carcinoma: a population-based, nested case-control study. Cancer 2006;106 : 524−31.
13. Dudešek B, Gatěk J, Duben J, et al. Lymfadenektomie u papilárního karcinomu štítné žlázy. Rozhl Chir 2010;89 : 443−7.
14. Beasley NJP, Lee J, Eski S, et al. Impact of nodal metastases on prognosis in patients with well-differentiated thyroid cancer. Arch Otolaryngol Head Neck Surg 2002;128 : 825−28.
15. Wada N, Suganuma N, Nakayama H, et al. Microscopic regional lymph node status in papillary thyroid carcinoma with and without lymphadenopathy and its relation to outcomes. Langenbeck‘s Arch. Surg 2007; 392 : 417−22.
16. Hughes CJ, Shaha AR, Shah JP, et al. Impact of lymph node metastasis in differentiated carcinoma of the thyroid: a matched-pair analysis, Head Neck 1996;18 : 127−32.
17. Carling T, Carty SE, Ciarleglio MM, et al. American Thyroid Association design and feasibility of a prospective randomized controlled trial of prophylactic central lymph node dissection for papillary thyroid carcinoma. Thyroid 2012;22 : 237−44.
18. Polistena A, Monacelli M, Lucchini R, et al. Surgical morbidity of cervical lymphadenectomy for thyroid cancer. A retrospective cohort study over 25 years. International Journal of Surgery 2015;21 : 128−134.
19. Palazzo FF, Gosnell J, Savio R, et al. Lymphadenectomy for papillary thyroid cancer: Changes in practice over four decades EJSO 2006;32 : 340–4.
20. Bishop JA. Pitfalls in the surgical pathologic diagnosis of papillary thyroid carcinoma. Diagnostic Histopathology 2016;22 : 191−8.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2016 Issue 11-
All articles in this issue
- Možnost eliminace axilárních disekcí u pacientek s karcinomem prsu pomocí neoadjuvantní léčby
- Karcinom štítné žlázy, desetiletý soubor
- Transplantace allogenního kostního štěpu v léčbě rozsáhlých post-sternotomických defektů – 6 let zkušeností s metodou
- Neobvyklý případ mezenteriální abscedující lymfadenitidy
- Vzácné maligní nádory apendixu: léčba metastáz do jater − kazuistiky
- Mechanický ileus jako následek jizevnaté stenózy tenkého střeva
- Zlomeniny celého glenoidu
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neobvyklý případ mezenteriální abscedující lymfadenitidy
- Vzácné maligní nádory apendixu: léčba metastáz do jater − kazuistiky
- Zlomeniny celého glenoidu
- Transplantace allogenního kostního štěpu v léčbě rozsáhlých post-sternotomických defektů – 6 let zkušeností s metodou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

