-
Medical journals
- Career
Neoadjuvantní chemoterapie a chirurgická léčba u pokročilých stadií nemalobuněčného karcinomu plic
Authors: M. Szkorupa; J. Klein 1; T. Bohanes; Č. Neoral; V. Kolek 2; I. Grygárková 2
Authors‘ workplace: I. chirurgická klinika FN a LF UP Olomouc, přednosta: doc. MUDr. Č. Neoral, CSc. ; Krajská nemocnice T. Bati, a. s., Zlín, primář: prof. MUDr. J. Klein, Ph. D. 1; Klinika plicních nemocí a tuberkulózy FN a LF UP Olomouc, přednosta: prof. MUDr. V. Kolek, DrSc. 2
Published in: Rozhl. Chir., 2011, roč. 90, č. 8, s. 433-439.
Category: Monothematic special - Original
Overview
Úvod:
Karcinom plic se řadí v České republice na první místa jak v incidenci, tak v mortalitě. Souvisí to především s diagnostikou této nemoci v pokročilých stadiích a tudíž limitovanou možností výběru radikální terapie. Pětileté přežívání u nemocných operovaných ve stadiu IIIA je nízké a nedosahuje ani 20 %. V souvislosti s těmito výsledky a rozvojem systémové chemoterapie v 90. letech se objevila snaha ovlivnit lokálně pokročilé onemocnění předřazením systémové chemoterapie před samotný resekční výkon – indukční chemoterapií, jejíž přínos však na rozdíl od adjuvantní chemoterapie zůstává stále nejasný.Cíl:
Analýza nemocných s nemalobuněčným karcinomem plic (NSCLC) stadia III A-B, operovaných na I. chirurgické klinice FN a LF UP Olomouc v letech 2000–2008, kteří prodělali předoperační chemoterapii, spolu s výsledky nemocných stadia III A-B diagnostikovaných až po operaci na základě histologického nálezu. Hodnoceno je tříleté a pětileté přežívání a medián přežívání v obou skupinách.Výsledky:
Nebyl zjištěn statisticky významný rozdíl v přežívání mezi oběma skupinami.Závěr:
Neoadjuvantní chemoterapie je stále kontroverzní otázkou v léčbě NSCLC. Její zpočátku slibné výsledky nebyly v pozdějších studiích jednoznačně potvrzeny a její role zůstává nadále otázkou dalších rozsáhlejších randomizovaných studií.Klíčová slova:
nemalobuněčný karcinom plic – chirurgická léčba – neoadjuvantní chemoterapieÚVOD
Karcinom plic zaujímá v České republice jedny z prvních míst v incidenci i mortalitě onemocnění. V roce 2006 vykazoval u mužů nejvyšší incidenci (90/100 000) i mortalitu (81/100 000), u žen zaujímal třetí místo – incidence (31/100 000), mortalita (27,6/100 000). Zatímco u mužů má vývoj standardizované incidence a mortality pomalu klesající tendenci, u žen naopak roste, nicméně stále je výskyt této nemoci u mužů 3,5x vyšší než u žen [1]. Jedním z hlavních důvodů vysoké úmrtnosti je pozdní diagnostika nemoci. Časná stadia I-II jsou diagnostikována v 15–20 % případů, naopak ve stadiu IV přesahuje počet případů 40 %. Radikální metodou léčby nemocných s NSCLC je léčba chirurgická. Dává nemocným největší šanci na dlouhodobé přežívání. Je indikována u časných stadií nemoci I-II a u vybraných stadií nemoci IIIA-B s potenciálně resekabilním nádorem a bez masivního metastatického postižení lymfatických uzlin (bulky disease) [2]. V těchto stadiích překročila nemoc lokální hranice kontroly a chirurgická léčba může být jen jednou z modalit terapie, spolu se systémovou chemoterapií nebo radioterapií. Pětileté přežívání nemocných ve stadiu IIIA po radikální operaci nepřesahuje 20 % a z tohoto důvodu směřuje největší snaha o zlepšení výsledků přežívání zvláště do oblasti systémové chemoterapie, protože naprostá většina nádorových relapsů se manifestuje tvorbou metastáz, které nelze jinou léčbou ovlivnit [3].
V souvislosti se zavedením cytostatik III. generace v 90. letech (Paklitaxel, Docetaxel, Vinorelbin, Gemcitabin, Irrinotecan), u kterých bylo zaznamenáno zlepšení odpovědi na léčbu i prodloužení doby přežívání oproti dříve používaným platinovým derivátům, se zvýšil zájem o indukční i adjuvantní chemoterapii u NSCLC. Indukční chemoterapie si klade za cíl cytoredukci primárního nádoru, a tím dosažení operability, „sterilizaci“ regionálních uzlin, zničení vzdálených mikrometastáz a v konečném důsledku tedy zlepšení možnosti prodloužení života, nebo trvalého vyléčení. Předpokladem je potenciálně resekabilní nádor a použití cytostatika s prokázanou aktivitou u NSCLC a zároveň i nízkou plicní toxicitou.Výhodou indukční chemoterapie je poměrně dobrá tolerance, možnost časné kontroly mikrometastáz a snadnější průnik cytostatika do primárního nádoru. Nevýhodou pak navození chemorezistence na dané cytostatikum, odložení léčby, možnost nádorové progrese (5–10 %) a také vyšší pooperační morbidita a letalita [4, 5].
Indukční chemoterapie by tedy teoreticky měla být indikována u lokálně pokročilých variant NSCLC. Stadium IIIA a III B však představuje poměrně heterogenní skupinu lokálně pokročilého NSCLC [6] (Tab. 1).
Table 1. Stadium III NSCLC: podskupiny 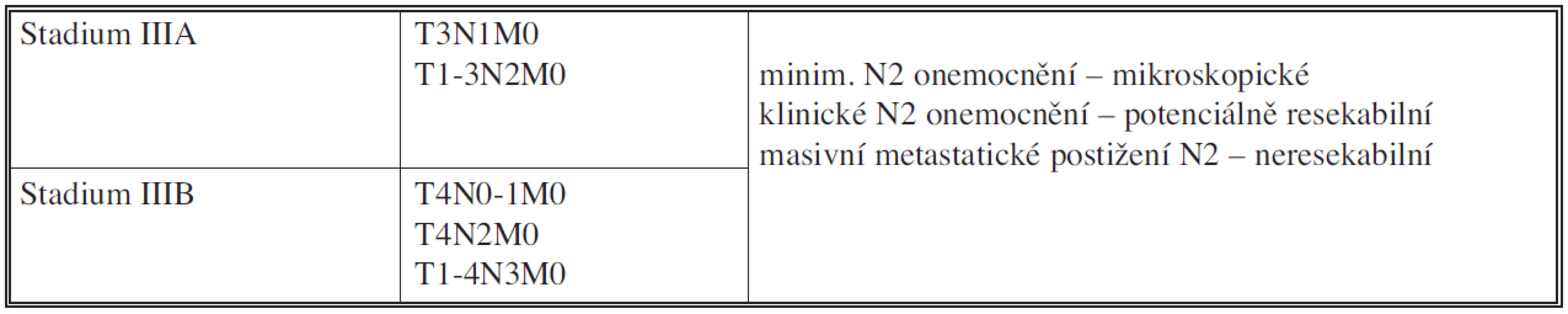
U stadia IIIA může být tedy N2 postižení vyjádřeno jen mikroskopicky (při předoperačním stagingu nezjistitelné), N2 postižení vyjádřené a diagnostikovatelné při předoperačním stagingu (PET CT, EBUS, FNAB, TBNA, MS,TS) a je potenciálně resekabilní, a N2 neresekabilní stadium, vyjádřené masivním metastatickým postižením mediastinálních uzlin. Pokud je N2 postižení detekované až při operaci při negativním předoperačním stagingu, měla by být radikální resekce dokončena s předpokladem negativních resekčních okrajů a provedením systematické disekce mediastinálních uzlin, přičemž uzlina odebraná z nejvyšší mediastinální pozice by měla být negativní (kompletní, tedy R0 resekce) [7].
Z uvedeného také vyplývá, že důsledný primární staging, stejně tak, jako restaging po případné neoadjuvatní chemoterapii, je velmi důležitý jak z hlediska stanovení správné terapie, tak i z hlediska prognózy nemoci. Odpověď na indukční chemoterapii, a to především mediastinální downstaging, je jedním ze závažných prognostických faktorů pro další přežívání [8].
MATERIÁL A METODA
Na I. chirurgické klinice FN a LF UP Olomouc ročně provádíme 70–90 anatomických resekcí pro karcinom plic. Dalších 25–30 diagnostických výkonů je pro stejnou diagnózu k ověření stagingu bronchogenního karcinomu.
Provedli jsme retrospektivní analýzu nemocných operovaných na naší klinice v letech 2000–2008 s diagnózou NSCLC, vstupně diagnostikovaných ve stadiu IIIA-IIIB, kteří prodělali neoadjuvantní chemoterapii s následnou chirurgickou resekcí. Další sledovanou skupinou byli nemocní stadia IIIA-IIIB, diagnostikovaní až na základě pTNM klasifikace po chirurgické resekci, kteří tudíž neoadjuvantní chemoterapii neprodělali.
K neoadjuvantní chemoterapii byli vybíráni nemocní se stadiem nemoci IIIA (výjimečně IIIB – T4N1) s pozitivním nálezem ve stejnostranných mediastinálních uzlinách. Pozitivita uzlin byla hodnocena podle nálezu na CT-scanu (uzliny větší než 1 cm ve svém kratším průměru), podle PET CT, transbronchiální biopsie, nebo ověřením při mediastinoskopii či torakoskopii. Nemocní prodělali 2–4 cykly indukční chemoterapie, ve dvojkombinaci cytostatik, z nichž jedno je na platinové bázi a druhé cytostatikum III. generace (Paklitaxel, Docetaxel, Vinorelbin, Gemcitabin). Účinek chemoterapie byl hodnocen při kontrolním vyšetření – restagingu – podle CT nebo PET CT vyšetření. Remediastinoskopie nebyla v našem souboru provedena.
K operaci byli následně indikováni nemocní s potenciálně resekabilním nádorem bez nádorové nebo lymfatické progrese a bez prokázané generalizace. Všichni nemocní byli radikálně operováni v rozsahu od lobektomie po rozšířenou pulmektomii se systematickou mediastinální lymfadenektomií. Resekát i uzliny byly histopatologicky vyšetřeny a byla hodnocena odpověď na léčbu v parametrech T a N v systému TNM klasifikace. V dalším průběhu byli všichni pacienti indikováni k adjuvantní chemoterapii a v závislosti na pozdější progresi nemoci k dalším modalitám léčby (II. a III. linie chemoterapie nebo biologické léčby, radioterapie). Hodnoceno bylo tří - a pětileté přežívání a medián přežití nemocných.
VÝSLEDKY
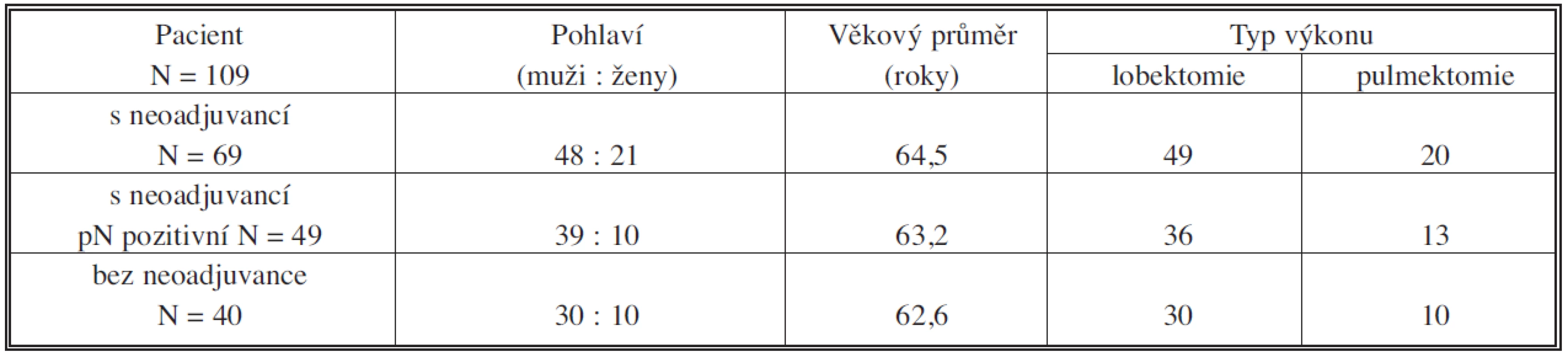
Celkově bylo v letech 2000–2008 operováno na I. chirurgické klinice FN a LF UP Olomouc 109 pacientů ve stadiu IIIA-IIIB NSCLC. Rozdělení podle pohlaví, věkového průměru, typu výkonu a podle podstoupené neoadjuvantní chemoterapie ukazuje tabulka 2.
Celkem 69 pacientů podstoupilo před resekčním výkonem indukční chemoterapii, z toho 40 pacientů (58 %) na základě histologického vyšetření mediastinálních uzlin (TBB, mediastinoskopie, torakoskopie), 49 pacientů mělo pozitivní histologický výsledek postižení mediastinálních uzlin – N2 i po resekci. U 40 pacientů bylo stadium IIIA-IIIB stanoveno až po resekčním výkonu (neprodělali indukční chemoterapii) na základě histologického vyšetření uzlin při mediastinální lymfadenektomii.
Indukční chemoterapii i následnou léčbu po plicní resekci pacienti prodělali na příslušném pneumoonkologickém pracovišti (Klinika plicních nemocí a tuberkulózy FN Olomouc, TRN oddělení Ostrava-Vítkovice, Šumperk, Krnov, Kroměříž). Na těchto pracovištích byli pacienti i dispenzarizováni.
Hodnotili jsme parametry tří a pětiletého přežívání a medián přežívání a srovnávali dvě skupiny souborů.
V první skupině jsme srovnávali celý soubor pacientů, kteří prodělali neoadjuvantní chemoterapii N = 69 (včetně hodnocení stadia jen na podkladě paraklinických vyšetření – CT, PET CT), se souborem pacientů bez neoadjuvantní chemoterapie N = 40 (Tab. 3, 4, 5; Graf 1).
Table 3. Soubor s neoadjuvancí vs. bez neoadjuvance 
Table 4. Soubor s neoadjuvancí vs. bez neoadjuvance – průměr a medián přežívání 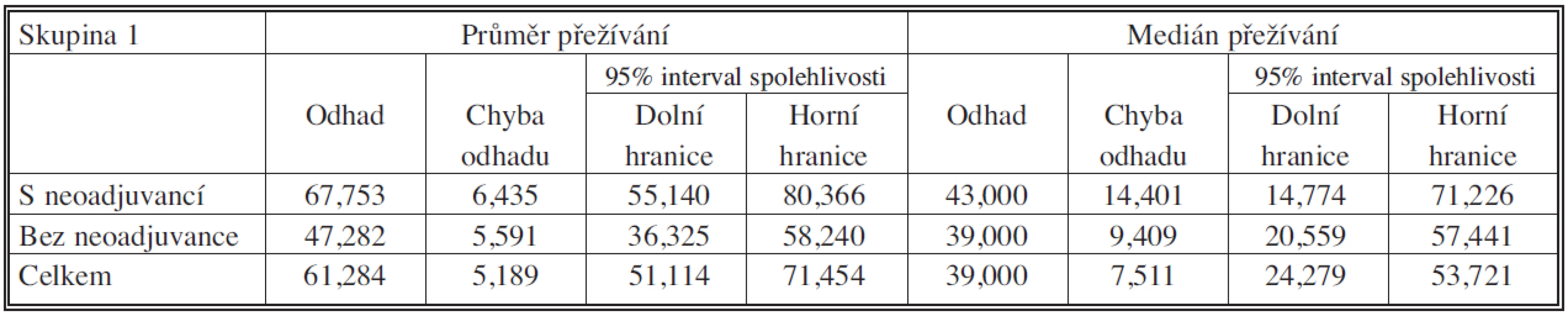
Table 5. Soubor s neoadjuvancí vs. bez neoadjuvance – tří- a pětileté kumulativní přežívání 
Medián přežívání byl v souboru s neoadjuvancí 67,753 měsíců (95% CI – interval spolehlivosti – 55,140 – 80,366 měsíců), v souboru bez neoadjuvance 47,282 měsíců (95% CI – interval spolehlivosti – 36,325 – 58,240 měsíců). Tříleté a pětileté přežívání v souboru s neoadjuvancí bylo 55,7 % resp. 46,0 %. V souboru bez neoadjuvance 52,3 % resp. 34,5 %. Podle porovnání přežívání testem Log Rank p = 0,219 – nebyl rozdíl v této skupině signifikantní.
V druhé skupině jsme srovnávali soubor pacientů, kteří prodělali neoadjuvantní chemoterapii a byli pN pozitivní N = 49 (pozitivní mediastinální uzliny po resekci), se souborem pacientů bez neoadjuvantní chemoterapie N = 40 (Tab. 6, 7, 8; Graf 2).
Table 6. Soubory s neoadjuvancí pN pozit. vs. bez neoadjuvance 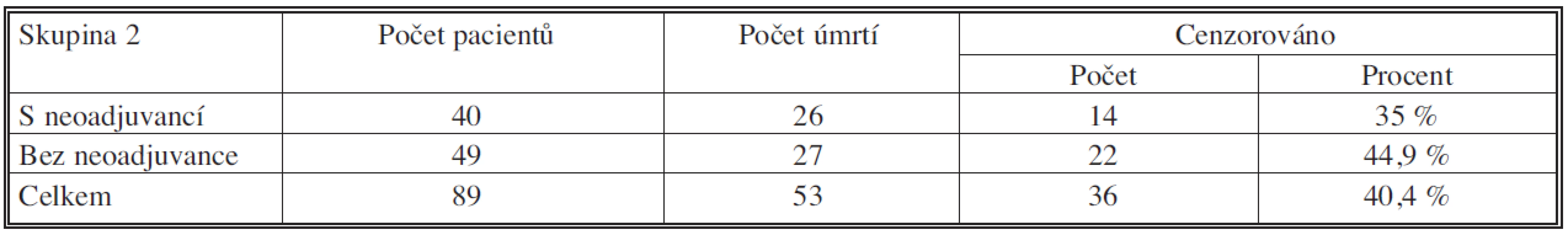
Table 7. Soubory s neoadjuvancí pN pozit. vs. bez neoadjuvance – průměr a medián přežíván 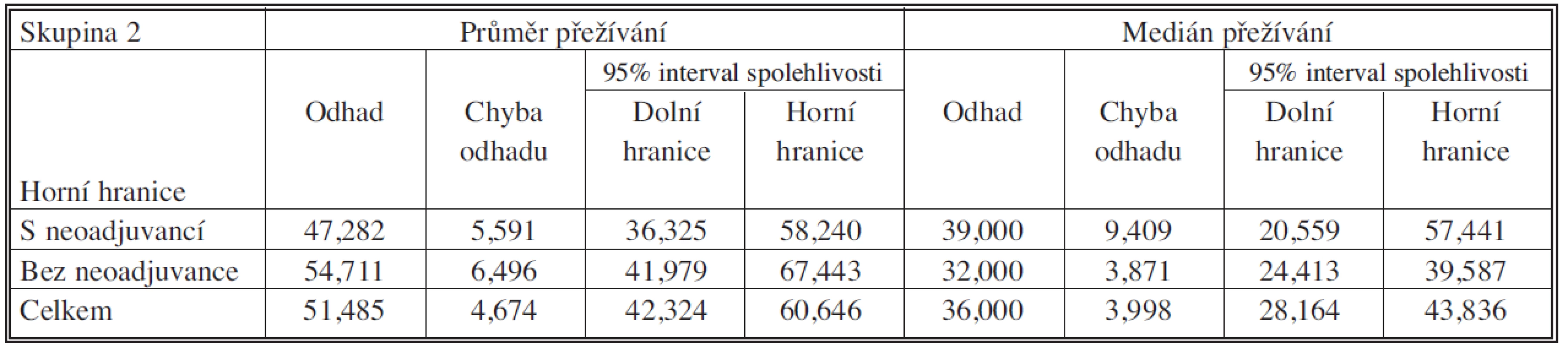
Table 8. Soubory s neoadjuvancí pN pozit. vs. bez neoadjuvance – tří- a pětileté kumulativní přežívání 
Medián přežívání byl v souboru s neoadjuvancí pN pozit 54,711 měsíců (95% CI – interval spolehlivosti – 41,979 – 67,443 měsíců), v souboru bez neoadjuvance 47,282 měsíců (95% CI – interval spolehlivosti – 36,325 – 58,240 měsíců). Tříleté a pětileté přežívání v souboru s neoadjuvancí bylo 46,3 % resp. 34,0 %. V souboru bez neoadjuvance 52,3 % resp. 34,5 %. Podle porovnání přežívání testem Log Rank p = 0,782 – nebyl rozdíl v této skupině signifikantní.
Podle výsledků nebylo zjištěno statisticky významné zlepšení přežívání při použití neoadjuvantní chemoterapie ani v jedné skupině porovnávaných pacientů. V hodnocení přežívání nebyl zohledněn např. typ NSCLC, rozsah výkonu, komorbidity pacienta, rozsah mediastinálního postižení lymfatických uzlin. Nicméně parametry tří - a pětiletého přežívání dosahují velice nadějných výsledků. Zdá se tedy, že u limitované skupiny pacientů s pokročilým stadiem IIIA NSCLC může kombinovaná terapie přinést zlepšení výsledků léčby těchto pokročilých stadií.
DISKUSE
Karcinom plic se řadí mezi zhoubná onemocnění s nejhorší prognózou vůbec. Jen cca 20 % nemocných je diagnostikováno v časných stadiích nemoci, dalších až 80 % spadá do stadia III-IV. Pětileté přežívání u časných stadií I-II se po radikální resekci pohybuje od 50–80 %, zatímco u stadia III je menší než 20 %. Za posledních 30 let se medián přežití u pokročilých stadií (IV) zvýšil jen o 6 měsíců. Pětileté přežívání se pohybuje od 1–5 % [9].
I z těchto důvodů se zájem, kromě časné diagnostiky NSCLC, soustřeďuje na zlepšení možností léčby NSCLC v pozdějších stadiích. Limity chirurgie jsou u karcinomu plic prakticky definované, cesta ke zlepšení výsledků se tedy hledá v oblasti systémové léčby. V 90. letech se s objevem cytostatik III. generace, která vykázala vyšší odezvu na léčbu i delší přežití, než do té doby užívané preparáty na platinové bázi, objevil zvýšený zájem jak o indukční, tak i o adjuvantní chemoterapii. Systémová terapie může postihnout i mikroskopické, v době diagnózy nedetekovatelné metastázy a tím zvýšit možnost vyléčení. U pokročilých stadií nemá kurativní charakter, ale má cytoreduktivní účinek a může „sterilizovat“ regionální uzliny, a tak prodloužit dobu přežívání [10].
Zlepšená odpověď na systémovou léčbu v 90. letech přinesla s sebou řadu studií, týkajících se jak indukční, tak i adjuvantní chemoterapie. První randomizované studie potvrdily benefit neoadjuvantní chemoterapie. Rosell et al. provedl randomizovanou studii nemocných s NSCLC ve stadiu IIIA, v níž jedna skupina byla léčena pouze chirurgickou resekcí s následnou radioterapií a druhá skupina byla navíc léčena třemi cykly předoperační chemoterapie. Rozdíl s mediánu přežití i v pětiletém přežívání byl statisticky významný ve prospěch skupiny s chemoterapií [11].
I v další podobné studii autorů Roth et al. bylo randomizováno 60 nemocných ve stadiu IIIA NSCLC. První skupina nemocných prodělala operační léčbu, u druhé předcházela resekci chemoterapie. I v této studii byly výsledky u skupiny s předoperační chemoterapií statisticky lepší, než u skupiny se samotnou resekcí [12]. Tyto studie, prokazující benefit indukční chemoterapie, byly později kritizovány jednak pro malý počet a nesourodé skupiny nemocných s horší předpokládanou prognózou u chirurgické skupiny (mutace K-ras) [5, 9, 14].
Další randomizované studie již neprokázaly jednoznačný benefit neoadjuvantní chemoterapie. Depierre et al. zařadil do studie 355 pacientů s NSCLC ve stadiích IB-IIIA, kteří byli randomizováni a ve dvou ramenech porovnáváno užití neoadjuvantní chemoterapie s následnou chirurgickou resekcí versus samotná chirurgická resekce. Medián přežití (37 x 26 měsíců) stejně jako disease free interval (26,7 x 12,9 měsíců) byl delší ve prospěch skupiny s chemoterapií, ale nebyl statisticky významný. Významný byl rozdíl v přežívání u pacientů s N0-N1 onemocněním, kteří prodělali chemoterapii, naopak prakticky žádný u pacientů s N2 onemocněním [13, 15].
Stejně tak i další studie CALBG (The Cancer and Leucemia Group B) nebo japonská studie JCOG 2000 ( Japan Clinical Oncology Group) neprokázaly významný benefit neoadjuvance. V nedávné době referované výsledky dalších randomizovaných studií také nepřinesly jednoznačnou odpověď na otázku benefitu neoadjuvantní chemoterapie. Studie americké skupiny SWOG 9900 srovnávala užití samotné chirurgické resekce vůči indukční chemoterapii s následnou resekcí u pacientů s NSCLC ve stadiích IB-IIIA. Byla předčasně ukončena v důsledku výsledků jiných studií, které jednoznačně prokázaly prospěch pooperační adjuvantní chemoterapie oproti samotné chirurgické resekci. Tato byla následně doporučena jako standard léčby NSCLC ve stadiích IB-IIIA po chirurgické resekci (ASCO 2005). Výsledky prokázaly statisticky nevýznamné delší pětileté přežívání u nemocných v rameni s indukční terapií (50 % x 43 %) [16].
Studie španělské skupiny NATCH (Spanish Lung Cancer Group) porovnává výsledky předoperační a pooperační chemoterapie u pacientů ve stadiích IB – IIIA (T3N1). Nemocní ( cílový počet 624) byli randomizováni do tří skupin: tři cykly chemoterapie před nebo po chirurgické resekci a třetí skupina podstoupila samotnou resekci. Výsledky studie, na které se podílelo 42 pracovišť z pěti evropských zemí, byly zveřejněny na 13. World Conference of Lung Cancer 8/2009 (IASLC). Nebyl zjištěn významný rozdíl v pětiletém přežívání mezi jednotlivými skupinami (44 % chirurgická resekce, 44,5 % adjuvantní chemoterapie, 46,6 % předoperační chemoterapie). Nebyl zjištěn ani statisticky významný rozdíl v pětiletém disease-free intervalu, i když nejlepší výsledky měla skupina s předoperační chemoterapií (38,3 % s předoperační chemoterapií, 36,6 % s adjuvantní chemoterapií a 34 % s operací). Při dalších analýzách studie na základě prognostických faktorů měli nejlepší výsledky nemocní ve stadiích II-IIIA v rameni s předoperační chemoterapií. Pětileté přežívání bylo 36,6 % s předoperační chemoterapií, 31 % s adjuvantní chemoterapii, a 25 % se samotnou chirurgickou resekcí. Neoadjuvantní chemoterapii (paklitaxel/carboplatina) podstoupilo 97 % pacientů, naproti tomu adjuvantní léčbu mohlo podstoupit jen 66 % pacientů. Obecně byla indukční chemoterapie dobře tolerována a nebyly zjištěny rozdíly v nežádoucích účincích. Celkově studie prokázala určitý benefit ve prospěch předoperační chemoterapie, ale tento nebyl statisticky významný [17].
Z českých autorů se problematikou neoadjuvantní terapie zabýval Pešek, Špásová a Kolek, který zveřejnil výsledky studie, věnující se neoadjuvantní chemoterapii u hraničně operabilních stadií IIIA NSCLC v kombinaci s adjuvantní chemoterapií na základě testů chemorezistence po resekčním výkonu. Prokázal dobrou snášenlivost režimů indukční chemoterapie (Karboplatina + Vinorelbin, Karboplatina + Paklitaxel) s downstagingem u více než 50 % nemocných. Tříleté přežívání dosáhlo 47 %, pětileté přežívání pak 35,7 % [3, 18].
Z výsledků těchto studií vyplývá, že kombinace indukční a adjuvantní chemoterapie spolu s resekcí mohou poskytovat dobré výsledky u pacientů s pokročilým stadiem NSCLC – IIIA, nicméně benefit samotné indukční chemoterapie pro celkovou léčbu NSCLC je velmi těžké definovat. Ten lze prakticky stanovit jen v případě downstagingu primárního nádoru a dosažení operability nádoru, protože ovlivnění případných mikrometastáz je těžko prokazatelné.
V řadě studií bylo také hodnoceno porovnání předoperační a pooperační chemoterapie. Na konferenci ASCO 2008 byl zveřejněn systematický přehled 31 randomizovaných studií (21 týkajících se adjuvantní a 10 indukční chemoterapie). V tomto přehledu a výsledcích nebyly zjištěny žádné statisticky významné rozdíly v disease-free intervalu a celkovém přežívání. Z těchto výsledků se zdá, že načasování chemoterapie u operabilních stadií NSCLC má jen malý vliv, nicméně ve většině případů je předoperační chemoterapie mnohem lépe snášena a ve větším procentu případů i dokončena, na rozdíl od adjuvantní chemoterapie, kde hraje velkou roli prodělaný resekční výkon, spojený se zvýšenou morbiditou a tudíž riziko oddálení chemoterapie, nebo její nedokončení [9, 15].
Další diskutovanou otázkou je role chirurgické resekce u těchto pokročilých stadií. Dosažení R0 resekce, rozsah resekce, zvýšení morbidity a mortality u nemocných po neoadjuvantní chemoterapii byly v řadě studií také sledováno a vyhodnocováno [9, 15]. Mediastinální downstaging a dosažení R0 resekce se jeví jako velmi důležitý prognostický faktor přežívání. U pacientů s reziduální N2 nemocí po indukční chemoterapii a následné resekci se pohybuje pětileté přežívání od 0–15 %. V jiných studiích se pohybuje čtyřleté přežívání pacientů po indukční chemoterapii a následné resekci s pN0-N1 od 35–60 % [19–21].
Z tohoto hlediska je další zásadní prioritou důsledný restaging nemoci po indukční chemoterapii. Určení rozsahu mediastinálního postižení před event. chirurgickou resekcí je nezbytné. Nejběžnější chirurgickou metodou ověření mediastinálního postižení je mediastinoskopie, resp. remediastinoskopie, která ovšem může být technicky obtížná. To je způsobeno fibrózní přestavbou a srůsty v mediastinu po mediastinoskopii, která předcházela indukční terapii. Zvyšuje se tím riziko možných komplikací a také rozsah explorace mediastina. Podle výsledků z renomovaných pracovišť se senzitivita remediastinoskopie pohybuje mezi 70–73 % [22, 23]. Výhodou mediastinoskopie je histologické ověření uzlin, které naopak chybí u zobrazovacích metod. Z těch je v posledních letech nejvíce využívána metoda pozitronové emisní tomografie, fúzovaná s počítačovou tomografií – PET CT. I tato metoda má však své slabiny. Podle uváděných výsledků se pohybuje její citlivost jen kolem 50–60 %, s dobrou specificitou kolem 85–90 %. Příčiny nízké citlivosti nejsou zcela jasné, ale může se na tom podílet zmenšení nádorové masy obklopené fibrózou po indukční terapii pod rozlišovací schopnost PET, snížená perfuze nádorových buněk po chemoterapii, a také časový interval mezi indukční terapií a PET. Další možností ke stanovení stagingu je využití endoskopických metod (EBUS, FNAB, TBNA) [24]. Přehled využívaných metod ke stanovení stagingu, včetně výtěžnosti ukazuje tabulka 9.
Table 9. Výtěžnost jednotlivých metod ke stanovení stagingu lymfadenopatie mediastina pacientů s bronchogenním karcinomem 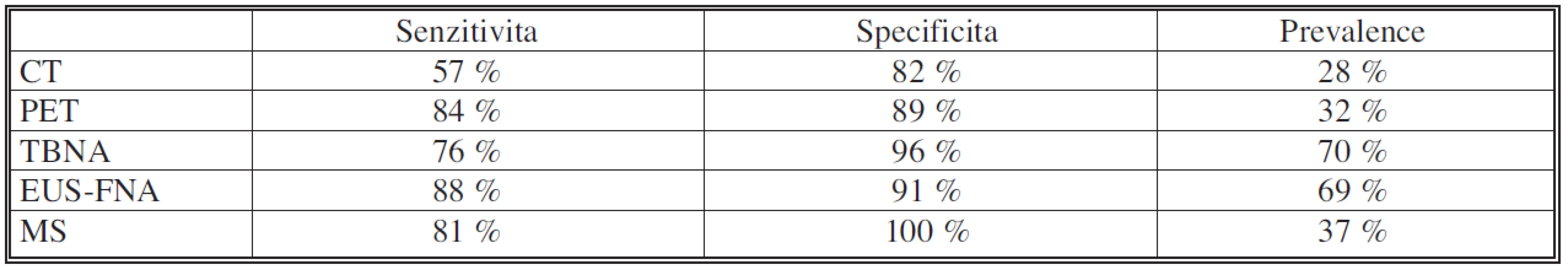
Rozsah samotné chirurgické resekce je na druhé straně významným faktorem morbidity a mortality nemocných po prodělané indukční chemoterapii.
Pneumonektomie bývá zatížena vyšším procentem morbidity i mortality, i když některé analýzy tento ukazatel nepotvrdily. Mansour retrospektivně vyhodnotil 306 pacientů po pneumonektomii a nenašel výraznější rozdíly mezi skupinou bez a s indukční chemoterapií [25]. Naproti tomu Martin et al. měl ve skupině 479 pneumonektomií po indukční chemoterapii mortalitu 23,9 % ! Ve většině případů se jednalo o pravostrannou pneumonektomii [26].
Radioterapie bývá součástí schématu neoadjuvantní léčby standardně u Pancoastova nádoru, ale bývá na některých pracovištích zařazena i v léčbě pokročilých stadií N2 NSCLC. Výhodu radioterapie vidí na jedné straně ve zlepšení lokální odpovědi tumoru na léčbu, která bývá spojena i se zlepšením celkového přežívání. A na druhé straně i v případě, že nedojde k chirurgické resekci pro nedostatečnou odpověď na léčbu, nebo pro nedostatečné rezervy pacienta, nevede tento postup k oddálení onkologické terapie [27].
Různí se též názory na dávku předoperační radioterapie. Většina pracovišť používá nižší dávky radioterapie z důvodu vyššího výskytu komplikací po následné chirurgické resekci (bronchopleurální píštěle). Cerfolio et al. ve své retrospektivní analýze pacientů po neoadjuvantní radiochemoterapii neprokázal vyšší výskyt komplikací při radikální dávce 60 Gy a prokázal lepší odpověď na léčbu při použití této dávky [28].
Adjuvantní radiochemoterapie by měla být vyhrazena pacientům s ověřeným klinickým reziduálním N2 postižením uzlin, nebo s progresí nemoci. U této skupiny pacientů nejsou výsledky po chirurgické resekci příznivé a jsou s uvedenou modalitou radiochemoterapie srovnatelné [9].
ZÁVĚR
Kombinovaná léčba, zahrnující neoadjuvantní chemoterapii, chirurgickou resekci a adjuvantní chemoterapii může mít u selektivní skupiny pacientů s pokročilým stadiem IIIA-IIIB NSCLC svůj přínos. Měla by mít však určitá nepodkročitelná kritéria indikace. Zahrnují co nejpřesnější staging nemoci s ověřením postižených mediastinálních uzlin, indukční chemoterapii nebo radiochemoterapii v současných používaných režimech, zásadní je důsledný restaging po této terapii, s co nejpřesnějším stanovením event. reziduálního postižení uzlin, a s na to navazující přísně indikovanou chirurgickou resekcí, splňující kritéria R0 resekce. Kontraindikací resekce by mělo být, kromě obecně známých faktorů (věk, komorbidity, ventilační rezerva, progrese nemoci), i ověřené reziduální postižení uzlin.
MUDr. Marek Szkorupa
Šmeralova
772 00 Olomouc
e-mail: szkorupm@fnol.cz
Sources
1. ÚZIS ČR, Aktuální informace č. 6/2009.
2. Skřičková, J., Čoupek, P., Babičková, L., et al. Léčebné postupy u nemalobuněčného karcinomu plic. Klinická onkologie, 2008; 21 : 317–329.
3. Kolek, V., Grygárková, I., Hajdúch, M. Long term follow-up of neoadjuvant-adjuvant combination treatment of IIIA stage non-small-cell-lung cancer: results of neoadjuvant carboplatin/vinorelbine and carboplatin/paclitaxel regiment combined with selective adjuvant chemotherapy according to in-vitro chemoresistance test. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub., 2008; 152(2): 259–266.
4. Klein, J. Chirurgie karcinomu plic. Praha, Grada publishing, a.s., 2006.
5. Špásová, I. Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu. Vnitřní lékařství, 2007; 53(6): 715–723.
6. Mountain, C. F. Revisions in the international system for staging lung cancer. Chest, 1997; 111 : 1710–1717.
7. van Schil, P. E., de Waele, M., Hendricks, J. M., Lauwers, P. R. Surgical treatment of stage III non-small cell lung cancer. European Journal of Cancer, 2009; 45 : 106–112.
8. Carretta, A., Ciriaco, P., Melloni, G., et al. Results of surgical treatment after neodajuvant chemotherapy for stage III non-small cell lung cancer. World J. Surg., 2008; 32 : 2636–2642.
9. Gray, J., Sommers, E., Alvelo-Rivera, M., et al. Neoadjuvant chemotherapy of resectable non-small-cell lung cancer. Oncology, 2009; 23(10): 879–886.
10. De Marinis, F., Tedesco, B., Treggiari, S., et al. Role of induction chemotherapy in resectable N2 non-small cell lung cancer. J. Thorac. Oncol., 2007; 2(5): 31–34.
11. Rosell, R., Gomez-Codina, J., Camps, C., et al. A randomized trial comparing preoperative chemotherapy plus surgery with surgery alone in patients with non-small-cell lung cancer. N. Engl. J. Med., 1994; 330(3): 153–158.
12. Roth, J. A., Fossella, F., Komaki, R., et al. A randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-small-cell lung cancer. J. Natl. Cancer Inst., 1994; 86 : 673–680.
13. Depierre, A., Milleron, B., Moro-Sibilot, D., et al. Preoperative chemotherapy followed by surgery compared with primary surgery in resectable stage I (except T1N0), II and IIIa non-small-cell lung cancer. J. Clin. Oncol., 2002; 20 : 247–253.
14. De Marinis, F., Gebbia, V., De Petris, L. Neoadjuvant chemotherapy for stage IIIA – N2 non small cell lung cancer. Ann. Oncol., 2005; 16(4): 116–122.
15. Stinchcombe, T. E., Socinski, M. A. The Role of induction therapy for resectable non-small cell lung cancer. Drugs, 2007; 67(3): 321–333.
16. S9900: Surgery alone or surgery plus induction (ind) paclitaxel/carboplatin (PC) chemotherapy in early stage non-small cell lung cancer (NSCLC): Follow-up on a phase III trial. Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. Vol 25, No. 18S (June 20 Supplement), 2007 : 7520.
17. NATCH Trial Finds No Benefit When Chemo is Added to Surgery in Early-Stage Lung Cancer – 13th World Conference on Lung Cancer (WCLC) July 31 – August 4, 2009; San Francisco, California.
18. Kolek, V., Grygárková, I., Hajdúch, M. Neoadjuvantní chemoterapie u hraničně operabilních stadií IIIA nemalobuněčného karcinomu plic kombinací vinorelbin a karboplatina. Následná cílená adjuvantní chemoterapie. Klinická onkologie 2001; 14 : 55–58.
19. Bueno, R., Richards, W. G., Swanson, S. J., et al. Nodal stage after induction therapy for stage IIIA lung cancer determines patient survival. Ann. Thorac. Surg., 2000; 70 : 1826–1831.
20. Voltolini, L., Luzzi, L., Ghiribelli, C., et al. Results of induction chemotherapy followed by surgical resection in patients with stage IIIA (N2) non-small cell lung cancer: the importance of the nodal down-staging after chemotherapy. Eur. J. Cardiothorac. Surg., 2001; 20 : 1106–1112.
21. Detterbeck, F. C., Socinski, M. A. Induction therapy and surgery for stage IIIIA, B non-small lung cancer. In: Detterbeck, F. C., Socinski, M. A., Rivera, M. et al.: Diagnosis and treatment of lung cancer. W. B. Saunders Comp., 2001 : 267–282.
22. van Schil, P., van der Schoot, J., Poniewierski, J., et al. Remediastinoscopy after neoadjuvant therapy for non-small cell lung cancer. Lung Cancer, 2002; 37 : 281–285.
23. Mateu-Navarro, M., Rami-Porta, R., Bastus-Piulats, R., et al. Remediastinoscopy after induction chemotherapy in non-small cell lung cancer. Ann. Thorac. Surg., 2000; 70 : 391–395.
24. Lardinois, D. Pre - and intra-operative mediastinal staging in non-small-cell lung cancer. Swiss Med. Wkly., 2011 Mar 8;141:w13168. doi: 10.4414/smw.2011.13168.
25. Mansour, Z., Kochetkova, E. A., Ducrocq, X., et al. Induction chemotherapy does not increase the operative risk of pneumonectomy! Eur. J. Cardiothorac. Surg., 2007; 31 : 181–185.
26. Martin, J., Ginsberg, R. J., Abolhoda, A., et al. Morbidity and mortality after neoadjuvant therapy for lung cancer: The risks of right pneumonectomy. Ann. Thorac. Surg., 2001; 72 : 1149–1154.
27. Pisters, K. M., Ginsberg, R. J., Giroux, D. J., et al. Bimodality Lung Oncology Team. Induction chemotherapy before surgery for early-stage lung cancer: a novel approach. J. Thorac. Cardiovasc. Surg., 2000; 119 : 429–439.
28. Cerfolio, R. J., Bryant, A. S., Jones, V. L., Cerfolio, R. M. Pulmonary resection after concurrent chemotherapy and high dose (60Gy) radiation for non small cell lung cancer is safe and may provide increased survival. Eur. J. Cardiothorac. Surg., 2009; 35 : 718–723.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 8-
All articles in this issue
- Neoadjuvantní chemoterapie a chirurgická léčba u pokročilých stadií nemalobuněčného karcinomu plic
- SILS cholecystektómia – analýza súboru prvých 100 pacientov
- Nenádorové stenózy žlučových cest
- Transanální endoskopická mikrochirurgie a její postavení v chirurgii rekta – review
- 1000 laparoskopických operací na kolorektu
- Divertikulární nemoc tračníku
- Biochemický průkaz přítomnosti moči v drénu po chirurgickém výkonu
- Pilonidálny sinus – klasická plastika podľa Limberga alebo modifikovaná verzia?
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pilonidálny sinus – klasická plastika podľa Limberga alebo modifikovaná verzia?
- Divertikulární nemoc tračníku
- Nenádorové stenózy žlučových cest
- Biochemický průkaz přítomnosti moči v drénu po chirurgickém výkonu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career