-
Medical journals
- Career
Laparoskopická distálna pankreatektómia pre neuroendokrinné nádory pankreasu – prvé skúsenosti
Authors: R. Kyčina; B. Edwin 1; L. Šutiak; Ľ. Strelka; P. Szépe 2; A. Mikolajčík; M. Drgová 3; Marek Vojtko; D. Mištuna
Authors‘ workplace: Chirurgická klinika, Univerzitná nemocnica Martin, Slovenská republika, prednosta: doc. MUDr. Dušan Mištuna Ph. D., mim. Prof. ; Intervenčné centrum a chirurgické oddelenie, Rikshospitalet, Oslo, Nórsko 1; Klinika patologickej anatómie, Univerzitná nemocnica Martin, Slovenská republika, prednosta: prof. MUDr. Lukáš Plank, Ph. D. 2; Rádiodiagnostická klinika, Univerzitná nemocnica Martin, Slovenská republika, prednosta: MUDr. Hubert Poláček, Ph. D. 3
Published in: Rozhl. Chir., 2011, roč. 90, č. 3, s. 200-206.
Category: Monothematic special - Original
Overview
Úvod:
Hoci prvú úspešnú laparoskopickú distálnu pankreatektómiu v Martine sme zaznamenali už v roku 2005, až po piatich rokoch sme nadviazali na tento ojedinelý chirurgický výkon. Cieľom tejto práce je prezentovať obe úspešné laparoskopické distálne pankreatektómie u pacientov s neuroendokrinnými nádormi distálnej časti pankreasu.Materiál a metodika:
Laparoskopická distálna resekcia pankreasu je v súčasnosti výzvou mnohých chirurgov zaoberajúcich sa pankreatobiliárnou chirurgiou. Jej klasická „open“ varianta je štandardným chirurgickým výkonom pri nádoroch uložených v tele a chvoste pankreasu. Laparoskopická distálna pankreatektómia spĺňa všetky aspekty radikálnej onkologickej resekcie vrátane lymfadenektómie. Podobne ako otvorená resekcia je často spojená so splenektómiou, ale prináša pre pacienta výrazný benefit vo forme miniinvazivity. V práci prinášame celý operačný postup tohto ešte stále ojedinelého operačného výkonu.Výsledky:
Hoci za posledné 4 mesiace sme operovali laparoskopicky len 2 pacientov prezentujeme aspoň prvé skúsenosti s touto operačnou metódou ako aj dokumentáciu výsledkov operácie.Záver:
Laparoskopická distálna pankreatektómia v rukách skúseného laparoskopického chirurga má šancu stať sa plnohodnotnou náhradou otvoreného výkonu.Kľúčové slová:
distálna pankreatektómia – laparoskopia – neuroendokrinný tumorÚVOD
Distálna resekcia pankreasu je operačný výkon bežne vykonávaný na klinických pracoviskách. Jeho laparoskopická varianta predstavuje náročný výkon laparoskopickej chirurgie a je veľkou výzvou pre mnohých chirurgov pevne etablovaných v pankreatobiliárnej chirurgii. Hoci už v roku 1996 sa v literatúre objavila prvá zmienka o laparoskopickej distálnej resekcii pankreasu od autorov Gagner a kolektív [1], táto operácia dodnes nie je všeobecne uznaná ako najvhodnejší prístup ku operačnému riešeniu tumorov pankreasu [2].
Ešte aj dnes po 15 rokoch od jej svetovej premiéry sa laparoskopická distálna resekcia vykonáva relatívne zriedka a stále je považovaná za elitný chirurgický operačný výkon, najmä z dôvodu technickej náročnosti, dlhého operačného času a dlhej „learning curve“ [2, 3]. Napriek tomu, že Gagnera a spol. nasledovali mnohí ďalší autori (Ammori, Fernandez-Cruz, Cushieri, Vezakis, Lillemoe, Edwin a ďalší), dodnes existujú pochybnosti o adekvátnosti laparoskopického operačného postupu pri distálnej resekcii pankreasu [3].
K distálnej resekcii pankreasu sú indikované pankreatické lézie nachádzajúce sa laterálne od vena mesenterica superior. Relatívne malú časť takýchto indikácií predstavujú neuroendokrinné nádory pankreasu (ďalej NET). NETy sú nádory, ktorých bunky majú schopnosť syntetizovať, uskladňovať a vylučovať hormonálne aktívne látky a súčasne aj schopnosť syntetizovať, uskladňovať a vylučovať bielkovinové substancie s funkciou neuromodulačných a neurotransmiterových látok v centrálnom aj enterickom nervovom systéme [4]. Vznikajú nádorovou transformáciou buď nediferencovaných pluripotentných kmeňových, alebo plne diferencovaných buniek neuroendokrinného systému [5]. NETy pankreasu majú relatívne benígny charakter, no svojou hormonálnou aktivitou môžu spôsobiť život ohrozujúce komplikácie. Podľa výskytu ich delíme na sporadické (väčšinou solitárne) a familárne (väčšinou mnohopočetné, vyskytujúce sa naraz vo viacerých endokrinných žľazách, sú geneticky podmienené). Podľa funkčnosti ich delíme na funkčné a nefunkčné.
Najčastejším typom NETu pankreasu je inzulinóm (50 %) a gastrinóm (20 %), približne 25 % nádorov (ale podľa niektorých autorov sa udáva ich výskyt až do 50 %) je nefunkčných (hormonálne neaktívnych) a zvyšných 5 % predstavujú zvyšné raritné funkčné nádory (VIPóm, glukagonóm, somatostatinóm) [6, 7] (VIP = vazoaktívny intestinálny polypeptid).
Donedávna boli považované za zriedkavé, vyskytujú sa v pomere nižšom ako 1/100 000 obyvateľov, no vďaka diagnostickým pokrokom sa za posledných 30 rokov ich incidencia zvýšila štvornásobne! Familiárne sa vyskytujúce NETy predstavujú približne jednu štvrtinu NETov pankreasu a súvisia so syndrómom mnohopočetnej endokrinnej neoplázie. Až 50 % z nich sú nádory malígne. Zvyšné tri štvrtiny sú nádory so sporadickým výskytom, ale až 70 % z nich predstavuje malígne nádory [6, 7]. Väčšinou rastú pomaly ako solídne nádory, len zriedkavo ako nádory cystické. Ich malígny charakter sa nedá vždy jednoznačne určiť. Významnými znakmi malignity sú invazívny rast do okolitých štruktúr a orgánov, infiltrácia regionálnych lymfatických uzlín, metastazovanie do pečene a veľkosť nádoru nad 2 cm, histologicky malígnym znakom je angioinvázia, viac ako 2 mitózy na 10 zorných polí, viac ako 2 % Ki67 buniek na 10 zorných polí [5].
Klinické prejavy NETov pankreasu závisia od typu a množstva dominantného produkovaného hormónu. Secernujúce nádory sa môžu klinicky prejavovať už od veľkosti niekoľko mm (hlavne gastrinóm). Nefunkčné alebo nesecernujúce nádory sa prejavujú lokálnymi príznakmi alebo celkovými nešpecifickými príznakmi nádorového ochorenia. Prejavujú sa hlavne bolesťami, obštrukčným ikterom, pocitom tlaku v epigastriu, stratou telesnej hmotnosti [6, 7].
Väčšina NETov pankreasu produkuje veľký počet hormónov. Zaujímavosťou je, že až v 50 % imunohistochemicky potvrdená prítomnosť jednotlivých hormónov nezodpovedá klinickému obrazu, ktorý nádor spôsobuje. Bolo dokázané, že funkčné nádorové bunky sú schopné pod vplyvom liečby zmeniť svoje produkty [7].
V nefunkčných pankreatických NEToch možno imunohistochcemicky dokázať jeden alebo viac hormónov aj napriek tomu, že tento nádor je klinicky hormonálne neaktívny.
V pooperačnom managemente pacienta je nutné jeho dlhodobé sledovanie, nakoľko metastázy sa môžu objaviť aj mnoho rokov po odstránení primárneho nádoru [7].
Okrem gastrinómov a somatostatinómov, ktoré sa vyskytujú najčastejšie v hlave pankreasu, 60–70 % NETov pankreasu sa vyskytuje v tele a chvoste pankreasu. Práve lokalizácia v distálnej časti pankreasu je vhodná na laparoskopický operačný výkon [8].
Rozsah chirurgického výkonu sa pohybuje v prípade NETov od enukleácie nádoru až po radikálne resekcie. Inzulinómy sú zväčša malé a benígne, gastrinóm je prevažne malígny, veľkosťou však varíruje od drobučkých niekoľko milimetrov veľkých tumorčekov po niekoľko centimetrov veľký nádor, ostatné nádory (somatostatinóm, glukagonóm, afunkčné) sú zväčša väčšie a malígne. U nádorov vyskytujúcich sa v sporadickej forme je chirurgická liečba pomerne jednoduchá, v prípade syndrómu mnohopočetnej endokrinnej neoplázie je nutný komplex viacerých chirurgických výkonov. Pri rozhodovaní sa o rozsahu operačného výkonu je nevyhnutná dôkladná lokalizačná diagnostika, vrátanie pátrania po možnom metastatickom rozseve či už do lymfatických uzlín alebo do pečene, táto je však náplňou hlavne interných klinických pracovísk, nakoľko pacient sa na chirurgické pracoviská dostáva spravidla až po laboratórnom a klinickom stanovení diagnózy respektíve už aj s presnou topografickou lokalizáciou nádoru [8].
Na chirurgickej klinike v Martine ako prvý vykonal laparoskopickú resekciu pankreasu Straka jr. už v 1. marca 2005. Išlo o 58-ročnú pacientku s počítačovou tomografiou (ďalej len CT) verifikovanou cystickou léziou v chvoste pankreasu. Operácia bola kompletne dokončená laparoskopicky, histologicky sa potvrdila chronická pseudotumorózna pankreatitída s pseudocystou. Operačný výkon prebehol bez komplikácií, lienálne cievy boli selektívne ošetrené klipmi, žľaza pankreasu prerušená staplerom. Pacientka sa zhojila bez komplikácií, na 7. pooperačný deň bola prepustená do domácej starostlivosti. Žiaľ táto prvá úspešná operácia tohto typu v Martine nebola v literatúre publikovaná a navyše napriek operačnému úspechu sa v tomto type výkonu pokračovalo výlučne už iba otvorenou metódou. Až po študijnom pobyte v nórskom Oslo u dr. Edwina sa objavili ďalšie pokusy o znovuzavedenie tejto operácie do spektra výkonov na našom klinickom pracovisku.
Autori prezentujú dve kazuistiky afunkčných neuroendokrinných nádorov distálneho pankreasu, ktoré boli úspešne odstránené laparoskopickou distálnou pankreatektómiou za posledné 4 mesiace.
MATERIÁL A METODA
Operačný postup
Poloha pacienta na chrbte s abdukovanými dolnými končatinami, s podloženým ľavým hrudníkom a panvou do cca 15–25 stupňov od horizontály. Laparoskopická veža je umiestnená pri ľavej hornej končatine pacienta, operatér sa nachádza medzi abdukovanými dolnými končatinami, asistent na pravej strane pacienta. Po zavedení kapnoperitonea a zavedení bezpečnostného portu supraumbilikálne kamerou vizuálne revidujeme peritoneálnu dutinu pacienta a následne ho dávame do Fowlerovej polohy s naklonením operačného stola doprava. Zavádzame ďalšie tri pracovné porty, jeden približne v strednej čiare asi 4–5 cm pod processus xyphoideus a ďalšie dva v medioklavikulárnej čiare a prednej axilárnej čiare tesne nad úrovňou pupka. Samotný operačný výkon začíname uvoľnením hrubého čreva v Toldovej línii v oblasti lienálnej flexúry približne 5–10 cm aborálne pod ohybom flexúry, postupujeme orálne ku vrcholu flexúry a pokračujeme otvorením najviac vľavo vzdialeného kraja omentálnej burzy, približne do jednej tretiny pretíname gastrokolické ligamentum a tým doširoka otvárame omentálnu burzu, pričom dochádza ku obnaženiu dolného pólu sleziny a dolného okraja distálneho pankreasu. Následne smerom kraniálnym ponad hilus sleziny prerušujeme lienogastrické ligamentum s prerušením „vasa gastrica brevia“, až po úroveň ľavého „crus diaphragmae“. Uvoľňujeme dolnú hranu pankreasu od Gerotovej fascie smerom od chvosta pankreasu resp. hílu sleziny doľava, dostávame sa postupne ku plánovanej resekčnej línii pankreasu. Po obnažení dolného okraja pankreasu postupne tunelizujeme budúcu resekčnú líniu harmonickým skalpelom (HarmonicAce, Johnson&Johnson Medical) od Gerotovej fascie až po úroveň lienálnych ciev. Potom vypreparujeme kmeň lienálnej artérie, ktorý prerušujeme linárnym staplerom (TRT35, biela cievna náplň, Johnson&Johnson Medical). Až po prerušení artérie vypreparujeme kmeň lienálnej vény, ktorý prerušíme staplerom event klipujeme (Absolok, Johnson&Johnson Medical). Následne nakladáme na tkanivo tunelizovaného pankreasu lineárny 45mm alebo 60mm stapler (Duet TRS 45-3,5, Covidien alebo Echelon Flex 60, Johnson&Johnson Medical) a pretíname tkanivo pankreasu. Po preťatí pankreasu postupujeme v uvoľnení chvosta pankreasu s lymfadenektómiou pozdĺž lienálnych ciev a nakoniec uvoľňujeme závesy sleziny. Po kompletnom uvoľnení resekát ukladáme do endovrecka, zavádzame drén do ľavého subfrénia cez ľavý pracovný port, desuflujeme kapnoperitoneum a minilaparotómiou supraumbilikálne v strednej čiare v rozsahu 3–6 cm podľa veľkosti tumoru extrahujeme resekát.
VÝSLEDKY
Kazuistika č 1: (obrázky 1–5)
Pacientka, 62 rokov, bola posledné 3 roky opakovane kontrolovaná spádovým gastroenterológom na inom pracovisku s diagnózou „chronická pankreatitída“. V posledných 3 mesiacoch sa jej zdravotný stav zhoršil, objavili sa dyspeptické obtiaže, sporadické večerné zvracanie a pobolievanie brucha lokalizované do ľavého podrebria. Podstúpila ERCP (endoskopická retrográdna cholangio-pankreatikografia) vyšetrenie s negatívnym nálezom. Pri CT vyšetrení bol v apríli 2010 nájdený „na prednej ploche pankreasu 23 x 19 x 20 mm veľký, dobre ohraničený tumorózny útvar s cystickou prípadne nekrotickou zložkou v tesnej blízkosti lienálnej artérie“. O mesiac neskôr pri endoskopickom vyšetrení bola lézia popisovaná ako „solídny, ostro ohraničený tumor oválneho až okrúhleho tvaru s centrálnou anechogénnou (tekutinou vyplnenou) zložkou“. Vyšetrenie bolo spojené s endoskopickou biopsiou lézie tenkoihlovou aspiračnou biopsiou pod ultrasonografickou kontrolou, ale už bola popisovaná dovtedy nediagnostikovaná trombóza a. lienalis. Z bioptického materiálu bolo vyslovené podozrenie na „mucinóznu cystickú tumoróznu léziu pankreasu nejednoznačnej dignity“, patológ nevylúčil možnosť mucinózneho karcinómu pankreasu. V deň operácie u nás bola realizovaná kontrola onkomarkerov – Ca19-9 malo hodnotu 9,7 U/ml, hladina CEA (karcino-embryonálny antigén) bola ľahko zvýšená – 3,7 ng/ml. Po absolvovaní predoperačných vyšetrení pacientke navrhnutý laparoskopický operačný výkon, vzhľadom na trombózu a. lienalis popisovaný endosonograficky aj so splenektómiou. Operácia trvala 175 minút, resekčná línia v tele pankreasu prebiehala približne 3 cm distálne od sútoku vena mesenterica superior a vena lienalis, cez pravý pracovný port (z pohľadu operatéra) bol zavedený drén do ľavého subfrénia, ktorého koniec bol umiestnený ku resekčnej línii pankreasu. Na druhý deň už bola pri rannej vizite zaznamenaná efektívna peristaltika na bruchu pacientky s odchodom prvých vetrov necelých 24 hodín po operácii. Do 24 hodín bola pacientke podaná vakcína Pneumo23 (Sanofi Pasteur, Francúzsko) z dôvodu odstránenia sleziny. Drén v prvý pooperačný deň odviedol 10 ml, druhý deň rovnako 10 ml, na tretí deň neodviedol ani merateľné množstvo objemu a bol odstránený. Vzhľadom na aspoň minimálne množstvo sekrétu v dréne bol realizovaný odber na stanovenie hladiny amyláz v sekréte z drénu, ktorá bola 47 mkat/l, sérová hladina amyláz bola 2,1 mkat/l. Od druhého pooperačného dňa sme začali s perorálnym príjmom tekutín u pacientky (čaj) od ďalšieho dňa s príjmom tekutej stravy. Počas operácie ani v pooperačnom období nebola pacientke podaná transfúzia krvi, celý pooperačný priebeh u pacientky bol bezproblémový, na 7. pooperačný deň bola prepustená do domácej starostlivosti. Histologicky sa jednalo o nefunkčný endokrinný dobre diferencovaný tumor s histochemickou pozitivitou chromogranínu A a synaptofyzínu s hormonálnym profilom inzulín negat., glukagón fokálne pozit., gastrín fokálne pozit., VIP ojedinele pozit., somatostatín negat a serotonín negat.
Image 1. Na zadnú stenu žalúdka naliehajúci tumor prednej plochy pankreasu Fig. 1. Anterior pancreatic tumor touching the posterior gastric wall 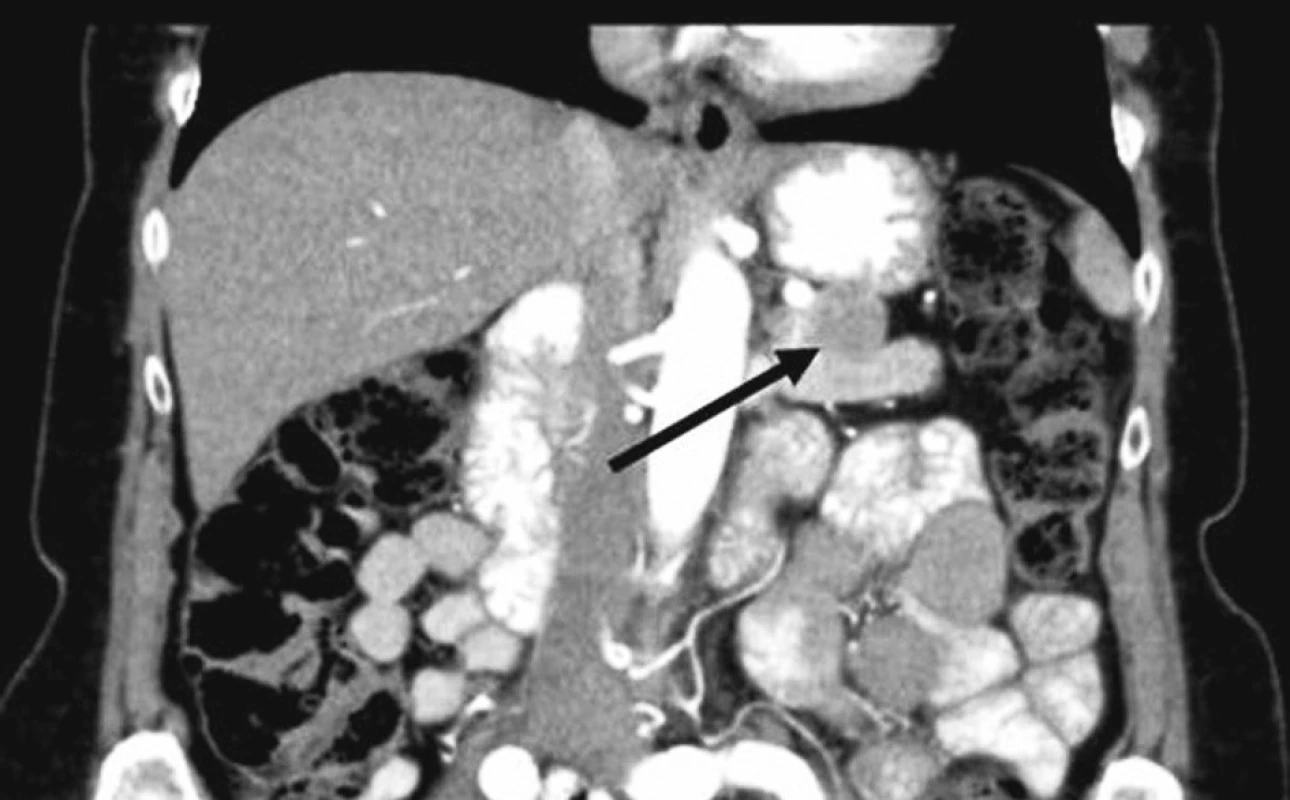
Image 2. Resekčná línia so svorkami (veľká šípka), svorky na staplerom preťatej trombotizovanej a lienalis (malá šípka) Fig. 2. Resection line with clips (large arrow), clips on the thrombotized lienal artery, cut with a stapler (small arrow) 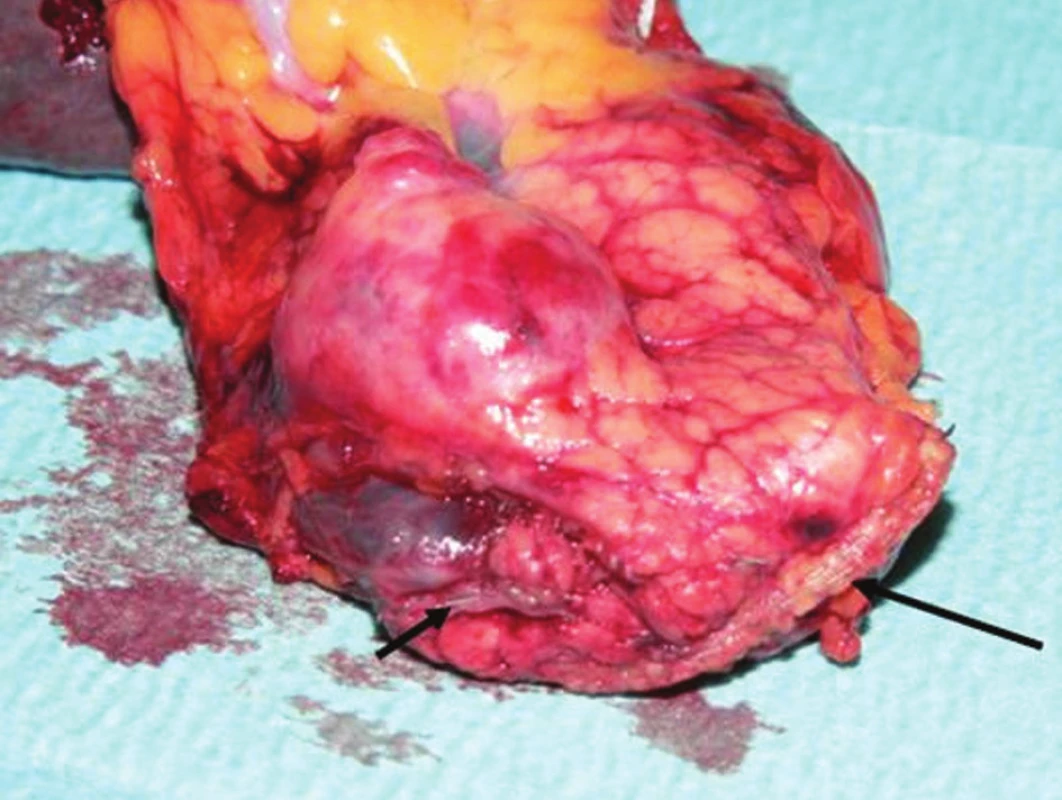
Image 3. Červený trombus v pozdĺžne otvorenej a lienalis, biele klipy naložené na vena lienalis (šípka) Fig. 3. Red thrombus in the longitudinally cut lienal artery, white clips placed on the lienal vein (arrow) 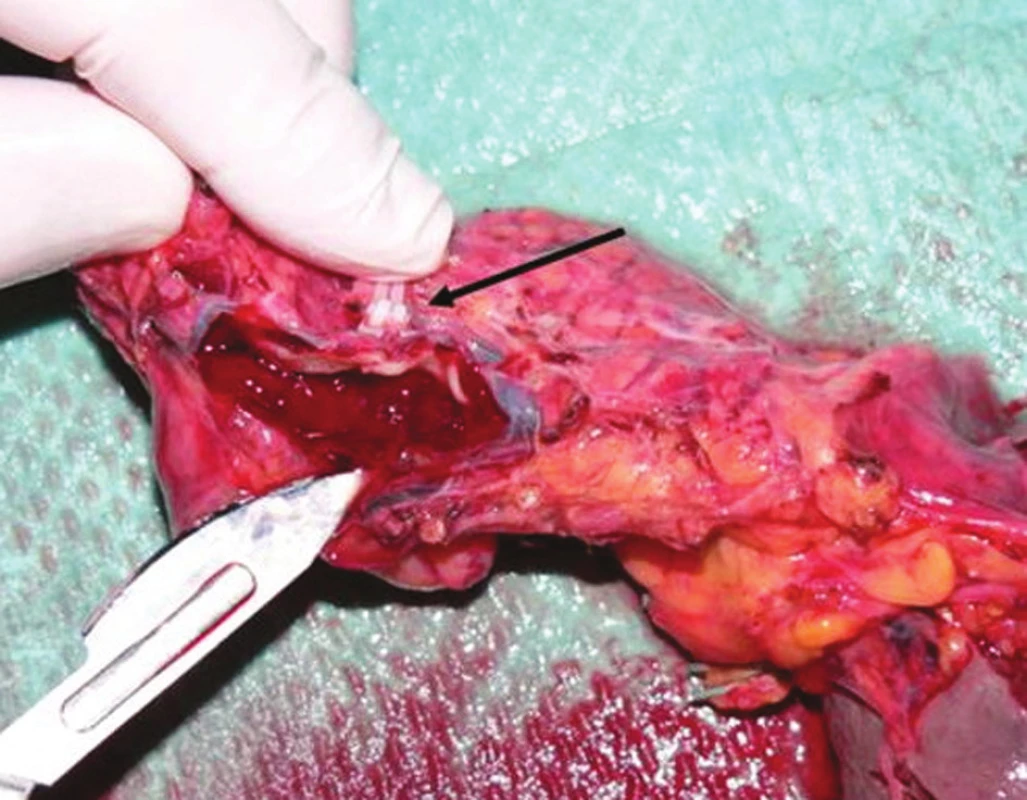
Image 4. Rez nefunkčným endokrinným dobre diferencovaným tumorom. Trhliny na slezine vznikli až extrakciou resekátu cez brušnú stenu, nie počas operácie Fig. 4. Acut through a non-functional well differentiated endocrine tumor. The lienal tears resulted from the resecate extraction through the abdominal wall, were not caused by the procedure 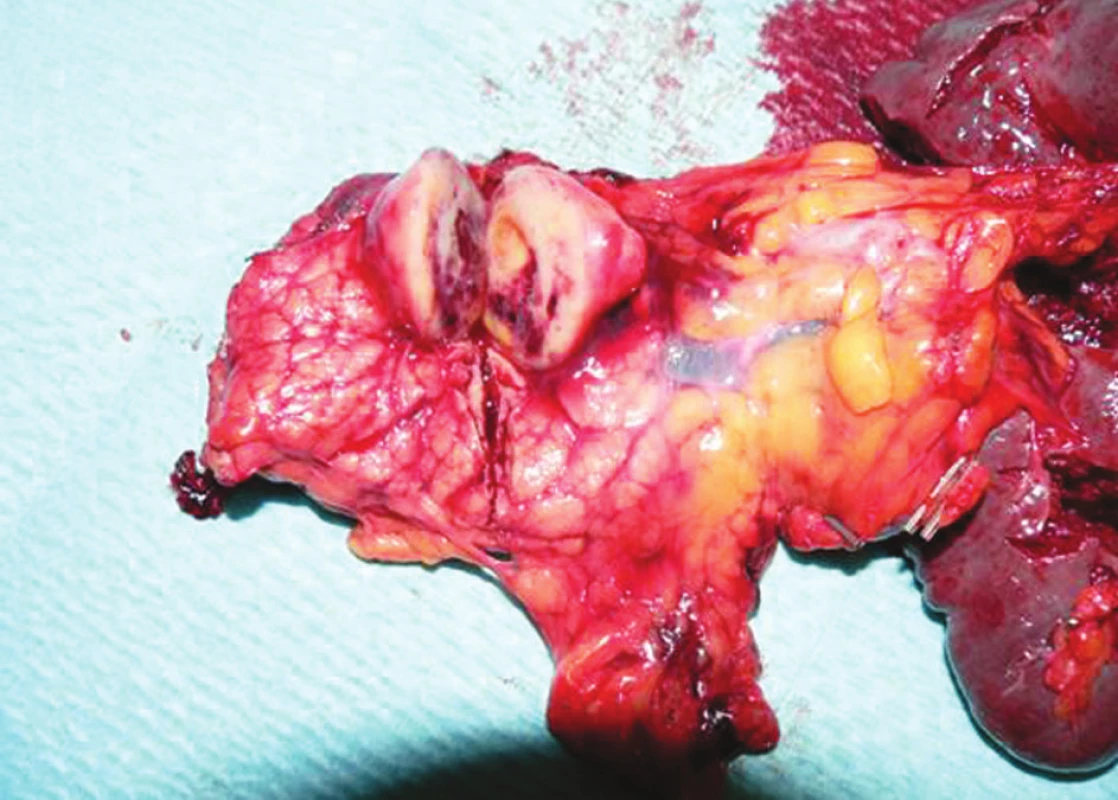
Image 5. Ohraničená kolekcia za žalúdkom 3 mesiace po operácii Fig. 5. Defined collection behind the stomach, 3 month after the procedure 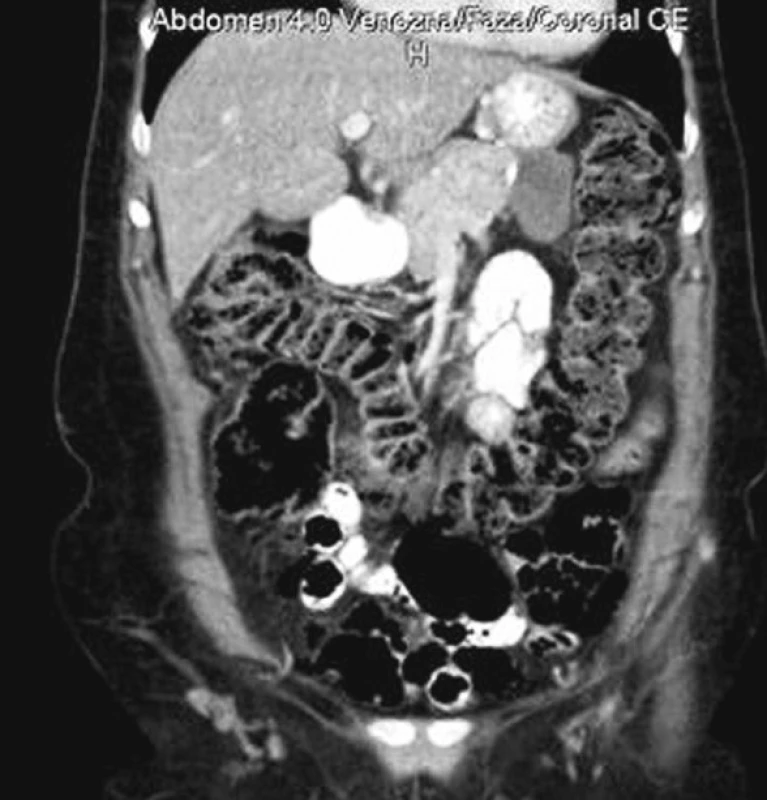
Diabetický syndróm sa u pacientky v pooperačnom období nevyvinul, len v deň operácie po výkone mala hyperglykémiu, podobne aj prvý pooperačný deň (maximálna glykémia 11,1). Od druhého pooperačného dňa normoglykemická.
Tri mesiace po operácii je pacientka bez akýchkoľvek obtiaží, ale pri kontrolnom CT vyšetrení zameranom na oblasť lôžka distálneho pankreasu bola zaznamenaná retrogastricky dobre ohraničená hrubostenná kolekcia naliehajúca na resekčnú líniu pankreasu o rozmeroch 40 x 22 mm (Obr. 5). Vzhľadom na negatívnu hladinu C-reaktívneho proteínu (CRP) 2,5 mg/l a oligo - až asymptomatický priebeh (posledné 2 týždne občasný pocit tlaku na žalúdok) sme pacientke odporučili kontrolu o mesiac (v prípade objavenia sa akýchkoľvek ťažkostí skôr). V prípade ťažkostí budeme podľa charakteru kolekcie zvažovať drenáž kolekcie do žalúdka (kolekcia nalieha na zadnú stenu žalúdka) pod endosonografickou kontrolou prípadne chirurgickú revíziu.
Kazuistika č 2: (obrázky 6–10)
Pacientka, 66 rokov, s približne trojmesačnou anamnézou bolestí pod ľavým rebrovým oblúkom, nechutenstvom a poklesom telesnej hmotnosti o 8 kg, prijatá na naše pracovisko po doplnení vyšetrenia magnetickou rezonanciou (MRI) s nálezom 7 x 7 x 6 cm tumoru lokalizovaného v chvoste pankreasu, naliehajúcim na zadnú stenu žalúdka a odtláčajúcim hrubé črevo v oblasti ľavej časti colon transversum kaudálne. Onkomarkery odobraté ešte spádovým gastroenterológom boli negatívne (CEA, Ca19-9, Ca72-4). Po predoperačnej príprave indikovaná vzhľadom na veľkosť tumoru k pokusu o laparoskopickú distálnu resekciu. Operačný výkon prebehol bez komplikácií, trval 3 hodiny a 30 minút, krvné straty odhadnuté na cca 100 ml. Resekčná línia na pankrease prebiehala približne 2 cm od sútoku vena lienalis a vena mesenterica superior, artéria lienalis bola prerušená tesne po odstupe z truncus celiacus. Veľkosť minilaparotómie vzhľadom na tumor bola v rozsahu 6 cm supraumbilikálne. Perioperačne bola pacientka prechodne hypotenzná (pravdepodobná príčina bola hypohydratácia predoperačne). V pooperačnom období bol zaznamenaný pokles hladiny hemoglobínu o 21 g/l na 87 g/l preto indikované podanie 2 transfúzne jednotiek erytrocytárneho koncentrátu v prvý pooperačný deň. Pacientke z dôvodu odstránenia sleziny bolo indikované podanie vakcíny Pneumo23 (Sanofi Pasteur, Francúzsko). Už na druhý deň u pacientky zaznamenaná efektívna peristaltika, pocit hladu, od prvého pooperačného dňa u pacientky zahájený perorálny príjem tekutín, od druhého dňa aj tekutej stravy, hladina amyláz v sekréte z drénu na tretí pooperačný deň bola 3,7 mkat/l, sérová hladina amyláz bola 2,0 mkat/l, drén pre hemoragicky prifarbený obsah ponechaný 7 dní a následne odstránený. Zaznamenali sme aj komplikáciu v zmysle veľkého hematómu v podkoží, ktorý nám dodatočne vysvetľuje pokles hemoglobínu v pooperačnom období nekorešpondujúci s výdajom drénu zo subfrénia (Obr. 10). Pacientka demitovaná do domácej starostlivosti na 9. pooperačný deň.
Image 6. MRI vyšetrenie so zobrazeným tumorom vo frontálnej rovine Fig. 6. MRI examination depicting the tumor, frontal view 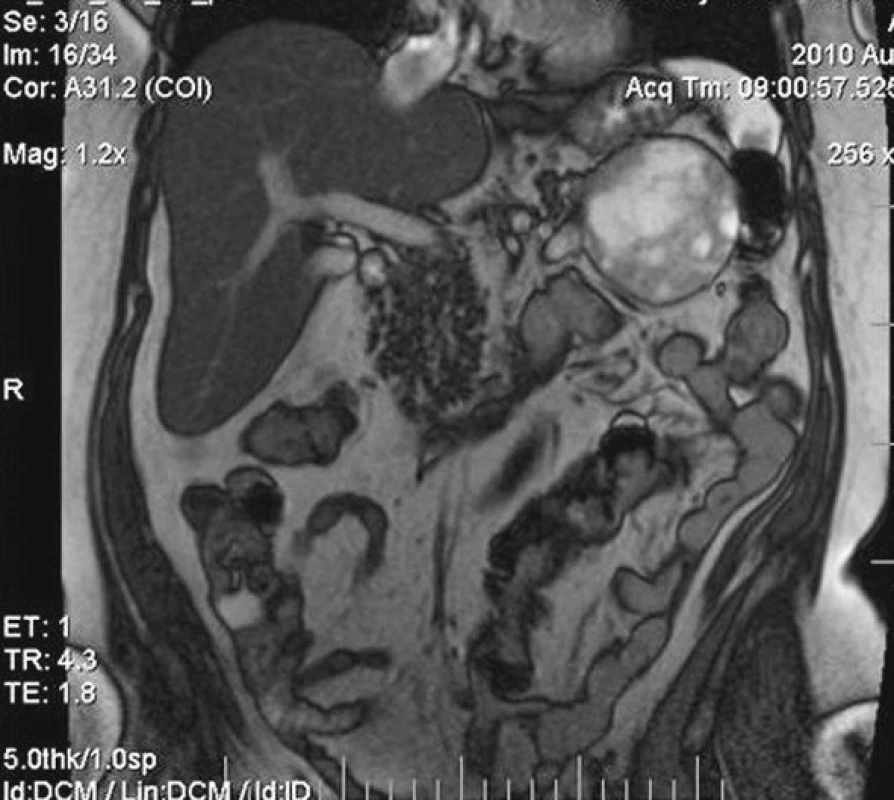
Image 7. MRI vyšetrenie v sagitálnej rovine Fig. 7. MRI examination, sagittal view 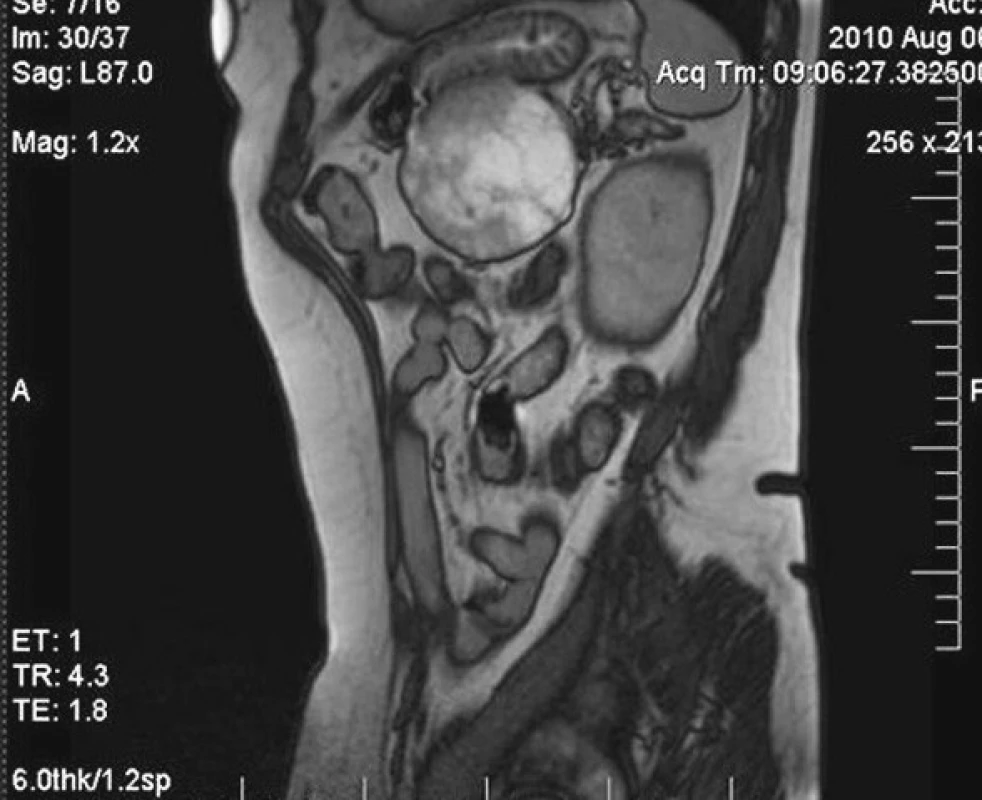
Image 8. Resekovaný distálny pankreas so slezinou, resekčná línia označená šípkou Fig. 8. The resected distal pancreas and spleen, the resection line marked with an arrow 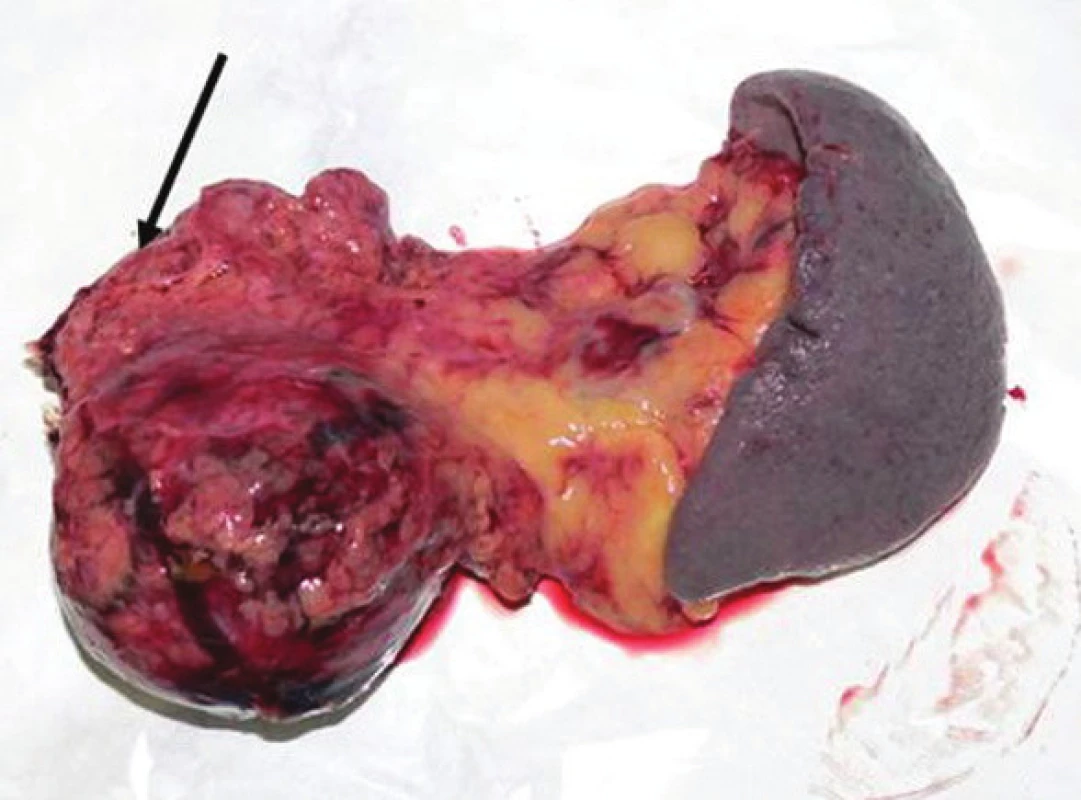
Image 9. Rozrezaný tumor na dolnej hrane tela pankreasu Fig. 9. Sliced tumor of the inferior pancreatic body margin 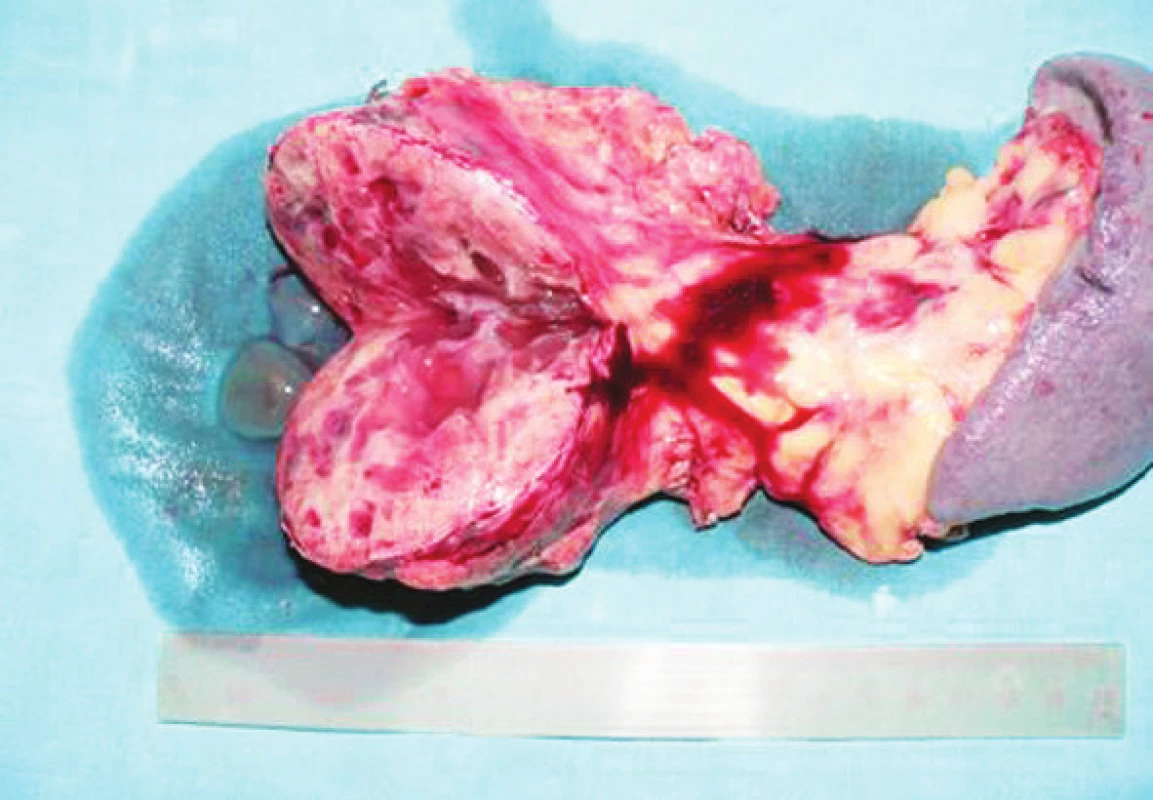
Image 10. Komplikácia po distálnej pankreatektómii – veľkosť hematómu 41 cm, napriek štandardnej kontrole portov kamerou pred ukončením operácie port po extrakcii nejavil známky krvácania ani do brušnej dutiny ani do oblasti podkožia. Z obrázka je zrejmá aj telesná konštitúcia pacientky ako aj uloženie portov a drénu Fig. 10. A complication after distal pancreatectomy – the size of hematoma is 41cm. Despite a standard control of ports with a camera at the end of the procedure, the port showed no signs of intraabdominal or intradermal bleeding after extraction. The picture shows the patient’s body constitution and the ports and drain locations 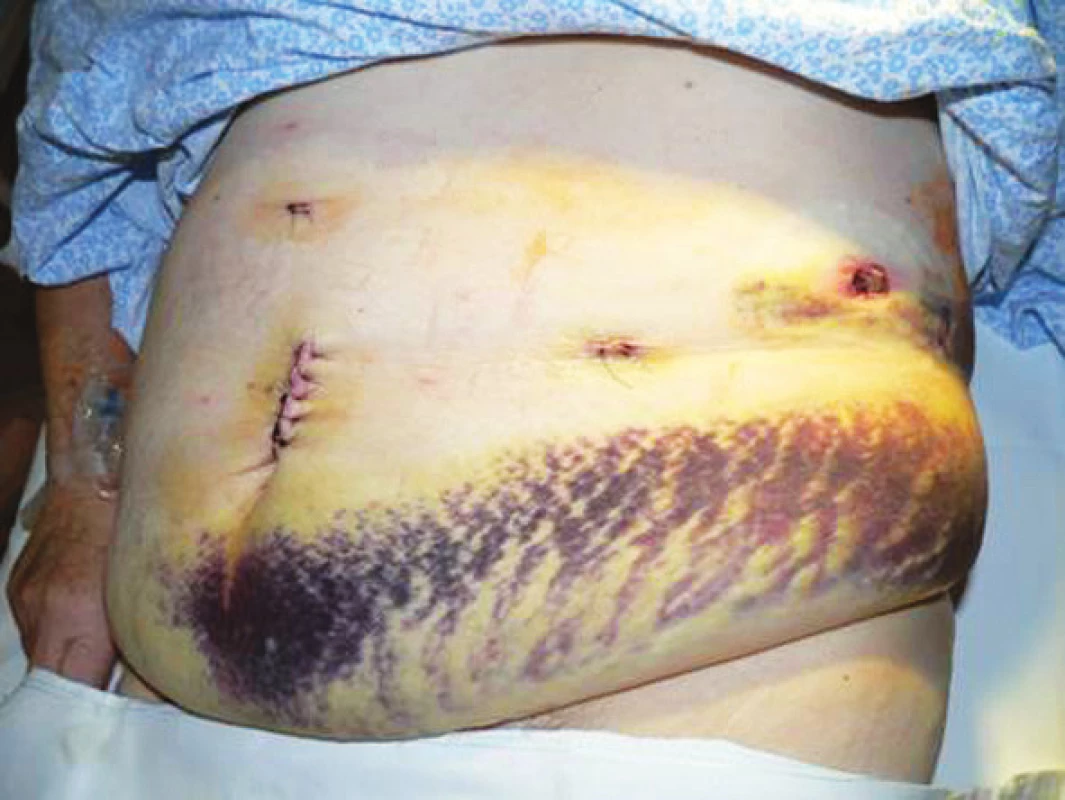
Histologicky sa jednalo o neuroendokrinný tumor, s neistým biologických chovaním, mitotická aktivita 0-2 mitózy na 10 zorných polí, imunohistochemicky pozitívny synaptofyzín, CD56 a CK8/18, s hormonálnym profilom glukagón pozitívny, somatostatín negat., gastrín negat., sertonín negat.,VIP negat, inzulín negat. Resekčné línie boli negatívne, nájdených a vyšetrených 6 LU bez nádorovej infiltrácie. Ako vedľajší nález v tkanive pankreasu prítomná chronická fokálna pankreatitída v.s. na podklade duktálnej obštrukcie tumorom.
Pacientka už pred resekciou pankreasu bola diabetička, po resekcii bola nutná korekcia diabetickej liečby v zmysle zvýšených dávok inzulínu o 4 jednotky za deň.
DISKUSIA
Laparoskopická resekcia pankreasu je bez akejkoľvek pochybnosti náročný operačný výkon, ktorý ešte ani zďaleka nie je pevne etablovaný v ponuke čo i len klinických pracovísk. Na Slovensku podľa dostupných informácii sú len 4 pracoviská, ktorým sa tento operačný výkon podarilo realizovať (Banská Bystrica 5x, Bratislava 3x, Košice 1x a Martin 3x).
Viacerí autori začínajú laparoskopický operačný výkon podobne ako otvorený, napr. Palanivelu, Kothaj [3, 9] a operáciu začínajú otvorením omentálnej burzy cez gastrokolické ligamentum. Na našom pracovisku využívame postup publikovaný a používaný dr. Edwinom [10]. Zdieľame názor, že takto má operatér výborný prehľad v operačnom poli. Hoci kompletné uvoľnenie lienálnej flexúry sa považuje za najťažší úkon laparoskopickej kolorektálnej chirurgie a je technicky pomerne náročné, dá sa realizovať aj u obéznych pacientov.
Otázka zachovania sleziny sa vynára pri operačnom riešení benígnej lézie pankreasu. Sú dve možnosti zachovania sleziny – exaktnou, ale mimoriadne náročnou precíznou preparáciou kmeňových lienálnych ciev s resekciou výlučne len žľazy pankreasu (nie vždy je to technicky možné), alebo zachovaním intaktných „vasa gastrica brevia“ a resekcii lienálnych ciev od miesta resekčnej línie pankreasu po hílus sleziny [11].
Oba naše operačné výkony boli vykonané so splenektómiou – v prvom prípade pre endosonograficky diagnostikovanú trombózu lienálnej artérie pri suspektnom prerastaní tumoru do artérie, čo sa histologicky nepotvrdilo, ale hlavne z dôvodu radikality operačného výkonu – pri predoperačnej endosonografickej tenkoihlovej aspiračnej biopsii bolo patológom vyslovené podozrenie na mucinózny cystadenokarcinóm. V druhom prípade pre nejednoznačnú dignitu tumoru (vzhľadom na veľkosť nad 2 cm, čo je jedno z kritérií svedčiace pre malígny charakter NETu), ale súčasne aj z dôvodu anatomických pomerov, keďže vinutá lienálna artéria bola na 3 miestach výrazne zanorená do parenchýmu horného okraja pankreasu.
Pankreatická fistula po distálnej pankreatektómii je ešte stále predmetom diskusií a hlavnou príčinou pooperačnej morbidity. Výskyt pankreatického leaku po distálnej resekcii pankreasu sa udáva v literatúre v rozmedzí od 0 do 50 % prípadov. Môže to byť zapríčinené faktom, že názory na definíciu fistuly sú dodnes nejednotné, niektorí autori dokonca ani štandardne nedrénujú operačné pole po distálnej resekcii, zatiaľ čo ďalší rutinne ani neodoberajú hladinu amyláz v dréne, prípadne dokonca paušálne odstraňujú drén do 24 hodín od operácie ak neodviedol viac ako 50 ml [10–12].
Podľa Shimizu a spol. je incidencia pankreatického leaku po distálnej pankreatektómii na základe prehľadu v literatúre 10 % (9 z 88 prípadov) [13]. V multicentrickej európskej štúdii na 127 pacientoch bol celkový výskyt fistuly 27 % po laparoskopickej distálnej resekcii pankreasu so splenektómiou a 36 % po slezinu záchovnej distálnej pankreatektómii [14].
Na transekciu pankreasu sa v laparoskopickej chirurgii používajú staplery. Podľa dostupných dát sa ale nedá vyhlásiť, či je výskyt pankreatického leaku po laparoskopickej resekcii vyšší alebo nižší ako pri otvorenom výkone [12].
Zaujímavé zistenie publikoval Nakamura a spol., ktorý rozdelil 42 pacientov indikovaných na laparoskopickú distálnu resekciu pankreasu do dvoch skupín. Kým v prvej skupine 25 pacientov použil na preťatie pankreasu stapler štandardne (cca 15-sekundová kompresia tkaniva), v druhej skupine u 17 pacientov použil metódu „predĺženej kompresie tkaniva staplerom“. Na preťatie žľazy pankreasu použil stapler Echelon 60, (Johnson&Johnson Medical) so zelenou náplňou, pričom 3 minúty ponechal tkanivo pankreasu komprimované aplikovaným staplerom, až potom stapler odpálil („firing“), ale po odpálení ponechal zachovanú kompresiu tkaniva pankreasu staplerom ešte ďalšie 2 minúty a až potom stapler z tkaniva uvoľnil. Kým v prvej skupine na vyskytla pankreatická fistula v 27 % prípadov, v druhej skupine sa fistula nevyskytla vôbec! [15]
Na našom pracovisku po každej resekcii pankreasu štandardne stanovujeme hladinu amyláz v drénoch na tretí a piaty pooperačný deň a za pankreatickú fistulu považujeme stav, kedy drén odvedie merateľné množstvo obsahu na tretí a neskorší pooperačný deň a koncentrácia amyláz v dréne presahuje 3-násobok sérovej hladiny amyláz.
V prípade prvej pacientky napriek relatívne vysokej hladine amyláz sme stav najskôr nehodnotili ako pankreatickú fistulu, nakoľko drén neodviedol merateľné množstvo sekrétu a teda nespĺňal podmienku merateľného výdaja drénom a v prípade viacerých renomovaných autorov by bol odstránený už v prvý pooperačný deň. Vzhľadom na nález ohraničenej kolekcie retrogastricky pri CT kontrole (3,5 mesiaca po operácii) však teraz jednoznačne nález považujeme za pankreatickú pooperačnú fistulu, hoci s asymptomatickým priebehom.
V našich kazuistikách bol operačný čas relatívne dlhý 175 min resp. 210 min. Keďže sa jedná o naše prvé skúsenosti s týmto typom operácie, rovnako ako sme si plne vedomí dlhej „learning curve“ pri tomto type operácie, rozhodne nepovažujeme tento výsledok za zlý. Pre porovnanie uvádzame čas operácie u dostupných publikovaných laparoskopických distálnych resekcií – Edwin priemerne 235 minút (od 78 do 332 minút), Patterson priemerne 264 min, Cassadei priemerne 219 minút a Fernandez-Cruz priemerne 198 minút [10, 16–18].
Možno nová téma na odbornú diskusiu je zvážiť, či je nevyhnutné, aby o náročný laparoskopický výkon sa operatér pokúsil až po perfektnom zvládnutí otvoreného výkonu; totiž oba naše publikované laparoskopické výkony boli prvými dvoma distálnymi resekciami pankreasu autora v jeho chirurgickej praxi.
ZÁVER
Laparoskopická distálna pankreatektómia je elitný chirurgický výkon patriaci vylúčne na pracoviská zaoberajúce sa problematikou pankreatobiliárnej chirurgie. Operácia pankreasu laparoskopicky si od operatéra vyžaduje vzhľadom na uloženie pankreasu a technickú nemožnosť uplatniť palpačné vnemy operatéra precíznu znalosť anatómie danej lokality.
V rukách skúseného laparoskopického chirurga sa táto operácia mení na plnohodnotnú náhradu otvoreného výkonu, dokonca časovo porovnateľnú s otvoreným výkonom (v júni 2009 dr. Edwin v Rikshospitalet v nórskej metropoli Oslo vykonal distálnu resekciu pankreasu so splenektómiou pre tumor prechodu tela a chvosta pankreasu za 78 minút).
Poďakovanie:
Aj touto cestou chcem poďakovať doc. MUDr. Stanislavovi Czudekovi, Ph.D., že mi v praxi ukázal obsah pojmu „laparoskopická chirurgia“.
Rovnako chcem poďakovať dr. BjŅrnovi Edwinovi, Ph.D. z Rikshospitalet, Oslo za priam otcovský prístup pri odovzdávaní svojich chirurgických vedomostí a laparoskopických zručností chirurgie pankreasu.MUDr. Roman Kyčina
Maše Haľamovej 1/8
036 01 Martin
Slovenská republika
e-mail: rkycina@gmail.com
Sources
1. Gagner, M., Pomp, A., Herrera, M. F. Early experience with laparoscopic resections of islet cell tumours. Surgery, 1996; 120 : 1051–1054.
2. Takaori, K., Tanigawa, N. Laparoscopic pancreaatic resection: the past, persent and future. Surg. Today, 2007; 37 : 535–545.
3. Palanivelu, C., Shetty, R., Jani, K., et al. Laparoscopic distal pancreatectomy: results of a prospective non-randomized study from a tertiary center. Surg. Endosc., 2007; 21 : 373–377.
4. Plöckinger, U., Rindi, G., Arnold, R., et al. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. Neuroendocrinology, 2004; 80, 394–424.
5. Kajo, K., Macháleková, K., Plank, L. Pohľad patológa na problematiku neuroendokrinných nádorov GIT-U: terminológia, klasifikácia a diagnostika podľa princípov klasifikácie SZO. Gastroenterol. prax, 2006; 5(2): 88–94.
6. Hyrdel, R., Demeter, M., Božíková, J., a spol. Neuroendokrinné nádory horného GIT-u a endosonografia. Gastroenterol. prax, 2010; 9(1): 20–25
7. Hyrdel, R., Božíková, J., Demeter, M., a spol. Neuroendokrinné nádory (NET) tráviaceho systému. Gastroenterol. prax, 2006; 5(2): 78–87.
8. Kothaj, P. Chirurgická liečba neuroendokrinných nádorov GIT. Gastroenterol. prax, 2006; 5(2): 106–111.
9. Kothaj, P., Winter, P., Slobodník, I. Laparoskopická distálna pankreatektómia. Slovenská chirurgia, 2009; 5 : 4–6.
10. Edwin, B., Mala, T., Mathisen, O., et al. Laparoscopic resection of the pancreas. A feasibility study of the short-term outcome. Surg. Endosc., 2004;18 : 407–411.
11. Pryor, A., Means, J. R., Pappas, T. N. Laparoscopic distal pancreatectomy with splenic preservation. Surg. Endosc., 2007; 21 : 2326–2330.
12. Fernandez-Cruz, L. Distal pancreatic resection: technical differences between open and laparoscopic approaaches. HPB, 2006; 8 : 49–56.
13. Shimizu, S., Tanaka, M., Mizumoto, K., et al. Laparoscopic pancreatic surgery: current indications and surgical results. Surg. Endosc., 2004; 18 : 402–406.
14. Mabrut, J. Y., Fernandez-Cruz, L., Azagra, J. S., et al. Lapaorscopic pancreatic resection: results of a multicenter study of 127 patients. Surgery, 2005; 137 : 597–605.
15. Nakamura, M., Ueda, J., Kohno, H., et al. Prolonged peri-firing compresion with a linear stapler prevents pancreatic fistula in laparoscopic distal pancreatectomy. Surg. Endosc., 2010 Online First DOI 10.1007/s00464-010-1285-6 http://www.springerlink.com/content/102j724660779432/
16. Patterson, E. J., Gagner, M., Salky, B., et al. Laparoscopic pancreatic resection: single-institution experience of 19 patients. J. Am. Coll. Surg., 2001; 193 : 281–287.
17. Casadei, R., Ricci, C., Zanini, N., et al. Laparoscopic distal pancreatectomy in non-malignant pancreatic tumors. J. Pancreas (Online), 2008; 9(1): 71–73.
18. Fernandez-Cruz, L., Martinez, I., Gilabert, R., et al. Laparoscopic distal pancreatectomy combined with preservation of the spleen for cystic neoplasms of the pancreas. J. Gastrointestinal. Surg., 2004; 8 : 493–501.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 3-
All articles in this issue
- Role VATS v léčení empyému hrudníku
- Vzdálený syndrom zraněného gliomu po stereotaktické biopsii – kazuistika
- Biliární komplikace po velkých resekcích jater
- Jednotná klasifikace plicních lymfatik. Cesta ke status quo
- Přednosti klasického operačního přístupu v chirurgické léčbě plicních metastáz
- Kvalita života po laparoskopické fundoplikaci v závislosti na předoperační symptomatologii
- Vplyv pooperačných komplikácií na prežívanie pacientov s karcinómom pankreasu
- Laparoskopické ošetření poranění tlustého střeva při kolonoskopii
- Nové možnosti diagnostiky karcinómu pankreasu
- Metastáza světlobuněčného renálního karcinomu do ductus choledochus
- Laparoskopická resekce pankreatu v experimentu a klinické praxi
- Laparoskopická distálna pankreatektómia pre neuroendokrinné nádory pankreasu – prvé skúsenosti
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kvalita života po laparoskopické fundoplikaci v závislosti na předoperační symptomatologii
- Laparoskopická distálna pankreatektómia pre neuroendokrinné nádory pankreasu – prvé skúsenosti
- Laparoskopické ošetření poranění tlustého střeva při kolonoskopii
- Vplyv pooperačných komplikácií na prežívanie pacientov s karcinómom pankreasu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

