-
Medical journals
- Career
Short bowel syndróm a limity resekčnej chirurgie tenkého čreva
: A. Prochotský 1; Ľ. Jančula 2; J. Škultéty 1; A. Vavrečka 2; J. Sekáč 1; R. Okoličány 1; V. Slezák 1; A. Mifkovič 1
: II. chirurgická klinika LF UKo, FNsP Bratislava, Slovenská republika, prednosta doc. MUDr. J. Škultéty, CSc. 1; Gastroenterologická klinika Slovenskej zdravotníckej univerzity, Bratislava, Slovenská republika prednosta prof. MUDr. A. Vavrečka, CSc. 2
: Rozhl. Chir., 2008, roč. 87, č. 6, s. 311-316.
: Monothematic special - Original
Syndróm krátkeho čreva (short bowel syndrome – SBS) je malabsorpcia vznikajúca ako dôsledok anatomickej alebo funkčnej straty signifikantne dlhého segmentu tenkého čreva. Strata viac ako 80 % dĺžky tenkého čreva sa spája so zvýšenou nevyhnutnosťou podpornej parenterálnej výživy a redukuje celkové prežívanie pacientov. Ak dôjde aj k strate ileocekálnej chlopne (valvula Bauhini), vzniká bakteriálna kontaminácia tenkého čreva, ktorá ovplyvňuje toleranciu orálnej, resp. enterálnej výživy. Autori predkladajú kazuistiku 27ročného pacienta, ktorý mal opakované resekcie tenkého čreva, naposledy aj s Bauhinskou chlopňou, až mu napokon zostalo len 70 cm jejuna.
Kľúčové slová:
syndróm krátkeho čreva – malnutrícia – totálna parenterálna výživa – rozsiahla resekcia tenkého črevaSyndróm krátkeho čreva (short bowel syndrome, short gut syndrome, anenterický malabsorpčný syndróm a pod.) je porucha, ktorá sa klinicky prejavuje malabsorpciou, hnačkami, steatoreou, tekutinovou a elektrolytovou disturbáciou a malnutríciou. Syndróm krátkeho čreva sa najčastejšie vyskytuje u novorodencov po rozsiahlych resekciách (napr. pre nekrotizujúcu enterokolitídu, intestinálnu atréziu a volvulus). Inými, menej častými príčinami v pediatrickom veku môžu byť kongenitálne krátke tenké črevo, gastroschisis a mekóniová peritonitída. U dospelých sú najčastejšími etiologickými faktormi tohto syndrómu Crohnova choroba, radiačná enteritída, mezenteriálne vaskulárne príhody, traumy a opakované obštrukcie čreva [16, 21]. Bez ohľadu na vyvolávajúcu príčinu, konečným výsledkom funkčnej alebo anatomickej straty významne dlhého segmentu tenkého čreva je ťažká porucha jeho digestívnej a absorpčnej kapacity. I keď resekcia len hrubého čreva (vrátane totálnej kolektómie) zvyčajne nevyústi do short bowel syndrómu, môže byť kritickým faktorom, ktorý ovplyvňuje manažment pacientov, ktorý stratili dlhý segment tenkého čreva.
KAZUISTIKA
Mladý, 27ročný jadrový fyzik bol na našu kliniku preložený dňa 8. 8. 2007 z iného pracoviska pre prolongovaný pooperačný ileus a podozrenie na pooperačnú pankreatitídu (elevácia sérových amyláz, lipáz a CT nález na pankrease). Pacient bol do krajskej nemocnice prijatý pre ileóznu NBP a dňa 27. 7. 2007 tam bol aj operovaný. Operačná diagnóza: ileus mechanicus et adhesionibus, operačný výkon: adhesiolysis.
Predchorobie: Pred 16 rokmi bol pacient ako 11ročný na tom istom pracovisku operovaný pre akútnu apendicitídu. V bezprostrednom pooperačnom období bol reoperovaný a vtedy mu robili aj resekciu tenkého čreva. Výsledok histopatológie z resekátu tenkého čreva a apendixu sa nám nepodarilo zistiť. Po reoperácii bol pacient v septickom šoku. Po vysokých dávkach antibiotík došlo k akútnemu renálnemu zlyhaniu s nevyhnutnosťou prechodnej hemodialýzy. Pacient stratil sluch. Stav sa však napokon podarilo zvládnuť a s odstupom času mu bol ako prvému na Slovensku úspešne aplikovaný kochleárny implantát [15]. Až do júla 2007 bol pacient takmer bez ťažkostí, aktívne športoval, vrátane lyžovania, plávania i cvičenia s bremenami. Bez problémov zvládol náročné univerzitné štúdium na fakulte jadrovej fyziky.
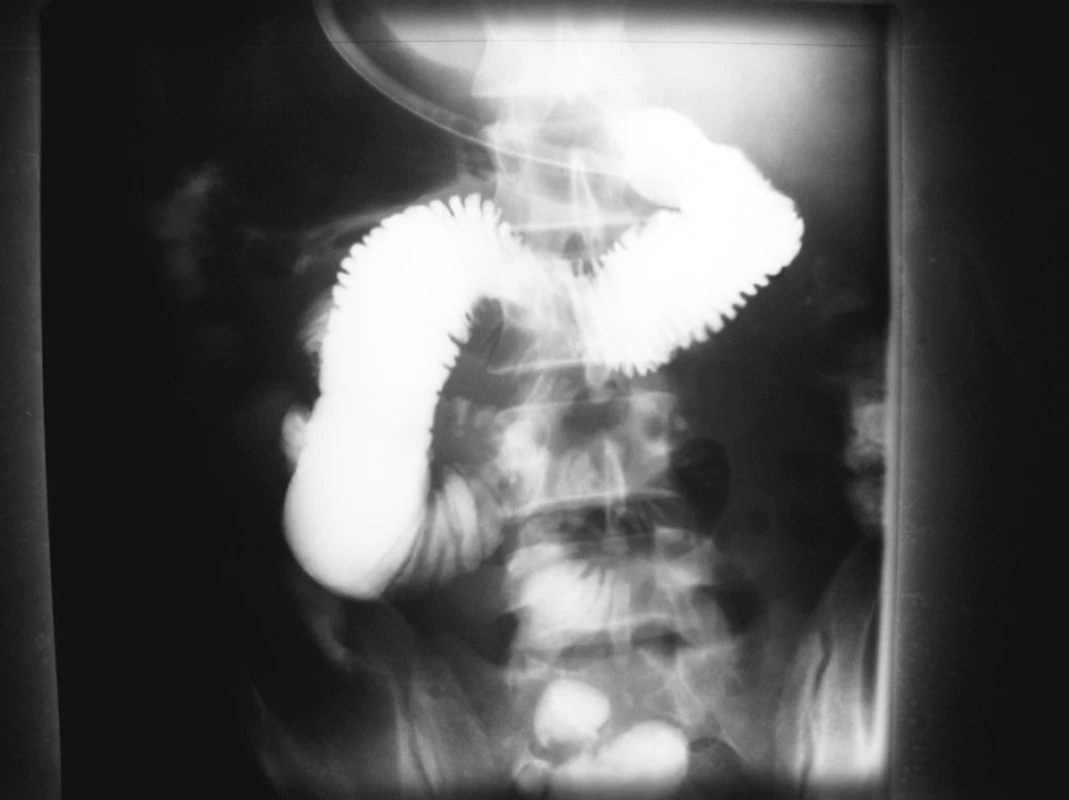
Po preklade na našu kliniku pretrvávali príznaky vysokého ileu, pacient bol na totálnej parenterálnej výžive a realizovali sme mu sériu diagnostických vyšetrení. Pri konvenčnej pasáži horného GIT, ale aj pri enteroklýze sa dosiahla náplň kontrastnou látkou len do úrovne duodéno-jejunálneho prechodu (Obr. 1). Gastroenterológ sa pri pokuse o enteroskopiu taktiež dostal len približne do úrovne prechodu duodéna a jejuna. Pri CT vyšetrení sme našli enormnú gastrektáziu a dilatáciu duodéna s patologickou rezistenciou lokalizovanou nad duodéno-jejunálnym prechodom (Obr. 2). Kľučky tenkého čreva mali zhrubnutú stenu, kontrastná látka z duodéna do jejuna prechádzale len tenkým, filiformným lúmenom čreva. Laboratórne parametre a opakované CT vyšetrenia podozrenie na pooperačnú pankreatitídu nepotvrdili.
2. CT vyšetrenie – v kruhu je patologická rezistencia lokalizovaná nad duodéno-jejunálnym prechodom. Pri operácii sa zistilo, že sa jedná o organizovaný hematóm. 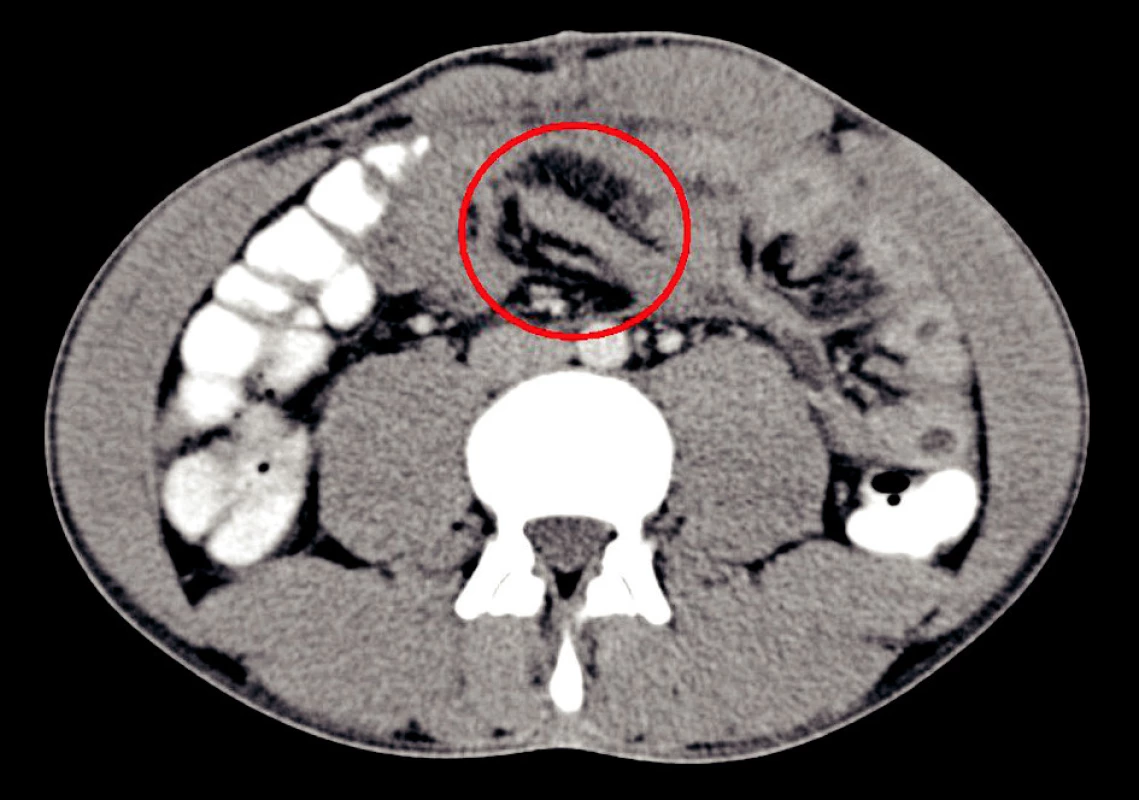
Pre nelepšiaci sa stav pacienta, počínajúci rozvoj vodnej a elektrolytovej disturbácie, ale aj progredujúcej malnutrície sme boli nútení pacienta operovať. Operácia bola vykonaná dňa 20. 8. 2007. Operačné diagnózy: hematoma interansalis, adhesiones cavi peritonealis multiplices, stenoses intestini tenuis multiplices. Pri operácii sme našli veľký hematóm, ktorý bol lokalizovaný v úrovni duodéno-jejunálneho prechodu a komprimoval tenké črevo. V brušnej dutine boli masívne zrasty. Kľučky tenkého čreva tvorili jeden obrovský konvolut. Striedali sa segmenty dilatácie a stenóz tenkého čreva so zhrubnutou, inde miestami až pergamenovitou stenou, ktorá už makroskopicky javila poruchy výživy a menejcennosti. Terén bol neprehľadný a preparácia mimoriadne obtiažna (Obr. 3). Po evakuácii hematómu sa nám postupne podarilo čiastočne deliberovať tenké črevo. Napokon sme však boli nútení resekovať menejcenný rozsiahly segment tenkého čreva aj s cékom. Kontinuitu dutej trubice GIT sme obnovili jejuno-ascendento end to end anastomózou, pričom sa podarilo zachovať len 70 cm jejuna. Operácia od incízie až po sutúru kože trvala 6 hodín a 25 minút.
3. FOTO z operácie – zachytáva neprehľadný terén a masívne zrasty medzi kľučkami tenkého čreva, pinzety mieria do dutiny po evakuácii hematómu. 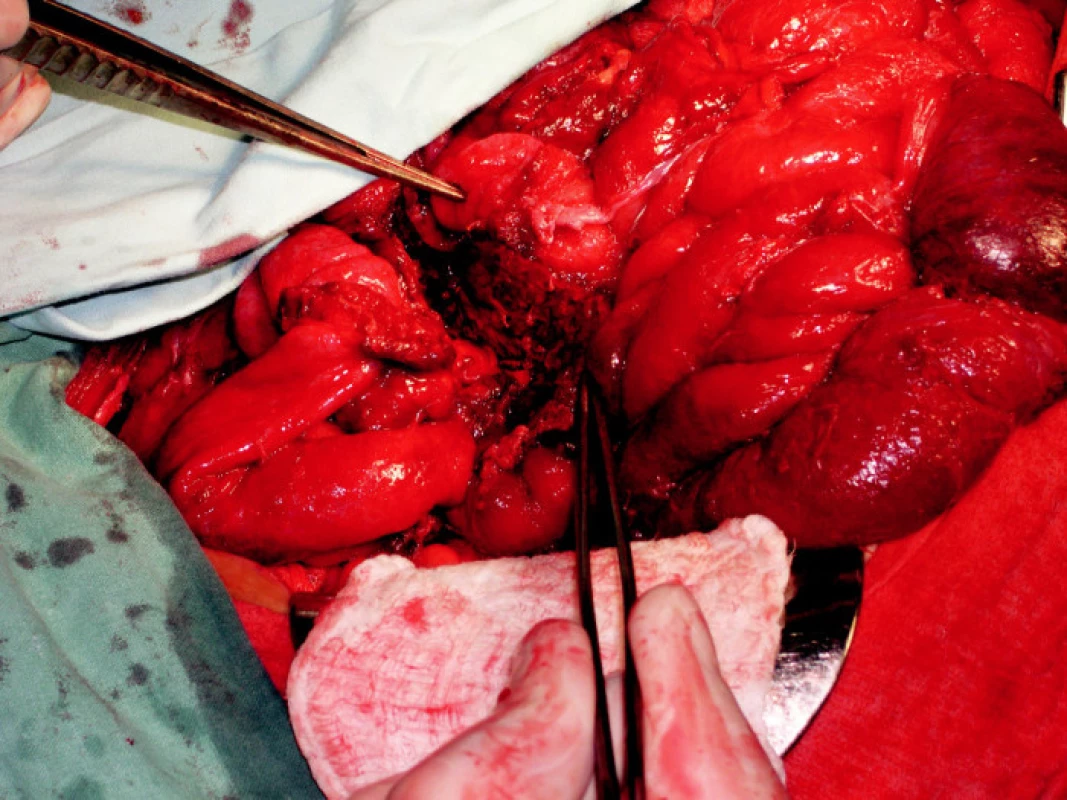
Po nej bol pacient preložený na Oddelenie anestézie a intenzívnej medicíny. Pooperačný priebeh bol opäť komplikovaný prolongovaným pooperačným ileom, sepsou z centrálnej venóznej linky, anémiou, hypopro - teinémiou a hypoalbuminémiou, ďalším poklesom hmotnosti a depresiou. Po stabilizácii bol pacient preložený späť na našu kliniku a 11. 9. 2007 na Gastroenterologickú kliniku za účelom ďalšej liečby a manažmentu pooperačného short bowel syndrómu. Výživu pacienta sme po prechodnej totálnej parenterálnej nutrícii zabezpečovali kombináciou perorálnej výživy (vrátane nutridrinkov) a podpornej parenterálnej výživy cez centrálnu venóznu linku. Intenzívne sme monitorovali vnútorné prostredie, elektrolyty, stopové prvky a vitamíny, najmä vitamín B12. Ich deficit sme nahrádzali parenterálne. Pri monitoringu a realimentácii pacienta sme úzko spolupracovali s klinickým biochemikom, diétológom a odborníkom na short bowel syndróm. Hmotnosť pacienta sme merali denne a pacient, osobne zainteresovaný na procese liečby, sám vyhodnocoval hmotnostnú krivku (Obr. 4).
4. Graf hmotnostnej krivky – spracovaný samotným pacientom 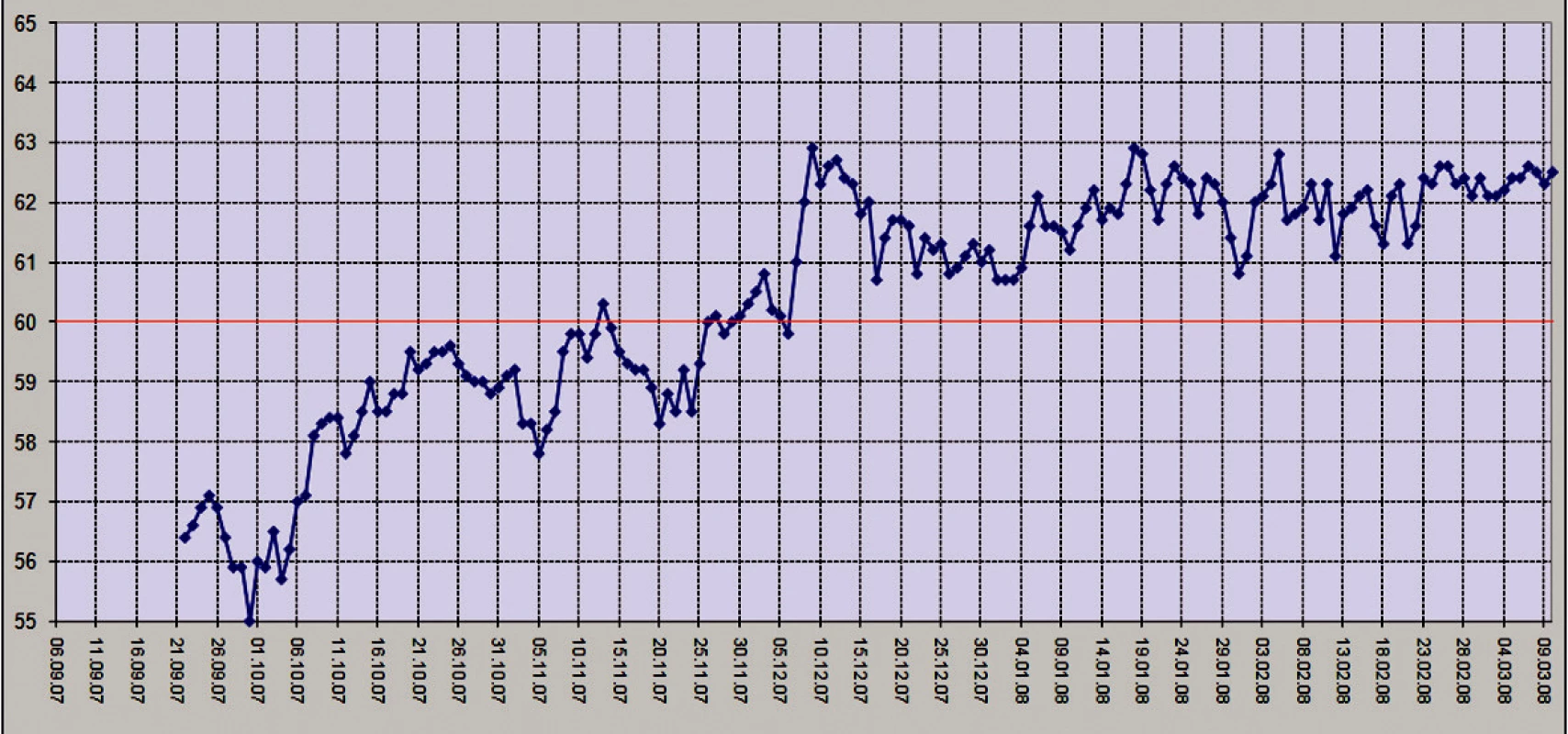
Dňa 30. 10. 2007, t. j. po 97 dňoch hospitalizácie, sme pacienta prepustili do ambulantnej starostlivosti.
V súčasnosti sa má pacient dobre. Je na plnej per os výžive, bez podpornej parenterálnej nutrície. Sleduje ho gastroenterológ a podľa odborníka na short bowel syndróm nemá žiadne príznaky tohto syndrómu. Stolicu máva 2–3x denne (Obr. 5).
5. Graf zobrazujúci počet stolíc/deň – spracovaný samotným pacientom 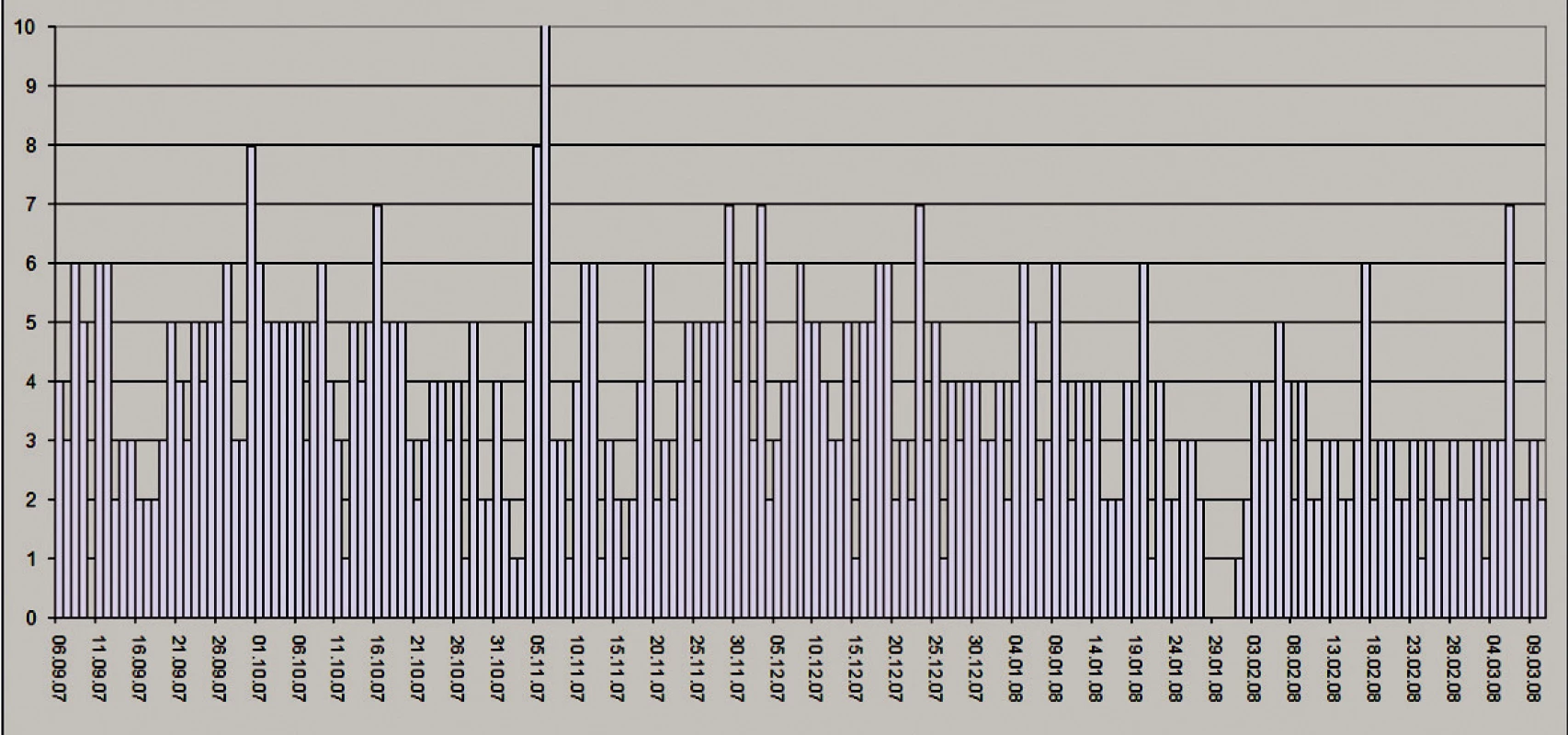
Histológia. Histopatológ pri zhodnotení resekátu opísal vo variabilných lokalitách tenkého čreva aj variabilne intenzívne známky akútneho zápalu i regresie, miestami až do úrovne nekrózy sliznice čreva. Excízie zo steny čreva vykazovali miestami známky aktívnej purulentnej peritonitídy. V líniach resekcie čreva boli na seróze opísané len minimálne zápalové zmeny. Mezenteriálne lymfatické uzliny boli bez akútnych zápalových zmien, s obrazom tzv. vyprázdnenia. Tukové tkanivo vykazovalo prejavy stázy až mierneho aktívneho zápalu. Histopatologický nález však jednoznačne nesvedčil pre morbus Crohn.
DISKUSIA
Priemerná dĺžka tenkého čreva dosahuje pri meraní na kadaveroch približne 600 cm. Podľa údajov Wesera, 1983 a Lennarda-Jonesa, 1990, to je 260–800 cm [18, 32]. Akékoľvek ochorenie, trauma, cievna príhoda alebo iná patológia, ktorej výsledkom je strata ≥ 50 % tenkého čreva alebo po ktorej zostane pacientovi menej ako 200 cm tenkého čreva, ohrozuje pacienta vznikom syndrómu krátkeho čreva.
Stanoviť incidenciu a prevalenciu SBS je ťažké, lebo ochorenie je zriedkavé. Možno skôr hovoriť o odhade incidencie na základe stanovenia počtu pacientov, ktorí pre príznaky tohto syndrómu vyžadujú dlhodobú domácu parenterálnu výživu.
Lennard-Jones z V. Británie, 1990 a 1994, uvádza že na short bowel syndróm trpia dvaja z dvoch miliónov obyvateľov [18, 19]. Podľa Byrneho a kol., 1995, vyžaduje v USA domácu parenterálnu výživu pre tento syndróm ročne 10–20 000 ľudí [5]. Moreno a kol., 2005, zo Španielska zistili na základe údajov z národného registra z roku 2002, že podľa počtu pacientov, ktorí vyžadovali domácu parenterálnu výživu je prevalencia ochorenia 1,8/1 000 000 populácie [20].
Tenké črevo pozostáva z duodéna, jejuna a ilea. Väčšina uhľohydrátov a proteínov sa absorbuje v duodéne a jejune. Tuky a v tukoch rozpustné kyseliny sa však absorbujú v ileu. Žlčové soli, ktoré sa vylučujú z pečene do duodéna sú potrebné na absorpciu dlhého reťazca mastných kyselín a v tuku rozpustných vitamínov, čo prebieha v ileu. Vitamín B12 viažuci sa na intrinsic faktor (produkovaný v žalúdku) sa tiež absorbuje v terminálnom ileu. Tekutiny a elektrolyty sa predominantne absorbujú v ileu a kolone. Ak sa zresekuje duodénum a/alebo jejunum, ileum sa dokáže adaptovať a nahrádza ich absorpčné funkcie. Ale duodénum a jejunum funkcie ilea nahradiť nedokážu. Preto organizmus vo všeobecnosti lepšie toleruje resekciu duodéna a/alebo jeuna, ako resekciu ilea [4, 10, 14].
Ileocekálna chlopňa je hlavnou bariérou medzi tenkým a hrubým črevom. Podieľa sa na regulácii odchodu tekutín a nestrávených zvyškov potravy z tenkého čreva. Kompetentná valvula Bauhini bráni refluxu baktérií z kolonu do tenkého čreva. Resekcia ileocekálnej chlopne vedie k poklesu absorpcie tekutín a výživných látok a spôsobuje prerastanie bakteriálnej flóry v tenkom čreve [31].
Ihneď po operácii, ktorá prináša riziko rozvoja syndrómu krátkeho čreva, treba aplikovať totálnu parenterálnu výživu. V nej pokračujeme až do obnovy funkcie čreva (auskultačne detegovaná peristaltika a odchod stolice). V závislosti od intenzity syndrómu možno potom predpokladať, že plnú enterálnu/orálnu výživu dosiahneme v priebehu niekoľkých týždňov až mesiacov [3, 6]. Je ale tiež možné, že sa ju už nikdy obnoviť nepodarí a pacient je trvalo odkázaný prinajmenšom na podpornú parenterálnu výživu. Dôležité však je, aby pacient dostával toľko enterálnej/orálnej výživy koľko je možné. Tá podporuje rastové vlastnosti sliznice čreva, zlepšuje absorpciu živín a redukuje škodlivý efekt totálnej parenterálnej výživy na pečeň [7, 33].
Hlavným príznakom short bowel syndrómu sú hnačky, ktoré sprevádzajú kŕče. Typickým príznakom býva steatorea. Často sa tiež vyskytuje pocit nafukovania a pálenie žáhy. Pacient si sťažuje na slabosť, únavu a neraz upadá do depresie. Po určitom čase, v závislosti od intenzity syndrómu, dochádza k malnutrícii, poklesu hmotnosti, hypovitaminóze, anémii, dysbalancii minerálov a dehydratácii, ktorá môže byť až život ohrozujúca. Bakteriálna infekcia ako dôsledok prerastania bakteriálnej črevnej mikroflóry vedie k febrilným stavom. Zriedkavosťou nie je ani alimentárna alergia.
Rozsiahla resekcia ilea môže vyústiť do malabsorpcie tukov a v tuku rozpustných vitamínov. Preto treba tieto vitamíny podávať vo vode rozpustnej forme a to buď jednotlivo alebo ako multivitamínové vo vode rozpustné prípravky (ADEK). Pacient s resekciou ilea vyžaduje tiež podávanie injekčnej formy vitamínu B12 v intervale 1–3 mesiacov. To však môže byť potrebné po dobu niekoľkých mesiacov až rokov. Pravidelný a dlhodobý monitoring hladiny vitamínu B12 je pri jeho deficiencii nevyhnutnosťou.
Z minerálov a stopových prvkov sa môže vyskytovať malnutrícia kalcia, ktorá býva často spôsobené malabsorpciou vitamínu D, železa, magnézia a zinku. Tieto prvky treba monitorovať periodicky, najmä však v mesiacoch tesne po prerušení parenterálnej výživy a vždy vtedy, keď sa vyvinú prolongované hnačky alebo prerastanie bakteriálnej mikroflóry.
Pacienti s SBS mávajú niekedy oslabenú peristaltiku a dilatované úseky tenkého čreva. Tieto faktory, aj s prípadnou absenciou ileocekálnej chlopne, podporujú prerastanie bakteriálnej mikroflóry v tenkom čreve [23]. To vyúsťuje do malabsorpcie, ktorá je dôsledkom inflamácie črevnej steny a dekonjugácie žlčových kyselín. Tá urýchluje reabsorpciu žlče, čím sa redukuje vstrebávanie tukov. Symptomatickými prejavmi takéhoto stavu sú odporne zapáchajúca vetry a stolica, nafukovanie, kŕče, úporné hnačky, ale aj gastrointestinálne krvácanie a akumulácia D-laktátovej kyseliny v krvi. Bakteriálne prerastanie črevnej mikroflóry v tenkom čreve možno diagnostikovať dychovým hydrogénovým testom buď nalačno alebo po orálnej náloži glukózy, aspiráciou a kultiváciou obsahu tenkého čreva alebo vyšetrením D-laktátovej kyseliny v krvi. Prerastanie bakteriálnej mikroflóry v tenkom čreve možno liečiť perorálnymi antibiotikami. V mnohých prípadoch treba podávať antibiotiká cyklicky, zvyčajne prvých päť dní v mesiaci. Niektorí pacienti musia antibiotiká užívať trvale. Vtedy je však potrebná ich rotácia v 2–3 mesačných intervaloch, aby sa zabránilo prerastaniu rezistentných bakteriálnych kmeňov [31].
Liečba SBS začína vždy konzervatívne a často aj konzervatívnou trvale, resp. až do exitu pacienta zostáva. Opiera sa o zmeny v diétnom režime, intravenóznu výživu, náhradu minerálov, stopových prvkov a vitamínov, ale aj medikamentov, ktoré slúžia na potlačenie alebo aspoň zmiernenie symptómov syndrómu. Rozhodujúcu úlohu v konzervatívnej liečbe zohráva odborník na SBS, ktorý intenzívne spolupracuje s gastroenterológom, hematológom, klinickým biochemikom a mikrobiológom.
Hnačky, ktoré pacienta sužujú najviac, sú vážnym terapeutickým problémom. Ak pacient neprijíma nič per os, možno aplikovať kodeín i.m. (poznámka: u nás nie je parenterálna forma kodeínu dostupná). V prípade perorálneho príjmu môže pomôcť Imodium alebo Lomotil, v refraktérnych prípadoch aj tinctura opii. Najťažší je manažment pacienta po resekcii kolonu a ilea, ktorý má založenú terminálnu jejunostómiu a zvyšok jejuna je menej ako 100 cm. V takýchto prípadoch môže pomôcť subkutánne podávanie analógu somatostatínu – octreotidu v dávke 100 mikrogramov subkutánne 3x denne. Takto možno zredukovať výdaj cez jejunostómiu až o 50 % [11].
Napriek adaptácii čreva a rôznym formám nutričnej podpory nemožno niektorým pacientom parenterálnu výživu vysadiť. Týka sa to najmä tých, ktorým zostane menej ako 60 cm jejuna a nemajú ileum a kolon. U takýchto pacientov je možné využiť koncepciu farmakologickej kompenzácie čreva, ktorá urýchľuje proces adaptácie. Zahŕňa podávanie rastového hormónu, parenterálnych alebo enterálnych suplementov glutamínu a stravu s vysokým obsahom uhľohydrátov, ktoré by mali pokrývať 55–60 % kalorickej potreby organizmu. Zvyšných 20–25 % a 20 % by sa malo hradiť z tukov, resp. proteínov [5, 25, 26].
Možnosti chirurgickej liečby SBS sú limitované a zahŕňajú netransplantačné metódy a transplantáciu. V minulosti sa využívali najmä techniky reverzných intestinálnych segmentov a recirkulujúcich kľučiek tenkého čreva. Ich cieľom bolo spomalenie intestinálneho „transit time,“ čo malo viesť k zlepšeniu absoprčných funkcií čreva a zníženiu počtu stolíc [2]. Výsledky boli kontroverzné až otázne a dnes sa tieto metódy používajú len zriedka [22]. Bianchiho procedúra („predĺženie čreva“), vytváranie arteficiálnych enterických chlopní, intestinálny tapering a tzv. sériová transverzálna enteroplastika (STEP) sú metódy, ktoré sa využívajú dnes [13, 27, 28, 29]. Názory na ich efektivitu sú však protichodné. Robia ich najmä detskí chirurgovia v centrách, ktoré sa špecializujú na chirurgiu tenkého čreva [34].
Transplantácia tenkého čreva, či už samotná alebo so súčasnou transplantáciou pečene, prípadne multiviscerálnymi transplantáciami, má rôznu úspešnosť. Horná hranica pooperačnej mortality dosahuje až 30 %, ročné a štvorročné prežívanie pacientov kolíše podľa údajov z centier okolo 80–90 %, resp. 60 % [1, 8, 9, 17, 30]. Prvá úspešná kombinovaná transplantácia pečene a tenkého čreva bola urobená v roku 1990. Odvtedy boli vyvinuté a aj vo väčšej miere využívané techniky izolovanej transplantácie tenkého čreva. Z hľadiska prežívania sa lepšie výsledky dosahujú vtedy, ak je transplantácia realizovaná skôr ako sa vyvinú sekundárne komplikácie SBS, najmä však cirhóza pečene [7, 24]. Transplantácie tenkého čreva sa dnes robia približne v 25–30 centrách. Pri predoperačnom zhodnotení je biopsia pečene, zo známych príčin, conditio sine qua non. Jej výsledok rozhoduje o izolovanej transplantácii tenkého čreva alebo jej kombinácii s transplantáciou pečene [31]. Najvážnejšími komplikáciami transplantácií bývajú sepsa a rejekcia štepu.
Našťastie, syndróm krátkeho čreva sa nevyvinie u každého pacienta, ktorý z rôznych príčin stratil rozsiahly úsek tenkého čreva. Medzi dôležité prediktory, ktoré pomáhajú predpovedať, či sa SBS vyvinie alebo nie, patrí dĺžka čreva v predchorobí, segment chýbajúceho čreva a vek pacienta v čase jeho straty, dĺžka zostávajúceho tenkého čreva a kolonu, ale aj zachovanie, resp. strata ileocekálnej chlopne [34].
Short bowel syndróm vznikajúci ako dôsledok roz - siahlej resekcie tenkého čreva môže byť vďaka adaptačným schopnostiam čreva len prechodným stavom. Počas procesu tzv. intestinálnej adaptácie dochádza vo zvyšku tenkého čreva k fyziologickým zmenám, ktoré zvyšujú jeho absorpčnú kapacitu. Tieto zmeny zahŕňajú: zmnoženie a predĺženie črevných klkov, predĺženie celkovej dĺžky čreva a spomalenie peristaltiky alebo tranzitu potravy tenkým črevom [35].
Naša kazuistika potvrdzuje, že SBS môže byť aj po rozsiahlej resekcii tenkého čreva (vrátane ilea) skutočne len prechodným stavom.
ZÁVER
V súčasnosti nejestvuje jednoznačne spoľahlivá metóda liečby short bowel syndrómu. Štvorročné prežívanie pacientov na parenterálnej výžive sa dosahuje až v 70 % prípadov [12, 16]. Mnohí pacienti mávajú septické komplikácie a častými problémami liečby sú dlhodobe udržateľný venózny prístup, ale aj vysoké ekonomické náklady. Najčastejšou príčinou smrti je zlyhanie pečene. Podávanie rastového hormónu, glutamínových suplementov a strava s vysokým obsahom uhľohydrátov poskytujú nové perspektívy konzervatívnej liečby.
Netransplantačné chirurgické metódy liečby, okrem reverzných segmentov čreva a arteficiálnych intestinálnych chlopní, sú možnosťami liečby pri pretrvávajúcom short bowel syndróme. Klinické zlepšenie možno pri ich využití pozorovať takmer u 80 % pacientov.
Prísľubom je transplantácia čreva, či už izolovaná alebo kombinovaná s pečeňou alebo v rámci multiviscerálnych transplantácií. Neustále sa zlepšujúca technika transplantácie predlžuje prežívanie pacientov. Vážnym problémom naďalej zostáva imunologická tolerancia. Novšie preparáty (napr. Tacrolimus), ale aj aplikácia antigénov darcu cez portálnu vénu ešte pred transplantáciou, sú ďalšími možnosťami zlepšenia výsledkov liečby.
Rozsiahle resekcie tenkého čreva prinášajú riziko prinajmenšom prechodného short bowel syndrómu. Incidencia trvalého short bowel syndrómu však našťastie nie je taká vysoká, akoby sa dalo predpokladať. Častejšie je syndróm len prechodným stavom. Jeho intenzívna liečba vyžadujúca úzku interdisciplinárnu spoluprácu však napokon o osude pacienta rozhoduje. Kazuistika z nášho pracoviska je toho príkladom.
doc. MUDr. A. Prochotský, CSc.
II. chirurgická klinika LF UKo FNsP Bratislava
Antolská 11
851 07 Bratislava 5
Slovenská Republika
Sources
1. Abu-Elmagd, K., Reyes, J., Todo, S., Rao, A., Lee, R., Irish, W. Clinical intestinal transplantation: new perspectives and immunologic considerations. J. Am. Coll. Surg., 1998, roč. č. 5, s. 512–525; diskusia s. 525–527.
2. Baldwin-Price, H. K., Copp, D., Singleton, A. O. Reversed intestinal segments in the management of anenteric malabsorption syndrome. Ann. Surg., 1965, roč. 161, s. 225–230.
3. Booth, I. W. Enteral nutrition as primary therapy in short bowel syndrome. Gut., 1994, roč.35, Suppl. 1, S 69–72.
4. Borgstrom, B., Dahlquist, A., Lundh, G. Studies of intestinal digestion and absorption in the human. J. Clin. Invest., 1957, roč. 36, s. 1521–1536.
5. Byrne, T. A, Persinger, R. L, Young, L. S, Ziegler, T. R, Wilmore, D. W. A new treatment for patients with short-bowel syndrome. Growth hormone, glutamine, and a modified diet. Ann. Surg., 1995, roč. 86, č. 5, s. 243–254, diskusia s. 254–255.
6. Carbonnel, F., Cosnes, J., Chevret, S., Beaugerie, L., Ngo, Y., Malafosse, M. The role of anatomic factors in nutritional autonomy after extensive small bowel resection. JPEN J. Parentel. Enteral. Nutr., 1996, roč. 20, č. 4, s. 275–280.
7. Cavicchi, M., Beau, P., Crenn, P., Degott, C, Messing, B. Prevalence of liver disease and contributing factors in patients receiving home parenteral nutrition for permanent intestinal failure. Ann. Intern. Med., 2000, roč. 132, č. 7, s. 525–532.
8. Cicalese, L., Baum, C., Brown, M., Sileri, P., Smith, D., Abcarian, H. Segmental small bowel transplant from adult living-related donors. Transplant. Proc., 2001, roč. 33, č. 1–2, s. 1553–1558.
9. Cicalese, L., Rastellini, C., Sileri, P., Abcarian, H., Benedetti, E. Segmental living related small bowel transplantation in adults. J. Gastrointest. Surg., 2001, roč. 5, č. 2, s. 168–172; diskusia s. 173.
10. Clarke, R. M. Mucosal architecture and epithelial cell production rate in the small intestine of the albino rat. J. Anat., Nov. 1970, roč. 107, č. 3, s. 519–529.
11. Farthing, M. J. Octreotide in dumping and short bowel syndromes. Digestion, 1993, roč. 54, Suppl. 1, s. 47–52.
12. Howard, L., Ament, M., Fleming, C. R., Shike, M., Steiger, E. Current use and clinical outcome of home parenteral and enteral nutrition therapies in the United States. Gastroenterology, 1995, roč. 109, č. 2, s. 355–365.
13. Javid, P. J., Kim, H. B., Duggan, C. P., Jaksic, T. Serial transverse enteroplasty is associated with successful short-term outcomes in infants with short bowel syndrome. J. Pediatr. Surg., 2005, roč. 40, č. 6, s. 1019–1023; diskusia s. 1023–1024.
14. Johansson, C. Studies of gastrointestinal interactions. VII. Characteristics of the absorption pattern of sugar, fat and protein from composite meals in man. A quantitative study. Scand. J. Gastroenterol., 1975, roč. 10, č. 1, s. 33–42.
15. Kabátová, Z., Profant, M., Šimko, M., Šimková, Ľ., Groma, M. Výsledky kochleárnej implantácie na Slovensku. Lekárske listy – Odborná príloha Zdravotníckych novín, 2003, roč. 5, č. 27, s. 24–25.
16. Ladefoged, K., Hessov, I., Jarnum, S. Nutrition in short-bowel syndrome. Scand. J. Gastroenterol. Suppl., 1996, s. 122–131.
17. Langnas, A. N, Shaw, B. W. Jr., Antonson, D. L., Kaufman, S. S., Mack, D. R., Heffron T. G. Preliminary experience with intestinal transplantation in infants and children. Pediatrics, 1996, roč. 97, č. 4, s. 443–448.
18. Lennard-Jones, J. E. Indications and need for long-term parenteral nutrition: implications for intestinal transplantation. Transplant. Proc., 1990, roč. 22, č. 6, s. 2427–2429.
19. Lennard-Jones, J. E. Review article: practical management of the short bowel. Aliment. Pharmacol. Ther., 1994, roč. 4, č. 6, s. 563–577.
20. Moreno, J. M., Planas, M., Lecha, M., Virgili, N., Gomez-Enterría, P., Ordonez, J. The year 2002 national register on home-based parenteral nutrition. Nutr. Hosp., 2005, roč. 20, č. 4, s. 249–253.
21. Nightingale, J. M., Lennard-Jones, J. E. The short bowel syndrome: what‘s new and old? Dig. Dis., 1993, roč. 11, č. 1, s. 12–31.
22. Panis, Y., Messing, B., Rivet, P., Coffin, B., Hautefeuille, P., Matuchansky, C. Segmental reversal of the small bowel as an alternative to intestinal transplantation in patients with short bowel syndrome. Ann. Surg., 1997, roč. 225, č. 4, s. 401–407.
23. Phillips, S. F., Giller, J. The contribution of the colon to electrolyte and water conservation in man. J. Lab. Clin. Med., 1973, roč. 81, č. 5, s. 733–746.
24. Quigley, E. M., Marsh, M. N., Shaffer, J. L., Markin, R. S. Hepatobiliary complications of total parenteral nutrition. Gastroenterology, 1993, roč. 104, č. 1, s. 286–301.
25. Scolapio, J. S., McGreevy, K., Tennyson, G. S., Burnett, O. L. Effect of glutamine in short-bowel syndrome. Clin. Nutr., 2001, roč. 20, č. 4, s. 319–323.
26. Stern, L. E., Erwin, C. R., O‘Brien, D. P., Huang, F., Warner, B. W. Epidermal growth factor is critical for intestinal adaptation following small bowel resection. Microsc. Res. Tech., 2000, roč. 51, č. 2, s. 138–148.
27. Thompson, J. S., Langnas, A. N. Surgical approaches to improving intestinal function in the short-bowel syndrome. Arch. Surg., 1999, roč. 134, č. 7, s. 706–709; diskusia s. 709–711.
28. Thompson, J. S., Langnas, A. N., Pinch, L. W., Kaufman, S., Quigley, E. M., Vanderhoof, J. A. Surgical approach to short-bowel syndrome. Experience in a population of 160 patients. Ann. Surg., 1995, roč. 111, č. 4, s. 600–605, diskusia s. 605–607.
29. Thompson, J. S., Pinch, L. W., Young, R., Vanderhoof, J. A. Long-term outcome of intestinal lengthening. Transplant. Proc., 2000, roč. 32, s. 1242–1243.
30. Todo, S., Reyes, J., Furukawa, H., Abu-Elmagd, K., Lee, R. G., Tzakis, A. Outcome analysis of 71 clinical intestinal transplantations. Ann. Surg., 1995, roč. 111, č. 3, s. 270–280; diskusia s. 280–282.
31. Vanderhoof, J. A., Langnas, A. N. Short-bowel syndrome in children and adults. Gastroenterology, 1997, roč. 26, č. 5, s. 1767–1778.
32. Weser, E. Nutritional aspects of malabsorption: short gut adaptation. Clin. Gastroenterology, 1983, roč. 12, č. 2, s. 443–461.
33. Wilmore, D. W., Dudrick, S. J., Daly, J. M., Vars, H. M. The role of nutrition in the adaptation of the small intestine after massive resection. Surg. Gynecol. Obstet., 1971, roč. 97, č. 4, s. 673–680.
34. Wilmore, D. W., Lacey, J. M., Soultanakis, R. P., Bosch, R. L., Byrne, T. A. Factors predicting a successful outcome after pharmacologic bowel compensation. Ann. Surg., 1997, roč. 113, č. 3, s. 288–292; diskusia s. 292–293.
35. Wilmore, D. W, Robinson, M. K. Short bowel syndrome. World J. Surg., 2000, roč. 24, č. 12, s. 1486–1492.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2008 Issue 6-
All articles in this issue
- Cystic Feochromocytoma, Mimicing a Liver Cyst. A Case Review
- Short Bowel Syndrome and Limits of Small Intestinal Resections
- Chronic Wound as a Precancerosis (Ulcus Marjolini – Marjolin‘s Ulcer) – A Case Review
- Plastic and Reconstructive Surgery and Orthopaedics Interdisciplinary Cooperation in the Management of Extremity Injuries. Review
- Ventral Hernia Associated with Morbid Obesity – When Is Surgery Indicated?
- CT Findings in Alcohol Intoxicated Patients after Mild Brain Injury
- Miniinvasive Surgery in Spontaneous Pneumothorax – Indications and Surgical Technique
- Current Benefit of Biological and Non-biological Methods in the Treatment of Acute Liver Failure
- Surgical Site Infection Following Proximal GIT Procedures
- Ruputure of an Abdominal Aortic Aneurysm into the Inferior Vena Cava
- Leiomyoma of the Abdomen Wall. Case Report
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Short Bowel Syndrome and Limits of Small Intestinal Resections
- Cystic Feochromocytoma, Mimicing a Liver Cyst. A Case Review
- Ventral Hernia Associated with Morbid Obesity – When Is Surgery Indicated?
- Miniinvasive Surgery in Spontaneous Pneumothorax – Indications and Surgical Technique
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career