-
Medical journals
- Career
Mnohočetný myelom pohledem praktika – kazuistika pracovnělékařských služeb
Authors: J. Ševčíková 1,2; H. Kollárová 2; A. Entrová 2,3
Authors‘ workplace: Všeobecný praktický lékař, Klinika Orpral, s. r. o, Bohuňovice, vedoucí lékařka MUDr. Jarmila Ševčíková, Ph. D. 1; Lékařská fakulta Univerzity Palackého v Olomouci, Ústav preventivního lékařství, přednostka prof. MUDr. Dagmar Horáková, Ph. D. 2; Transfuzní oddělení Fakultní nemocnice Olomouc, primářka MUDr. Dana Galuszková, Ph. D., MBA 3
Published in: Pracov. Lék., 73, 2021, No. 1-2, s. 21-29.
Category: Case Report
Overview
Mnohočetný myelom je onemocněním převážně vyššího věku a je druhým nejčastějším zhoubným onemocněním krvetvorné tkáně. Tvoří asi 10 % všech krevních nádorových onemocnění a jeho incidence pozvolna narůstá. V prognóze onemocnění hraje klíčovou roli včasný záchyt a terapie. Přes jeho vzácnost je třeba na něho myslet i u mladých jedinců. Péče o pacienta s mnohočetným myelomem vyžaduje mezioborovou spolupráci.
Cílem sdělení je shrnout základní informace o mnohočetném myelomu, prezentovat kazuistiku z praxe a zmínit přitom i pracovnělékařské aspekty.
Klíčová slova:
mnohočetný myelom – praktický lékař – pracovnělékařské služby
ÚVOD
Mnohočetný myelom (MM) je druhým nejčastějším zhoubným onemocněním krvetvorné tkáně, tvoří asi 10 % všech krevních nádorových onemocnění. Incidence onemocnění je 4,8/100 000 obyvatel v České republice (ČR), s nepatrnou převahou výskytu onemocnění u mužů [1, 2]. Riziko výskytu MM se zvyšuje s věkem, medián věku při stanovení diagnózy mnohočetného myelomu je 68 let u mužů a 70 let u žen. Jenom 1 % osob je v době stanovení diagnózy mladší 40 let [2, 3]. V počáteční bezpříznakové fázi nemoci je diagnostikováno pouze 20 % pacientů. Právě včasný záchyt a terapie však hrají v prognóze onemocnění klíčovou roli [4]. Péče o pacienta s MM vyžaduje mezioborovou spolupráci, v níž má praktický lékař své nezastupitelné místo.
MM vzniká poruchou plazmatických buněk. Plazmatické buňky se vyvíjí z B lymfocytů a jsou důležitou součástí imunitního systému. Jejich funkcí je tvorba protilátek v případě infekce. Za normálních okolností sídlí plazmatické buňky v kostní dřeni, kde mají zastoupení asi 5 % [5]. K jejich maturaci dochází po setkání s antigenem v lymfatické tkáni a respiračním traktu [6].
V případě nekontrolovatelného množení plazmatických buněk v kostní dřeni s tvorbou klonů dochází k malignímu zvratu. Nádorově změněné plazmatické buňky označujeme jako buňky myelomové. Myelomové buňky infiltrují kostní dřen, omezují krvetvorbu a produkují defektní imunoglobuliny [1]. Nádorová hmota navíc osteolyticky poškozuje okolní kostní tkáň. Jelikož všechny nádorové buňky pochází z jediné buňky plazmatické, produkují totožnou protilátku. Tento abnormální monoklonální imunoglobulin (M-protein) se dostává do krve a někdy je vylučován také do moči [1].
Choroba může dlouhou dobu probíhat zcela asymptomaticky a projeví se až poškozením cílových orgánů, například patologickou frakturou či poruchou funkce ledvin [7]. V prognóze nemoci hraje klíčovou roli včasný záchyt a terapie. Podezření na mnohočetný myelom zpravidla jako první vysloví praktický lékař, a podílí se tak na včasném záchytu a diagnostice tohoto zhoubného onemocnění.
Cílem sdělení je shrnout základní informace o mnohočetném myelomu, prezentovat kazuistiku z praxe a zmínit přitom i pracovnělékařské aspekty. Kazuistika mimo jiné dokumentuje, že toto zhoubné onemocnění postihuje i poměrně mladé jedince.
Epidemiologie
Mnohočetný myelom je po lymfomu druhým nejčastějším zhoubným onemocněním krvetvorné tkáně a jak již bylo zmíněno, tvoří asi 10 % všech krevních nádorových onemocnění. Přesto patří mezi onemocnění vzácná, kdy představuje pouze 1 % všech malignit [8].
Incidence mnohočetného myelomu v ČR pozvolna stoupá od 2,3 až na 6,0 nových případů na 100 000 obyvatel v období 1985–2017, v letech 2017–2019 byl zaznamenán mírný pokles na 5,2. Ještě významnější trend lze pozorovat v prevalenci onemocnění se vzestupem z 6,3 na 18,8 žijících nemocných s MM na 100 000 obyvatel v období 1990–2014 [1, 2, 9]. S tím nekoresponduje vývoj mortality, která se v posledních 20 letech prakticky nemění (obr. 1).
Image 1. Incidence a mortalita MM v ČR 1977-2019 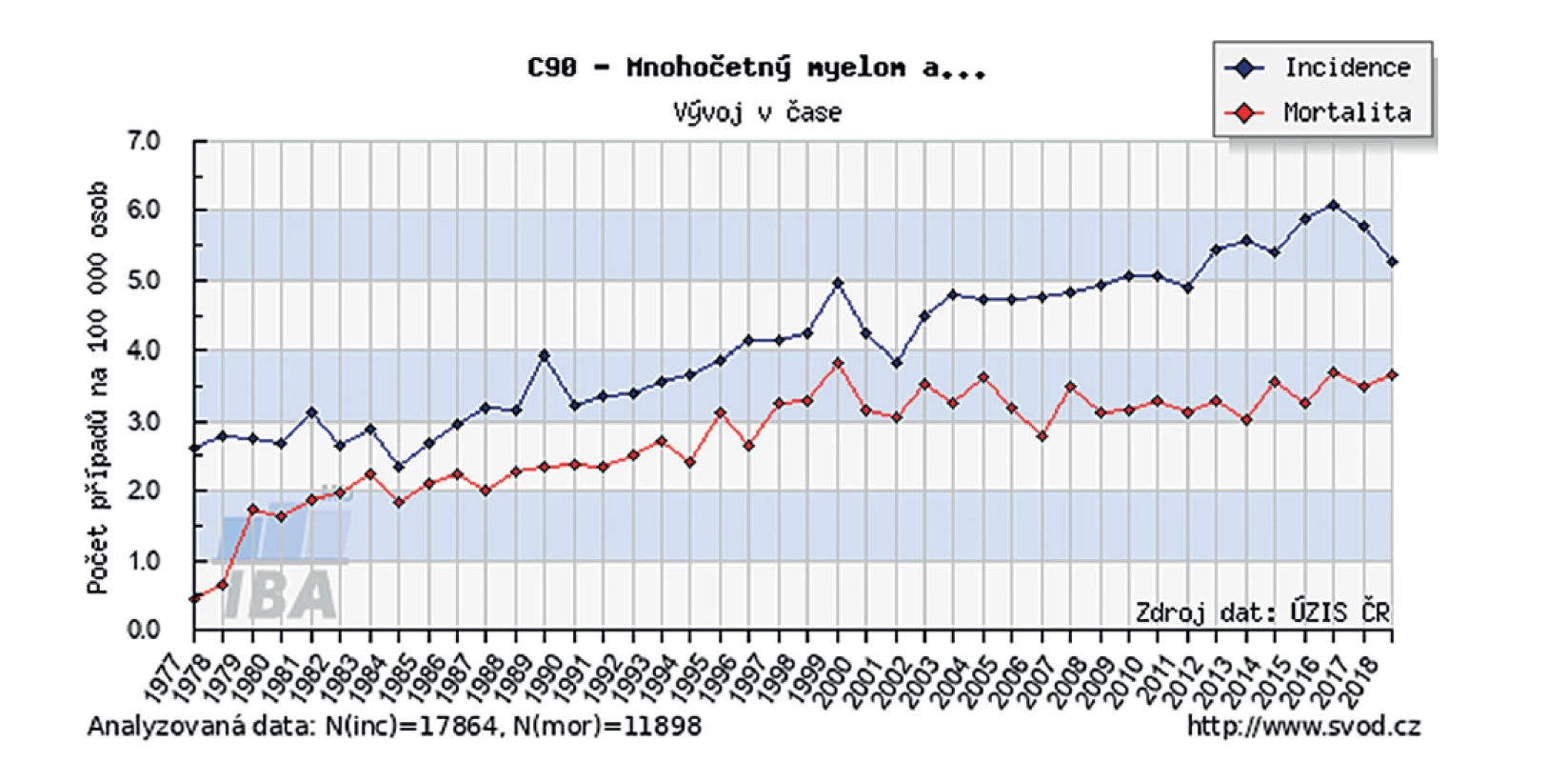
Zdroj: http://www.svod.cz Etiologie
Příčiny mnohočetného myelomu nejsou dosud zcela objasněny. Pro většinu nádorů však platí, že nejvýznamnějším, a přitom neovlivnitelným rizikovým faktorem, je věk. Také mnohočetný myelom je onemocněním převážně vyššího věku. Pouze 1 % osob je v době stanovení diagnózy mladších 40 let. Incidence MM se ve věku nad 70 let zvyšuje téměř trojnásobně (obr. 2). V průběhu života dochází k hromadění a kombinaci nepříznivých faktorů vedoucích k nestabilitě genetické výbavy plazmatických buněk. Uplatňují se faktory životního stylu, životního a pracovního prostředí, faktory demografické, působení chemických látek, radiace, výživové faktory, hormonální změny a také věkem podmíněný pokles imunity. Častěji bývají postiženi muži [1, 2, 10, 11]. Vyšší incidence MM je v afro-karibské skupině obyvatel [2].
Image 2. Věkové složení pacientů s MM 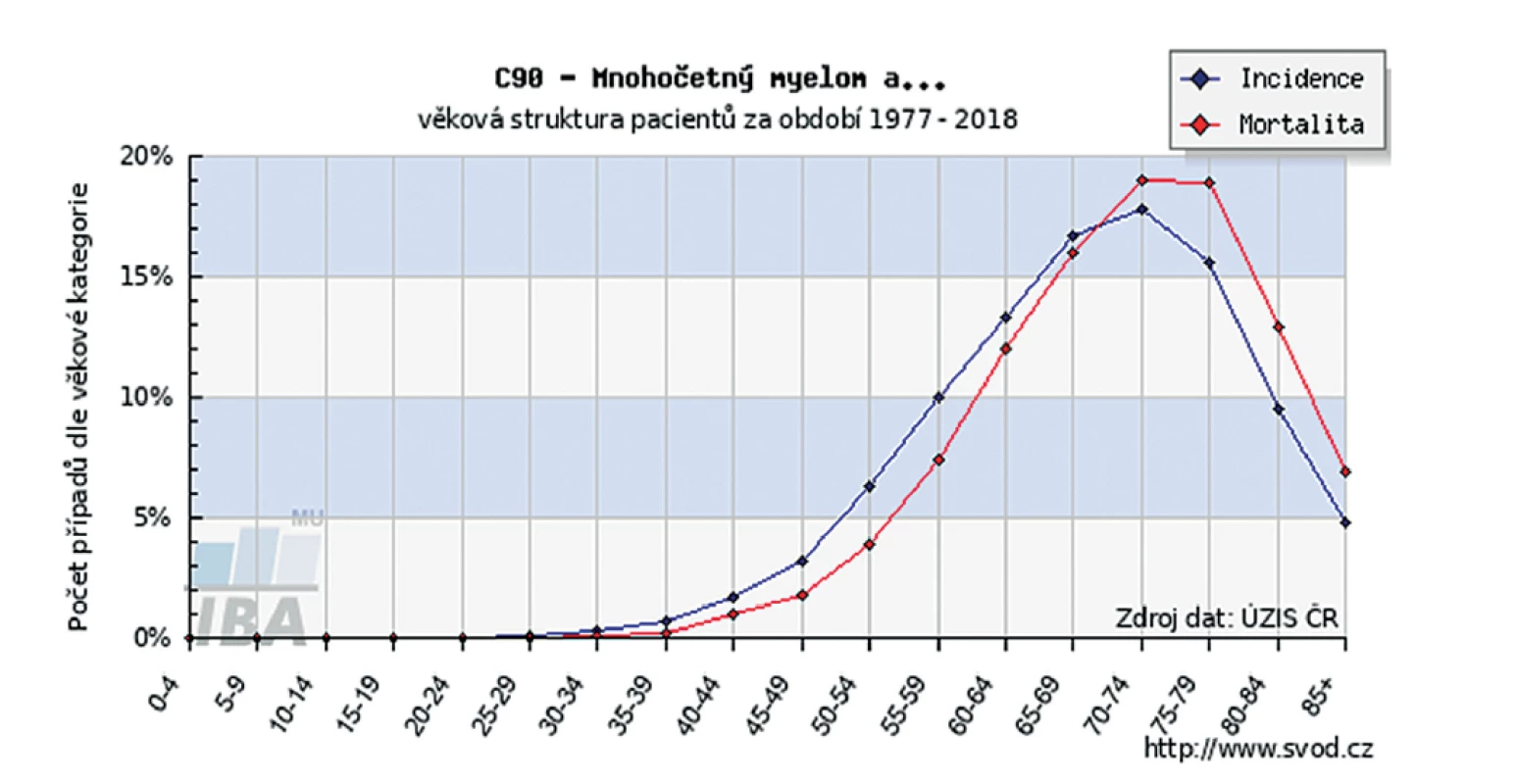
Zdroj: http://www.svod.cz Symptomatologie a diagnostika
Mnohočetný myelom má plíživý charakter, začátek onemocnění je často nenápadný. Onemocnění může dlouhou dobu probíhat zcela asymptomaticky, včasná diagnostika tedy bývá zpravidla náhodná [5]. Symptomatičtí pacienti se většinou nachází už v pokročilejší fázi choroby. Příznaky mnohočetného myelomu mohu být snadno zaměněny za příznaky běžných nemocí [12]. Klinické projevy jsou podmíněny především infiltrací kostní dřeně myelomovými buňkami, přítomností monoklonálního imunoglobulinu (MIG) v séru nebo v moči a poruchou imunity [13]. K praktickému lékaři přivádějí pacienta s myelomem nejčastěji bolesti páteře. Osteolytické působení myelomových buněk s následným odvápněním skeletu působí bolesti zpravidla v místech největšího zatížení páteře, tedy v bederní krajině, méně často na končetinových kostech. Prvním projevem myelomu tak nezřídka bývá kompresivní fraktura obratle nebo patologická fraktura v jiné lokalizaci. Dalšími častými stesky pacientů s mnohočetným myelomem jsou vleklá únava, malátnost, nevýkonnost, či nadměrná spavost jako projevy anemie. Dále se mohou vyskytnout krvácivé projevy na kůži a sliznicích při trombocytopenii a náchylnost k infekcím u leukopenie s nedostatečnou tvorbou protilátek. Vzácně se pacient k lékaři dostaví pro polydipsii, polyurii, nevolnosti či zvracení v rámci hyperkalcemie [3, 5, 14, 15]. Hromadění paraproteinu v drobných cévách zhoršuje funkce orgánů a projeví se například poškozením ledvin nebo zraku. Poruchy funkce ledvin nacházíme častěji u pacientů s masivní tvorbou monoklonálních lehkých řetězců, které přecházejí do moči [13, 17]. V literatuře bývají projevy orgánové dysfunkce zahrnuty v označení CRAB (C – hyperkalcemie, R – renální postižení, A – anemie, B-lytická kostní ložiska) [16]. Vzácnějšími symptomy jsou těžká kombinovaná dyslipidemie s hyperviskozitou krve špatně reagující na farmakoterapii a kryoglobulinemie s jejími typickými projevy ve vazbě na chladné počasí, kdy dochází k systémové zánětlivé odpovědi organismu. Sami pacienti vnímají především kožní postižení, jako Raynaudův fenomen, purpuru, dále kloubní a svalové bolesti. Při postižení plic si stěžují na kašel, či poruchy dechu. Kryoglobulinemii provází též glomerulonefritidy a neuropatie [15, 16, 18, 19].
Pilířem diagnostiky mnohočetného myelomu je komplexní hematologické vyšetření zahrnující vyšetření krevního obrazu včetně diferenciálního rozpočtu, provedení elektroforézy plazmatických bílkovin, imunofixaci séra, imunofenotypizaci krevních elementů, vyšetření volných lehkých řetězců v séru a moči, vyšetření kostní dřeně. Prvním varovným signálem může být pro lékaře zvýšená sedimentace, která dosahuje i stovkových hodnot za první hodinu. Zobrazovací metody jako rentgen (RTG), počítačovou tomografii (CT), magnetickou rezonanci (MR), pozitronovou emisní počítačovou tomografii (PET CT), či denzitometrii využíváme především k ozřejmění rozsahu onemocnění [1, 3, 20, 21, 22].
Terapie
I přes značné pokroky v terapii zůstává pro většinu pacientů MM onemocněním nevyléčitelným, četně relabujícím, vyžadujícím opakovanou léčbu. Podmínkou vyléčitelnosti jsou včasný záchyt a použití včasné intenzivní komplexní vstupní terapie a následně terapie udržovací [23]. Pětileté relativní přežití u léčených pacientů v České republice z období 2010–2014 bylo necelých 40 % [2].
Pacienti v počátečním stadiu choroby bez orgánových projevů myelomu bývají pouze sledováni. Důležité je zachování přiměřené pohybové aktivity k udržení mineralizace kostí a pitný režim s ohledem na uchování funkce ledvin [3].
Léčba MM by měla být zahájena v případě splnění kritérií symptomatické fáze onemocnění (známky orgánového poškození „CRAB“) nebo u vysoce rizikových asymptomatických pacientů. U nově diagnostikovaných pacientů s MM léčebné strategie používají vždy, pokud je to možné, maximálně možnou intenzivní léčbu (vysokodávkovanou chemoterapii s autologní transplantací kostní dřeně nebo bez transplantace) [24].
Relapsy mívají agresivnější průběh a kratší dobu trvání léčebné odpovědi a ve finále vyústí v refrakterní chorobu [3].
Největší význam pro zlepšení dlouhodobého přežití u pacientů s MM má použití nových léčebných kombinací s novými preparáty. V případě progrese nemoci jsou léčbou volby MM imunomodulační léčiva (lenalidomid a thalidomid) a inhibitory proteazomu (bortezomid) obvykle v kombinaci s kortikosteroidy (dexametazon, prednison), alkylační látky (cyklofosfamid, melfalan) a nově i monoklonální protilátky (elutuzumab a daratumumab), případně s následnou autologní transplantací kmenových buněk (Autologous Stem Cell Transplantation – ASCT). V rámci ramdomizovaných studií jsou zkoušeny kombinace s novými léčebnými modalitami – např. používání inhibitoru antiapoptotického proteinu bcl-2 (Venetoclax), selektivně působícího inhibitoru nukleárního transportu (Selinexor) nebo použití Car-T cells [24, 25, 26, 27].
Cílem protinádorové léčby je snížení počtu myelomových buněk, optimálně kompletní eliminace nádorové hmoty. K léčbě kostních ložisek nereagujících na chemoterapii se používá radioterapie. Podpůrná terapie počet myelomových buněk nesnižuje, ale omezuje příznaky nemoci, zejména bolesti. Zde mají výsadní postavení bisfosfonáty omezující řídnutí kostí. Terapie MM musí být vždy komplexní a individuální tak, aby se předešlo zbytečným komplikacím. Komplikace je třeba předvídat a řešit bezodkladně. Infekce podáním antibiotik, útlum krvetvorby podáním transfuzních přípravků, hyperviskózní syndrom plazmaferézou, renální selhání dialyzační léčbou. U depresivních pacientů je na místě podpůrná psychoterapie, případně podání antidepresiv [24]. Praktický lékař zná své pacienty dlouhou dobu, mnohdy od dětství, ve všeobecné praxi se také odehrává s pacientem nejvíce kontaktů. Právě praktik tak může jako první zaznamenat změnu zdravotního stavu, nebo chování pacienta a přispět i k včasné terapii komplikací [25].
Prevence
Lékaři první linie se účastní zdravotnické prevence na všech jejích úrovních, nejvíce na úrovni primární a sekundární. Všeobecná preventivní prohlídka u praktického lékaře se podle vyhlášky č. 70/2012 Sb. provádí vždy jednou za 2 roky, nejdříve po uplynutí 23 měsíců po provedení poslední prohlídky [26]. Cílem primární prevence je odstranit již vzniklý rizikový faktor nebo alespoň neumožnit jeho působení. Protože příčiny MM nejsou dosud objasněny, primární preventivní opatření zůstávají pouze obecná. Patří sem poučení o zásadách správné výživy, pohybových aktivitách, otužování, poučení o prevenci infekčních nemocí včetně očkování a prevence vzniku závislostí na tabáku a jiných návykových látkách.
Včasný záchyt onemocnění v rámci prevence sekundární zvyšuje šanci na vyléčení. Z tohoto pohledu by neměly být přehlédnuty stesky pacienta, které bývají mezi pacienty časté a které lékař slyší v ordinaci denně a opakovaně. Nadměrná únavnost, spavost, bolesti páteře, častější nemocnost nemohou být lékařem bagatelizovány.
Cílem prevence terciární je zabránit recidivám onemocnění, což umožňuje dispenzarizace nemocných, většinou na specializovaném pracovišti. Stabilizovaný, nebo naopak pacient v terminální fázi onemocnění může být předán k dispenzarizaci registrujícímu praktikovi [27].
Cílem prevence kvartérní je potom zlepšit kvalitu života nemocného, předvídat a předcházet důsledkům nemoci a komplikacím v oblasti somatické, psychické i sociální. Patří sem například prevence onkologické bolesti, prevence pádů a tím i patologických zlomenin, prevence dekubitů, sekundárního depresivního syndromu, ale i sociální, psychická a případně duchovní podpora. Součástí prevence je i posouzení pracovní neschopnosti, invalidity či stupně závislosti. Koordinaci zdravotních a sociálních služeb a práce v terénu zajištuje praktický lékař [28].
KAZUISTIKA
Žena, 45 let, se dostavila do ordinace praktického lékaře k preventivní prohlídce pracovnělékařských služeb na pracovní pozici trenér jezdectví na koních, kategorii rizika 2. Z rodinné anamnézy: otec pacientky zemřel v 68 letech na zápal plic, matka se léčí s varixy, pacientka má jednu zdravou sestru a jednoho zdravého syna. Z osobní anamnézy: V 10 letech prodělala operaci ledvin pro oboustranný reflux, v 31 letech měla zlomenou levou klíční kost po pádu z kola. Nemocnost pacientky je malá, nemá zjištěné žádné alergie a trvale neužívá žádné léky. Kouří 20 cigaret denně 10 let, alkohol nekonzumuje.
Při vyšetření dne 6. 5. 2015 subjektivně udává bolesti v oblasti hrudní páteře s maximem mezi lopatkami. Bolesti se objevují při jízdě na koni, jiné potíže nemá. S částečným efektem na bolest sama užívala Nimesulid, který jí předepsán nebyl, vypůjčila si ho od matky.
V objektivním nálezu při fyzikálním vyšetření bylo patrné pohodlné držení těla, na hrudní páteři zjištěna poklepová a pohmatová bolestivost s maximem mezi lopatkami. Na cílený dotaz uvedla pád z koně před 4 dny a drobné pády opakovaně. Pacientce byl doporučen klidový režim a bylo indikováno RTG vyšetření hrudní páteře. Posudek o zdravotní způsobilosti k práci vydán nebyl s tím, že způsobilost bude posouzena až na základě doplňkových vyšetření. Vystavení pracovní neschopnosti pacientka odmítla s vysvětlením, že potíže má jen při jízdě na koni, klidové bolesti negovala.
S výsledkem RTG vyšetření se dostavila dne 12. 5. 2015. Na RTG snímku hrudní páteře byla popsána napřímená hrudní kyfóza, mírná sinistroskolióza, výška a tvar obratlových těl v normě, meziobratlové prostory bez zúžení, drobné zobáčkovité ventrální osteofyty na 5–9 hrudním obratli. Na skeletu nebyly popsány žádné ložiskové ani strukturální změny.
Subjektivně pacientka udávala spíše zhoršení bolestí, objektivně byly patrné paravertebrální spasmy mezi lopatkami po obou stranách páteře, pro které byl aplikován praktickým lékařem Mesocain 1% (Trimecaini hydrochloridum) 10 mililitrů intradermální pupeny paravertebrálně mezi lopatky. Dále byla pacientka odeslána na neurologické vyšetření.
Neurolog doplnil magnetickou rezonanci hrudní páteře, která prokázala kompresivní frakturu Th6 s prolomením horní krycí plochy s mírným snížením, bez propagace do páteřního kanálu. Podle popisu fraktura vznikla pravděpodobně na podkladu hemangiomu, patologická fraktura se jevila nepravděpodobná. Neurologem byla následně pacientka odeslána na neurochirurgické konzilium, kde dne 1. 6. 2015 neurochirurg indikoval vertebroplastiku Th6 a termín operace stanovil na 13. 7. 2015. Do té doby doporučil konzervativní postup, klidový režim.
K praktickému lékaři se k provedení předoperačního vyšetření dostavila pacientka 2. 7. 2015. Elektrokardiograf (EKG) a rentgenový snímek srdce a plic byly s fyziologickým nálezem. Pacientka byla afebrilní, TK 110/65 mm rtuti, puls 68/min. V laboratorním nálezu byla patrná leukocytóza 12.06 x 109/l (norma 4.0–10,0 x 109/l), trombocytopenie 87.0x109/l (150–400 x 109/l), anemie s hemoglobinem 115 g/l (120–160 g/l), erytrocyty 3.57 (3.8–5.2 x1012/l), dále známky postižení ledvin: kreatinin 95,0 μmol/l (44–90 μmol/l). V chemickém vyšetření moči byla krev 1 arb. j. a bílkovina 1 arb. j., v močovém sedimentu erytrocyty 1 arb. j., epitelie ploché 3 arb. j., hlen 1 arb. j., uráty 3 arb. j.
Pacientka připustila nachlazení a udávala častější močení, proto byla přeléčena Duomoxem (Amoxicillinum) 1 000 mg každých 12 hodin 7 dnů a pozvána ke kontrolním odběrům krve a moči. Podle kontrolního laboratorního vyšetření ze dne 10. 7. 2015 došlo k progresi leukocytózy na 13.78 x 109/l i anemie s hemoglobinem 105 g/l, erytrocyty 3.18 x 1012/l, trombocyty 96,0 x 109/l, CRP 0,4 mg/l (0–5), v chemickém vyšetření moči byla přítomna bílkovina 2 arb. j., v močovém sedimentu leukocyty 1 arb. j., oxaláty 1 arb. j. a uráty 1 arb. j.
Praktický lékař vyslovil podezření na možnou souvislost zlomeniny hrudního obratle a patologického laboratorního nálezu, termín vertebroplastiky zrušil, pacientku poučil o závažnosti stavu a odeslal ji k hematologickému vyšetření.
Dne 16. 7. 2015 byla na hematologii provedena suchá punkce kostní dřeně a 23. 7. 2015 byl pak na základě trepanobiopsie lopaty kyčelní kosti diagnostikován mnohočetný myelom. Karnofského skóre pacientky bylo ohodnoceno na 90 % (schopen normální aktivity, velmi málo symptomů). V laboratorním vyšetření ze dne 23. 7. 2015 došlo k další progresi leukocytózy na 14.08 x 109/l a zvýšení kreatininu na 103.0 μmol/l, dále byla přítomná hyperkalcemie s hodnotou vápníku 2.95 mmol/l (2.15–2.65 mmol/l). CT vyšetření prokázalo mnohočetná osteolytická ložiska lbi, páteře, sterna a pánve, největší v průměru 19,3 milimetrů a celotělová scintigrafie i SPECT vyšetření prokázalo přítomnost aktivní nádorové tkáně difuzně v kostní dřeni páteře, sterna, pánve, femurů, pletenců ramenních a humerů i žeber a ložiskově také v kalvě. Z trepanobiopsie byly získány reprezentativní vzorky s výrazně hypercelulární kostní dření v důsledku difuzní infiltrace monoklonálních nezralých plazmocytárních buněk, exprimujících CD 138, CD 56 a lehké řetězce kappa. Ty tvořily asi 70 % všech jaderných elementů kostní dřeně. Diagnóza byla uzavřena hematologem jako Myeloma multiplex IgG kappa, st. IIIA, ISS 2, t(4,14), del RB1, gain 1q21.
V úvodu terapie byly pacientce podány 4 cykly indukční chemoterapie CVD junior: Endoxan (cyklofosfamid), Velcade (bortezomibum), Dexametason (dexamethasone sodium phosphate) + podpůrná terapie k prevenci nevolnosti Zofran Zydis (Ondansetroni hydrochloridum dihydricum), Helicid (omeprazolum) 20 mg 2krát denně a k prevenci virových infekcí Zovirax (Aciclovirum) 200 mg 1krát denně, Milurit (Allupurinolum) 200 mg 1krát denně. Terapií bylo dosaženo parciální remise a pacientka byla indikována k autologní transplantaci kostní dřeně.
S ohledem na charakter nemoci pacientka dlouhodobě pozbyla způsobilost k práci na pozici trenér jezdectví. Tuto skutečnost nesla velmi těžce, neboť jí zaměstnání bylo zároveň největší zálibou a splněným dětským snem. Situaci s praktikem opakovaně konzultovala. Proti posudkovému závěru se neodvolala.
Přes poučení o riziku patologické zlomeniny v případě pádu alespoň příležitostně na koně sedala. Nakonec podala žádost o invalidní důchod a dne 10. 9. 2015 byl vypracován ošetřujícím praktickým lékařem odborný nález pro posouzení zdravotního stavu ve věcech sociálního zabezpečení k posouzení invalidity, na základě kterého byla posudkovým lékařem České správy sociálního zabezpečení přiznána pacientce invalidita 3. stupně.
Dne 16.11.2015 byl pacientce podán pulz Endoxanu (Cyclophosphamidum monohydricum) 3,8 gramů intravenózně, 25.11.2015 byla provedena separace periferních kmenových buněk a celkem bylo naseparováno 7,1x 10 x 6/kg CD34+buněk v množství dostatečném ke dvěma autologním transplantacím. Pacientka byla zajištěna antikoagulační léčbou Fraxiparine (Nadroparinum calcicum) 0,3ml roztoku1krát denně subkutánně a po přípravném režimu Alkeranem (melfalanum) 360 mg intravenózně byla 19. 1. 2016, v podmínkách jednotky intenzivní hematologické péče, v režimu běžném bez izolace a za selektivní dekontaminace gastrointestinálního traktu, provedena autologní transplantace periferních kmenových buněk. Štěp (vak A 3,5x10 x 6/kg CD341 buněk) byl převeden cestou centrálního žilního katetru 20. 1. 2016. Období cytopenie bylo komplikováno trombózou vena jugularis interna vpravo, která byla léčena nízkomolekulárním heparinem a také G+ katetrovou sepsí, jež se podařila zvládnout antibiotiky 1 linie-Tazocin (piperacillinum natricum a tazobactamum natricum).
Dne 5. 2. 2016 byla pacientka propuštěna do ambulantní péče. V domácím ošetřování dodržovala doporučení s dostatečným příjmem tekutin, šetřící dietu bez tuků a smažených a kořeněných jídel, bez alkoholu a kazivých potravin (majonéza, zákusky, šlehačka). Po dobu domácí péče medikovala pacientka Calcichew D3 (Calcii carbonas 500 mg/cholecalciferolum 400IU) 1krát denně, Citalopram (Citalopramum) 20 mg 1krát denně, Fluconazol (Fluconazolum) 100 mg 1krát denně 7 dnů, Valtrex (Valaciclovirum ) 500 mg 2krát denně 42 dnů, následně Zovirax (Aciklovirum) 200 mg 1krát denně do dne + 100, Helicid 20 mg 1krát denně, Cefuroxim (Cefuroximum axetili) 500 mg každých 12 hodin, Co-trimoxazol (trimethoprimum, sulfamethoxazolum) 480 mg 2krát týdně do dne + 100, Acidum folicum 1krát denně 5krát týdně ve dnech mimo užití Co-trimoxazolu, Fraxiparine forte 0,8 ml roztoku 1krát denně subkutánně.
Pro zhoršení bolestí v oblasti hrudní páteře s PEC/CT aktivitou v oblasti 10. hrudního obratle byla pacientce v červnu 2016 frakcionovaně aplikována radioterapie 30 Gy (Gray) a následně za hospitalizace pacientka cíleně rehabilitovala.
První progrese onemocnění: v červenci 2016 byla zahájena terapie RD (Revlimid/Dexamethazon) s potenciací o ixazomib od 2 cyklu – režim IRD (Ixazomib/Revlimid/ Dexamethazom) Revlimid (Lenalidomid) 25 mg 1krát denně v režimu D1–21, Dexamethazon 40 mg 1krát denně, Ixazomib 4 mg dne 23. 8., 30. 8. a 6. 9. 2016, nadále Helicid 20 mg 2krát denně 1krát týdně, Calcichew D3 1krát denně, Fraxiparine forte 0,6 ml roztoku 1krát denně subkutánně. Celkem byly do prosince 2016 podány 4 cykly chemoterapie.
Dne 25. 8. 2016 byla praktikem odeslána k odbornému vyšetření pro bolesti břicha. Subjektivně pacientka udávala trvalou bolest za stydkou sponou a v obou podbříšcích, více vpravo. Nezvracela, nevolnost negovala, poslední stolici měla před dvěma dny, tělesná teplota byla normální. Chirurgické konzilium vyloučilo náhlou příhodu břišní. K observaci byla přijata na hematoonkologickou kliniku. Objektivně při přijetí bylo Karnofského skóre 80 (schopen normální aktivity s mírnými obtížemi), výška 165 cm, hmotnost 75 kg, TK 90/65 mm Hg, P 90/min., pravidelný, poslech srdce a plic byl s normálním nálezem. Břicho bylo palpačně bolestivé v obou podbříšcích více vpravo, peristaltika byla oslabená, tapotement byl negativní oboustranně, vyšetření per rectum bylo bez patologického nálezu. Z laboratorního nálezu: urea 4,4 mmol/l (2,8–8,1 mmol/l), kreatinin 74,0 μmol/l, CRP 87,6 mg/l, leukocyty 7,24 x 109/l, trombocyty 186,0 x 109/l, hemoglobin 120 g/l, erytrocyty 3,8 x 1012/l. V chemickém vyšetření moči byla krev 1 arb. j., bílkovina 0 arb. j., v močovém sedimentu erytrocyty 4 arb. j., leukocyty 6 arb. j., epitelie dlaždicové 1 arb. j., hlen 1 arb. j. Na prostém snímku břicha ze dne 25. 8. 2016: podle popisu bez známek náhlé příhody břišní, na sonografickém vyšetření břicha 25. 8. 2016 byla popsána cysta pravé ledviny, jinak bez průkazu patologie na nitrobřišních orgánech. Dne 26. 8. 2016 bylo doplněno gynekologické vyšetření, rovněž s normálním nálezem. Po kompletizaci výsledů stav uzavřen jako počínající infekce močových cest a za hospitalizace na hematoonkologickém oddělení zahájena empiricky antibiotická terapie Tazocinem 4,5 gramů intravenózně každých 8 hodin. Pro přetrvávající bolesti břicha i přes pokles hodnoty CRP na 33,3 bylo dne 2. 9. 2016 provedeno CT vyšetření břicha, které prokázalo akutní zánět slepého střeva. Chirurg indikoval operativní řešení. Perioperačně byl nalezen periapendikulární infiltrát, nekrotické cékum, proto přistoupeno k ileocekální resekci. Stav pacientky se stabilizoval a následně byla propuštěna do domácího ošetřování. Přes všechny zdravotní komplikace zůstávala pacientka optimistická, věřila v plnou úzdravu, těšila se na budování nových stájí a návrat k původní profesi. Dne 1. 11. 2016 byla vyšetřena na neurologické ambulanci oddělení urgentního příjmu pro nově vniklé bolesti v oblasti levé kyčle s propagací do levé dolní končetiny po přední straně stehna až do lýtka. Na rentgenu levého kyčelního kloubu nález popsán bez průkazu čerstvé zlomeniny, počínající artrotické změny a mnohočetná osteolytická ložiska. CT vyšetření bederní páteře prokázalo mediální protruzi disku v etáži L4/5 4 milimetry a L5/S1 3 milimetry s kompresí durálního vaku a se zúžením páteřního kanálu. Byla podána analgetická infuze s Novalginem (Metamizolum natricum monohydricum) s částečným efektem, do medikace dále doporučena analgetika Novalgin 3krát denně 500 mg a Tralgit SR (Tramadoli hydrochloridum) 100 mg každých 12 hodin., doporučeno bylo zahájit řízenou rehabilitaci. Dne 3. 11. 2016 pacientka navštívila praktického lékaře pro horečnatý stav trvající 1 den, udávala horečku přes s 38 °C, bolesti v hrdle, dráždivý kašel. Při vyšetření v objektivním nálezu hrdlo bylo překrvené, zadní strana nosohltanu pokryta hlenohnisem, tonzily hypertrofické, bez povláčků. Poslech srdce a plic byl bez patologického nálezu, jizva po ileocekální resekci byla zhojená, pevná, klidná, tapotement byl oboustranně negativní. Při orientačním vyšetření moči testovacím papírkem nalezena stopa krve, bílkovina a leukocyty byly v moči negativní. Zaléčena byla Augmentinem (Amoxicillinum/acidum clavulanicum) 1gram každých 12 hodin. Stav pacientky se stabilizoval, infekci se podařilo zvládnout.
Druhá progrese onemocnění: od prosince 2016 pacientka podstoupila 3 cykly VTD (Velcade, Thalidomid, Dexamethazon), naplánována byla 2. autologní transplantace periferních kmenových buněk, pro kterou byla přijata 21. 3. 2017 na Hemato-onkologickou kliniku. Po přípravném režimu BuMel-Busulfan (Busulfanum)/ Alkeran (Melfalan) převeden 30. 30. 2017 štěp vaku B 3,6 x 106/kg CD34+ buněk, 1,758 x 108/kg monoklonárních buněk, 36,34 x 104/kg CFU-GM, 68,58 x 104/kg BFU-E. Období cytopenie bylo komplikováno febrilní neutropenií se záchytem gramnegativních tyčí v hemokultuře a E. coli a Proteus mirabilis v moči s odpovědí na antibiotika (Tazocin 4,5 g intravenózně každých 8 hodin), pro mukositidu v dutině ústní bylo přechodně nutné podání opiátových analgetik a plné parenterální výživy 5 dnů. Od dne +7 byly aplikovány růstové faktory Zarzio (filgrastimum) 48 IU subkutánně 1krát denně celkem 4krát. Došlo k postupnému vzestupu neutrofilů až nad 1,0 x 109 +12. den a pacientka byla ve stabilizovaném stavu propuštěna do ambulantní péče. Medikace po propuštění byla Calcichew D3 1krát denně, Citalopram 20 mg 1krát denně, Fluconazol 100 mg 1krát denně 7 dnů, Valtrex 500 mg 2krát denně 21 dnů, následně Zovirax 200 mg do dne +100, Helicid 20 mg 1krát denně, Cefuroxim 500 mg 2krát denně každých 12 hodin, Co-trimoxazol 480 mg 2krát týdně do dne + 100, Acidum folicum 1krát denně 5krát týdně ve dnech mimo užití Co-trimoxazolu, Fraxiparine forte 0,8 ml roztoku 1krát denně subkutánně, doporučena také probiotika. I nadále se pacientka snažila zůstat aktivní, k praktickému lékaři jezdila sama osobním autem, zůstávala pozitivně laděná.
Třetí progrese onemocnění: v červnu 2017 dochází k časné 3. progresi onemocnění, podány byly 2 cykly Pomalidomid + Dexamethazon, na které však rezistence, od srpna 2017 tedy v terapii KRD (Carfilzomid +Lenalidomid+Dexametazon), nicméně i pak choroba progreduje.
Dne 3. 8. 2017 byla praktickým lékařem cíleně vyšetřena k posouzení zdravotního stavu ve věcech sociálního zabezpečení pro posouzení invalidity. Kontrolní posouzení lékařem České správy sociálního zabezpečení potvrdilo i nadále invaliditu 3. stupně.
Čtvrtá progrese onemocnění: od 11. 10. 2017 byla pacientka přijata na hematoonkologickou kliniku k podání 1 cyklu terapie schválené zdravotní pojišťovnou ve složení Darzalex 90 mg (daratumumabum), Bortezomib 2,16 mg (bortezomibum) a Dexamed 24 mg (Dexamethasoni dihydrogenophosphas). Při přijetí bylo Karnofského skóre 90 (schopen normální aktivity, velmi málo symptomů), výška 165 cm, hmotnost 60 kg, TK 90/60 mmHg, P 70/min., pravidelný, při fyzikálním vyšetření bez patologického nálezu. Podání bylo komplikováno celkovou reakcí na Darzalex – zarudnutím v obličeji, dekoltu, dušností a kašlem. Stav se po podání Dithiadenu (Bisulepini hydrochloridum) a hydrataci upravil. Do ledna 2018 byly celkem podány 4 cykly, i přesto došlo k další progresi onemocnění.
Pátá progrese onemocnění: vzhledem k rezistenci na už podaná schémata chemo/imunoterapie byla u pacientky schválena polychemoterpie VD-PACE, její podání bylo zahájeno 30. 1. 2018 ve složení Endoxan 680 (Cyclophosphamidum monohydricum) 6,8 g intravenózně D 1–4, Etoposid (Etoposidum), 65 mg intravenózně D1–4, Cisplatin (Cisplatinum) 15 mg intravenózně D1–4, Doxorubicin (doxorubicin hydrochlorid) 15 mg intravenózně D1–4, Bortezomib (bortezomibum) 2,16 mg subkutánně D 1,7,15,22, Dexamethazon 40 mg intravenózně (Dexamethasoni dihydrogenophosphas) D 1–4 a D 15–18. Pro hyperkalcemii byly podávány pacientce bisfosfanáty a substituována vitaminem D. V medikaci po propuštění nadále Citalopram 20 mg 1krát denně, Fluconazolum 100 mg 1krát denně, Zovirax 200 mg 2krát denně, Helicid 40 mg 1krát denně, Co-trimoxazol 960 mg 3krát týdně, Cetirizin (cetirizini dihydrochloridum) 10 mg 1krát denně, Osteod (Calcitriolum) 0,25 mg 1krát denně, Pamitor (Acidum pamidronicum) 60 mg intravenózně 1krát měsíčně naposledy 30. 1. 2018, Dexamethazon 20 mg ráno a v poledne od 13. 2. do 16. 2. 2018, Fraxiparine forte 0,8 ml roztoku 1krát denně subkutánně.
Postupně ovšem u pacientky došlo k dalšímu nárůstu volných lehkých řetězců, proto a také vzhledem k pozitivitě proteinu Bcl-2 zahájena od 15. 3. 2018 terapie Venetoclaxem v úvodní dávce 400 mg denně. Podání první dávky proběhlo bez komplikací. Laboratorní vyšetření ze dne 16. 3. 2018: urea 5,0 mmol/l, kreatinin 80,0 μmol/l, CRP 1,5 mg/l, vápník 2,49 mmol/l, celková bílkovina 63,5 (65–85 g/l, albumin 34,7 (35–52 g/l), kyselina močová 179 μmol/l (202–417), leukocyty 7,6 x 109/l, trombocyty 97,0 x 109/l, Hemoglobin 85 g/l, erytrocyty 2,53 x 109/l, 20. 3. 2018 a 21. 3. 2018 podán pulz kortikoidů a od 23. 3. 2018 navýšena dávka Venetoclaxu na 800 mg za den, terapie potencována o Bortezomib. Od 1. 4. 2018 měla pacientka rýmu a kašel bez zvýšení teploty, udávala bolesti kostí, laboratorně zůstávala bez nutnosti hemosubstituce. Hemoglobin 96 g/l, erytrocyty 2,97 x 109/l, leukocyty 4,47 x 109/l, došlo ale k progresi trombocytopenie – trombocyty 28 x 109/l. Aplikace Bortezomibu byla tedy odložena. Pro bolesti dále do medikace přidán Oxycontin (oxycodone hydrochloride) 20 mg každých 12 hodin a pro nachlazení s elevací CRP na 52,7 mg/l Zinnat 500 mg každých 12 hodin. Dne 6. 4. 2018 pacientka přijata k hospitalizaci na hematoonkologickou kliniku pro extrémní hyperkalcemii a celkové zhoršení stavu. Karnofsky skóre 30 (těžký stav, indikace k hospitalizaci). Laboratorně: vápník více než 5 mmol/l, urea 7,8 mmol/l, kreatinin 109,0 μmol/l, kyselina močová 352 μmol/l, CRP 37,2 mg/l, leukocyty 8,39 x 109/l, trombocyty 29,0 x 109/l, hemoglobin 95 g/l, erytrocyty 2,79 x 109/l. Za hospitalizace zavedena maximální konzervativní terapie hyperkalcemie – forsírovaná diuréza, podání bisfosfanátů, puls kortikoidů, pro bolesti změna analgetické terapie na Durogesic (fentanylum) o síle 25 pikogramů uvolněných za 1 hodinu, hemosubstituována, podány 2 erymasy a v den propuštění 11. 4. 2018 ještě 1 erymasa. Po propuštění pacientka bez teplot, bez krvácivých projevů, bolesti kostí trvají. Při kontrole na hematoonkologické klinice dne 17. 4. 2018 opětovná elevace vápníku na 3,52 mmol/l, pro kterou aplikován Pamitor 60 miligramů v intravenózní infuzi 250 ml fyziologického roztoku, subkutánně podána chemoterapie Bortezomib 2,16 miligramů a Zarzio (filgrastimum) 48 milionů jednotek. Pozvána ke kontrolnímu vyšetření za týden, kdy 20. 4. 2018 pro opětovnou výraznou hyperkalcemii na 4,61 mmol/l a celkové zhoršení stavu s nauzeou, zvracením znovu hospitalizována. Pro refrakteritu onemocnění, vyčerpání veškerých terapeutických možností a celkové zhoršení stavu bylo rozhodnuto lékařským konziliem o ukončení paliativní chemoterapie. Opakovaně aplikovány bisfosfonáty s minimálním efektem na hyperkalcemii, pro infekt horních cest dýchacích zajištěna antibiotickou terapií Augmentin 1 gram každých 12 hodin a Prokanazol (Itraconazolum) 200 mg 1krát denně, upravena analgetická terapie na Durogesic o síle 50 pikogramů uvolněných za 1 hodinu v kombinaci s Novalginem 2krát denně 500 mg a na průlomovou bolest Lunaldin (fentanylum) 100 mikrogramů sublingválně, dále Prednison 20 mg denně.
Dne 27. 4. 2018 byla na přání pacientky propuštěna do domácího ošetřování, předána do péče praktického lékaře. Pro další celkové zhoršení stavu dne 2. 5. 2018 provedl praktický lékař návštěvu pacientky v bytě. Subjektivně pacientka udávala silné bolesti v dolních končetinách a jejich slabost, s pomocí manžela a matky ušla jen několik kroků. Nebyla schopna vylézt z vany. Vyšetřena na lůžku. Objektivně byla pacientka afebrilní, odevzdaná, k další terapii skeptická. Posadit se zvládla s pomocí další osoby, při manipulaci sténala bolestí. Krevní tlak byl 120/80 mm Hg, P 90/min., pravidelný, poslech srdce a plic byl s normálním nálezem, břicho měkké, prohmatné, tapotement byl negativní oboustranně, na dolních končetinách bylo patrné oboustranné prosáknutí s maximem kolem kotníků, palpace dolních končetin byla se zvýšenou citlivostí difuzně, bolestivě pacientka vnímala i dotyky na horních končetinách a trupu. Po vzájemné domluvě byla ponechána pacientka ve vlastním sociálním prostředí, bylo navýšeno transdermální podání fentanylu na 100 pikogramů za hodinu, na průlomovou bolest doporučen Lunaldin 100 mikrogramů subungválně. Lékařem byl veden psychoterapeutický podpůrný pohovor. Rodina byla poučena o prevenci vzniku dekubitů, nutnosti polohování, péče o pokožku a dostatečné hydratace. Dále byli manžel a matka pacientky srozuměni se závažností stavu, s principy péče o umírajícího a seznámeni s dalším postupem v případě úmrtí pacientky. Dne 4. 5. 2018 ve 14 hodin znovu požádal manžel pacientky o návštěvu praktického lékaře v bytě. Podle jeho sdělení se pacientce po navýšení opiátových náplastí ulevilo. V noci spala, ráno snídala, normálně komunikovala, před polednem ji vyvezli na zahradu k obědu. Náhle došlo ke zhoršení dechu, začala dráždivě kašlat, proto ji uložili zpět na lůžko, následně spavá, nedařilo se ji probudit. Objektivně byla pacientka opocená, soporózní, při manipulaci sténala, dýchala těžce, přerývaně, TK byl 120/90 mmHg, P 105/min., akce srdeční pravidelná, bez patologických fenoménů, při poslechu plic byly slyšitelné oboustranně chropy malých a velkých bublin. Praktik aplikoval Morphin (Morphini hydrochloridum trihydricum) 10 mg subkutánně. Rodina byla znovu poučena o závažnosti a neodklonitelnosti stavu. Pacientka zemřela v 18.00 hodin, obklopena nejbližší rodinou. Ohledání provedl praktický lékař v 19.00 hodin. Jako bezprostřední příčinu smrti stanovil plicní edém při embolii do plic.
DISKUSE
Předkládaná kazuistika ukazuje, jak je pro stanovení diagnózy důležitý správný a úplný odběr anamnestických dat, včetně podrobné pracovní anamnézy a že se i za běžně a často udávanými symptomy může skrývat závažné onemocnění v pokročilém stadiu. Poukazuje také na fakt, že i u mladých jedinců je nutné v rámci diferenciální diagnostiky zvažovat zhoubné onemocnění. Průběh nemoci, klinické projevy a počáteční chudá symptomatologie odpovídala mnohočetnému myelomu. Dalším přínosem uvedené kazuistiky je upozornění na skutečnost, že teprve laboratorní vyšetření přispělo ke správnému stanovení diagnózy a že i v rámci pracovnělékařské péče je třeba pacienta řádně vyslechnout a vyšetřit komplexně a zabývat se i zdánlivě nevýznamnými stesky [29, 30].
Práce lékařů první linie je léčebně-preventivní a onkologická prevence je její nedílnou součástí. Působení praktiků je dlouhodobé a kontinuální stále na stejném místě, s pacientem mají nejvíce kontaktů. Díky znalosti osobní, rodinné, pracovní a sociální anamnézy získávají praktici nadhled, který jim umožní chápat pacientovy obtíže v širších souvislostech. Právě oni většinou jako první vyslovují podezření na malignitu a účastní se na jejím záchytu a diagnostice. Onkologické prevence se účastní na všech jejich úrovních. V rámci prevence primární může praktik díky znalosti pacientova životního stylu upozornit na rizikové faktory a možnosti jejich ovlivnění, v rámci prevence sekundární doporučit cílené vyšetření a vysvětlit smysl preventivních prohlídek a screeningových vyšetření pro včasný záchyt nádorových onemocnění. V rámci prevence terciální přebírá praktik stabilizované onkologické pacienty k dispenzarizaci a v rámci prevence kvartérní zajišťuje terminálním pacientům lékařskou péči, psychickou oporu, koordinaci sociálních služeb a v případě úmrtí též ohledání. Stává se tak průvodcem pacientovou nemocí a někdy také umíráním.
ZÁVĚR
Z předloženého sdělení vyplývá, že navzdory významnému pokroku v terapii mnohočetného myelomu zůstává toto onemocnění nadále chorobou velmi závažnou. Nicméně část pacientů je v současné době dobře léčitelná při včasném použití komplexní intenzivní vstupní léčby včetně udržovací. Asi 40 % nemocných podstupujících komplexní intenzivní léčbu žije déle než 10 let od stanovení diagnózy. Proti tomu v 80. letech minulého století byla délka přežití pacientů s mnohočetným myelomem jen 2,5–3 roky. Prognóza pacientů s relabujícím/refrakterním mnohočetným myelomem je však výrazně horší.
Navzdory mladému věku, absenci přidružených onemocnění, vůli žít, široké paletě podávaných léků a individuálně a specificky volených léčebných kombinací a polychemoterapii naše pacientka zemřela 34 měsíců od stanovení diagnózy.
Nádorová onemocnění provázejí lidstvo od nepaměti a jsou druhou nejčastější příčinou úmrtí ve světě a také v České republice, a to u obou pohlaví a jsou odpovědná téměř za 1/4 všech úmrtí [1]. Přesto, že se mnohočetný myelom řadí mezi vzácná onemocnění, tvoří pouhé 1 % všech malignit, je třeba na něho pamatovat i u mladých jedinců.
Do redakce došlo dne 3. 8. 2021.
Do tisku přijato dne 10. 8. 2021.
Adresa pro korespondenci:
MUDr. Jarmila Ševčíková, Ph.D.
Za pilou 199
78314 Bohuňovice
e-mail: jarmilars@seznam.cz
Sources
1. Adam, Z., Krejčí, M., Vorlíček, J. et al. Hematologie. Přehled maligních hematologických onemocnění. 2. vydání, Praha, Grada, 2008.
2. Malušková, D., Svobodová, I., Kučerová, M. et al. Epidemiology of multiple myeloma in the Czech Republic. Klin. Onkol., 2017, 30, 35–42.
3. Hájek, R., Adam, Z., Ščudla, V. et al. za Českou myelomovou skupinu. Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou. Transfuze a hematologie dnes, 2012, 18 (Suppl 1). Dostupné z www: http:// www.myeloma.cz/res/file/Trans%20suppl%201.pdf.
4. Mnohočetný myelom. Česká myelomová skupina [online]. [cit. 2018–12–30]. Dostupné z www: .
5. Špička, I., Klánová, M. Mnohočetný myelom. Vnitř. Lék., 2013, 59, 7, s. 627–630.
6. Kumar, S. K., Rajkumar, V., Kyle, R. A. et al. Multiple myeloma. Nat Rev Dis Primers [online] 2017; 3 : 17046. Dostupné z DOI: .
7. Ryšavá, R. Renální selhání u mnohočetného myelomu a jeho léčba. Vnitř. Lék., 2020, 66, 7, s. 425–431.
8. Tsakiris, D. J., Stel, V. S., Finne P. et al. Incidence and outcome of patients starting renal replacement therapy for end-stage renal disease due to multiple myeloma or light-chain deposit disease: an ERA-EDTA Registry study. Nephrol. Dial. Transplant., 2010 Apr, 25, 4,, s. 1200–1206, doi: 10.1093/ndt/gfp679. Epub 2009 Dec 27. PMID: 20037169.
9. Dušek, L., Mužík, J., Kubásek, M., Koptíková, J., Žaloudík, J., Vyzula R. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2021-6-28]. Dostupný z www: http://www.svod.cz. Verze 7.0 [2007], ISSN 1802-8861.
10. Kyle, R. A., Rajkumar, S. V. Multiple myeloma. Blood, 2008, 111, s. 2962–2972.
11. Rajkumar, S. V,, Kyle, R. A. Treatment of multiple myeloma and related disorders. 1st edit. Cambridge: Cambridge University Press, 2009.
12. Vorlíček, J., Adam, Z. Mnohočetný myelom. Doporučené postupy pro praktické lékaře, ČLS JEP, reg. č. a/030/099, dostupné na: https://www.cls.cz/seznam-doporucenych-postupu?PHPSESSID-52695afa218b7cd4731757ba0978b85c.
13. Ščudla, V., Pika, T., Minařík, J. Role stanovení těžkých/lehkých párů řetězců imunoglobulinů u monoklonálních gamapatií. Vnitř. Lék., 2015, 61, 1, s. 60–61, 63–71.
14. Hrabálek, L., Bačovský, J., Ščudla, V. et al. Mnohočetný myelom páteře a jeho chirurgická léčba. Rozhl. Chir., 2011, 90, 5, s. 270–276.
15. Adam, Z., Krejčí, M., Pour, L. et al. Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014. Vnitř. Lék., 2014, 60, 10, s. 861–879.
16. Projekt CRAB, aneb Časnou diagnostikou k lepší kvalitě života. Praktický lékař, 2008, 88, 1, s. 59–61.
17. Ščudla, V., Minařík, J., Pika, T. Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease). Vnitř. Lék., 2012, 58, 1, s. 38–43.
18. Rajkumar, S.V., Kumar, S. Multiple Myeloma: Diagnosis and Treatment, symposium on neoplastic hematology and medical oncology, Mayo Clinic Proceedings Vol. 91 Issue 1 s. 101–119. Published in issue: January 2016
19. Machálková, K., Radocha, J., Maisnar, V. Hyperviskózní syndrom u pacientů s mnohočetným myelomem. Klin. Biochem. Metab., 19, 40, 2011, No. 2, s. 93–95.
20. Vaníček, J., Krupa, P., Adam, Z. Přínos různých zobrazovacích technik pro stanovení diagnózy a sledování aktivity mnohočetného myelomu. Vnitř. Lék., 2010, 56, 6, s. 585–590.
21. Ščudla, V., Herman, M., Minařík, J. et al. Přínos celotělové magnetické rezonance pro diagnózu MGUS a mnohočetného myelomu a stanovení Durie Salmon staging plus systému. Vnitř. Lék., 2011, 57, 1, s. 52–60.
22. Fernández de Larrea, C., Kyle, R. A., Durie, B. G. et al. International Myeloma Working Group. Plasma cell leukemia: consensus statement on diagnostic requirements, response criteria and treatment recommendations by the International Myeloma Working Group. Leukemia, 2013, 27, 4, s. 780–791.
23. Barlogie, B., Mitchell, A., van Rhee, F. et al. Curing myeloma at last: defining criteria and providing the evidence. Blood, 2014, Nov 13, 124, 20, s. 3043–3051.
24. Hájek, R., Plonková, H., Gumulec, J. Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem. Klin. Onkol., 2013, 26, 3, s. 163–169.
25. Ševčíková, J., Azeem, K., Kollárová, H. Úskalí screeningu nádorových onemocnění v ordinaci praktického lékaře. Praktický lékař, 2013, 93, č. 3, s. 121–124.
26. Kubiczková, L., Matějíková, J., Sedlaříková, L. et al. Proteasomové inhibitory v léčbě mnohočetného myelomu. Klin. Onkol., 2013, 26, 1, s. 11–18.
27. Dingli, D., Ailawadhi, S., Bergsagel, L. P. et al. Therapy for Relapsed Multiple Myeloma: Guidelines From the Mayo Stratification for Myeloma and Risk-Adapted Therapy, Mayo Clinic Proceedings Vol. 92 Issue 4p 578–598 Published online: March 10, 2017.
28. Prausová, J., Petráková, K., Býma, S., Šonka, P. Péče o vybraná onkologická onemocnění. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře 2018, ČLS JEP, ISBN 978-80-88280-09-5
29. Žídková, V., Nakládalová, M., Pastorková, R. Dočasná zdravotní nezpůsobilost zaměstnance k práci aneb: kam s ním. Pracovní lékařství, 2017, 69, 3–4, s. 93–98.
30. Švábová, K., Tuček, M., Nakládalová, M. Pracovní lékařství pro všeobecné praktické lékaře. Rabbe, Praha 2020, 158 s., ISBN: 978 - 80-87553-74-9
Labels
Hygiene and epidemiology Hyperbaric medicine Occupational medicine
Article was published inOccupational Medicine

2021 Issue 1-2-
All articles in this issue
- Posudková činnost v pracovním lékařství
- Termodynamická odpověď rukou na práci na počítači
- Paratyfus A a kampylobakterióza jako nemoc z povolání
- Mnohočetný myelom pohledem praktika – kazuistika pracovnělékařských služeb
- Okrúhle, 70 ročné jubileum odboru pracovné lekárstvo v Martine (pohľad na obdobie rokov 1951–2008)
- Zakladatelé pracovního lékařství
- Problémy s používáním Metodiky Nejvyššího soudu při stanovení finančních náhrad za ztížení společenského uplatnění
- Kritické myšlení aneb zamyšlení, proč jako společnost hloupneme
- doc. MUDr. Evžen Hrnčíř, CSc., MBA – blahopřání k 65. narozeninám
- Occupational Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mnohočetný myelom pohledem praktika – kazuistika pracovnělékařských služeb
- Paratyfus A a kampylobakterióza jako nemoc z povolání
- doc. MUDr. Evžen Hrnčíř, CSc., MBA – blahopřání k 65. narozeninám
- Posudková činnost v pracovním lékařství
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

