-
Medical journals
- Career
Dědičné nádorové syndromy, jejich testování a prevence
Authors: Lenka Foretová
Authors‘ workplace: Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno
Published in: Čas. Lék. čes. 2019; 158: 15-21
Category: Review Article
Overview
Většinou se jedná o monogenní příčinu predispozice způsobenou patogenní zárodečnou mutací v tumor-supresorovém genu, DNA-reparačním genu, méně často v onkogenu. Dosud je známo více než 200 různých dědičných nádorových syndromů. Nejčastěji je genetické testování prováděno pro podezření na dědičný syndrom nádorů prsu a vaječníků nebo na dědičný nepolypózní kolorektální karcinom neboli Lynchův syndrom, časté jsou i dědičné polypózy zažívacího traktu.
Klinický projev zárodečné mutace je variabilní i v rámci jedné rodiny, je ovlivněn jak pohlavím, tak dalšími genetickými i negenetickými faktory. Genetické poradenství a testování je běžně dostupné pro pacienty nebo jejich příbuzné. Metody testování se mění, nově se testování provádí pomocí nové generace sekvenování (masivního paralelního sekvenování) s testováním panelů mnoha rizikových genů. Po nalezení dědičné příčiny je nabízeno testování příbuzným. Genetické testování indikuje lékařský genetik po předchozí genetické konzultaci. Rizikové osoby by měly být dispenzarizovány na onkologických pracovištích v rámci rizikových preventivních ambulancí nebo na dalších specializovaných pracovištích dle typu syndromu.
Klíčová slova:
genetické poradenství – genetické testování
ÚVOD
V dnešní době je genetické vyšetření a testování dědičných nádorových syndromů součástí preventivní onkologické péče. Znalost osobní a rodinné anamnézy je důležitá pro doporučení genetického vyšetření. Familiární výskyt nádorových onemocnění je běžný, ve většině případů jsou však příčinou špatný životní styl, vyšší věk a další možné rizikové faktory nádorů. Monogenní predispozice k nádorovým onemocněním je odhadována asi u 5–10 % nádorů, u nádorů vaječníků až u 20 % nemocných bez ohledu na věk a rodinnou anamnézu. Genetická konzultace s podrobnou osobní a rodinnou anamnézou, která zachycuje nejméně čtyřgenerační rodokmen, může být indikací pro genetické testování. Genetik určí, jaké testování je vhodné podstoupit, kdo v rodině by měl být testován jako první a u koho je největší pravděpodobnost najít rizikovou mutaci. Vysvětluje výsledky testování a navrhuje další testování v rodině i preventivní péči. Vyšetření vysoce rizikových genů je nutné spojit s genetickým poradenstvím před i po testování. Před genetickým testováním musí pacient vždy podepsat informovaný souhlas.
Genetické testování se provádí v akreditovaných laboratořích molekulární genetiky pomocí nejmodernějších vyšetřovacích metod. Jedná se o metody k vyhledávání mutací, metody přímého Sangerova sekvenování nebo sekvenování nové generace (masivního paralelního sekvenování). Pozitivní výsledek musí být vždy potvrzen na dalším nezávisle izolovaném vzorku genomické DNA. Genetické testování musí vždy zahrnovat kompletní vyšetření všech exonů a exon-intronových spojení a vyšetření velkých přestaveb genů (velké delece nebo inzerce). Vzhledem k tomu, že klinické příznaky syndromů jsou velice variabilní a genetická příčina stejných onemocnění může být různá, je role lékařského genetika důležitá. V tab. 1 je podán stručný přehled nejčastěji diagnostikovaných nádorových syndromů.
Table 1. Některé vybrané syndromy s rizikem maligních onemocnění 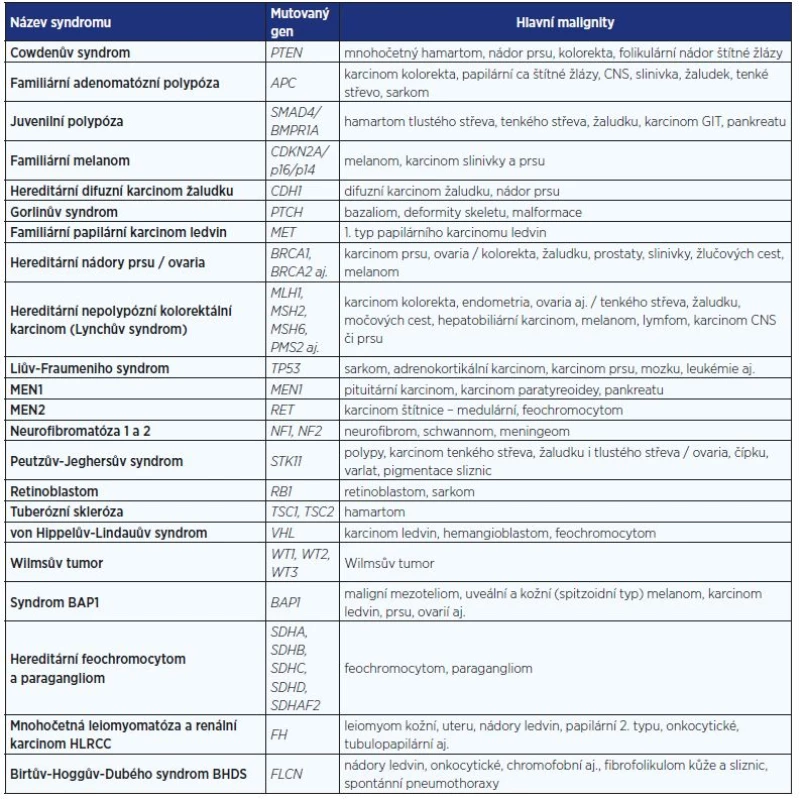
Genetické vyšetření by mělo být navrženo v případě:
- karcinomu ovarií v jakémkoliv věku, karcinomu prsu opakovaně se vyskytujícího v rodině, bilaterálního karcinomu prsu, vícečetných nádorů nebo nádorů prsu ve věku pod 45 let;
- nádorů kolorekta / dělohy opakovaně se vyskytujících v rodině, vícečetných nádorů, metachronních nádorů, nádorů kolorekta nebo dělohy ve věku pod 40 let;
- opakovaného výskytu jakýchkoliv nádorů v rodině, kdy je podezření na možnou dědičnou příčinu (melanomů, mnohočetných bazaliomů, difuzních nádorů žaludku, nádorů ledvin, syndromů), vzácných typů nádorů, vícečetných malignit, časného výskytu;
- premaligních rizikových stavů (polypózy kolorekta i v dětském věku, polypózy žaludku).
HEREDITÁRNÍ SYNDROM NÁDORŮ PRSU A OVARIÍ
Hereditární syndrom s vysokým rizikem výskytu karcinomu prsu, ovarií i jiných nádorových onemocnění je nejčastěji diagnostikovaným dědičným nádorovým syndromem. Hlavní rizikové geny BRCA1 a BRCA2 byly objeveny v roce 1994 a 1995 (1, 2). BRCA1 (lokus 17q21–q24, 24 exonů) a BRCA2 (lokus 13q12–q13, 27 exonů) se účastní řízení regulace buněčného cyklu a apoptózy, homologní rekombinace (HR) a reparačních mechanismů DNA spojených s HR. Gen BRCA2 je nezbytný pro transport proteinu RAD51 do jádra. Je součástí FA komplexu (Fanconiho anémie) jako FANCD1 a podílí se na lokálních změnách struktury chromatinu. Frekvence nosičů zárodečných mutací v těchto genech v západních populacích se odhaduje na 1 : 300 až 1 : 800. Existují i další geny jako CHEK2, ATM, PALB2, NBN, BRIP1, RAD51C, RAD51D, jejichž zárodečné mutace mohou zvýšit riziko nádorů prsu nebo vaječníků (3–8). Vyšší riziko nádorů prsu je spojeno i s Liovým-Fraumeniho syndromem, neurofibromatózou typu 1, Peutzovým-Jeghersovým syndromem či syndromem difuzního karcinomu žaludku.
V současné době jsou základními kritérii k testování syndromu následující (9):
a) Sporadický výskyt:
- bilaterálního karcinomu prsu, výskyt do 50 let věku, nebo oba do 60 let;
- unilaterálního karcinomu prsu do 45 let věku (do 50 let, pokud není vůbec známá rodinná anamnéza);
- všech epitelových karcinomů ovarií, karcinomů vejcovodů a peritoneálních karcinomů bez věkové limitace;
- duplicity nádoru prsu a ovaria bez věkové limitace;
- nádoru prsu u muže bez věkové limitace;
- medulárního karcinomu prsu (do 60 let věku u sporadického výskytu);
- ER–, PR–, ErbB2–, tzv. triple negativního karcinomu prsu (do 60 let věku u sporadického nádoru);
- duplicity karcinomu prsu a slinivky v jakémkoliv věku.
b) Familiární výskyt:
- alespoň tří příbuzných s nádorem prsu bez věkové limitace;
- dvou příbuzných s nádorem prsu, z toho alespoň jednoho diagnostikovaného ve věku do 50 let (nebo oba do 60 let);
- karcinomu prsu do 50 let věku s přímým příbuzným s nádorem spojeným s HBOC (prostaty, slinivky).
Hlavní předpokládaná celoživotní rizika onemocnění u nosiček a nosičů mutace v genech BRCA1 nebo BRCA2 uvádí tab. 2.
Table 2. Hlavní předpokládaná celoživotní rizika onemocnění u nosiček a nosičů mutace v genech BRCA1 nebo BRCA2 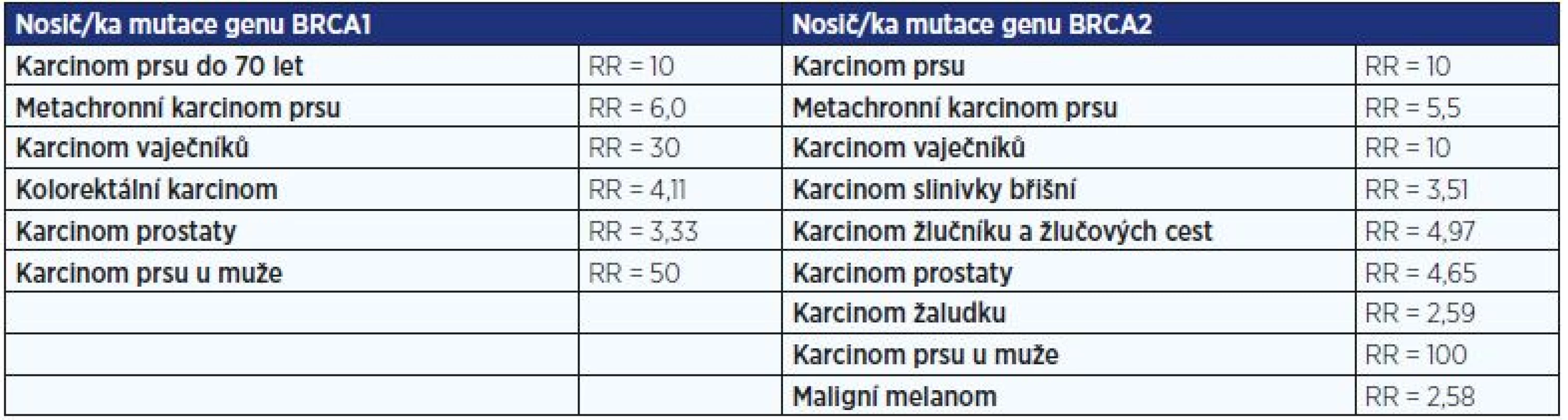
Pozn.: RR = relativní riziko Jakou prevenci je možné nabídnout rizikovým nosičům mutace
U nosiček mutace BRCA1/2 (počínaje věkem 20–25 let) se doporučují:
- půlroční kontroly onkologem, celkové tělesné vyšetření;
- kontroly prsou 2× ročně včetně ultrasonografie (střídavě), magnetickou rezonanci každý rok (do 65 let), mamografii ve 25 letech v MLO projekci k vyloučení kalcifikací, pravidelně od 35 let 1× ročně – harmonogram střídavě UZ/MG+MRI po půlroce;
- gynekologické kontroly včetně vaginálního ultrazvuku a markeru CA125 2× ročně;
- od 40 let věku každoroční vyšetření krve ve stolici – hemokult test;
- od 45 let věku po 3–5 letech kolonoskopie (u nosičů BRCA2 i gastroskopie);
- ultrazvukové vyšetření břišních orgánů 1× ročně;
- vhodné kožní a oční kontroly 1× ročně (především u nosičů BRCA2).
Sledování žen v těhotenství a laktaci pomocí ultrazvuku je důležité. Případy rychle rostoucích nádorů prsu právě v tomto období nejsou výjimečné.
U nosičů mutace BRCA1/2 mužského pohlaví (po 30. roce věku) se doporučují:
- roční kontroly onkologem, celkové fyzikální vyšetření;
- kontroly prsou onkologem, každoroční UZ prsou;
- každoroční UZ vyšetření břišních orgánů;
- od 40 let věku každoroční vyšetření krve ve stolici – hemokult test;
- od 45 let věku po 3–5 letech koloskopie (u nosičů BRCA2 i gastroskopie);
- od 45 let věku každoroční urologické kontroly včetně PSA;
- vhodné jsou každoroční kožní a oční kontroly (především u nosičů BRCA2) (10).
Preventivní operace
V rámci primární prevence jsou ženy informovány o vhodnosti profylaktické operace prsou a profylaktické adnexektomie (vhodná je i hysterektomie) ke snížení extrémně vysokého rizika onemocnění (u prsou z 85% celoživotního rizika, u ovarií z 20–60% rizika na 1–5%). Profylaktická gynekologická operace se doporučuje mezi 35. a 40. rokem (11–15).
HEREDITÁRNÍ NEPOLYPÓZNÍ KOLOREKTÁLNÍ KARCINOM (LYNCHŮV SYNDROM)
U 5–10 % nádorů kolorekta je možné odhalit dědičnou dispozici, tzv. Lynchův syndrom. Jeho frekvence v populaci se pohybuje kolem 1 : 2000. Screening časných nádorů kolorekta může být velice úspěšný, proto je důležité včasné odhalení vysokého rizika a dědičného syndromu. Kromě až desetinásobného rizika nádorů kolorekta je u žen také zvýšené riziko nádorů dělohy a ovarií, dále jsou zvýšená rizika nádorů žaludku, tenkého střeva, žlučových cest, močového systému, slinivky, melanomů a dalších nádorů.
Hlavními příčinami jsou zárodečné mutace v DNA-reparačních genech MLH1, MSH2, MSH6 a PMS2, vzácně i mutace v genech MLH3, EXO1, EPCAM. Základními indikacemi k testování jsou výskyt nádorů kolorekta či dělohy do 40 let věku, duplicita nádorů kolorekta a dělohy (nebo ovaria s dalšími nádory typickými pro Lynchův syndrom) a výskyt nádoru kolorekta či dělohy ve více generacích, z toho alespoň jednou do 50 let věku. Jako screeningová metoda k vyhledávání Lynchova syndromu je dnes používáno imunohistochemické stanovení absence proteinů MLH1, MSH2, MSH6 a PMS2 v nádoru. V případě patologického výsledku je patologem doporučeno odeslat pacienta na genetické vyšetření (16, 17).
Vzácně se vyskytne bialelická mutace v genech způsobujících Lynchův syndrom, mutace zděděná od obou rodičů, která způsobuje tzv. syndrom konstitučního deficitu MMR systému s nádory v dětském věku, jako jsou nádory tlustého střeva, lymfomy, leukémie či nádory mozku. Kožním příznakem mohou být kávové skvrny (café au lait) (18).
Preventivní možnosti u Lynchova syndromu
S koloskopií je nutné začít velmi brzy, již od 20 let věku, v intervalu 1–2 let. U žen je vhodné navrhnout profylaktickou adnexektomii a hysterektomii do 40 let věku. Důležité jsou i pravidelné gastroduodenoskopie, kontroly močového systému, UZ břišních orgánů, kožní a oční kontroly, u mužů kontroly prostaty, u žen UZ kontroly prsou nebo mamograficky po roce. Další preventivní kontroly mohou být genetikem doporučeny dle rizikovosti rodinné anamnézy, u výskytu nádorů slinivky například pravidelné endosonografie (16, 17, 19).
POLYPÓZNÍ SYNDROMY ZAŽÍVACÍHO TRAKTU
Familiární adenomatózní polypóza (FAP)
Familiární adenomatózní polypóza je autosomálně dominantně dědičný syndrom, který je častou příčinou vysokého rizika karcinomu kolorekta. Incidence onemocnění činí asi 1 : 8000 a penetrance až 100 %. V důsledku zárodečné mutace v genu APC (lokus 5q21-22) se objevují mnohočetné adenomatózní polypy (stovky až tisíce), především v rektu a sigmoideu, mnohdy již v dětském věku, a hrozí časné maligní zvrhnutí. Velká část případů vzniká de novo a onemocnění se v předchozích generacích nevyskytlo.
Prediktivní testování příbuzných je vhodné již v dětském věku. Prevence spočívá v kolonoskopickém (u dětí sigmoideoskopickém) odstraňování polypů, UZ břišních orgánů, gastroduodenoskopii, urologických kontrolách od 40 let věku, očních, neurologických a stomatologických kontrolách. U většiny pacientů je nutná kolektomie (20, 21).
Variantou je syndrom GAPPS (gastric adenocarcinoma and proximal polyposis of stomach, obr. 1). Příčinou této masivní kobercové polypózy fundu a těla žaludku bez postižení antra a duodena s vysokým rizikem adenokarcinomu žaludku je mutace v promotoru 1B genu APC, tj. v regulační, nikoli v kódující oblasti genu APC. Věk prvních příznaků je velice variabilní, ale většinou je nutná gastrektomie v mladém věku (22, 23).
Image 1. Masivní polypóza žaludku u mladého pacienta při syndromu GAPPS před preventivní gastrektomií 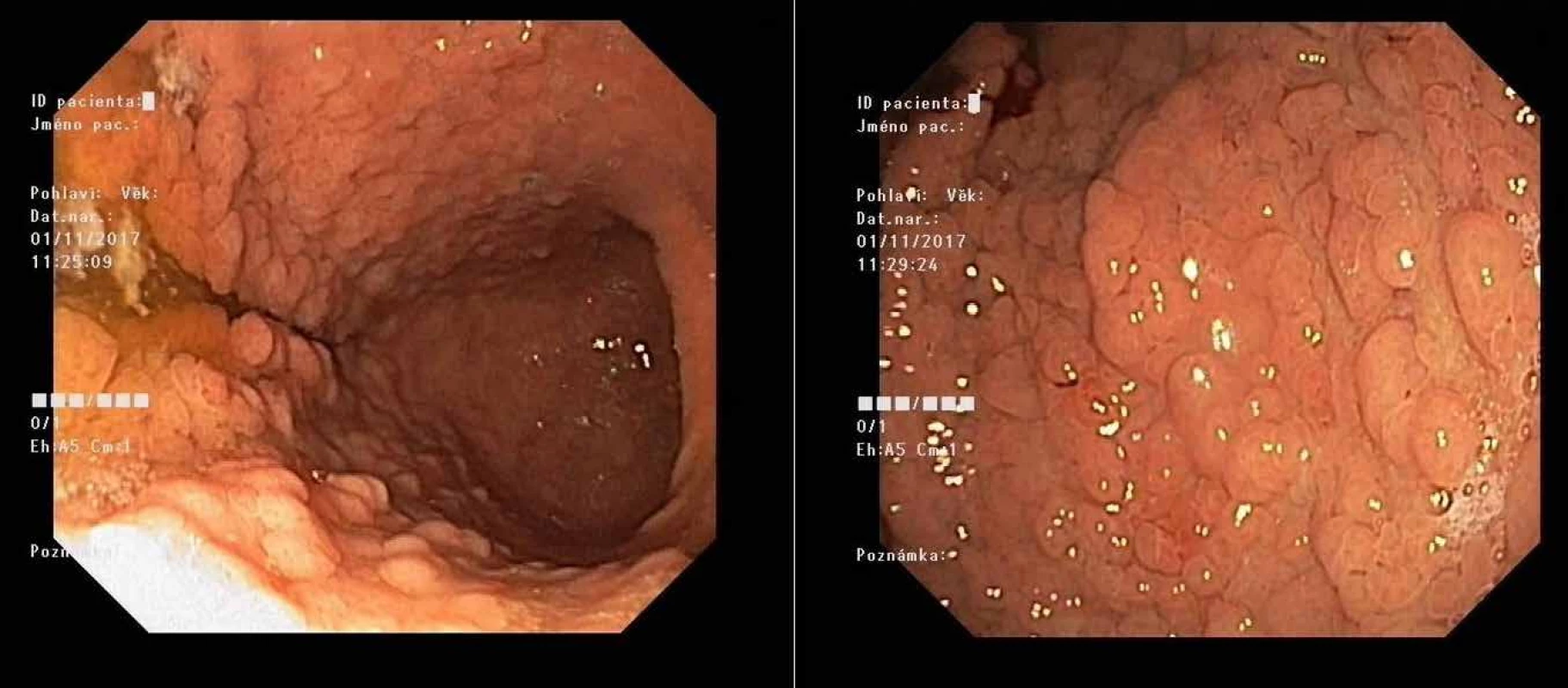
Další příčiny polypóz
MYH/MUTYH-asociovaná polypóza (MAP) je autosomálně recesivně dědičný syndrom způsobený mutacemi v DNA reparačním genu MYH/MUTYH (lokus 1p34). U heterozygotů zvyšuje jedna mutace riziko nádorů kolorekta pravděpodobně jen velmi mírně, ale doporučujeme u nich kolonoskopie ve 3–5letých intervalech. U homozygotů probíhá sledování podobně jako u FAP pomocí ročních kolonoskopií.
Hamartomatózní syndromy zahrnují především juvenilní polypózní syndrom. Mutace v genech SMAD4/MADH4/DPC4 (lokus18q21) nebo BMPR1A (lokus 10q22) mohou být příčinou syndromu s mnohočetnými hamartomatózními polypy celého zažívacího traktu, především však v tlustém střevu a konečníku (24). Dále se může jednat o Peutzův-Jeghersův syndrom. Gen STK11/LKB1 (lokus 19p13) může být příčinou autosomálně dominantně dědičného syndromu, jehož incidence činí 1 : 100 000. Hamartomatózní polypy se objevují nejčastěji v tenkém střevu a mohou být příčinou mnohočetných invaginací (25).
Cowdenův syndrom je také autosomálně dominantně dědičný hamartomatózní syndrom, jehož příčinou bývá zárodečná mutace v genu PTEN/MMAC1 (lokus 10q23), vzácně i mutace v genu BMPR1A (lokus 10q22). Jeho hlavními nádorovými riziky jsou benigní i maligní nádory štítné žlázy, prsu, endometria i tlustého střeva. Jeho incidence v populaci dosahuje asi 1 : 200 000, s penetrancí 95 %. Klinickými příznaky mohou být i trichilemomy a papulomatózní papuly, kožní, slizniční hamartomy, makrocefalie, podle kterých je možné syndrom i diagnostikovat.
Kromě dospělého projevu klinických příznaků může existovat i vrozená forma Bannayanova-Rileyho-Ruvalcabova (BRR) syndromu s projevy již při narození. Dysplastický gangliocytom mozečku je označován jako Lhermitteova-Duclosova choroba (26).
U všech těchto polypóz je v dnešní době velkým pokrokem v genetické diagnostice zavedení testování pomocí panelu genů, což významně zvyšuje výtěžnost genetického testování, a především zkracuje dobu testování ve srovnání s postupným testováním individuálních genů. Přesný popis klinických příznaků gastroenterologem je však vždy nutný k hodnocení korelace genetických výsledků a klinických dat.
U polypózních syndromů, u Lynchova syndromu, u nosičů BRCA2, TP53 mutace se mohou vyskytovat nádory žaludku, ale může se jednat i o hereditární difuzní karcinom žaludku (HDGC), jehož příčinou je zárodečná mutace v genu CDH1 (lokus 16q22). Tento gen kóduje E-kadherin, který je důležitý pro regulaci diferenciace epitelových tkání a kontaktní inhibice proliferace. Celoživotní riziko onemocnění nádorem žaludku dosahuje až 83 % u žen a 67 % u mužů. Zvýšené je i riziko nádorů tlustého střeva a u žen i nádorů prsu, především lobulárního typu. Prevence nádoru žaludku je problematická a je nutné diskutovat rovněž profylaktickou gastrektomii (27).
Dědičné příčiny nádorů ledvin jsou různorodé a zahrnují von Hippelovu-Lindauovu chorobu (VHL), při níž zárodečné mutace v genu VHL (lokus 3p25) vedou k vysokému riziku hemangioblastomů, především mozečku, retiny, míchy a mozkového kmene. Světlobuněčné karcinomy ledvin mohou být jedno - i oboustranné a postihují asi 40 % nosičů mutace. Prediktivní testování je vhodné již u dětí. Preventivní sledování využívá celotělovou magnetickou rezonanci. Nutné jsou kontroly krevního tlaku, testy metanefrinu, oční kontroly i kontroly sluchu. Frekvence tohoto autosomálně dominantně dědičného syndromu je uváděna asi 1 : 35–40 000, s penetrancí až 100 % (28).
Další příčinou nádorů ledvin může být Birtův-Hoggův-Dubého syndrom (BHDS) způsobený mutacemi v genu FLCN (lokus 17p11.2). Nádory ledvin jsou často bilaterální a multifokální, většinou onkocytomy, chromofobní nebo smíšené, méně často světlobuněčné. Typickým nálezem bývají i fibrofolikulomy a mnohočetné plicní cysty s vysokým rizikem spontánních pneumotoraxů (29).
Heterozygotní mutace v genu FH (lokus 1q42.3-43) je příčinou hereditární leiomyomatózy a renálního karcinomu (HLRCC)/mnohočetné kožní a děložní leiomyomatózy MCUL neboli Reedova syndromu. Většinou se jedná o papilární karcinomy 2. typu, ale výjimkou nejsou ani karcinomy sběrného kanálku, sarkomatózní, onkocytické, tubulopapilární, může se však jednat i o světlobuněčné karcinomy a Wilmsův tumor. U nosičů bialelické mutace je gen FH příčinou recesivně dědičného onemocnění, fumarové acidurie (30).
Papilární nádory ledvin 1. typu mohou být způsobeny zárodečnou mutací v proto-onkogenu c-MET (31). Wilmsův tumor, jeden z nejčastějších solidních nádorů u dětí, se vyskytuje jako sporadický nebo dědičný. Wilmsův tumor může být součástí několika kongenitálních syndromů s malformacemi, ale vyskytnout se může i u nosičů genů NF1 a BRCA1/2. Zárodečné mutace v genu WT1 (11p13) jsou velmi vzácné. Další příčinou Wilmsova tumoru mohou být mutace v genech WT2–WT5, mikrodelece v oblasti 11p13 (32).
Endokrinní nádory mohou být součástí mnohočetné endokrinní neoplazie typu 1 (MEN1) Tento autosomálně dominantně dědičný syndrom je způsoben mutacemi v genu MEN1 (lokus 11q13). Kromě adenomů příštítných tělísek s hyperparatyreózou jsou dalšími projevy enteropankreatické endokrinní nádory (např. inzulinomy, gastrinomy, glukagonomy, VIPomy), adenomy hypofýzy (např. prolaktinomy, somatotrofinomy), nádory kůry nadledvin, karcinoidy (thymu, bronchu, žaludku). Další příčinou endokrinních nádorů je mnohočetná endokrinní neoplazie typu 2 (MEN2) s vysokým rizikem medulárního karcinomu štítné žlázy, mnohdy již v dětském věku. Je doporučována preventivní tyreoidektomie (33, 34). Hereditární feochromocytomy a paragangliomy mohou být součástí komplexních syndromů, např. s mutacemi v genech MEN2, VHL nebo NF1, ale mohou být způsobeny i geny SDHA, SDHB, SDHC, SDHD a SDHAF2, které kódují podjednotky mitochondriálního enzymu sukcinátdehydrogenázy (35).
Mezi dědičné formy kožních nádorů patří syndrom familiárního melanomu. Celoživotní riziko maligního melanomu se u nosičů mutace v genu CDKN2A (lokus 9p21) pohybuje mezi 58 a 92 %. Kromě rizika kožního melanomu se zvyšuje i možnost onemocnění melanomem oka, nádorem slinivky a prsu (36). Gorlinův syndrom je komplexní syndrom s autosomálně dominantně dědičným rizikem výskytu mnohočetných bazaliomů, mnohdy se objevujících již v dětském věku. Je doprovázen vysokým vzrůstem, makrocefalií a skeletálními malformacemi žeber a páteře. Příčinou je zárodečná mutace v genu PTCH (lokus 9q22.3) (37). Vzácný syndrom BAP1 způsobený zárodečnou mutací v genu BAP1 se projevuje vysokým rizikem vzniku maligního mezoteliomu, uveálního melanomu, kožního melanomu (spitzoidního typu), nádorů ledvin, ale i jiných nádorů, jako jsou nádory prsu, vaječníků, prostaty, slinivky, meningiomy (38–40).
Mezi neurokutánní syndromy patří neurofibromatóza typu 1 (NF1 – Recklinghausenova choroba) s incidencí 1 : 3000. Mutace v genu NF1 (lokus 17q11.2) způsobuje mnohočetné kávové skvrny (café au lait), hamartomy duhovky (Lishovy noduly), axilární a ingvinální pihy, dysplastické kostní změny a mnohočetné periferní neurofibromy, schwannomy, juvenilní xantogranulomy a lipomy. Může při ní dojít k maligní transformaci. Vysoké je rovněž riziko gliomů optiku a CNS, nádorů prsu u žen, mohou se objevit leukémie i endokrinní nádory. Vzácnějším typem je neurofibromatóza typu 2 (NF2), centrální neurofibromatóza s incidencí asi 1 : 33–40 000, jejíž příčinou je většinou de novo mutace v genu NF2 (22q12.2). Hlavním příznakem je často oboustranný výskyt vestibulárních schwannomů, nádorů VIII. hlavového nervu. Neurinomy akustiku se mohou kombinovat s dalšími centrálními nebo periferními benigními nádory, s míšními nebo mozkovými gliomy, meningiomy a schwannomy míšních kořenů (41, 42).
Tuberózní skleróza je častější onemocnění s incidencí asi 1 : 5800 a ve většině případů mutace vzniká de novo (v 70 % případů) v genech TSC1 (lokus 9q34) nebo TSC2 (lokus 16p13). Jejími hlavními příznaky jsou benigní hamartomy kůže, sítnice, mozku, srdce, ledvin i jiných orgánů. Dalšími příznaky mohou být faciální angiofibromy a fibrózní plaky čela. Komplikacemi mohou být epilepsie, hydrocefalus, selhání ledvin díky rostoucím angiomyolipomům a cystám, lymfangioleiomyomatóza plic s rizikem pneumotoraxů. Nemocní vyžadují komplexní péči mnoha odborníků. (21, 42, 43).
DALŠÍ NÁDOROVÉ SYNDROMY S PŘÍZNAKY V DĚTSKÉM VĚKU
Liův-Fraumeniho syndrom je charakteristický nádory, jako jsou sarkomy, nádory prsu, mozku, lymfomy a adrenokortikální karcinomy či leukémie. Mohou se však objevit i jiné nádory, jako např. Wilmsův tumor, nádory tlustého střeva, žaludku, plic, slinivky, melanomy, germinální nádory, často se objevují vícečetné malignity. Zvýšené může být riziko jakékoli malignity. Hlavní příčinou tohoto syndromu jsou zárodečné mutace v genu TP53 (17p13.1) a u části pacientů mohou vznikat de novo. Prediktivní testování je v dnešní době možné již od dětského věku, neboť se zásadně zlepšily možnosti preventivní péče. Prevence zahrnuje vždy i celotělovou magnetickou rezonanci (21, 44–46).
Retinoblastom je nejčastějším zhoubným nádorem oka v dětském věku. Asi 40 % retinoblastomů je dědičného původu a je způsobeno zárodečnou mutací v genu RB1 (lokus 13q14). Velké procento mutací vzniká de novo. U nosičů mutace RB1 bývá zvýšené riziko i sekundárních nádorů, jako jsou sarkomy měkkých tkání i kostí, nádory mozku a melanomy. Nejčastější lokalizací sarkomu mimo radiační pole je oblast femuru (42, 45).
Syndromy chromosomové nestability – autosomálně recesivně dědičné syndromy, jakými jsou ataxia telangiectasia (ATM gen, incidence 1 : 40–300 000), xeroderma pigmentosum (geny XPD/ERCC2, dále XPA, XPB/ERCC3, XPC, XPE/DDB2, XPF/ERCC4, XPG/ERCC5, XPV/POLH a ERCC1, incidence 1 : 70–250 000), Bloomův syndrom (gen BLM), Fanconiho anémie (geny FANCA, FANCB, FANCC, FANCD1/synonymum BRCA2, FANCD2, FANCE, FANCF, FANCG/XRCC9, FANCI, FANCJ/BRIP1/BACH1, FANCL/FAAP43, FANCM/KIAA1596, FANCN/PALB2, FANCO/RAD51C, FANCP/SLX4), Nijmegen breakage syndrom (syndrom Seemanové, gen NBN, incidence 1 : 70 000) nebo Wernerův syndrom (gen RECQL2/WRN), jsou velice vzácná recesivní onemocnění s významnými vrozenými vadami, těžkými klinickými symptomy a vysokým rizikem maligních onemocnění v dětském věku.
Díky nové generaci sekvenování je možná genetická analýza všech rizikových genů při podezření na onemocnění a včasná diagnostika. Prevence nádorových onemocnění je u pacienta velice složitá. Diagnostika mutací způsobujících syndrom je důležitá pro rodiče při plánování dalších potomků s využitím preimplantační genetické diagnostiky, dále ke zjištění přenašečství mutace u příbuznýc a, pro možnost testování partnerů přenašečů před plánováním gravidity (21, 32, 42, 45).
ZÁVĚR
V případech podezření na dědičný nádorový syndrom je vhodné pacienta informovat, poučit a doporučit genetické vyšetření. Jestliže pacient po genetické konzultaci souhlasí s genetickým testováním a podepíše informovaný souhlas, je genetické testování prováděno ve specializovaných akreditovaných laboratořích. V České republice je vyžadován vysoký standard genetických testů.
V současné době se provádí testování panelu více než 20 nádorových genů (často více než 200 genů), které jsou nejčastějšími příčinami vysokých rizik onemocnění. Metoda masivního paralelního sekvenování umožní vyšetření všech těchto genů zároveň a získání velkého množství dat o variantách v těchto genech. Tato data je nutné filtrovat, získat údaje o významnosti variant, potvrdit možné patogenní varianty Sangerovým sekvenováním a předat lékařskému genetikovi laboratorní zprávu s popisem biologické významnosti nalezených variant. Kompletní genetické testování trvá většinou několik měsíců, v případě testování pro účely plánování léčby je prováděno ve zrychleném režimu dle požadavku lékaře, zpravidla do 1–3 měsíců.
Genetické testování a odhalení kauzální mutace je důležité také pro plánování rodičovství a předcházení přenosu závažného onemocnění nebo predispozice do další generace. Preimplantační diagnostika je čím dál více využívána rizikovými páry (47, 48).
Vhodný postup genetického vyšetření:
- genetické poradenství a indikace testování genů lékařským genetikem;
- molekulárně genetické testování ve specializované akreditované laboratoři;
- biologická interpretace výsledků testování molekulárním genetikem a laboratorní zpráva;
- genetická konzultace a předání klinické zprávy s výsledky testování, s doporučením prevence a testování rodinných příslušníků.
Tímto způsobem je možné testování správně indikovat, a především správně interpretovat jeho výsledky, doporučit preventivní sledování a další postup vyšetření v rodině probanda. Indikace k testování, metody testování a preventivní doporučení jsou pravidelně publikovány v supplementech Klinické onkologie (www.linkos.cz).
Lékaři jakékoli specializace mohou indikovat genetickou konzultaci. Genetické testování vždy indikuje lékařský genetik a jeho cena není započtena do indukované péče odesílajícího zdravotnického zařízení, proto je vhodné při podezření lékaře nebo při oprávněném požadavku a obavách pacienta odeslat dotyčného ke konzultaci na oddělení lékařské genetiky. V mnoha případech – se současnými znalostmi i možnostmi testování a prevence – můžeme účinně předcházet velmi agresivním nádorovým chorobám, onemocnění v mladém věku a zabránit tragickým osudům predisponovaných osob. Spolupráce lékařů různých profesí je v této oblasti velmi důležitá.
Čestné prohlášení
Autorka prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článků nebyly podpořeny žádnou farmaceutickou firmou.
Adresa pro korespondenci:
doc. MUDr. Lenka Foretová, Ph.D.
Oddělení epidemiologie a genetiky nádorů,
Masarykův onkologický ústav, Brno
Tel.: 543 136 900, 543 136 907
e-mail: foretova@mou.cz
Sources
- Miki Y, Sewnsen J, Shattuck-Eidens D et al. A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1. Science 1994; 266(5182): 66–71.
- Wooster R, Bignell G, Lancaster J et al. Identification of the breast cancer susceptibility gene BRCA2. Nature 1995; 378(6559): 789–792.
- Apostolou P, Fostira F. Hereditary breast cancer: the era of a new susceptibility genes. Biomed Res Int 2013; 2013 : 747318.
- Ford D, Easton D. F, Straton M et al. Genetic heterogeneity and penetrance analysis of BRCA1 and BRCA2 genes in breast cancer families. Am J Med Genet 1998; 62(3): 676–689.
- Lallo F, Evans D. G. Familial breast cancer. Clin Genet 2012; 82(2): 105–114.
- Macháčková E, Plevová P, Lukešová M et al. Genetická predispozice ke vzniku maligního nádoru prsu. Klin Onkol 2006; 19(Suppl.): 48–54.
- Pohlreich P, Klebl Z, Kleiblová P et al. Klinický význam analýz genů středního rizika pro hodnocení rizika vzniku karcinomu prsu a dalších nádorů v České republice. Klin Onkol 2012; 25(Suppl.): 59–66.
- Plevová P, Novotný J, Petráková K et al. Syndrom hereditárního karcinomu prsu a ovarií. Klin Onkol 2009; 22(Suppl.): 8–11.
- Foretová L, Macháčková E, Palácová M et al. Doporučení rozšíření indikačních kritérií ke genetickému testování mutací v genech BRCA1 a BRCA2 u hereditárního syndromu nádorů prsu a ovarií. Klin Onkol 2016; 29(Suppl.): 9–13.
- Petráková K, Palácová M, Schneiderová M et al. Syndrom hereditárního karcinomu prsu a ovarií. Klin Onkol 2016; 29(Suppl.): 14–21.
- Zikán M. Gynekologická prevence a gynekologické aspekty péče u nosiček genů BRCA1 a BRCA2. Klin Onkol 2016; 29(Suppl.): 22–30.
- Zikán M, Kalábová R. Doporučení k provedení profylaktické operace pro snížení rizika gynekologických malignit u žen s hereditárním rizikem. Klin Onkol 2009; 22(Suppl.): 58–59.
- Dražan L, Veselý J, Hýža P et al. Chirurgická prevence karcinomu prsu u pacientek s dědičným rizikem. Klin Onkol 2012; 25(Suppl.): 78–83.
- Dražan L. Profylaktická mastektomie a její indikace u rizikových žen. Klin Onkol 2006; 19(Suppl.): 97–100.
- Finch A, Evans G, Narod S. A. BRCA carriers, prophylactic salpingo-oophorectomy and menopause: clinical management considerations and recommendations. Womens Health 2012; 8 (5): 543–555.
- Mľkvá I. Genetika tumorigenézy nádorov kolorekta (možnosti testovania a screeningovej predikcie dědičnej formy ochorenia – Lynchovho syndromu. Klin Onkol 2016; 29(Suppl.): 2–11.
- Vasen H. F. A, Blanco I, Aktan-Collan K et al. Revised guidelines for the clinical management of Lynch syndrome (HNPCC): recommendations by a group of European experts. Gut 2013; 62 : 812–823.
- Ilenčíková D. Syndróm konštitučného deficit mismeč opravného systemu (CMMR-D) – kazuistika rodiny s bialelickou MSH6 mutáciou. Klin Onkol 2012; 25(Suppl.): 34–38.
- Plevová P, Novotný J, Šachlová M et al. Hereditární nepolypózní kolorektální karcinom (HNPCC, Lynchův syndrom). Klin Onkol 2009; 22(Suppl.): 12–15.
- Plevová P, Štekrová J, Kohoutová M et al. Familiární adenomatózní polypóza. Klin Onkol 2009; 22(Suppl.): 16–19.
- Bajčiová V. Syndromy predisponující k nádorům v dětském věku – zkušenosti Kliniky dětské onkologie FN Brno. Klin Onkol 2016; 29(Suppl.): 62–70.
- Li J, Woods S. L, Healey S et al. Point mutations in exon 1B of APC reveal gastric adenocarcinoma and proximal polyposis of the stomach as a familial adenomatous polyposis variant. Am J Hum Genet 2016; 98 : 830–842.
- Repák R, Kohoutová D, Podhola M et al. The first European family with gastric adenocarcinoma and proximal polyposis of the stomach: case report and review of the literature. Gastrointest Endosc 2016; 84(4): 718–725.
- Vasovčák P, Foretová L, Puchmajerová A et al. Juvenilný polypózny syndróm. Klin Onkol 2012; 25(Suppl.): 16–17.
- Puchmajerová A, Vasovčák P, Křepelová A. Peutz-Jeghersův syndrom. Klin Onkol 2009; 22(Suppl.): 36–37.
- Puchmajerová A, Vasovčák P, Křepelová A et al. Cowdenův syndrom. Klin Onkol 2009; 22(Suppl.): 56–57.
- Puchmajerová A, Vasovčák P, Macháčková E et al. Hereditární difuzní karcinom žaludku. Klin Onkol 2012; 25(Suppl.): 30–33.
- Plevová P, Novotný J, Křepelová A. Von Hippel-Lindauova choroba. Klin Onkol 2009; 22(Suppl.): 23–24.
- Křepelová A, Puchmajerová A, Vasovčák P et al. Syndrom Birt-Hogg-Dubé. Klin Onkol 2012; 25(Suppl.): 18–20.
- Plevová P, Hladíková A, Tesařová M. Hereditární leiomyomatóza a renální karcinom – HLRCC / mnohočetná kožní a děložní leiomyomatóza – MCUL. Klin Onkol 2012; 25(Suppl.): 55–58.
- Haas N. B, Nathanson K. L. Hereditary renal cancer syndromes. Adv Chronic Kidney Dis 2014; 21(1): 81–90.
- Ilenčíková D, Čižmárová M, Krajčová A et al. Klinické dysmorfické syndrómy s tumorigenézou. Klin Onkol 2012; 25(Suppl.): 39–48.
- Bendlová B, Dvořáková Š, Václavíková E et al. Mnohočetná endokrinní neoplazie typ 1 – syndrom MEN1. Klin Onkol 2009; 22(Suppl.): 24–27.
- Bendlová B, Dvořáková Š, Vlček P et al. Mnohočetná endokrinní neoplazie typ 2 – syndrome MEN2. Klin Onkol 2009; 22(Suppl.): 28–31.
- Musil Z, Vícha A, Zelinka T et al. Hereditární feochromocytom a paragangliom. Klin Onkol 2012; 25(Suppl.): 21–26.
- Foretová L, Macháčková E, Šachlová M et al. Syndrom familiárního melanomu (s dysplastickými naevy či bez nich). Klin Onkol 2009; 22(Suppl.): 32–33.
- Plevová P, Krutílková V, Puchmajerová A et al. Gorlinův syndrom. Klin Onkol 2009; 22(Suppl.): 34–35.
- Popova T, Herbert L, Jacquemin V et al. Germline BAP1 mutations predispose to renal cell carcinomas. Am J Hum Genet 2013; 92 : 974–980.
- Carbone M, Ferris L. K, Baumann F et al. BAP1 cancer syndrome: malignant mesothelioma, uveal and cutaneous melanoma, and MBAITs. Journal of Translational Medicine 2012; 10 : 179.
- Abdel-Rahman M. H, Pilarski R, Cebulla C. M et al. Germline BAP1 mutations predispose to uveal melanoma, lung adenocarcinoma, meningioma, and other cancers. J Med Genet 2011; 48 : 856–859.
- Petrák B, Plevová P, Novotný J et al. Neurofibromatosis von Recklinghausen. Klin Onkol 2009; 22(Suppl.): 38–44.
- Krutílková V. Genetické syndromy predisponující k dětským nádorům centrálního nervového systému. Klin Onkol 2016; 29(Suppl.): 71–77.
- Vrtěl R, Filipová H, Vodička R et al. Tuberózní skleróza. Klin Onkol 2009; 22(Suppl.): 50–53.
- Foretová L, Štěrba J, Opletal P et al. Li-Fraumeni syndrom – návrh komplexní preventivní péče o nosiče TP53 mutace s použitím celotělové magnetické rezonance. Klin Onkol 2012; 25(Suppl.): 49–54.
- Krutílková V, Eckschlager T. Přehled syndromů spojených s rizikem nádorů dětského věku. Klin Onkol 2009; 22(Suppl.): 45–49.
- Plevová P, Krutílková V, Petráková K et al. Syndrom Li-Fraumeni. Klin Onkol 2009; 22(Suppl.): 20–12.
- Hüttelová R, Kleibl Z, Řezáčová J et al. Předpoklady pro preimplantační genetickou diagnostiku (PGD) u nosičů mutací v nádorových predispozičních genech. Klin Onkol 2009; 22(Suppl.): 69–74.
- Veselá K, Kocur T, Horák J et al. Asistovaná reprodukce a preimplantační genetická diagnostika u pacientek ohrožených karcinomem prsu. Klin Onkol 2016; 29(Suppl.): 93–99.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2019 Issue 1-
All articles in this issue
- Clinical genetics in the 21st century
- Vrozené vady u narozených dětí v České republice v období 1994–2015
- Dědičné nádorové syndromy, jejich testování a prevence
- Význam cytogenetické a molekulárně cytogenetické analýzy v diagnostice hematologických malignit v době nových sekvenačních technik
- Vyhledávání genetických variant u trombofilních stavů
- Vzácná onemocnění a jejich domácí a mezinárodní kontext v roce 2019
- Specifika informovaného souhlasu v klinické genetice a genetickém poradenství
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dědičné nádorové syndromy, jejich testování a prevence
- Vrozené vady u narozených dětí v České republice v období 1994–2015
- Význam cytogenetické a molekulárně cytogenetické analýzy v diagnostice hematologických malignit v době nových sekvenačních technik
- Specifika informovaného souhlasu v klinické genetice a genetickém poradenství
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

