-
Medical journals
- Career
Současné postavení cytoredukční chirurgie (CRS) a intraperitoneální hypertermické chemoterapie (HIPEC) v multimodální léčbě nádorů peritoneálního povrchu
Authors: Dušan Klos 1; Juraj Riško 1; Martin Stašek 1; Martin Loveček 1; Jan Hanuliak 1; Pavel Skalický 1; Radmila Lemstrová 2; Beatrice Duchoňová Mohelníková 2; Hana Študentová 2; Čestmír Neoral 1; Bohuslav Melichar 2
Authors‘ workplace: I. chirurgická klinika LF UP a FN Olomouc 1; Onkologická klinika LF UP a FN Olomouc 2
Published in: Čas. Lék. čes. 2018; 157: 419-428
Category: Review Article
Overview
Primární i sekundární nádory peritoneálního povrchu jsou spojovány s velmi špatnou prognózou a rychlou progresí přes konvenční onkologickou léčbu zahrnující systémovou chemoterapii, případně cílenou léčbu, radioterapii, chirurgický výkon a symptomatickou léčbu.
První informace o cytoredukční chirurgii kombinované s intraperitoneální hypertermickou chemoterapií se objevily v 80. letech 20. století. V současnosti je tato léčba standardní pro vybrané nádorové entity peritoneálního povrchu (pseudomyxom peritonea a primární peritoneální mezoteliom). U řady dalších peritoneálních karcinomatóz pocházejících z karcinomů kolorekta, žaludečního karcinomu a ovariálního karcinomu u vysoce selektovaných nemocných může tato léčba vést k výraznému prodloužení celkového přežívání při zachování vysokého standardu kvality života. Ve specializovaných centrech jde o metodu bezpečnou s akceptovatelnou mírou morbidity a mortality, dostupnou i pro nemocné v České republice.
Klíčová slova:
chirurgie, onkologie, cytoredukce, intraperitoneální chemoterapie, hypertermie
ÚVOD
Nádory peritoneálního povrchu, jak primární, tak sekundární, jsou spojovány s velmi špatnou prognózou a rychlou progresí přes konvenční onkologickou léčbu zahrnující systémovou chemoterapii, eventuálně cílenou léčbu, radioterapii, chirurgický výkon a symptomatickou léčbu. Ještě donedávna byla většina z nich považována za neléčitelné.
V 80. letech 20. století se objevily první informace o cytoredukční chirurgii (CRS – cytoreductive surgery) kombinované s intraperitoneální hypertermickou chemoterapií (HIPEC) (1), jež se postupem řasu staly standardem léčby pro vybrané nádorové entity peritoneálního povrchu. Současně se postupně upřednostňoval pojem peritoneálních metastáz před peritoneální karcinomatózou, která pro většinu lékařů definuje terminální stav nádorového onemocnění, bez možnosti léčby.
Byť existuje řada různých názorů na význam extenzivních chirurgických výkonů a významu hypertermie, za čtyři dekády, kdy se tato kombinovaná léčba zařadila do běžné klinické praxe se podařilo definovat typy nádorů, u kterých dokáže významně ovlivnit celkové přežití nemocných nebo období bez rekurence a některé pacienty i zcela vyléčit.
PATOLOGIE
Primární nádory peritoneálního povrchu
Maligní peritoneální mezoteliom (MPM)
Jedná se o vzácné agresivní nádory vycházející ze serózních povrchů peritonea (cca 30 %), častěji pak mezoteliomy vychází z pleury (cca 65–70 %) či z tunica vaginalis testis (cca 3–5 %) a perikardu (1–2 %).
Primární maligní mezoteliom peritonea je vzácný nádor, který typicky postihuje muže mezi 50. a 69. rokem věku, s fatálním průběhem do 612 měsíců. Poprvé byl popsán v roce 1908 Millerem a Wynnem (2). Typickým predispozičním faktorem pro vznik mezoteliomů je kontakt s azbestem. Přitom se popisují dvě hlavní teorie vztahu azbestových vláken a peritoneálního mezoteliomu: první předpokládá, že jsou azbestová vlákna spolknuta a poté pronikají z orgánů zažívacího traktu do peritonea; druhá popisuje inhalaci azbestových vláken, která se pak dostávají do peritonea cestou lymfatických cév. Dalšími rizikovými faktory jsou radiace, předchozí účinek thoria, talku, erionitu či nemocní s difuzním lymfocytovým lymfomem.
Hlavními klinickými projevy MPM jsou nádorové masy v dutině břišní nebo drobnouzlíková ložiska s ascitem. Existují tři hlavní histologické subtypy MPM: epiteloidní (je nejčastější), sarkomatoidní a bifázický. MPM je charakteristický svou lokální progresí s postupným extrémním zvětšováním objemu břicha s retencí tekutin a výraznými symptomy poruchy pasáže střevní, malnutricí a dušností. Hematogenní a lymfatické metastázy jsou však vzácné.
Multicystický mezoteliom a dobře diferencovaný peritoneální mezoteliom jsou typické pro mladé ženy bez předchozí anamnézy kontaktu s azbestem a rovněž charakteristické lokální intraperitoneální progresí a recidivami, bez známek metastazování.
Primární peritoneální serózní papilární karcinom (PPSPC)
Vyskytuje se zpravidla u postmenopauzálních žen. Poprvé byl popsán v roce 1959. Protože ovariální a peritoneální epitel mají stejný embryonální původ, tj. coelomický epitel, považují se serózní karcinomy ovarií, dělohy, tub a cervixu stejně jako PPSPC za jednu entitu (3). PPSPC a karcinom ovaria mají identickou mikroskopickou strukturu.
Kritéria pro definici PPSPC dle Světové zdravotnické organizace (WHO) a Gynekologické onkologické skupiny (GOG) jsou následující:
1. Vaječníky musejí být normální velikosti nebo jsou zvětšené pouze benigním procesem.
2. Extraovariální nádory musejí velikostí převyšovat nádory vaječníků.
3. Mikroskopické nádory vaječníků musejí být povrchové s velikostí < 5 × 5 mm.Vzhledem k jednotnému původu je pro klasifikaci tohoto nádoru používána klasifikace FIGO, přitom pacientky s PPSPC bývají starší a s vyššími stupni (stadium ≥ III) než pacientky s ovariálními karcinomy.
Intraabdominální dezmoplastický malobuněčný nádor peritonea
Poprvé byl popsán v roce 1989. Jedná se o vzácný vysoce agresivní nádor, který se typicky objevuje u adolescentních chlapců a mladých mužů. Četnost postižení mužů proti ženám je 5 : 1 a průměrný věk stanovení diagnózy 22 let (4). Obecně tento nádor vyrůstá z dutiny břišní a má tendenci k rozsevu po peritoneu s časným metastazováním do lymfatických uzlin, jater a plic. 80 % pacientů má založeny vzdálené metastázy v játrech a plicích již v době diagnózy, medián přežití tak dosahuje pouze 17–25 měsíců (5). Nejčastější modalitou léčby je chemoterapie v kombinaci s chirurgií a radioterapií.
Peritoneální sarkomatóza
Jedná se o vzácnou nově popsanou entitu, která může být definována jako rekurence či rozsev sarkomů měkkých tkání v dutině břišní při absenci další extraabdominální diseminace (6). Sarkomy měkkých tkání tvoří cca 0,8 % všech nádorů a metastazují nejčastěji do plic, kostí a jater. Sarkomatóza peritonea může vznikat při recidivě intraabdominálních sarkomů nebo pocházet z okrajů sarkomu. Peritoneální sarkomatóza nemá žádný specifický klinický obraz. Nejčastěji takto metastazují leiomysarkomy, gastrointestinální stromální tumory a liposarkomy. Vzácně pak další tumory jako hemangiopericytomy, solitární fibrózní tumory, fibrosarkomy, rhabdomyosarkomy a další.
Sekundární nádory peritoneálního povrchu
Peritoneální metastázy ovariálního karcinomu
Nejčastějším typem ovariálního karcinomu jsou epitelové tumory, které tvoří cca 85–90 %. Dělí se na serózní, endometroidní, mucinózní, nediferencované, z jasných buněk (clear cells) a z přechodných buněk (Brennerův typ). Zbytek tvoří germinální nádory, sex-cord/stromální a metastazující tumory. Typické je pro ně právě metastazování do peritoneálního povrchu.
Peritoneální metastázy z tumorů apendixu
Nádory apendixu můžeme rozdělit na epitelové, neuroendokrinní (klasické a tubulární) a jiné (např. lymfomy, mezenchymové tumory, sarkomy apod.). Epitelové tumory dělíme podle PSOGI (Mezinárodní skupina léčby malignit peritoneálního povrchu) na neinvazivní a invazivní neoplazie. Neinvazivní neoplazie pak rozdělujeme na low-grade apendikální mucinózní neoplazie (LAMN), high-grade apendikální mucinózní neoplazie (HAMN), serátní polyp s dysplazií nebo bez ní a konvenční adenom kolorektálního typu (tubulární, tubulovilózní či vilózní). Invazivní neoplazie dělíme na mucinózní adenokarcinom (dobře, středně či špatně diferencovaný) a špatně diferencovaný mucinózní adenokarcinom s prstenčitými buňkami (7).
Mezi základní charakteristiky LAMN patří: ztráta muscularis mucosae, fibróza submukózy, vlnitý nebo vlající epitelový růst, disekce acelulárního mucinu ve stěně, mucinózní či neoplastické buňky mimo apendix. Typickým nálezem je na mucin bohatý epitel s cirkumferentním postižením mukózy, který zahrnuje alespoň jeden segment apendixu. HAMN je velmi vzácná neoplazie, která je charakterizována high-grade cytologií omezenou pouze na apendix bez invaze. Mucinózní adenokarcinom je definován infiltrativním destruktivním růstem s oblastmi low - i high-grade diferenciace.
Tzv. pseudomyxom peritonea (PMP) je klinickou jednotkou charakterizovanou nálezem acinózních a gelatinózních hmot v dutině břišní s postižením omenta. Nejedná se tedy o jednotku histopatologickou. Léze dělíme na acelulární mucin, low-grade mucinózní carcinoma peritonei (DPAM – diseminovaná peritoneální adenomucinóza), high-grade mucinózní carcinoma peritonei (PMCA – peritoneální mucinózní karcinomatóza) a high-grade mucinózní carcinoma peritonei s prstenčitými buňkami (PMCA-S).
Nejčastější příčinou pseudomyxomu peritonea jsou právě LAMN tumory po perforaci červa, dále adenokarcinom tračníku či urachu. Pro pseudomyxom je typický neinvazivní nemetastazující, ale vytrvalý, ač velmi pomalý růst, kdy příčinou smrti nemocných bývají nikoliv vzdálené metastázy, nýbrž obstrukce střevní s postupnou kachektizací a zástavou pasáže. Pro PMP je typický tzv. redistribuční fenomén růstu v dutině břišní s maximem v omentu, parakolických prostorech, Douglasově prostoru, ligamentum falciforme a obou subfreniích.
Peritoneální metastázy kolorektálního karcinomu
Ve dvou velkých populačních studiích byla prokázána peritoneální karcinomatóza u 4,8–8,3 % všech nemocných s kolorektálním karcinomem (8, 9). Přítomnost karcinomatózy u nádorů kolorekta je velmi obtížně předvídatelná, protože senzitivita a specificita zobrazovacích metod zejména pro malé noduly na peritoneu je relativně nízká, na rozdíl od vzdálených metastáz jaterních či plicních, které zpravidla vyřazují nemocné z chirurgického výkonu již v první linii před zahájením paliativní systémové léčby.
Stejně jako v jiných případech můžeme peritoneální karcinomatózu rozdělit na synchronní (v čase primární manifestace) a metachronní (po primární léčbě). Intraperitoneální rozsev může nastat dvěma způsoby, a to jednak jako transmurální invaze nádoru před vlastním chirurgickým výkonem, jednak po potenciálně kurativním výkonu, kdy se nádorové buňky uvolňují do břišní dutiny přímo z nádoru nebo z lymfatických cest a cév (10).
Rizikovými faktory pro rozvoj peritoneální karcinomatózy (PC) u kolorektálního karcinomu jsou: T4 stadium primárního nádoru, postižení lymfatických uzlin (N1–N2), mucinózní/prstenčité buňky v histologickém obrazu, pravostranné tumory, pozitivní peritoneální cytologie, akutní chirurgický výkon, perforovaný primární nádor, metastázy do ovarií, předchozí resekce peritoneálních nodulů a mladý věk (11, 12).
Peritoneální metastázy karcinomu žaludku
O incidenci peritoneální karcinomatózy u karcinomu žaludku toho v současnosti víme jen málo. Pro studii na základě Eindhovenského nádorového registru bylo v Nizozemsku definováno 2029 nemocných s karcinomem žaludku, z nichž 39 % mělo vzdálené metastázy; z této skupiny nemocných se vzdálenými metastázami mělo 35 % karcinomatózu peritonea a 24 % izolovanou peritoneální karcinomatózu bez dalšího postižení (13).
Prognóza nemocných s PC u karcinomu žaludku je velmi špatná, s mediánem přežití 4,6 měsíce, resp. 3,3 měsíce v případě kombinace PC s dalšími vzdálenými metastázami. Na základě hypotézy, že PC je způsobena infiltrací serózy primárním nádorem a dalším rozsevem nádorových buněk do peritoneální dutiny můžeme vyšší T a N stadia považovat za rizikové faktory, stejně jako mladý věk, nádory z prstenčitých buněk a linitis plastica (13).
EPIDEMIOLOGIE
Validní data z České republiky v současné době nejsou veřejně přístupná, protože vzácné nádory peritonea a retroperitonea nejsou součástí vybraných diagnóz reportovaných v přehledu „Novotvary“ vydávaném Ústavem zdravotnických informací a statistiky ČR (ÚZIS). Tato část tedy bude vyžadovat speciální evaluaci. Pokud použijeme data z mezinárodních registrů např. pro Rakousko z roku 2012, pak v tomto roce bylo hlášeno celkem 158 nádorových onemocnění peritonea a retroperitonea z celkového počtu 20 167 nádorových onemocnění, podobně na Slovensku bylo hlášeno 85 případů z celkových 13 027 (14). Incidence pseudomyxomu peritonea se popisuje asi 9/1 milion, častěji u žen 15). Podobně u primárního mezoteliomu dosahuje incidence 0,5–3/1 milion obyvatel, častější incidence je lokálně popisována v místech s výskytem azbestu – např. v janovském přístavu 5,5/1 milion (16).
DIAGNOSTIKA A STAGING MALIGNIT PERITONEÁLNÍHO POVRCHU
Diagnostika nádorů peritoneálního povrchu má za cíl stanovit rozsah postižení a v případě peritoneálních metastáz odhalit primární zdroj. Je zajímavou částí preoperační fáze, zejména při minimálních klinických projevech některých subtypů nádorů. Základem je výpočetní tomografie (CT) (obr. 1), magnetická rezonance (MRI) a pozitronová emisní tomografie s CT (PET/CT) (obr. 2). Každá z těchto modalit vykazuje určitou míru senzitivity a specificity pro každý typ nádoru. Ultrazvukové vyšetření má omezenou vypovídající hodnotu, ale může být cennou metodou u malignit malé pánve při transvaginálním vyšetření.
Metodou první volby je jistě v dnešní době výpočetní tomografie. Senzitivita pro detekci implantačních metastáz ≥ 5 mm při použití rekonstrukčního intervalu 3 mm dosahuje 89 % a specificita 92 % (17).
Význam magnetické rezonance v diagnostice PC roste s narůstající kvalitou zobrazení. Konvenční magnetické rezonance dosahuje senzitivity 90 % a specificity 95,5 % (18). Výhodou je detailní zobrazení nádorových depozit v subdiafragmatických prostorech, jaterním hilu, Treitzově ligamentu, ve stěně tenkého střeva a na mezenteriu, což může být cenné k vyloučení kandidátů chirurgického výkonu. Nevýhodami tohoto vyšetření jsou cena, délka akvizičního času a pohybové artefakty, které mohou vést k přehlédnutí nebo naopak falešné pozitivitě malých nodulů na peritoneu.
PET/CT s použitím 18F-fluorodeoxyglukózy značným způsobem posunulo diagnostické možnosti u nemocných s nádorovým onemocnění, zejména ve vyloučení vzdálených metastáz a sledování vývoje choroby a případných rekurencí po ukončení multimodální onkologické léčby. V rozlišení benigních a maligních nádorů ovarií prokazuje PET/CT 87–100% senzitivitu a 74–100% specificitu (19). Naproti tomu u menších lézí, zejména cystických a mucinózních, je výtěžnost tohoto vyšetření relativně malá, resp. srovnatelná s konvenčním CT vyšetřením. Nevýhodou je také velká radiační zátěž a nutný časový odstup od předcházejícího operačního výkonu a chemoterapie.
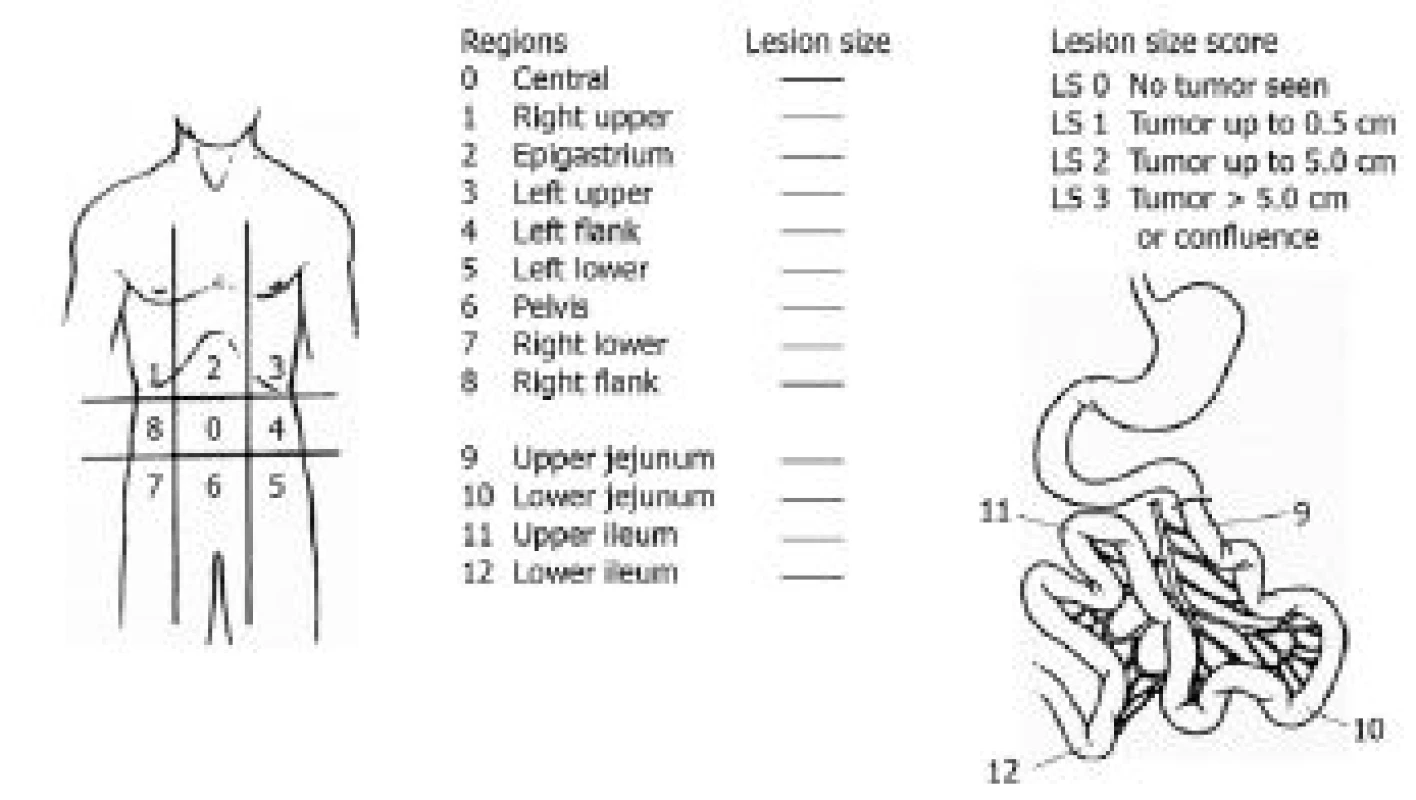
Základním cílem je určení rozsahu onemocnění, lokalizace primárního ložiska a detekce vzdálených metastáz. Tedy podstatné podklady k rozhodnutí o případné kontraindikaci operačního řešení. Byť se v praxi užívají různé skórovací systémy pro peritoneální karcinomatózu, nejpoužívanějším se stal systém popsaný Jacquetem a Sugarbakerem (20), tzv. PCI (peritoneal cancer index). Ten popisuje karcinomatózu podle rozsahu a lokalizace: Dutina břišní je rozdělena na 13 oblastí (0–12, obr. 3). V každé z nich se velikost lézí klasifikuje následovně: 0 bodů (bez lézí), 1 bod (léze do 0,5 cm), 2 body (léze od 0,5-5 cm), 3 body pro léze přesahující 5 cm a splývající postižení peritonea. Body se poté sečtou. Studie prokazují, že výrazně horší prognózu mají pacienti s peroperačně stanoveným PCI > 13 (21). Toto doporučení neplatí pro pseudomyxom peritonea a low-nuclear grade peritoneální mezoteliom, kde je i v případě vysokých hodnot PCI možné docílit kompletní cytoredukce s možností dlouhodobého přežívání. Prognostickým faktorem je zde úroveň dosažené cytoredukce (tzv. completeness of cytoreduction score) (21).
INDIKAČNÍ ROZVAHA PRO CRS A HIPEC
Indikace nemocného k tomuto rozsáhlému chirurgickému výkonu zatíženému významnou morbiditou a mortalitou je vysoce individualizovaný a personalizovaný postup v rámci multidisciplinárního týmu zahrnujícího chirurga, klinického onkologa, radiologa, patologa a anesteziologa. Limitací pro výkon je celkový stav nemocného a jeho přidružené choroby, jež musejí být pečlivě zváženy v rámci předoperační přípravy.
Doporučujeme vyloučit z kandidátů pro CRS a HIPEC nemocné s limitujícím srdečním a plicním onemocněním, dysfunkcí jater a ledvin. Absolutní kontraindikací je dle našeho názoru a zkušeností např. užívání methotrexátu u autoimunitních onemocnění z důvodu násobně vyššího rizika nežádoucích účinků v podobě těžké myelotoxicity. Relativní kontraindikací je dlouhodobé užívání kortikoidů, ty je nutné vysadit alespoň 6 týdnů před plánovanou CRS a HIPEC.
Pro rozhodování je také důležitá informace o typu primárního nádoru, rozsahu onemocnění podle zobrazovacích metod, postižení tenkého střeva a resekabilitě metastáz, dále reakce na předchozí chemoterapii, přítomnost vzdálených metastáz (extraperitoneální metastázy jsou vylučujícím kritériem) a v neposlední řadě celková motivace nemocného k takovému výkonu (většinou paliativního charakteru).
CYTOREDUKČNÍ CHIRURGIE – PŘEHLED TECHNIKY
Cílem cytoredukce je odstranění makroskopicky viditelných ložisek nádoru. Tento postup zahrnuje řadu chirurgických postupů, z nichž dominantní je peritonektomie. Tento pojem zavedený prof. Paulem Sugarbakerem a standardizovaný ve Washington Cancer Institute (22) definuje současné cíle cytoredukční chirurgie, a to excizi těch částí parietálního a viscerálního peritonea, jež jsou postiženy nádorem. Reziduální nádorové buňky nebo malé zbytky implantátu jsou pak vystaveny účinku HIPEC. Přitom úloha cytoredukce je zásadní především z toho důvodu, že cytostatika penetrují jen do hloubky ne větší než 4 mm.
Základním předpokladem pro provádění těchto výkonů je adekvátní personální a technické vybavení pracoviště. Chirurg by měl být dokonale obeznámen se všemi procedurami břišní chirurgie, zejména kolorektální, ale také s výkony v oblasti horní části zažívacího traktu, pankreatu a žlučových cest a v malé pánvi. Význam learning curve a práce chirurga byl evaluován v řadě studií. Kusamura et al. (23) prokázali, že teprve 140 cytoredukčních výkonů provedených jedním chirurgem vede k excelenci v této specializaci. Z technického vybavení jsou nezbytné všechny známé technologie, jež jsou běžně využívané u chirurgických procedur. Nepodkročitelným minimem je vhodný rozvěrací břišní systém, který umožňuje dokonalou vizualizaci a dostupnost všech kvadrantů břišních, nadto je nutné přístrojové vybavení k provedení HIPEC.
Peritonektomie v modifikaci dle Sugarbakera zahrnuje:
- přední parietální peritonektomii,
- peritonektomii levého horního břišního kvadrantu,
- peritonektomii pravého horního břišního kvadrantu,
- pánevní peritonektomii,
- omentální burzektomii,
- mezenterickou peritonektomii.
Resekční fáze obsahuje také excizi staré jizvy a pupku, omentektomii a splenektomii, odstranění Glisonova pouzdra jater s tumorem, en bloc extraperitoneální modifikovanou zadní exenteraci malé pánve (rektum, děloha, adnexa), cholecystektomii a excizi malého omenta, eventuálně také pravostrannou hemikolektomii a resekci různých etáží tenkého střeva.
Peritonektomie je zahajována od střední čáry směrem do stran pomocí závěsných stehů (Sugarbakerova modifikace) (obr. 4) a pokračuje se do stran k závěsům pravého a levého kolon dále do retroperitonea, kde se vyvěšují oba uretery. Po otevření peritonea následuje kompletní omentektomie, pokud možno se zachováním gastroepiploické arkády jako prevence protrahované pooperační žaludeční parézy. Pokračuje se strippingem obou bránic (obr. 5), strippingem dna omentální burzy, odstraněním malého omenta se žlučníkem bez porušení arkády levé a pravé gastrické tepny podél malé kurvatury žaludku. V malé pánvi se provádí kompletní peritonektomie s uvolněním peritonea z močového měchýře ventrálně a dorzálně s resekcí rekta a kompletně extraperitoneální hysterektomií a adnexektomií (u žen) (obr. 6).
Častou limitací vlastní cytoredukce je postižení viscerálního mezenteria, zde je možná precizní peritonektomie pomocí liftingu fyziologickým roztokem instalovaným pod peritoneum. Pokud noduly postihují serózu střeva, pak je možná buď resekce kličky, sestřižení nodulu s přešitím, nebo využití vaporizace nodulů bipolární či argon-beam koagulací. Anastomózy konstruujeme buď ručně pokračujícím stehem (nejčastěji side-to-side), nebo v případě nízkých resekcí rekta využíváme kruhových staplerů.
Anastomózy tvoříme ještě před vlastní HIPEC terapií. Pojistná ileostomie není v našem souboru standardem; byť konstruujeme anastomózy před aplikací ohřátého roztoku a cytostatika, nepozorovali jsme statisticky významný nárůst anastomotických leaků. Pojistnou ileostomii však doporučujeme při počtu anastomóz na tenkém a tlustém střevě > 3 nebo při limitujících anatomických poměrech z hlediska bezpečné střevní anastomózy.
V rámci předoperační přípravy zajišťujeme dostatečnou intravenózní hydrataci nemocných vhodnými roztoky v objemu 2–3 litrů během 6–8 hodin, a to zejména v případě perorální mechanické přípravy tračníku.
HYPERTERMICKÁ INTRAPERITONEÁLNÍ CHEMOTERAPIE
Cílem cytoredukční chirurgie je eliminace makroskopického postižení peritoneální dutiny pomocí chirurgické peritonektomie a série viscerálních resekcí a HIPEC pak cílí na reziduální mikroskopickou chorobu (24). Existuje řada teoretických modelů, jež podporují racionalitu tohoto přístupu. Vycházíme především z teoretického Gompertzova buněčného kinetického modelu, kde profil růstu nádorových buněk můžeme popsat jako S křivku, kdy nádor iniciálně roste velmi pomalu a poté jeho růst rapidně zrychluje (25). Jakmile nádor roste, jeho cévní zásobení a progrese klesají a vzrůstá počet buněk v neproliferativní fázi buněčného cyklu. Z toho pak vychází Nortonova-Simonova hypotéza, že míra regrese objemu nádoru po chemoterapii je úměrná míře růstu neporušeného tumoru stejné velikosti. Malé nádory rostou mnohem rychleji a snáze vedou k buněčné smrti, pokud je aplikována chemoterapie. Pokud rychlá obnova buněk neumožňuje eradikovat všechny nádorové buňky, pak má tento smrtící efekt chemoterapie minimální význam pro dlouhodobé přežívání (26).
Význam extenzivní cytoredukce spočívá v tom, že čím méně nádorových buněk zůstane po výkonu, tím lepší bude účinek použitého cytostatika a rovněž ve stimulaci nádorových buněk k přechodu do proliferativní fáze, tedy k vyšší senzitivitě k chemoterapii (27). Z mnoha důvodů je také podstatné, aby intraperitoneální chemoterapie následovala rychle po vlastní chirurgické cytoredukci: Především proto, že chirurgický výkon samotný vede ke stimulaci fibrinu a ten pak ke stimulaci růstu zbytkové nádorové choroby a nádorových buněk, což způsobuje rychlou progresi a rekurenci karcinomatózy. A také z toho důvodu, že četné adheze po předcházejícím výkonu blokují běžnou cirkulaci aplikovaných tekutin do peritoneální dutiny a limitují tak její účinky. Adheze rovněž omezují vstup do peritoneální dutiny samotné již několik týdnů po výkonu.
Farmakologická racionalita aplikace cytostatika přímo do dutiny peritoneální spočívá v možnosti použití vyšších koncentrací léčiva než při běžném intravenózním podání, z důvodu funkční peritoneální plazmatické bariéry. Peritoneální dutina a krevní řečiště jsou odděleny semipermeabilní membránou, která umožňuje využití vysokodávkovaných cytostatik v intraperitoneálním prostoru, což zvyšuje jejich účinek, a přitom limituje přechod cytostatika do plazmy, což omezuje jeho systémovou toxicitu. Na modelu peritoneální dialýzy Dedrick et al. potvrdili, že peritoneální permeabilita k určitému druhu látek je nápadně nižší než plazmatická clearance této látky. Peritoneální clearance použitého cytostatika je nepřímo úměrná druhé odmocnině její molekulové hmotnosti (28). Dalším podstatným důvodem pro využití intraperitoneálního podání cytostatika je relativně dlouhý kontakt mezi léčivem a terapeutickým cílem, což ilustrují křivky dosažitelných koncentrací v peritoneu a plazmě, kdy plazmatická křivka koncentrace v čase rychle klesá, na rozdíl od intraperitoneální cirkulace (29).
Význam hypertermie použité při HIPEC spočívá ve zlepšení cytotoxického účinku léku (tzv. regionální intenzifikace dávky) v kombinaci s přímým cytotoxickým účinkem vysoké teploty. Kombinovaná hypertermie s intraperitonální perfuzní chemoterapií zvyšuje účinek protinádorové léčby cestou řady mechanismů. Teplota > 41 °C inhibuje DNA reparace v nádorových buňkách, denaturuje proteiny, indukuje lyzosomovou aktivaci a zvyšuje počty buněčných smrtí (30). Hypertermie také potencuje účinek cytostatik snížením intracelulárních mechanismů detoxikace cytostatik a DNA reparačních mechanismů (31). Konečně pak vyšší teploty zvyšují průnik cytostatik do tkání, která tak účinkují hlouběji než u normotermické laváže (32).
Variabilita používaných režimů cytostatik, dávkování a délky laváže je velká (tab. 1). Mezi nejpoužívanější cytostatika patří mitomycin C, cisplatina, oxaliplatina, doxorubicin, gemcitabin a melfalan. Neexistuje jeden protokol, který by byl užíván napříč centry u různých diagnóz. Preference vychází z lokálních zkušeností a podmínek ve vztahu k důkazům intraperitoneálního účinku daného cytostatika u jednotlivých nádorových skupin. I v našem centru prochází výběr cytostatik a jejich dávka kontinuálním vývojem.
Table 1. Typy režimů pro HIPEC (podle Lemoine et al.) 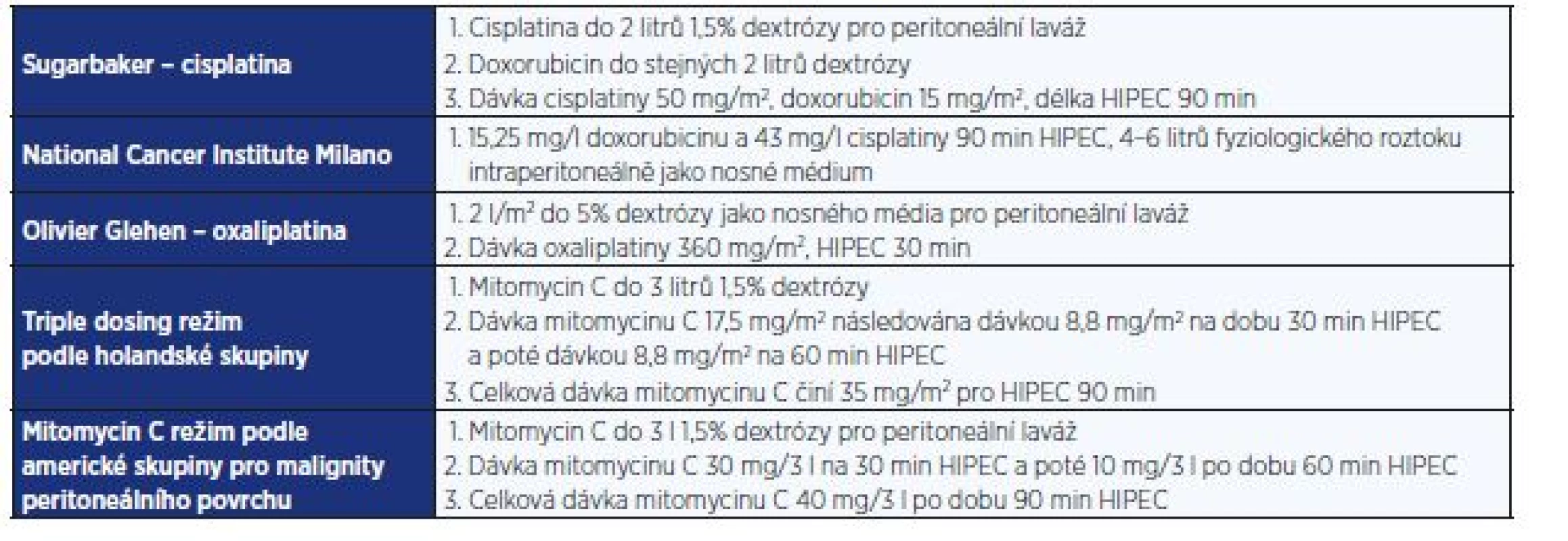
Vlastní technické provedení laváže zahrnuje uložení lavážních drénů do čtyř kvadrantů dutiny břišní: horní do pravého a levého subfrenia slouží k instilaci nosného roztoku a cytostatika ohřátého na 42 °C (nejčastěji fyziologický roztok, v případě oxaliplatiny 5% glukóza) a dva dolní drény uložené do malé pánve jsou určené k odvádění roztoku při jeho cirkulaci v systému zavřené dutiny peritoneální a stěny břišní, kdy po ukončení laváže a vypuštění roztoku dva drény ponecháváme jako drenážní. Tento typ laváže je v bezpečnostních podmínkách a stávajících regulích preferován v zemích Evropské unie, na rozdíl od USA či Asie, kde je upřednostňován otevřený systém, kdy cirkulaci a distribuci roztoku s cytostatikem zajišťuje svou rukou sám chirurg.
JEDNOTLIVÉ INDIKACE VÝKONU
CRS a HIPEC u pseudomyxomu peritonea a peritoneálních metastáz apendikulárních malignit
Nádory apendixu představují široké spektrum biologické aktivity. Pokud se jedná o low-grade malignity, které nepronikly přes stěnu mukokély, po prostém odstranění apendixu s mukokélou již nedochází k recidivám onemocnění. Pokud však nastala k ruptura mukokély, ať už se jedná o low-grade nebo high-grade malignity, dochází k rozsevu mucinu po peritoneálním povrchu, což může vyústi v rozvoj klinického obrazu pseudomyxoma peritonei. Všechny agresivní formy nádoru jsou pak určeny ke kombinované léčbě. Prostá mukokéla apendixu může být asymptomatická nebo symptomatická, nezřídka přitom imituje projevy akutní apendicitidy. Většina mukokél odstraněných při konvenční apendektomii bývá benigních. Samotný klinický obraz pseudomyxoma peritonei bývá velmi chudý a spočívá v neurčitých a netypických často bodavých bolestech v různých kvadrantech břicha s jeho poměrně pomalu narůstajícím objemem.
U žen tyto malignity bývají často náhodně odhaleny při pravidelném gynekologickém vyšetření a v první fázi často zaměněny s malignitami ovarií, protože postižení ovarií imituje karcinom ovaria. Základní diagnostickou metodou je CT sken, který určí rozsah onemocnění. Vlastní diagnóza bývá určena až na základě laparoskopické či laparotomické explorace s typickým nálezem hlenových formací v dutině břišní a po histopatologickém určení typu nádoru. Vzorek tumoru lze také získat cílenou biopsií pod CT kontrolou. V laboratoři stoupá hladina Ca 19-9 a karcinoembryonálního antigenu (CEA). Oba tyto markery je možné použít při sledování nemocných v pooperačním období k časné detekci rekurence choroby.
V případě peritoneálního rozsevu a pseudomyxoma peritonei z nádorů apendixu je na místě rozsáhlá cytoredukce a HIPEC. Tento postup je dnes všeobecně považován za standardní, a to na základě širokého konsenzu a důkazů z multicentrických studií. Ve studii z roku 2012 ze 16 světových center u 2298 pacientů s pseudomyxoma peritonei bylo dosaženo celkového průměrného mediánu přežití 16,3 roku. Medián období do progrese onemocnění činil 8,2 roku, deseti - a patnáctileté přežívání 63 %, resp. 59 %. Mortalita spojená s tímto výkonem dosáhla 2 % a morbidita 24 % (33).
U malignit apendixu o průměru > 2 cm bývá doporučována pravostranná hemikolektomie umožňující vyšetřit také spádové lymfatické uzliny v ileokolické spádové oblasti. Gonzáles-Moreno a Sugarbaker analyzovali klinická data u 501 pacientů s epitelovými malignitami apendixu (34). U 198 nemocných byla provedena prostá apendektomie, pravostranná hemikolektomie u 280 a žádná resekce u 23. Postižení lymfatických uzlin bylo detekováno u 4,2 % nemocných s mucinózními apendikálními metastázami, významně vyšší u adenokarcinomů intestinálního typu (66,7 %). Přitom bylo prokázáno, že provedení pravostranné hemikolektomie ani postižení uzlin u těchto nádorů nemá vliv na celkové přežívání. Pravostranná hemikolektomie by tedy měla být indikovaná přísně individuálně zejména ve vztahu k peroperačnímu nálezu, a to především z důvodu optimalizace cytoredukce, nikoli radikality. PCI index přitom u PM není limitován, i u hodnoty 39 může být dosaženo optimální cytoredukce.
Pokud není cytoredukce možná při prvotní operaci například z důvodu rozsahu postižení, nestability stavu nemocného během operace apod., doporučuje se second-look operace a re-HIPEC nejpozději do 6–8 měsíců (35).
Nejčastěji používanými cytostatiky pro HIPEC u PMP jsou mitomycin C, cisplatina, 5-fluorouracil a jejich kombinace. Běžně se používá cisplatina v dávce 100 mg/m2 plus mitomycin C 16 mg/m2 při teplotě 41,5 °C nebo mitomycin samostatně v dávce 35 mg/m2 po dobu 60 minut (36).
CRS a HIPEC u primárního peritoneálního mezoteliomu
Primární peritoneální mezoteliom je vzácné onemocnění vycházející z mezotelových buněk. Charakterizován je tvorbou malých nodulů spojujících se ve velké plaky a pláty, které postupně pokrývají celý peritoneální povrch. Až do roku 1990 bylo toto onemocnění považováno za neléčitelné. Od počátku 90. let 20. století s rozvojem CRS a HIPEC se daný postup ukazuje jako standardní pro tento typ onemocnění.
Klinická manifestace je v počátcích velmi chudá, postupně narůstá ascites, objem dutiny břišní a projevují se klinické známky střevní neprůchodnosti. Nejčastějšími symptomy bývají ascites, břišní dyskomfort a bolest a postupná kachektizace. Mohou se také objevit průjmy, teploty, herniace či zvracení.
Základem diagnostiky je CT a biopsie masy pod CT kontrolou nebo při diagnostické laparoskopii. Histologicky rozlišujeme epitelovou, sarkomatoidní a bifázickou variantu mezoteliomu. Jako velmi významný prognostický faktor se ukazuje být index ki-67, excelentní marker buněčné proliferace. Obecně je hodnota indexu u mezoteliomu nízká, vyšší hodnoty však značí významně horší prognózu (37). Tento antigen je tak nejen prognostickým faktorem, ale může rovněž předoperačně vyloučit pacienty, u nichž CRS a HIPEC neovlivní jejich extrémně špatnou prognózu. Takto jsou v Národním onkologickém institutu v Miláně vyloučeni nemocní s mezoteliomem s ki-67 > 9 % a PCI > 17 (38).
Horší prognózu má toto onemocnění u mužů než u žen (39). Je to vysvětlováno zejména časnějším záchytem tohoto typu nádoru a jeho břišní diseminace u žen v rámci preventivních gynekologických prohlídek a také kvůli častějšímu výskytu kontaktu s azbestem u mužů. V této studii činilo pětileté přežívání u žen 63 % a u mužů 42 %.
Tento nádor je povětšinou chemorezistentní. Nejlépe reaguje na cisplatinu a doxorubicin v kombinaci s pemetrexedem (40). Prognosticky nejvýznamněji lze onemocnění ovlivnit pomocí CRS a HIPEC. Z cytostatik se nejčastěji používá cisplatina v dávce 45 mg/l společně s doxorubicinem v dávce 15 mg/l po dobu 90 minut při teplotě 42,5 °C (41). U nemocných ve věku nad 70 let a s předchozí systémovou chemoterapií nebo extenzivní cytoredukcí se doporučuje uvedené dávky redukovat na 30 % původních (42). Při použití této léčby bylo dosaženo pětiletého přežívání u 46,2 % nemocných, celkový medián přežití činil 44,9 měsíce; věk, rozsah postižení, úroveň cytoredukce, použité cytostatikum a délka HIPEC byly faktory nezávislé (43). Mortalita na specializovaných pracovištích dosahuje 1–5 %, morbidita 12–52 %, což je úroveň srovnatelná s ostatními typy velkých onkologických procedur na zažívacím traktu (44).
CRS a HIPEC u peritoneálních metastáz kolorektálního karcinomu, karcinomu žaludku a ovariálního karcinomu
Kolorektální karcinom (CRC) představuje celosvětově třetí nejčastější nádorové onemocnění a čtvrtou nejčastější příčinu úmrtí (45. Tento trend kopíruje dle hlášení „Novotvary 2016“ vydaného ÚZIS i Česká republika. Nejčastější příčinou selhání léčby jsou lokální rekurence v oblasti dutiny břišní a pánve v podobě lokální recidivy či peritoneálních metastáz. Tento nález byl dlouhodobě považován za terminální stadium onemocnění. Rozvoj peritoneálních metastáz je očekáván cca u 40 % všech pacientů s kolorektálním karcinomem (46). Klinické projevy jsou různé, metastázy mohou být synchronní či metachronní a mohou mít podobu jednotlivých lokalizovaných nodulů nebo difuzního peritoneálního postižení. Pokročilá klinická stadia se projevují podobně jako u jiných PM, a to kachexií, ascitem a příznaky střevní obstrukce.
CRS a HIPEC se dlouhou dobu považují u vybraných nemocných za metodu volby v rámci multimodální onkochirurgické léčby. Poprvé byl tento postup popsán Sprattem v roce 1980 (47). V roce 2003 nizozemská skupina vedena Verwaalem (48) prezentovala výsledky randomizované studie hodnotící srovnání systémové léčby vs. CRS a HIPEC, s mediánem přežití v první skupině 13 měsíců vs. 22 měsíců u pacientů po HIPEC. Další zajímavé výsledky přinesla francouzská skupina vedená Eliasem z Institutu Gustava Roussyho ve Villejuif (49), kde průměrný medián přežití u pacientů s PM kolorektálního původu po CRS a HIPEC dosáhl 63 měsíců a pětileté přežití 51 %.
Bohužel tyto výsledky nepotvrdily recentní prospektivní randomizované studie. V rámci studie PRODIGE 7, jejíž závěry prezentoval François Quenet z Francie na 11. světovém kongresu Mezinárodní skupiny léčby malignit peritoneálního povrchu (PSOGI) v roce 2018 v Paříži, byli pacienti s PM z CRC randomizováni do dvou skupin, v jednom rameni podstoupili pouze CRS a ve druhém CRS + HIPEC s oxaliplatinou. Přitom nebyl prokázán efekt HIPEC s oxaliplatinou na celkové přežívání a období bez rekurence, naopak ve skupině s HIPEC došlo k vzestupu pooperačních komplikací. Jednoznačně však bylo prokázáno, že zásadní je efekt kvality cytoredukce, tzn. že pacienti s PM CRC by měli být referováni do center, jež s tímto chirurgickým výkonem a metodikou mají zkušenosti.
Podobně dopadl i výsledek prospektivní randomizované studie fáze III PROPHYLOCHIP vedené francouzskou skupinou z Institutu Gustava Roussyho prezentovaný na stejném fóru, jejímž cílem bylo zhodnotit benefit second-look operace následovaný HIPEC u nemocných s PM CRC. Zařazeni byli pacienti, kterým v době primárního nádoru byly resekovány PM nebo metastázy do ovarií, případně se jednalo o perforovaný CRC. Po primární operaci následovala adjuvantní systémová léčba po dobu 6 měsíců (FOLFOX či XELOX ± cílená léčba). Na jejím konci byli pacienti s normálními hladinami markerů, bez symptomů a s negativním nálezem na CT randomizováni do dvou ramen, v nichž v prvním byli pravidelně dispenzarizováni každé 3 měsíce po dobu 2 let a dále každých 6 měsíců další 3 roky, ve druhém pak podstoupili second-look operaci s HIPEC (oxaliplatina i. p. + 5-fluorouracil i. v.) a teprve poté byli dispenzarizováni. Nebyl prokázán efekt proaktivní léčby ve srovnání se skupinou, která byla po primární léčbě pouze dispenzarizovaná. Celkové pětileté přežívání ve skupině s HIPEC činilo 67,9 %, ve skupině bez HIPEC 72 %.
CRS a HIPEC je u kolorektálního karcinomu stále diskutovanou možností léčby a její indikace by měla být přísně individuální. Aktuální guidelines National Comprehensive Cancer Network (NCCN), verze 1.2017, doporučují CRS s HIPEC či bez ní u pacientů s limitovanými PM CRC, u kterých je možné docílit R0 resekci. Vzhledem k možnostem současné systémové a cílené léčby a výsledkům recentních studií se zdá být přínos CRS a HIPEC u CRC omezený. Indikace se tak posouvají k preventivním výkonům u vysoce rizikové skupiny mladých a relativně zdravých jedinců u CRS s mucinózní složkou, u kterých jsou peroperačně nalezena ložiska PM, jsou přítomné ovariální cysty metastazujícího CRC, pozitivní cytologie, nádorové píštěle do střeva v nádorové mase, obstrukce nádorem, perforované tumory, T3 mucinózní nádory, T4 stadia, perforace tumoru během resekčního výkonu nebo pozitivní resekční okraje. Obecně vyřazujícím kritériem jsou extraperitoneální metastázy a celkově špatný stav nemocného limitující rozsáhlý operační výkon.
PM u karcinomu žaludku (GC) jsou popsány u 5–20 % pacientů indikovaných k resekčnímu výkonu (50). Agresivita žaludečních karcinomů obzvláště u mladších ročníků je vysoká. Problémem také zůstává vysoký počet lokoregionálních rekurencí GC po resekčních výkonech a D2 lymfadenektomii. Důvody jsou dva, jednak je to spontánní metastatický rozsev nádorových buněk v peritoneální dutině a dále rozsev buněk uvolněných při samotném chirurgickém výkonu. Během gastrektomie dochází k uvolnění nádorových buněk z resekčních ploch lymfatických drah, tkání blízko resekčním liniím a také ke kontaminaci peritoneální dutiny krví z nádoru. Cytologické vyšetření nitrobřišních tekutin těsně po chirurgickém zákroku vykazuje vysoký počet pozitivních nádorových buněk (51). To je podkladem k použití peroperační chemoterapie, a to jak v normotermii, tak i v hypertemii.
K dispozici je řada výsledků studií, jež prokazují význam CRS a HIPEC u vybrané skupiny nemocných s PM GC. Ve francouzské studii z roku 2010 bylo dosaženo mediánu přežití 15 měsíců a pětiletého přežívání u nemocných s PM GC 23 % (52). Yonemura et al. z japonské skupiny popisují pětileté přežití ve svém souboru 27 % a medián přežití 15,5 měsíce (53). Prospektivní randomizovaná studie GASTRIPEC prof. Rau z Německa, která měla srovnávat význam CRS a HIPEC u nemocných s PM GC proti skupině nemocných s resekčním výkonem a pooperační chemoterapií, byla v roce 2018 ukončena a zastavena z důvodu extrémní progrese nemoci v obou ramenech, kdy průměrné přežívání nemocných s PM GC jak s CRS a HIPEC, tak s pouhou chemoterapií dosáhlo 4 měsíce.
Indikace k CRS a HIPEC u tohoto typu nádoru tedy musejí být přísně individuální. Očekávají se výsledky profylaktického využití HIPEC po standardních gastrektomiích a D2 lymfadenektomiích s cílem redukovat lokoregionální recidivy – studie GASTRICHIP. Velmi slibné výsledky v paliativní léčbě a zmírnění symptomů PM u GC má nová metoda zavedená prof. Markem Reymondem z německé Bochumi označovaná jako PIPAC (pressurized intraperitoneal aerosol chemotherapy) (54). Během této laparoskopické metody se aplikuje roztok s cytostatikem při teplotě 37 °C pomocí injektoru a speciální sondy do peritoneální dutiny s kapnoperitoneem při tlaku 12 mmHg po dobu 30 minut bez předchozí cytoredukce. Vlivem vyššího průniku aerosolu do nádorové tkáně dochází k regresi karcinomatózy a zmírnění symptomů ascitu a poruchy střevní pasáže. Výsledky této paliativní metody jsou dále evaluovány.
Epitelové nádory ovaria (OC) se obecně vyznačují sklonem k šíření per continuitatem, a karcinomatóza peritonea tedy patří k jejich klinickému obrazu. Maligní buňky mohou být přítomné v peritoneálním výplachu již v časných stadiích. Zejména high-grade epitelové nádory vaječníku patří mezi chemosenzitivní nádory.
Základem léčby je systémová léčba. U pacientek, u nichž není možno primárně provést chirurgický výkon, aplikujeme neoadjuvantní systémovou chemoterapii, optimálně 3–4 cykly platinového derivátu v kombinaci s taxanem, a v této systémové léčbě pokračujeme po chirurgickém výkonu. Bohužel u většiny nemocných dochází i v případě kurativního zákroku následovaného standardní adjuvantní systémovou léčbou k recidivě onemocnění (do 5 let u 60 % žen, do 10 let u 66 %). Z toho dvě třetiny nemocných jsou v případě recidivy nemoci postiženy peritoneálními metastázami (55).
V loňském roce byla publikována rozsáhlá multicentrická studie fáze III (56), která jednoznačně prokázala benefit přidání HIPEC (cisplatina 100 mg/m2) k intervalové cytoredukční chirurgii u pacientek s karcinomem ovaria FIGO III, které podstupovaly výkon po 3 cyklech systémové neoadjuvantní chemoterapie v kombinaci karboplatiny a paklitaxelu (medián OS 33,9 vs. 45,7 měsíce).
Jiná studie fáze III poukázala i na přínos HIPEC během cytoredukčního výkonu v případě chirurgicky řešitelné recidivy onemocnění (57). HIPEC protokol pro platina-senzitivní pacientky obsahoval cisplatinu (100 mg/m2) a paklitaxel (175 mg/m2) a pro platina-rezistentní pacientky doxorubicin (35 mg/m2) a mitomycin C (15 mg/m2) s dobou aplikace 60 minut. Obě ramena následně absolvovala standartní systémovou chemoterapii. V této studii přidání HIPEC k cytoredukčnímu výkonu prokázalo jednoznačné prodloužení celkového přežívání pacientek (26,7 vs. 13,4 měsíce). Ve skupině nemocných léčených HIPEC nebyl pozorován rozdíl v celkovém přežívání platina-senzitivních a platina-rezistentních pacientek (26,6 vs. 26,8 měsíce), zatímco ve skupině s pouze systémovou chemoterapií po chirurgickém výkonu byl rozdíl markantní (15,2 vs. 10,2).
Na podkladě uvedené studie tak lze usuzovat, že zejména u platina-rezistentních pacientek by měl být tento alternativní způsob léčby zvážen s přihlédnutím k individuálnímu stavu. Výsledky však musejí být dále evaluovány. Kvůli názorovým střetům gynekologů, klinických onkologů a chirurgů navíc hypertermie u PM OC není zatím jednoznačně přijímána. Je však jistě metodou volby u nemocných v dobré kondici s pokročilým metastatickým postižením peritoneální dutiny OC.
ZÁVĚR
Cytoredukční chirurgie a HIPEC je speciální kombinovanou onkochirurgickou metodou, která v sobě zahrnuje poměrně rozsáhlý operační zákrok směřující k odstranění viditelné nádorové masy a následuje aplikace cytostatika v hypertermii s cílem redukovat počet zbytkových nádorových buněk.
Tento typ léčby se stal standardem péče u nemocných s pseudomyxomem peritonea z neoplazií apendixu a u primárního maligního mezoteliomu peritonea, kde může u selektovaných pacientů vést k vyléčení. U sekundárních metastazujících karcinomů kolorekta, žaludku a ovarií je tato metoda předmětem řady celosvětově probíhajících multicentrických studií, na jejichž evaluaci se čeká. Nicméně u vybrané skupiny nemocných s tímto typem sekundárního postižením peritonea může tento postup vést k významnému prodloužení celkového přežívání a období bez choroby při zachování vysoké kvality života.
Ve specializovaných centrech v ČR je tato metoda zatížena pooperační morbiditou a mortalitou srovnatelnou se zahraničními údaji.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce byla podpořena grantovým projektem AZV MZČR č. NV18-03-00130.
Seznam použitých zkratek
CEA karcinoembryonální antigen
CRC kolorektální karcinom
CRS cytoredukční chirurgie
CT výpočetní tomografie
FIGO International Federation of Gynecology and Obstetrics
GC karcinom žaludku
GOG Gynecologic Oncology Group
HAMN high-grade apendikální mucinózní neoplazie
HIPEC hypertermická intraperitoneální chemoterapie
LAMN low-grade apendikální mucinózní neoplazie
MPM maligní peritoneální mezoteliom
MRI magnetická rezonance
NCCN National Comprehensive Cancer Network
OC karcinom ovaria
OS celkové přežití
PC peritoneální karcinomatóza
PCI peritoneal cancer index
PET pozitronová emisní tomografie
PIPAC pressurized intraperitoneal aerosol chemotherapy
PM peritoneální metastázy
PMCA peritoneální mucinózní karcinomatóza
PMCA-S mucinózní carcinoma peritonei s prstenčitými buňkami
PMP pseudomyxom peritonea
PPSPC primární peritoneální serózní papilární karcinom
PSOGI Peritoneal Surface Oncology Group International
ÚZIS Ústav zdravotnických informací a statistiky ČR
WHO Světová zdravotnické organizace
Adresa pro korespondenci:
MUDr. JUDr. Dušan Klos, Ph.D.
I. chirurgická klinika LF UP a FN Olomouc
I. P. Pavlova 6, 779 00 Olomouc
Tel.: 588 442 749
e-mail: dusan.klos@fnol.cz
Sources
- Spratt JS, Adcock RA, Muskovin M et al. Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res 1980; 40 : 256–260.
- Raptopoulos V. Peritoneal mesothelioma. Crit Rev Diagn Imaging 1985; 24 : 293–328.
- Seidman JD, Zhao P, Yemelyanova A et al. Primary peritoneal high-grade serous carcinoma is very likely metastatic from serous tubal intraepithelial carcinoma: assessing the new paradigm of ovarian and pelvic serous carcinogenesis and its implications for screening for OC. Gynecol Oncol 2011; 120 : 470–473.
- Mačák J, Mukenšnábl P, Kawano N et al. Intraabdominální dezmoplastický malobuněčný nádor peritonea. Česko-slovenská patologie 2003; (2): 69–75.
- Lal DR, Su WT, Wolden SL et al. Results of multimodal treatment for desmoplastic small round cell tumors. J Pediatr Surg 2005; 40 : 251–255.
- Bilimoria MM, Holtz DJ, Mirza NQ et al. Tumor volume as a prognostic factor for sarcomatosis. Cancer 2002; 94 : 2441–2446.
- Carr NJ, Bibeau F, Bradley RF et al. The histopathological classification, diagnosis and differential diagnosis of mucinous appendiceal neoplasms, appendiceal adenocarcinomas and pseudomyxoma peritonei. Histopathology 2017; 71 : 847–858.
- Lemmens VE, Klaver YL, Verwaal VJ et al. Predictors and survival of synchronous peritoneal carcinomatosis of colorectal origin: a population based-study. Int J Cancer 2011; 128 : 2717–2725.
- Segelman J, Granath F, Holm T et al. Incidence, prevalence and risk factors for peritoneal carcinomatosis from cancer. Br J Surg 2012; 99 : 699–705.
- Koppe MJ, Boermann OC, Oyen WJ et al. Peritoneal carcinomatosis of colorectal origin and current treatment strategies. Ann Surg 2006; 243 : 212–222.
- Kerscher AG, Chua TC, Gasser M et al. Impact of peritoneal carcinomatosis in the disease history of colorectal cancer management: a longitudinal experience of 2406 patients over two decades. Br J Cancer 2013; 108 : 1432–1439.
- Hampes D, Tiek J, Wolthuis A et al. HIPEC in T4a colon cancer: a defendable treatment to improve oncologic outcome? Ann Oncol 2013; 23 : 3123–3129.
- Thomassen I, van Gistel YR, van Ramshorst B et al. Peritoneal carcinomatosis of gastric origin: A population-based study on incidence, survival and risk factors. Int J Cancer 2014; 134 : 622–628.
- International Agency for Research on Cancer. Dostupné na: www.iarc.fr
- Sherer DM, Abulafia O, Eliakim R. Pseudomyxoma peritonei: a review of current literature. Gynecol Obstet Invest 2001; 51 : 73–80.
- Boffetta P. Epidemiology of peritoneal mesothelioma: a review. Ann Oncol 2007; 18 : 985–990.
- Marin D, Catalano C, Kaski M et al. 64-section multi-detector row CT in the preoperative diagnosis of peritoneal carcinomatosis: correlation with histopathological findings. Abd Imaging 2010; 35 : 694–700.
- Fujii S, Matsusue E, Kanasaki Y et al. Detection of peritoneal dissemination in gynecological malignancies: evaluation by diffusion-weighted MR imaging. Eur Radiol 2008; 18 : 18–23.
- Kitajima K, Murakami K et al. Present and future of FDG-PET/CT in ovarian cancer. Ann Nucl Med 2011; 25 : 155–164.
- Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. In: Sugarbaker PH (ed.). Peritoneal carcinomatosis: principles of management. Kluwer, Boston, 1996 : 359–374.
- Baratti D, Kusamura S, Migrone E et al. Identification of a subgroup of patients at highest risk for complications after surgical cytoreduction and hyperthermic intraperitoneal chemotherapy. Ann Surg 2012; 256 : 334–341.
- Sugarbaker PH. Peritonectomy procedures. Cancer Treat Res 2007; 134 : 247–264.
- Kusamura S, Baratti D, Deraco M. Multidimensional analysis of the learning curve for cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in peritoneal surface malignancies. Ann Surg 2012; 255 : 348–356.
- Sugarbaker PH, van der Speeten K. Surgical technology of hyperthermic perioperative chemotherapy. J Gastrointest Oncol 2016; 7 : 29–44.
- Norton L, Simon R, Brereton HD et al. Predicting the course of Gompertzian growth. Nature 1976; 264 : 542–545.
- Norton L, Simon R. The Norton-Simon hypothesis revisited. Cancer Treat Rep 1986; 70 : 163–169.
- Tanaka K, Inoue Y, Toiyama J. The role of cytoreduction for metastatic and recurrent colorectal cancer in the era of multidisciplinary treatments. J Clin Oncol 2010; 28 (15 Suppl.): e14091.
- Dedrick RL, Myers CE, Bungay PM et al. Pharmacokinetic rationale for peritoneal drug administration in the treatment of ovarian cancer. Cancer Treat Rep 1978; 62 : 1–11.
- Sugarbaker PH, van der Speeten K, Anthony Stuart O et al. Impact of surgical and clinical factors on the pharmacology of intraperitoneal doxorubicin in 145 patients with peritoneal carcinomatosis. Eur J Surg Oncol 2011; 37 : 719–726.
- Sticca RP, Dach BW. Rational for hyperthermia with intraoperative intraperitoneal chemotherapy agents. Surg Oncol N Am 2003; 12 : 689–701.
- Kampinga HH. Cell biological effects of hyperthermia alone or combined with radiation or drugs: a short introduction to newcomer in the field. Int J Hyperthermia 2006; 22 : 191–196.
- Leunig M, Goetz AE, Dellian M et al. Interstitial fluid pressure in solid tumors following hyperthermia: possible correlation with therapeutic response. Cancer research 1992; 52 : 487–490.
- Chua TC, Moran BJ, Sugarbaker PH et al. Early - and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol 2012; 30 : 2449–2456.
- Gonzales-Moreno S, Sugarbaker PH. Right hemicolectomy does not confer a survival advantage in patients with mucinous carcinoma of the appendix and peritoneal seeding. Br J Surg 2004; 91 : 304–311.
- Sugarbaker PH. New standard of care for appendiceal epithelial neoplasms and pseudomyxoma peritonei syndrome. Lancet Oncol 2006; 7 : 69–76.
- Glehen O, Sugarbaker PH, Elias D et al. Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer. A multi-institutional study of 506 patients. J Clin Oncol 2004; 22 : 3284–3292.
- Borczuk AC, Taub RN, Hesdorffer M et al. P16 loss and mitotic activity predict poor survival in patients with peritoneal malignant mesothelioma. Clin Cancer Res 2005; 11 : 3303–3308.
- Deraco M, Cabras A, Baratti D et al. Immunohistochemical evaluation of minichromosome maintance protein 7 (MCM7), topoisomerase II, and Ki-67 in diffuse malignant peritoneal mesothelioma patients using tissue microarray. Ann Surg Oncol 2015; 22 : 4344–4351.
- Yan TD, Popa E, Brun EA et al. Sex difference in diffuse malignant peritoneal mesothelioma. Br J Surg 2006; 93 : 1536–1542.
- Deraco M, Baratti D, Hutanu I et al. The role of perioperative systemic chemotherapy in diffuse malignant peritoneal mesothelioma patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. Ann Surg Oncol 2013; 20 : 1093–1100.
- Rossi CR, Foletto M, Mocellin S et al. Hyperthermic intraoperative intraperitoneal chemotherapy with cisplatin and doxorubicin in patients who undergo cytoreductive surgery for peritoneal and sarcomatosis: phase I study. Cancer 2002; 94 : 492–499.
- Kusamura S, O’Dwyer ST, Baratti D et al. Technical aspects of cytoreductive surgery. J Surg Oncol 2008; 98 : 232–236.
- Deraco M, Kusamura S, Sugarbaker PH et al. PSOGI International Registry on peritoneal mesothelioma., Eleventh International Symposium on regional Cancer Therapies, Phoenix, 2016.
- Chua TC, Yan TD, Saxena A et al. Should the treatment of peritoneal carcinomatosis by cytoreductive surgery and hyperthermic intraperitoneal chemotherapy still be regarded as a highly morbid procedure? A systematic review of morbidity and mortality. Ann Surg 2009; 249 : 900–907.
- WHO. Globoscan – Section of Cancer Information. International Agency for Research on Cancer, France, 2008. Dostupné na: www.iarc.fr
- Koppe MJ, Boerman OC, Oyen WJ et al. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies. Ann Surg 2006; 243 : 212–222.
- Spratt JS, Adcock RA, Muskovin N et al. Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res 1980; 40 : 256–260.
- Verwaal VJ, van Ruth S, de Bree E et al. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin Oncol 2003; 21 : 3737–3743.
- Elias D, Lefevre JH, Chevalier J et al. Complete cytoreductive surgery plus intraperitoneal chemohyperthermia with oxaliplatin for peritoneal carcinomatosis of colorectal origin. J Clin Oncol 2009; 27 : 681–685.
- Hioki M, Gotohda N, Konishi M et al. Predictive factors improving survival after gastrectomy in gastric cancer patients with peritoneal carcinomatosis. World J Surg 2010; 34 : 555–562.
- Kodera Y, Yamamura Y, Shimizu Y et al. Peritoneal washing cytology: prognostic value of positive findings in patients with gastric carcinoma undergoing a potentially curative resection. J Surg Oncol 1999; 72 : 60–65.
- Glehen O, Gilly FN, Arvieux C et al. Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy. Ann Surg Oncol 2010; 17 : 2370–2377.
- Yonemura Y, Kawamura T, Bandou E et al. Treatment of peritoneal dissemination from gastric cancer by peritonectomy and chemohyperthermic peritoneal perfusion. Br J Surg 2005; 92 : 370–375.
- Solass W, Kerb R, Mürdter T et al. Intraperitoneal chemotherapy of peritoneal carcinomatosis using pressurized aerosol as an alternative to liquid solution: first evidence for efficacy. Ann Surg Oncol 2014; 21 : 553–559.
- Ferrandina G, Legge F, Salutari V et al. Impact of pattern of recurrence on clinical outcome of ovarian cancer patients: clinical consideration. Eur J Cancer 2006; 42 : 2296–2302.
- van Driel WJ, Koole SN, Sonke GS. Hyperthermic intraperitoneal chemotherapy in ovarian cancer. N Eng J Med 2018; 3 : 230–240.
- Spiliotis J, Halkia E, Lianos E et al. Cytoreductive surgery and HIPEC in recurrent epithelial ovarian cancer: a prospective randomized phase III study. Ann Surg Oncol 2015; 22 : 1570–1575.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2018 Issue 8-
All articles in this issue
- Pracovní lékařství a prevence nemocí
- Aktuality a úskalí v diagnostice a uznávání nemocí z povolání
- Kategorizace prací ve vazbě na profesionální onemocnění hlášená v České republice v roce 2017
- Profesionální bronchiální astma a rýma: Myslíme na ně včas?
- Psychosociální rizika ve zdravotnictví
- Současné postavení cytoredukční chirurgie (CRS) a intraperitoneální hypertermické chemoterapie (HIPEC) v multimodální léčbě nádorů peritoneálního povrchu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné postavení cytoredukční chirurgie (CRS) a intraperitoneální hypertermické chemoterapie (HIPEC) v multimodální léčbě nádorů peritoneálního povrchu
- Psychosociální rizika ve zdravotnictví
- Profesionální bronchiální astma a rýma: Myslíme na ně včas?
- Kategorizace prací ve vazbě na profesionální onemocnění hlášená v České republice v roce 2017
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career