-
Medical journals
- Career
Potenciální zdroje ftalátů a bisfenolu A a jejich význam u metabolických onemocnění
Authors: MUDr. Ph.D. Miloš Mráz; prof. MUDr. DrSc. Štěpán Svačina; MUDr. Eva Kotrlíková; MUDr. Roman Piecha; Ing. Karel Vrbík; Ing. Jana Pavloušková; RNDr. CSc. Zdeňka Lacinová; Ing. Adam Vavrouš; doc. MUDr. Ph.D. Dana Müllerová; MUDr. Dagmar Matějková; MUDr. Ph.D. Jarmila Křížová
Authors‘ workplace: 3. interní klinika 1. LF UK a VFN v Praze 1; Státní zdravotní ústav, Praha 2; Ústav hygieny a preventivní medicíny LF UK v Plzni 3; 1. interní klinika LF UK a FN Plzeň 4
Published in: Čas. Lék. čes. 2016; 155: 121-125
Category: Original Article
Overview
Stále přibývá důkazů, že na rozvoji významných složek metabolického syndromu (obezity, diabetu mellitu 2. typu, arteriální hypertenze a dyslipidemie) se kromě tradičních rizikových faktorů (změny výživy, úbytek pohybové aktivity a genetika) podílejí organické látky z prostředí, nazývané obvykle organické polutanty či endokrinní disruptory. Tyto chemické látky se vyskytují v obalech, nátěrových hmotách, tzv. zpomalovačích hoření, výfukových plynech, hnojivech, ale i nejrůznějších předmětech denní potřeby. Mezi jejich nejznámější představitele patří ftaláty, používané především jako změkčovadla plastů, a bisfenol A.
Cílem následujícího článku je podat základní informace o vztahu mezi uvedenými látkami a metabolickými onemocněními a poukázat na jejich možné zdroje. Na základě analýzy materiálů používaných při parenterální výživě a exkrece uvedených látek močí u pacientů na dlouhodobé parenterální výživě se domníváme, že zdravotnické materiály jsou dnes bezpečné a pravděpodobnější je zdroj látek v domácím prostředí. Dle dalších našich analýz je nejpravděpodobnějším zdrojem používání kosmetických produktů.Klíčová slova:
endokrinní disruptory, ftaláty, bisfenol A, obezita, diabetes mellitus 2. typuÚvod
Rostoucí prevalence obezity a k ní přidružených komplikací zahrnujících diabetes mellitus 2. typu, arteriální hypertenzi, dyslipidemii a další onemocnění představuje v současnosti celosvětově jeden z nejpalčivějších zdravotních problémů (1). Jeho důležitost ještě více zdůrazňuje fakt, že uvedený cluster nemocí je spojený s významným nárůstem kardiovaskulární morbidity a mortality se všemi z toho plynoucími individuálními i socioekonomickými důsledky (2, 3). V současné době se ukazuje, že kromě tradičních faktorů, jako jsou genetická predispozice k ukládání tělesného tuku, nadměrný příjem energeticky bohatých potravin a snížená fyzická aktivita, se na etiopatogenezi obezity a diabetes mellitus 2. typu mohou podílet i další, méně známé mechanismy jako změny střevní mikroflóry, epigenetické faktory nebo vliv chemických látek z vnějšího prostředí (4−6). Tyto chemické látky, označované jako endokrinní disruptory, se vyskytují ve většině předmětů denní potřeby a nacházejí též rozsáhlé uplatnění jako součást obalové technologie především v potravinářském průmyslu (7). Mezi jejich nejběžnější představitele patří látky ze skupiny průmyslových změkčovadel, zahrnující rozličné deriváty ftalátů a bisfenol A (7, 8). Cílem následujícího článku je podat základní přehled o vztahu mezi uvedenými endokrinními disruptory a vznikem obezity, diabetu mellitu 2. typu a souvisejících komplikací, analyzovat materiály používané ve zdravotnictví a zároveň upozornit na možné zdroje ftalátů a bisfenolu A.
Výskyt obezity a přidružených onemocnění v poslední době rapidně stoupá. Podle Světové zdravotnické organizace (WHO) bylo v roce 2013 celosvětově postiženo diabetem 347 milionů lidí (9). Od roku 1980 do roku 2011 se prevalence obezity ve světě zdvojnásobila, přičemž u dětí a adolescentů do 19. roku věku dokonce došlo k jejímu zvýšení na trojnásobek (10). Důvody pro tak rychlý nárůst nejsou zcela zřejmé, i když nadměrný energetický příjem a sedavý způsob života představují nepochybně hlavní rizikové faktory. Pro existenci alternativních mechanismů podílejících se na etiopatogenezi obezity svědčí například i fakt, že v posledních desetiletích došlo ke zvýšení hmotnosti též u domácích a laboratorních zvířat, což nejde zcela přičítat změnám v příjmu potravy nebo fyzické aktivitě (7). Zatímco zavedení syntetických chemických látek do běžného života vedlo k radikálnímu zlepšení jeho kvality, v poslední době se začíná objevovat čím dál více údajů o jejich potenciálních nežádoucích účincích včetně zasahování do endokrinních a metabolických dějů, čímž mohou přispívat k aktuální explozi metabolických onemocnění asociovaných s obezitou (11).
Endokrinní disruptory
Endokrinní disruptory jsou definované jako exogenní látky, které mění funkci endokrinního systému, což vede k nežádoucím zdravotním dopadům na individuální organismus nebo jeho potomstvo (7). Endokrinní disruptory mohou interferovat se syntézou, sekrecí, transportem a eliminací nejrůznějších hormonů a stejně tak mohou napodobovat jejich funkce. Do skupiny endokrinních disruptorů patří široká škála chemických látek včetně pesticidů, změkčovadel, zpomalovačů hoření, nátěrových hmot, těžkých kovů, průmyslových rozpouštědel a substancí uplatňujících se při výrobě plastů a dalšího spotřebního zboží (12). Vzhledem k jejich všeobecnému rozšíření jsou jejich působení vystavené prakticky všechny lidské populace (13).
Některé endokrinní disruptory se vyznačují dlouhým poločasem rozkladu, jsou obtížně metabolizovatelné a vzhledem ke své lipofilní povaze mohou být roky ukládány v tukové tkáni (jako např. pesticidy, dioxiny nebo těžké kovy) (14). Ovšem i substance, které jsou z organismu rychle vylučovány, ale ze své podstaty jsou přítomné ve většině předmětů denní potřeby, jako např. bisfenol A, mohou mít za následek závažné zdravotní komplikace, obzvláště v případě působení v průběhu ontogeneticky důležitých vývojových etap (především intrauterinně) (12).
Hypotéza, že zvýšená prevalence obezity by mohla být spojená s vlivem endokrinních disruptorů, byla prvně zformulována Baillieovou-Hamiltonovou v roce 2002 (15). Exogenní substance zvyšující riziko vzniku obezity byly nazvány obezogeny. Od té doby byla identifikována řada potenciálních obezogenů, přičemž mezi nejvýznamnější kandidáty patří ftaláty a bisfenol A (7, 8, 16−18).
Ftaláty
Ftaláty, dialkyl - nebo arylestery kyseliny 1,2-benzendikarboxylové (ftalové) nacházejí rozsáhlé uplatnění především při výrobě spotřebního zboží a obalové technologie (19). Nižší ftaláty se využívají primárně jako rozpouštědla v parfémech. Např. diethylftalát (DEP) se vyskytuje v deodorantech, šampónech, mýdlech a tělových mlékách, zatímco dibutylftalát (DBP) se používá v lacích na vlasy a nehty, ale i v adhezivech, fixativech, detergentech, insekticidech a jinde. Vysokomolekulární ftaláty, jako di-2-ethylhexylftalát (DEHP) a benzylbutylftalát (BzBP) se přidávají jako změkčovače plastů k PVC (polyvinylchlorid), čímž mu dodávají vyšší elasticitu, trvanlivost a termostabilitu (20). Ftaláty se jako běžné součásti domácího prostředí vyskytují taktéž např. v podlahových krytinách z měkčeného PVC nebo plastových součástech aut (21).
Vzhledem k tomu, že ftaláty nejsou v daných produktech pevně chemicky vázány, mohou se z nich lehce uvolnit a dostat se do vzduchu nebo přímo kontaminovat okolní prostředí včetně potravin. Hlavní expoziční cesty proto zahrnují jejich požití v potravě či vodě, vdechnutí a vstřebání kůži (obvykle z kosmetických přípravků). Ftaláty jsou také schopny procházet placentární bariérou. Jejich biologický poločas je relativně krátký, jelikož jsou rychle metabolizovány hydrolýzou na bioaktivní monoestery, které jsou vylučovány převážně močí, a to buď volně, nebo ve formě glukuronidů. Monoestery ftalátů bývají dále postupně oxidovány, přičemž vzniklé sekundární produkty jsou taktéž vylučovány močí (22−25).
Díky své všudypřítomnosti dosahuje expozice ftalátům značného rozsahu – např. ve studii z roku 2004 byly v USA metabolity ftalátů detekovány v moči až u 75 % obecné populace (26). Ftaláty, klasifikované jako endokrinní disruptory či modulátory, jsou schopné ovlivňovat endogenní produkci hormonů, jako je testosteron, FSH (folikuly stimulující hormon) nebo inzulinu podobný růstový faktor 3 (IGF-3), čímž mohou způsobit narušení funkčního a strukturálního vývoje mužských pohlavních znaků, případně vést až k infertilitě (27).
V první epidemiologické studii, zabývající se vztahem mezi ftaláty, obezitou a diabetem 2. typu, byly koncentrace čtyř ftalátových monoesterů v moči (monobenzylftalát [MBzP], mono(2-ethyl-5-hydroxyhexyl)ftalát [OH-MEHP], mono(2-ethyl-5-oxohexyl)ftalát [oxo-MEHP] a monoethylftalát [MEP]) asociovány s větším obvodem pasu, přičemž nárůst jejich koncentrací z 10. na 90. percentil vedl ke zvětšení obvodu pasu o 3,9−7,8 cm. Obdobně byly vysoké močové hladiny tří ze sledovaných metabolitů (mono-n-butylftalát [MnBP], MBzP a MEP) spojené se sníženou citlivostí k inzulinu (28). V jiné práci prokázali Hatch et al. pozitivní korelaci mezi některými metabolity ftalátů v moči (MBzP, OH-MEHP, oxo-MEHP, MEP a MnBP), hodnotou BMI a obvodem pasu v mužské populaci, zatímco u žen byl tento vztah přítomen jenom u MEP, přičemž močové koncentrace mono(2-ethylhexyl)ftalátu (MEHP) naopak korelovaly s BMI negativně (29). Další průřezové studie potvrdily pozitivní asociaci mezi koncentracemi některých ftalátů v moči i seru (DEHP, MEP) a výskytem diabetu 2. typu (30−32). Ukázaly taktéž, že u žen dosahují močové hladiny ftalátů vyšších hodnot než u mužů, zatímco u sérových koncentrací žádné pohlavní rozdíly patrny nebyly (22). Důvod pro tento rozdíl zatím není zřejmý, i když může souviset s vyšším používáním produktů obsahujících ftaláty ženami než muži (33). Za hlavní mechanismus, kterým by ftaláty mohly zasahovat do etiopatogeneze obezity a diabetu 2. typu, je považována jejich potenciální interakce s receptory PPARα a γ (peroxisome proliferator-activated receptor), které se podílejí na regulaci adipocytární diferenciace a produkce adipokinů, jakož i na dalších procesech asociovaných s metabolismem glukózy a lipidů (34, 35).
Bisfenol A
Bisfenol A (2,2’-bis(4-hydroxyfenyl)propan) je jednou z nejrozšířenějších umělých chemických substancí ve světě. Poprvé byl syntetizován již koncem 19. století jako potenciální syntetický estrogen a i když byla jeho estrogenní aktivita potvrzena, v praxi se místo něj uplatnil diethylstilbestrol, jehož estrogenní účinky byly mnohem silnější (36). Vzhledem ke své tepelné odolnosti a schopnosti dodat umělohmotným materiálům elasticitu se BPA začal v 50. letech 20. století využívat při výrobě plastů, přičemž v současnosti se používá hlavně v produkci polykarbonátů a epoxidových pryskyřic (37). BPA je možno najít hlavně v plastových lahvích a obalech na jídlo, což vysvětluje, proč má většina lidí měřitelné hladiny BPA v moči nebo séru (38, 39).
I když je hlavní pozornost v souvislosti s potenciální toxicitou BPA zaměřená na jeho vliv na pohlavní vývoj a reprodukční zdraví, recentní výsledky poukazují na jeho možnou roli i při rozvoji obezity a diabetu 2. typu. Zatímco akutní expozice malou dávkou BPA vedla u myší k poklesu glykemie a zvýšení inzulinemie, chronické působení mělo za následek hyperinzulinemii a sníženou inzulinovou senzitivitu v periferních tkáních včetně jater, tukové tkáně a kosterního svalu, patrné obzvláště u zvířat, kterým byl BPA aplikován podkožní injekcí nebo jej požila perorálně (40). V průběhu chronické expozice ovlivňoval BPA prostřednictvím přímého efektu na regulační struktury v CNS i energetickou homeostázu, což mělo za následek snížení jak příjmu energie, tak jejího výdeje (41).
V lidských adipocytech vedlo působení BPA ke snížení produkce metabolicky příznivě působícího adipokinu adiponektinu a ke zvýšené diferenciaci a akumulaci lipidů v buňkách, což mělo za následek rozvoj inzulinové rezistence (42, 43). Extrapolace uvedených údajů na lidskou populaci však zůstává obtížná, zvláště proto, že klinické údaje u lidí jsou zatím značně omezené a nekonzistentní (18, 44−47).
Ftaláty a bisfenol A v České republice
Na našich pracovištích jsme recentně provedli několik analýz koncentrací ftalátů a bisfenolu A v moči a séru rozličných skupin probandů: zdravých jedinců, obézních osob, diabetiků 2. typu, pacientů s arteriální hypertenzí, dyslipidemií a nemocných na parenterální výživě. V pilotní studii zdravých jedinců jsme prokázali vyšší hladiny monoethylftalátů v moči v souvislosti s používáním kosmetických produktů (48). V další studii byla přítomnost diabetu 2. typu spojena s vyššími močovými koncentracemi čtyř ftalátových metabolitů (mono(3-karboxypropyl)ftalátu [cx-MBP], mono(2-ethyl-5-karboxypentyl)ftalátu [cx-MEHP], OH-MEHP, oxo-MEHP) nezávisle na výskytu arteriální hypertenze či dyslipidemie, což naznačuje možnou kauzální souvislost mezi těmito metabolity, inzulinovou rezistencí a dysfunkcí beta-buněk (49). Je zajímavé, že v podskupině obézních pacientů postupujících 2 týdny redukční diety došlo k poklesu močových koncentrací jenom u jednoho metabolitu (MnBP), přičemž však jeho hladiny neměly žádný vztah ke sledovaným antropometrickým, biochemickým a hormonálním parametrům. Stejně tak se nepodařilo prokázat žádnou asociaci mezi koncentracemi sledovaných ftalátů či bisfenolu A a expresí vybraných genů podílejících se na metabolických regulacích v podkožní tukové tkáni (50).
K významné expozici umělým hmotám nepochybně dochází ve zdravotnictví. Proto jsme vybrali k analýze skupinu pacientů s opakovaným kontaktem se zdravotnickým materiálem typu kanyl a vaků. Hladiny ftalátů a BPA byly hodnoceny u skupiny pacientů na parenterální výživě, a to jednak v nemocničním, jednak v domácím prostředí. Původní předpoklad o vyšší expozici ftaláty v důsledku používání plastových vaků na parenterální výživu stejně jako plastových kanyl a spojovacích hadiček několika výrobců však nebyl potvrzen laboratorní analýzou ve Státním zdravotním ústavu – přítomnost ftalátů či bisfenolu A nebyla prokázána v žádném z testovaných vaků (vaky Nutriflex, B. Braun; Oliclinomel, Baxter; Smofkabiven, Fresenius Kabi) ani v plastovém spotřebním materiálu (infuzní sady Intrafix Primeline, B. Braun). Dnes užívané materiály lze tedy hodnotit jako bezpečné. Obě skupiny se v zastoupení ftalátů v moči prakticky nelišily, kromě významně vyšších hodnot dvou metabolitů (MEP a mono(4-methyl-7-oxooctyl)ftalát [oxo-MMeOP]) u pacientů na domácí parenterální výživě, a to i přes tendenci k nižší hmotnosti a absenci přítomnosti diabetu 2. typu v této skupině (viz tab. 1). To svědčí pro možnou expozici pacientů jiným faktorům v domácím prostředí než v nemocnici. Perorální příjem pacientů byl s ohledem na diagnózy malý a definovaný. Jako nejpravděpodobnější zdroj se znovu jeví hlavně kosmetické přípravky a krémy, což je s ohledem na naši výše uvedenou studii (48) pravděpodobnější než jiné domácí zdroje.
Table 1. Metabolity ftalátů u pacientů na nemocniční a domácí parenterální výživě (PEN). Data jsou vyjádřena jako průměr ±SD nebo medián (IQR). Statistická signifikance byla stanovena pomocí nepárového t-testu nebo Mannova- Whitneyho Rank Sum testu. 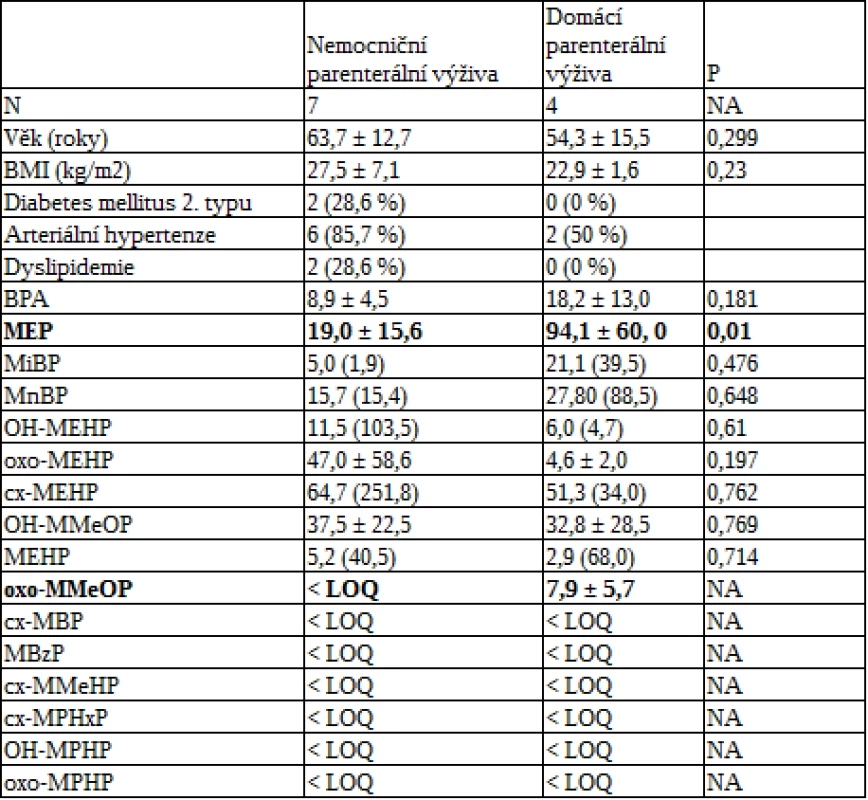
Pozn.: BMI = body mass index; BPA = bisfenol A; MEP = monoethylftalát; MiBP = monoizobutylftalát; MnBP = mono-n-butylftalát; OH-MEHP = mono(2-ethyl-5-hydroxyhexyl)ftalát; oxo-MEHP = mono(2-ethyl-5-oxohexyl)ftalát; cx-MEHP = mono(2-ethyl-5-karboxypentyl)ftalát; OH-MMeOP = mono(4-methyl-7-hydroxyoctyl)ftalát; MEHP = mono(2-ethylhexyl)ftalát; oxo-MMeOP – mono(4-methyl-7-oxooctyl)ftalát; cx-MBP = mono(3-karboxypropyl)ftalát; MBzP = monobenzylftalát; cxMMeHP = mono(4-methyl-7-karboxyheptyl)ftalát; cx-MPHxP = mono(2-propyl-6-karboxyhexyl)ftalát; OH-MPHP = mono(2-propyl-6-hydroxyheptyl)ftalát; oxo-MPHP = mono(2-propyl-6-oxo-heptyl)ftalát; < LOQ = pod detekčním limitem; NA = nehodnotitelné Závěr
I když epidemiologických důkazů o přímém spojení mezi endokrinními disruptory, jako jsou ftaláty či bisfenol A, a rozvojem metabolického syndromu, obezity a diabetes mellitus 2. typu v poslední době přibývá, vzhledem k jejich častému výskytu v okolním prostředí a komplexnosti jejich působení se jednoznačnou kauzální souvislost zatím prokázat nepodařilo. Statistický významný vztah byl u našich pacientů nalezen jen vzhledem k diabetu 2. typu.
Rozsáhlejší prospektivní studie v kontrolovaném prostředí by mohly pomoci rozřešit tuto otázku a případně nastínit nové přístupy v prevenci a léčbě trvající pandemie obezity a diabetu mellitu. Z našich výsledků vyplývá, že nejpravděpodobnějším zdrojem vysokých koncentrací ftalátů a bisfenolu A mohou být některé kosmetické přípravky. Za důležitý poznatek považujeme zjištění, že umělé hmoty používané v infuzních vacích a kanylách pro parenterální výživu jsou bezpečné a neobsahují sledované látky.
Seznam zkratek
BPA bisfenol A
BzBP benzylbutylftalát
cx-MBP mono(3-karboxypropyl)ftalát
cx-MEHP mono(2-ethyl-5-karboxypentyl)ftalát
cx-MMeHP mono(4-methyl-7-karboxyheptyl)ftalát
cx-MPHxP mono(2-propyl-6-karboxyhexyl)ftalát
DBP dibutylftalát
DEHP di(2-ethylhexyl)ftalát
DEP diethylftalát
MBzP monobenzylftalát
MEHP mono(2-ethylhexyl)ftalát
MEP monoethylftalát
MiBP monoizobutylftalát
MnBP mono-n-butylftalát
OH-MEHP mono(2-ethyl-5-hydroxyhexyl)ftalát
OH-MMeOP mono(4-methyl-7-hydroxyoctyl)ftalát
OH-MPHP mono(2-propyl-6-hydroxyheptyl)ftalát
oxo-MEHP mono(2-ethyl-5-oxohexyl)ftalát
oxo-MMeOP mono(4-methyl-7-oxooctyl)ftalát
oxo-MPHP mono(2-propyl-6-oxo-heptyl)ftalát
PPAR peroxisome proliferator-activated receptor
PVC polyvinylchlorid
Korespondenční adresa
MUDr. Miloš Mráz, Ph.D.
3. interní klinika – klinika endokrinologie a metabolismu 1. lékařské fakulty UK a Všeobecné fakultní nemocnice v Praze
U nemocnice 1
128 08 Praha 2
Tel.: 224 962 884
e-mail: milos.mraz@vfn.cz
Sources
1. O'Rahilly S. Science, medicine, and the future. Non-insulin dependent diabetes mellitus: the gathering storm. BMJ 1997; 314 : 955−959.
2. Reaven G, Abbasi F, McLaughlin T. Obesity, insulin resistance, and cardiovascular disease. Recent Prog Horm Res 2004; 59 : 207−223.
3. Reaven G. Metabolic syndrome: pathophysiology and implications for management of cardiovascular disease. Circulation 2002; 106 : 286−288.
4. Bluher M. Adipose tissue dysfunction in obesity. Exp Clin Endocrinol Diabetes 2009; 117 : 241−250.
5. Sweeney TE, Morton JM. The human gut microbiome: a review of the effect of obesity and surgically induced weight loss. JAMA Surg 2013; 148 : 563−569.
6. Biemann R, Navarrete Santos A, Navarrete Santos A et al. Endocrine disrupting chemicals affect the adipogenic differentiation of mesenchymal stem cells in distinct ontogenetic windows. Biochem Biophys Res Commun 2012; 417 : 747−752.
7. Chevalier N, Fenichel P. Endocrine disruptors: new players in the pathophysiology of type 2 diabetes? Diabetes Metab 2015;41 : 107−115.
8. De Coster S, van Larebeke N. Endocrine-disrupting chemicals: associated disorders and mechanisms of action. J Environ Public Health 2012; 2012 : 713696.
9. Diabetes Fact Sheet. WHO, 2013. http://www. who. int/mediacentre/factsheets/fs312/en
10. Danaei G, Finucane MM, Lu Y et al. National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants. Lancet 2011; 378 : 31−40.
11. Neel BA, Sargis RM. The paradox of progress: environmental disruption of metabolism and the diabetes epidemic. Diabetes 2011; 60 : 1838−1848.
12. Diamanti-Kandarakis E, Bourguignon JP, Giudice LC et al. Endocrine-disrupting chemicals: an Endocrine Society scientific statement. Endocr Rev 2009; 30 : 293−342.
13. Rousselle C, Ormsby JN, Schaefer B et al. Meeting report: international workshop on endocrine disruptors: exposure and potential impact on consumers health. Regul Toxicol Pharmacol 2013; 65 : 7−11.
14. Casals-Casas C, Feige JN, Desvergne B. Interference of pollutants with PPARs: endocrine disruption meets metabolism. Int J Obes (Lond) 2008; 32(suppl. 6): S53−S61.
15. Baillie-Hamilton PF. Chemical toxins: a hypothesis to explain the global obesity epidemic. J Altern Complement Med 2002; 8 : 185−192.
16. Chevalier N, Fenichel P. Bisphenol A: targeting metabolic tissues. Rev Endocr Metab Disord 2015; 16(4): 299−309.
17. Kuo CC, Moon K, Thayer KA, Navas-Acien A. Environmental chemicals and type 2 diabetes: an updated systematic review of the epidemiologic evidence. Curr Diab Rep 2013; 13 : 831−849.
18. Thayer KA, Heindel JJ, Bucher JR, Gallo MA. Role of environmental chemicals in diabetes and obesity: a National Toxicology Program workshop review. Environ Health Perspect 2012; 120 : 779−789.
19. Rahman M, Brazel CS. The plasticizer market: an assessment of traditional plasticizers and research trends to meet new challenges. Prog Polym Sci 2004; 29 : 1223−1248.
20. Serrano SE, Karr CJ, Seixas NS et al. Dietary phthalate exposure in pregnant women and the impact of consumer practices. Int J Environ Res Public Health 2014; 11 : 6193−6215.
21. Weschler CJ, Nazaroff WW. Semivolatile organic compounds in indoor environments. Atmospheric Environment 2008; 42 : 9018−9040.
22. Silva MJ, Barr DB, Reidy JA et al. Urinary levels of seven phthalate metabolites in the U. S. population from the National Health and Nutrition Examination Survey (NHANES) 1999-2000. Environ Health Perspect 2004; 112 : 331−338.
23. Silva MJ, Malek NA, Hodge CC et al. Improved quantitative detection of 11 urinary phthalate metabolites in humans using liquid chromatography-atmospheric pressure chemical ionization tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 2003; 789 : 393−404.
24. Silva MJ, Slakman AR, Reidy JA et al. Analysis of human urine for fifteen phthalate metabolites using automated solid-phase extraction. J Chromatogr B Analyt Technol Biomed Life Sci 2004; 805 : 161−167.
25. Silva MJ, Samandar E, Preau JL jr. et al. Quantification of 22 phthalate metabolites in human urine. J Chromatogr B Analyt Technol Biomed Life Sci 2007; 860 : 106−112.
26. Hauser R, Meeker JD, Park S et al. Temporal variability of urinary phthalate metabolite levels in men of reproductive age. Environ Health Perspect 2004; 112 : 1734−1740.
27. Wittassek M, Koch HM, Angerer J, Brüning T. Assessing exposure to phthalates – The human biomonitoring approach. Mol Nutr Food Res 2011; 55 : 7−31.
28. Stahlhut RW, van Wijngaarden E, Dye TD et al. Concentrations of urinary phthalate metabolites are associated with increased waist circumference and insulin resistance in adult U. S. males. Environ Health Perspect 2007; 115 : 876−882.
29. Hatch EE, Nelson JW, Qureshi MM et al. Association of urinary phthalate metabolite concentrations with body mass index and waist circumference: a cross-sectional study of NHANES data, 1999-2002. Environ Health 2008; 7 : 27.
30. James-Todd T, Stahlhut R, Meeker JD et al. Urinary phthalate metabolite concentrations and diabetes among women in the National Health and Nutrition Examination Survey (NHANES) 2001-2008. Environ Health Perspect 2012; 120 : 1307−1313.
31. Lind PM, Zethelius B, Lind L. Circulating levels of phthalate metabolites are associated with prevalent diabetes in the elderly. Diabetes Care 2012; 35 : 1519−1524.
32. Svensson K, Hernandez-Ramirez RU, Burguete-Garcia A et al. Phthalate exposure associated with self-reported diabetes among Mexican women. Environ Res 2011; 111 : 792−796.
33. Parlett LE, Calafat AM, Swan SH. Women's exposure to phthalates in relation to use of personal care products. J Expo Sci Environ Epidemiol 2013; 23 : 197−206.
34. Janesick A, Blumberg B. Minireview: PPARγ as the target of obesogens. J Steroid Biochem Mol Biol 2011; 127 : 4−8.
35. Kahn BB, McGraw TE. Rosiglitazone, PPARγ, and Type 2 Diabetes. N Engl J Med 2010; 363 : 2667−2669.
36. Rubin BS. Bisphenol A: an endocrine disruptor with widespread exposure and multiple effects. J Steroid Biochem Mol Biol 2011; 127 : 27−34.
37. Vandenberg LN, Maffini MV, Sonnenschein C et al. Bisphenol-A and the great divide: a review of controversies in the field of endocrine disruption. Endocr Rev 2009; 30 : 75−95.
38. Calafat AM, Ye X, Wong LY, Reidy JA, Needham LL. Exposure of the U. S. population to bisphenol A and 4-tertiary-octylphenol: 2003−2004. Environ Health Perspect 2008; 116 : 39−44.
39. Vandenberg LN, Hauser R, Marcus M et al. Human exposure to bisphenol A (BPA). Reprod Toxicol 2007; 24 : 139−177.
40. Alonso-Magdalena P, Morimoto S, Ripoll C et al. The estrogenic effect of bisphenol A disrupts pancreatic beta-cell function in vivo and induces insulin resistance. Environ Health Perspect 2006; 114 : 106−112.
41. Batista TM, Alonso-Magdalena P, Vieira E et al. Short-term treatment with bisphenol-A leads to metabolic abnormalities in adult male mice. PLoS One 2012; 7: e33814.
42. Kidani T, Kamei S, Miyawaki J et al. Bisphenol A downregulates Akt signaling and inhibits adiponectin production and secretion in 3T3-L1 adipocytes. J Atheroscler Thromb 2010; 17 : 834−843.
43. Masuno H, Iwanami J, Kidani T et al. Bisphenol A accelerates terminal differentiation of 3T3-L1 cells into adipocytes through the phosphatidylinositol 3-kinase pathway. Toxicol Sci 2005; 84 : 319−327.
44. Ning G, Bi Y, Wang T et al. Relationship of urinary bisphenol A concentration to risk for prevalent type 2 diabetes in Chinese adults: a cross-sectional analysis. Ann Intern Med 2011; 155 : 368−374.
45. Shankar A, Teppala S. Relationship between urinary bisphenol A levels and diabetes mellitus. J Clin Endocrinol Metab 2011; 96 : 3822−3826.
46. Silver MK, O'Neill MS, Sowers MR, Park SK. Urinary bisphenol A and type-2 diabetes in U. S. adults: data from NHANES 2003−2008. PLoS One 2011; 6: e26868.
47. Kim K, Park H. Association between urinary concentrations of bisphenol A and type 2 diabetes in Korean adults: a population-based cross-sectional study. Int J Hyg Environ Health 2013; 216 : 467−471.
48. Müllerová D, Matějková D, Kovářová K et al. Predictors of urinary phthalate metabolites in Czech healthy normal body weight adults. FANTOM study. Biomarkers – v recenzním řízení.
49. Piecha R, Svačina S, Malý M et al. Urine level of phthalate metabolites and bisphenol A in relation to main metabolic syndrome components: dyslipidaemia, hypertension and type 2 diabetes (pilot study). Centr Eur J Public Health – v recenzním řízení.
50. Lacinová Z, Svačina S, Haluzík M. The relationship of phthalates, their metabolites and bisphenol A with metabolic changes and subcutaneous adipose tissue mRNA expression of metabolic genes in patients with obesity. Zasláno do tisku.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Trendy v indikaci vybraných laboratorních metod všeobecnými praktickými lékaři
- Potenciální zdroje ftalátů a bisfenolu A a jejich význam u metabolických onemocnění
- K životnímu jubileu prof. MUDr. Jany Pařízkové, DrSc.
- Chirurgická léčba poranění nervů dolních končetin
- Ambulantní parenterální antibiotická terapie (OPAT)
- Fekální inkontinence – závažný medicínský a společenský problém
- Vezikoureterální reflux u dětí: stále mnoho nezodpovězených otázek
- Hyponatremie u dětí: od patofyziologie k léčbě
- Role inkretinů v energetickém metabolismu a změnách hmotnosti po zanechání kouření
- Biobanky − evropská infrastruktura
- Chirurgové a neurochirurgové jako laureáti Nobelovy ceny
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vezikoureterální reflux u dětí: stále mnoho nezodpovězených otázek
- Chirurgická léčba poranění nervů dolních končetin
- Hyponatremie u dětí: od patofyziologie k léčbě
- Fekální inkontinence – závažný medicínský a společenský problém
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

