-
Medical journals
- Career
Kardiovaskulární změnyu jaterní cirhózy
: Jana Šmalcová; Radan Brůha
: IV. interní klinika 1. LF UK a VFN, Praha
: Čas. Lék. čes. 2013; 152: 123-128
: Review Article
Jaterní cirhóza je spojena s řadou kardiovaskulárních abnormalit. Pro cirhotické pacienty je charakteristická hyperdynamická splanchnická i systémová cirkulace, která souvisí s arteriální vazodilatací vedoucí k centrální hypovolémii, retenci natria a navýšením intravaskulárního volumu. V souvislosti s těmito změnami jsou pozorovány patofyziologické změny v systolické a diastolické funkci srdce a v jeho elektrofyziologii popisované v literatuře jako tzv. cirhotická kardiomyopatie. Vzhledem k obtížnější včasné diagnostice mohou tyto změny nepoznaně vyústit v manifestní srdeční selhání. To může dále negativně ovlivňovat morbiditu a mortalitu již tak závažného stavu, jakým je jaterní cirhóza, proto zůstává zatím předmětem pokračujícího výzkumu..
Klíčová slova:
kardiomyopatie – hyperdynamická cirkulace – jaterní cirhóza – elektrofyziologické abnormality – srdeční selháníÚvod
Hyperdynamický syndrom byl popsán u pacientů s cirhózou již před více než 50 lety. Zahrnoval zvýšenou tepovou frekvenci, zvýšený srdeční výdej a zvýšený plazmatický objem s redukcí systémové vaskulární rezistence a krevního tlaku. Tyto abnormality byly zpočátku připisovány toxickému účinku alkoholu. Na podkladě mnoha klinických i experimentálních studií však bylo prokázáno, že kardiovaskulární abnormality se vyskytují u pacientů s jaterní cirhózou zcela nezávisle na její etiologii.
V současnosti jsou kardiovaskulární abnormality asociované s výskytem jaterní cirhózy a portální hypertenze nejrůznější etiologie známým klinickým syndromem ve světové literatuře označovaným jako cirhotická kardio-myopatie (KMP). Tato jednotka byla poprvé oficiálně definována na Světovém kongresu gastroenterologie v Montrealu v roce 2005. Na rozdíl od alkoholické kardiomyopatie, která je řazena mezi dilatační KMP s jednoznačnou souvislostí s abúzem alkoholu, se v případě „cirhotické KMP“ jedná o chronickou oběhovou dysfunkci zahrnující pokles systémové vaskulární rezistence, abnormální a zhoršenou reakci na zátěž (fyzikální nebo farmakologickou), ale normální až zvýšený srdeční výdej a kontraktilitu za klidových podmínek a/nebo diastolickou dysfunkci levé komory a elektrofyziologické abnormality, v nepřítomnosti jiného známého kardiálního onemocnění (1–5).
Diagnostická kritéria „cirhotické kardiomyopatie“ shrnuje tabulka 1. „Cirhotická kardiomyopatie“ bývá klinicky latentní, může se demaskovat až během fyzické nebo farmakologické zátěže, při dekompenzaci zdravotního stavu či v rámci výkonů, které představují pro organismus větší nároky na udržení homeostázy a rekonvalescenci (např. zavedení TIPS, transplantace jater). Až 50 % pacientů s jaterní cirhózou podstupujících transplantaci jater vykazuje známky kardiální dysfunkce, která nebyla před transplantací odhalena a až 7–21 % úmrtí po ortotopické transplantaci jater je na podkladě srdečního selhání (6).
1. Diagnostická a podpůrná kritéria cirhotické kardiomyopatie (převzato z 26) 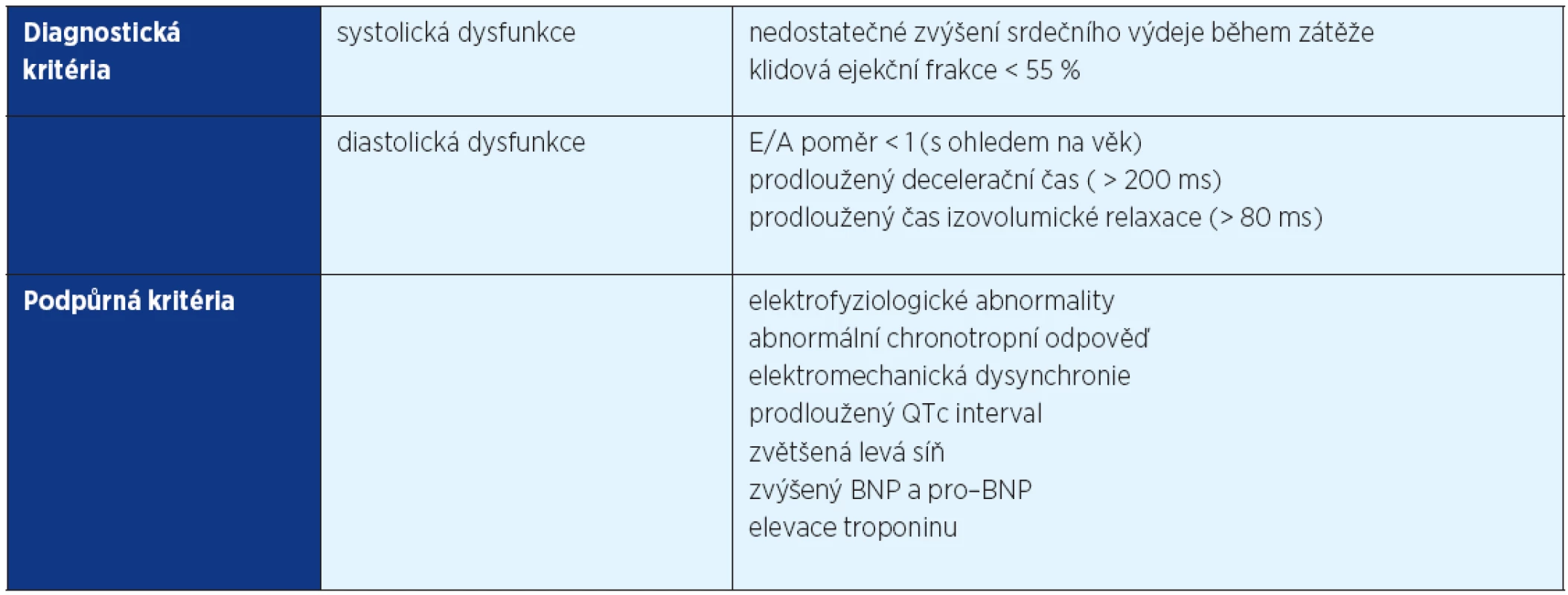
Epidemiologie
Epidemiologická data jsou prakticky nedostupná vzhledem k obtížné diagnostice, protože u většiny pacientů je klidová funkce myokardu normální. Většina pacientů je diagnostikována ve fázi klinické dekompenzace cirhózy, kdy jsou přítomny klinické známky kardiální insuficience. Kardiální dysfunkce je nepochybně dobře tolerovaná, měsíce až roky asymptomatická a v mnoha případech nemusí být symptomy snadno odlišitelné od symptomů základního onemocnění. Do jaké míry přispívá jaterní cirhóza ke kardiální dysfunkci, a tím ke zvýšení morbidity a mortality pacientů je stále otázkou.
Vztah mezi cirhotickou a alkoholickou kardiomyopatií
Kardiální dysfunkce u alkoholického onemocnění jater je připisována toxickému účinku alkoholu na myokard. Je dobře známo, že chronický abúzus alkoholu způsobuje dilataci srdečních oddílů až do obrazu dilatační kardiomyopatie. Alkohol poškozuje myokard sám o sobě a rovněž prostřednictvím svého metabolitu acetaldehydu. Jako nespecifické histologické známky etanolové kardiotoxicity jsou popisovány disperzní oblasti svalové degenerace, intersticiální fibróza a známky chronického zánětu (7). Podobné histologické změny byly popisovány u pacientů s jaterní cirhózou nezávisle na etiologii (8, 9). Je tedy otázkou, zda popisované změny jsou v souvislostí s alkoholickou nebo „cirhotickou kardiomyopatií“.
Patofyziologie
Mechanismus vedoucí k hyperdynamické cirkulaci není ještě zcela přesně objasněn. Iniciace hyperdynamické cirkulace je připisována splanchnické a i systémové arteriolární vazodilataci, která dále vyvolává zvýšení srdečního výdeje a tepové frekvence. Vazodilatace je způsobena pravděpodobně nadprodukcí vazodilatačních působků systémového i intestinálního původu, které při základním onemocnění jater obcházejí biodegradační procesy v játrech. Splanchnická arteriolární vazodilatace vede k redukci systémové vaskulární rezistence s aktivací vazokonstrikčních systémů, jako jsou sympatoadrenální systém, systém renin-angiotenzin - aldosteron, endoteliny, neuropeptid Y aj. vedoucí k rozvoji hyperkinetické cirkulace (3).
V souvislosti s rozvojem hemodynamických změn a „cirhotické kardiomyopatie“ u jaterní cirhózy je zkoumána celá řada dalších vazoaktivních substancí – např. glukagon, vazoaktivní intestinální peptid (VIP), tumor necrosis factor α (TNF-α), oxid dusnatý (NO), endotoxiny a další. Za nejvýznamnější z nich je považován NO. Podle hypotézy Vallance a Moncada (10) je periferní vazodilatace u jaterní cirhózy připisována hlavně uvolnění NO z endotelu produkujícího velké množství NO-syntázy za přispění cirkulujících cytokinů a endotoxinů, které se tak rovněž významně podílejí na rozvoji hyperkinetické cirkulace. Blokáda tvorby NO u zvířecích modelů a cirhotických pacientů významně zvýšila arteriální tlak a snížila plazmatický objem i retenci natria.
Srdeční výdej je regulován autonomním nervovým systémem a závisí na síle srdečního stahu, tepové frekvenci a regulaci diastolického plnění. Tyto fyziologické mechanismy jsou u pacientů s jaterní cirhózou v různé míře modifikovány – v důsledku zvýšení sympatické nervové aktivity se zvyšuje tepová frekvence a kontraktilita a dochází k expanzi cirkulujícího objemu. V pokročilejších fázích jaterního onemocnění progreduje pokles periferní vaskulární rezistence, a tím se snižuje efektivní vaskulární objem a krevní tlak, navíc dochází k úniku tekutin do třetího prostoru. Aktivací homeostatických mechanismů dochází k produkci neurohormonů působících jako vazokonstriktory a jako substance působící retenci tekutin a natria, jako jsou např. noradrenalin, angiotenzin, aldosteron, antidiuretický hormon aj. Ty přispívají na jedné straně k udržení oběhové stability, z druhé strany mají negativní vliv na složení tělesných tekutin a mohou nepříznivě ovlivňovat strukturu a funkci srdce. Retence sodíku je hlavním rysem jaterní cirhózy, exkrece natria je nižší oproti normě a vede k progresivní plazmatické expanzi. Podílí se na ní mimo jiné zvýšená aktivita sympatiku, který přímo stimuluje renální retenci natria a vody a nepřímo aktivuje systém renin–angiotenzin–aldosteron, který zvyšuje retenci natria a vody. S postupujícím jaterním onemocněním je porucha metabolismu sodíku stále zřetelnější, což přispívá i k progresi kardiální dysfunkce a ke stále zřetelnějším známkám retence tekutin.
Klinický obraz, funkční změny a strukturální změny srdce
Z klinického hlediska je fyzikální nález u pacientů s cirhotickou kardiomyopatií poměrně chudý, protože většina symptomů jaterní cirhózy a srdečního selhání splývá (otoky, nevýkonnost, ascites, fluidothorax, dušnost). Navíc snížení periferní vaskulární rezistence snižuje afterload (odpor, proti kterému je krev ze srdce vypuzována), a tím oddaluje manifestaci známek srdečního selhání. Vzhledem k principu tohoto „ochranného mechanismu“ je zřejmé, že podání terlipressinu ve fázi dekompenzace jaterní cirhózy může naopak vést k demaskování a manifestaci kardiální dysfunkce (11). Z hlediska diferenciální diagnostiky existuje mnoho kardiálních onemocnění vedoucích k lehké až středně významné kardiální dysfunkci, která může napodobovat cirhotickou kardiomyopatii. Pacienti s jaterním onemocněním mohou mít současně se vyskytující primární kardiální onemocnění jako např. ischemická choroba srdeční (ICHS), hypertrofická KMP. U jaterní cirhózy bylo popsáno mnoho aspektů kardiální dysfunkce, zahrnujících histologické a strukturální změny, systolickou a diastolickou dysfunkci, elektrofyziologické změny. Funkční a strukturální změny srdečních komor jsou více vyjádřeny v levé komoře (LK) než v pravé komoře (PK). Většina studií popisuje dilataci levé síně (LS), hypertrofii a dilataci LK. Pravostranné srdeční oddíly mají obvykle normální velikost.
Je omezená reakce na zátěž, echokardiograficky lze pozorovat zhoršenou systolickou i diastolickou funkci. Tepový objem a srdeční index jsou v klidu typicky lehce zvýšené nebo normální, při zátěži dochází k jejich snížení. Prevalence a rozsah systolické dysfunkce je u cirhotických pacientů variabilní (tab. 2). Diastolická dysfunkce se manifestuje jako tuhá a noncompliantní komora a je často přítomna u pacientů s různým stupněm dilatace nebo hypertrofie LK. Nicméně zjevné strukturální změny nejsou pro diastolickou dysfunkci nezbytné. Zhoršení pasivního i aktivního plnění LK v časné a středně pozdní diastole vede k neschopnosti adekvátně zvýšit tepový objemu v průběhu odpovědi na zátěž. Ruz-del-Arbor et al. (12) ve své studii poukazuje na to, že nižší hodnoty středního tlaku a srdeční výdej napomáhají k poklesu renální perfuze a jsou nezávislým prediktorem rozvoje hepatorenálního selhání. Rozvoj hepatorenálního selhání dále zhoršuje srdeční výdej pravděpodobně v důsledku redukce preloadu a zhoršení chronotropní odpovědi na zvýšenou aktivitu sympatiku. Klinické důsledky cirhotické kardiomyopatie jsou více patrné po různých intervencích (transplantaci jater, transjugulární intrahepatální portosystémové spojce (TIPS)) nebo v případě dekompenzace jaterní cirhózy (spontánní bakteriální peritonitida, ascites). U takových pacientů je v těchto a podobných situacích nutné myslet na možnou manifestaci kardiální dysfunkce (5).
2. Srovnání hodnot ejekční frakce LK (%) u pacientů za klidových podmínek a rozdíl změny oproti hodnotám EF LK při zátěžové ventrikulografii (volně podle 19) 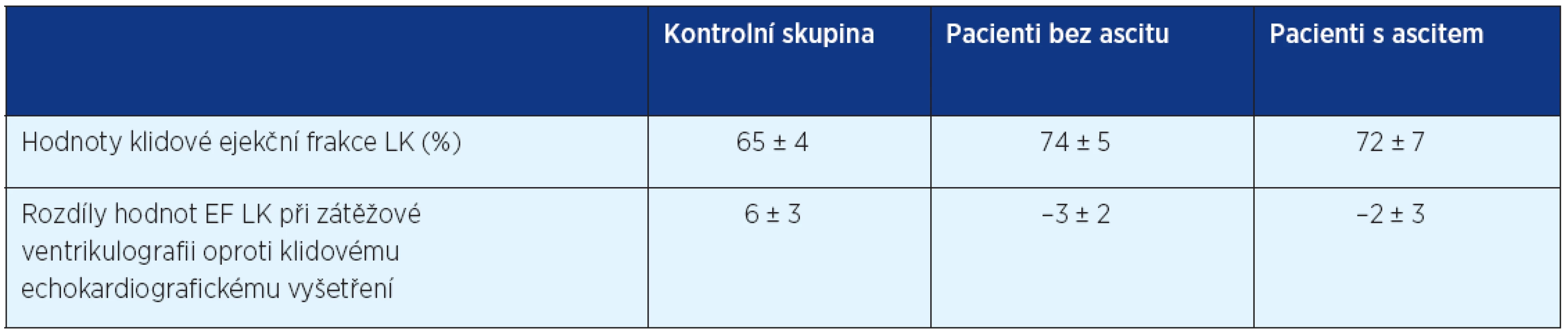
Systolická dysfunkce
Systolická funkce úzce souvisí s velikostí tepového objemu, srdeční frekvence a srdečního výdeje. Klidová ejekční frakce levé komory je popisována jako normální, avšak v důsledku působení zátěže dochází ke zhoršení funkce LK a neadekvátnímu navýšení kontraktility myokardu. Ačkoliv dříve byla systolická dysfunkce připisována efektu alkoholu na myokard, na základě dalších výzkumů (13), včetně animálních modelů (14) bylo zjištěno, že je možné ji pozorovat i u pacientů s jaterní cirhózou nealkoholické etiologie. Farmakologická nebo fyzická zátěž může u pacientů s jaterní cirhózou demaskovat latentní komorovou dysfunkci, o čemž svědčí zvýšení end diastolického objemu LK a snížení ejekční frakce LK (15). Zátěž u pacientů s jaterní cirhózou zvyšuje srdeční tlaky (16) a způsobuje relativně menší vzestup ejekční frakce LK a tepové frekvence než u zdravých jedinců. I přes zvýšený tonus sympatiku pozorujeme snížený srdeční výkon, který je pravděpodobně způsoben kombinací omezeného zvýšení tepové frekvence na zátěž, snížením kontraktility myokardu a zhoršenou svalovou výkonností. Snížená systolická funkce je přímo úměrná postupujícímu jaternímu selhání (17) a může mít dopad na rozvoj komplikací, jako jsou retence sodíku a vody s následnou tvorbou ascitu, rozvoj renální dysfunkce a celkové zhoršení prognózy (3).
Diastolická dysfunkce
Diastolická dysfunkce u jaterní cirhózy byla poprvé popsána v roce 1997. Ačkoliv některé diastolické změny mohou předcházet systolické poruše, obvykle se obě formy dysfunkce (systolická i diastolická) vyvíjejí současně. Při echokardiografickém vyšetření můžeme pozorovat v rámci diastolického plnění dvě fáze: časnou diastolickou (aktivní) relaxaci a pozdní diastolické (pasivní) plnění (obr. 1). Časná fáze (vlna E) závisí na rychlosti komorové relaxace, elasticitě stěny LK a LS a atrioventrikulárním tlakovém gradientu. Pozdní fáze (vlna A) závisí na síle kontrakce LS a poddajnosti stěny LK. Abnormální diastolická funkce LK je způsobena snížením compliance a relaxace LK. Mění se transmitrální průtok se zvýšením síňového příspěvku ke komorovému plnění. Patofyziologickým podkladem diastolické dysfunkce je zvýšená tuhost myokardiální stěny, pravděpodobně na podkladě kombinace lehké myokardiální hypertrofie, fibrózy a subendoteliálního edému. Na podkladě experimentálních i klinických důkazů se předpokládá, že je zvýšeno množství sodíku v séru. To může vést k rozvoji myokardiální hypertrofie (18). Retence sodíku sama o sobě tak může přispívat ke vzniku diastolické dysfunkce u pa-cientů s cirhózou. Ostatní echokardiografické parametry diastolické dysfunkce zahrnují prodloužení izovolumického relaxačního času a zvýšení deceleračního času, který vyjadřuje zvýšený odpor vtoku do komory. Toregrosa et al. (19) pomocí echokardiografického vyšetření zjistili, že u cirhotiků s tenzním ascitem je významně zvýšená rychlost vlny A, poměr E/A je významně snížen a decelerační čas je signifikantně prodloužen. Odstranění ascitické tekutiny vede k redukci rychlosti vlny A a ke zvýšení poměru E/A k hodnotám podobným ostatních cirhotiků bez ascitu, ale stále abnormálním hodnotám oproti zdravým pacientům. Klinicky mají pacienti se silnější stěnou LK a těžší diastolickou dysfunkcí větší pravděpodobnost srdečního selhání po transplantaci jater. Po transplantaci jater se diastolická dysfunkce navrací k normě během 6–12 měsíců (19).
1. a – echokardiografické zobrazení poruchy diastolického plnění I. stupně (porucha relaxace) a prodloužení izovolumického relaxačního tlaku; b – normální obraz diastolického plnění a IVRT (z archivu autora) 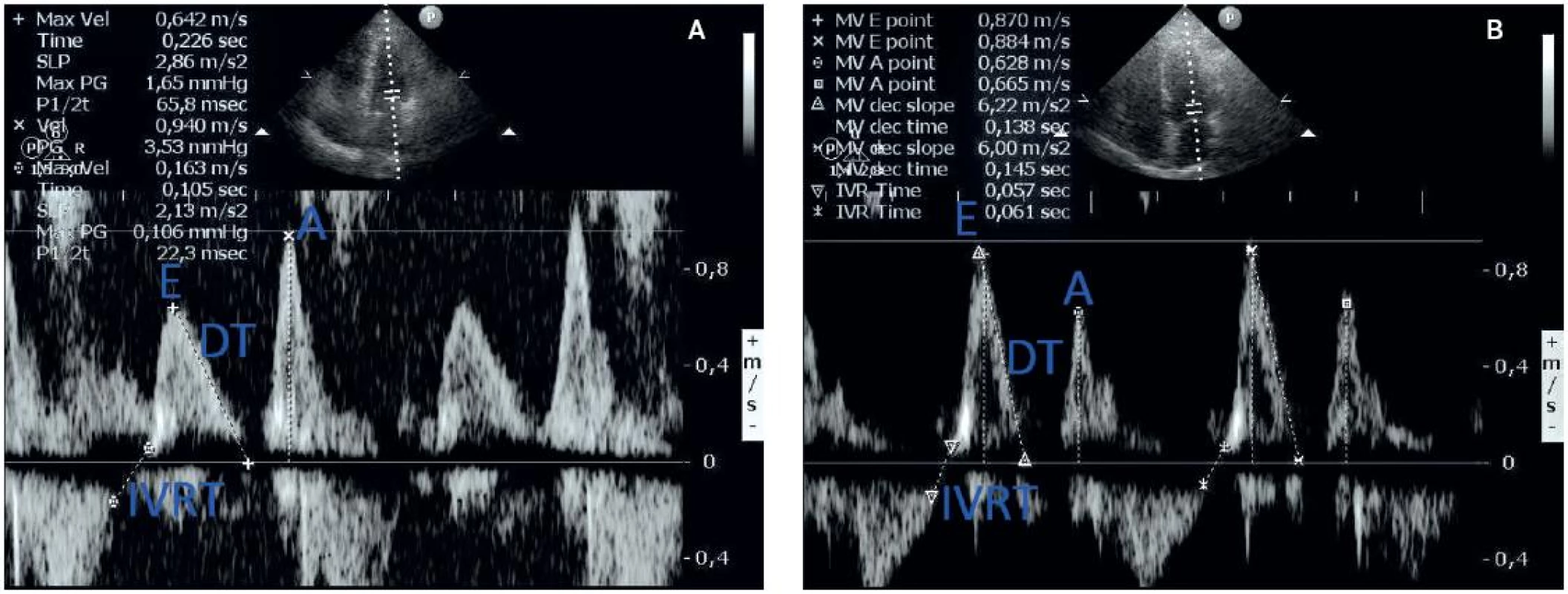
Pacienti s diastolickou dysfunkcí jsou částečně vnímaví ke změnám objemu, které se objevují např. ve vztahu k zavedení TIPS. Portální dekomprese po zavedení TIPS může vést k dalšímu zvětšení rozměru LS a zvýšení tlaku v zaklínění, což značí, že cirhotické srdce je neschopné přijmout adekvátně zvýšený preload. Změny v diastolické dysfunkci se objevují výrazněji u pacientů s těžkou dekompenzací a u těchto pacientů nacházíme kombinaci hypertrofie myokardu, kontraktilní dysfunkce, změny v srdečních objemech a diastolickou dysfunkci. Vzestup v diastolických objemech po TIPS se normalizuje po měsících, ale s perzistencí lehké hypertrofie LK. Navíc snížená diastolická funkce se zdá být asociována s pomalejší mobilizací ascitu (20).
Elektrofyziologické abnormality
Mezi elektrofyziologické abnormality u cirhotické kardio-myopatie patří chronotropní inkompetence, prodloužený QTc interval na EKG a dysynchronie mezi elektrickou a mechanickou systolou.
Chronotropní inkompetence je selhání srdečního rytmu v odpovědi na fyziologické a farmakologické stimuly. Sympatická aktivace různým způsobem např. Valsalvovým manévrem, stimulací psychickou zátěží, izometrickým, izotonickým fyzickým cvičením nebo hemoragií nevede k dostatečné akceleraci srdeční frekvence navzdory zvýšení plazmatických koncentrací noradrenalinu. Toto lze pozorovat u alkoholické i nealkoholické cirhózy a manifestace je přímo úměrná tíži jaterního onemocnění (1, 7, 9).
U pacientů s jaterní cirhózou můžeme pozorovat elektrofyziologické abnormality v srdeční excitaci. Snížení proudění K+ v myocytech srdečních komor způsobuje zpoždění komorové repolarizace, které prodlužuje QTc interval. Bernardi et al. (21) hodnotili funkci srdce u cirhotiků v klidu a po izometrickém cvičení a popsali prodloužení preejekční periody v klidu společně s patologickým zkrácením po cvičení. Dle autorů se jedná o manifestaci elektromechanické dysynchronie, která je zodpovědná za kontraktilní dysfunkci u pacientů s jaterní cirhózou. Dle Henriksena et al. (20) je tento časový rozdíl mezi elektrickou a mechanickou systolou výrazně prodloužen u pacientů s prodlouženým QTc intervalem oproti pacientům s normálním QTc. Aortální tlaková křivka hodnocená katetrizačně ukazuje, že trvání mechanické systoly u pacientů s prodlouženým QTc není změněné, ale její vztah s trváním elektrické systoly je abnormální, potvrzující dysynchronii mezi elektrickou a mechanickou systolou u těchto pacientů (22). Prodloužení QTc intervalu (> 440ms) (obr. 2) se u cirhotiků objevuje často, nezávisle na etiologii cirhózy. Jeho prevalence je asi 45%, což je výrazně více něž je 5% prevalence v běžné populaci. Míra prodloužení QTc intervalu je přímo úměrná tíži jaterního onemocnění. Ve vztahu k Child-Pugh klasifikaci jde o prodloužení asi o 25 % ve třídě A, do 51 % ve třídě B a nad 60 % ve třídě C (1). Prodloužený QTc interval je substrátem komorových arytmií a možnou příčinou náhlé srdeční smrti. Nicméně výskyt život ohrožujících arytmií je u cirhotiků relativně vzácný. Dle recentních studií prodloužení QTc intervalu koreluje s hladinou BNP – senzitivním markerem kardiální dysfunkce. Byly pozorovány zvýšené hodnoty BNP u pacientů s ascitem i bez ascitu a výše těchto hodnot korelovala s tíží jaterního a stejně tak srdečního onemocnění (23). V cirhóze je délka QTc intervalu spojena s indikátory autonomní dysfunkce a po transplantaci je částečně reverzibilní. Přesný mechanismus vzniku těchto elektrofyziologických změn je nejasný. Studie u cirhotických zvířecích modelů ukazují na funkční změny některých iontových kanálů v plazmatické membráně kardiomyocytů, zvláště draslíkových (24).
2. Výpočet QTc intervalu – Bazettova formule 
Transplantace jater a cirhotická kardiomyopatie
Po jaterní transplantaci je redukována koncentrace cirkulujících kardiotoxických a vazoaktivních substancí, a může proto docházet k redukci cirkulačních změn zahrnujících hyperdynamickou cirkulaci. Samotný chirurgický zákrok je pro srdce v mnoha směrech náročný. Rizikové faktory přestavují např. krvácení, únik tekutin do třetího prostoru nebo peroperační svorkování velkých cév s poklesem venózního návratu. Náhlá redukce preloadu vede k poklesu srdečního výdeje. Acidóza, hypotermie a porucha elektrolytů (hypokalémie, hypokalcémie) mohou dále zhoršit kontraktilitu myokardu. Reperfuze jaterního štěpu může být dále spojena s hypotenzí a bradykardií – tzv. reperfuzním syndromem, během kterého dochází k uvolňování kardiodepresivních cytokinů, např. TNF-α. V pooperačním období dochází k poklesu srdečního výdeje, tepové frekvence a tlaku v plicnici a ke značnému vzestupu krevního tlaku a systémové vaskulární rezistence. Zvýšený afterload může u LK demaskovat předchozí latentní dysfunkci a u pacientů byly zaznamenávány zjevné známky levostranného srdečního selhávání během prvního týdne po transplantaci. Celkem je srdečnímu selhání připisováno 7–21 % úmrtí spojených s transplantací jater (6), což z něj dělá 3. nejčastější příčinu úmrtí po rejekci štěpu a infekcích. Na základě proběhlých studií bylo po transplantaci pozorováno během 6–12 měsíců významné zlepšení srdečních funkčních parametrů. V podstatě všechny kardiální abnormality detekované před transplantací se mohou postupně navrátit k normě – mizí stav hyperdynamické cirkulace, normalizuje se bazální systolická funkce LK, regreduje tloušťka stěny LK, zlepší se diastolická i systolická dysfunkce v klidu i během zátěže. Byla zaznamenána normalizace prodlouženého QTc intervalu asi u 1/2 pacientů (19). Před transplantací má více než 80 % pacientů v terminálním stadiu jaterního onemocnění autonomní dysfunkci, která se zlepší asi u 2/3 pacientů po transplantaci (25). Některé studie se pokoušely identifikovat pacienty, u nichž je vysoké riziko rozvoje kardiálních komplikací, nicméně spolehlivý diagnostický test nebyl doposud stanoven (26). Nabízí se možnost dobutaminového zátěžového vyšetření, avšak jeho použití k predikci postoperační komorové dysfunkce není dostatečně senzitivní ani specifické, už jen pro sníženou citlivost receptorů vůči inotropikům u pacientů s jaterní cirhózou (27). Další možnosti by mohly představovat metody nukleární medicíny, případně stanovení vhodných biochemických markerů. Nalezení vhodné metody k odhalení rizikových pacientů zůstává ale zatím stále předmětem dalších výzkumů.
Terapie
Klinický obraz „cirhotické kardiomyopatie“ a její následné dekompenzace prakticky splývá s obrazem srdečního selhání jakékoliv jiné etiologie, neexistuje tudíž žádná specifická léčba. Pokud se srdeční selhání zjevně manifestuje, je na místě léčba jako u srdečního selhání bez závislosti na etiologii stavu, tzn. klidový režim, diuretika, oxygenoterapie, snížení preloadu, eventuálně inotropní podpora, jejíž efekt je ale vzhledem k již zmíněným skutečnostem sporný (1, 27). Pacienti s manifestací srdečního selhání na podkladě „cirhotické kardiomyopatie“ profitují i z terapie podávané v rámci jaterního onemocnění. Kličková diuretika přispívají k poklesu renální reabsorbce natria a vody, snižují celkový plazmatický objem, spironolakton je považován za inhibitor osy renin – angiotenzin a má i pozitivní vliv na remodelaci levé komory a zlepšení diastolické dysfunkce LK. Použití beta-blokátorů u pacientů s portální hypertenzí a jícnovými varixy má pravděpodobně příznivý účinek na denzitu β-adrenergních receptorů, která je u pacientů s jaterní cirhózou snížena, mohou redukovat hemodynamické zatížení a částečně mohou ovlivňovat délku QTc intervalu. Použití nitrátů je velmi často limitováno nízkým krevním tlakem (střední arteriální tlak kolem 60 mm Hg není neobvyklý), který bývá u pacientů s jaterní cirhózou běžný. Navíc u pacientů s jaterní cirhózou mají nitráty často jen malý efekt v důsledku vysoké endogenní NO aktivity a následně desenzitizace.
Prognóza
Jaterní cirhóza představuje pro pacienty závažné onemocnění s celkově nepříznivou prognózou, pokud není provedena úspěšná jaterní transplantace. S cirhózou je úzce spjato riziko rozvoje hepatocelulárního karcinomu, krvácení nebo infekce, což dále přispívá ke zhoršení morbidity a mortality těchto pacientů. Kardiální dysfunkce, která z již zmiňovaných důvodů nebývá vždy diagnostikována, vede rovněž ke zvýšenému riziku úmrtí, zvláště v případech akutní dekompenzace jaterní cirhózy. Zhoršením srdečního výdeje může docházet k horší perfuzi ledvin přispívající k rozvoji hepatorenálního selhání (12). Následně dochází k dalšímu zvýšení aktivity sympatiku s pokusem o zvýšení srdeční kontraktility, retenci natria a vody aktivací systému renin--angiotenzin-aldosteron (1). V případě rychlých hemodynamických změn např. po zavedení TIPS nebo transplantaci jater, mohou zvýšené plnicí tlaky přispět k rozvoji městnavého srdečního selhání. Po jaterní transplantaci se objevují kardiovaskulární komplikace cca ve 25 % (28).
Závěr
„Cirhotická kardiomyopatie“ má u pacientů s jaterní cirhózou většinou subklinický průběh, a zůstává tak podhodnocena. Její význam nelze podceňovat převážně u pacientů před plánovanými zákroky, jako jsou např. TIPS nebo transplantace jater. Přesný dopad na morbiditu a mortalitu těchto pacientů zůstává i nadále předmětem dalšího výzkumu.
Zkratky
BNP senzitivní marker kardiální dysfunkce (brain natriuretic peptide) EF ejekční frakce EKG elektrokardiogram ICHS ischemická choroba srdeční IVRT izovolumické relaxační čas KMP kardiomyopatie LK levá komora LS levá síň NO oxid dusnatý (nitric oxide) PK pravá komora TIPS transjugulární intrahepatální portosystémová spojka TNF-α tumor necrosis factor α VIP vazoaktivní intestinální peptid (vasoactive intestinal peptide) Práce byla podpořena grantem IGA MZ ČR NT-12290/4.
ADRESA PRO KORESPONDENCI:
MUDr. Jana Šmalcová
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: jana.smalcova@gmail.com
Sources
1. Wong F. Cirrhotic cardiomyopathy. Hepatology International 2009; 3(1): 294–304.
2. Lee SS. Cardiac abnormalities in liver cirrhosis. The western journal of medicine. 1989; 151 : 530–535.
3. Møller S, Henriksen JH. Cardiovascular complications of cirrhosis. Gut 2008; 57(2): 268–278.
4. Henriksen JH, Møller S. Cardiac and systemic haemodynamic complications of liver cirrhosis. Scandinavian Cardiovascular Journal 2009; 43(4): 218–225.
5. Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ. A perspective on cirrhotic cardiomyopathy. Transplantation Proceedings 2011; 43(5): 1649–1653.
6. Myers RP, Lee SS. Cirrhotic cardiomyopathy and liver transplantation. Liver transplantation 2000; 6(Suppl S1): S44–S52.
7. Baik SK, Lee SS. Cirrhotic cardiomyopathy: causes and consequences. Journal of Gastroenterology and Hepatology 2004; 19 : 185–190.
8. Piano MR, Schwertz DW. Alcoholic heart disease: a review. Heart Lung. 1994; 23 : 3–17.
9. Ma Z, Lee SS. Cirrhotic cardiomyopathy: Getting to the heart of the matter. Hepatology 1996; 24(2): 451–459.
10. Vallance P, Moncada S. Hyperdynamic circulation in cirrhosis: a role for nitric oxide? Lancet 1991; 337(8744): 776–778.
11. Møller S. Cirrhotic cardiomyopathy: a pathophysiological review of circulatory dysfunction in liver disease. Heart 2002; 87(1): 9–15.
12. Ruiz-del-Arbol L, Monescillo A, Arocena C, Valer P, Ginès P,Moreira V, Milicua JM, Jiménez W, Arroyo V. Circulatory function and hepatorenal syndrome in cirrhosis. Hepatology 2005; 42(2): 439–447.
13. Gould L, Shariff M, Zahir M, Di Lieto M. Cardiac hemodynamics in alcoholic patients with chronic liver disease and a presystolic gallop. The journal of clinical investigation 1969; 48 : 860–868.
14. Inglés AC, Hernández I, García-Estaň J, Quesada T, Carbonell LF. Limited cardiac preload reserve in conscious cirrhotic rats. American journal of physiology 1991; 260, H1912–1917.
15. Krag A, Bendtsen F, Henriksen JH, Møller S. Cardiac effects of terlipressin in cirrhosis. Unmasking a cirrhotic cardiomyopathy. Journal of Hepatology 2007; 46(Suppl S): 96.
16. Møller S, Henriksen JH. Cardiovascular dysfunction in cirrhosis: pathophysiological evidence of a cirrhotic cardiomyopathy. Scandinavian Journal of Gastroenterology 2001; 36(8): 785–794.
17. Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, van Tassel BW, Afeltra A, Sanyal AJ. Cirrhotic cardiomyopathy. Journal of the American College of Cardiology 2010; 56(7): 539–549.
18. Fields NG., Baoxue Y, Leenen FHH. Sodium-induced cardiac hypertrophy. Cardiac sympathetic activity versus volume load. Circulation research 1991; 68 : 745–755.
19. Torregrosa MS, Aguadé L, Segura R, Gónzalez A, Evangelista A, Castell J, Margarit C, Esteban R, Guardia J, Genescà J. Cardiac alterations in cirrhosis: reversibility after liver transplantation. Journal of Hepatology 2005; 42 : 68–74.
20. Rabie RN, Cazzaniga M, Salerno F, Wong F. The use of E/A ratio as a predictor of outcome in cirrhotic patients treated with trans-jugular intrahepatic portosystemic shunt. The American Journal of Gastroenterology 2009; 104(10): 2458–2466.
21. Hongqun L, Lee SS. Cardiopulmonary dysfunction in cirrhosis. Journal of Gastroenterology and Hepatology 1999; 14 : 600–608.
22. Henriksen JH, Fuglsang S, Bendtsen F, Christensen E. Dyssynchronous electrical and mechanical systole in patients with cirrhosis. Journal of Hepatology 2002; 36(4): 513–520.
23. Henriksen JH, Gotze JP, Christensen E, Bendtsen F, Møller S. Increased circulating pro-brain natriuretic peptide in patients with cirrhosis. Gut 2003; 52 : 1511–1517.
24. Ward CA, Ma Z, Lee SS, Giles WR. Potassium currents in atrial and ventricular myocytes from a rat model of cirrhosis. American journal of physiology: Gastrointestinal and Liver Physiology 1997; 273(2): G537–G544.
25. Rosmawati M, Forsey PR, Davies MK. Effect of liver transplantation on QT interval prolongation and autonomic dysfunction in end-stage liver disease. Hepatology 1997; 23(5): 1128–1134.
26. Møller S, Henriksen JH. Cirrhotic cardiomyopathy. Journal of Hepa-tology 2010; 53(1): 179–190.
27. Mikulic E, Munoz C, Puntoni LE, Lebrec D. Hemodynamic effects of dobutamine in patients with alcoholic cirrhosis. Clinical Pharmacology & Therapeutics 1983; 34(1): 56–59.
28. Ripoll C, Catalina MV, Yotti R, Olmedilla L, Pérez-Peña J, Lo Iacono O,Rincón D, García-Fernández MA, Bermejo J, Bañares R. Cardiac dysfunction during liver transplantation: Incidence and Preoperative Predictors. Transplantation 2008; 85(12): 1766–1772.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Cardiovascular abnormalities in liver cirrhosis
- Sobering-up stations in the Czech Republic in the context of analogous models of care for acute intoxications in Europe
- Experience with personalised medicine with respect to disability assessment in patients suffering from mental and behavioural disorders
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cardiovascular abnormalities in liver cirrhosis
- Sobering-up stations in the Czech Republic in the context of analogous models of care for acute intoxications in Europe
- Experience with personalised medicine with respect to disability assessment in patients suffering from mental and behavioural disorders
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

