-
Medical journals
- Career
Strategické prvenství slizničního imunitního systému v obraně a toleranci
: Jiří Městecký 1,2,3,4; Milan Raška 1,5
: University of Alabama at Birmingham, Department of Microbiology 1; University of Alabama at Birmingham, Department of Medicine 2; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav imunologie a mikrobiologie 3; Akademie věd České republiky Praha, Mikrobiologický ústav 4; Univerzita Palackého v Olomouci, Lékařská fakulta, Ústav imunologie 5
: Čas. Lék. čes. 2011; 150: 480-488
: Review Article
Slizniční imunitní systém je funkčně charakterizován svou schopností bránit vstupu okolních antigenů zejména z potravy, ovzduší a komenzální mikrobioty do vnitřního prostředí makroorganismu, a omezit tak rozsah systémové imunitní odpovědi. Slizniční systém reaguje v místě kontaktu s antigenem i v slizničních lokalitách anatomicky značně vzdálených, a to tvorbou specifických protilátek a aktivací specifické buněčné imunity. Jestliže je imunitní systém exponován neoantigenům, dochází k navození tvorby specifických slizničních a systémových protilátek a současné anergizaci specifických systémových efektorových T-lymfocytů a indukci různých populací regulačních T-lymfocytů. Pozorovaný fenomén, označovaný jako slizniční tolerance, byl základem mnoha studií usilujících o navození systémové anergie na antigeny spojované zejména s vybranými autoimunitními chorobami. Tyto pokusy však nevedly k očekávanému terapeutickému efektu. Snahou tohoto přehledového článku je proto vysvětlení mechanismů zapojených do indukce imunitní odpovědi a tolerance po imunizaci přes slizniční povrchy – orální nebo intranazální cesta – a objasnění okolností, které jsou považovány za klíčové při indukci slizniční imunitní odpovědi a tolerance.
Klíčová slova:
slizniční imunitní systém, komenzální mikrobiota, slizniční tolerance, orální tolerance, sekreční IgA, epitelové buňky.Úvod
Stálý evoluční tlak antigenů vnějšího prostředí v každodenním životě organismu vedl ke stabilizaci strategického rozmístění buněk účastnících se vrozené a specifické imunitní obrany do sliznic. Jeden z hlavních funkčních znaků slizničního imunitního systému spočívá v jeho schopnosti zamezit vstupu antigenů vnějšího prostředí, jako jsou složky potravy nebo ovzduší, jakož i antigenů komenzální mikrobioty do vnitřního prostředí makroorganismu, a tím omezit rozsah systémové imunitní odpovědi vůči nim. S přihlédnutím k obrovskému množství a variabilitě zevních antigenů, které se v naprosté většině vyskytují v gastrointestinálním traktu (GIT), je schopnost účelně řídit jejich vstup do organismu z existenčního pohledu zcela zřejmá.
Schopnost slizničního imunitního systému reagovat prostřednictvím specifických protilátek a specifické buněčné imunity v oblasti kontaktu s antigenem a na sliznicích anatomicky přilehlých, ale i značně vzdálených, je velmi dobře dokumentována (1). Navozené specificky reagující protilátky zajišťují ochranu proti slizničním infekcím nebo omezují vstup antigenů přes slizniční povrchy. Využití principů slizniční imunitní odpovědi bylo základem studií efektu aplikace experimentálních vakcín do různých slizničních lokalit. Přes jejich fyziologickou i farmakologickou přitažlivost bylo doposud zaznamenáno jen několik pokusů o koordinovaný vývoj slizničně aplikovaných vakcín. Tyto vakcíny mají přitom mnoho předností:
- stimulují specifickou imunitní odpověď na sliznicích, kudy vstupuje většina infekčních agens;
- jejich aplikace je snadná, bez potřeby sterilního materiálu jako stříkaček a jehel, a sterilní manipulace;
- jsou vhodné pro rychlou hromadnou imunizaci.
Slizniční vakcinace je na druhou stranu spojena s překážkami vyplývajícími ze základních principů indukce slizniční imunitní odpovědi. Vzhledem k relativně malé míře vstřebávání antigenů ze slizničních povrchů, jejich výrazné degradaci proteolytickými enzymy a nevyhnutelné kompetici s kvantitativně převládající endogenní mikrobiotou je pro dosažení dostatečně silné imunitní odpovědi nutné aplikovat relativně vysoké dávky antigenu. Kromě toho aplikace vakcinačních antigenů slizniční cestou může vést k potlačení systémové imunitní odpovědi T-lymfocytů. Tento fenomén se označuje jako slizniční tolerance. Je důležité poznamenat, že slizniční toleranci můžeme navodit pouze za určitých okolností a nejedná se tedy o univerzální formu odpovědi imunitního systému na slizniční vakcínu (2). Tento přehledový článek je zaměřen na objasnění podstaty současného navození imunitní odpovědi a slizniční tolerance a objasnění okolností, za kterých je možné je indukovat, čímž se snaží odpovědět na často diskutovanou otázku: Může dlouhodobá opakovaná aplikace antigenu na určité slizniční lokality potlačit systémovou imunitní odpověď na tento antigen a je tato slizniční tolerance překážkou při vývoji a využití slizničně aplikovaných, zejména orálních vakcín a lze využít principu slizniční tolerance k léčbě některých autoimunitních onemocnění?
Komenzální mikrobiota – stálý host a pomocník vyžadující trvalý dozor
Rozsáhlé slizniční povrchy (přibližně 400 m2 u dospělého člověka) jsou osídleny obrovským množstvím nepatogenních a příležitostně i patogenních mikroorganismů, zejména bakterií. Odhaduje se, že celkový počet bakterií na slizničních površích dutiny ústní, spojivek, pohlavního, gastrointestinálního a respiračního traktu dosahuje 1014 (obr. 1). Z toho 99,9 % se vyskytuje v tlustém střevě (3). Bakterie mohou být přítomny jednak volně, ve stolici, ale zejména fixované v hlenové vrstvě na povrchu sliznice, v Lieberkhünových kryptách nebo na deskvamovaných epitelových buňkách ve formě biofilmu. Biofilm představuje v současnosti velmi diskutovanou formu výskytu bakterií na slizničních, ale i jiných površích. Bakteriální biofilm v tlustém střevě je tvořen komunitami bakterií stejného druhu spojenými sekrečním IgA imunoglobulinem (S-IgA) a jinými slizničními glykoproteiny. S-IgA nejenže spojuje bakterie navzájem, ale umožňuje rovněž stabilizovat bakterie na epitelovém povrchu (4–5). Současně s olupováním buněk epitelu dochází k obnovování biofilmu. Biofilm poskytuje výhodu jak pro hostitele, tak pro bakterie. Bakteriím poskytuje mimo výše uvedené fixace v dané lokalitě střeva také ochranu před okolními faktory. Agregace bakterií do biofilmu naopak poskytuje hostiteli ochranu proti bakteriální invazi přes epitelovou vrstvu, aniž by byla omezena jejich metabolická aktivita významná pro hostitele.
1. Kvantitativní aspekty interakce antigenů vnějšího okolí se slizničním systémem 
Přestože provedení odběru biologických vzorků, možnosti kultivace bakterií z nich a individuální variabilita dobrovolníků (hormonální stav, dieta, historie použití antibiotik atd.) tvoří významné překážky pro detailní analýzu a vytvoření reprezentativních závěrů, metagenomické analýzy 16S ribozomální DNA vedly k závěru, že slizniční povrchy střeva jsou osídleny 15 000 až 36 000 bakteriálních druhů klasifikovatelných do 1800 rodů (6–8). Na sliznicích byly prokázány Gram-negativní, Gram-pozitivní, sporulující, nesporulující, aerobní i striktně anaerobní bakterie, přičemž zastoupení jednotlivých skupin je typické pro různé slizniční lokality. Pro ilustraci jen krátce několik údajů. Střevní mikrobiota se objevuje krátce po porodu a její složení je významně ovlivněno způsobem porodu (spontánní porod, aseptické vybavení plodu císařským řezem), okolním prostředím novorozence a zejména stravou (kojení, umělá výživa, způsob přikrmování a posléze přechod na tuhou stravu). Střevní mikrobiota se postupně mění. Po porodu dominují bifidobakterie, které jsou v průběhu času nahrazovány za Bacteroides, anaerobní koky s významnou příměsí koliformních bakterií, streptokoků a klostridií. V dospělosti pak převažují bakteriální druhy Bacteroides, Clostridium, Eubacterium, Lactobacillus, Streptococcus a Bifidobacterium. Escherichia coli představují pouze minoritní druh (< 1 %) (tab. 1) (9).
1. Koexistence komenzální mikrobioty a hostitele 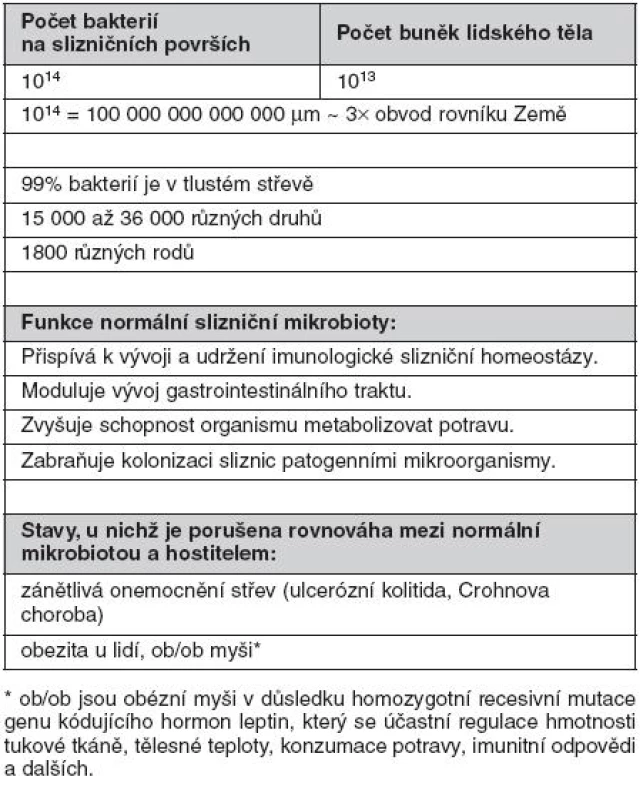
Střevní komenzální bakterie hrají významnou roli při výživě a metabolismu hostitele, neboť syntetizují některé vitamíny, přispívají k trávení potravy a poskytují hostiteli energii ve formě dobře využitelných chemických vazeb (kyselina máselná, mastné kyseliny). Mimoto kolonizace komenzálními bakteriemi chrání hostitele před invazí patogenních mikroorganismů. Nezastupitelnou roli hrají komenzální bakterie při vývoji slizničního imunitního systému, jak bude uvedeno dále.
Aby hostitel mohl využívat ke svému prospěchu všechny výše uvedené výhody přítomnosti komenzální mikrobioty, musí být schopen regulovat její přítomnost, množství a potenciální invazi spočívající v adhezi na epitelové buňky, penetraci přes epitel a eventuální systémové diseminaci. K tomu využívá složky vrozené i získané imunity slizniční, která je v mnoha ohledech odlišná od imunity systémové, ačkoliv využívá stejné principy a nástroje.
Vrozená slizniční imunita
Klíčovou úlohu v imunologii, a to nejen slizniční, hrají nezřídka imunologicky opomíjené epitelové buňky (EC). Jejich fenotypová a funkční variabilita je ohromující. Je třeba připomenout, že právě EC derivované z entodermu třetí branchiální výchlipky vytváří základ thymu a EC výchlipek embryonálního střeva vytváří základ jater a u ptáků dále Fabriciovy burzy. Základy uvedených orgánů jsou osidlovány prekurzory B - a T-lymfocytů, které zde posléze diferencují v přímém kontaktu s EC (10–11). EC slizničních povrchů zajišťují efektivní obranu několika mechanismy, které jsou závislé na dynamice obnovy EC a s tím souvisejícími změnami jejich fenotypu a funkce. Střevní EC diferencují z kmenových EC v kryptách střevní sliznice, odkud migrují k vrcholům střevních klků s poločasem 2–3 dny, kde se odlupují. Během této dráhy se z buněk „sekrečního“ typu, které exprimují receptor pro polymerní imunoglobuliny (pIgR) a aktivní transcytózou přispívají k tvorbě S-IgA, stávají buňky „absorpční“, které ztrácejí pIgR, ale exprimují MHC II molekuly DR, a mohou se tak účastnit prezentace antigenu slizničním T-lymfocytům. Množství denně odloupaných EC je přibližně 1011, tedy tolik, kolik máme T-, B-lymfocytů a plazmatických buněk v největším lymfoidním orgánu celého imunitního systému – střevě.
EC slizničních povrchů jsou aktivně zapojeny do procesů nespecifické i specifické imunitní slizniční obrany (12). Na jejich povrchu se nachází různě silná vrstva hlenu obsahujícího významně glykozylovaný glykoprotein mucin (MUC2), který je produkován zejména pohárkovými buňkami v epitelu střevních klků. Hlen tvoří nejen mechanickou bariéru proti pronikání mikrobů, ale udržuje rovněž optimální koncentraci sekrečních protilátek zamezením jejich odplavování v důsledku peristaltického pohybu. Přestup mikroorganismů přes epitelovou vrstvu je omezen těsnými spojeními mezi buňkami (tight junction), která jsou schopna zabránit prostupu molekul o molekulové hmotnosti větší než 900 Da. EC společně s Panetovými buňkami střeva a polymorfonukleáry sekretují mnoho antibakteriálních kationických peptidů (defenziny, kathelicidiny, sekreční inhibitor leukocytárních proteáz (SLPI), peptidy podobné kryptidinu), které poškozují a permeabilizují buněčnou membránu bakterií, poškozují některé viry (HIV, HSV, chřipka) a současně působí jako chemotaktické faktory monocytů a T - a B-lymfocytů (12–13). EC dále produkují bakteriolytické a baktericidní proteiny (lyzozym, laktoferrin, sekretovaná fosfolipáza A2) a mnoho dalších.
Aktivní komunikace s buňkami pojiva a imunitního systému je jednou z velmi významných funkcí. EC jsou schopny produkovat prozánětlivé cytokiny IL-1α, IL-1ß, IL-15, TNF-α a IL-6, z nichž IL-6 významně zasahuje do produkce polymerního IgA. Mimo to produkují protizánětlivé cytokiny IL-10, TGF-ß, kyselinu retinovou a indolamin dioxygenázu, čímž významnou měrou přispívají k převažující tolerogenní reakci slizniční tkáně na nejrůznější antigenní podněty. Recentní výzkum jasně prokázal, že v induktivních, nebo efektorových místech slizničního systému se EC a dendritické buňky (DC), svými cytokiny a SLPI cestou nezávislou na slizničních T-lymfocytech, účastní izotypového přesmyku a konečné diferenciace B-lymfocytů v buňky produkující IgA (14) (obr. 2, 3).
2. Induktivní a efektorová místa slizničního imunitního sytému GALT – lymfatická tkáň asociovaná se střevem, NALT – lymfatická tkáň asociovaná s nosní sliznicí 
3. Indukce slizniční imunitní odpovědi a tolerance B – B-lymfocyt, ICOS-L – ligand inducibilního kostimulátoru T-lymfocytů, IDO – indolamin dioxygenáza, IL – interleukin, pIgA – polymerní IgA, RA – kyselina retinová, S-IgA – sekreční IgA, SLPI – sekreční inhibitor lymfocytárních proteáz, TGF-β – transformující růstový faktor β, Th – pomocný T-lymfocyt, Treg – regulační T-lymfocyt 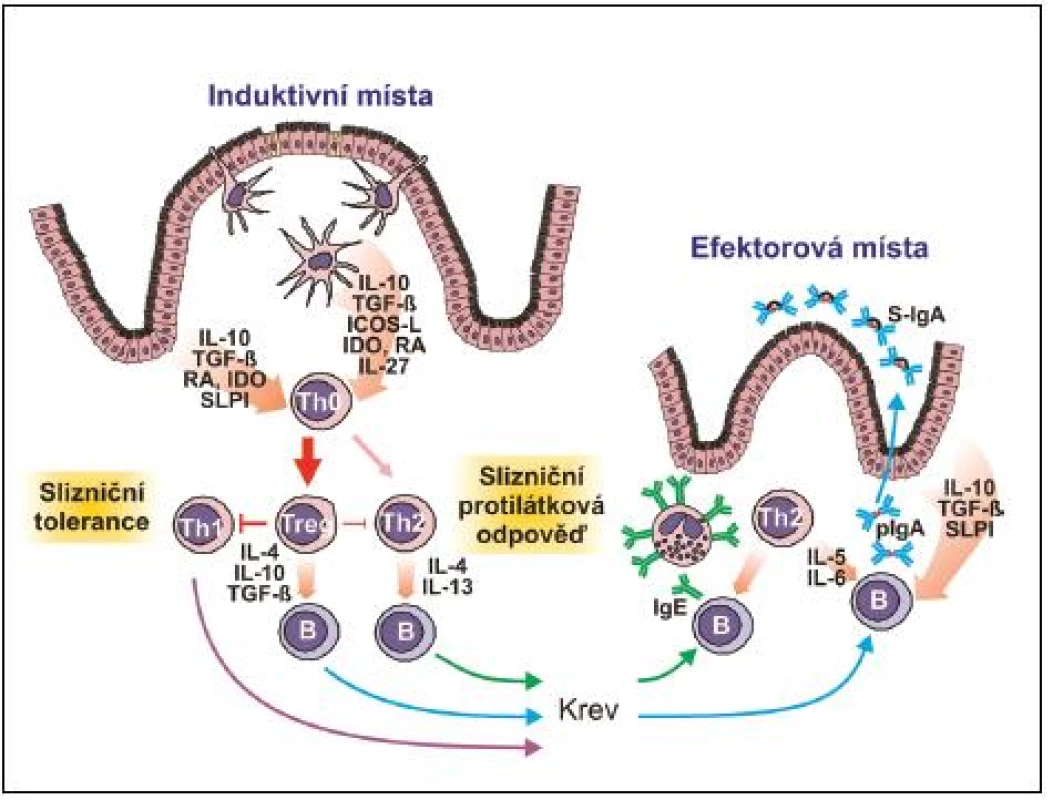
EC jsou dále zapojeny do aktivního transportu makromolekul přes epitelovou bariéru (transcytózu), a to oběma směry. Na bazolaterální straně EC je exprimován receptor pIgR, který je zodpovědný za sekreci polymerního IgA (pIgA) a pIgM. PIgA obsahuje nejčastěji dvě IgA molekuly spojené J řetězcem. Po navázání pIgA na pIgR dochází k jeho transcytóze a sekreci na slizniční povrchy ve formě S-IgA, jež oproti pIgA obsahuje navíc fragment pIgR (sekreční komponentu), která zajišťuje sekretovaným imunoglobulinům zvýšenou odolnost proti endogenním a exogenním proteázám. Mimo sekreci IgA na slizniční povrch je zřejmě tato dráha využívána při intracelulární neutralizaci i aktivním vylučování antigenů, které překonaly epitelovou bariéru, což je významné například při zajištění rezistence proti virům. EC dále exprimují neonatální receptor pro IgG imunoglobulin (FcγRn), který zajišťuje obousměrný transport IgG. Tím EC přispívají k distribuci IgG.
V neposlední řadě bylo prokázáno, že EC exprimují několik zástupců rodiny PRR (pattern-recognition receptors), kterými imunitní systém rozlišuje základní typy mikrobiální infekce (TLR-2 rozlišuje peptidoglykany Gram-pozitivních bakterií, TLR-3 rozlišuje dvouvláknovou virovou RNA, TLR-4 přispívá k rozlišení lipopolysacharidu Gram-negativních bakterií, TLR-5 rozlišuje bakteriální flagelin, TLR-9 rozlišuje bakteriální DNA prostřednictvím CpG motivů) (15). Jelikož mnohé ligandy jsou exprimovány jak patogenními, tak komenzálními mikroorganismy, musí být EC schopny obě tyto populace rozlišit, k čemuž využívají několik mechanismů. Během ontogeneze dochází například k potlačení exprese TLR-4 na EC, což vysvětluje sníženou vnímavost normálního dospělého jedince k lipopolysacharidu. Mimoto dochází k redistribuci některých PRR například z povrchu střevních klků do hloubky krypt, z apikální strany EC na bazolaterální stranu, z buněčného povrchu do cytoplazmy, což vede k tomu, že dokud komenzální bakterie neatakují slizniční epitelové buňky, nejsou imunitním systémem vnímány jako signál nebezpečí a nedochází k aktivaci zánětlivé imunitní reakce (16). Interakce s PRR nastávající převážně až v okamžiku mikrobiální invaze vede k iniciaci tvorby a sekrece prozánětlivých cytokinů a chemokinů EC za současného zvýšení obranné funkce samotné epitelové bariéry zvýšenou tvorbou antimikrobiálních peptidů a proteinů a zpevněním těsných mezibuněčných spojení. Přítomnost komenzálních bakterií a jejich interakce s EC přispívá významně k utlumení zánětlivé stimulace.
Epitelová slizniční vrstva není tvořena pouze epitelovými buňkami. S vysokou frekvencí jsou zde přítomny také intraepitelové lymfocyty. Vzhledem k tomu, že jeden lymfocyt připadá na 4–10 EC v tenkém střevě a na 30–50 EC v tlustém střevě, je jejich celkový počet velmi značný. EC aktivně komunikují s intraepitelovými lymfocyty prostřednictvím povrchových molekul. Přibližně 80 % tvoří CD8+, dále pak CD4+ a CD4+8+ T-lymfocyty. Intraepitelové lymfocyty exprimují buď heterodimerní CD8αß molekulu společně s heterodimerním TcRαß, což nasvědčuje tomu, že se jedná o konvenční T-lymfocyty, nebo exprimují homodimerní CD8αα molekulu společně s TcRαß nebo TcRγδ. Mimo to se ve sliznicích nacházejí dvojitě negativní CD4- CD8- T-lymfocyty exprimující TcRαß nebo TcRγδ (9).
Intraepitelově lokalizované CD8αα TcRγδ T-lymfocyty zajišťují nespecifickou obranu, neboť jejich aktivita není závislá na prezentaci antigenů pocházejících od většiny slizničních patogenů. Namísto toho rozlišují neklasické MHC molekuly MICA a MICB (MHC class I chain-related genes), jejichž geny jsou lokalizované v MHC I oblasti 6. chromozomu. MIC proteiny neprezentují antigen a jsou považovány za stresové markery epitelu indukované mikrobiální infekcí nebo tepelným šokem. Jsou výrazně polymorfní, ačkoliv význam tohoto polymorfismu není dosud plně pochopen (17). Vazba TcRγδ na MIC molekuly vede ke stimulaci TcRγδ T-lymfocytů a následné expresi cytokinů IL-2, IL-3, IL-6, IFN-γ, TNF-α, a dále lymfotaktinu významného pro atrakci CD8 T-lymfocytů. Mimo to aktivované TcRγδ T-lymfocyty exprimují perforin, granzym a Fas ligand, jejichž prostřednictvím působí cytotoxicky vůči infikovaným nebo stresovaným epitelovým buňkám. Na druhou stranu mohou TcRγδ T-lymfocyty přispívat k hojení epitelových povrchů produkcí růstového faktoru keratinocytů (KGF) a potlačení zánětu produkcí TGF-ß a IL-10. TcRγδ T-lymfocyty jsou unikátní mimo jiné tím, že přes produkci širokého spektra cytokinů samy po aktivaci neproliferují, čímž zachovávají integritu epitelové bariery. Zvláštní postavení TcRγδ dokumentuje i jejich schopnost fagocytovat protilátkami opsonizované partikule a bakterie po vazbě na povrchový receptor pro imunoglobulin CD16 (FcγRIII), s následným intracelulárním zpracováním a prezentací na MHC II (18). CD8αα TcRγδ T lymfocyty patrně nematurují v thymu. Místo jejich maturace bylo identifikováno u myších analogů a jsou jím patrně kryptoplaky, shluky lymfatické tkáně v kryptách tenkého a tlustého střeva. Schopnost fagocytózy, která byla vždy připisována pouze buňkám myelodní řady, nasvědčuje, že TcRγδ T-lymfocyty mohou být evolučními předchůdci konvenčních T lymfocytů.
Další linii lymfocytů, které jsou zapojeny do nespecifické imunitní odpovědi, představují přirození zabíječi (NK), kteří rovněž vážou MICA a MICB prostřednictvím aktivačních molekul NKG2D (activatory natural killer C-type lectin cell receptor). Aktivované NK-buňky exprimují IFN-γ a Fas ligand, který zprostředkovává jejich cytotoxické působení. Výše zmíněná exprese IL-15 epitelovými buňkami přispívá rovněž k aktivaci NK-buněk a TcRγδ T-lymfocytů, čímž je zajištěna efektivnější eliminace infikovaných a poškozených epitelových buněk. Další populací NK-buněk jsou NKT-lymfocyty, které jsou charakteristické expresí invariantního TcRα a variabilního TcRß řetězce. Tyto buňky rozlišují lipidové antigeny na neklasických MHC molekulách CD1d, exprimovaných mimo jiné slizničními EC. Prezentací bakteriálních lipidových struktur (α-glukuronosylceramid, α-galaktouronosylceramid, diacylglycerol) jsou epitelové buňky zapojeny do a iniciace imunitní odpovědi. Důsledky aktivace NKT-lymfocytů jsou nejednoznačné, neboť na jedné straně mohou přispívat k aktivaci efektorové imunitní odpovědi, a na druhé straně mohou potlačovat zánět produkcí IL-10 a IL-4.
Antigenně specifická odpověď
Slizniční systém je plně vybaven i pro antigenně specifickou imunitní odpověď. Je třeba zdůraznit, že sliznice obsahují více imunitních buněk, včetně B - a T-lymfocytů, plazmatických buněk, makrofágů a DC, než všechny ostatní lymfoidní tkáně těla (viz obr. 1). Jsou též místem nejintenzivnější tvorby protilátek a zřejmě i cytokinů, povážíme-li jejich obrovské množství na slizničních površích a jejich široké spektrum. Pro indukci specifické imunitní odpovědi je slizniční imunitní systém vybaven četnými lymfatickými strukturami: a) ve střevě hovoříme o GALT – gut-associated lymphoid tissues (Peyerovy pláty v enkém střevě – odhaduje se jich okolo 200, apendix, lymfatické pláty v lustém střevě (colonic patches), izolované lymfatické folikuly na antimezenterické straně střeva – odhaduje se jich okolo 80 000, a rektální tonsila), b) v oblasti horních cest dýchacích hovoříme o NALT – nasal-associated lymphoid tissues (patrové mandle a nosohltanové mandle, které společně tvoří Waldayerův okruh) a c) sublinguální lokalita dutiny ústní, která má na rozdíl od předchozích lymfatickou drenáž podobnou kůži, ale přesto je velmi efektivní při indukci specifické imunitní odpovědi na sliznicích (19–20). Do induktivní lymfatické tkáně migrují naivní T - a B-lymfocyty, zde dochází k ejich částečné maturaci. Následuje migrace zpět do krevního řečiště, které umožňuje distribuci a osídlování rozličných slizničních tkání (např. střevo, laktující mléčné žlázy, slinné a slzné žlázy a genitální trakt). B - a T-lymfocyty migrují do uvedených efektorových lokalit prostřednictvím interakce svých orgánově specifických „homing“ receptorů s příslušnými ligandy exprimovanými endotelovými buňkami postkapilárních venul. Zde dochází k erminální maturaci na efektorové T-lymfocyty a plazmatické buňky a k platnění jejich efektorových funkcí (viz obr. 2).
Jedním z ejlépe popsaných induktivních míst jsou Peyerovy pláty přilehlé k pitelu tenkého střeva. Jejich architektura je velmi podobná architektuře ostatních induktivních oblastí MALT. Nemají aferentní lymfatické cévy. Přísun antigenu zajišťují specializované epitelové M buňky (multifold/membraneous cells), přiléhající těsně ke kupoli Peyerových plátů. Mají krátké mikroklky, malé cytoplazmatické vezikly a jen několik lyzozomů. Účastní se transportu antigenů z umen sliznice k přilehlé lymfatické tkáni, dendritickým buňkám, makrofágům a lymfocytům. M buňky transportují proteiny, ale i částice jako viry, bakterie, malé parazity a mikrosféry, aniž by je jakkoliv zpracovávaly. V Peyerových plátech vyzrávají B-lymfocyty předurčené zejména k produkci IgA. Důkazem toho je přítomnost povrchového IgA na většině z nich. V lidských tonsilách jsou naopak převážně B-lymfocyty s povrchovým IgG, nicméně IgA a IgM pozitivní buňky jsou rovněž přítomny. Na rozdíl od sekundárních lymfatických uzlin v systémovém kompartmentu dochází v zárodečných centrech induktivních tkání sliznic pouze k částečnému vyzrávání antigenně specifických B-lymfocytů. To je dokončeno až po migraci do lamina propria efektorových slizničních oblastí, kde se nachází převážná většina slizničních plazmatických buněk produkujících pIgA. Tvorba zárodečných center v Peyerových plátech je závislá na přítomnosti normální komenzální mikrobioty. Laterálně od zárodečných center se nachází zóna T-lymfocytů, tvořená z více jak 97 % zralými TcRαß T-lymfocyty. Z nich asi dvě třetiny tvoří CD4 T-lymfocyty s vlastnostmi Th-lymfocytů. Zbytek tvoří převážně CD8αß T-lymfocyty, prekurzory cytotoxických T-lymfocytů. V těchto oblastech jsou četně zastoupeny venuly s vysokým endotelem, jejichž prostřednictvím přicházejí T-lymfocyty do Peyerových plátů. Obecně, vývoj induktivní slizniční lymfatické tkáně je závislý na přítomnosti normální mikrobioty. Jedinou výjimkou se zdají být izolované lymfatické folikuly v tlustém střevě, jejichž vývoj nastává i za bezmikrobních podmínek. Podstata tohoto fenoménu není zcela objasněna.
V Peyerových plátech se nachází několik dominantních populací DC. Plazmacytoidní DC jsou lokalizovány převážně v oblastech mezi epitelem a zárodečnými centry a jsou považovány za populaci DC přispívající význačnou mírou k indukci regulačních T-lymfocytů a obecně k tolerogenní reakci slizničního imunitního systému. Druhá dominantní populace, myeloidní DC, se nachází opět v oblasti pod epitelem s M buňkami. Odtud po kontaktu a internalizaci antigenu migrují myeloidní DC do T lymfocytární oblasti, kde prezentují antigen za současné produkce IL-10, čímž přispívají k indukci antigenně specifické buněčné tolerance spojené s indukcí regulačních T-lymfocytů (Treg). V T zóně se nachází další dominantní populace DC, označovaná u myší jako lymfoidní DC. Exprimují na svém povrchu CD8 a po mikrobiální stimulaci prezentují antigen za současné sekrece vysokých hladin IL 12, což vede k diferenciaci naivních T-lymfocytů směrem k prozánětlivé Th1 populaci.
V neposlední řadě mohou naivní T-lymfocyty diferencovat v Th17 prozánětlivé efektorové lymfocyty zajišťující účinnou obranu proti bakteriální infekci stimulací polymorfonukleárů. Mimoto Th17 lymfocyty přispívají k rozvoji některých zánětlivých autoimunitních onemocnění. Diferenciace směrem Th17 je iniciována současným působením cytokinů TGF-ß a IL-6. Vývoj v Th17 prochází několika stadii, která až do okamžiku terminální diferenciace jsou charakteristická regulačním fenotypem. Konečná diferenciace je indukována přítomností cytokinu IL-23. Veškeré rozhodovací funkce ve smyslu diferenciace jednotlivých subpopulací Th-lymfocytů a rovněž populace CD8 cytotoxických lymfocytů je určena cytokinovým pozadím, jehož zdrojem jsou převážně DC, ale jak bylo zmíněno výše, EC rovněž produkují mnoho zejména protizánětlivých tolerogenních cytokinů.
Vzhledem k obecné tolerogenní tendenci slizniční induktivní tkáně GALT a do jisté míry i NALT je třeba zmínit, že první slizniční kontakt s antigenem a jeho prezentace u naivních jedinců vede k indukci Th1 lymfocytární anergie a k indukci různých subpopulací regulačních T-lymfocytů.
Regulační T-lymfocyty tvoří velmi heterogenní populaci, jejíž efektorové působení spočívá v utlumení antigenně specifických T-lymfocytů několika mechanismy. CD25-pozitivní populace regulačních T-lymfocytů může potlačit aktivitu a vývoj Th1 lymfocytů odebíráním IL-2, významného aktivátoru Th1 diferenciace. Další mechanismus spočívá v tlumení antigenně specifických T-lymfocytů cytokiny IL-10 a TGF-ß. Antigenní specificita může být zajištěna vazbou regulačního a regulovaného T-lymfocytu na jednu antigen prezentující buňku přes klasickou interakci MHC-Ag-TcR. Antigen prezentující buňka může aktivně přispívat k lokálnímu působení TGF-ß jeho aktivací spočívající v odštěpení inaktivační domény přítomné na TGF-ß sekretovaném z regulačního T-lymfocytu. Dalším mechanismem, kterým regulační T-lymfocyt může potlačit aktivovaný efektorový T-lymfocyt, je navození apoptózy sekrecí perforinu a granzymu. Regulační T-lymfocyty jsou schopny dokonce i utlumit aktivaci DC, což je možné v jistém smyslu považovat za nejpozoruhodnější mechanismus, neboť zde zasahují buňky klonální imunity do aktivační funkce evolučně starší imunity vrozené.
Podle fenotypu povrchových antigenů, původu, mechanismu aktivace a mechanismu působení rozdělujeme regulační T-lymfoctyty na několik populací. Přirozené Treg, které diferencují v thymu, jsou typické povrchovou expresí α řetězce receptoru pro IL-2 (CD25), CD4, CTLA-4 a transkripčního faktoru FoxP3. Jsou přítomny v Peyerových plátech, z čehož možno usuzovat na zapojení do regulace průběhu antigenně specifické aktivace naivních T-lymfocytů. Treg působí na okolní T-lymfocyty produkcí cytokinů IL-10, TGF-ß a dále uvolňováním indolamin dioxygenázy, která katabolizací tryptofanu, nezbytného pro proliferaci efektorových T-lymfocytů, brzdí průběh jejich aktivace. Vzhledem k tomu, že je v oblasti sliznice gastrointestinálního traktu zvýšená hladina IL-10 a TGF-ß a oba cytokiny přispívají k diferenciaci Treg, předpokládá se, že podpopulace Treg může diferencovat přímo ve střevě, tedy mimo thymus. Pro udržení populace Treg je nezbytný IL 2, což nasvědčuje tomu, že Treg se v lymfatické tkáni vyskytují jako reakce na určitý antigenní podnět. Další populací jsou regulační Tr1 lymfocyty, které produkují rovněž IL-10 a TGF-ß, ale neexprimují FoxP3. Tr1 tlumí okolní T-lymfocyty se stejnou antigenní specificitou (TcR-Ag-MHC II). Zde musí být zapojeny i DC. Tr1 však mohou tlumit i aktivované T-lymfocyty v blízkém okolí, s odlišnou antigenní specificitou v důsledku difuze sekretovaných tlumivých cyktokinů (bystander effect). Tr1 jsou typickou populací střevní sliznice, o čemž svědčí exprese chemokinového receptoru CCR9 i na Tr1 identifikovaných v krvi. Přispívají tak k normálnímu protizánětlivému profilu cytokinů sliznice zejména gastrointestinálního traktu. Další populací jsou Th3 regulační T-lymfocyty sekretující TGF-ß. Jejich diferenciace je zvýšená v přítomnosti TGF-ß, IL-4 a IL-10. Na rozdíl od Treg jsou Th3 nezávislé na IL-2. Jinou populací T-lymfocytů, jež může přispívat k navození orální tolerance, jsou regulační nebo dříve supresorové CD8 T-lymfocyty, které jsou schopny regulovat antigenně specifickou aktivaci naivních T lymfocytů potlačením exprese kostimulačních molekul na antigen prezentujících buňkách (makrofágy, DC). Další subpopulací je CD8+ populace exprimující ß řetězec receptoru pro IL-2 a IL-15 (CD122), u které se předpokládá podobné působení jako u přirozených Treg.
B-lymfocyty a IgA jako dominantní představitel specifické imunitní odpovědi ve většině sliznic
Slizniční povrchy se zásadně liší od systémové imunity v zastoupení jednotlivých tříd imunoglobulinů. Dominujícím izotypem je IgA v podobě S-IgA. Imunoglobuliny GIT jsou produkovány převážně lokálně z plazmatických buněk v lamina propria. Naprostá většina (90 %) plazmatických buněk produkuje IgA, IgM produkuje 6 % a IgG asi 4 %. U některých pacientů s vrozenou IgA deficiencí dochází ke kompenzaci syntézou S-IgM plazmatickými buňkami lamina propria, které dosahují až 75 % všech Ig-pozitivních lymfocytů v dané lokalitě. IgM a IgA mají mnoho společných vlastností, jako je schopnost tvořit polymery, vázat J řetězec, vázat pIgR na bazolaterální straně epitelových buněk GIT a být sekretován do lumen s navázanou sekreční komponentou. Evoluční příbuznost IgM a IgA dokumentuje vysoká strukturní homologie konstantních domén těžkého řetězce Cμ3, Cμ4 a Cα2, Cα3, C’koncový fragment a podobné množství N-vázaných postranních oligosacharidů s vysokým zastoupením manózy. Zastoupení a původ protilátek na sliznicích pohlavního traktu je odlišné. Převažuje zde IgG nad IgA a významný podíl protilátek pochází z krevní plazmy, odkud jsou protilátky aktivně transportovány prostřednictvím imunoglobulinových receptorů (FcγRn pro IgG a pIgR pro IgA) exprimovaných epitelovými buňkami zejména cervixu.
Jak bylo zmíněno, vyzrávání naivních B-lymfocytů v plazmatické buňky probíhá ve dvou časově posloupných dějích ve dvou lokalitách. V první fázi dochází k afinitní maturaci variabilních oblastí těžkého a lehkého řetězce imunoglobulinu v kontextu s antigenem prezentovaným ve formě komplexů na povrchu folikulárních DC v zárodečných centrech induktivní lymfatické tkáně, podobně jako je tomu při indukci systémové imunitní odpovědi. Tento proces je závislý na kostimulačních signálech od CD4 T-lymfocytů (povrchový CD40L a cytokiny IL-4, TGF-ß), které spouštějí v B-lymfocytech izotypový přesmyk směrem k produkci IgA. B-lymfocyty nyní exprimující na svém povrchu molekulu IgA jsou následně stimulovány retinovou kyselinou, produkovanou lokálními DC, k expresi chemokinových receptorů a integrinů, s jejichž pomocí, po vycestování do krevního řečiště, mohou vstoupit do efektorových oblastí (lamina propria) přilehlých či vzdálených sliznic (CCR9, α4ß7 umožňuje migraci do tenkého střeva; CCR10, α4ß1 migraci do NALT a sliznice pohlavního systému). V lamina propria jsou lokálními Th2 lymfocyty a jimi produkovanými cytokiny IL-5, IL-6, IL-10 a IL-15 stimulovány příchozí B-lymfocyty k terminální diferenciaci v plazmatické buňky a sekreci převážně pIgA, který je po vazbě na pIgR aktivně transportován epitelovými buňkami do lumen ve formě S-IgA (viz obr. 3).
S-IgA se podílí na ochraně slizničních povrchů před bakteriální invazí dvěma odlišnými mechanismy. První z nich spočívá v běžné antigen specifické vazbě mikroorganismů, která je zajištěna interakcí bakteriálních povrchových antigenů s antigen vážící oblastí IgA. Druhý mechanismus spočívá ve vazbě mezi bakteriálními receptory pro různé oligosacharidy a postranními N - a O-vázanými oligosacharidy na Cα řetězci, J řetězci a sekreční komponentě S-IgA. Jelikož jsou tyto postranní cukry podobné těm, které na svém povrchu exprimují epitelové buňky, mohou S-IgA a podobně i S-IgM interagovat s mikroorganismy touto antigenně nespecifickou cestou. Vzhledem k tomu, že bakteriální receptory pro oligosacharidy rozlišují různé konformace, sekvence monosacharidů a typy glykosidických vazeb, a vzhledem k odhadovanému počtu bakteriálních druhů (až 36 000) vyvstává otázka, zda mohou být na S-IgA vytvořeny všechny varianty postranních oligosacharidů tak, aby efektivně reagovaly s převážnou většinu přítomných bakterií a jejich receptorů. Teoretický odhad ukazuje, že cukerná variabilita daleko převyšuje variabilitu aminokyselinové sekvence. Pro demonstraci 6 aminokyselin z 20 možných může být sestaveno do 6 . 107 různých hexapeptidů. Naproti tomu 6 monosacharidů může vytvořit až 1015 různých hexasacharidů. Experimentální analýzy S-IgA skutečně potvrdily velmi vysokou heterogenitu postranních oligosacharidů (21–23). Interakce bakterií s oligosacharidovými ligandy epitelových buněk byla potvrzena pro mnoho slizničních infekcí (Escherichia coli, Helicobacter pylori, Streptococcus pneumoniae, Clostridium difficile, Shigella flexneri, Pseudomonas aeruginosa, Neisseria gonorrhoeae, viry HIV, paramyxoviry, viry chřipky, koronaviry, rotaviry, reoviry a další) (8).
Vazba S-IgA na bakteriální povrch brání vazbě bakterií na receptory slizničních epitelových buněk, aniž by docházelo k významné zánětlivé aktivaci, eliminaci bakterií či omezení jejich metabolismu. Nezánětlivá reakce na vazbu IgA-bakterie je dána mimo jiné i tím, že IgA neaktivují klasickou komplementovou kaskádu. Jak bylo uvedeno výše, vazba IgA-bakterie vede u komenzálních střevních bakterií ke tvorbě biofilmů s následným omezením penetrace bakterií přes epitelovou vrstvu. Jinými slovy, na S-IgA můžeme nahlížet jako na molekulu imunitního systému, která je zapojena jak do antigenně specifické (Fab vazba), tak i antigenně nespecifické, vrozené (postranní oligosacharidy) imunitní obrany jedince. Spojení principů adaptivní a vrozené imunitní obrany mechanisticky do jedné molekuly S-IgA zajišťuje dokonalou protekci slizničních povrchů za efektivního využití struktury a jejích možných funkcí.
Slizniční tolerance
Přes svou schopnost aktivně reagovat na komenzální mikrobiotu, ale i na obrovské množství antigenů přicházejících trvale z vnějšího prostředí (potrava, vzdušné antigeny, antigeny sexuálního partnera atd.), je slizniční imunitní systém evolučně nastaven směrem k nezánětlivé formě imunitní odpovědi, tvorbě protizánětlivě působícího IgA a navození slizniční tolerance. To je možné demonstrovat experimentálně opakovanou orální nebo nazální aplikací velkých dávek antigenu nebo haptenu konjugovaného s vhodným nosičem, což vede k poklesu nebo naprostému vymizení T buněčné odpovídavosti na následnou systémovou imunizaci identickým antigenem. Takto navozená orální tolerance byla studována na mnoha zvířecích modelech (myš, laboratorní potkan a morče; jiné druhy jsou k navození systémové neodpovídavosti mnohem méně vnímavé). Orální tolerance postihuje zejména populaci T-lymfocytů a hlavními znaky jsou pokles reakce oddálené přecitlivělosti (DTH), snížená antigenně specifická proliferace T-lymfocytů in vitro, indukce různých populací specifických regulačních T-lymfocytů a produkce imunosupresivních či protizánětlivých cytokinů, zejména IL-10, TGF-ß, IL-4. Bylo popsáno mnoho mechanismů zapojených do vzniku orální tolerance: delece, ale zejména anergie antigenně-specifických T-lymfocytů a indukce regulačních T-lymfocytů různých subpopulací. Jednotlivé mechanismy mohou probíhat současně. Na druhou stranu možnost potlačení tvorby specifických protilátek byla zkoumána v menším počtu studií. Nejatraktivnější je přirozeně otázka možnosti potlačení odpovídavosti organismu na alergeny životního prostředí IgE protilátkami či navození tvorby alergenně specifických sekrečních IgA nebo IgG, které by úspěšně soutěžily s IgE o antigenní determinanty alergenů. Tato otázka zůstává stále aktuální.
Parametry navozené slizniční odpovědi vykazují výrazné rozdíly v závislosti na uspořádání experimentu. Tyto rozdíly mohou být zapříčiněny mnoha faktory, z nichž nejvýznamnější roli hraje časová posloupnost podání, dávka, způsob podání, druh a čistota antigenu, použité adjuvans a samozřejmě druh experimentálního zvířete (obr. 4).
4. Vliv časové souslednosti slizniční a systémové imunizace při navození tolerance B – B-lymfocyt, DTH – reakce oddálené přecitlivělosti, IL – interleukin, TGF-β – transformující růstový faktor, T – T-lymfocyt, Treg – regulační T-lymfocyt 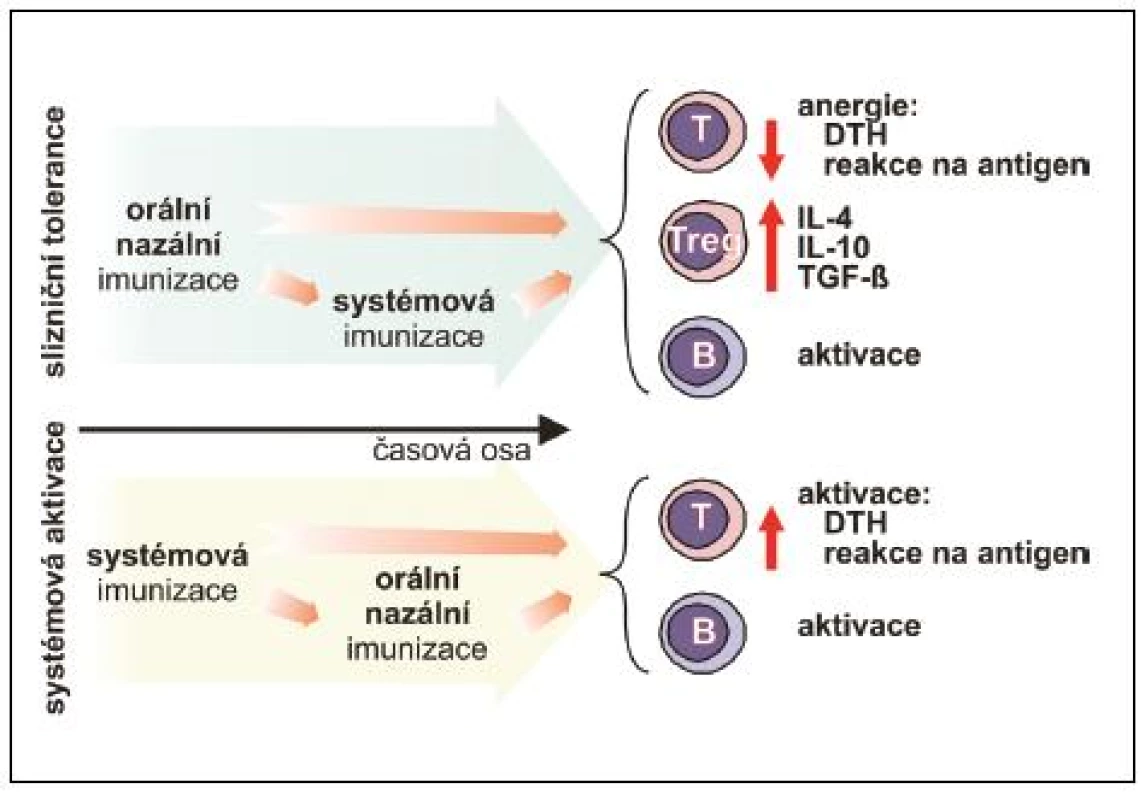
Laboratorně potvrzená možnost předejít nebo modulovat T lymfocyty zprostředkovanou experimentálně navozenou autoimunitní reakci (experimentální autoimunitní encefalomyelitida, artritida navozená kolagenem typu II, autoimunitní diabetes mellitus) vedla k obnovení zájmu o možné využití principů orální tolerance pro terapii autoimunitních onemocnění člověka včetně roztroušené sklerózy nebo revmatoidní artritidy. Tyto pokusy však u člověka nevedly k očekávanému efektu, což vyvolává otázku, jaká je příčina rozdílů mezi slibnými výsledky studií na laboratorních zvířatech a selháním klinických experimentů. Významnou roli jistě hraje nízký věk experimentálních zvířat, jejich druh, pohlaví, dávka, frekvence a způsob podání studovaného antigenu, adjuvans a zřejmě mnoho dosud neidentifikovaných parametrů, nicméně jeden z klíčových parametrů je zřejmě předchozí vystavení jedince antigenu. Jakmile dojde k navození určitého typu systémové imunitní reakce hostitele, další aplikace antigenu již tuto reakci nemůže zvrátit. Jsou určité výjimky, které snad otevřou cestu budoucnosti. Jako příklad uveďme adjuvantní efekt B podjednotky teplotně labilního enterotoxinu Gram-negativní enterobakterie Vibrio cholerae (CTB). Antigeny jako myelinový bazický protein (MBP), lidský imunoglobulin, xenogenní erytrocyty a ovalbumin po chemické konjugaci s CTB podjednotkou vyvolaly po orálním podání antigenně specifickou toleranci, projevující se potlačením specifické T lymfocytární odpovědi (v kožním testu či v in vitro proliferačním testu) u experimentálních myší, které byly systémově imunizovány stejným antigenem buď krátce před, nebo po orální aplikaci. Navíc orální imunizace MBP konjugovaným s CTB vedla k ochraně experimentálních potkanů před rozvojem komplikací experimentální autoimunitní encefalomyelitidy navozené předem systémovou imunizací MBP v kompletním Freundově adjuvans (24–26). Jelikož imunizace těmito a mnoha dalšími antigeny, při nichž jako zdroj CTB sloužil extrakt V. cholerae, vedla naopak k významné indukci protilátkové i systémové T lymfocytární odpovědi, je nutné zmínit, že pozorovaná slizniční tolerance je navozena v případě, že CTB neobsahuje další podjednotku choleratoxinu nebo celý holoenzym, jejichž příměs se považuje za příčinu popsaného rozdílu (2).
Slizniční tolerance u člověka
Existuje u člověka fenomén slizniční tolerance? Množství studií věnujících se této otázce je překvapivě nízké, uvážíme-li možný klinický dopad. Lowney pozoroval pokles incidence a intenzity rekce kožní přecitlivělosti na 2,4-dinitrobenzen u zhruba poloviny dobrovolníků, kterým byla předem tato látka aplikována na bukální sliznici dutiny ústní (27). Při demonstraci slizniční tolerance na antigen proteinové povahy u člověka je základní problém nalézt takový vhodný neoantigen, se kterým se skupina jedinců zapojených do experimentu dosud nesetkala. Takový antigen musí být použitelný jak pro slizniční, tak pro systémovou aplikaci, aby fenomén slizniční tolerance bylo možné navodit, ale i jednoznačně vyhodnotit. Nejčastěji využívaný neoantigen je protein Keyhole Limpet Hemocyanin (KLH). Jedná se o nehemový respirační protein obsahující měď. KLH se izoluje z hemolymfy mořského měkkýše Megathura crenulata. KLH je silný imunogen schopný navodit při systémové aplikaci specifickou protilátkovou i buněčnou odpověď již při použití malých dávek. V několika experimentech u dobrovolníků, kteří dosud nebyli exponováni KLH, byl po perorální nebo intranazální aplikaci prokázán pokles systémové T lymfocytární odpovědi, měřený testem oddálené kožní přecitlivělosti a testem proliferace krevních T-lymfocytů in vitro stimulovaných KLH. Naopak B lymfocytární odpověď byla aktivována. Slizničně imunizovaní jedinci odpovídali na následnou parenterální aplikaci KLH tvorbou specificky reagujících systémových, ale i sekrečních protilátek, jejichž titry byly vyšší než u jedinců, kteří byli imunizováni pouze parenterální cestou. Slizniční imunizace antigenně naivních jedinců je tedy schopna potlačit systémovou specifickou T lymfocytární odpověď, ale naopak stimuluje specifickou humorální odpověď, a to jak slizniční, tak i systémovou (2). Tyto závěry jsou v souladu s výše popsanými obecnými mechanismy slizniční imunity.
Na základě výše zmíněných úspěšných pokusů u laboratorních myší a potkanů, u kterých orální nebo nosní podání autoantigenu (MBP nebo kolagenu Typ II z chrupavky) bez, nebo s CTB zabránilo vývoji experimentální autoimunitní encefalomyelitidy nebo revmatoidní artritidy navozených systémovou imunizací, bylo přikročeno na několika pracovištích k léčbě pacientů s roztroušenou sklerózou nebo revmatoidní artritidou využívající principy slizniční tolerance. Bohužel bez významného zlepšení nemoci u naprosté většiny z nich. Tento neúspěch lze přičíst faktu popsanému nejprve u zvířat a mnohem později i u lidí, jasně vypovídajícímu o tom, že lidé i zvířata s předem navozenou a dlouhodobě trvající systémovou protilátkovou a buněčnou imunitní odpovědí jsou refraktorní k indukci slizniční tolerance. Je tudíž zřejmé, že časová závislost a počáteční slizniční cesta imunizace mají základní dopad na úspěch či neúspěch navození systémové imunitní tolerance.
Výhledy slizniční vakcinace
Infekce přenášené přes slizniční povrchy – respirační infekce, průjmová onemocnění, tuberkulóza a HIV – představují celosvětově naprosto nejvýznamnější příčinu úmrtí na infekční onemocnění. Indukce imunitní odpovědi pomocí orální, intranazální, případně rektální aplikace vhodně modifikovaného antigenu je jedním z významných cílů úsilí mnoha slizničních vakcinologů. Doposud pouze velmi malé množství vakcín aplikovaných slizniční cestou je komerčně dostupných. Patří sem živé atenuované vakcíny: virus chřipky (Flueshield a jiné), poliovirus (Sabine), Salmonella typhi (Ty21a), lidský rotavirus (Rotarix) a lidský adenovirus a dále inaktivovaná vakcína Vibrio cholerae obsahující rekombinantní cholera toxin B (Dukoral). Většina v současnosti používaných vakcín sloužících k prevenci infekcí přenášených přes slizniční povrchy je podávána parenterálně. Tyto vakcíny indukují vysoké hladiny systémových IgG a méně IgM a IgA protilátek a rovněž specifické T-lymfocyty, u nichž však příspěvek k protektivitě nebyl dosud jasně prokázán u žádné vakcíny (28). Slizniční protekce navozená výše uvedenými vakcínami je spojena převážně s aktivitou IgG, které je efektivně transportováno na sliznice dýchacích cest a pohlavního traktu, ale jen ve velmi malé míře na sliznice gastrointestinálního traktu. Zde navíc IgG podléhá degradaci působením mnohých proteolytických enzymů. Přes svou prokázanou účinnost nejsou systémově podané vakcíny optimální pro navození slizniční protekce, která je přirozeně spojena s tvorbou S-IgA a nízkou zánětlivou aktivací imunitního systému. Oproti systémové vakcinaci indukuje efektivní slizniční aplikace antigenu výraznou lokální tvorbu S-IgA. Hlavní překážky v rychlejším rozvoji slizniční vakcinace spočívají v přirozeně nízké absorpci podaného antigenu, což vede k nutnosti aplikovat jej opakovaně a ve vysokých dávkách. Podaný antigen je navíc významně degradován žaludečními kyselinami a dále proteolytickými enzymy střeva. Jedním z potenciálních nebezpečí slizniční vakcinace je indukce specifických IgE protilátek. Na druhou stranu mají slizničně podané vakcíny několik výhod: menší požadavky na čistotu produktu, nepotřebnost sterilního vybavení při aplikaci, nižší požadavky na zdravotnický personál a rychlá aplikace v případě epidemií a pandemií.
Uvedená nízká absorpce a degradace antigenu a možnost navození orální tolerance vedly k vývoji systémů umožňujících dopravu antigenu k induktivním místům a speciálně M buňkám. V současnosti je intenzivně studováno několik přístupů: živé atenuované bakteriální a virové nosiče (E. coli, Lactobacillus, Listeria, Mycobacterium, Salmonella, Shigella, Streptococcus, Vibrio, adenoviry, poxviry, polioviry, coxackie viry, Mengo virus, virus venezuelské koňské encefalitidy, rhinoviry a další) geneticky modifikované k expresi potřebného antigenu, enkapsulace purifikovaného antigenu do biodegradabilních partikulí (liposomy, mikrosféry, kochleáty), ochrana proteinových antigenů inkorporací do rostlinných proteinových tělísek (PB-I, PB-II proteiny rýže MucoRice) (29–36). Je však třeba zdůraznit, že rekombinantní antigeny produkované v bakteriálních nosičích, antigeny exprimované pomocí rekombinovaných virových nosičů nebo exprimované v rostlinách nemají strukturu zcela identickou s antigeny produkovanými v průběhu přirozené infekce. Rozdíly se týkají zejména skládání rekombinantního antigenu a připojené cukerné komponenty, což vede k rozdílům v epitopové výbavě takto připravených vakcín. Významný stimulační efekt má aplikace antigenů společně s mukózními adjuvans (CTB, tepelně labilní enterotoxin z E. coli, případně slaběji působící nízce metylované CpG motivy, lipopolysacharid, pertusigen Bordetella pertusis a další) či konjugace antigenu s ligandy M buněk, z nichž nejefektivnější se zdá rekombinantní Fab fragment monoklonální protilátky NKM 16-2-4.
V slizniční vakcinaci si hledají své místo i DNA vakcíny, které jsou výhodné vzhledem ke své stabilitě, relativně nízké ceně výroby a expresi antigenů buňkami vakcinovaného jedince, do kterých je DNA vakcína vpravena. Posttranslační modifikace proteinů exprimovaných z DNA vakcín jsou důležité zejména při preventivní imunizaci u virových infekcí, jejich cílem je navodit protilátky účinně blokující přestup viru přes slizniční bariéru.
Vzhledem k očekávané velkovýrobě a požadavku na nízkou cenu eventuálních slizničně aplikovaných vakcín se jako jeden z nejvýhodnějších přístupů jeví exprese antigenu v transgenních rostlinách, jako jsou rýže, brambory, nebo rajčata. Vakcína na bázi transgenní rýže MucoRice nabízí několik předností: pyl rýže se šíří jen na velmi malé vzdálenosti a tím je omezeno nebezpečí šíření geneticky modifikovaných organismů, produkce cizorodých proteinů je uspokojivě vysoká, rýže relativně dobře inkorporuje produkované cizorodé antigeny do proteinových tělísek, která, kromě ochrany antigenu před degradací, jsou dobře vychytávána M buňkami GALT. Dále množení samotné rekombinované rostliny a zisk zrna jsou levné. Experimentální MucoRice vakcína exprimující CTB indukovala po orální aplikaci slizniční i systémovou odpověď, která chránila vakcinované jedince před následky orálního podání cholera toxinu.
Možná komplikace slizničně podaných vakcín – navození slizniční tolerance – není příliš pravděpodobná, není-li zcela vyloučená. U infekčních agens, u kterých se dá předpokládat předchozí expozice jedinců antigenně příbuznými mikroorganismy (virus chřipky), slizniční aplikace neprolomí již dříve navozenou zkříženě reagující systémovou specifickou imunitu. Důležitější je ale výše zmíněný fakt, že protektivní efekt současných vakcín závisí na indukci specifické protilátkové, a nikoliv buněčné imunitní odpovědi – jediném potenciálním cíli slizniční tolerance (28). V úvahu tedy přichází pouze infekce, proti nimž je většina lidí nesenzibilizovaných a jejichž prevence je spojována s nutností navození specifické buněčné imunity (cytotoxické T-lymfocyty), jako je HIV. Možnému nebezpečí navození slizniční tolerance však lze v těchto případech čelit systémovou imunizací předcházející slizničnímu podání vakcíny.
V budoucnu tedy můžeme očekávat přerod ve vakcinační praxi, spočívající v přechodu od systémové k slizniční aplikaci, která využívá přirozenou cestu vstupu většiny infekcí, nehledě na snížení ekonomické náročnosti a snadnou aplikovatelnost takových vakcín.
Zkratky
- CCR – receptor pro CC chemokin
- CD – diferenciační klastr
- CpG – nízce metylovaný cytidin guanozin dinukleotidový motiv
- CTB – B podjednotka cholerového toxinu
- DC – dendritická buňka
- DTH – reakce oddálené přecitlivělosti
- EC – epitelová buňka
- Fab – fragment vážící antigen
- FcγRn – neonatální receptor pro IgG
- FoxP3 – transkripční faktor (forkhead box P3)
- GALT – lymfatická tkáň asociovaná se střevem
- GIT – gastrointestinální trakt
- HIV – virus lidské imunodeficience
- HSV – herpes simplex virus
- ICOS-L – ligand inducibilního kostimulátoru T-lymfocytů
- IDO – indolamin dioxygenáza
- IFN – interferon
- IgA – imunoglobulin A
- IgG – imunoglobulin G
- IgM – imunoglobulin M
- IL – interleukin
- KGF – růstový faktor keratinocytů
- KLH – hemocyanin z měkkýše Megathura crenulata
- MALT – lymfatická tkáň asociovaná se sliznicí
- MBP – myelinový bazický protein
- MHC II DR – hlavní histokompatibilní komplex DR
- MICA – gen A příbuzný MHC I
- NALT – lymfatická tkáň asociovaná s nosní sliznicí
- NK – přirozený zabíječ (natural killer)
- NKG2D – lektinům podobný receptor NK-buněk rodina K, člen 1
- NKT – populace NK buněk exprimující invariantní TcRα a variabilní TcRß
- PB – proteinová tělíska
- pIgA – polymerní IgA
- pIgM – polymerní IgM
- pIgR – receptor pro polymerní imunoglobulin
- PRR – receptor molekulárních motivů
- RA – kyselina retinová
- S-IgA – sekreční IgA
- SLPI – sekreční inhibitor lymfocytárních proteáz
- TcR – receptor T-lymfocytů
- TGF – transformující růstový faktor
- Th-lymfocyt – pomocný T-lymfocyt
- TLR – Toll-like receptor
- Treg – regulační T-lymfocyt
Práce vznikla za podpory grantů MSM6198959223, MSM0021620812 a 2B06155 Ministerstva školství, mládeže a tělovýchovy ČR.
Adresa pro korespondenci:
MUDr. Milan Raška, Ph.D.
Ústav imunologie LF UP
Hněvotínská 3, 772 00 Olomouc
e-mail: raskamil@uab.edu
Sources
1. Mestecky J, et al. Selective induction of an immune response in human external secretions by ingestion of bacterial antigen. J Clin Invest 1978; 61 : 731–737.
2. Mestecky J, et al. Perspectives on mucosal vaccines: is mucosal tolerance a barrier? J Immunol 2007; 179 : 5633–5638.
3. Savage DS. Mucosal Microbiota. In: Mestecky J, et al. Mucosal Immunology. Amsterdam, Boston: Elsevier Academic Press 2005; 19–34.
4. Orndorff PE, et al. Immunoglobulin-mediated agglutination of and biofilm formation by Escherichia coli K-12 require the type 1 pilus fiber. Infect Immun 2004; 72 : 1929–1938.
5. Bollinger RR, et al. Human secretory immunoglobulin A may contribute to biofilm formation in the gut. Immunology 2003; 109 : 580–587.
6. Frank DN, et al. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proc Natl Acad Sci USA 2007; 104 : 13780–13785.
7. Gill SR, et al. Metagenomic analysis of the human distal gut microbiome. Science 2006; 312 : 1355–1359.
8. Mestecky J, et al. Specific antibody activity, glycan heterogeneity and polyreactivity contribute to the protective activity of S-IgA at mucosal surfaces. Immunol Lett 2009; 124 : 57–62.
9. Kiyono H, et al. The Mucosal Immune System. In Paul WE. Fundamental Immunology. Philadelphia: Wolters Kluwer / Lippincott Williams & Wilkins 2008; 983–1030.
10. Gordon J, et al. Functional evidence for a single endodermal origin for the thymic epithelium. Nat Immunol 2004; 5 : 546–553.
11. Matsumoto K, et al. Liver organogenesis promoted by endothelial cells prior to vascular function. Science 2001; 294 : 559–563.
12. Tlaskalova-Hogenova H, et al. Interaction of mucosal microbiota with the innate immune system. Scand J Immunol 2005; 62(Suppl 1): 106–113.
13. Fritz JH, et al. Innate immune recognition at the epithelial barrier drives adaptive immunity: APCs take the back seat. Trends Immunol 2008; 29 : 41–49.
14. Cerutti A, et al. The biology of intestinal immunoglobulin A responses. Immunity 2008; 28 : 740–750.
15. Kawai T, et al. The roles of TLRs, RLRs and NLRs in pathogen recognition. Int Immunol 2009; 21 : 317–337.
16. Artis D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut. Nat Rev Immunol 2008; 8 : 411–420.
17. Stephens HA. MICA and MICB genes: can the enigma of their polymorphism be resolved? Trends Immunol 2001; 22 : 378–385.
18. Wu Y, et al. Human gamma delta T cells: a lymphoid lineage cell capable of professional phagocytosis. J Immunol 2009; 183 : 5622–5629.
19. Czerkinsky C, et al. Sublingual vaccination. Hum Vaccin 2011; 7 : 110–114.
20. Kweon MN. Sublingual mucosa: A new vaccination route for systemic and mucosal immunity. Cytokine 2011; 54 : 1–5.
21. Wold AE, et al. Secretory immunoglobulin A carries oligosaccharide receptors for Escherichia coli type 1 fimbrial lectin. Infect Immun 1990; 58 : 3073–3077.
22. Novak J, et al. IgA nephropathy and Henoch-Schoenlein purpura nephritis: aberrant glycosylation of IgA1, formation of IgA1-containing immune complexes, and activation of mesangial cells. Contrib Nephrol 2007; 157 : 134–138.
23. Renfrow MB, et al. Analysis of O-glycan heterogeneity in IgA1 myeloma proteins by Fourier transform ion cyclotron resonance mass spectrometry: implications for IgA nephropathy. Anal Bioanal Chem 2007; 389 : 1397–1407.
24. Sun JB, et al. Cholera toxin B subunit: an efficient transmucosal carrier–delivery system for induction of peripheral immunological tolerance. Proc Natl Acad Sci USA 1994; 91 : 10795–10799.
25. Sun JB, et al. Oral tolerance induction with antigen conjugated to cholera toxin B subunit generates both Foxp3+CD25+ and Foxp3-CD25 - CD4+ regulatory T cells. J Immunol 2006; 177 : 7634–7644.
26. Sun JB, et al. Treatment of experimental autoimmune encephalomyelitis by feeding myelin basic protein conjugated to cholera toxin B subunit. Proc Natl Acad Sci U S A 1996; 93 : 7196–7201.
27. Lowney ED. Suppression of contact sensitization in man by prior feeding of antigen. J Invest Dermatol 1973; 61 : 90–93.
28. Zinkernagel RM, et al. Antiviral immunity. Immunol Today 1997; 18 : 258–260.
29. Altmeyer R, et al. Attenuated Mengo virus: a new vector for live recombinant vaccines. J Virol 1995; 69 : 3193–3196.
30. Goossens PL, et al. Listeria monocytogenes: a live vector able to deliver heterologous protein within the cytosol and to drive a CD8 dependent T cell response. Biologicals 1995; 23 : 135–143.
31. Castrucci MR, et al. Protection against lethal lymphocytic choriomeningitis virus (LCMV) infection by immunization of mice with an influenza virus containing an LCMV epitope recognized by cytotoxic T lymphocytes. J Virol 1994; 68 : 3486–3490.
32. Dollenmaier G, et al. Membrane-associated respiratory syncytial virus F protein expressed from a human rhinovirus type 14 vector is immunogenic. Virology 2001; 281 : 216–230.
33. Lee JS, et al. Viral vectors for use in the development of biodefense vaccines. Adv Drug Deliv Rev 2005; 57 : 1293–1314.
34. Phillpotts RJ, et al. Intranasal immunisation with defective adenovirus serotype 5 expressing the Venezuelan equine encephalitis virus E2 glycoprotein protects against airborne challenge with virulent virus. Vaccine 2005; 23 : 1615–1623.
35. Ada G. Overview of vaccines and vaccination. Mol Biotechnol 2005; 29 : 255–272.
36. Czerkinsky C, et al. Topical immunization strategies. Mucosal Immunol 2010; 3 : 545–555.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Perspectives of health care and system of health services
- Strategic dominance of the mucosal immune system in the defence and tolerance
- Problems with placement and using of automated external defibrillators in Czech Republic
- Human dignity and medical ethics
- Preparation of the Eighth Framework Programme of the European Union – Health Priority (European Commission organizes proposal of aims in biomedical research prospecting to 2020)
- The impact of neuroprotection on brain metabolism during carotid endarterectomy
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Human dignity and medical ethics
- Strategic dominance of the mucosal immune system in the defence and tolerance
- Problems with placement and using of automated external defibrillators in Czech Republic
- Perspectives of health care and system of health services
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

