-
Medical journals
- Career
Reaktivní kyslíkové a dusíkové sloučeniny v klinické medicíně
Authors: Jaroslav Macášek; Miroslav Zeman; Marek Vecka; Lucie Vávrová; Jana Kodydková; Eva Tvrzická; Aleš Žák
Authors‘ workplace: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
Published in: Čas. Lék. čes. 2011; 150: 423-432
Category: Review Articles
Overview
V poslední době dochází k rychlému růstu poznatků o reaktivních kyslíkových a dusíkových sloučeninách (RONS, reactive oxygen and nitrogen species) v klinické medicíně. Jejich významná úloha byla popsána v patogenezi mnoha chorob včetně těch, které značně zatěžují zdravotnické systémy vyspělých států. Výzkumu reaktivních kyslíkových a dusíkových radikálů je proto věnováno velké úsilí. Jedná se o nestabilní částice ochotně reagující s biomolekulami v organismech. Tyto reakce se řetězově propagují a vedou k mnohočetnému poškození buněčných systémů, což se uplatňuje v patogenezi mnoha chorob. Chemickou podstatou těchto částic je přítomnost nespárovaného elektronu v zevním orbitalu. Patří sem také sloučeniny snadno oxidující jiné molekuly. Volné kyslíkové radikály vznikají během fyziologických procesů, jako jsou oxidativní fosforylace v mitochondriích, fagocytóza či při metabolismu purinů. Při nadměrné tvorbě ROS během těchto procesů může dojít k poškození tkáně. Dusíkaté radikály vznikají především při metabolismu oxidu dusnatého, který reguluje mnoho procesů v organismu, rozpřažením jeho syntézy působením např. asymetrického dimetylargininu. Při vzniku radikálů či oxidačně působících látek hrají roli mnohé enzymy jako peroxizomální oxidázy, NAD(P)H oxidáza, xanthinoxidáza, syntáza NO, myeloperoxidáza, lipooxygenáza a mnoho dalších. RONS svůj negativní účinek zprostředkovávají chemickou modifikací DNA, proteinů a lipidů, čímž zasahují do základních biochemických a molekulárně biologických dějů buněk. Proti působení RONS zasahují antioxidační systémy, které se dělí na enzymatické a neenzymatické. RONS se uplatňují v rozvoji mnoha chorobných stavů, z nichž jmenujme aterosklerózu a její kardiovaskulární komplikace, diabetes mellitus, hyperlipidémii, neurodegenerativní či psychiatrická onemocnění.
Klíčová slova:
RONS, radikály, superoxidový anion, radikál oxidu dusnatého, antioxidanty, ateroskleróza, diabetes mellitus, neurodegenerativní a psychiatrická onemocnění.ÚVOD
V klinické medicíně je dnes věnována velká pozornost pochodům spojeným s oxidačním stresem a působením reaktivních sloučenin kyslíku a dusíku (RONS – reactive oxygen and nitrogen species). Mezi tyto látky patří nejen volné radikály, ale i sloučeniny, které nejsou v chemickém slova smyslu radikály, ale snadno oxidují jiné látky, nebo se na radikály mění. Většina chemických sloučenin obsahuje v zevních orbitalech spárované elektrony. Tzv. volné radikály obsahují v zevním orbitalu jeden nepárový elektron, což je pro ně energeticky nevýhodné, a tudíž se snaží spárovat elektron vazbou s jiným atomem či molekulou. Získáním elektronu od jiného atomu či molekuly (redukce) nebo jeho odevzdáním na jiný atom či molekulu (oxidace) přejde atom či molekula do energeticky stabilnějšího stavu s nižší reaktivitou. Mezi radikály v organismu patří například superoxidový anion ·O2-, oxid dusnatý ·NO, nebo hydroxylový radikál ·OH. Mezi neradikálové reaktivní substance patří například peroxid vodíku (H2O2), kyselina chlorná (HClO) a peroxynitrit (ONOO-). Příklady nejdůležitějších reaktivních látek jsou uvedeny v tabulce 1.
Table 1. Přehled reaktivní sloučenin kyslíku a dusíku 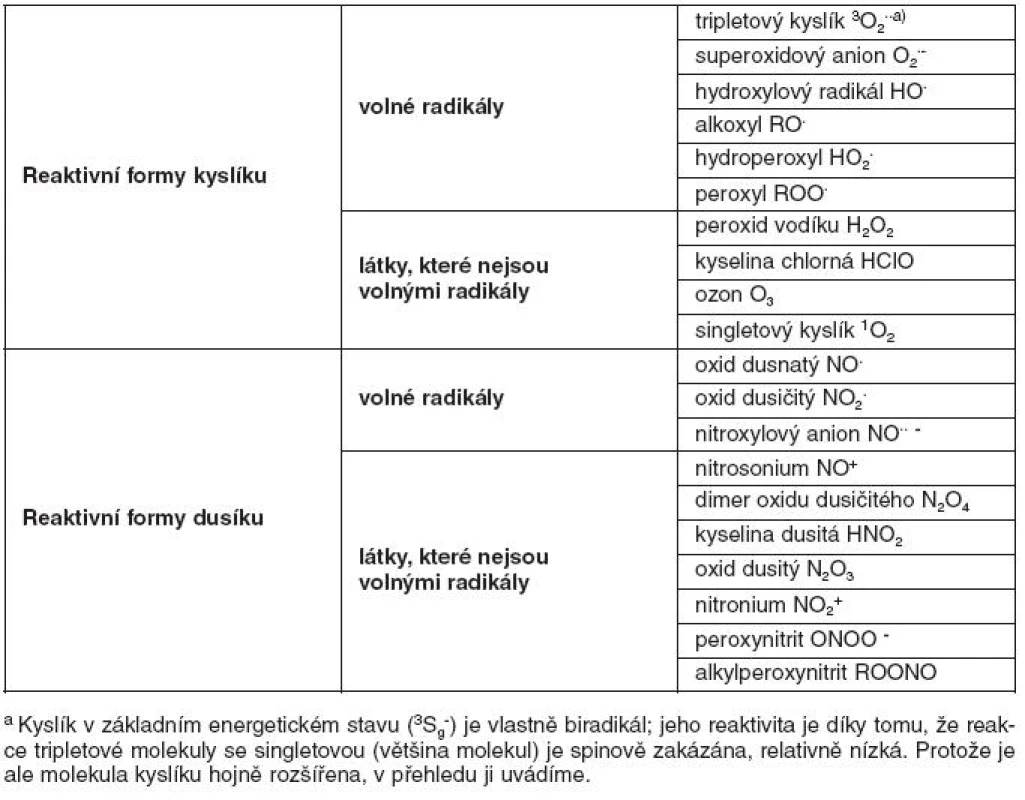
Reaktivní formy kyslíku i dusíku vznikají v průběhu metabolických pochodů u všech aerobních organismů. Na jejich vzniku se podílejí i vnější vlivy, jako je ionizační záření, xenobiotika, toxiny či léky. Buňky a tkáně živých organismů jsou před poškozením těmito látkami chráněny antioxidačními ochrannými systémy (enzymatickými i neenzymatickými). V organismu však RONS nepůsobí pouze jako patogeny, ale podílejí se také na obraně vůči infekčním agens a v přiměřených koncentracích ovlivňují signální transdukci a genovou transkripci, přičemž oxid dusnatý (NO·) je jednou z nejvýznamnějších signálních molekul v lidském organismu (1).
Nadměrná tvorba a/nebo nedostatečné odstraňování RONS, resp. zvýšený poměr prooxidační k antioxidační aktivitě je označována pojmem oxidační stres (OS) (2). V důsledku OS může dojít k: 1. adaptaci buňky nebo organismu se zvýšením aktivity obranných systémů, 2. poškození buňky s oxidativní modifikací lipidů, DNA, proteinů, sacharidů atd., 3. buněčné smrti (3). Oxidační stres podle současných názorů hraje roli zejména u onemocnění, v jejichž patogenezi se uplatňuje zánět, který je s OS spojen. Jde o řadu rozšířených chorob, jako je ateroskleróza a její komplikace (ischemická choroba srdeční – ICHS), ischemická kolitida, ischemické cévní mozkové příhody, arteriální hypertenze, diabetes mellitus, neurodegenerativní neurologická onemocnění (Alzheimerova nemoc, roztroušená skleróza, Parkinsonova nemoc), psychiatrická onemocnění (schizofrenie, deprese) i zhoubné nádory (4).
ZDROJE A VZNIK RONS V LIDSKÉM ORGANISMU
Reaktivní sloučeniny kyslíku (ROS)
K nejvýznamnějším ROS se počítají superoxidový anion ·O2 , hydroxylový radikál ·OH a látka neradikálové povahy peroxid vodíku H2O2. K hlavním zdrojům ·O2- patří v lidském organismu reakce provázející oxidativní fosforylaci v mitochondriích, reakce katalyzované peroxizomálními oxidázami, NAD(P)H oxidázami, xantinoxidázou nebo jednoelektronová redukce kyslíku syntázami NO v případě deficitu argininu nebo tetrahydrobiopterinu (obr. 1).
Image 1. Vznik reaktivních forem kyslíku v lidském organismu a jejich další osud (dle 6, 19) vit – vitamin, GSH – glutathion, GSSG – glutathion disulfid, GPx – glutahion peroxidáza, GRed – glutathion reduktáza, GST – glutathion S-transferáza, TRRed – thioredoxin reduktáza, CAT – kataláza, LH – mastná kyselina, SOD – superoxid dismutáza 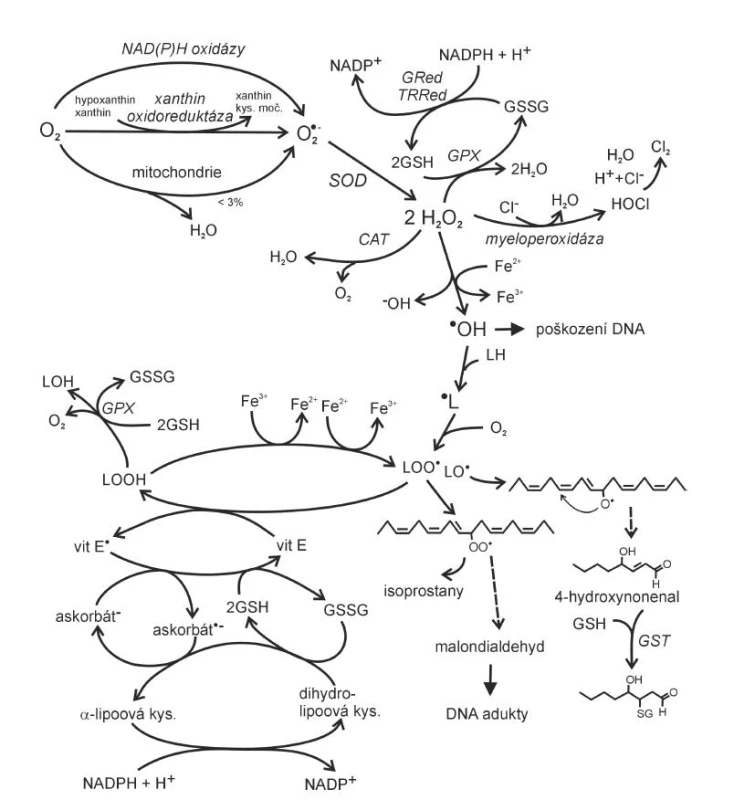
Při oxidativní fosforylaci probíhá v dýchacím řetězci v mitochondriích redukce molekuly atmosférického kyslíku na dvě molekuly vody, spojená s tvorbou ATP (4). Redukce molekulárního kyslíku na vodu vyžaduje celkem čtyři elektrony, pokud se uskuteční transfer pouze jednoho elektronu, vzniká superoxidový anion (4).
O2 + e - → O2·-[1]
Na superoxidový anion je převedeno až 3 % molekul mitochondriálního kyslíku (5). NAD(P)H oxidáza je enzym vázaný na buněčnou membránu, který používá elektrony pocházející z NADPH k redukci molekulárního kyslíku na ·O2-:
NAD(P)H + 2 O2 → NAD(P)+ + H+ + 2 ·O2-[2]
Enzym se nachází v neutrofilních leukocytech, monocytech či makrofázích, kde je zdrojem velkého množství ·O2-, který má baktericidní účinky. Strukturálně poněkud odlišná je NAD(P)H oxidáza obsažena v endotelu cév. Její produkce ·O2- je ve srovnání s formou obsaženou ve fagocytech o několik řádů nižší. Aktivita cévní NAD(P)H oxidázy a následná tvorba ·O2- je zvyšována působením řady faktorů účastnících se v patogenezi aterosklerózy, jako jsou angiotenzin II působící vazokonstrikci, PDGF (platelet derived growth factor) působící hyperplazii hladkých svalových buněk nebo trombin (6). Superoxid vzniká také působením enzymu xantinoxidoreduktázy. Tento flavoproteinový enzym obsahující molybden existuje ve dvou formách: xanthin oxidáza (XO) a xantin dehydrogenáza (XD). Enzym katalyzuje postupnou oxidativní hydroxylaci hypoxanthinu na xanthin a dále na kyselinu močovou (ve formě XD), ale může také redukovat kyslík na ·O2- (forma XO). Je zajímavé, že je lokalizován hlavně v endoteliálních a epiteliálních buňkách, což dobře nekoresponduje s jeho funkcí v metabolismu purinů, ale spíše naznačuje význam v systému antimikrobiální ochrany (7). Xantinoxidáza hraje významnou úlohu v patofyziologii reperfuzního syndromu. Při hypoxii způsobené nedostatečným přívodem kyslíku krví (nízká perfuze tkání např. při infarktu myokardu) dochází k vzestupu hladiny ADP, který je za fyziologických okolností přeměňován působením XO na hypoxantin, xantin a močovou kyselinu. Při hypoxii je enzym inhibován; poté, co dojde k reperfuzi a opětovnému obnovení dodávky kyslíku, zvýší XO svoji aktivitu s cílem odstranit nahromaděné ADP a jako vedlejší produkt jsou ve zvýšeném množství produkovány enzymem XO i ROS s následným paradoxním prohloubením poškození po obnově dodávky kyslíku.
Vznikající ·O2- je působením enzymu superoxid dismutázy (SOD) přeměňován na H2O2, ze kterého pak účinkem lyzozomální katalázy nebo mitochondriální glutathion peroxidázy (GPx) vzniká voda a kyslík (obr. 2).
Image 2. Vznik a působení reaktivních forem dusíku (dle 6, 11, 16, 17) BH4 – tetrahydrobiopterin, eNOS – endoteliální syntháza NO, sGC – solubilní guanylát cykláza, cGMP – cyklický guanylmonofosfát 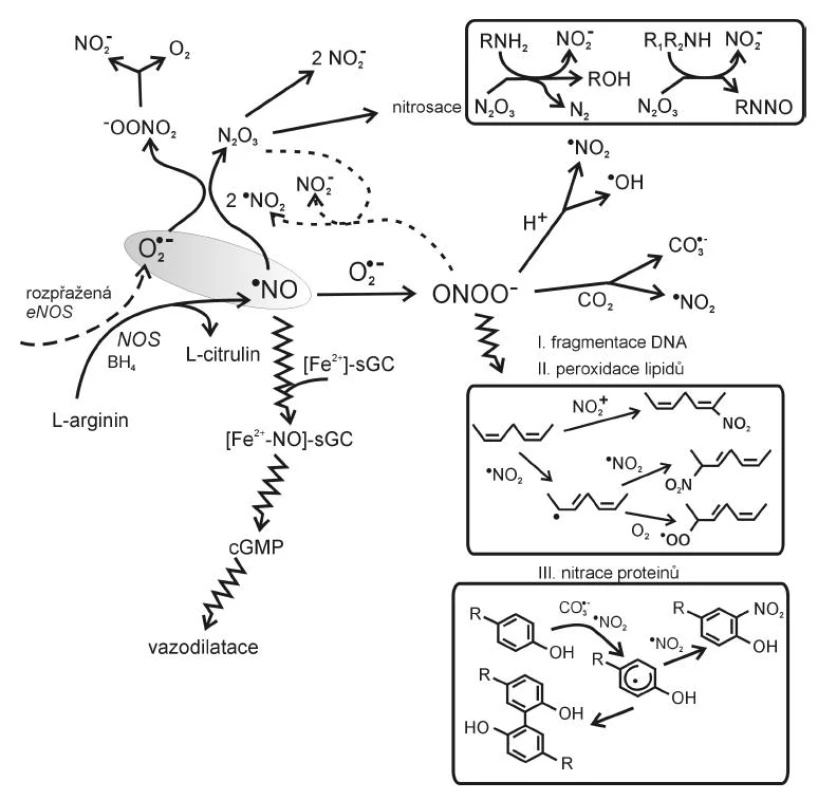
Glutathion, používaný GPx jako donor vodíku během eliminace H2O2, je regenerován glutathion reduktázou (GR). Součástí obranných mechanismů lidského organismu proti infekčním agens je také enzym myeloperoxidáza (MPO), nacházející se v azurofilních granulech neutrofilů a lyzozomech monocytů. Enzym, který hraje roli ve fagocytóze, vytváří kyselinu chlornou (HClO) z peroxidu vodíku (H2O2) a chloridů. Reakce HClO se superoxidem může vést ke vzniku mimořádně reaktivního hydroxylového radikálu (8).
HOCl + ·O2- → ·OH + Cl- + O2 [3]
HOCl + Fe2+ → ·OH + Cl - + Fe3+[4]Chlornanové anionty reagují také s nízkomolekulárními aminy za vzniku chloraminů, které stejně jako chlornany mají silný baktericidní účinek (4). Hemo-peroxidázy, jako je MPO i eozinofilní peroxidázy, katalyzují také v přítomnosti H2O2 a nitritu NO2- nitraci tyrozinu v proteinech, a mohou tak nepříznivě modifikovat jejich funkci, jako např. v případě apolipoproteinu A 1 a apolipoproteinu B.
Reaktivní sloučeniny dusíku
Mezi nejvýznamnější reaktivní formy dusíku patří radikál oxidu dusnatého·NO a peroxynitrit ONOO-. Radikál oxidu dusnatého ·NO je tvořen oxidací L-argininu působením syntázy oxidu dusnatého (NOS) za vzniku citrulinu a NO. U člověka lze rozlišit tři hlavní izoformy NOS: endoteliální NOS (eNOS), inducibilní (iNOS) a neuronální (nNOS). nNOS a eNOS jsou konstitutivně exprimované enzymy, aktivované vzestupem hladiny intracelulárního kalcia (Ca2+). Ca2+ se váže na kalmodulin a komplex Ca2+/kalmodulin aktivuje nNOS nebo eNOS. iNOS obsahuje pevně vázaný kalmodulin s kalciem a její syntéza je indukována zánětlivými cytokiny, jako je interleukin-1 (IL-1), tumor nekrotizující faktor alfa (TNF-α), interferon gamma (IFN-γ), ale i antigeny bakterií a nádorových buněk.
Za fyziologických okolností se ·NO významně podílí na tzv. endotel-dependentní vazodilataci a regulaci cévního tonu, má protizánětlivé účinky, inhibuje agregaci krevních destiček a adhezi leukocytů i destiček na endotel a reguluje proliferaci a diferenciaci buněk cévní stěny. V buňce hladkého svalu cévy aktivuje ·NO enzym guanylát cyklázu. Aktivace guanylát cyklázy vede k syntéze cyklického GMP a k vazorelaxaci.
Ke správné funkci vyžadují NOS pět kofaktorů: flavinadenindinukleotid (FAD), flavinmononukleotid (FMN), hem, tetrahydrobiopterin (BH4) a Ca2+-kalmodulin. Jestliže chybí L-arginin – substrát pro NOS nebo jeden z jeho kofaktorů, může NOS produkovat ·O2- místo ·NO, což je označováno jako rozpřažený (uncoupled) stav NOS (9). K rozpřažení reakce vede též zvýšení hladiny inhibitoru NOS, asymetrického dimetylargininu (ADMA), jehož zvýšené koncentrace jsou spojeny s endoteliální dysfunkcí u hypercholesterolémie, inzulínové rezistence či hyperhomocysteinémie. Rozpřažení eNOS v cévní stěně působí oxidační stres jednak poklesem tvorby ·NO, jednak zvýšenou tvorbou ·O2-. Pokud jsou tvořeny současně ·NO a ·O2-, vzniká toxický peroxynitrit ONOO-. Peroxynitrit reaguje s CO2, který je v tělesných tekutinách obsažen ve vysokých koncentracích, a vytváří jednoelektronové oxidanty ·NO2 a CO3·-, které oxidací aminokyseliny tyrozinu vedou ke vzniku tyrozinového radikálu Tyr· a následně 3-nitrotyrozinu, 3-NO2-Tyr . Z ONOO- může také vzniknout ·OH, působící peroxidaci lipidů, mutace DNA, jejich fragmentaci nebo modifikace proteinů (obr. 2). Peroxynitrit vedle přímého toxického působení oxiduje BH4, což rovněž přispívá k rozpřažení eNOS.
Lipoxygenáza
Lipoxygenázy jsou dioxygenázy obsahující železo, které katalyzují stereospecifickou inzerci molekulárního kyslíku do molekuly vícenenasycené mastné kyseliny. Aktivní forma enzymu obsahuje v katalytickém centru trojmocné železo, forma lipoxygenázy s dvojmocným železem není aktivní. Působení lipoxygenáz na kyselinu arachidonovou vede k tvorbě 5-, 11 - a 15 - hydroperoxyeikosatetraenových mastných kyselin (HPETE), které jsou v tkáních rychle redukovány na odpovídající hydroxyeikosatetraenové kyseliny (HETE), jako jsou 5S hydroxy-6t,8c,11c,14c-, 12S-hydroxy-5c,8c,10t,14c - a 15S-hydroxy-5c,8c,11c,13t-eikosatetraenové mastné kyseliny (10). Z těchto derivátů jsou 5-hydroxy izomery předchůdci biologicky aktivních leukotrienů a lipoxinů (obr. 3), které hrají významnou roli v patofyziologii zánětu. 5-HETE má chemotaktický účinek na neutrofily, leukotrien B4 (LTB4) působí chemotakticky na fagocyty, LTC4, LTD4 a LTA4 působí vazokonstrikci, bronchokonstrikci a zvyšují permeabilitu cév. Lipoxiny mají naopak účinky protizánětlivé.
Image 3. Metabolizmus eikosanoidů HETE – hydroxyeikosatetraenová kyselina, HPETE – hydroperoxyeikosatetraenová kyselina, LO-x – lipoxygenáza, COX – cyklooxygenáza, LX – lipoxiny, LT – leukotrieny, cysLT – cysteinylleukotrieny 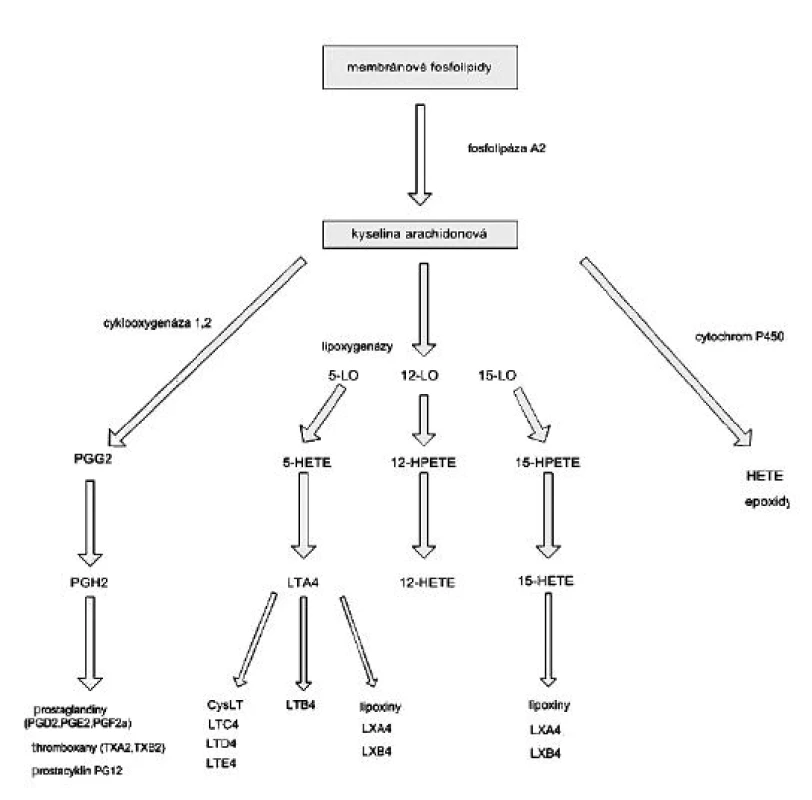
Myeloperoxidáza
Myeloperoxidáza (MPO) je enzym, obsahující hem, který se nachází v azurofilních granulech neutrofilů a lyzozomech monocytů. Enzym vytváří kyselinu chlornou (HClO) z peroxidu vodíku (H2O2) a chloridů. MPO hraje roli při fagocytóze a produkty jejího působení se podílejí na destrukci bakterií, intracelulárních parazitů i nádorových buněk. Reakce kyseliny chlorné se superoxidem může vést ke vzniku mimořádně reaktivního hydroxylového radikálu (8). Chlornanové anionty reagují také s nízkomolekulárními aminy za vzniku chloraminů, které stejně jako chlornany mají silný baktericidní účinek (4). Hemo-peroxidázy, jako je MPO i eozinofilní peroxidázy, katalyzují také v přítomnosti H2O2 a nitritu NO2- nitraci tyrozinu v proteinech, a mohou tak nepříznivě modifikovat jejich funkci, jako např. v případě apolipoproteinu A-1 a apolipoproteinu B. Oxidované produkty působení MPO jsou ve vysokých koncentracích prokazovány v částicích LDL lokalizovaných v aterosklerotických plátech. Předpokládá se, že aktivita MPO souvisí s vulnerabilitou ateromových plátů (11). MPO může také modifikovat lipoprotein HDL, což vede k poruše reverzního transportu cholesterolu. Nejvyšší kvartily MPO v krvi a leukocytech významně korelovaly s přítomností koronární aterosklerózy. Ve studii u nemocných s AKS předpovídaly hladiny MPO rozvoj IM nezávisle na jiných rizikových faktorech, jako např. CRP (12). Zdá se, že MPO je významným činitelem, podílejícím se na destabilizaci ateromového plátu a stanovení MPO by mohlo sloužit jako nezávislý prognostický ukazatel u nemocných přijatých k observaci pro bolest na hrudi.
MECHANISMY PŮSOBENÍ REAKTIVNÍCH ČÁSTIC
Nukleové kyseliny, lipidy a proteiny mohou být poškozeny působením RONS, což může vést až k buněčné smrti (5). Jejich působení není však jen nepříznivé, aktivují také různé buněčné signální kaskády, které regulují proliferaci, detoxifikaci, reparaci DNA nebo apoptózu. V případě snížené tvorby RONS může dojít k poruše imunitní odpovědi na cizorodou noxu nebo k poruše proliferace. V závislosti na koncentraci a typu RONS mohou být aktivovány buď signální cesty protektivní (např. reparace DNA) anebo buněčná apoptóza.
Poškození lipidů
Působením radikálové látky, nejčastěji ·OH, na lipidy, zejména na vícenenasycené mastné kyseliny (polyunsaturated fatty acids, PUFA), vede k lipoperoxidaci (viz obr. 2). Oxidující látka vytrhne elektron z metylenové skupiny uhlovodíkového řetězce PUFA (-CH2-) za vzniku lipidového radikálu (L·). Po vytržení vodíku dojde ke změně elektronového uspořádání v uhlovodíkovém řetězci PUFA tak, že mezi dvěma dvojnými vazbami je jedna vazba jednoduchá (konjugovaný dien) (4). Konjugované dieny se snadno spojují s molekulárním kyslíkem za vzniku peroxylového radikálu LOO·. Peroxylový radikál může vytrhnout elektron ze sousední mastné kyseliny, která se stává radikálem, zatímco peroxyl se mění na hydroperoxid LOOH. Radikálová reakce se pak řetězovitě šíří dál (propagace), dokud není ukončena (terminace) setkáním radikálu mastné kyseliny s jiným radikálem nebo vitaminem E (4). Lipoperoxidačními pochody vznikají hydroperoxidy a cyklické peroxidy mastných kyselin, které v přítomnosti přechodných kovů (jako Ca2+, Fe2+) podléhají tzv. Fentonově reakci za vzniku alkoxylového radikálu LO· a hydroxidového aniontu OH.
LOOH + Fe2+ {Cu+} → LO· + Fe3+ {Cu2+} + OH - [5]
Lipoperoxidace nakonec vede ke vzniku stabilních látek, které lze laboratorně stanovit, jako je např. MDA (malondialdehyd) a nebo 4-hydroxynonenal (4-HNE). Malondialdehyd velmi ochotně reaguje s nukleofilními skupinami (aminoskupiny), a způsobuje tak modifikaci struktury a následně funkce proteinů (zesíťování kolagenu). Další produkt oxidace vícenenasycených mastných kyselin 4-hydroxynonenal, elektrofilní α,ß-nenasycený aldehyd, způsobuje kovalentní modifikaci DNA, což způsobuje vznik mutací, a proteinů signálních drah, a ovlivňuje tak genovou expresi zodpovědnou za produkci složek antioxidačního systému, heat shock proteinů a proteinů účastnících se reparace poškozené DNA. 4-hydroxynonenal je též užíván jako biomarker oxidativního poškození buněk. Jinými významnými produkty působení oxidačního stresu na lipidy jsou F2-izoprostany (13). Izoprostany jsou látky podobné F2-prostaglandinu vznikající neenzymatickou peroxidací kyseliny arachidonové působením radikálů. F2-izoprostany však in vivo prodělávají další přeměnu v E2-, D2-, A2-, J2-izoprostany, izotromboxany a vysoce reaktivní ketoaldehydy zvané izoketaly. Podobné sloučeniny vznikají též z kyseliny dokosahexaenové, která je hojná v neuronech, a proto se sloučeniny vzniklé její radikálovou neenzymatickou peroxidací nazývají neuroprostany či neuroketaly. F2-izoprostany jsou nejenom markery lipoperoxidace, ale jako ligandy specifických receptorů způsobují i vazokonstrikci. U různých onemocnění (např. diabetu) dochází ke vzniku oxidativně modifikovaných LDL částic tzv. oxLDL, jejichž hlavními komponentami jsou 9-hydroxy-10,12-oktadekadienová (9-HODE) a 13-hydroxy-9,11-oktadekadienová (13-HODE) kyselina. Vznikají působením ROS na linolovou kyselinu. Bylo zjištěno, že 9-HODE i 13-HODE jsou endogenními aktivátory PPAR-γ (peroxisome proliferator-activated receptor gamma) a hrají významnou úlohu například při rozvoji diabetické nefropatie tím, že stimulují mezangiální proliferaci.
Poškození DNA
Podobně jako lipidy jsou nukleové kyseliny poškozovány především ·OH. Hydroxylový radikál reaguje se všemi složkami DNA a poškozuje jak purinové, tak pyrimidinové báze i strukturu deoxyribózy. Dochází k vyjmutí vodíkového atomu z deoxyribózy s následnou destrukcí sacharidu a přerušení řetězce. Hydroxylový radikál vytváří addukty s purinovými i pyrimidinovými bázemi a modifikované báze pak slouží jako marker poškození DNA, např. 8-hydroxydeoxyguanozin (8-OH-dG), 8-hydroxy-guanin a 8-hydroxy-guanozin (4). Modifikace nukleových kyselin pak vede k chybným párováním bázi při replikaci DNA a k následným změnám genetické informace.
Poškození bílkovin
Oxidativní modifikace poškozuje strukturu bílkovin. Oxidace aminokyselin v proteinech vede k nevratným změnám. Dochází k fragmentaci a agregaci bílkovin. V důsledku konformačních změn se zvyšuje citlivost k proteolytickému štěpení. Citlivost proteinů vůči oxidaci je ovlivňována také přítomností iontů kovů schopných katalyzovat reakci Fentonova typu (14). Modifikovány jsou zejména aminokyseliny postranních řetězců, zejména cystein a methionin, přičemž oxidací cysteinových zbytků vznikají smíšené disulfidy mezi thiolovými skupinami bílkovin (-SH) a nízkomolekulárními thioly, zejména GSH (15). Oxidace proteinů vede také k fragmentaci polypeptidových řetězců a k intra - i intermolekulárnímu síťování (cross-linking). Takto modifikované proteiny snáze podléhají degradaci. Je známo, že glykovaný kolagen zvyšuje tvorbu malondialdehydu a 4-hydroxynonenalu, produktů oxidace vícenenasycených mastných kyselin. Malondialdehyd je velice reaktivní sloučenina vytvářející vazby především s amino-skupinami aminokyselin, což zapříčiňuje zesíťování proteinů a ztrátu jejich funkce. U diabetiků se zvyšuje glykace kolagenu, jenž se působením malondialdehydu zesíťuje a tento děj sekundárně urychluje rozvoj aterosklerózy.
ANTIOXIDAČNÍ SYSTÉM V LIDSKÉM ORGANISMU
Složité biochemické děje neustále probíhající v živých organismech vytvářejí RONS, které mohou mít jak nepříznivé, tak i příznivé účinky. Pro správné fungování metabolických procesů je tak nutné stále ustavovat rovnovážný stav mezi vznikem a odbouráváním RONS. K udržení homeostázy v situaci, kdy jsou neustále vytvářeny RONS, slouží systém antioxidantů (tab. 2). Dříve se pomýšlelo, že RONS mají pouze negativní účinky, ukázalo se však, že mají i příznivé účinky. V leukocytech slouží k likvidaci infekčních částic cestou respiračního vzplanutí za účasti NADPH oxidázy, hrají důležitou úlohu v signálních dráhách (ovlivňují nukleární faktor κB, mitogen - activated proteinkinázu atd.), proliferaci, přežívání, migraci a adhezi buněk.
Table 2. Důležité komponenty antioxidačního systému (dle 30, 31, 36) 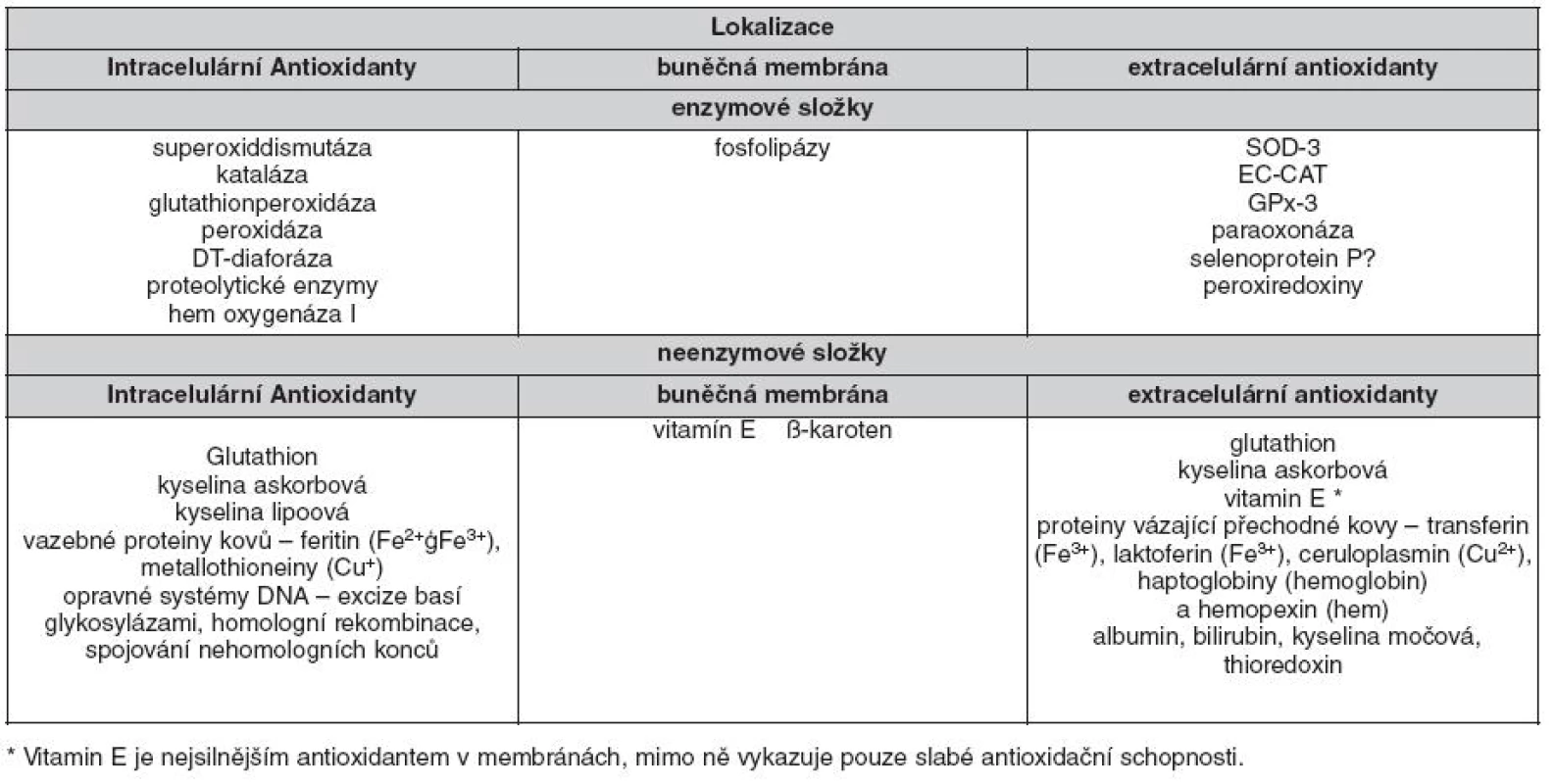
Enzymatické antioxidanty
Mezi enzymatické antioxidanty patří např. superoxid dismutáza (SOD), kataláza (CAT), glutathion peroxidáza, glutathion reduktáza. Enzymy glutathion peroxidáza a glutathion reduktáza se nacházejí v cytoplazmě, mitochondriích i v jádře. Glutathion peroxidáza mění H2O2 na vodu za spoluúčasti glutathionu (GSH) jako dárce vodíku. Vznikající glutathion disulfid (GSSG) je přeměňován zpět na GSH působením GR, jejímž kofaktorem je NADPH. Působením SOD dochází k přeměně ∑O2- na H2O2, který je detoxikován buď katalázou, která v lyzozomech rozkládá H2O2 na vodu a kyslík, nebo účinkem GPx v mitochondriích (viz obr. 1). Glutathion reduktáza regeneruje GSH, který je používán jako donor vodíku glutathion peroxidázou během eliminace H2O2.
Neenzymatické antioxidanty
Mezi neenzymatické antioxidanty patří vitaminy A, C a E, glutathion, kyselina alfa-lipoová, dále karotenoidy, stopové prvky jako měď, zinek a selen, koenzym Q10 (Co Q10) a kofaktory jako kyselina listová, vitaminy B1, B2, B6 a B12, dále též močovina, albumin či bilirubin. Hlavním intracelulárním antioxidantem je GSH, který působí jako přímý scavenger a současně jako kosubstrát pro GPx. Vitamin E je označení pro skupinu osmi příbuzných tokoferolů a tokotrienolů, které zabraňují peroxidaci lipidů. U lidí je nejaktivnější forma α-tokoferolu. Hydroxylový radikál reaguje s tokoferolem za vzniku stabilního fenolického radikálu, který je redukován zpět na fenol askorbátem a NAD(P)H dependentními reduktázami (16). Koenzym Q10 působí jako elektronový nosič v komplexu II mitochondriálního elektronového transportního řetězce. Je to v tucích rozpustný antioxidant, který ve vyšších koncentracích působí jako scavenger ∑O2- (17). Vitamin C (kyselina askorbová) stabilizuje kofaktor NOS, tetrahydrobiopterin (BH4), což podporuje tvorbu NO (18). Kyselina α-lipoová je hydrofilní antioxidant, působící jak ve vodném, tak v lipidovém prostředí. Její redukovaná forma, dihydrolipoát, je schopna regenerovat jiné antioxidanty, jako jsou vitamin C nebo vitamin E (18). Bilirubin je v poslední době intenzivně studován jako neenzymatický antioxidant. Kromě toho působí antiaterogenně tím, že inhibuje oxidaci LDL částic a lipidů obecně a pohlcuje kyslíkové radikály. Mnohé studie prokázaly inverzní vztah hladin bilirubinu k výskytu kardiovaskulárních chorob. Lidé s Gilbertovým syndromem (nekonjugovaná hyperbilirubinémie) mají nižší incidenci koronární choroby (19).
UPLATNĚNÍ RONS V KLINICKÉ MEDICÍNĚ
Volné radikály i ostatní RONS plní v organismu významné funkce. Jsou součástmi obranného systému organismu proti bakteriální infekci, intracelulárním parazitům, cizorodým látkám i nádorovým buňkám. V případě bakteriální infekce se v neutrofilních leukocytech a makrofázích aktivuje enzym NAD(P)H oxidáza, vzniká superoxidový anion. Takto aktivované buňky zvýší spotřebu O2 (tzv. oxidační nebo respirační vzplanutí, respiratory burst). Vznikající ∑O2- se přeměňuje na H2O2. Enzym myeloperoxidáza zase v polymorfonukleárních leukocytech katalyzuje tvorbu kyseliny chlorné z H2O2 a chloridového iontu. Významnou součástí obrany organismu proti různým mikrobům, intracelulárním parazitům i nádorovým buňkám, je aktivita iNOS. Exprese enzymu je indukována působením mikrobů a různých cytokinů a vede k produkci NO mnohem vyšší, než ke které dochází v důsledku aktivity eNOS. Současně vytvářený ∑O2- však působí zvýšení koncentrací peroxynitritu ONOO-, který má baktericidní účinky (4). V nízkých koncentracích se RONS podílejí na nitrobuněčných signálních pochodech. V tzv. signální transdukci je zprostředkován přenos informace přicházející zvenčí prostřednictvím hormonů, cytokinů, růstových faktorů či neurotransmiterů až do buněčného jádra. Transkripční faktory po vazbě na specifické sekvence DNA regulují aktivitu RNA polymerázy II. Některé signální cesty v buňce jsou zprostředkovány RONS, které v tomto případě hrají roli „druhotných poslů“ (second messengers). Pravděpodobně nejvýrazněji se RONS uplatňují při ovlivnění systému MAP kináz (mitogen associated protein kinase), který představuje kaskádu fosforylačních reakcí, ve kterých se postupně aktivují enzymy a další proteiny s výsledným ovlivněním jaderných transkripčních faktorů, regulujících buněčný růst, diferenciaci i apoptózu. Patří sem faktory NF-κB (nuclear factor kappa B), významný u zánětlivých procesů, AP-1 (activated protein-1), ovlivňující růst a diferenciaci buněk a p53, což je protein, který pomáhá udržovat stabilitu genomu (zásahem do reparačních mechanismů DNA a také do regulace proliferace a diferenciace buňky) (20).
VYBRANÁ ONEMOCNĚNÍ, V JEJICHŽ ETIOPATOGENEZI JSOU VÝZNAMNÉ VOLNÉ RADIKÁLY
Ateroskleróza a její komplikace
Aterosklerózu je možno charakterizovat jako chronické zánětlivé fibroproliferativní onemocnění, ve kterém hraje podstatnou roli proliferace hladkých svalových buněk (SMC) a makrofágů, tvorba pojivové tkáně buňkami hladké svaloviny a hromadění lipidů, zejména volného (FC) a esterifikovaného cholesterolu (CE), v buňkách a mezibuněčné hmotě. V aterogenezi hraje oxidační stres významnou roli. Uplatňuje se zejména ·O2-, H2O2 a ·NO. Nadměrná tvorba RONS vede k aterogenním a trombogenním změnám ve smyslu zvýšené adheze monocytů, agregace krevních destiček a porušené vazodilatace. Působením RONS jsou ve stěně cévy modifikovány LDL částice a vznikají tzv. minimálně modifikované a oxidované LDL (mmLDL – minimally modified and oxLDL-oxidized), mmLDL mají zoxidovanou pouze lipidovou složku a u oxLDL dochází k oxidační modifikaci i proteinové složky. Tyto částice následně inhibují vazodilataci a působí proaterogenně tím, že aktivují zánětlivou odpověď, proliferaci buněk, ale i jejich apoptózu. Syntéza proaterogenních adhezních molekul je zvyšována cytokiny (interleukiny, tumor necrosis factor alfa, angiotenzin II, endoteliální růstový faktor VEGF) mechanismy zahrnujícími RONS. Inaktivace ·NO působením ·O2- a zvýšená tvorba H2O2 inhibuje vazodilataci. Oxidační stres působí také zvýšenou apoptózu endoteliálních buněk cestou aktivace signální cesty proteinkinázy C (21). H2O2 i ·O2- významně ovlivňují migraci hladkých svalových buněk do cévní stěny indukcí MCP-1 (monocyte chemotactic protein 1) i proliferaci hladkých svalových buněk. Zvýšením sekrece i aktivity metaloproteinázy 9 se RONS podílejí i na zvýšeném odbourávání extracelulární matrix (22), což má význam při vývoji nestabilního ateromového plátu a následné trombózy.
Diabetes mellitus
U diabetes mellitus zvýšený oxidační stres pochází z několika zdrojů: 1. neenzymatické zdroje, tj. zejména hyperglykémie, 2. zdroje enzymatické, kde vznikají RONS v důsledku aktivity enzymů, hlavně NAD(P)H oxidázy, xanthinoxidázy, cyklooxygenázy a 3. mitochondriální elektronový řetězec v průběhu oxidativní fosforylace (23). Hyperglykémie zvyšuje tvorbu volných radikálů několika způsoby (24). Během tzv. autooxidace glukózy, katalyzované přechodnými kovy, dochází ke vzniku redukovaných kyslíkových derivátů, jako jsou ∑O2-, ∑OH a H2O2 ale i reaktivních ketoaldehydů. Glukóza je dále schopna vázat se neenzymaticky adicí k aminoskupině proteinu (glykace), tímto vznikají přes meziprodukt (Schiffovy báze) tzv. Amadoriho produkty. Důsledkem intramolekulárních přesmyků v Amadoriho produktech je vznik vysoce reaktivních dikarbonylových látek, glyoxalu, methylglyoxalu a 3-deoxyglukosonu. Řádově během týdnů jsou Amadoriho produkty po intra - a intermolekulárních přestavbách přeměňovány na novou třídu molekul, tzv. Maillardovy sloučeniny, neboli AGE (advanced glycation end products). U hyperglykémie se metabolismus glukózy ubírá i polyolovou cestou, která také vede ke zvýšené tvorbě ∑O2-. Glukóza je nejprve redukována aldozoreduktázou za účasti NADPH na sorbitol, ten je oxidován NAD+ s následným zvýšením poměru NADH/NAD+ v cytosolu (hyperglykemická pseudohypoxie).
Zdrojem zvýšené tvorby superoxidu ∑O2- jsou u diabetu vedle hyperglykémie také enzymatické aktivity NAD(P)H oxidázy, xanthinoxidázy i cyklooxygenázy, jejichž působením vzniká ∑O2- jednoelektronovou redukcí kyslíku. Se vzestupem hladiny ∑O2-, možná v důsledku poklesu BH4 jsou spojeny stavy spojené s inzulinovou rezistencí jako obezita, arteriální hypertenze a diabetes mellitus (25). Superoxid, tvořený v mitochondriálním systému za hyperglykemických podmínek, aktivuje enzym poly (ADP-ribóza) polymerázu (PARP). To působí inhibici glyceraldehydfosfát dehydrogenázy (GAPDH) s následným zvýšením koncentrace glyceraldehyd-3-fosfátu a aktivací 4 patologických mechanismů: 1. polyolové cesty, 2. glukozaminové cesty, 3. zvýšené tvorby methylglyoxalu a AGE, 4. vzniku diacylglycerolu (DAG), který aktivuje PKC (proteinkinázu C) (26). Aktivací PKC je možné vysvětlit některé cévní abnormality pozorované u diabetu (změny funkcí buněk endoteliálních, mezangiálních, buněk hladkého svalstva cév s výslednými změnami permeability, kontraktility a syntézy bazální membrány). PKC může také modulovat působení hormonů, růstových faktorů a iontových kanálů. Nástin působení oxidačního stresu v patofyziologii komplikací diabetu je podán na obrázku 4.
Image 4. Oxidační stres a hyperglykémie v patofyziologii diabetu (dle 26) COX-2 – izoforma 2 cyklooxygenázy, SOD – superoxid dismutáza, PKC – proteinkináza C, F-3-P – fruktóa 3-fosfatáza, GFAT – glutamin: fruktóza 6-fosfát aminotransferáza, Gln – glutamin, Glu – glutamát, PGs – prostaglandiny 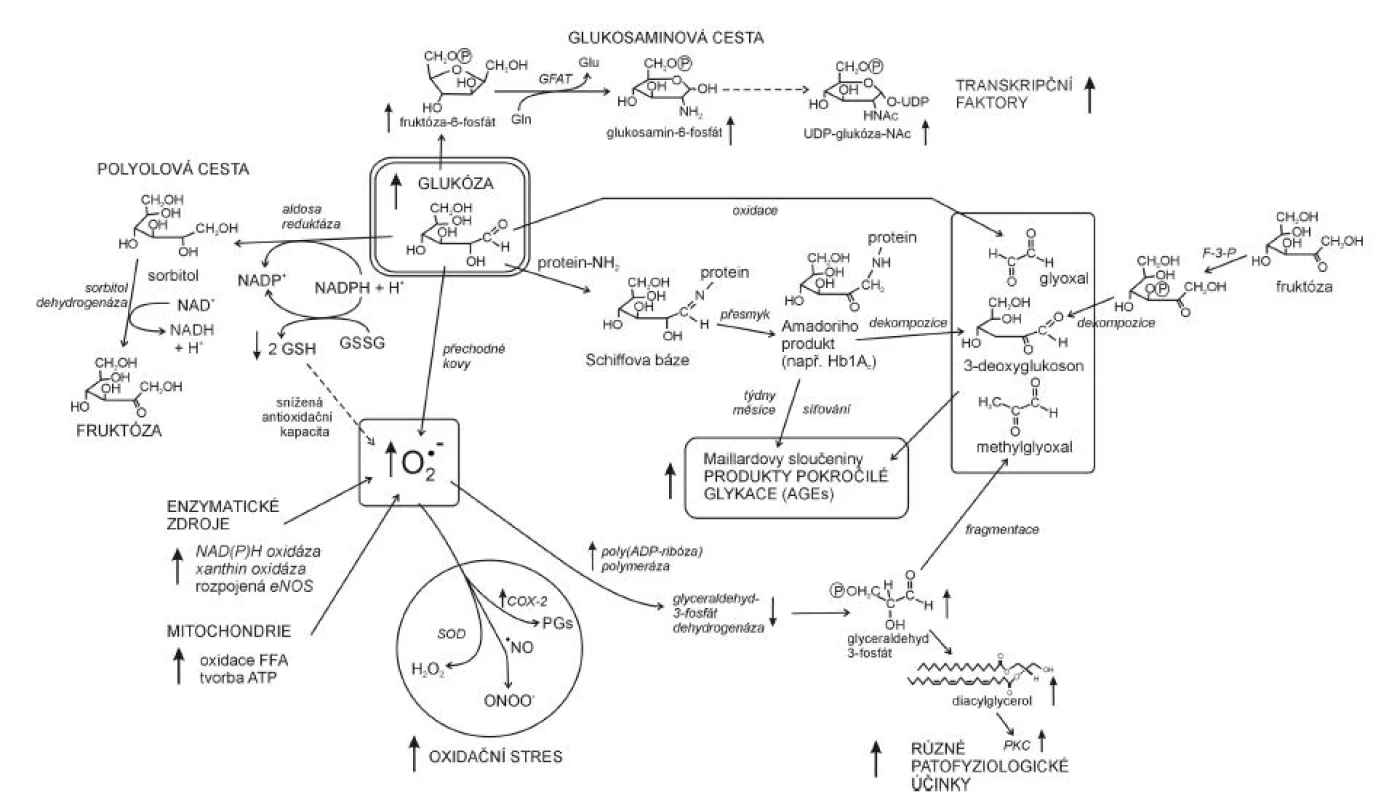
Hyperlipidémie
Hypercholesterolémie i hypertriglyceridémie (HTG) jsou zdrojem zvýšeného oxidačního stresu. Je u nich zjišťována zvýšená tvorba ∑O2-, zřejmě v důsledku zvýšené aktivity xantin oxidázy (27) a NAD(P)H oxidázy (28). Léčiva užívaná k léčbě těchto dvou stavů, statiny a fibráty, nesnižují pouze hladinu lipidů, ale mají tzv. pleiotropní účinky, mezi které patří i příznivé účinky na oxidační stres. U nemocných s HTG léčených fibráty byl popsán pokles hladiny konjugovaných dienů, prodloužení lag fáze lipoproteinových částic VLDL a LDL i vzestup aktivity SOD a GPx (29).
Neurodegenerativní onemocnění
Mozek je vůči oxidačnímu stresu vysoce citlivý, protože využívá 20 % kyslíku spotřebovávaného organismem (30). Mozek také obsahuje velké množství vícenenasycených mastných kyselin a železa a nízkou koncentraci antioxidačních enzymů.
Parkinsonova nemoc. U Parkinsonovy nemoci dochází k degeneraci neuronů v substantia nigra, secernujících dopamin, které se podílí na kontrole a plánování pohybu. Předpokládá se, že v patofyziologii choroby se uplatňuje tvorba RONS a oxidace dopaminu (31). U pacientů s Parkinsonovou nemocí jsou silné důkazy o působení oxidačního stresu. V mozku pacientů s Parkinsonovou nemocí byla zjištěna zvýšená množství oxidovaných forem proteinů, lipidů a nukleových kyselin, jako jsou karbonyly proteinů, 4-hydroxy-2-nonenol a 8-hydroxy-2-deoxyguanozin (2, 3, 5, 9–11).
Alzheimerova nemoc. Podobně se oxidační stres podle současných názorů uplatňuje také v patogenezi Alzheimerovy nemoci. Alzheimerova nemoc (AD) je heterogenní onemocnění, za jejíž hlavní rys je považováno ukládání amyloidu beta (Aß) v mozku. Beta-amyloid je ukládán extracelulárně v tzv. senilních placích a je tvořen z těla vlastního amyloidového prekurzorového proteinu (APP). Dalším patologickým proteinem u AD je degenerovaný protein tau, uložený intracelulárně (32). Tvorba RONS, jako např. H2O2 provázející redukci kovových iontů, vedla k oxidačnímu poškození neuronů a vzniku Aß. Aß sám je zdrojem oxidačního stresu. Během progrese AD byla prokázána lipoperoxidace, oxidační poškození proteinů i DNA.
V mozkové tkáni jsou u pacientů s AD prokazovány markery oxidačního stresu, jako je zvýšená aktivita hem-oxygenázy 1 (HO-1) a koncentrace 8-hydroxyguaninu (8-OHG). Senilní plaky nesou známky oxidativního poškození jako modifikace Maillardovými sloučeninami (AGE), karbonylace, „síťování“ (cross-linking) proteinů. V mozkové tkáni nemocných s AD jsou také prokazovány zvýšené koncentrace železa a mědi. Přesné mechanismy spojení mezi oxidačním stresem a smrtí neuronů, vedoucí k poruchám poznávacích procesů, však zatím nebyly objasněny (33).
Psychiatrická onemocnění
V poslední době je úloha oxidačního stresu sledována i u některých psychiatrických onemocnění, zejména schizofrenie, ale i depresivních poruch, obsedantní kompulzivní poruchy (OKP) a autismu.
Schizofrenie. U pacientů se schizofrenií je většinou prokazována dysfunkce antioxidačního systému spojená s vystupňovanou lipoperoxidací. Mechanismy vzniku a působení oxidačního stresu u schizofrenie nejsou jasné, někteří autoři ukazují na význam zvýšeného obratu katecholaminů u nemocných se schizofrenií (34).
Depresivní poruchy. V etiopatogenezi deprese se předpokládá účast oxidačního stresu, a protože mozek obsahuje velké množství vícenenasycených mastných kyselin, železa a nízkou koncentraci antioxidačních enzymů je k jeho působení náchylný. Deprese je často spojena i se subklinickým zánětem provázeným zvýšenými hladinami zánětlivých cytokinů, zvyšujících tvorbu reaktivních částic (35). Byla popsána korelace závažnosti symptomů deprese s hladinou lipoperoxidů v séru.
ZÁVĚR
RONS i antioxidační systémy hrají v organismu důležitou úlohu. Jejich vývoj šel ruku v ruce s vývojem aerobního metabolismu a ochrany před toxicitou kyslíku. Role RONS není pouze negativní účastí v patofyziologických mechanismech různých chorob, ale RONS mají též řadu příznivých účinků a jsou součástí přirozených buněčných signálních drah. Jejich patologické působení závisí hlavně na nerovnováze prooxidačních a antioxidačních systémů. V současné době je jejich studiu věnována zvýšená pozornost a lze doufat v brzké uplatnění poznatků pro léčbu chorob, v jejichž rozvoji se RONS uplatňují.
Zkratky
- 13-HODE – a 13-hydroxy-9,11-oktadekadienová kyselina
- 4-HNE – 4-hydroxynonenal
- 8-OH-dG – 8-hydroxydeoxyguanozin
- 8-OHG – 8-hydroxyguanin
- 9-HODE – 9-hydroxy-10,12-oktadekadienová kyselina
- AD – Alzheimerova nemoc
- ADMA – asymetrický dimetylarginin
- AGE – advanced glycation end products
- AP-1 – activated protein-1
- APP – amyloidový prekurzorový protein
- Aß – amyloid beta
- BH4 – tetrahydrobiopterin
- Ca2+ – intracelulární kalcium
- CAT – kataláza
- CE – esterifikovaný cholesterol
- cGMP – cyklický guanylmonofosfát
- Co Q10 –koenzym Q10
- COX – cyklooxygenáza
- COX-2 – izoforma 2 cyklooxygenázy
- CRP – C-reaktivní protein
- cysLT – cysteinylleukotrieny
- DAG – diacylglycerol
- eNOS – endotheliální syntáza NO
- F-3-P – fruktóza 3-fosfatáza
- FAD – flavinadenindinukleotid
- FC – volný cholesterol
- FMN – flavinmononukleotid
- GAPDH – glyceraldehydfosfát dehydrogenázy
- GFAT – glutamin: fruktóza 6-fosfát aminotransferáza
- Gln – glutamin
- Glu – glutamát
- GPx – glutahion peroxidáza
- GR – glutathion reduktáza
- GSH – glutathion
- GSSG – glutathion disulfid
- GST – glutathion S-transferáza
- H2O2 – peroxid vodíku
- HclO – kyselina chlorná
- HETE – hydroxyeikosatetraenová kyselina
- HO-1 – hem-oxygenáza
- HPETE – hydroperoxyeikosatetraenová mastná kyselina
- HTG – hypertriglyceridémie
- IFN-γ – interferon gamma
- ICHS – ischemická choroba srdeční
- IL – interleukin
- iNOS – inducibilní NOS
- LDL – lipoproteiny o nízké hustotě
- LH – mastná kyselina
- LO-x – lipoxygenáza
- LT – leukotrieny
- LX – lipoxiny
- MCP-1 – monocyte chemotactic protein-1
- MDA – malondialdehyd
- mmLDL – minimálně modifikované a oxidované LDL (minimally modified and oxLDL-oxidized)
- MPO – myeloperoxidáza
- NF-κB – nuclear factor kappa B
- nNOS – neuronální NOS
- NO – oxid dusnatý
- NOS – syntáza oxidu dusnatého
- OKP – obsedantní kompulzivní porucha
- ONOO- – peroxynitrit
- OS – oxidační stres
- PDGF – platelet derived growth factor
- PGs – prostaglandin
- PKC – proteinkináza C
- PPAR-γ – peroxisome proliferator-activated receptor gamma
- PUFA – polyunsaturated fatty acids
- RONS – reactive oxygen and nitrogen species
- ROS – reaktivní sloučeniny kyslíku
- sGC – solubilní guanylát cykláza
- SMC – proliferace hladkých svalových buněk
- SOD – superoxid dismutáza
- TNF-α – tumor nekrotizující faktor alfa
- TRRed – thioredoxin reduktáza
- XD – xanthin dehydrogenáza
- XO – xanthaxanthin oxidáza
Práce byla podpořena výzkumným záměrem MŠMT ČR, MSM 0021620820.
ADRESA PRO KORESPONDENCI:
MUDr. Jaroslav Macášek
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: jmacasek@seznam.cz
Sources
1. Ignarro LJ, Cirino G, Casini A, Napoli C. Nitric oxide as a signalling molecule in the vascular system: an overview. J Cardiovasc Pharmacol 1999; 34 : 879–886.
2. Sies H. Role of reactive oxygen species in biological processes. Klin Wochenschr 1991; 69(21–23): 965–968.
3. Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean? Br J Pharmacol 2004; 142 : 231–255.
4. Štípek S. (ed.) Antioxidanty a volné radikály ve zdraví a nemoci. Praha: Grada Publishing 2000.
5. Valko M, Leibfritz D, Moncola J, Cronin MTD, Mazura M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem & Cell Biol 2007; 39 : 44–84.
6. Madamanchi NR, Vendrov A, Runge MS. Oxidative stress and vascular disease. Arterioscler Thromb Vasc Biol 2005; 25 : 39–38.
7. Harrison R. Physiological Roles of Xanthine Oxidoreductase Drug Metab Rev 2004; 36(2): 363–375.
8. Racek J, Holeček V. Enzymy a volné radikály. Chem Listy 1999; 93 : 11A–780.
9. Maritim AC, Sanders RA, Watkins JB, 3rd. Diabetes, oxidative stress, and antioxidants: a review. J Biochem Mol Toxicol 2003; 17 : 24–38.
10. Smith WL. The eicosanoids and their biochemical mechanisms of action. Biochem. J 1989; 259 : 315–324.
11. Hazen SL, Heinecke JW. 3-chlorotyrosine, a specific marker of myeloperoxidase - catalyzed oxidation, is markedly elevated in low density lipoprotein isolated from human atherosclerotic intima. J Clin Invest 1997; 99(9): 2075–2081.
12. Brennan ML, Hazen SL. Emerging role of myeloperoxidase and oxidant stress markers in cardiovascular risk assessment. Curr Opin Lipidol 2003; 14 : 353–359.
13. Lawson JA, Rokach J, Fitzgerald GA. Isoprostanes: formation, analysis and use as indices of lipid peroxidation in vivo. J Biol Chem 1999; 274 (35): 24441–24444.
14. Stadtman ER. Metal ion-catalyzed oxidation of proteins: biochemical mechanism and biological consequences. Free Radical Biol Med 1990; 9 : 315–325.
15. Grune T, Reinheckel T, Davies Kja. Degradation of oxidized proteins in mammalian cells. FASEB J 1997; 11 : 526–534.
16. Hensley K, Robinson KA, Gabbita SP, et al. Reactive oxygen species, cell signaling, and cell injury. Free Radic Biol Med 2000; 28(10): 1456–1462.
17. Hodgson JM, Wats GF. Can koenzyme Q10 improve vascular fiction and blood pressure? Potential for effective therapeutic reduction in vascular oxidative stress. Biofactors 2003; 18 (1–4): 129–136.
18. Heller R, Unbehaun A, Schellenberg B, et al. L-ascorbic acid potentiates endothelial nitric oxide synthesis via a chemical stabilization of tetrahydrobiopterin. J Biol Chem 2001; 276(1): 40–47.
19. Vítek L, et al. Gilbert syndrome and ischemic heart disease: a protective effect of elevated bilirubin levels. Atherosclerosis 2002; 160(2): 449–456.
20. Piette J, Piret B, Bonini G, Schoonbroodt S, Merville MP, Legrand-Poels S, Bours V. Multiple redox regulativ in NF-kappa B transcription factor activation. Biol Chem 1997; 378 (11): 1237–1245.
21. Brunt KR, Fenrich KK, Kiani G, et al. Protection of human vascular smooth cells from H2O2-induced apoptosis through functional codependence between HO-1 and Akt. Arterioscler. Thromb. Vasc Biol 2006; 26 : 2027–2034.
22. Libby P, Ridker PM, Maseri A. Inflammation and Atherosclerosis. Circulation 2002; 105 : 1135–1143.
23. Griendling KK., FitzGerald GA. Oxidative stress and cardiovascular injury: Part I: Basic mechanisms and in vivo monitoring of ROS. Circulation 2003; 108 : 1912–1916.
24. Giugliano D, Ceriello A, Paolisso G. Oxidative stress and diabetic vascular complications. Diabetes Care 1996; 19 : 257–267.
25. Das UN. Folic acid says NO to vascular diseases. Nutrition 2003; 19 : 686–692.
26. Brownlee M. The Pathobiology of diabetic complications. A unifying mechanism. Banteng Lemure 2004. Diabetes 2005; 54 : 1615–1625.
27. Ohara Y, Peterson TE, Harrison DG. Hypercholesterolemia increases endothelial superoxide anion production. J Clin Invest 1993; 6 : 2546–2551.
28. Guzik TJ, Mussa S, Gastaldi D, et al. Mechanisms of increased vascular superoxide production in human diabetes mellitus: role of NAD(P)H oxidase and endothelial nitric oxid synthese. Circulation 2002; 105 : 1656–1662.
29. Zeman M, Žák A, Vecka M, Tvrzická E, Romaniv S, Konárková M. Treatment of hypertriglyceridemia with fenofibrate, fatty acid composition of plasma and LDL, and their relations to parameters of lipoperoxidation of LDL. Ann NY Acad Sci 2002; 967 : 336–341.
30. Juurlink BH, Patison PG. Review of oxidative stress in brain and spinal cord Indry: suggestions for pharmacological and nutritional management strategies. J Spinal Cord Med 21 1998; 309–334.
31. Zhang J, Perry G, Smith MA, et al. Parkinsonęs dinase is associated with oxidative damage to cytoplasmic DNA and RNA in substantia nigra neurons. Am J Pathol 1999; 154 : 1423–1429.
32. Jirák R, Koukolík F. Demence. Praha: Galén 2004.
33. Perry G, Cash AD, Smith MA. Alzheimer disease and oxidative stress. J Biomed Biotechnol 2002; 23 : 120–123.
34. Mahadik SP, Mukherjee S. Free radical pathology and antioxidant defense in schizophrenia: A review. Schizophrenia Research 1996; 19(1): 1–17.
35. Maziere C, Auclair M, Maziere JC. Tumor necrosis factor enhances low density lipoprotein oxidative modification by monocytes and endothelial cells. FEBS Lett 1994; 338 : 43–46.
36. Tkáč I, Molčányiová A, Javorský M, Kozárová M. Fenofibrate treatment reduces circulating conjugated diene level and increases glutathione peroxidase activity. Pharmacol Res 2006; 53 : 261–264.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Reaktivní kyslíkové a dusíkové sloučeniny v klinické medicíně
- Současné možnosti léčení poranění pánevního kruhu
- Klinický význam nemoci spojené s imunoglobuliny IgG4
- Nejčastěji využívané metodiky k analýze DNA metylačních změn
- Hazard u dětí a dospívajících
- Naše zkušenosti s maravirocem u HIV pozitivních pacientů
- Antiepileptické léky a lékové interakce: klinická kazuistika
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné možnosti léčení poranění pánevního kruhu
- Klinický význam nemoci spojené s imunoglobuliny IgG4
- Reaktivní kyslíkové a dusíkové sloučeniny v klinické medicíně
- Nejčastěji využívané metodiky k analýze DNA metylačních změn
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

