-
Medical journals
- Career
Současný stav diagnostiky karcinomu pankreatu
: Tomáš Krechler 1; Josef Hořejš 2; Jan Ulrych 3; Miroslav Zeman 1; Jaroslav Macášek 1; Jaroslava Dušková 4; Aleš Žák 1
: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN 1; Univerzita Karlova v Praze, 1. lékařská fakulta, Radiodiagnostická klinika VFN 2; Univerzita Karlova v Praze, 1. lékařská fakulta, I. chirurgická klinika VFN 3; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav patologie 4
: Čas. Lék. čes. 2011; 150: 587-593
: Review Articles
Karcinom pankreatu stále patří mezi nádory s nejhorší prognózou. Pětileté přežití se pohybuje od 0,4 do 2 %. Ve většině případů je nádor diagnostikován v pokročilém stadiu, které neumožňuje radikální chirurgické ošetření. V současné době se diagnostika karcinomu pankreatu opírá o dynamicky se rozvíjející zobrazovací metody, které umožňují detekovat i malé léze. Základní vyšetřovací metodou je kontrastní počítačová tomografie, na kterou navazuje ve většině případů endoskopická ultrasonografie. U většiny pacientů se provádí cytopatologické a histologické vyšetření před chirurgickým zákrokem nebo onkologickou terapií. Rozhodující pro další terapeutický postup je zjištění stadia pokročilosti nádoru. Přes jednoznačný pokrok v diagnostice zůstává časná diagnostika karcinomu pankreatu stále neuspokojivá.
Klíčová slova:
karcinom pankreatu, zobrazovací metody, počítačová tomografie, endoskopická ultrasonografie.ÚVOD
Časná diagnostika karcinomu pankreatu (KP), resp. pankreatického duktálního adenokarcinomu, je v současnosti velmi obtížná. Ve většině případů je KP diagnostikován až v pokročilém stadiu s malou perspektivou kurativní resekce. Navíc ani radikální chirurgický výkon v časných stadiích KP nemá příznivou prognózu.
Novější analýzy ukázaly, že ke kurativní resekci je indikováno zhruba 10–15 % nemocných s KP. Průměrné doba přežití u neoperovaného nemocného (nebo po paliativním operačním výkonu) činila 4–6 měsíců a po resekčním výkonu se prodloužila 2–3× (1). Na konci devadesátých let 20. století se resekabilita KP pohybovala mezi 15–20 % (2) a medián celkového přežití nepřesahoval 6 měsíců (3).
Obtížnost diagnózy KP spočívá především v anatomické lokalizaci slinivky břišní v retroperitoneu, která souvisí s pozdní manifestací klinických příznaků. Symptomatologie onemocnění je ovlivněna anatomickou lokalizací KP (hlava vs. tělo a ocas) a jeho topografickými vztahy k orgánům dutiny břišním, do kterých může KP prorůstat. Vedoucími příznaky KP je bolest (v epigastriu a zádech), obstrukční ikterus a hubnutí. Mnohdy jim předchází různě dlouhé období necharakteristických zažívacích potíží (dyspepsie, nechutenství) a váhový úbytek (4, 5).
Mezi příznaky KP můžeme přiřadit časně manifestovaný diabetes mellitus (DM) (6). Až u 1/2 nemocných s KP jsou přítomny poruchy glukózové homeostázy DM, porušená glykémie nalačno (IFG), porušená glukózová tolerance (IGT). Vztahy mezi DM a KP jsou zřejmě obousměrné. Nemocní s dlouhotrvajícím diabetes mellitus 2. typu (DM2) mají mírně zvýšené riziko KP a DM zvyšuje riziko KP 1,7–2× (7). U nově manifestovaného DM2 je riziko KP výrazně vyšší a často se DM manifestuje několik měsíců před stanovením diagnózy KP (8, 9). V současné době se ukazuje, že nově diagnostikovaný DM (trvání < 3 roky) by mohl sloužit jako vhodný první stupeň ve screeningu KP. V rozsáhlé populační studii v USA byl u nemocných starších 50 let s nově zjištěným DM během 3letého sledování diagnostikován KP 7,9× častěji při srovnání s obecnou populací. Na druhé straně je KP spojen s vysokou prevalencí DM2. DM je přítomen již v časných stádií KP. DM byl přítomen u 1/3 malých KP (< 10 mm) (10). Pannala et al. pozorovali v souboru 642 nově zjištěných KP 47 % diabetiků (9). Podobná data byla zjištěna v České republice. U nově diagnostikovaného KP byl časně manifestovaný DM2 přítomen v 35 % a 70 % nemocných s KP mělo poruchu glukózové homeostázy (11). Brněnští autoři ve skupině nemocných s KP prokázali DM u 24 % nemocných a u 50 % kombinaci kouření s DM (12). Proto někteří autoři doporučují preventivně vyšetřit osoby s atypickými klinickými projevy DM (manifestující se ve vyšším věku, s negativní rodinnou anamnézou, astenického habitu nebo s významným úbytkem tělesné hmotnosti nereagujícím na antidiabetickou léčbu či s opakujícími se infekcemi) vysoce senzitivními zobrazovacími metodami k vyloučení asymptomaticky probíhajícího KP (11).
Vysoké riziko vzniku KP představuje hereditární pankreatitida (HP). Ta zvyšuje pravděpodobnost vzniku KP zhruba 50–70× nejen ve srovnání s běžnou populací, ale i při srovnání s nehereditární chronickou pankreatitidou (ChP). Nehereditární ChP (alkoholická či idiopatická forma) zvyšuje riziko vzniku KP cca 10–17×. Proto je nutné HP diagnostikovat a diferenciálně diagnosticky odlišit od nehereditárních forem. Při dlouhodobém sledování pacientů s ChP byl zjištěn výskyt KP v 5,8 % (13).
Diagnostický algoritmus při podezření na HP zahrnuje klinické a genealogické vyšetření doplněné molekulárně-genetickými analýzami. Pacienti s HP mají přítomny germinální mutace v genu pro kationický trypsinogen (PRSS1) nebo pro inhibitor serinové proteázy (SPINK1). V případě nálezu mutací v relevantních genech je nezbytné pacienty i postižené příbuzné celoživotně dispenzarizovat. Vzhledem k riziku rozvoje KP je u HP v současnosti doporučován screeningový program s využitím moderních zobrazovacích metod (především EUS, CT, ERCP s odběrem pankreatického sekretu k molekulárně-genetické analýze somatických mutací), který zvyšuje pravděpodobnost záchytu časného stadia KP (14, 15).
Pokud se KP manifestuje bezbolestným ikterem, zpravidla současně s úbytkem hmotnosti, bývá diagnóza poměrně rychlá. U pacientů s ikterem dochází k invazi nádoru do distální části ductus choledochu. Takto se mohou manifestovat i relativně menší nádory, které mají naději na radikální resekci.
Bolesti jsou již většinou známkou pokročilosti onemocnění a současného perineurálního šíření nádoru; v 80 % případů již známkou neresekability nádoru (16). Naše zkušenosti se však blíží spíše pozorování jiných autorů, u kterých bylo procento kurativních resekcí jen 2,6 % z celkového počtu diagnostikovaných KP (17).
Naprostá většina případů KP je diagnostikována ve stadiu III a IV s postižením lymfatických uzlin a přítomností metastáz. Proto se objevují snahy o rozpoznání klinických znaků, jejichž stanovení by pomohlo klinikovi diagnostikovat KP v „preklinickém stadiu”. Z hlediska rozměrů nádoru by se mělo jednat o nádory menší než 2 cm, s omezeným šířením do okolních struktur. U takových nádorů pak stoupá 5leté přežití na 14–37 % (18, 19).
SOUČASNÝ STAV DIAGNOSTIKY KARCINOMU PANKREATU
Zobrazovací metody
Současná diagnostika KP spočívá ve využití zobrazovacích metod. Lze již dnes konstatovat, že je možné díky těmto metodám diagnostikovat i malé léze pankreatu (10 mm), a tím dramaticky zvýšit možnost časné diagnostiky a přežití pacientů. Hlavní problém však spočívá v tom, že právě tyto léze jsou asymptomatické a jejich občasná, většinou náhodná diagnóza nemění nic na nepříznivé prognóze drtivé většiny nemocných s KP.
Transabdominální ultrasonografie
I přes četné limity této metody, jako jsou: habitus pacienta, přítomnost plynu, v střevních kličkách a v žaludku, je transabdominální ultrasonografie v rukou zkušeného vyšetřujícího metodou první volby a její senzitivita je u tumorů větších než 3 cm až 95 %, ale snižuje se u menších lézí. Typický obraz KP zahrnuje přímé známky (hypoechogenní nebo smíšené (hypo-hyperechogenní), ložisko proti okolní pankreatické tkáni neostře ohraničené). Mezi nepřímé US příznaky patří biliární obstrukce (dilatace společného žlučovodu (> 7 mm)), dilatace ductus Wirsungi (> 3 mm), nález jaterních metastáz (> 1 cm) a ascitu. Za příhodných anatomických podmínek je možná i vizualizace periampulární oblasti. Z těchto důvodů zůstává v široké klinické praxi transabdominální ultrasonografie základním vyšetřením, od kterého se odvíjí další diagnostický algoritmus při podezření na nádorový proces pankreatu (20, 21). Obrázek 1 ukazuje USG obraz karcinomu pankreatu a dilatace distálního choledochu.
1. USG obraz nádoru pankreatu (↑), stenózující distální úsek společného žlučovodu, který je suprastenoticky dilatován (↑↑) 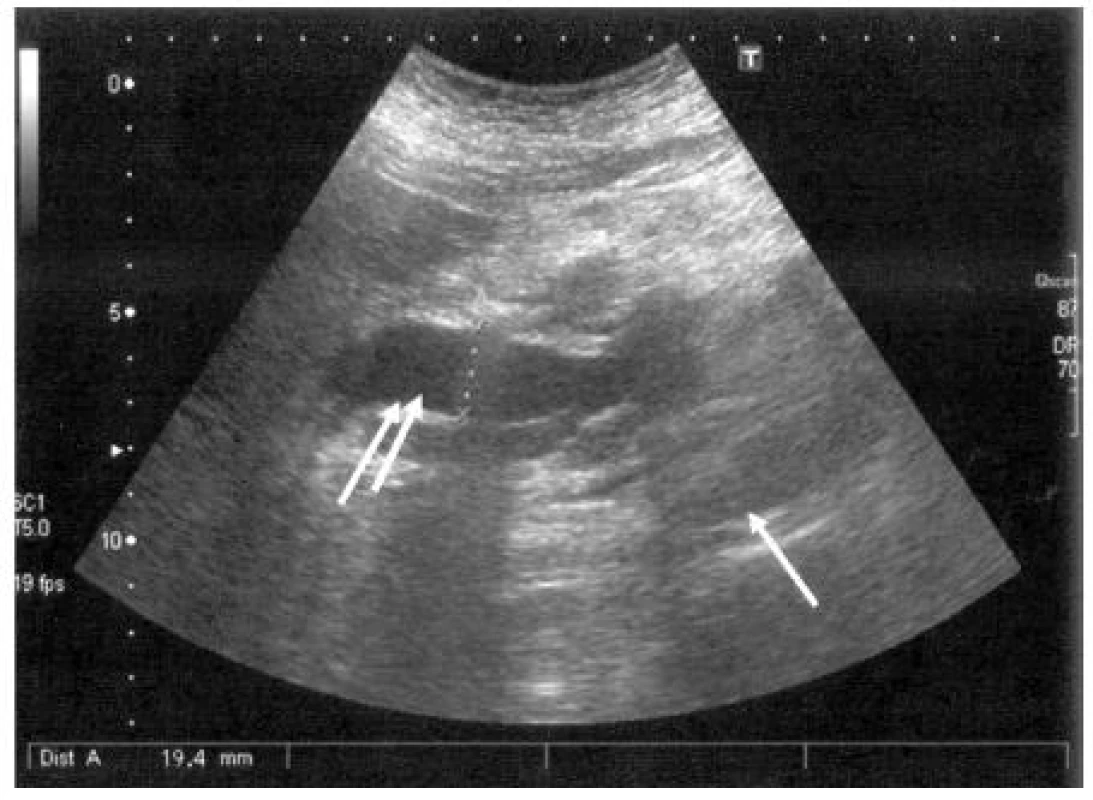
Endoskopická ultrasonografie
Endoskopická ultrasonografie (EUS) je v současně době dynamicky se rozvíjející metoda, kombinující endoskopickou techniku (s možností cíleného odběru tkáně na patologicko-anatomickou analýzu) s vysoce kvalitním ultrazvukovým obrazem. Výhoda EUS je podmíněna malou vzdáleností mezi echoendoskopem a pankreatem (jen přes stěnu žaludku a duodena). Vzhledem k tomu je možné detekovat již malé léze (> 2–3 mm). Význam UES spočívá nejen v detekci drobných lézí pankreatu, ale v určení lokálně-regionálního stagingu KP, vaskulární invaze a postižení lymfatických uzlin (21, 22).
Karcinom pankreatu se v EUS obraze zobrazuje jako hypoechogenní nebo smíšené (hypo-hyperechogenní) ložisko s neostrými a nepravidelnými okraji. Současně může být přítomna dilatace Wirsungu nad ložiskem nebo dilatace choledochu (4, 22). Velmi často může být přítomna peripankreatická lymfadenopatie nebo v oblasti odstupu truncus coeliacus. Nedílnou součástí EUS vyšetření je hodnocení lokální invaze do velkých cév: v. portae, v. mesenterica sup. v. lienalis, truncus coeliacus, a. hepatica, a. gastroduodenalis, a. mesenterica sup. a a. linealis. Při hodnocení EUS popisu je nutné hodnotit stupeň vaskulární invaze: intimní naléhání KP na stěnu cévní, nádorovou infiltraci stěny cévy, invazi do lumen cévy nebo úplnou obturaci spojenou často s trombózou. V těchto případech je nepostradatelným pomocníkem využití dopplerometrického signálu.
Zavedením moderních CT (počítačová tomografie) vyšetření (multifázické spirální CT s využitím tenkých řezů) se senzitivita CT přiblížila u malých lézí (2 cm) vyšetření EUS (21, 23). Na rozdíl od CT je specificita EUS limitována při rozpoznání tumoru v terénu akutní pankreatitidy. Pozitivní predikční hodnota činí v těchto případech jen 60 % (24). Obrázek 2 ukazuje EUS nález KP.
2. EUS obraz objemného nádoru hlavy pankreatu (↑), zavedená bioptická jehla (↑↑); plastový biliární stent s aerobilií (↑↑↑) 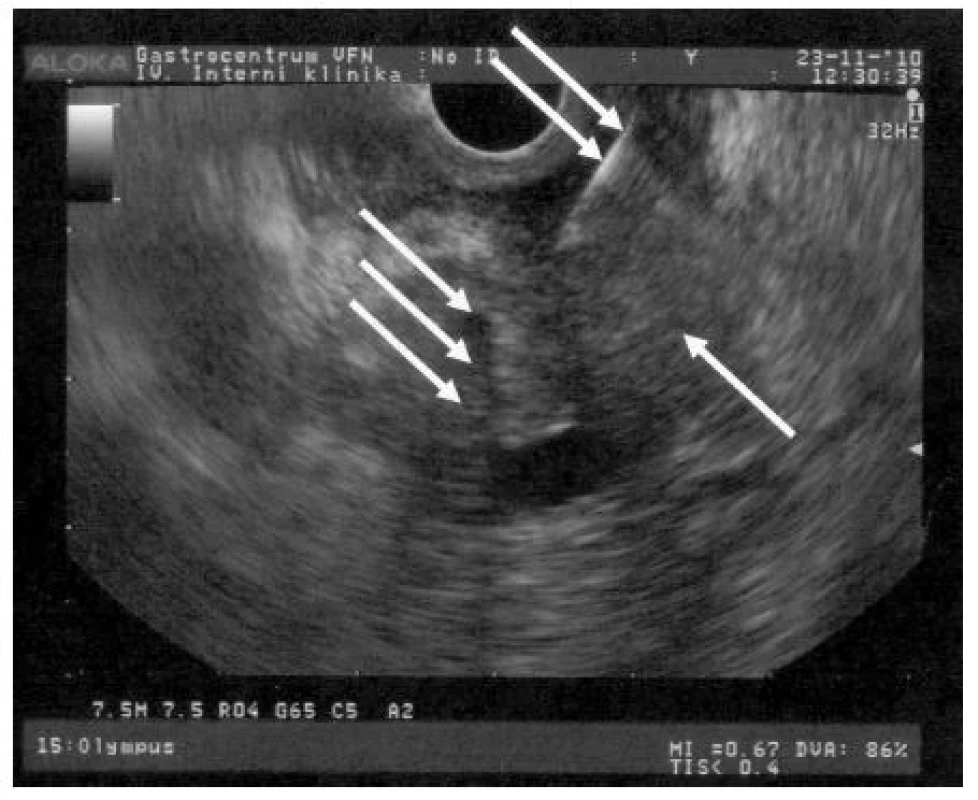
Počítačová tomografie
Základním vyšetřením pro diagnózu KP je v současné době vyšetření pomocí kontrastní CT. Nativní CT břicha k diagnostice KP je bezcenné.
V CT obrazu se KP projevuje jako zvětšený úsek pankreatu, často též jako hypodenzní fokální léze. Charakteristickým nálezem mohou být excentricky uložená cystoidní ložiska odpovídající nekrotickému rozpadu tkáně. Na rozdíl od pankreatických pseudocyst nebo cystických nádorů nemají rozpadové dutiny jednoznačně definovanou stěnu. Kalcifikace v pankreatu bývají u KP neobvyklé a vypovídají o současné přítomnosti chronické kalcifikující pankreatitidy.
Zavedením moderních spirálních CT do vyšetřovacího algoritmu se významně zvýšila výtěžnost i u malých tumorů (< 20 mm) a zde se senzitivita blíží EUS (21). V současné době se pohybuje senzitivita spirálního CT u těchto malých lézi mezi 72–77 % a specificita dosahuje až 100 %. Diferenciálně diagnostický problém nastává u pacientů s chronickou pankreatitidou, kdy rozlišení tumoru v zánětlivém terénu je podstatně horší a specificita CT vyšetření klesá (25).
Kontrastní spirální CT hraje v současné době klíčovou roli ve stanovení stadia pokročilosti nádoru (předoperační staging). Dává základní informaci o lokální invazi nádoru do velkých cév a metastatickém postižení dalších orgánů (játra, plíce). Peritoneální rozsev je hodnocen nepřímými znaky (ascites, rozšíření omenta). Rovněž se hodnotí přítomnost postižených mezenteriálních lymfatických uzlin. Ve stanovení postižení lymfatických uzlin v korelaci s histologickým nálezem je však senzitivita a specificita CT nízká (4, 26). Obrázek 3 ukazuje CT obraz hlavy KP.
3. CT obraz nádoru hlavy pankreatu infiltrující oblast confluens (↑) 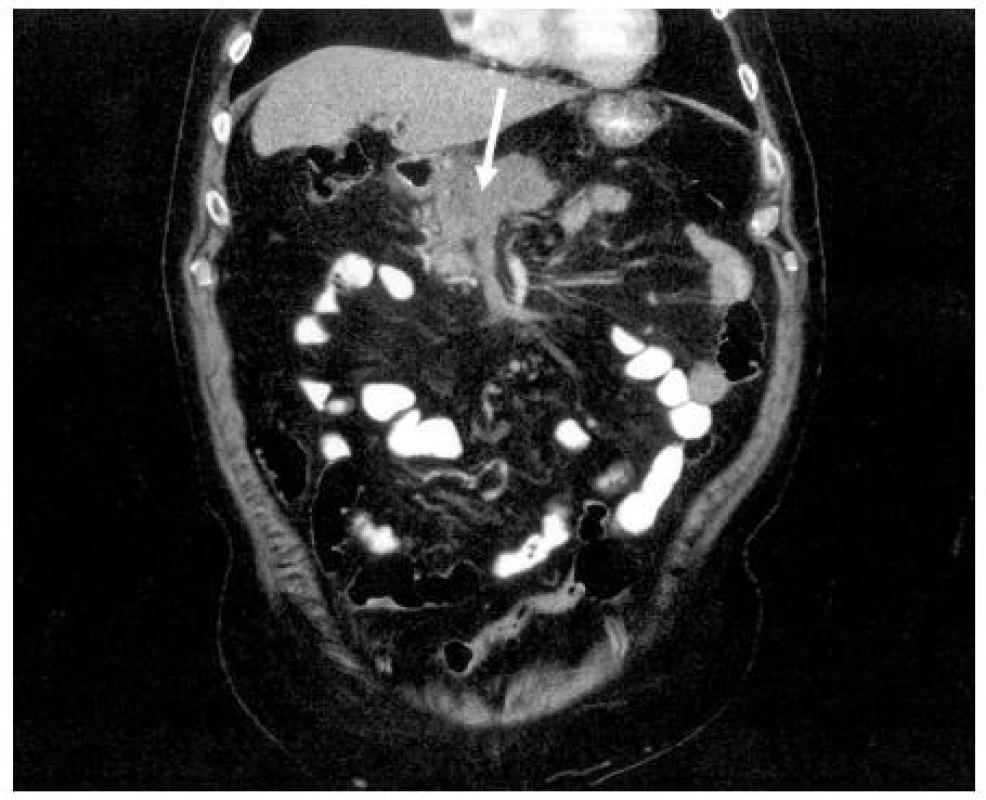
Endoskopická retrográdní cholangiopankreatikografie
Vyšetření endoskopickou retrográdní cholangiopankreatografií (ERCP) má v současné době význam především v diagnostice biliární obstrukce, která je způsobena nádorem prorůstajícím do žlučových cest.
Karcinom pankreatu lokalizovaný v hlavě většinou postihuje oba vývodné systémy (žlučový a pankreatický). Při ERCP pak zjistíme kombinovanou stenózu terminálního choledochu a hlavního pankreatického vývodu přibližně ve stejné výši (double-duct sign). Při lokalizované náplni ductus Wirsungi se objevuje několik typů nálezů, charakteristických pro KP: 1. stenózující typ bez nebo s přerušením kontrastní náplně vývodu; 2. obstrukční typ s chybějící náplní periferního úseku, nebo jeho postupným zužováním, či s předčasně ukončenou kontrastní náplní; 3. kavernózní typ, kdy náplň vývodu končí v rozpadové dutině nádoru a dále do periferie nepostupuje. Zakončení kontrastní náplně blokovaného pankreatického vývodu má u KP ve většině případů klínovité, excentrické a nepravidelné okraje. Je nutné však zdůraznit, že specifický pankreatogram pro KP neexistuje a že v diferenciální diagnostice ložiskových procesů pankreatu je nutné většinou využít i další diagnostické metody (4). Obrázek 4 ukazuje ERCP nález nádorové stenózy distálního choledochu se zavedeným plastovým stentem.
4. ERCP nález nádorové stenózy terminálního úseku choledochu a hlavního pankreatického vývodu při karcinomu hlavy pankreatu (↑), suprastenotická dilatace žlučovodu (↑↑) a hlavního pankreatického vývodu (↑↑↑): „double duct sign“ 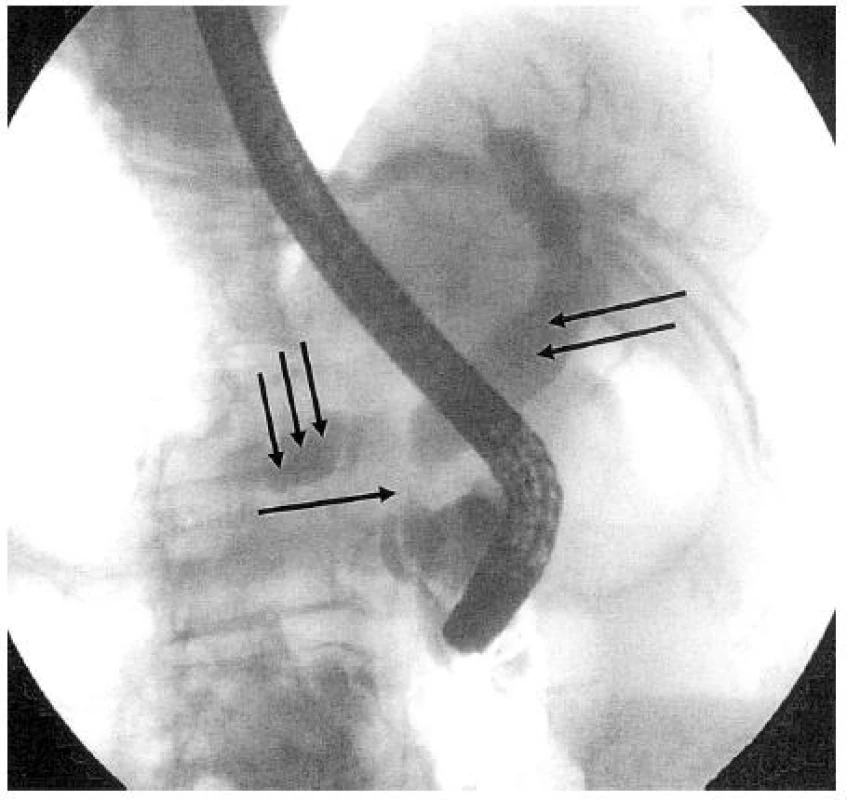
Další zobrazovací metody
Diagnostickou úlohu v zobrazení pankreatického a žlučového vývodného systému přebírá vzhledem k malé invazivitě magnetická rezonance (MR) a magnetická rezonanční cholangiopankretikografie (MRCP). Využití MRCP je především v lokalizaci pankreatobiliární obstrukce, méně již v bližší identifikaci nádorové léze. Senzitivita MRCP pro diagnózu KP je 84 % a specificita 97 %. Podobná data jsou uváděna pro vyšetření ERCP, jehož využití však pro diagnostiku klesá vzhledem k výskytu závažných komplikací (4, 27).
Vyšetření MR pankreatu není v současné době doporučováno v prvním sledu vyšetření při podezření na KP. Senzitivita a specificita je podobná jako u spirálního CT, ale dosažitelnost a cena je v našich podmínkách limitující.
Využití MR se ukázalo v některých studiích jako přesnější než CT při průkazu malých nádorů, které neměnily obrys vlastní žlázy. Toto vyšetření je vyčleněno tudíž spíše pro diagnostiku některých nejasných fokálních lézí pankreatu, dále v diferenciální diagnostice jaterních metastáz a u pacientů s alergií na jodovou kontrastní látku (28). V současné době MR a MRCP mají komplementární význam v případech, kdy kontrastní CT dává nejednoznačné výsledky a je přítomna chronická pankreatitida (21).
V některých případech se v rámci stagingu provádí laparoskopické vyšetření (při podezření na intraabdominální metastatický rozsev), ale význam tohoto vyšetření není v současné době vzhledem pokročilosti ostatních zobrazovacích metod velký. Obrázek 5 znázorňuje zobrazení KP magnetickou rezonancí.
5. MR obraz nádoru v hlavě pankreatu (↑); nativně je v T1 váženém obrazu ložisko hyposignální 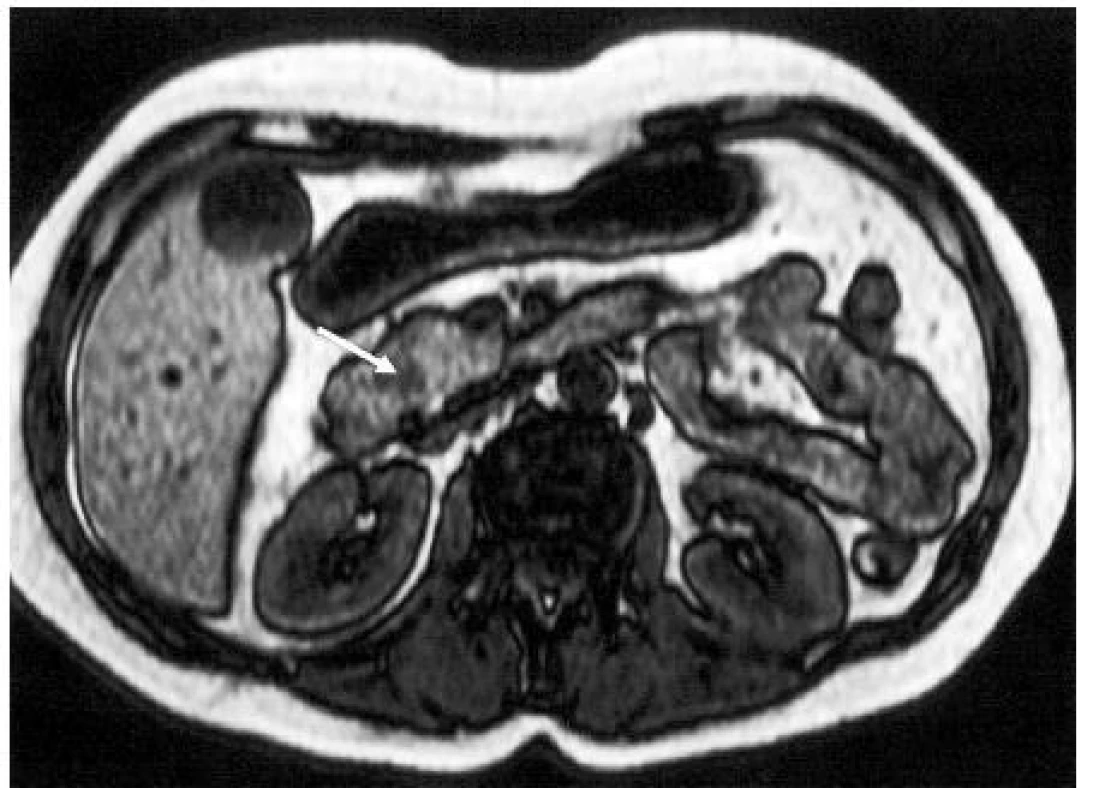
Vyšetření pozitronovou emisní tomografií (PET) slouží především k detekci vzdálených metastáz a její limity jsou v nedostatečné anatomické rozlišitelnosti. Proto se využívá kombinované vyšetření PET a CT. Hybridní zobrazení PET/CT se ukazuje jako výhodné při diferenciální diagnostice mezi tumorem a tumoriformní ChP, pokud není přítomna akutní exacerbace ChP. Protože v klinické praxi se PET/CT využívá relativně krátkou dobu, její místo v diagnostickém algoritmu přinesou očekávané studie (4).
Novou metodu představuje EUS elastografie, která může významný způsobem přispět především v diferenciální diagnostice ložiskových pankreatických lézí (29). Jeví se jako vhodné vyšetření u pacientů s chronickou pankreatitidou při sledování dynamiky fibrózních změn a pro časné rozpoznání vzniku KP v terénu chronické pankreatitidy (30). Praktické využití této metody limitují kapacitní možnosti provádět toto vyšetření v České republice.
Laboratorní diagnostika
V současné době neexistuje laboratorní test, který by bylo možné využít v časné diagnostice KP, a dostupná laboratorní vyšetření mají omezený význam.
Pro diagnostiku, určení stadia pokročilosti a sledování účinnosti léčby KP bylo navrženo široké spektrum nádorových markerů. Nejvýznamnějším z nich u KP je CA 19-9, který patří mezi antigeny (spolu s CEA, CA 72-4) asociované s nádorovým bujením. Je totožný s haptenem krevní skupiny Lewis-a. Glykoprotein CA 19-9 je exprimován na povrchu buněk některých nádorů (KP, karcinom žaludku, kolorektální karcinom, mucinózní karcinom ovaria) i normálních buněk pankreatických a žlučových vývodů, sliznice žaludku, tlustého střeva a dělohy. Zvýšené koncentrace CA 19-9 jsou přítomny nejen u řady solidních nádorů (KP, hepatocelulární karcinom, ovariální karcinom, kolorektální karcinom, karcinom žaludku a bronchogenní karcinom), ale i u nenádorových onemocnění (ChP, jaterní choroby, cholestatické stavy, idiopatické střevní záněty, hydronefróza, pneumonie). Senzitivita CA 19-9 pro diagnostiku KP se pohybuje v poměrně širokém rozpětí (67–92 %), podobně jako jeho specificita (80–90 %), přičemž nejvyšší hodnota dosahuje u lokálně pokročilých a diseminovaných nádorů (31). Využití CA 19-9 je limitováno jeho nižší senzitivitou u malých nádorů (< 10 mm). Jen 50 % KP menších než 2 cm má vyšší hladiny CA 19-9 (32). Situaci komplikuje ještě fakt, že 5–15 % populace nesyntetizuje CA 19-9. Jedná se o nositele krevní skupiny Lewis -a,-b, u nichž je negativita CA 19-9 podmíněna geneticky (33, 34).
Karcinoembryonální antigen (CEA) je další nádorový marker využívaný v klinické praxi. CEA se nachází ve fetální tkáni (embryonální střevo) i v dospělé epiteliální tkáni. Tento antigen je exprimován v buňkách normální sliznice a jeho syntéza je zvýšená u některých nádorů (karcinom plic, kolorekta, KP). Senzitivita CEA pro detekci KP se popisuje v rozmezí 48–55 % a specificita 87–90 % (35). Vzhledem k relativně nízké senzitivitě a specificitě je využití CA 19-9 a CEA pro diagnostiku KP značně limitováno. Použití těchto markerů spočívá především v monitorování pooperačního průběhu a vývoje onemocnění během chemoterapie.
Prognostickými faktory KP jsou podle některých autorů také další sérové nádorové markery, jako je podjednotka lidského choriogonadotropinu (hCG) a CA 72-4. CA 72-4 je antigen glykoproteinového typu detekovaný monoklonálními protilátkami, významný především pro monitorování malignit žaludku, dolní třetiny jícnu, tlustého střeva, pankreatu a mucinózního typu ovariálního karcinomu. Senzitivita je asi 50% při poměrně vysoké specificitě (33, 36, 37).
Z molekulárně-genetických markerů je v současné době využíváno stanovení některých somatických mutací nádorové tkáně získaných při cílené biopsii (event. odběrem pankreatického sekretu, či kartáčovou obrazí při ERCP). Nález těchto somatických mutací je podmíněn molekulárními změnami během neoplastické transformace.
V úvodní části karcinogeneze (PanIN1A až PanIN-1B) vznikají mutace onkogenu K-ras a zvyšuje se exprese onkogenu HER2. Střední fáze karcinogeneze je charakterizována inaktivací supresoru p16. Infiltrující stadium nádoru je charakterizováno mutacemi dalších genů (p53, PDC4, BRCA2). Incidence alterovaných genů v tkání KP je nejvyšší u p16 (80–95 %), K-ras (75–90 %) p53 (50–75 %) a PDC4 (45–55 %) (38).
Z praktického hlediska je účelné vyšetřovat K-ras onkogen v pankreatickém sekretu u pacientů s ChP s cílem detekce časných stadií KP. Vyšetření K-ras v kombinaci s histologickým vyšetření zvýšila senzitivitu panelu vyšetření pro KP bez ztráty specificity. Pacienti s ChP a endokrinně aktivnímu nádory pankreatu měli toto vyšetření také negativní. Ukazuje se, že stanovení samotné K-ras mutace není vzhledem k senzitivitě a specificitě (75–77 %) dostačující pro diagnostiku KP i pro sekundární prevenci KP u ChP a bude nutné ji kombinovat s dalšími molekulárně genetickými markery (39, 40).
Protože časně manifestovaný DM může být diagnostickým ukazatelem přítomnosti KP, tak se výzkum orientuje na hledání dalších markerů jeho časné diagnostiky. V souboru pacientů s KP byl ve srovnání se zdravými kontrolami zjištěn signifikantně vyšší výskyt homozygotů A/A polymorfizmu -23HphI (T/A) promotoru genu pro inzulin (41). Dále u KP byla prokázána, ve srovnání s DM2 a zdravými osobami, významně nižší koncentrace solubilních receptorů konečných produktů pozdní glykace (sRAGE) (42). Rovněž pacienti s nově diagnostikovaným KP měli nižší koncentrace sérového leptinu s vyšším poměrem adiponektin/leptin v séru (43). Možnost praktického využití těchto ukazatelů v diagnostice KP ověří další prospektivní klinické studie.
Cytologická a histologická verifikace
Záleží na zkušenostech jednotlivých pracovišť, jak se k této otázce staví. Je nutné zdůraznit, že ne všechny nádory pankreatu jsou duktální adenokarcinomy, ale že existuje celá řada jiných maligních lézí pankreatu s různou prognózou a odpovědí na léčbu. Mezi ně patří neuroendokrinní tumory, lymfomy, ampulární tumory či acinární nádory, což podtrhuje význam histologického vyšetření.
Některá pracoviště (včetně našeho) doporučují cílenou biopsii u všech ložiskových lézi pankreatu i v případě potenciální resekability. Onkologové v současné době nezahájí chemoterapii bez verifikace nádoru patologem. Na druhou stranu je nezbytné co nejvíce zkrátit časovou periodu mezi podezřením na KP a jeho operací.
Odběr vzorků na cytopatologické nebo histologické vyšetření se provádí několika způsoby: endoskopicky cestou EUS nebo ERCP, perkutánně pod CT nebo USG kontrolou.
Kartáčková cytologie využívaná v diagnostice malignit pankreato-biliárního systému včetně nádorů Vaterské papily dosahuje senzitivity mezi 33–75 % a specificity 97–100 %. Nízká senzitivita souvisí s limitovanou možnosti přímé vizualizace místa odběru a pravidelnou přítomností kontaminujících struktur z okolí nádoru. Ty velmi často vykazují patologické změny a morfologické artefakty, které imitují některými charakteristikami nádorové buňky. Vyšetření vyžaduje vysokou obecnou i na diagnostiku pankreatických lézí cílenou zkušenost odečítajícího cytopatologa. Množství získaného materiálu a možnost případného zpracování metodou cytobloku zásadně zlepšuje diagnostické možnosti cytopatologa (44–46).
Pro diagnostiku nádorů pankreatu je v současné době více doporučován odběr vzorku tenkou jehlou pod EUS kontrolou (EUS-FNA biopsie). Toto vyšetření kombinuje nízké riziko invazivního výkonu s přijatelnou senzitivitou (75–90 %) a dobrou specificitou (94–100 %) (47). Senzitivita i specificita EUS-FNA biopsie je úzce vázaná na zkušenost vyšetřujícího endoskopisty a odečítajícího cytopatologa. Množství komplikací po tomto výkonu je poměrně malé. Jedná se především o klinicky nezávažná krvácení, vzácné jsou infekce; akutní pankreatitida po tomto výkonu je vzácná (< 1 %) a popisuje se častěji při biopsii cystických lézí, než při biopsii solidních nádorů (48–50). Při klinickém podezření na KP a nálezu léze při EUS i přes negativní cytologii je nezbytné provést explorativní laparotomii (51).
Vzhledem ke stále se zvyšující dostupnosti EUS vyšetření klesá počet cílených biopsií prováděných transabdominálně pod CT nebo US kontrolou. V současné době nejsou k disposici validní prospektivní data týkající se porovnání výtěžnosti biopsie pankreatu pod EUS a CT kontrolou. Retrospektivní studie Quiana et al. prokázala vyšší senzitivitu cílené biopsie pod CT kontrolou (71 %) ve srovnání s biopsií pod EUS kontrolou (42 %) (52). Naopak retrospektivní studie Malleryho et al. hodnotí senzitivitu vyšetření pod EUS kontrolou jako srovnatelnou s vyšetřením pod CT kontrolou či s chirurgickým odběrem (53).
Vzhledem k tomu, že asi 25 % pankreatických lézí není detekovatelných při CT vyšetření, tak hlavními indikacemi cílené biopsie pod EUS kontrolou jsou malé intrapankreatické léze a dále pak tumory s menším maligním potenciálem, jako jsou např. neuroendokrinní nádory (54). Obrázek 6 ukazuje cytologický nález KP získaného při FNA pod EUS kontrolou.
6. Cytologický obraz karcinomu pankreatu získaný FNA biopsií pod EUS kontrolou Fragment středně diferencovaného duktálního adenokarcinomu, kompaktní formace nádorových buněk s výraznou anisocytózou, anisokaryózou, měnlivým, často zvýšeným nukleo-plazmovým poměrem a překrýváním jader. Nátěr barven polychromatickým barvením dle Papanicolaoua, zvětšení 400×. 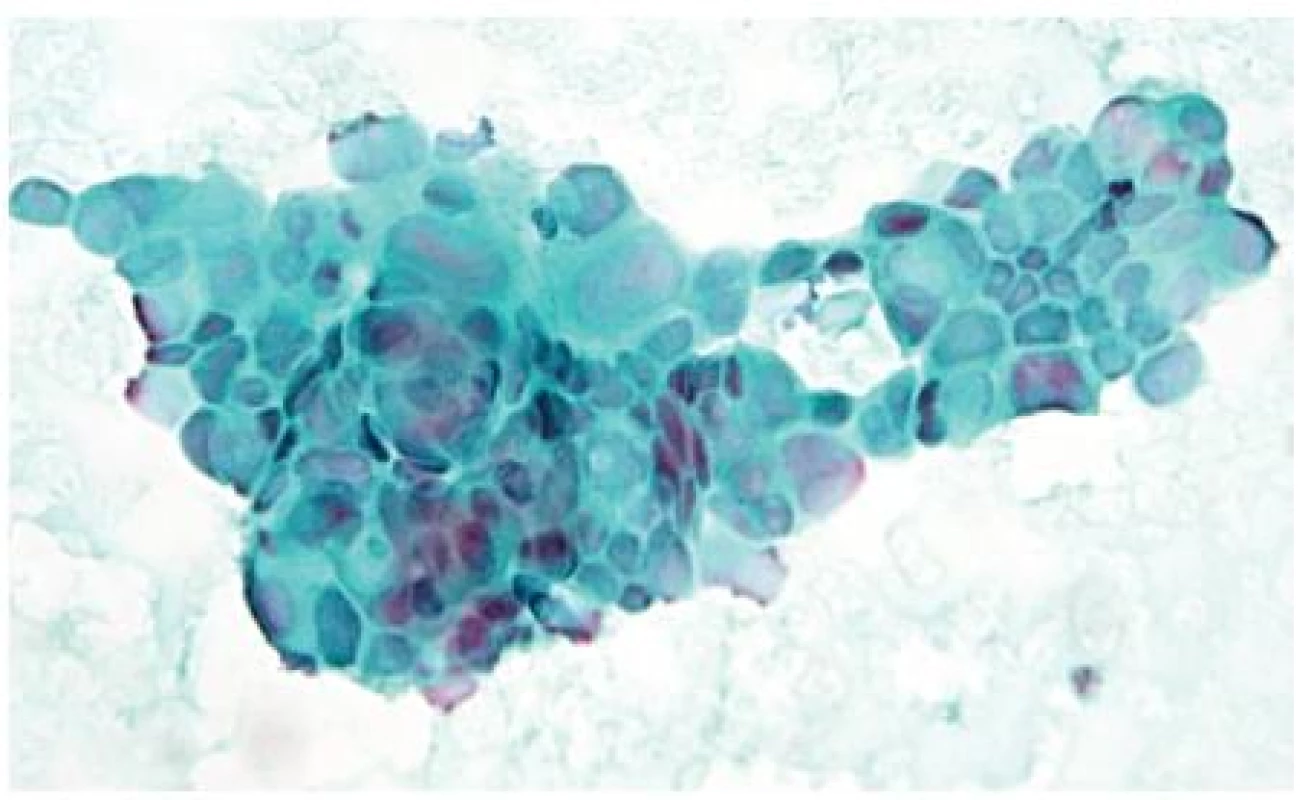
Navržený diagnosticko-léčebný algoritmus
Užití vyšetřovacích metod se liší podle pracoviště a je závislé na dostupnosti metody, zkušenostech a praxi personálu (4). V současné době je doporučováno pro diagnózu a staging nádorů pankreatu několik algoritmů. Postup, který je ukázán přehledně v schématu na obrázku 7, používáme na našem pracovišti. Jedná se o modifikaci diagnostického algoritmu, publikovaného v roce 2006 (43, 55). Postup je realizovatelný z hlediska jednoduchosti, dostupnosti a praktického využití dalších metod. Při klinickém podezření na KP nebo patologickém nálezu náhodně zjištěném při abdominální USG indikujeme spirální CT s kontrastem. Pokud je KP potenciálně resekabilní, nebo se jedná o nejasný nález, následuje EUS. Toto vyšetření provádíme i u pacientů s primárně neresekabilním KP vhodným k chemoterapii, pro kterou je nezbytné cytopatologické potvrzení diagnózy. Pokud obě vyšetření (EUS/CT) svědčí pro příznivé stadium pokročilosti, je pacient indikován ke kurativní resekci. Trvající nejistota možnosti radikálního chirurgického výkonu si vynutí provedení dalších diagnostických metod (MR, PET/CT, ERCP, případně laparoskopie).
7. Doporučený postup v diagnostice a léčbě karcinomu pankreatu 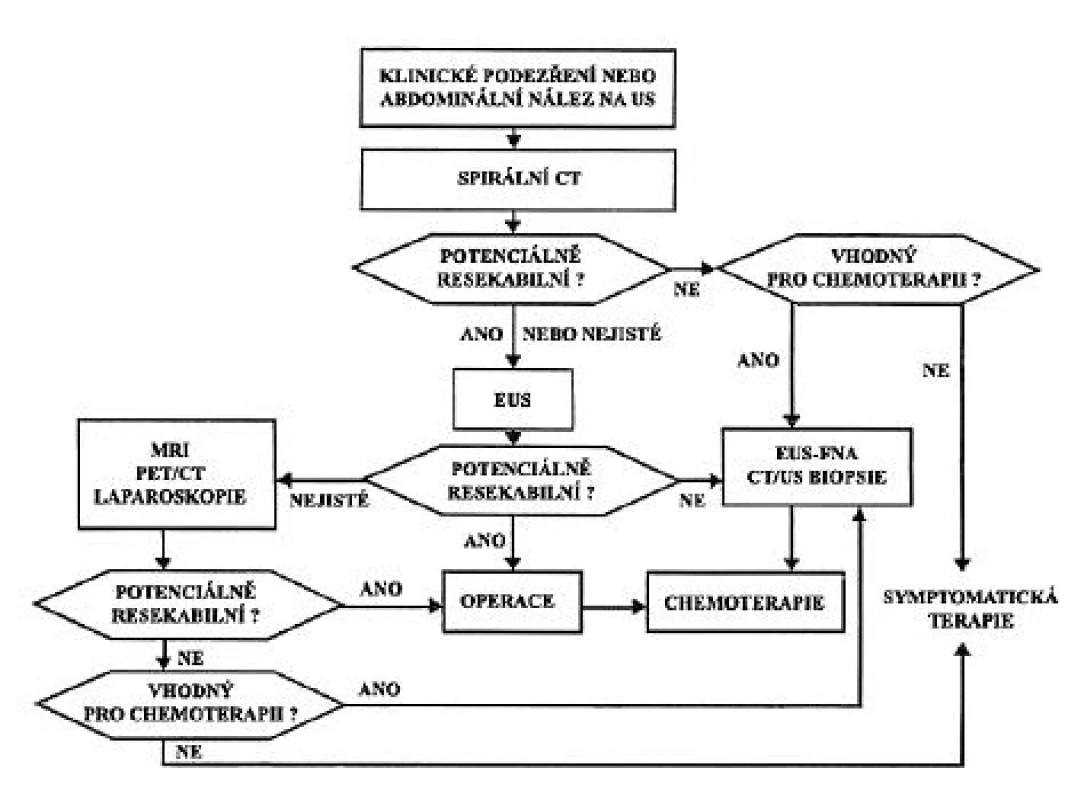
ZÁVĚR
Karcinom pankreatu zůstává stále nádorem s velmi špatnou prognózou. Klíčovou zůstává otázka časné diagnostiky a určení pacientů vhodných k radikální chirurgické léčbě. Nezbytností je určení stadia pokročilosti nádoru (staging) nejen ve vztahu k resekabilitě, ale i vzhledem k lokálnímu šíření a přítomnosti metastáz. Cílem je stanovení optimálního léčebného programu v co nejkratší době. Pacienti s KP by měli být soustředěni do center, která nabídnou komplexní diagnostiku a chirurgickou, onkologickou nebo kombinovanou terapii.
Zkratky
- CEA – karcinoembryonální antigen
- CT – počítačová tomografie
- DM – diabetes mellitus
- DM2 – diabetes mellitus 2. typu
- ERCP – endoskopická retrográdní cholangiopankreatografie
- EUS – endoskopická ultrasonografie
- hCG – podjednotka lidského choriogonadotropinu
- HP – hereditární pankreatitida
- ChP – chronická pankreatitida
- IFG – porucha glykémie nalačno
- IGT – porušená glukózová tolerance
- KP – karcinom pankreatu
- MR – magnetická rezonance
- MRCP – magnetická rezonanční cholangiopankretikografie
- PET – pozitronová emisní tomografie
- PRSS1 – gen pro kationický trypsinogen
- SPINK1 – gen pro serinovou proteázu
- sRAGE – solubilní receptor konečných produktů pozdní glykace
Práce podpořena grantem IGA MZ ČR NS9769-4.
ADRESA PRO KORESPONDENCI:
MUDr. Tomáš Krechler, CSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: tomas.krechler@vfn.cz
Sources
1. Ryska M, Bělina F, Strnad R. Chirurgická terapie. In: Zavoral M. Karcinom pankreatu. Praha: Galén 2005; 167–216.
2. Yeo CJ, Cameron JL. Improving results of pancreaticoduodenectomy for pancreatic cancer. World J Surg 1999; 23 : 907–912.
3. Parker SL, Tong T, Bolden S, et al. Cancer statistics, 1996. CA Cancer J Clin 1996; 46 : 5–27.
4. Zavoral M. Klinický obraz a diagnostika. In: Zavoral M. Karcinom pankreatu. Praha: Galén 2005; 99–136.
5. Freelove R, Walling AD. Pancreatic cancer: diagnosis and management. Am Fam Physician 2006; 73 : 485–492.
6. Yamaguchi K, Tahala M, and Committee for revision of clinical guidelines for pancreatic cancer of Japan Pancreas Society. EBM-based clinical guidelines for pancreatic cancer 2009 from the Japan Pancreas Society: A synopsis. Jpn J Clin Oncol 2011; 41 : 836–840.
7. Everhart J, Wright D. Diabetes mellitus as a risk factor for pancreatic cancer. JAMA 1995; 273 : 1605–1609.
8. Huxley R, Ansary-Moghaddam A, Berrington DF, et al. Type-II – diabetes and pancreatic cancer: a meta-analysis of 36 studies. Br J Cancer 2005; 92 : 2076–2083.
9. Pannala R, Leirness JB, Bamlet WR, et al. Prevalence and clinical profile of pancreatic cancer – associated diabetes mellitus. Gastroenterology 2008; 134 : 981–987.
10. Tsuchia R, Noda T, Harada N, et al. Colective review of small carcinoma of the pancreas. Ann Surg 1986; 203 : 77–81.
11. Krechler T, Zeman M, Vecka M, et al. Karcinom pankreatu – naše zkušenosti se vztahem k diabetes mellitus. Čas Lék čes 2010; 149 : 291–296.
12. Dítě P, Trna J, Bělohrádková J, et al. Pancreatic cancer – association with diabetes mellitus and smoking. Vnitř Lék 2011; 57 : 159–162.
13. Dítě P, Novotný J, Přecechtělová M, et al. Incidence of pancreatic carcinoma in patiens with chronic pankreatitis. Hepatogastroenterology 2010; 57 : 957–960.
14. Koudová M, Macek jr. M. Hereditární pankreatitida a karcinom pankreatu. In: Zavoral M. Karcinom pankreatu. Praha: Galén 2005; 53–65.
15. Greenhalf W, Malates N, Nilsson M, et al. International registries of families at high risk of pancreatic cancer. Pancreatology 2008; 8 : 558–565.
16. Buchler MW, Uhl W, Malfertheimer P. Pankreaserkrankungen. Basel: Karger 1996.
17. DiMagno EP, Reber HA, Tempero MA. AGA technical rewiew on the epidemiology, diagnosis and treatment of pancreatic ductal adenocarcinoma. Gastroenterology 1999; 177 : 1464–1484.
18. Bramhall SR, Allum WH, Jones AG, et al. Treatment and survival in 13560 patients with pancreatic cancer and incidence of the diseases in the West Midlands: an epidomiological study. Br J Surg 1995; 82 : 111–115.
19. Niederhuber JE, Brennan MF, Menck HR. The national cancer data base report on pancreatic cancer. Cancer 1995; 76 : 1671–1677.
20. Balci NC, Semelka RC. Radiologic diagnosis and staging of pancreatic ductal adenocarcinoma. Eur J Radiol 2001; 38 : 105–112.
21. Papanikolaou IS, Karatzas PS, Trintafyllou K, et al. Role of endoscopic ultrasonography in 2010. World J Gastroenterol 2010; 2 : 335–343.
22. Papanikolaou IS, Adler A, Neumann U, et al. Endoscopic ultrasound in pancreatic disease – its influence on surgical decision-making. Pancreatology 2009; 9 : 55–65.
23. Hunt GC, Faigel DO. Assassment of EUS for diagnosing, staging and determinig resectability of pancreatic cancer: a review. Gastrointest Endosc 2002; 55 : 323–237.
24. Bronstein YL, Loyer EM, Kaur H, et al. Detection of small pancreatic tumors with multiphasic helical CT. AJR Am J Roentgenol 2004; 182 : 619–623.
25. Kim T, Murakami T, Takamura M, et al. Pancreatic mass due to chronic pancreatitis: correlation of CT a MR imaging features aith pathologic findings. AJR Am J Roentgenol 2001; 177 : 367–371.
26. Roche CJ, Highes ML, Garvey CJ, et al. CT and pathologic assessment of prospective nodal staging in patents sith ductal adenocarcinoma of the head of pancreas. AJR Am J Roentgenol 2003; 180 : 475–480.
27. Adamek HE, Albert J, Breer H, et al. Pancreatic cancer detection with magnetic resonance cholangiopancreatography and endoscopic retrograde cholangiopancreatography: a prospective controlled study. Lancet 2000; 356 : 190–193.
28. Pamuklar E, Semelka RC. MR imaging of the pancreas. Magn Reson Imaging Clin N Am 2005; 13 : 313–330.
29. Janssen J. EUS elastography: current status and perspectives. Z Gastroenterol 2008; 46 : 572–579.
30. Itokawa F, Itoi T, Sofuni A, et al. EUS elastography combined with the strain ratio of tissue elasticity for diagnosis of solid pancreatic masses. J Gastroenterol 2011; 46 : 843–853.
31. Paganuzzi M, Onetto M, Martini P, et al. CA 19-9 and CA 50 in benign and malignant pancreatic biliary diseases. Cancer 1988, 61 : 2100–2108.
32. Riker A, Libutti SK, Bartlets DL. Advences in the early detection, diagnosis and staging of pancreatic cancer. Surg Oncol 1997; 6 : 157–169.
33. Urban D, Catane R. Serum tumor markers in oncology. Isr Med Assoc J 2009; 12 : 103–104.
34. Lee MX, Saif MW. Screening for early pancreatic ductal adenocarcinoma: an urgent call! JOP. J Pancreas 2009; 10 : 104–108.
35. Kuno N, Kurimoto K, Fukushima M, et al. Effectiveness of multivariate analysis of tumor markers in diagnosis of pancreatic carcinoma: a propective study in multiinstitutions. Pancreas 1994; 9 : 725–730.
36. Louhimo J, Alfthan H, Stenman UH, Haglund C. Serum HCG beta and CA 72–4 are stronger prognostic factors than CEA, CA 19-9 and CA 242 in pancreatic cancer. Oncology 2004; 66 : 126–131.
37. Okusaka T, Yamada T, Maekawa M. Serum tumor markers for pancreatic cancer: The Dawn of New Era? JOP. J Pancreas 2006; 7 : 332–336.
38. Koorstra JB, Hustinx SR, Offerhaus GJ, Maitra A. Pancreatic carcinogenesis. Pancreatology 2008; 8 : 110–1125.
39. Parker LA, Porta M, Lumbreras B, et al. Clinical validity of detecting K–ras mutations for the diagnosis of exocrine pancreatic cancer: a prospective study in a clinically-relevant spectrum of patients. Eur J Epidemiol 2011; 26 : 229–236.
40. Kamisawa T, Takuma K, Tabata T, et al. Long-term follow-up of chronic pancreatitis patiens with K-ras mutation in the pancreatic juice. Hepatogastroenterology 2011; 58 : 174–176.
41. Krechler T, Jáchymová M, Pavliková M, et al. Polymorphism –23HPhI in the promoter of insulin gene and pancreatic cancer: a pilot study. Neoplasma 2009; 56 : 26–32.
42. Krechler T, Jáchymová M, Mestek O, et al. Soluble receptor for advanced glycation end-products (sRAGE) and polymorphisms of RAGE and glyoxalase I genes in patients with pancreas cancer. Clin Biochem 2010; 43 : 882–886.
43. Krechler T, Zeman M, Vecka M, et al. Leptin and adiponectin in pancreatic cancer: connection with diabetes mellitus. Neoplasma 2011; 58 : 58–64.
44. Mansfield JC, Griffin SM, Wadehra V, Matthewson K. A prospective evaluation of cytology from biliary strictures. GUT 1997; 40 : 671–677.
45. Jallwala J, Fogel EL, Herman S, et al. Triple-tissue sampling at ERCP in malignant biliary obstruction. Gastroinest Endosc 2000; 51 : 383–390.
46. Macken E, Drijkoningen M, Van Aken E, Van Steenbergen W. Brush cytology of ductal strictures during ERCP. Acta Gastroenterol Belg 2000; 63 : 254–259.
47. Harewood GC, Wiersems LM, Halling AC, et al. Influence of EUS training and pathology interpretation of accuracy of EUS-guided fine needle aspiration of pancreatic masses. Gastrointest Endosc 2002; 55 : 669–673.
48. Raut CP, Braun AM, Staerkel GA, et al. Diagnostic accuracy of endioscopic ultrasound – guided fine-needle aspiration in patiens with presumed pancreatic cancer. J Gastrointest Surg 2003; 7 : 118–126.
49. O’Toole D, Palazzo L, Arotcarena R, et al. Assessment of complications of EUS – guided fine-needle aspiration. Gastrointest Endsosc 2001; 53 : 470–474.
50. Wilson JL, Kalade A, Prasat S, et al. Diagnosis of solid pancreatic masses by endoscopic ultrasound-guided fine-needle aspiration. Intern Med J 2009; 39 : 32–37.
51. Kliment M., Urban O., Cegan M. et al. Endoscopic ultrasound – guided fine needle aspiration of pancreatic masses: the utility and impact on management of patients. Scand J Gastroenterol 2010; 45 : 1372–1379.
52. Qian X, Hecht JL. Pancreatic fine needle aspiration. A comparison of computed tomographic and endsoscopic ultrasonographic guidance. Acta Cytol 2003; 47 : 723–726.
53. Mallery JS, Centano BA, Hahn PF, et al. Pancreatic tissue sampling guided by EUS, CT/US, and surgery: a comparison of sensitivity and specificity. Gastrointest Endosc 2002; 56 : 218–224.
54. Chang KJ, Nguyen P, Ericsson RA, et al. The clinical utility of endoscopic ultrasound-guided fine-needle aspiration in the diagnosis and staging of pancreatic carcinoma. Gastrointest Endosc 1997; 45 : 387–393.
55. Michl P, Oauls S, Gross TM. Evidence-based diagnosis and staging of pancreatic cancer. Best Pract Res Clin Gastroenterol 2006; 120 : 227–251.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Current status of pancreatic cancer diagnosis
- Postoperative recurrence of Crohn’s disease
- The role of estrogens in regulations of biological processes involved into wound healing – a review
- Metabolism monitoring with microdialysis in the intensive care
- Babyboxes in the Czech Republic – what next?
- Quadruple anniversary of Bohumil Eiselt
- Correlation of intracardiac pressures and electrical atrial potentials with morphology and function of overloaded atria assessed by echocardiography
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Current status of pancreatic cancer diagnosis
- Postoperative recurrence of Crohn’s disease
- The role of estrogens in regulations of biological processes involved into wound healing – a review
- Babyboxes in the Czech Republic – what next?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

