-
Medical journals
- Career
Klinická validita a užitečnost molekulárně genetických laboratorních zkoušek
Authors: R. Brdička
Authors‘ workplace: Ústav hematologie a krevní transfuze a Ústav experimentální medicíny AV ČR, Praha
Published in: Čas. Lék. čes. 2009; 148: 10-15
Category: Topic
Overview
Míra genetické determinace našich fenotypů je variabilní, z kvantitativního hlediska se liší intenzitou, s jakou ovládá jednotlivé znaky ať fyziologické, nebo patologické. Východiskem pro diagnostiku jsou stále častěji nálezy laboratorních vyšetření, která by měla mít z klinického hlediska dostatečnou výpovědní a užitnou hodnotu (klinickou validitu a klinickou užitečnost). Pro medicínu je znalost genetické determinace zásadní, a proto byly ustaveny různé způsoby jejího hodnocení, z nichž se věnujeme dvěma pohledům kvantifikujícím její míru: tzv. dědivosti a genetickému riziku opakování. Je přiblížen způsob jejich určování a diskutován význam uváděných hodnot, neboť porozumění těmto parametrům je velice užitečné pro lékařskou praxi, zvláště v případě jejich použití při konzultaci s pacientem.
Klíčová slova:
míra genetická determinace, dědivost (heritabilita), genetické riziko, monogenní choroby, komplexní choroby.Úvod
Klinická validita a klinická užitečnost jsou dalšími parametry genetického laboratorního vyšetřování navazující na analytickou validaci, o které již byla řeč (1), stejně jako první zmínka o validaci klinické (2).
Klinická validita je zcela závislá na kvalitě výsledků získaných laboratorními analýzami a přímo souvisí s jejich interpretacemi. Závěry klinické validace mohou být jednoznačné a odpovídat na otázku, zda jsou výsledky laboratorních vyšetření pro klinickou praxi použitelné, tedy mohou být použité v rámci diagnostiky, v péči a léčení pacienta, případně prognózy vývoje jeho onemocnění, nebo nikoliv. Pochopitelně odpověď na tyto otázky má kvantitativní charakter a vyjadřuje také, do jaké míry jsou laboratorní výsledky použitelné pro klinickou praxi. K lepšímu pochopení může přispět vzpomínka na rannější období laboratorního vyšetřování, kterému dominovala nepřímá metoda DNA testování. V té době jsme rozdělovali situace (rodiny) na informativní a neinformativní. V případě informativní situace jsme mohli s určitou mírou pravděpodobnosti odhadovat riziko přenosu postižení do další generace, tedy laboratorní výsledek byl schopen klinikovi při rozhodování pomoci. V případě neinformativnosti to nebylo možné a laboratorní vyšetření nebylo z tohoto hlediska klinicky validní, stejně jako užitečné, i když bylo v rámci laboratorních analýz provedeno bezchybně a správně (lege artis).
Zcela zásadní otázkou klinické validity je vztah mezi genotypem a fenotypem. Relativně jednodušší je situace u tak zvaných monogenních chorob, kdy mezi genotypem a fenotypem je dobře definovatelný vztah. Taková ideální situace je však vzácná a nenašli bychom mnoho příkladů, kterým by nebylo možné vytknout byť jen malou míru zjednodušení. Klasická formální genetika překonala nesoulad mezi teorií a praxí zavedením pojmů penetrance a expresivity, které jsou používány dodnes. Těmito pojmy vyjadřujeme, jak se skutečnost liší od stavu, kdy bychom u všech osob s daným genotypem našli stejný fenotyp. Padesátiprocentní penetrance znamená, že jen u poloviny nositelů daného genotypu najdeme i odpovídající fenotyp, a protože fenotyp bývá vícesložkový, expresivitou vyjadřujeme, jak je zřetelná ta která jeho složka.
Klinická užitečnost (užitná hodnota) s klinickou validitou těsně souvisí. Tam, kde je klinická validita nízká, nebo dokonce chybí, je i klinická užitečnost minimální nebo nulová. Přesto může klinická validita být zřejmá, ale užitečnost malá. Je třeba si uvědomit, že medicína ovládaná hipokratovskou přísahou, nechce-li se jí zpronevěřit, má v případě genetiky, s jejím dodržováním jisté problémy. Vyplývají z toho, že genetický pohled není omezen na pacienta a jeho osobní prospěch (v genetice raději mluvíme o vyšetřované osobě nebo o probandovi), ale všímá si a bere ohled na příbuzné dotyčné osoby včetně dětí – i ještě nenarozených. Ke genetickému uvažování také nesporně patří také pohled populační, který byl v souvislosti s eugenickými představami často chybně interpretován. Proto je posuzování klinické užitečnosti, v případě genetického testování, složité až záludné.
Situace by byla o něco jednodušší, kdybychom se mohli omezit na posuzování klinické užitečnosti jen vzhledem k vyšetřované osobě a nemuseli brát v potaz význam našich zjištění pro jeho příbuzné a potomky. Stejně nemůžeme nechat bez povšimnutí etické problémy, které jsou zatím spojeny hlavně s omezenými možnostmi terapie. Omezíme-li se na strukturní analýzu genomu – tedy na stanovení genotypu – ať v jakékoliv šíři (počínaje mutacemi na úrovni jednoho nukleotidu až po celogenomovou analýzu), můžeme a měli bychom zvážit pravděpodobnost výskytu obdobné situace u ostatních členů rodiny včetně dětí a případného přenosu do dalších generací. To je právě specifický úkol genetiky, kterým se odlišuje od ostatní medicínské diagnostiky. Zdrojem poznatků, se kterými je třeba zacházet podobným způsobem, mohou být i jiné druhy vyšetření, především cytogenetická a pochopitelně i vyšetření fenotypu. Nicméně právě proto, že existuje různá míra penetrance a expresivity a mnoho podobných fenotypů může mít různý genetický základ a obráceně, je třeba považovat za úplné pouze takové vyšetření, které obsahuje i nález získaný analýzou genomu. Dalším specifikem genetických vyšetření, zvláště takových, která vedou k určení zárodečného genotypu, je doba jejich platnosti. Na rozdíl od většiny ostatních laboratorních oborů, např. klinické biochemie, je jejich platnost celoživotní, a pokud jsou bezchybná, není je třeba opakovat. Stačí jednou za život. Klinická užitečnost je ovšem také závislá na dostupnosti takové informace. Všem srozumitelným příkladem mohou být krevní skupiny. S jakou se kdo z nás narodí, takovou má celý život (výjimkou mohou být osoby po alogenní transplantaci krvetvorných buněk).
Protože bychom však na klinickou užitečnost genetických vyšetření měli pohlížet nejen z hlediska vyšetřované osoby, ale i její rodiny a potomků, měli bychom při každém vyšetření zvážit, jaký význam bude získaný nález mít pro každého člena této „skupiny“. Jiný význam bude mít farmakogenetické vyšetření předoperační nebo před zahájením léčby pro vyšetřovaného a jiný pro ostatní členy rodiny. Rozdíl je nejen v akutnosti potřeby získat potřebné informace, ale i v tom, že analogická situace u ostatních členů rodiny nemusí nikdy nastat. Úplně jiný význam má nález dědičné dispozice k nějaké chorobě, kdy nejen vzhledem k možnosti anticipace, tedy dřívějšího propuknutí choroby u potomků postiženého, je informace pro ostatní členy rodiny stejně důležitá, ne-li ještě důležitější, zvláště z hlediska jejich potencionálního rodičovství.
Stať
Ze zákonitostí nebo pravidel formální genetiky můžeme odvodit i dva ze záklaních parametrů, které budou mít při hodnocení míry klinické užitečnosti genetických testů důležitý význam. Jsou to: heritabilita (dědivost) a riziko opakování.
Heritabilita – dědivost
Než si jich všimneme podrobněji, připomeneme si několik faktů. Genetické informace, které každý z nás získal od svých předků a které přeneseme do svých potomků, jsou zakódovány v nukleových kyselinách. Jejich replikace (kopírování) je velice složitý proces s vysokou mírou zajištění identity kopie s originálem. Aby nedocházelo k neúnosnému množení genetických informací, dochází při tvorbě gamet k jejich redukci tak, že nový jedinec získá od každého rodiče polovinu. Protože většina genetických informací je přítomna v každém z nás (v každé tělní buňce) ve dvojím vydání, přechází do nového jedince jen jedna z každých dvou. Při oplození vajíčka tak vzniknou nové dvojice, z nichž jedna polovina každé pochází od matky a druhá od otce.
Tato zdvojená genetická informace je naším genotypem a můžeme mít na mysli jednu – o jednom genu – jeho části, nebo všechny genetické informace. Taková dvojice může sestávat ze dvou identických nebo navzájem většinou jen nepatrně odlišných „polovin“. V odborném vyjadřování budeme nazývat tyto informace alelami a v případě jejich identity budeme mluvit o homozygotním genotypu, v případě různosti o heterozygotním. Výskyt těchto základních genotypů v populaci popisují Hardy-Weinbergovy zákony (někdy bývá připomínán ještě Castle), podle nichž můžeme usuzovat, zda distribuce genotypů v populaci je „normální“, tj., odpovídá pravidlům nahodné kombinace alel, nebo nikoliv. Odchylky od náhodné distribuce mohou být medicínsky významné a diagnosticky využitelné (3).
Popsat vztah mezi genotypem a fenotypem, tj. vnějším projevem genotypu, není jednoduché, neboť fenotyp je genotypem určován jen z části. Proces realizace genotypu ve fenotypu je většinou vícekrokový a podléhá mnoha dalším vlivům, a to jak opět ostatním genetickým informacím a jejich produktům, tak i vnějším vlivům působícím na celý organismus. Vzácné situace, kdy cesta od genotypu k fenotypu je krátká a poměrně jednoznačná, může připomenout například zmíněnou dědičnost krevních skupin ABO.
V rámci lidské patologie jsou relativně dobře prozkoumány vztahy mezi genotypem a fenotypem u tzv. monogenních chorob. Vedle alel „normálních“ (u ostatních organismů používáme termín „divokých“) nacházíme alely patogenní, z nichž genotyp může ovlivnit i jen jedna (z alelního páru) – jde o tzv. dominanci. Nebo v genotypu musí být přítomny obě patogenní alely, a pak mluvíme o tzv recesivitě. Ještě je třeba připomenout, že účinek různých alel na genotyp může být tak výrazný, že pro přítomnost různých alel v genotypu byly i jimi ovládané fenotypy zařazovány jako samostatné choroby (Beckerova a Duchenneova svalová dystrofie). Jinými slovy na úrovni jednoho genu – jedné genetické informace rozhoduje o fenotypu každá alela – genotyp (u genů, jichž lokusy se nacházejí na autozómech obě – alelní pár, u pohlavních chromozomů alela funkčního chromozómu). A protože geny disponují často větším počtem alel, existuje i velká variabilita ve fenotypovém projevu. Příkladem nám může být dnes již historický nález H. Harrise, který měřil aktivitu kyselé krvinkové fosfatázy a zjistil, že distribuce hodnot v populaci, která se podobala klasickému Gausovu rozložení, je ve skutečnosti tvořena skupinou distribucí odpovídajících jednotlivým fenotypům/genotypům (4). Variabilita fenotypu není ovšem dána pouze variabilitou genotypu, ale je výsledkem procesu jeho realizace v daných podmínkách, které někdy souhrnně označujeme jako vnější vlivy. Podíl genetické variability na variabilitě fenotypové právě vyjadřujeme heritabiltou daného znaku. V češtině máme pro heritabilitu termín dědivost. Rozeznáváme dědivost v širším smyslu slova i v užším smyslu slova a označujeme je jako H2 a h2. Při dědivosti v širším slova smyslu nerozlišujeme vliv jednotlivých složek genetické variability, ale hodnotíme je jako celek (genom, genofond) na rozdíl od dědivosti v užším slova smyslu, kdy se zaměřujeme pouze na aditivní (alelickou) složku genetické variability. U člověka, kde nemáme možnost volit experimentální podmínky, používáme k odhadu dědivosti dvojčecí studie (5–8) nebo studie rodokmenové a populační. Předpokládáme, že jednovaječná dvojčata mají identickou genovou výbavu, a lze tedy rozdíly mezi nimi poměrně dobře připsat vnějším vlivům. Proto jsou zvláště vhodné takové páry, u nichž na každého člena z páru působily odlišné podmínky. Populační studie (9) vyžadují vysoké počty jedinců v porovnávaných skupinách (10). Heslo „čím více, tím lépe“ uplatňované při tzv. metaanalýzách může být ošidné, protože by neměly být při sběru materiálu překročeny hranice oblastí s charakteristickými rozdíly ve výskytu alel (rasové, etnické a dokonce někdy i regionální) (11, 12). Číselné hodnoty dědivosti se pohybují mezi 0–100 %, nebo 0,00–1,00. Při úplném ovládání projevu znaku genetickými informacemi by byla hodnota dědivosti rovna 100 % a fenotyp, který je zcela dán vnějšími podmínkami by odpovídal 0 % dědivosti. Obě tyto extrémní hodnoty jsou spíše teoretické. Z medicínského hlediska se minimální hodnotě dědivosti blíží například úrazy a na druhé straně bychom mohli jmenovat již zmíněnou přítomnost určitých antigenních substancí na krvinkách v podobě krevních skupin. Většina fenotypových znaků se pohybuje mezi oběma extrémy – monogenní dědičné choroby se blíží spíše vyšším hodnotám dědivosti, jednotlivé znaky komplexních chorob spíše nižším a hodnoty dědivosti jsou k dispozici pro velké množství situací snad v každém medicínském oboru, z nichž uvedeme pro zajímavost jen několik příkladů: U vnitroočního tlaku jsou uváděny hodnoty H2 závislé na technice měření v rozmezí mezi 60 až 75 % (7), pro sklerózu věnčitých tepen uvádí Cassidy-Bushrow (13) podíl dědičných faktorů 14 %, H2 pro fobie 36–50 % (6), pro závislost na nikotinu (kouření) zjistil Hamdami (14), že genetické faktory se podílejí 55 % (11–84%), přičemž na vstupu do kuřácké komunity o něco více 61 % (52–71%), ale na vytrvání přibližně 50 % a výsledky se lišily vzhledem k pohlaví a věku. Závislost struktury kosti na věku a dědičnosti řešil Malkin (15). Vlivem aditivních genetických faktorů (h2) bylo možné vysvětlit 81 % variability v tělesné výšce, 59 % v BMI indexu (body mass index) a 50–60 % svalové síly (10). Vlastnosti semene a hladiny hormonů ovládajících funkci Sertliho buněk z hlediska heritability hodnotil Stoorgaard (5), H2 pro astma a alergie určil Willemsen (8) na 75 % a 66 %, pochopitelně s tím, že mnoho genetických faktorů je společných, dědivostí u schizofrenie se zabýval Porteous (16).
Rozptyly uváděných hodnot bývají značné!
O dědivosti viz též:
http://en.wikipedia.org/wiki/Heritability
Riziko
Druhým údajem, kterému se v tomto příspěvku věnujeme, je tzv. genetické riziko, riziko opakování nebo také genotypově-specifické riziko. Odhad tohoto parametru je stejně jako výše zmíněná dědivost záležitostí statistiky, která porovnává výskyt daného znaku s určitou genetickou konstelací (17). Podobně hodnotíme míru rizika, hraničícího s jistotou hodnotou 100 % nebo 1,00. V některých publikacích však najdeme vyjádření relativního rizika v podobě násobku, kolikrát častěji se daný fenotyp vyskytuje u nositele určitého genotypu ve srovnání s osobami jiného „normálního“ genotypu. Odhlédneme-li od jistoty, že všichni zemřeme, nachází se v pásmu blízkém jistotě celkem slušná řádka vztahů genotyp-fenotyp. Nejnápadnější je to u dominantního typu dědičnosti monogenních chorob (znaků), kdy přítomnost i jen jedné alely může znamenat i rozvoj onemocnění. Parametrem, který vyjadřuje rozvoj onemocnění, lze ovlivnit další vlivy, jako je míra penetrance vyjádřená buď dobou latence, během níž se přítomný genotyp ještě ve fenotypu neprosadí, nebo poměrem mezi počtem osob, které příslušný genotyp mají, a počtem osob, které mají odpovídající fenotyp. Úplnou penetrancí by byl stav, kdyby všichni nositelé příslušného genotypu měli i odpovídající fenotyp a jeho projevy by byly přítomné již v době našeho pozorování, např. od narození. Údaje o vztahu mezi genotypem a fenotypem jsou poměrně dobře prozkoumány u jednoduše dědičných chorob, a lze je proto použít i k hodnocení klinické užitečnosti. U komplexních chorob, kde je vztah mezi genotypem a fenotypem složitý a kde platí, že různé stavy genomu mohou vést k podobnému fenotypu, je i jakékoliv vyjádření o klinické užitečnosti genetického testování problematické přesto, že se o to řada autorů již pokouší (18–21). Je problematické hlavně proto, že procesům, které v genomu probíhají jak v rámci jeho základní funkce, tak pod vlivem vnějšího prostředí, zatím ještě nedostatečně rozumíme. A to nejen v individuálním genomu každého z nás, který rozhodně není totožný s genomy ostatních osob (existuje strukturní i funční variabilita), ale i na úrovni populační a evoluční. Dnes je sice již možné vyšetřit celý genom, i když zatím jen z hlediska určitých míst, např. SNP (jednonukleotidových polymorfismů), ale díky pokroku v sekvenčních technikách je možné, že v budoucnosti budeme moci získat při přijatelných nákladech i kompletní nukleotidovou sekvenci. Pak při znalosti všech eventualit mezigenových vztahů (22) budeme moci popsat genetický podklad našeho fenotypu (23, 24). Potřeba zvládnout i druhou a neméně důležitou část našeho problému, tj. zhodnocení významu všech ostatních vlivů, současných i minulých, je nepochybná, ale zatím také jen obtížně naplňovaná (25–29). Za tím účelem vznikají různé databáze, z nichž toxikologické problematice se věnovali Waters a Jackson (30).
Z hlediska výpočetního se pohybujeme v oblasti statistiky a počtu pravděpodobnosti. I zde stejně jako u dědivosti vycházejí výsledná čísla z různě velkých a často i různě definovaných souborů, a závěry se proto vyskytují v určitém, někdy značně širokém rozmezí (např. 7, 14, 31).
I když nepředpokládám, že by některý ze čtenářů chtěl proniknout hlouběji do podstaty a způsobu, jak k hodnotám rizika dospíváme, alespoň pro ty „výjimečně zvídavé“ poslouží odkaz na příručku statistiky v genetice „Handbook of Statistical Genetics“, kde se problematikou stanovení rizika zabývá A. Chakraborty (32). Najdeme v ní i zmínku o dalším, hojně užívaném parametru, jakým je tzv. PIC (polymorphism information content). Nehledě na jednoduchou mendelovskou dědičnost, u níž jsou odhady rizik zcela elementární – např. pro dominantní znak s plnou penetrancí, který nese jeden z rodičů, je pravděpodobnost narození dítěte se stejným znakem 50% neboli 0,5, pro situace se složitější genetickou determinací vycházíme z populačních údajů. Především zjišťujeme, jak často se uvedený znak vyskytuje v populaci, jak často se vyskytuje u dětí postižených rodičů (17), a hodnotíme tzv. empirické riziko. U něho opět platí, že získané hodnoty mají svůj rozptyl a nemusí se hodit pro všechny posuzované případy.
Vhodným příkladem nám mohou být nádorová onemocnění, která se obvykle vyskytují sporadicky (nahodile), někdy však v rodinném nakupení. V případě rodinného nakupení často zjistíme nějakého společného jmenovatele v podobě genotypu charakteristického pro všechny postižené – identifikujeme vrozenou (dědičnou) dispozici, která může být specifická pro určitý typ nádoru, nebo naopak ji nalézáme jako příčinu nádorových onemocnění nejrůznějšího typu. Toto platí jak pro zděděné dispozice, tak pro získané. Abychom byli konkrétnější, použijeme jako příklad nádory prostaty, jehož problematikou se pochopitelně zabývá velké množství prací. Empirické populační riziko je dáno výskytem v té které populaci.
Pro Českou republiku podle údajů Ústavu zdravotnických informací a statistiky ČR bylo například v roce 2005 pro karcinom prostaty jako příčinu smrti uváděno < 100/100 000 (27,7 na 100 000), přičemž výskyt nemocných dosahoval téměř 100/100 000 (tab. 1) (viz Zdravotnická ročenka http://www.uzis.cz). Různé další pohledy na význam dědičných faktorů tohoto onemocnění pak najdeme v následujících pracích, z nichž většina se zabývá jednotlivými konkrétními geny (9, 12, 33–40).
Table 1. Úmrtnost na zhoubné novotvary v ČR (= empirické populační riziko úmrtí) – výňatek z údajů zdravotnické ročenky za rok 2005 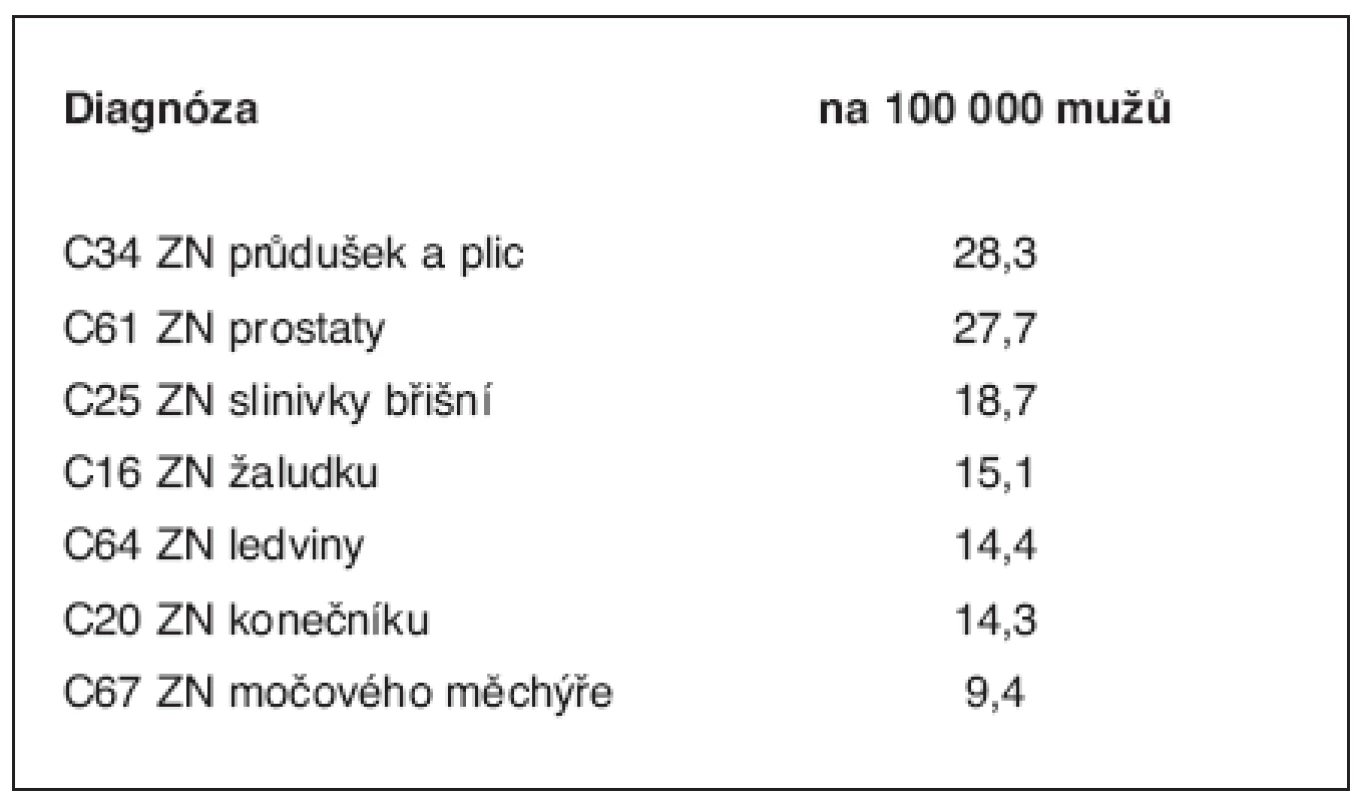
Studie založené na celogenomových analýzách ať strukturních (jednonukleotidové polymorfismy – SNP) (41) nebo funkčních (transkripční profilování) (42–44) se snaží odhalit vztahy panující uvnitř genomu, mezi genomem, transkriptomem a fenotypem. Jejich nástrojů (počítačových programů – Polymorphism Interaction Analysis – PIA) se snaží využít některé laboratoře v rámci tzv. DTC (Direct-to-Costumer) genetického testování. U obou přístupů však zůstává k řešení ještě řada problémů (45). Aby jimi generované výsledky byly dostatečně validní, je pro strukturní analýzy zapotřebí dostatečně velkých počtů analyzovaných vzorků. Nabízejí je již zmíněné metaanalýzy, které však často zanedbávají otázky populační struktury a mezipopulační rozdíly. Ty ale mohou mít podstatný vliv na jejich použitelnost, a proto je vždy zapotřebí platnost jejich závěrů ověřit na populaci, v níž mají být používány a jejíž strukturu známe (dnes se při zkoumání struktury populace již neomezujeme na fenotypové charakteristiky, ale hodnotíme i strukturu genotypovou). Podobným nedostatekm trpí i analýzy funkční a kromě toho se ukazuje, že funkční variabilita je zřejmě ještě mnohem vyšší než variabilita strukturní. Nehledě na technické problémy funkčních analýz (biočipové techniky) spojené se získáváním validních výsledků (analytická validita), je funkční variabilita na rozdíl od strukturní rovněž i dynamická, tj. mění se v čase. Zatím se zdají výsledky celogenomových studií v souvislosti s možnostmi jejich interpretace nepříliš přesvědčivé, ačkoliv postupy jsou neustále „vylepšovány“ (21, 46, 47). I názory některých podnikatelů v této oblasti diagnostických služeb jsou opatrné a upozorňují na interpretační problémy (48).
Ze všech výše uvedených důvodů je zatím použití celogenomových analýz funkčních i strukturních (SNP) v rámci DTC považováno za neodpovědné (20). Tyto přístupy budou vyžadovat ještě mnoho výzkumného úsilí a kritického zhodnocení. Prudký rozvoj technických možností a nebývale vysoký příliv informací nám nedopřává dost času potřebného k tomu, abychom stačili zhodnotit jejich význam a optimální způsob jejich využití. Ještě jsme se často ani nedokázali dohodnout na tom, jaká opatření jsou úměrná jakému riziku, kdy poskytovat a jaká doporučení, v jaké míře aplikovat prevenci, léčebná či jiná opatření. Na prvním místě však chybí potřebná a odpovídající míra vzdělání.
Závěr
Obecně platí, že čím je podíl genotypu na vytvářeném znaku menší, tím významnější jsou vnější vlivy, a proto je i klinická užitečnost stanovení genotypu nízká tam, kde je genetický podíl malý, a pochopitelně nepřináší mnoho tam, kde již známe empirické riziko. Pokud se nepodaří stanovit nějakou hierarchii jednotlivých součástí genetické determinace, bude klinická užitečnost genetického testování u komplexních chorob tak, jak vypadá v současnosti, velice nízká. I v případě vnějších vlivů se již přistoupilo k jejich hodnocení, jenže to je ještě mnohem obtížnější než hledání odpovědných genů. Je to dáno tím, že vnější vlivy působí nejen na náš fenotyp, ale i na náš genotyp – nejen zprostředkovaně, ale i přímo. Navíc může být jejich působení kladné i záporné – některé vlivy nás chrání, jiné podporují vznik nemoci či urychlují její průběh. Kromě toho je třeba chápat vzájemné působení jednotlivých faktorů dynamicky, tj. v časové proměnlivosti, a samozřejmě nezapomínat na tzv. „kulturní“ dědičnost – přenášení určitých typů chování z generace na generaci (27, 28, 49–54). Po formální stránce řeší otázky používání genetického testování v medicíně doplňkový protokol k Úmluvě o lidských právech.
Vedle zdravotníků a dalších profesí, které například pečují o životní prostředí, o kvalitu potravin, sociální zabezpečení atd., se zdravotním rizikem zabývají pojišˇtovny, zvláště ty, které nabízejí tzv. životní pojistky. Jejich hodnocení může vycházet z údajů o populačním výskytu daných onemocnění (úrazů) a nemělo by zohledňovat tzv. genetickou zátěž pojišťovaných osob. Zatím v tomto směru převažuje tendence omezovat zdroje informací a jejich dostupnost, ale smysluplnější by bylo soustředit se na sankční obranu proti zneužívání takových informací.
Adresa pro korespondenci:
prof. MUDr. Radim Brdička, DrSc.
Ústav hematologie a krevní transfuze
U Nemocnice 1, 128 08 Praha 2
fax: +420 221 977 196, e-mail: molgen@uhkt.cz
Sources
1. Brdička R, et al. Analytic Validation of Molecular Genetic Methods for Human Genom Analysis (Recommendation of SLG). Klin Biochem Metabol 2007; 1 : 58–62.
2. Brdička R, et al. Clinical Validation of Genetic testing. Klin Biochem Metabol 2007; 1 : 63.
3. Wang J, Shete S. A test for genetic association that incorporates information about deviation from Hardy-Weinberg proportions in cases. Am J Hum Genet 2008; 83 : 53–63.
4. Harris H. Enzyme polymorphisms in man. Proc R Soc Lond B Biol Sci 1966; 164 (sv 995): 298–310.
5. Storgaard L, et al. Genetic and environmental correlates of semen quality a twin study Epidemiology 2006; 17 : 674–681.
6. Distel MA, et al. Heritability of self-reported phobic fear. Broad-sense heritability estimates ranged from 36 to 51% and were similar for men and women. Behav Genet 2008; 38 : 24–33.
7. Carbonaro F, et al. Heritability of intraocular pressure a classical twin study. Br J Ophthalmol 2008; 92 : 1125–1128.
8. Willemsen G, et al. Heritability of self-reported asthma and allergy a study in adult. Dutch twins, siblings and parents. Twin Res Hum Genet 2008; 1 : 132–142.
9. Sun J, et al. Cumulative effect of five genetic variants on prostate cancer risk in multiple study populations. Prostate 2008; 68 : 1257–1262.
10. Silventoinen K, et al. Heritability of body size and muscle strength in young adulthood a study of one million. Swedish men Genet Epidemiol 2008; 32 : 341–349.
11. Marchini J, et al. The effects of human population structure on large genetic association studies. Nat Genet 2004; 36 : 1129–1130.
12. Drake BF, et al. Racial differences in prostate cancer screening by family history. Ann Epidemiol 2008; 18 : 579–583.
13. Cassidy-Bushrow AE, et al. Coronary artery calcification progression is heritable. Circulation 2007; 116 : 25–31.
14. Hamdani N, et al. Heritability and candidate genes in tobacco use Encephale 2006; 32 : 966–975.
15. Malkin I, et al. Heritability of a skeletal biomarker of biological aging. Biogerontology 2007; 8 : 627–637.
16. Porteous D. Genetic causality in schizophrenia and bipolar disorder out with the old and in with the new. Curr Opin Genet Dev 2008; 18 : 1–6.
17. Rybicki BA, Elston RC. The relationship between the sibling recurrence-risk ratio and genotype relative risk. Am J Hum Genet 2000; 66 : 593–604.
18. Marchini J, et al. Genome-wide strategies for detecting multiple loci that influence complex diseases. Nat Genet 2005; 37 : 413–417.
19. Wray NR, et al. Prediction of individual genetic risk to disease from genome-wide association studies. Genome Res 2007; 17 : 1520–1528.
20. Offit K. Genomic profiles for disease risk. JAMA 2008; 299 : 1353–1355.
21. Iles MM. What can genome-wide association studies tell us about the genetics of common disease. PLoS Genet 2008; e33.
22. Tan Q, et al. Retrospective analysis of main and interaction effects in genetic association studies of human complex traits. BMC Genet 2007; 870.
23. Chung Y, et al. Odds ratio based multifactor-dimensionality reduction method for detecting gene-gene interactions Bioinformatics 2007; 23 : 71–76.
24. Chen SH, et al. A support vector machine approach for detecting gene-gene interaction Genet Epidemiol 2008; 32 : 152–167.
25. Ambrosini GL, et al. Dietary patterns identified using factor analysis and prostate cancer risk a case control study in Western Australia. Ann Epidemiol 2008; 18 : 364–370.
26. Mink PJ, et al. Pesticides and prostate cancer a review of epidemiologic studies with specific agricultural exposure information. Eur J Cancer Prev 2008; 17 : 97–110.
27. Chávez A, MuĖoz de Chávez M. Nutrigenomics in public health nutrition short-term perspectives. Eur J Clin Nutr 2003; 57 (Suppl 1): S97–S100.
28. Ullah MF, Khan MW. Food as medicine potential therapeutic tendencies of plant derived polyphenolic compounds. Asian Pac J Cancer Prev 2008; 9 : 187–196.
29. Įrstavik RE, et al. Genetic and environmental contributions to depressive personality disorder in a population-based sample of Norwegian twins. J Affect Disord 2007; 99 : 181–189.
30. Waters M, Jackson M. Databases applicable to quantitative hazard/risk assessment-Towards a predictive systems toxicology. Toxicol Appl Pharmacol 2008; 233 : 34–44.
31. Rigby AS, et al. HLA haplotype sharing in rheumatoid arthritis sibships risk estimates subdivided by proband genotype. Genet Epidemiol 1998; 15 : 403–418.
32. Chakraborty R. Statistical Basis of Risk Calculationsin Handbook od Statistical Genetics. Balding DJ, Bishop M, Cannings C. (eds). New York: John Wiley & Sons Ltd 2001.
33. Beuten J, et al. CYP1B1 variants are associated with Prostate Cancer in non-Hispanic and Hispanic Caucasians Carcinogenesis 2008; 29 : 1751–1757.
34. Holt SK, et al. Association of megalin genetic polymorphisms with prostate cancer risk and prognosis. Clin Cancer Res 2008; 14 : 3823–3831.
35. Huse K, et al. Genetic variants of the copy number polymorphic beta-defensin locus are associated with sporadic prostate cancer. Tumour Biol 2008; 29 : 83–92.
36. Narod SA, et al. Rapid progression of prostate cancer in men with a BRCA2 mutation. Br J Cancer 2008; 99 : 371–374.
37. Ostrander EA, Johannesson B. Prostate cancer susceptibility loci finding the genes. Adv Exp Med Biol 2008; 617 : 179–190.
38. Wakefield CE, et al. Issues faced by unaffected men with a family history of prostate cancer a multidisciplinary overview J Urol 2008; 180 : 38–46.
39. Hemminki K, et al. New cancer susceptibility loci: Population and familial risks. Int J Cancer 2008; 123 : 1726–1729.
40. Arsova-Sarafinovska Z, et al. Manganese superoxide dismutase (MnSOD) genetic polymorphism is associated with risk of early-onset prostate cancer. Cell Biochem Funct 2008 26 : 771–777.
41. Mechanic, LE. Polymorphism Interaction Analysis (PIA) a method for investigating complex gene-gene interactions. BMC Bioinformatics 2008; 9 : 146.
42. Clarke J, West, M. Bayesian Weibull tree models for survival analysis of clinico-genomic data. Stat Methodol 2008; 5 : 238–246.
43. Schliekelman P, Slatkin M. Multiplex relative risk and estimation of the number of loci underlying an inherited disease. Am J Hum Genet 2002; 71 : 1369–1385.
44. Schliekelman P. Statistical power of expression quantitative trait loci for mapping of complex trait loci in natural populations. Genetics 2008; 178 : 2201–2216.
45. Lasky-Su J, et al. On the replication of genetic associations timing can be everything! Am J Hum Genet 2008; 82 : 849–858.
46. Slatkin M. Genotype-specific recurrence risks as indicators of the genetic architecture of complex diseases. Am J Hum Genet 2008; 83 : 120–126.
47. Li J. A novel strategy for detecting multiple loci in Genome-Wide Association Studies of complex diseases. Int J Bioinform Res Appl 2008; 4 : 150–163.
48. Dodsworth S. SNP genotyping aids diagnostic development. GEN 2008; 28 : 50–52.
49. Herceg Z. Epigenetics and cancer towards an evaluation of the impact of environmental and dietary factors. Mutagenesis 2007; 22 : 91–103.
50. Olden K, White SL. Health-related disparities influence of environmental factors. Med Clin North Am 2005; 89 : 721–738.
51. Olden K. Toxicogenomics – a new systems toxicology approach to understanding of gene-environment interactions. Ann NY Acad Sci 2006; 107 : 6703–6706.
52. Ishikawa H, et al. A polymorphism of the methionine synthase reductase gene increases chromosomal damage in peripheral lymphocytes in smokers. Mutat Res 2006; sv 599 : 135–143.
53. Ishikawa H, et al. Genotoxic effects of alcohol in human peripheral lymphocytes modulated by ADH1B and ALDH2 gene polymorphisms. Mutat Res 2007; sv 615 : 134–142.
54. Fontaine-Bisson B, et al. Genetic polymorphisms of tumor necrosis factor-alpha modify the association between dietary polyunsaturated fatty acids and fasting HDL-cholesterol and apo A–I concentrations. Am J Clin Nutr 2007; 86 : 768–774.
Přívažek:
adresy programů genetického vyhodnocování:
http://linkage.rockefeller.edu/soft/list.html
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Káva, její legenda, historie a vliv na lidské zdraví
- Nespravedlnost, která zabíjí Zpráva o sociálních determinantách zdraví
- Klinická validita a užitečnost molekulárně genetických laboratorních zkoušek
- Mastné kyseliny 1. Výskyt a biologický význam
- Osteoporóza: koho, kdy a jak léčit?
- Oxid dusnatý u obezity a metabolického syndromu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mastné kyseliny 1. Výskyt a biologický význam
- Osteoporóza: koho, kdy a jak léčit?
- Káva, její legenda, historie a vliv na lidské zdraví
- Oxid dusnatý u obezity a metabolického syndromu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

