-
Medical journals
- Career
Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
Authors: Bronislav Čapek; Jan Václavík
Authors‘ workplace: Interní a kardiologická klinika Fakultní nemocnice Ostrava a Lékařská fakulta Ostravské univerzity ; Interní oddělení, Sdružené zdravotnické zařízení Krnov, p. o.
Published in: Vnitř Lék 2023; 69(1): 14-22
Category: Review Articles
doi: https://doi.org/10.36290/vnl.2023.002Overview
V roce 2022 byla publikována aktualizovaná doporučení Evropské kardiologické společnosti pro kardiovaskulární hodnocení a perioperační management pacientů podstupujících nekardiální operační výkon. V článku stručně shrnujeme nejdůležitější body těchto doporučení s důrazem na využití v každodenní klinické praxi – od komplexního hodnocení kardiovaskulárního rizika a predikce kardiovaskulárních komplikací, přes indikaci základních paraklinických vyšetření, význam biomarkerů, úpravu farmakoterapie srdečního selhání, úpravu antikoagulační či protidestičkové terapie, po další specifika jednotlivých kardiovaskulárních i jiných onemocnění a jejich význam v perioperačním období. Znalost a využití doporučených postupů pro předoperační management má potenciál zlepšit prognózu pacientů podstupujících různé typy operačních výkonů.
Klíčová slova:
biomarkery – kardiovaskulární riziko – farmakoterapie – předoperační vyšetření
Úvod
V roce 2022 byla publikována aktualizovaná doporučení Evropské kardiologické společnosti (ESC) pro kardiovaskulární hodnocení a perioperační management pacientů podstupujících nekardiální operační výkon (NCS, non‑cardiac surgery). Nejedná se jen o aktualizaci, ale také o rozšíření doporučení pro předoperační, perioperační a pooperační péči.
Dosah této problematiky může být stručně vyjádřen počtem celosvětově provedených operačních výkonů, jejichž počet se odhaduje na více než 300 milionů ročně, tedy více než 5 % světové populace (1). Riziko perioperačních komplikací je určeno především klinickým stavem pacientů, jejich komorbiditami, rozsahem, typem a urgencí operačního výkonu. Následující doporučení se soustředí na předoperační kardiovaskulární hodnocení a perioperační management pacientů, u kterých je kardiovaskulární (KV) onemocnění potenciálním zdrojem komplikací.
Hodnocení kardiovaskulárního rizika
Stěžejním bodem při hodnocení KV rizika pacientů před jakýmkoli NCS nadále zůstává pečlivé posouzení anamnézy a fyzikální vyšetření se zaměřením na KV rizikové faktory a KV onemocnění. U všech pacientů podstupujících středně rizikový nebo vysoce rizikový výkon (viz Tab. 1) by měly být provedeny běžné laboratorní testy (renální funkce, mineralogram, krevní obraz) (1).
Table 1. Operační riziko dle typu operačního výkonu (1) 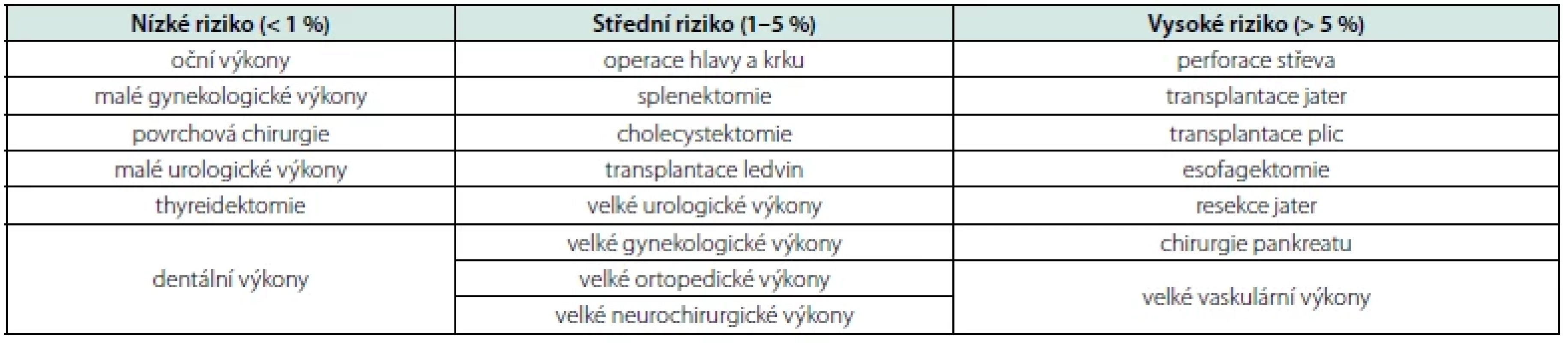
Elektrokardiografie (EKG) a odběr biomarkerů (hs‑cTn I/T, NTpro‑BNP/ BNP), ev. objektivní zhodnocení KV funkční kapacity, by měly být provedeny u pacientů nad 65 let věku, u pacientů s KV rizikovými faktory a pacientů se známým KV onemocněním, protože všichni tito pacienti mají zvýšené riziko KV perioperačních komplikací (1).
Před elektivními NCS je u pacientů se známým KV onemocněním doporučeno optimalizovat farmakoterapii a předoperačně dosáhnout co nejlepší kontroly všech rizikových faktorů (hypertenze, diabetu, dyslipidemie) (1).
Pacientům s nově zjištěným srdečním šelestem (a známkami KV onemocnění) má být provedena transthorakální echokardiografie (TTE) před jakkoli rizikovým NCS. U asymptomatických pacientů stačí provést TTE pouze před NCS s vysokým rizikem. I když lze výsledek TTE využít k rizikové stratifikaci pacientů, stále zůstává nejasné, jestli tím dochází ke zlepšení prognózy (1).
U pacientů s těžkým srdečním selháním (NYHA IV), kardiogenním šokem nebo těžkou plicní hypertenzí bychom se měli vyhnout vysoce rizikovým NCS, u pacientů s vysokým KV rizikem provádět co nejméně invazivní výkony (1).
Jako pomocný faktor k posouzení rizika KV komplikací mohou být použity různé skórovací systémy, které by ale neměly určovat další postup v předoperačním vyšetření.
Frailty syndrom
Předoperační hodnocení starších pacientů (> 70 let) by mělo zahrnovat i hodnocení frailty syndromu (křehkosti), který vyjadřuje snížení fyziologické rezervy se sníženou odolností, adaptabilitou a schopností odolávat stresovým vlivům, a velmi dobře predikuje špatný pooperační průběh (morbidita, mortalita) dané skupiny pacientů (2). Doporučenými screeningovými prostředky jsou Frailty Index, Frail Phenotype a Clinical Frailty Scale (1).
Elektrokardiografie
EKG nám může pomoci zachytit dříve neznámé KV onemocnění, které by mohlo vyžadovat terapii (např. fibrilace síní s rychlou odpovědí komor). Není ale doporučeno EKG provádět rutinně u nízce rizikových pacientů před nízce rizikovým NCS (3). Naopak je vhodné provést EKG u pacientů nad 65 let, u pacientů se známým KV onemocněním, u pacientů s KV rizikovými faktory nebo u pacientů s příznaky KV onemocnění.
Biomarkery
Biomarkery (hs‑cTn I/T, NTpro‑BNP/ BNP) mohou pomoci v odhadu perioperačního rizika. Vysoce senzitivní srdeční troponin I nebo T kvantifikuje myokardiální poškození, a NTpro‑BNP nebo BNP kvantifikují hemodynamický stres vyvíjený na srdeční stěnu. Velmi nízké hodnoty troponinů mají velmi vysokou negativní prediktivní hodnotu k vyloučení myokardiální ischemie. Několik velkých prospektivních studií ukázalo, že hs‑cTn I/T a BNP/NTpro‑BNP mají vysokou prognostickou hodnotu pro perioperační kardiální komplikace včetně KV úmrtí, srdeční zástavy, akutního srdečního selhání a tachyarytmií (1).
Asi u 15 % rizikových pacientů (s manifestním KV onemocněním, nebo > 65 let) dojde ke vzniku perioperačního infarktu či poškození myokardu (PMI), který u 90 % pacientů probíhá asymptomaticky. K jeho správné diagnostice je doporučováno stanovení hs‑cTn předoperačně a 1. a 2. pooperační den (viz Obr. 1).
Image 1. Opatření ke stanovení rizika a detekci perioperačních kardiálních komplikací. Perioperační poškození/infarkt myokardu je diagnostikováno, pokud dojde po operaci ke vzestupu hodnot hs-cTN o více, než je výše jeho horního referenčního rozmezí. 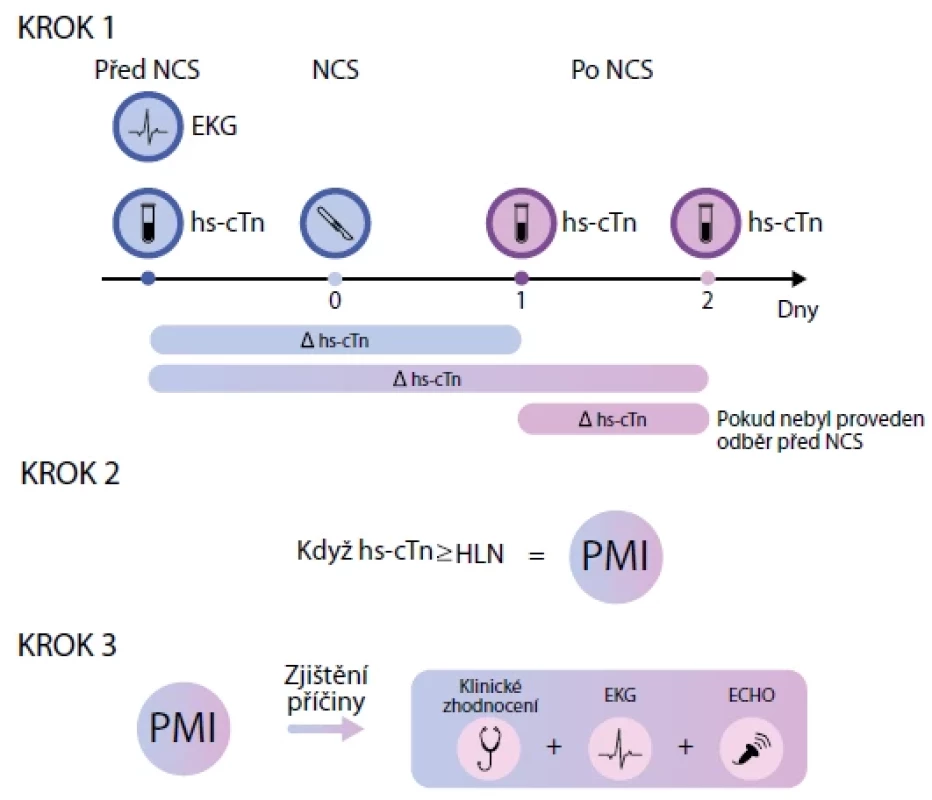
HLN – horní limit normy; PMI – perioperační infarkt myokardu Transthorakální echokardiografie
Rutinně prováděná TTE nesnižuje pooperační riziko velkých KV příhod (MACE) ani před vysoce rizikovou NCS (1), ale může identifikovat pacienty s lepší pooperační prognózou (4). Předoperačně provedený POCUS (point‑of‑care ultrasound) s přenosným ultrazvukovým přístrojem může zlepšit diagnostiku šelestů, hemodynamické nestability, funkce srdečních komor a dušnosti, a tím zúžit spektrum pacientů odesílaných k TTE. Nicméně dvojznačné výsledky nekontrolovaných a retrospektivních observačních studií zatím zcela nepotvrdily zlepšení prognózy pacientů (1). Jedním z omezujících faktorů POCUS je nemožnost adekvátního posouzení diastolické dysfunkce, která je nezávislým rizikovým faktorem pooperačního vzniku plicního edému, městnavého srdečního selhání (HF) a infarktu myokardu (IM) – nezávisle na ejekční frakci levé komory (5).
Zátěžové testy, funkční kapacita
Prosté subjektivní sebehodnocení schopnosti vyjít 2 patra schodů by mělo pomoci upravit odhad předoperačního rizika pacientů před středně až vysoce rizikovým NCS (1). Kardiopulmonální zátěžové testy nebyly ve studiích schopny predikovat 30denní pooperační mortalitu, pooperační IM, ani srdeční zástavu. Zátěžové testy v podobě ergometrie nebo chůze na běžeckém pásu by měly být zváženy pouze v případě, že není dostupná adekvátní neinvazivní zobrazovací metoda (1). Zátěžová TTE a SPECT (single‑photon emission computed tomography) mají podobnou prognostickou hodnotu – střední až velký perfuzní defekt má vysokou senzitivitu pro pooperační KV příhody (1).
CT koronarografie a invazivní koronární angiografie
Role CT koronarografie (CCTA) u pacientů před NCS byla zatím zkoumána pouze v malých až středně velkých observačních studiích. Ve studii Coronary CTA VISION zlepšila CCTA odhad primárního rizika KV smrti a nefatálních IM v prvních 30 dnech, nicméně výrazně nadhodnocovala perioperační riziko (1).
Vliv invazivní koronární angiografie na prognózu pacientů před NCS není zatím dobře prostudován. Je doporučeno využít stejných indikací k provedení invazivní koronární angiografie jako u ostatních pacientů, které NCS nečeká (1).
Kardiovaskulární rizikové faktory a úpravy životního stylu
Nejlépe dokumentovaným doporučením z řad úprav životního stylu je přerušení kouření. Observační studie opakovaně prokázaly, že přerušení kouření alespoň na 4 týdny zlepšuje prognózu pacientů před NCS – každý další týden výsledný efekt zvyšuje (1, 6).
Obézní pacienti mají vyšší výskyt KV rizikových faktorů, vyšší riziko smrti a zvýšenou pravděpodobnost komplikací v pooperačním období NCS (7), nicméně hubnutí těsně před operačním výkonem není vhodné. Lehce obézní pacienti podstupující NCS mají nižší mortalitu než pacienti s podváhou a normální hmotností. Obézní pacienti s dobrou kardiorespirační kondicí mají dobrou prognózu nezávisle na BMI (1).
Souhrn vhodných vyšetření dle rizika operačního výkonu a rizikového profilu pacienta najdete v tabulce 2.
Table 2. Indikace předoperačních vyšetření (dle literatury (1)) 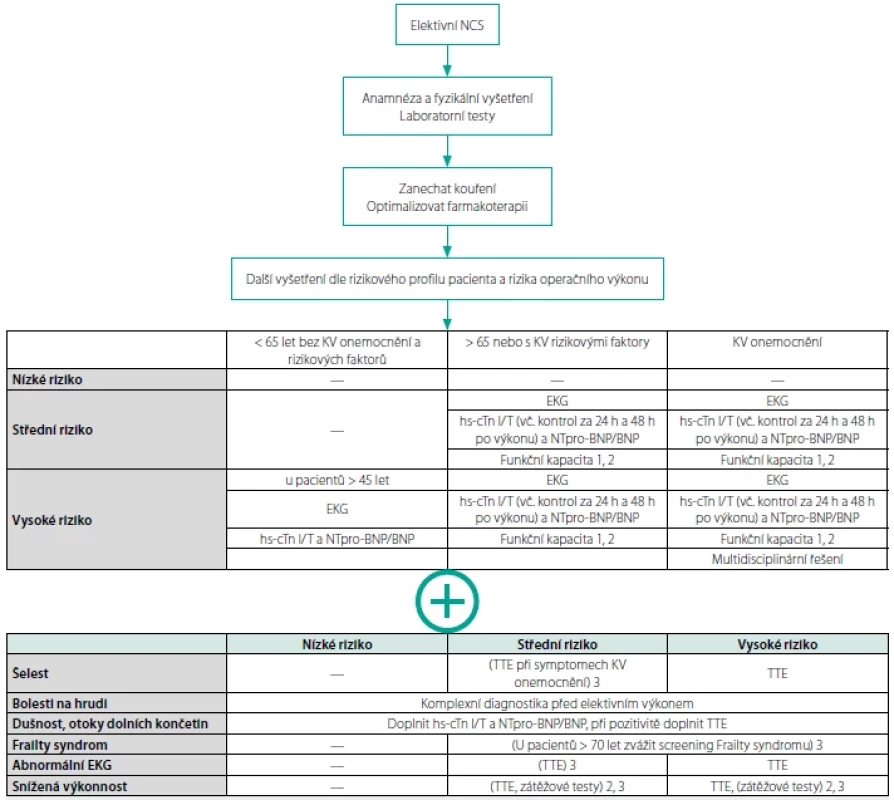
1) subjektivní sebehodnocení schopnosti vyjít 2 patra schodů
2) zvážit zátěžové testy při snížené funkční kapacitě, vysoké pravděpodobnosti chronické koronární nemoci, u pacientů po PCI nebo CABG
3) doporučení uvedené v závorce je možno zvážitFarmakoterapie
Betablokátory
Betablokátory (BB) jsou díky svým vlastnostem (snížení myokardiální potřeby O2, antiarytmický efekt, inhibice hyperaktivace neutrofilů) jedny z nejtestovanějších léků v perioperačním období. Ve studii POISE-1 metoprolol v dávce 200 mg denně nasazený 2–4 h před operačním výkonem a podávaný dalších 30 dní významně snížil pooperační KV komplikace, ale současně zvýšil celkové riziko smrti, ischemické centrální mozkové příhody (iCMP) a klinicky významné hypotenze a bradykardie (1). Ve většině dalších studií nebylo nasazení BB před NCS asociováno se zlepšením pooperační prognózy (1).
Na druhou stranu observační studie ukázaly zvýšení mortality po vysazení BB v perioperačním období (8). U pacientů na chronické terapii BB je tedy doporučeno tuto terapii nepřerušovat během celého perioperačního období (1).
Amiodaron
I když amiodaron pravděpodobně snižuje riziko vzniku fibrilace síní v perioperačním období NCS, efekt rutinního užívání na klinický benefit není zcela jasný (1).
Statiny
Zahájení terapie statiny před NCS není dostatečně prostudováno. Observační i prospektivní randomizovaná data nabízejí dvojznačné výsledky, které plně neprokazují snížení perioperačních KV rizik. Z tohoto důvodu není zahájení terapie statiny před NCS doporučeno. Perioperačně bychom měli v terapii statiny pokračovat, a to především před vysoce rizikovými vaskulárními výkony (1).
Table 3. Lékový management v perioperačním období (1) 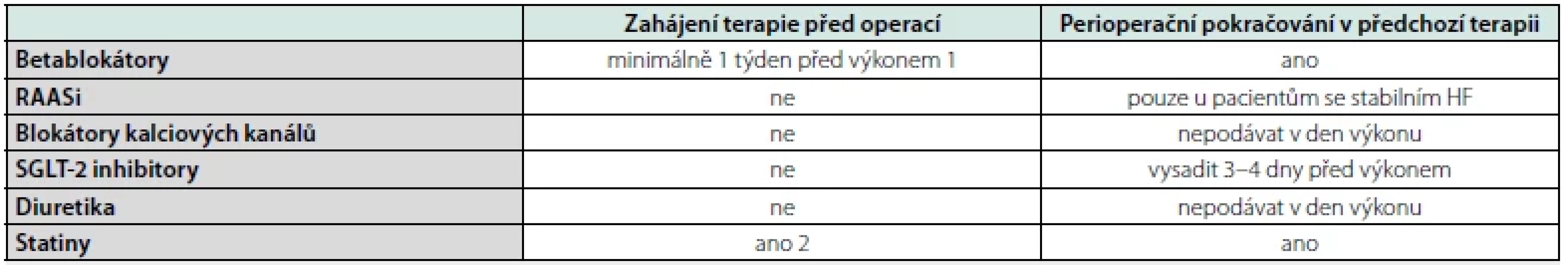
1) u pacientů s CV rizikovými faktory před vysoce rizikovým NCS s pomalou titrací k cílové tepové frekvenci
2) u pacienta s indikací k terapii statiny můžeme zahájit léčbu během celého perioperačního obdobíInhibitory renin‑angiotensin‑aldosteronového systému
Nepřerušené podávání inhibitorů renin‑angiotensin‑aldosteronového systému (RAAS) v perioperačním období zvyšuje riziko hypotenze a jako důsledek zvýšené užití vasopresorů a inotropik. Peroperační hypotenze je pak spojena s rozvojem AKI, IM a iCMP (9). Naopak vysazení RAAS inhibitorů před NCS snižuje riziko peroperační hypotenze, ale pravděpodobně nemá vliv na mortalitu a MACE (1).
Blokátory kalciových kanálů
U pacientů na chronické terapii blokátory kalciových kanálů (BKK) je doporučeno v této terapii pokračovat i v perioperačním období, ovšem s vynecháním dávky v den operačního výkonu k k omezení rizika pooperační hypotenze (1).
Diuretika
Dávkování diuretik u pacientů s HF by měla být v předoperačním období upravena k optimalizaci volumového stavu, aby se předešlo retenci tekutin nebo naopak dehydrataci. Veškeré elektrolytové dysbalance by měly být před operačním výkonem korigovány (včetně farmakologicky indukovaných). Retrospektivní data ukazují, že peroperační užití diuretik zvyšuje riziko AKI.
SGLT-2 inhibitory
Kazuistická data naznačují, že euglykemická diabetická ketoacidóza (EDKA) se může ojediněle vyskytnout po NCS u pacientů užívajících SGLT-2 inhibitory. EDKA je vzácná, ale nebezpečná komplikace. FDA proto doporučuje přerušení terapie SGLT-2 inhibitory alespoň 3–4 dny před plánovaným operačním výkonem za současného pečlivého pátrání po symptomech EDKA.
Kyselina acetylsalicylová
U pacientů užívajících kyselinu acetylsalicylovou (ASA) z primární prevence je ischemické riziko nízké a ASA může být před NCS vysazena (1). V rozsáhlé studii POISE-2 ASA nesnížila riziko smrti a nefatálních IM a zvyšovala riziko velkých krvácení (1). V subanalýze pacientů po PCI měla ASA signifikantní efekt na snížení rizika smrti a IM, proto by pacienti po PCI v minulosti měli v užívání chronické dávky ASA pokračovat během během perioperačního období, pokud riziko krvácení není nepřiměřeně vysoké. V případě recentně provedené PCI s implantací metalického stentu (BMS) by pacienti neměli ASA vysazovat alespoň 4 týdny, po implantaci lékového stentu (DES) 3–12 měsíců po implantaci.
U pacientů před NCS s vysokým rizikem krvácení by měla být ASA vysazena alespoň 7 dní před výkonem.
Duální antitrombotická terapie (DAPT)
Observační studie popisují zvýšené riziko MACE včetně KV úmrtí, IM a in‑stent trombózy v perioperačním období pacientů po PCI (nejvyšší riziko mají pacienti do 1 měsíce od PCI) (1). Předčasné přerušení DAPT u pacientů po recentní implantaci koronárního stentu je nejsilnější prediktor in‑stent trombózy. Elektivní výkon je doporučeno odložit o 6 měsíců po elektivní perkutánní koronární intervenci (PCI) a o 12 měsíců po akutním koronárním syndromu (ACS). Časově senzitivní výkony je doporučeno provést minimálně 1 měsíc od PCI (u vysoce rizikových pacientů minimálně 3 měsíce). Pokud je třeba přerušit antiagregační terapii, ticagrelol musí být vysazen 3–5 dní před výkonem, clopidogrel 5 dní a prasugrel 7 dní. Téměř všechny výkony by pak měly probíhat při nepřerušené terapii ASA (1).
Antagonisté vitaminu K
Pacienti na terapii antagonisty vitaminu K (VKA) pro mechanickou chlopeň (MHV) jsou velmi rizikovou skupinou stran tromboembolismu. U nízce rizikových výkonů s nízkým rizikem krvácení je doporučeno výkon provést bez přerušení terapie VKA. V opačném případě je vždy doporučena přemosťující (bridging) antikoagulační terapie. Rozdíl mezi nefrakcionovaným heparinem (UFH) a nízkomolekulárním heparinem (LMWH) nebyl pozorován (1).
Obdobně jako u pacientů s MHV, u pacientů s fibrilací síní (FS) nebo žilní tromboembolickou nemocí (VTE) lze u nízce rizikových výkonů s nízkým rizikem krvácení provést operační výkon bez přerušení terapie VKA. V dalších případech lze na 3–5 dní přerušit terapii VKA bez bridging terapie (1).
LMWH bridging lze zvážit u pacientů s vysokým tromboembolickým rizikem (CHA2DS2-VASc > 6, iCMP před méně než 3 měsíci, vysokým rizikem rekurence VTE). Terapie VKA by měla být obnovena za 12–24 h po výkonu (první dva dny s 50% navýšením oproti chronické dávce) (1). V případě LMWH bridgingu by k obnově VKA terapie mělo dojít současně s LMWH za 24 h po operaci až do dosažení účinného INR.
Přímá orální antikoagulancia
Invazivní chirurgické výkony (kromě těch s nejmenším rizikem krvácení) mohou vyžadovat přerušení terapie přímými orálními antikoagulancii (DOAC). Podobně jako u VKA je bridging terapie u DOAC spojena se zvýšeným rizikem krvácení, aniž by snižovala tromboembolické riziko (1). Bridging terapie u DOAC tedy není doporučena, ale měla by být zvážena u vysoce rizikových pacientů (VTE v posledních 3 měsících nebo VTE při předchozím přerušení DOAC).
U výkonů s velmi vysokým rizikem krvácení (spinální a epidurální anestezie), by mělo být přerušeno podávání DOAC alespoň 5 biologických poločasů (1).
DOAC můžeme vrátit zpět do terapie obvykle 6–8 h po výkonu v případě dostatečné kontroly hemostázy. Při vyšším riziku krvácení můžeme začátek užití DOAC posunout na 48–72 h po výkonu, v takovém případě v tomto období podáváme profylaktickou antikoagulační terapii (1).
Schéma 1. Management DOAC v perioperačním období (1) 
Perioperační tromboprofylaxe
Rozhodnutí o perioperační tromboprofylaxi by mělo být v předoperačním období pečlivě zváženo. Perioperační riziko VTE závisí na více faktorech (typ operace, imobilizace, komorbidity). Pacienti s KV onemocněním mají vyšší riziko VTE.
K určení potřeby perioperační tromboprofylaxe lze využít některé skórovací systémy (Caprini skóre) (1). Tromboprofylaxe má být zahájena na začátku hospitalizace, přerušena 12 h před výkonem a po výkonu pak podávána dle rizika krvácení do obnovení plné mobility pacienta (nebo do propuštění domů).
Krevní ztráty
Velké operační výkony nesou vyšší riziko perioperačních krevních ztrát. Již lehká anémie významně zvyšuje pooperační morbiditu (respirační selhání, močové, rané, septické a tromboembolické komplikace) a mortalitu (1). Anemiční pacienti vyžadující peroperační podání krevní transfuze mají o 50 % nižší dlouhodobé přežití (1).
Kromě poruchy kostní dřeně je většina anémií korigovatelná během 2–4 týdnů. Autotransfuze jsou doporučeny u operačních výkonů s předpokládanou krevní ztrátou přes 500 ml (1).
Koronární nemoc
Perioperační riziko KV komplikací u pacientů s koronární nemocí (coronary artery disease, CAD) závisí na několika faktorech (typ operačního výkonu a jeho načasování). Starší pacienti mají vyšší riziko než mladší a pacienti s recentním akutním koronárním syndromem (ACS) mají vyšší riziko než pacienti s chronickým koronárním syndromem (CHCS).
U pacientů s ACS bychom měli postupovat nezávisle na plánovaném elektivním operačním výkonu (který je možno alespoň o 3 měsíce odložit) – je tedy preferovaná PCI se zavedením DES stentu, až poté elektivní chirurgický výkon. V jiných případech by mělo být rozhodnutí mezi řešením ACS a operačním výkonem hodnoceno individuálně (1).
Chronické srdeční selhání
Srdeční selhání (heart failure, HF) je známým rizikovým faktorem pooperační mortality. Riziko pooperačních komplikací závisí přímo na ejekční frakci levé komory (EFLK), hemodynamické kompenzaci a přítomnosti příznaků HF (1). Pacienti s akutní dekompenzací HF mají vyšší perioperační mortalitu než pacienti se stabilním chronickým HF (1). Perioperační mortalita se zvyšuje se snižující se EFLK.
Ke snížení rizika akutní dekompenzace HF je doporučeno optimalizovat farmakoterapii dle doporučení ESC z roku 2020. K monitoraci pacientů s HF během NCS lze využít kontinuální intraarteriální monitoring krevního tlaku nebo techniku k analýze pulzní křivky k monitoraci hemodynamiky. Základní farmakoterapie HF by neměla být v perioperačním období přerušena. U pacientů s resynchronizační terapií je doporučeno ponechat přístroj zapnutý k zajištění lepší hemodynamické stability.
Hypertrofická obstrukční kardiomyopatie
U pacientů s hypertrofickou kardiomyopatií je doporučeno před NCS provést TTE k posouzení rozsahu hypertrofie, obstrukce a diastolické funkce. Je důležité se předoperačně vyhnout protrahovanému lačnění, protože dehydratace může snížit ejekční objem a zhoršit obstrukci výtokového traktu levé komory (LVOT). Farmakoterapie zaměřená na snížení obstrukčního gradientu v LVOT by neměla být v perioperačním období přerušena (1).
Chlopenní vady
Chlopenní vady zvyšují riziko perioperačních KV komplikací během NCS – závažnější jsou stenotické vady aortální a mitrální chlopně. Před středně až vysoce rizikovým elektivním NCS je u pacientů se známou nebo suspektní chlopenní vadou doporučeno TTE (pokud nebylo realizováno v posledním roce).
Těžká symptomatická aortální stenóza (AS) je silným rizikovým faktorem pooperačního IM, HF a krátkodobé i dlouhodobé pooperační mortality (1). U pacientů s těžkou symptomatickou AS je doporučeno odložit NCS a nejprve provést intervenci na aortální chlopni. V případě akutních operačních výkonů může být zváženo dočasné provedení balónkové valvuloplastiky. Pacienti s těžkou nesymptomatickou AS a normální EFLK mohou bezpečně podstoupit nízce a středně rizikový NCS (1).
Pacienti podstupující NCS s lehkou, nebo asymptomatickou středně těžkou mitrální stenózou (MS) a systolickým plicním arteriálním tlakem (SPAP) < 50 mm Hg mají relativně nízké riziko perioperačních komplikací. U ostatních pacientů je perioperační KV riziko zvýšené. V některých případech lze předoperačně provést perkutánní mitrální komisurotomii, vždy je ale nutná konzultace kardiocentra.
Pacienti s těžkou aortální nebo mitrální regurgitací, u kterých je indikovaná chlopenní intervence, mají být zaléčeni před středně až vysoce rizikovým NCS.
Profylaxe infekční endokarditidy by měla probíhat podle doporučení ESC z roku 2015.
Supraventrikulární a ventrikulární arytmie
Supraventrikulární i ventrikulární arytmie mohou doprovázet akutní chirurgické onemocnění v perioperačním období, ale pokud nejsou život ohrožující, neměly by vést k odkladu operačního výkonu. Všichni pacienti s anamnézou arytmie by měli mít předoperačně provedeno 12svodové EKG. Velmi důležité je vyhnout se vlivům, které mohou působit jako spouštěč arytmie (poruchy mineralogramu, ischemie myokardu, velké změny intravaskulárního objemu).
Kvůli supraventrikulárním arytmiím většinou k odložení operačního výkonu nedochází. Jedině v případě – přes veškerou farmakoterapii – recidivující supraventrikulární tachykardie lze zvážit před vysoce rizikovým NCS provedení radiofrekvenční ablace (RFA).
Část pacientů s fibrilací síní (FS) je asymptomatických a FS může být tedy nově diagnostikována i v předoperačním období. Před nástupem k operačnímu výkonu je nutná dostatečná kontrola frekvence (tzn. dosažení frekvence komor < 110/min) (1). Výběr antikoagulační terapie závisí na riziku operačního výkonu (viz výše), AK terapie by měla být zahájena co nejdříve.
Pokud nejsou komorové extrasystoly a nesetrvalé komorové tachykardie časté a symptomatické, pak u pacientů před urgentní NCS léčbu nevyžadují. Pokud jsou hemodynamicky významné, jsou indikovány beta‑blokátory (při jejich intoleranci amiodaron) (1). Naopak před elektivními výkony by měla proběhnout komplexní diagnostika komorových arytmií.
Při výskytu setrvalé komorové tachykardie nebo fibrilace komor v perioperačním období by mělo rychle dojít k vyloučení těžké systolické dysfunkce, ischemické choroby srdeční vyžadující revaskularizaci etc.
Bradykardie a kardiostimulace
Dočasná kardiostimulace u pacientů s bradykardií by měla být v perioperačním období vyhrazena pouze pro urgentní NCS – pokud není dostatečná reakce na farmakologickou chronotropní terapii. Pokud je indikovaná implantace kardiostimulátoru, měla by předcházet elektivnímu NCS (1).
U kardiostimulátor‑dependentních pacientů by před operačním výkonem měl být přístroj přeprogramován do asynchronního módu (u většiny modelů toho lze dosáhnout přiložením magnetu během výkonu). Pacienti s implantabilním defibrilátorem (ICD) by měli mít před výkonem přístroj vypnutý nebo také přiložený magnet k dočasnému přerušení defibrilační funkce. Minimalizace rizika elektromagnetické interference (EMI) lze dosáhnout použitím bipolární elektrokoagulace, krátkými impulzy (< 5 s) s co nejnižší energií a užitím elektrokauteru minimálně 15 cm od implantovaného přístroje.
Onemocnění perikardu
Terapie perikarditid by měla probíhat podle doporučení ESC z roku 2015. Akutní perikarditida je jasnou indikací k odkladu elektivního výkonu. V případě, že NCS odložit nelze, musíme dbát zvýšené pozornosti na lékové interakce. Kolchicin může kromě jiného zvyšovat efekt sedativ a zvyšovat riziko dechové zástavy. Chronická terapie kortikoidy může zvýšit riziko infekce a zhoršit hojení ran (akutní terapie kortikoidy hojení ran pravděpodobně nezhoršuje) (10). Hrozící srdeční tamponáda je absolutní kontraindikací jakéhokoli NCS.
Onemocnění plic
I když je chronická obstrukční plicní nemoc (CHOPN) rizikovým faktorem KV chorob, neexistují u těchto pacientů důkazy o zvýšeném výskytu KV perioperačních komplikacích. Užívání beta‑adrenergních agonistů a anticholinergik by se v perioperačním období nemělo přerušovat. Při přítomnosti plicní infekce by měl být elektivní výkon odložen do ukončení ATB terapie (11).
Plicní arteriální hypertenze je spojena se zvýšením morbidity a mortality u pacientů podstupujících NCS, což je především důsledkem hemodynamické odpovědi pravé komory na navýšení afterloadu (1).
Arteriální hypertenze
Pacienti s neléčenou hypertenzí před operačním výkonem mají významně vyšší 90denní mortalitu (1). Není doporučeno odkládat operační výkon u pacientů s hypertenzí 1.–2. stupně (TK < 180/110 mm Hg). Pokud se nejedná o emergentní NCS, je u pacientů se systolickým TK > 180 mm Hg a/nebo diastolickým TK > 110 mm Hg doporučeno výkon odložit do úpravy krevního tlaku (44). Dle meta‑analytických dat je peroperační hypotenze spojena se zvýšením morbidity, mortality, KV komplikacemi a AKI (1).
Cerebrovaskulární onemocnění
Pacienti se symptomatickou stenózou karotid (> 70 %) s prodělanou transientní ischemickou atakou nebo iCMP v posledních 3 měsících významně benefitují z revaskularizace, která by měla být provedena před elektivní NCS (1). Načasování revaskularizace vůči NCS u pacientů s těžkou asymptomatickou stenózou karotid není jasné.
Onemocnění ledvin
Přítomnost onemocnění ledvin představuje zvýšené riziko pooperačních KV komplikací (IM, iCMP, progrese HF), a to u pacientů s eGFR dle CKD‑EPI < 60 ml/min/1,73 m2. Navíc mají pacienti s KV onemocněním pooperačně vyšší riziko rozvoje AKI kvůli častým změnám hemodynamiky a kvůli přerušení farmakoterapie HF. Incidence pooperačního AKI se pohybuje v rozmezí 18–47 % (1).
Diabetes mellitus
Zvýšené perioperační riziko diabetiků vyplývá z více faktorů – pokročilejší aterosklerotické změny oproti zdravé populaci, zvýšené riziko iCMP, zvýšené riziko HF a zhoršené hojení ran. Data ukazují, že optimální terapie hyperglykemie před NCS snižuje pooperační riziko KV příhod včetně IM, iCMP a progrese HF (1). V den výkonu by měla být glykemie opakovaně kontrolována, cílová glykemie se pohybuje mezi 5,6–10 mmol/l.
Závěr
Přes nové poznatky a dostupná data v perioperačním období pacientů zbývá mnoho otázek, které zatím neumíme zodpovědět. Velká část doporučení je postavena na restrospektivních analýzách úzce specifikované skupiny pacientů (např. jedním typem operačního výkonu) a názorech expertních skupin. Měli bychom se v budoucnu pokusit o provedení a zařazení více randomizovaných kontrolovaných studií do doporučených postupů pro perioperační management.
MUDr. Bronislav Čapek
Interní oddělení, Sdružené zdravotnické zařízení Krnov, p. o.
capek.bronislav@szzkrnov.czCit. zkr: Vnitř Lék. 2023;69(1):14-22
Článek přijat redakcí: 31. 10. 2022
Článek přijat po recenzích: 11. 1. 2023
Sources
1. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non‑cardiac surgery: Developed by the task force for cardiovascular assessment and management of patients undergoing non‑cardiac surgery of the European Society of Cardiology (ESC) Endorsed by the European Society of Anaesthesiology and Intensive Care (ESAIC), European Heart Journal, 2022;, ehac270, https://doi.org/10.1093/eurheartj/ehac270
2. Sioutas G, Tsoulfas G. Frailty assessment and postoperative outcomes among patients undergoing general surgery. Surgeon. 2020;18(6):e55-e66. doi:10.1016/j.surge.2020. 04. 004
3. Sowerby RJ, Lantz Powers AG, Ghiculete D, et al. Routine Preoperative Electrocardiograms in Patients at Low Risk for Cardiac Complications During Shockwave Lithotripsy: Are They Useful?. J Endourol. 2019;33(4):314-318. doi:10.1089/end.2019.0053
4. Kusunose K, Torii Y, Yamada H, et al. Association of Echocardiography Before Major Elective Non‑Cardiac Surgery With Improved Postoperative Outcomes – Possible Implications for Patient Care. Circ J. 2019;83(12):2512-2519. doi:10.1253/circj.CJ-19-0663
5. Kaw R, Hernandez AV, Pasupuleti V, et al. Effect of diastolic dysfunction on postoperative outcomes after cardiovascular surgery: A systematic review and meta‑analysis. J Thorac Cardiovasc Surg. 2016;152(4):1142-1153. doi:10.1016/j.jtcvs.2016. 05. 057
6. Wong J, Lam DP, Abrishami A, Chan MT, Chung F. Short‑term preoperative smoking cessation and postoperative complications: a systematic review and meta‑analysis. Can J Anaesth. 2012;59(3):268-279. doi:10.1007/s12630-011-9652-x
7. Bamgbade OA, Rutter TW, Nafiu OO, Dorje P. Postoperative complications in obese and nonobese patients. World J Surg. 2007;31(3):556-561. doi:10.1007/s00268-006-0305-0
8. Hoeks SE, Scholte Op Reimer WJ, van Urk H, et al. Increase of 1-year mortality after perioperative beta‑blocker withdrawal in endovascular and vascular surgery patients. Eur J Vasc Endovasc Surg. 2007;33(1):13-19. doi:10.1016/j.ejvs.2006. 06. 019
9. Gregory A, Stapelfeldt WH, Khanna AK, et al. Intraoperative Hypotension Is Associated With Adverse Clinical Outcomes After Noncardiac Surgery. Anesth Analg. 2021;132(6):1654 - 1665. doi:10.1213/ANE.0000000000005250
10. Wang AS, Armstrong EJ, Armstrong AW. Corticosteroids and wound healing: clinical considerations in the perioperative period. Am J Surg. 2013;206(3):410-417. doi:10.1016/j. amjsurg.2012. 11. 018
11. Jamali S, Dagher M, Bilani N, et al. The Effect of Preoperative Pneumonia on Postsurgical Mortality and Morbidity: A NSQIP Analysis. World J Surg. 2018;42(9):2763-2772. doi:10.1007/s00268-018-4539-4
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2023 Issue 1-
All articles in this issue
- Jistoty a nejistoty na křižovatkách současné medicíny
- Isolated pulmonary embolism – a specific clinical entity?
- What is new in 2022 ESC guidelines on cardiovascular assessment and management of patients undergoing non‑cardiac surgery
- Diabetic foot infection – diagnosis and treatment
- Dental interventions in oral antithrombotic therapy
- Histamine intolerance
- Gut microbiome and renal transplantation
- Differential diagnosis of increased Erythrocyte Sedimentation rate
- News in cardiology
- ESC 2022 a studie DELIVER
- Zprávy o knihách
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Histamine intolerance
- Differential diagnosis of increased Erythrocyte Sedimentation rate
- Dental interventions in oral antithrombotic therapy
- What is new in 2022 ESC guidelines on cardiovascular assessment and management of patients undergoing non‑cardiac surgery
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

