-
Medical journals
- Career
Vyšetření renální funkce v praxi
Authors: Vladimíra Bednářová; Hana Šafránková
Authors‘ workplace: Klinika nefrologie VFN a 1. LF UK Praha
Published in: Vnitř Lék 2022; 68(E-1): 27-32
Category:
Overview
Pacienti s chronickým onemocněním ledvin nejsou často pro minimální obtíže včas podchyceni ani praktickým lékařem ani odborným lékařem a přicházejí k léčbě nahrazující funkci ledvin nepřipraveni a pozdě. Nemají informace o možnostech léčby, včetně preemptivní transplantace ledvin a nemají vytvořený trvalý dialyzační přístup. Tento fakt pak zvyšuje riziko úmrtí a morbiditu pacientů po zařazení do dialyzačního programu. Preventivní vyšetření, jako je kontrola krevního tlaku, biochemické vyšetření séra, vyšetření moči a vyšetření glomerulární filtrace by umožnilo záchyt těchto pacientů praktickými a odbornými lékaři a včasné předání nemocných nefrologům.
Klíčová slova:
Glomerulární filtrace – albuminurie – proteinurie – chronické selhání ledvin
Úvod
Chronické onemocnění ledvin (CKD – chronic kidney disease) je definováno přítomností zhoršené renální funkce nebo přítomností strukturálních a funkčních změn ledvin a dobou trvání více než 3 měsíce (tabulka 1). Jedná se o heterogenní skupinu onemocnění, která ve výsledku ovlivňují celkový stav pacienta, zvyšují riziko kardiovaskulárního onemocnění, riziko akutního renálního selhání a riziko mortality (1). Snížená glomerulární filtrace je definovaná jako snížení renální funkce pod 1 ml/s na 1,73 m2. Selhání ledvin nebo ESKD (end stage kidney disease) je definováno jako zhoršení renální funkce pod 0,25 ml/s na 1,73 m2 (2). Pacienti s ESKD jsou indikováni při dalším zhoršení glomerulární filtrace k léčbě nahrazující funkci ledvin, k RRT (renal replacement therapy). Včasná diagnostika CKD je velmi obtížná, neboť pacienti s CKD nemají žádné klinické projevy až do stadia pokročilé renální insuficience. V této fázi onemocnění se začínají projevovat metabolické a hormonální změny, jako je anémie, pokročilá kostní nemoc, těžká metabolická acidóza, poruchy kognitivních funkcí a retence uremických toxinů, které společně vedou k rozvoji uremického syndromu. Uremický syndrom se může projevit gastroenteritidou, krvácivými stavy, uremickou encefalopatií a polyserositidou. Komplikace mohou vést k úmrtí pacienta (3). Cílem péče o pacienty s CKD je zpomalit progresi renálního poškození a co nejdále oddálit konečné selhání ledvin. Dalším úkolem je léčba komplikací renální insuficience a včasná příprava do transplantačně dialyzačního programu. Pacient s CKD by měl být proto včas diagnostikován a odeslán k nefrologovi, to je nejpozději rok před zahájením dialyzační léčby (2). Další indikace k odeslání pacienta na nefrologii jsou uvedeny v Tabulce číslo 6. Odhalení rizika CKD a diagnostika CKD může významně ovlivnit další osud nemocného. Cílem tohoto článku je seznámit lékaře, jak postupovat při vyšetření pacienta s chronickým onemocněním ledvin a pacienta s rizikem CKD, jaká vyšetření provést a kdy odeslat pacienta k nefrologovi.
Table 1. CKD – definice a známky poškození ledvin 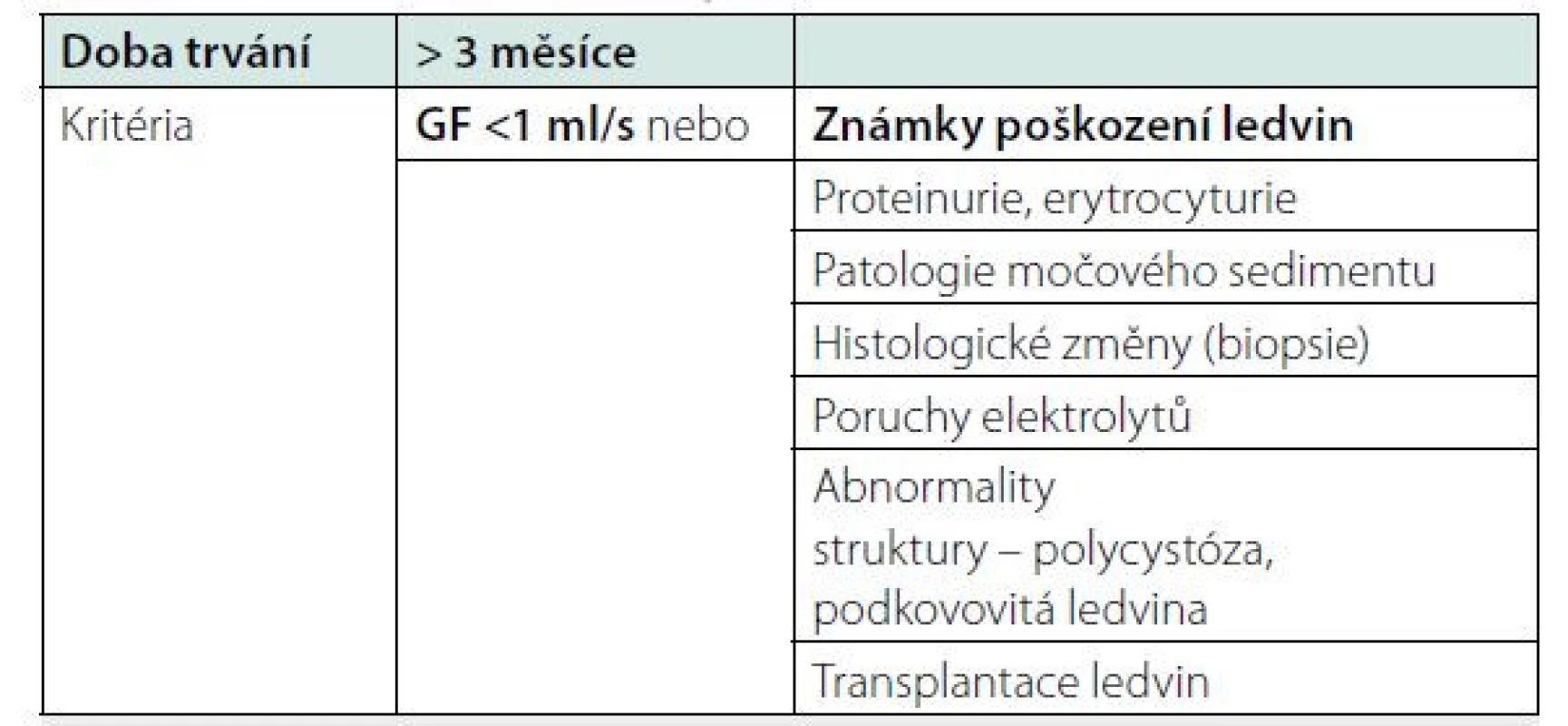
GF – glomerulární filtrace Chronické onemocnění ledvin CKD
Může mít celou řadu příčin, které jsou uvedeny v tabulce č. 2. Mezi hlavní rizikové faktory CKD patří hypertenze, diabetes, genetická predispozice, kardiovaskulární onemocnění, riziko CKD se zvyšuje s věkem pacienta. Z ročenky Česke nefrologické společnosti víme, kolik je v České republice pacientů s konečným selháním ledvin léčených RRT. Počet pacientů s renální insuficiencí není přesně znám, ale můžeme jej odhadnout ze statistik podobně vyspělých zemí. Snížená renální funkce má celosvětově za následek čtyři procenta všech úmrtí, z toho polovina pacientů umírá na kardiovaskulární onemocnění. V USA v roce 2010 mělo CKD 10,4 procent mužů a 11,4 procent žen. Čísla jsou srovnatelná s prevalencí diabetu, která je v USA 10,6 % (4, 5). CKD se dělí do pěti stadií G1-G5 podle renální funkce a podle přítomnosti albuminurie do stadií A1-A3. Kategorizace dle renální funkce a albuminurie je uvedena v tabulkách č. 3 a 4. Hlavním cílem péče o pacienty s chronickým onemocněním ledvin je maximální renoprotekce a zpomalení progrese onemocnění do konečného stadia selhání ledvin. Mezi rizikové faktory zhoršení renální funkce patří proteinurie, nedostatečně kontrolovaná hypertenze a ostatní faktory uvedené v tabulce č. 2. Senioři s mírnou renální insuficiencí bez proteinurie a s dobře kompenzovaným krevním tlakem mají obdobné mortalitní riziko jako lidé s normální renální funkcí. Nefrologická péče o pacienty s CKD se zaměřuje na maximální ovlivnění všech rizikových faktorů. Hlavním cílem je snížení proteinurie, léčba hypertenze, kontrola diabetu, léčba hypercholesterolemie. Nelze opomenout ani režimová a dietní opatření, nutný je zákaz kouření (6). Lékem první volby léčby hypertenze jsou ACEI nebo sartany pro svůj renoprotektivní efekt (7). Novými léky snižujícími riziko progrese renálního onemocnění jsou glifloziny. Studie DAPA CKD prokázala snížení kardiovaskulárního a renální rizika i u pacientů s CKD bez diabetu (8). Léčba glifloziny není u nediabetiků v současné době hrazena pojišťovnami.
Table 2. Příčiny selhání ledvin a rizikové faktory progrese CKD 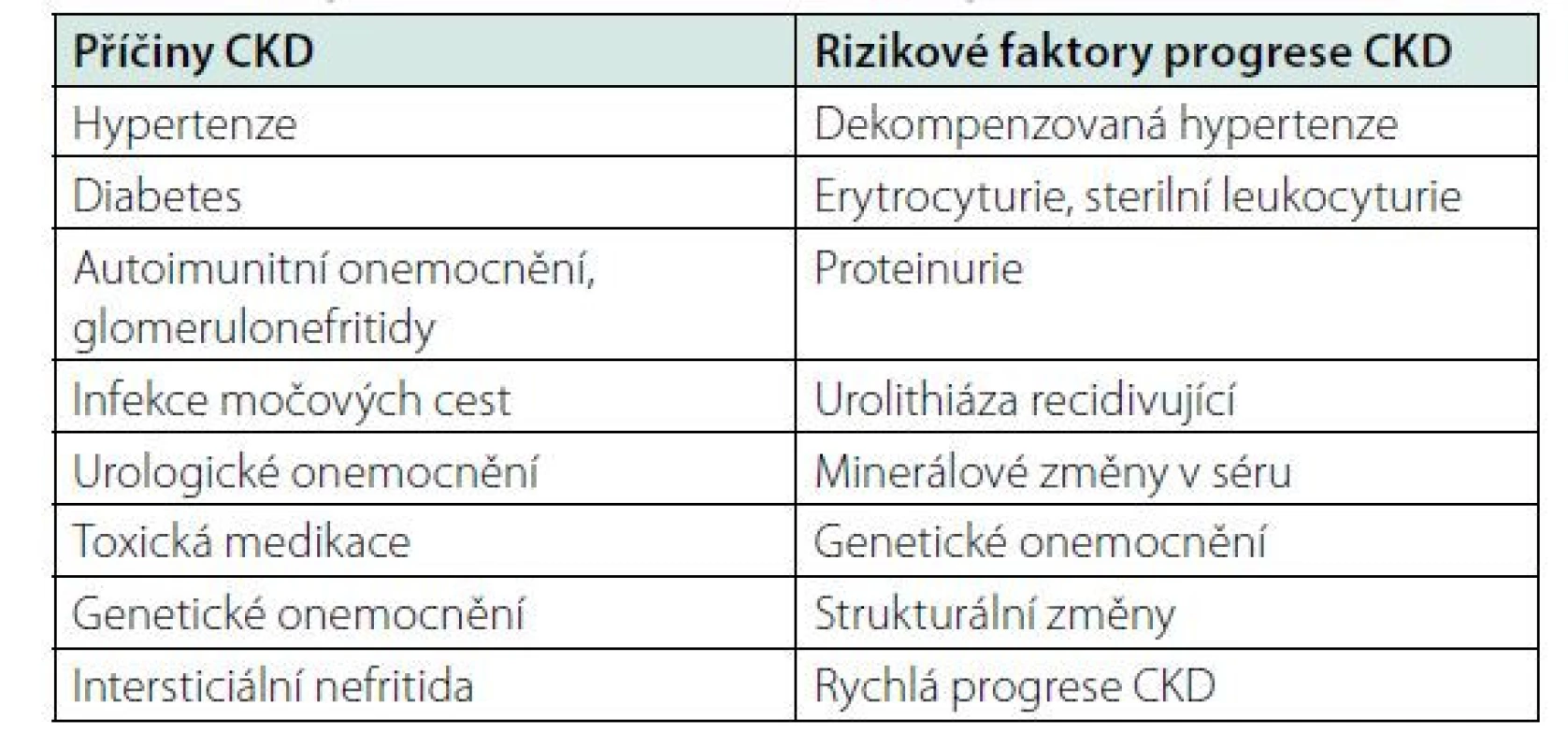
Table 3. Kategorie CKD dle hodnoty GF 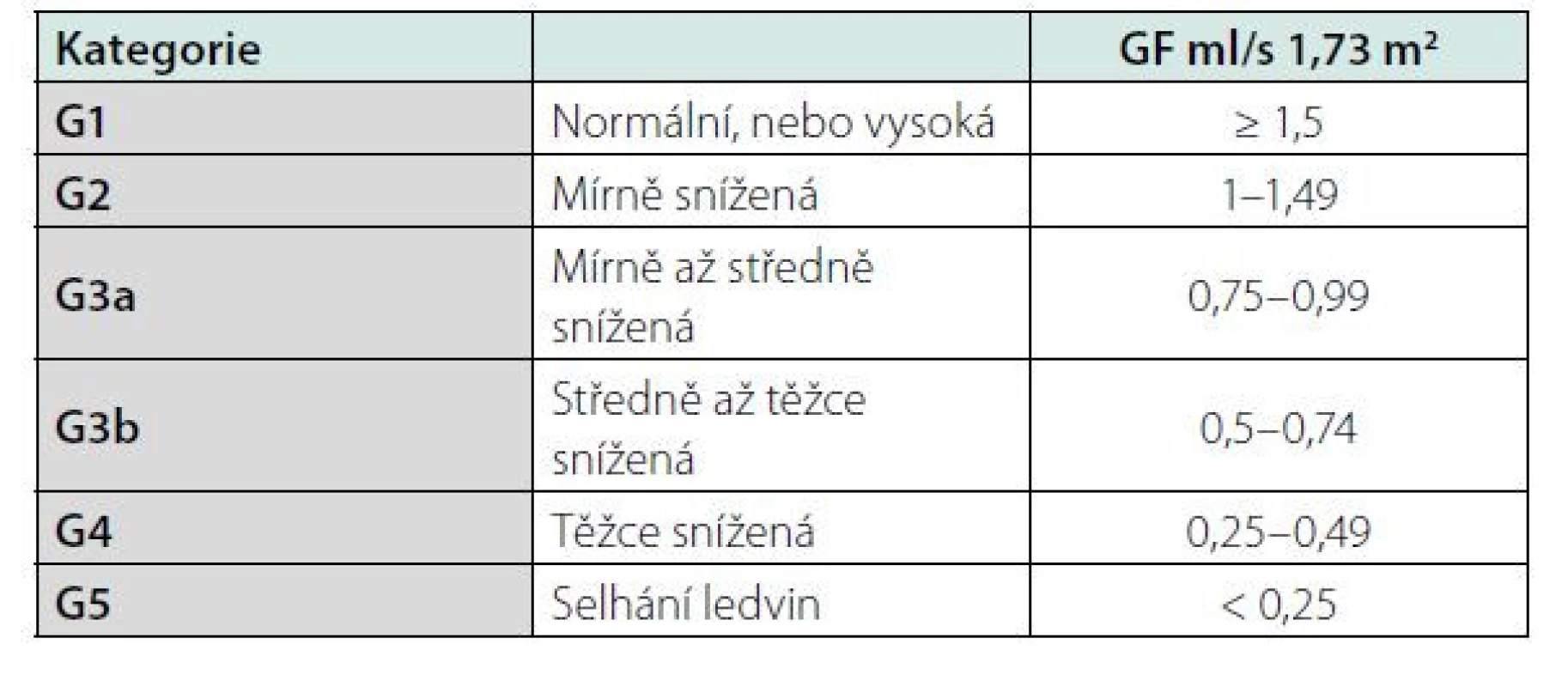
Table 4. Kategorie albuminurie a proteinurie 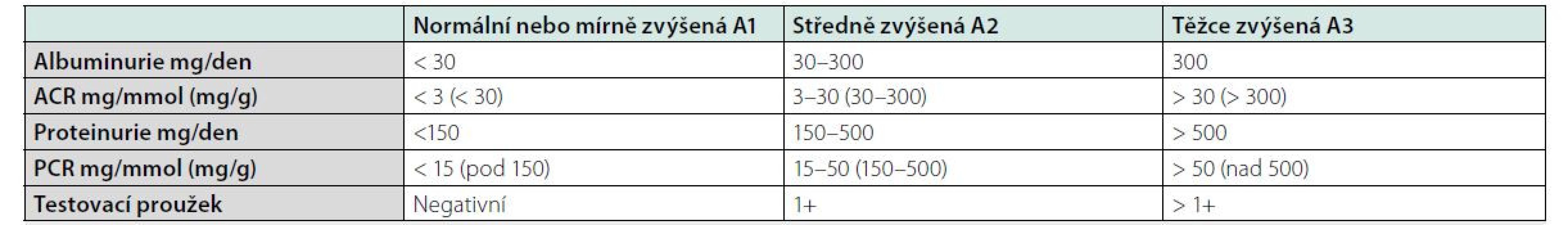
ACR albumin to creatinine ratio, PCR protein to creatinine ratio Léčba nahrazující funkci ledvin
Při progresi renální insuficience by měl být pacient postupně připraven k léčbě nahrazující funkci ledvin. Pacient, který je schopen podstoupit transplantaci ledvin, by měl být v optimálním případě transplantován ještě před zahájením dialyzační léčby preemptivně a měla by být zvážena možnost příbuzenské transplantace (2). Preemptivní zařazení do čekací listiny nebo příbuzenská transplantace se uskuteční při poklesu glomerulární filtrace pod 0,17 ml/s (9). Léčbou první volby pro pacienty čekající na transplantaci ledviny od zemřelého dárce je peritoneální dialýza. Výhodou tohoto postupu je, že při peritoneální dialýze není třeba zakládat trvalý cévní přístup a je delší dobu zachována reziduální diuréza. Peritoneální katétr se zakládá asi 3 týdny před zahájením dialyzační léčby. Peritoneální dialýzu lze zahájit v případě potřeby i bezprostředně po zavedení peritoneálního katétru (10). Nemocní, kteří nejsou indikováni k transplantaci ledvin, mají možnost volby mezi peritoneální dialýzou, hemodialýzou ve středisku, domácí hemodialýzou a konzervativní léčbou (11). Volba léčby má být individuální, tak aby vyhovovala pacientovi jak z medicínského hlediska, tak také ze sociálního hlediska. Pacient, který se rozhodne pro hemodialýzu, musí mít vytvořený cévní přístup (arteriovenózní spojku nebo permanentní centrální žilní katétr). Zahájení dialyzační léčby s nativní arteriovenózní spojkou je spojeno s nejnižším rizikem infekčních komplikací, větší riziko komplikací je v případě arteriovenózní spojky s umělou protézou (12). Nejhorší prognózu mají pacienti zahajující dialyzační léčbu s dočasnou centrální žilní kanylou (13). Arteriovenózní spojka se zakládá minimálně 2 měsíce před zahájením dialyzační léčby. Včasné a pravidelné nefrologické sledování umožní zahájit léčbu nahrazující funkci ledvin v době, kdy pacient nemá žádné uremické příznaky. Transplantace ledvin ještě před zahájením dialyzační léčby – preemptivní transplantace od příbuzného dárce je indikována, jak bylo uvedeno, až při poklesu renální funkce pod 0,17 ml/s. V této době nemá ještě pacient žádné uremické obtíže. Při stejné glomerulární filtraci (pod 0,17 ml/s) zařazujeme pacienta do čekací listiny od zemřelého dárce (9). Rozhodování, kdy zahájit dialyzační léčbu, není jednoduché. Hodnoty kreatininu a močoviny jsou jen pomocnými parametry. Zahájení dialyzační léčby je nutné při přítomnosti uremických příznaků, jako je nechutenství, únava, nauzea, další indikací je nedostatečně kompenzovaná metabolická acidóza a hyperhydratace nezvládnutelná diuretiky. Pokud je pacient bez obtíží, kardiopulmonálně a metabolicky je kompenzován, zahájení dialyzační léčby je indikováno až při poklesu glomerulární filtrace pod 0,1 ml/s (2).
K 31. 12. 2020 bylo v České republice léčeno hemodialýzou celkem 5808 pacientů, peritoneální dialýzou bylo léčeno 295 pacientů. V roce 2020 bylo transplantováno 443 pacientů, příbuzenská transplantace byla provedena u 28 pacientů. Nově bylo do dialyzačního programu zařazeno 2077 pacientů, z toho pouze 961 bylo odesláno z nefrologické ambulance. Alarmující je, že více než polovina pacientů (1116) přichází takzvaně z ulice (14). Termín z ulice znamená, že pacient s chronickým selháním ledvin se dostává do dialyzačního programu akutně. Obecně je pozdní předání pacienta do nefrologické péče definováno jako první vyšetření nefrologem měsíc před zahájením dialyzační léčby. Jedná se o pacienty s již rozvinutými a neléčenými komplikacemi selhání ledvin, jako je anémie, metabolická acidóza, kostní nemoc. Pacienti nejsou připraveni k další léčbě nahrazující funkci ledvin, nemají vytvořený dialyzační přístup, nemají informace o transplantaci ledvin. Pacienti z ulice nebo pozdně předaní pacienti mají, ve srovnání s pacienty sledovanými v nefrologické ambulanci, vyšší riziko mortality a morbidity po zahájení dialyzační léčby, mají i zhoršenou morbiditu a mortalitu po transplantaci ledvin (15).
Jaké parametry a jaká vyšetření je třeba provádět preventivně, a jaká vyšetření provádět u pacientů s onemocněním ledvin?
Hlavním cílem prevence rozvoje CKD je vyšetřit pacienty s rizikem CKD a u pacientů s již zjištěným CKD zajistit ochranu stávající renální funkce. Novela vyhlášky o preventivních prohlídkách z roku 2016 rozšiřuje preventivní vyšetření o vyšetření sérového kreatininu a odhad glomerulární filtrace pro pacienty s diabetem, hypertenzí a kardiovaskulárním onemocněním nad 50 let věku ve čtyřletých intervalech. Podle našich klinických zkušeností se domníváme, že by preventivní vyšetření sérového kreatininu a odhad glomerulární filtrace mělo být provedeno i u zdravé populace po 50 roce věku a u pacientů s rizikem CKD bez ohledu na věk. Počet pacientů přicházejících z ulice je skutečně alarmující a jsou to často i mladí pacienti. Základním vyšetřením je vyšetření moči chemicky a močového sedimentu a vyšetření sérového kreatininu. Při hodnotách kreatininu nad horní hranici normy je třeba zajistit vyšetření glomerulární filtrace. Hodnoty kreatininu pro muže od 18 do 64 let jsou 64–104 μmol na litr a pro ženy od 18 do 64 let 49–90 μmol na litr (16). Algoritmus vyšetření je uveden ve schématu číslo 1 (17).
Schéma 1. Algoritmus vyšetření pacientů s rizikem CKD nebo preventivní vyšetření pacientů nad 50 let věku k odhalení CKD 
Vyšetření kreatininu v séru
V rámci prevence stačí vyšetření sérového kreatininu. V nefrologické ambulanci kromě kreatininu a močoviny vyšetřujeme i další parametry. Hodnoty sérového kreatininu závisí na velikosti svalové hmoty, na stavu nutrice, na celkovém stavu pacienta. Mladý svalnatý muž může mít hodnoty kreatininu vyšší ve srovnání s malou starší ženou, i když jejich renální funkce bude stejná. Hodnoty močoviny jsou ovlivněny nutričním stavem, při katabolismu se mohou hodnoty urey zvyšovat, při malnutrici může být hodnota močoviny v séru nízká. Zvýšené hodnoty močoviny jsou i při terapii kortikoidy nebo při dehydrataci. Laboratorní vyšetření je třeba vždy hodnotit současně s přihlédnutím k celkovému stavu nemocného (16).
Vyšetření glomerulární filtrace
Hodnota kreatininu nad horní hranici normy je indikací k vyšetření glomerulární filtrace. CKD je definováno poklesem GF pod 1 ml/s, hraniční hodnota kolem 1 ml/s by měla být ověřena dalším vyšetřením do 3 měsíců.
Ledvinou proteče za minutu 20 % celkového minutového srdečního objemu, to je asi 1 litr krve. Denně se vytvoří v ledvině až 150 litrů primární moči, která se po průchodu tubulárním systémem ledvin změní v definitivní moč. Glomerulární filtrace je u lidí ve třetí dekádě věku 1,78 ml/sekundu na 1,73 m2 tělesného povrchu, během stárnutí se postupně glomerulární filtrace zmenšuje a ve věku nad 80 let je zhruba poloviční.
Glomerulární filtrace pod 1 ml/s na 1,73 m2 u seniorů nemusí proto znamenat patologickou hodnotu. Nicméně pokles glomerulární filtrace je prognosticky nepříznivý faktor úmrtí a renálního selhání jak u mladých nemocných, tak i u seniorů. Riziko zhoršení renální funkce zvyšuje přítomnost albuminurie (18).
Glomerulární filtrace se vyšetřuje jako clearance látky, která se vylučuje v glomerulech a v tubulech se již nevstřebává ani nevylučuje. Ideální látkou pro měření glomerulární filtrace je například inulin. Inulinová clearance je nejpřesnější metodou vyšetření glomerulární filtrace. V praxi se užívá na některých pracovištích při vyšetření žijících dárců ledviny k přesnému určení jejich renální funkce. Vyšetření je však spíše vyhrazeno pro výzkumné účely.
K vyšetření glomerulární filtrace se používají dnes výpočtové metody. Glomerulární filtrace se podle KDIGO z roku 2012 určuje výpočtem podle rovnice CKD EPI ze sérového kreatininu. Vzorec MDRD a Cockroft Gault se dnes ke stanovení GF nepoužívá. Odhad GF podle CKD EPI více odpovídá skutečnosti i pro zdravou populaci na rozdíl od rovnice MDRD. Další možností určení GF je odhad podle vzorce CKD EPI ze sérového cystatinu. Vyšetření se užívá hlavně u pacientů s malnutricí, s malou svalovou hmotou, při dlouhodobé imobilizaci. Nemá se používat u pacientů užívajících glukokortikoidy, u pacientů s hypertyreózou nebo hypotyreózou a u pacientů s nádorem. Glomerulární filtraci lze vypočítat i podle rovnice CKD EPI ze sérového kreatininu a sérového cystatinu. Hodnota cystatinu vykazuje vyšší korelaci s rizikem kardiovaskulárního onemocnění ve srovnání s kreatininem, ale v rámci preventivního vyšetření není vyšetření cystatinu a cystatinové clearance nutné (19).
Vyšetření glomerulární filtrace vypočítané z 24hodinového sběru moči je spojeno s chybou při sběru moči. Kreatinin se navíc při zhoršující se renální funkcí vylučuje i tubuly, proto je takto vypočítaná hodnota clearance kreatininu nadhodnocena a neodpovídá skutečné glomerulární filtraci. K diagnostice tubulárních poruch je stále nutný sběr moči za 24 hodin ke stanovení odpadů minerálů.
Izotopové metody GF Tc DTPA nebo Cr EDTA – dynamická scintigrafie umožňuje určit přesnou glomerulární filtraci u žijících dárců, nebo se používá ke zhodnocení symetrie funkce ledvin před urologickými výkony (16).
Metody vyšetření glomerulární filtrace jsou uvedeny v tabulce č. 5.
Table 5. Možnosti vyšetření glomerulární filtrace 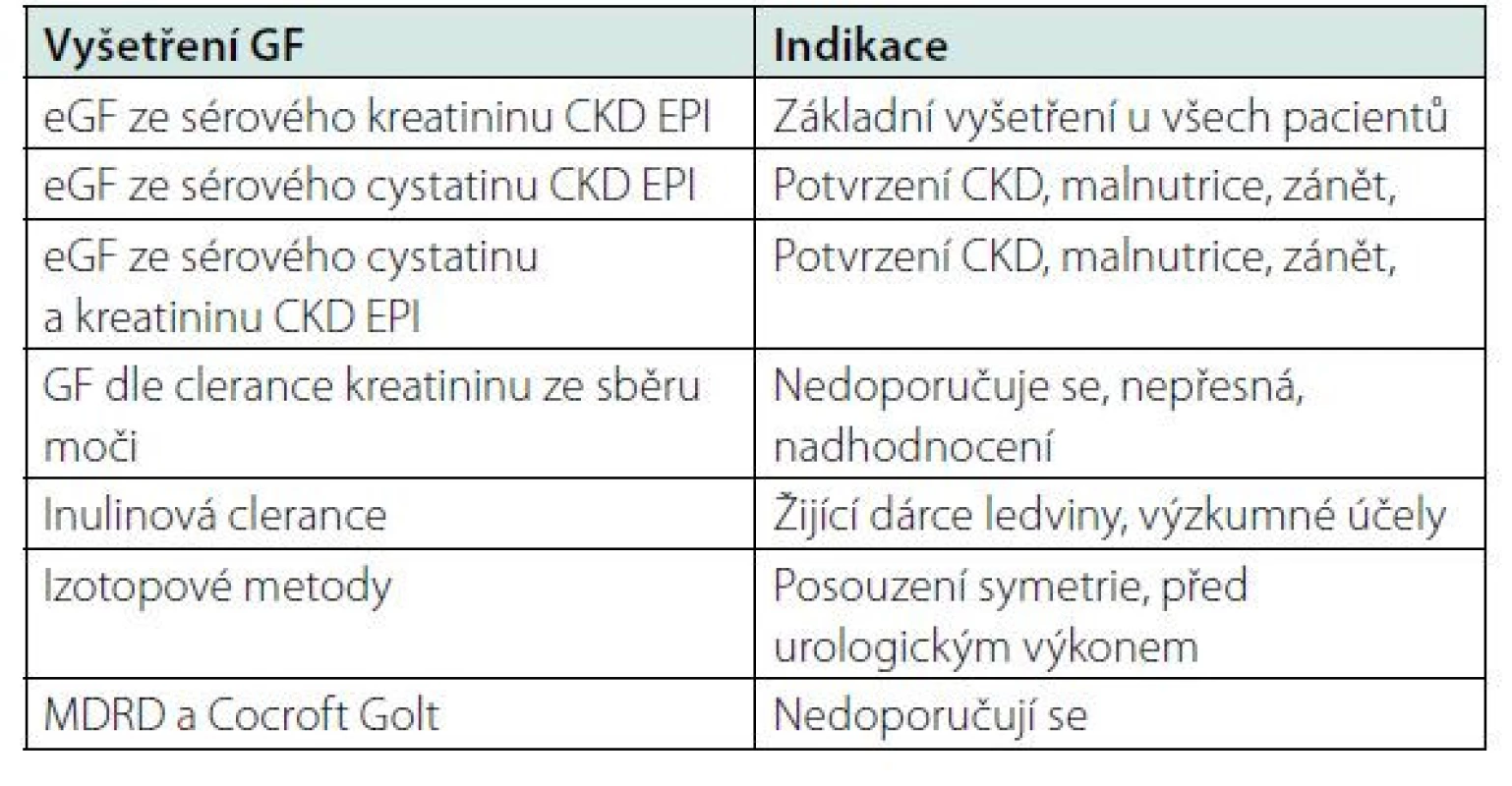
Vyšetření moči chemicky a vyšetření močového sedimentu
Vyšetření moči chemicky a vyšetření močového sedimentu patří mezi základní preventivní vyšetření. Patologické nálezy pak vedou v rámci diferenciální diagnostiky k další sérii vyšetření.
Chemickým vyšetřením moči zjišťujeme přítomnost krevního barviva, glukózy, žlučových barviv, ketokyselin a bílkoviny. Pokud je při chemickém vyšetření moč na bílkovinu negativní, je třeba vyšetřit u pacientů s rizikem CKD a u pacientů s CKD albuminurii.
Vyšetření albuminurie a proteinurie
Proteinurie může být fyziologicky přítomna při nadměrné fyzické zátěži, při prolongované ortostáze, při dehydrataci a při zánětu ledvin. Horní hranice fyziologické proteinurie je 150 mg za 24 hodin. Albuminurie dříve označovaná jako mikroalbuminurie je známkou endoteliálního poškození. Objevuje se u pacientů s diabetem jako první známka poškození ledvin. Albuminurie je u pacientů s hypertenzí indikátorem poškození ledvin.
Vyšetření albuminurie
Jednoduchým orientačním vyšetřením moči na přítomnost albuminu je vyšetření papírkem. Standardním vyšetřením albuminurie je vyšetření imunochemické v ranním vzorku moči, výsledek se uvádí jako poměr albuminu a kreatininu v moči (ACR – albumin creatinine ratio) Vyšetření albuminurie v 24hodinovém sběru moči se již nedoporučuje pro možné chyby při sběru moči. Nález malé albuminurie by měl být potvrzen dalším vyšetřením do 3 měsíců. Albuminurie v kombinaci s renální insuficiencí zhoršuje kardiovaskulární mortalitu a celkovou mortalitu a riziko progrese do konečného stadia renální insuficience (20).
Vyšetření proteinurie
Provádí se orientačně papírkem nebo kyselinou sulfosalicylovou. V případě nálezu bílkoviny v moči při orientačním vyšetření jsou kromě albuminu přítomny i další proteiny s větší molekulovou hmotností. K přesnému kvantitativnímu vyšetření proteinurie se využívají standardizované kolorimetrické a turbidimetrické metody. Při pozitivitě vyšetření na proteinurii není již třeba provádět vyšetření albuminurie. V současné době se doporučuje vyšetření poměru proteinu a kreatininu (PCR) nejlépe v ranním vzorku moči. Stále v klinické praxi provádíme stanovení proteinurie ve sbírané moči za 24 hodin, výsledek se vyjadřuje v gramech za 24 hodin. Výsledek závisí na přesnosti provedeného sběru moči. Proteinurie se dle etiologie dělí na prerenální, renální a postrenální. Příčinou prerenální proteinurie je zvýšená koncentrace některých bílkovin v séru, nejčastěji při zvýšené produkci lehkých řetězců u mnohočetného myelomu nebo při hemolýze nebo rhabdomyolýze. Proteinurie renální glomerulární vzniká při poškození glomerulární membrány, sérové bílkoviny pronikají do primární moči a následně při přetížení tubulárního transportu do definitivní moči. Příčinou jsou jak primární, tak i sekundární glomerulopatie (glomerulonefritidy, diabetes, hypertenze nebo systémové onemocnění jako systémový lupus erythmatodes). Proteinurie renální tubulární vzniká při poškození tubulů. V moči je přítomen beta-2-mikroglobulin a alfa-1-mikroglobulin. Při postrenální proteinurii dochází k úniku sérových bílkovin přímo do moči při zánětech, krvácení nebo nádorech. Podle odhadu odpadu bílkoviny do moči se proteinurie označuje za malou 0,15–1,5 g/24 hodin, střední 1,5–3,4 g za 24 hodin a velkou – nefrotickou (16).
Vyšetření močového sedimentu poskytne další informace
V močovém sedimentu vyšetřujeme přítomnost krevních elementů, epitelií, válců a krystalů. Leukocyturie je definovaná jako přítomnost více než 10 leukocytů na 1 mikrolitr moči nebo více než 5 leukocytů v zorném poli. Leukocyturie je nejčastějším nálezem u pacientů s akutní infekcí močových cest. Může být přítomna u pacientů s intersticiálním onemocněním ledvin. Opakovaný nález leukocyturie při negativní močové infekci by měl vést k další diferenciálně diagnostické rozvaze. Měli bychom vyloučit mykobakteriální infekci a STD infekci (sexual transmitted diseases). Patří sem mimo jiné infekce vyvolané bakteriemi chlamydie, ureaplazma a mykoplazma Opakovaná leukocyturie by měla být i podnětem k vyloučení tumorózní etiologie a mělo by být doplněno cytologické vyšetření moči, urologické a u žen gynekologické vyšetření (21).
Erytrocyturie je přítomnost více než 5 erytrocytů na zorné pole nebo 5 erytrocytů na 1 mikrolitr moči. Erytrocyturie je patologickým nálezem a musí vést k dalšímu vyšetření. V rámci diferenciální diagnostiky je třeba rozlišit, zda se jedná o erytrocyturii glomerulární, nebo neglomerulární. Vyšetření se provádí ve fázovém mikroskopu, kdy se vzorek čerstvé moči vyšetřuje na přítomnost erytrocytů tvarově změněných a akantocytů. Jedná se o erytrocyty, které projdou do moči glomerulární membránou. Glomerulární erytrocyturie je definovaná přítomností 80 procent změněných erytrocytů ve vzorku moči a přítomností více než 5 procent akantocytů. Pacienti s glomerulární erytrocyturií by měli být dále vyšetřeni nefrologem. Při malé erytrocyturii je vyšetření ve fázovém mikroskopu nepřínosné, proto je indikací k vyšetření ve fázovém mikroskopu nález více než 30 erytrocytů v jednom mikrolitru (22). Pacient s neglomerulární erytrocyturií má být odeslán k urologickému vyšetření.
Přítomnost válců je známkou poškození glomerulů a tubulů. Mohou být přítomny válce erytrocytrání při masivní glomerulární erytrocyturii, leukocytární při infekci, smíšené, nebo bílkovinné a tukové při velké proteinurii, nebo válce tvořené lehkými řetězci globulinu při nefropatii u pacientů s myelomem.
Pacienti s pokročilou renální insuficiencí nebo s patologií v močovém sedimentu by měli být odesláni k nefrologickému vyšetření. Indikace k odeslání pacienta jsou uvedeny v tabulce 6.
Table 6. Indikace k odeslání pacienta k nefrologickému vyšetření 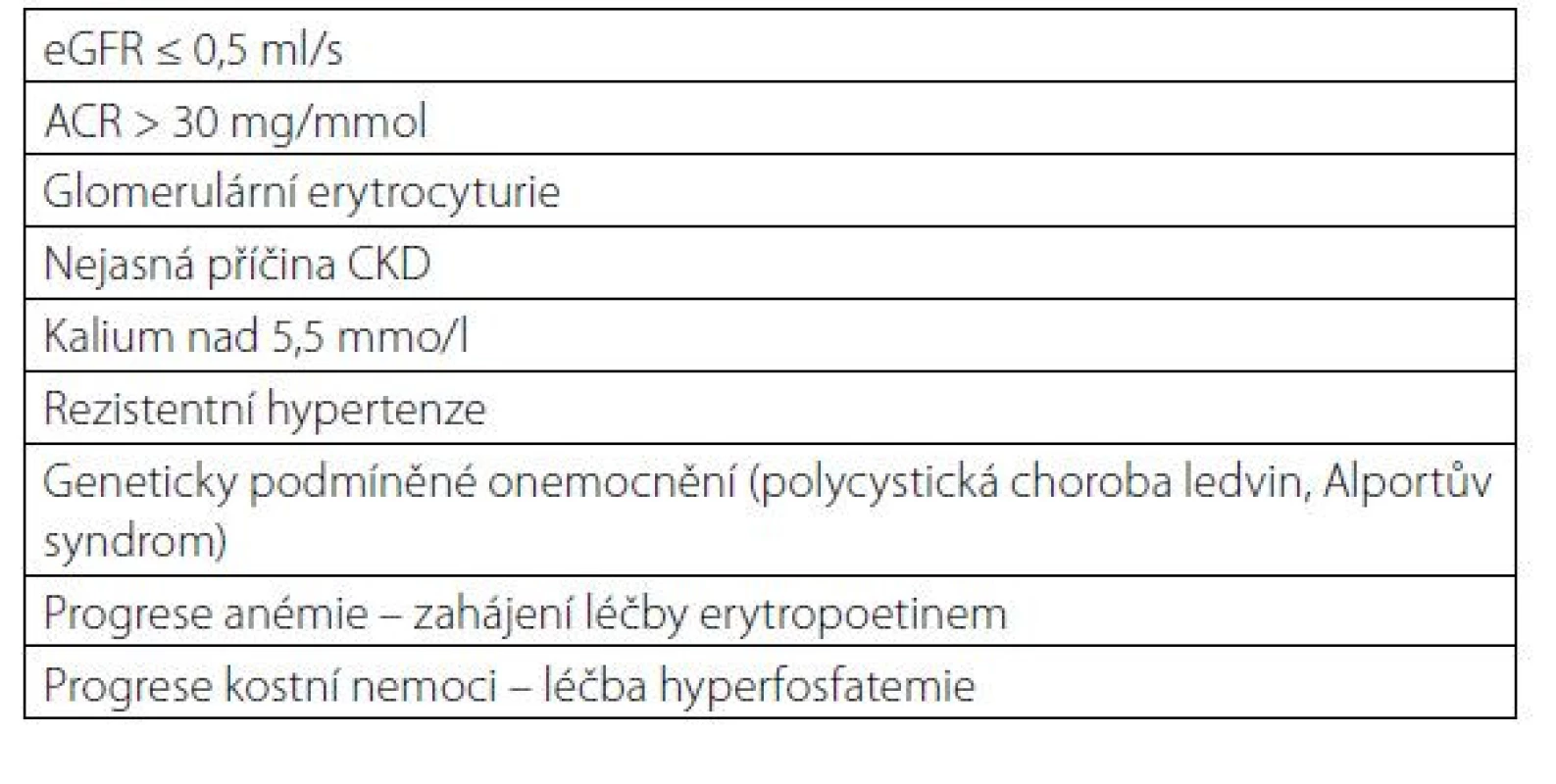
Pacient s CKD, který zůstává v péči praktického lékaře nebo jiného odborného lékaře musí být pravidelně vyšetřen, a to v intervalech dle stadia renální insuficience a přítomnosti albuminurie jednou nebo dvakrát ročně a od stadia G3 A3 jednou za 4 měsíce. Důležitá je kontrola krevního tlaku, kontrola proteinurie a renální funkce. Základem léčby je léčba a prevence komplikací CKD (2). Při poklesu hemoglobinu pod 90 g/l při dostatečných zásobách železa je indikována léčba erytropoetin stimulujícími léky, u pacientů s CKD 5 a na dialýze je indikováno zahájení léčby při poklesu hemoglobinu pod 100 g/l (23). Vysoké hladiny fosfátu v séru a nízké koncentrace nativního vitaminu D jsou rizikem pro rozvoj sekundární hyperparathyreózy. V rámci prevence kostní nemoci by měla být zahájena léčba vazači fosfátů, nativním vitaminem D a upravana metabolická acidóza podáním natrium bikarbonátu (24). Indikováno je sonografické vyšetření ledvin a močového měchýře. Nejpozději ve stadiu G3b je nutné zahájit očkování proti hepatitidě B. V rámci renoprotekce je nutné vysazení všech nefrotoxických léků a úprava medikace dle stadia renální insuficience. Hlavním cílem léčby CKD je minimalizovat progresi onemocnění, předcházet a léčit komplikace se zachováním kvality života.
Závěr
Cílem péče o pacienty s onemocněním ledvin je snaha o maximální renoprotekci. Pokud pacient i přes maximální léčbu progreduje do terminálního stadia onemocnění ledvin, je třeba jej na léčbu nahrazující funkci ledvin včas a dobře připravit, včetně možnosti preemptivní transplantace ledvin. Těsná spolupráce s praktickými lékaři a lékaři jiných odborností je z tohoto důvodu důležitá. Jednoduché preventivní vyšetření může podchytit nemocné včas a snížit počet pacientů, kteří zahajují léčbu nahrazující funkci ledvin nepřipraveni a pozdě. Cílem je i záchyt pacientů s ještě normální renální funkcí, ale s nálezem v močovém sedimentu, aby mohlo být diagnostikováno a léčeno onemocnění ledvin.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Vladimíra Bednářová
Klinika nefrologie VFN a 1. LF UK Praha U Nemocnice 2, 128 08 Praha 2
Cit. zkr: Vnitř Lék 2022;68(1):E27-E32
Článek přijat redakcí: 23. 12. 2021
Článek přijat po recenzích: 11. 1. 2022
Sources
1. Jankowski J, Floege J, Fliser D et al. Cardiovascular Disease in Chronic Kidney Disease Circulation. 2021;143 : 1157-1172.
2. KDIGO 2012 Clinical Practice Guidiline for Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl 2013;3 : 1-150.
3. Levey AS, Becker C, Inker LA. Et al. Glomerular filtration rate and albuminuria for detection and staging of acute and chronic kidney disease in adults: a systematic review JAMA 2015;313 : 837-846.
4. Mills KT,Xu Y, Zhang W et al. A systematic analysis of worldwide population - based data on the global of chronic kidney disease in 2010. Kidney Int 2015;88 : 950-7.
5. Thomas B, Matsuhita K Abata KH et al Global Cardiovascular and Renal Outcomes of reduced GFR. J Am Soc Nephrol 2017;28 : 2167-2179.
6. Koye DN, Magliano DJ, Reid ChM. Risk of Progression of Nonalbuminuric CKD to End‑Stage Kidney Disease in People With Diabetes: The CRIC (Chronic Renal Insufficiency Cohort) Study AmJ Kidney Dis 2018;72 : 653-661.
7. Chen TK, Knicely DH, Grams ME. Chronic Kidney Disease Diagnosis and Management: A Review JAMA 2019;322 : 1294.
8. Cherney DZI, Verma S: DAPA‑CKD: The Beginning of a New Era in Renal Protection J Am Coll Cardil Basic Trans Science 2021;6 : 74-77.
9.www.transplant.cz
10. Zimmerman AM, Peritoneal dialysis: inccreasing global utilization as an option for ranal replacement therapy. J Glob Health 2019;9: Published online 2019 Oct 7. doi: 10.7189/ jogh.09.020316.
11. Weinhandl ED, Foley RN, Gilbertson DT et al. Propensity‑Matchad Mortality Comparison of Incident Hemodialysis and Peritoneal dialysis JASN 2010;21 : 499-506.
12. Allon M. Vascular Access for hemodialysis Patients New Data Should Guide Decision Making CJASN 2019;14 : 954-961.
13. Ravani P, Quinn R, Oliver M et al. Assotiation between Hemodialysis Access Type and Mortality: The Role of Access Complications. CJASN 2017;12 : 955-964.
14. Rychlík: Statistická ročenka ČNS 2020 www.nefrol.cz.
15. Tu YR, Tsai TY, Lin et al. Association between initial dialytic modalities and the risks of mortality, infection death, and cardiovascular events: A nationwide population‑based cohort Sci Re2020;10 : 8066doi:10.1038/s41598-020-64986.
16. Zima T, Racek J, Ryšavá R et al. Doporučení k diagnostice chronického onemocnění ledvin Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP Klin. Biochem. Metab., 2021;29 : 94-103.
17. Vassalotti JA, Centor R, Turner BJ et al. Practical Approach to Detection and Management of Chronic Kidney Disease for the Primary Care Clinician AmJ Med 2016;129 : 153-162
18. Ping L, Rob RQ, Ngan NLl. Accounting for age in the definition of chronic kidney disease. JAMA Intern Med 2021;181:] 1359-1366.
19. Potok OA, Ix JH, Shlipak MG et al. The Difference Between Cystatin C - and Creatinine‑Based Estimated GFR and Associations With Frailty and Adverse Outcomes: A Cohort Analysis of the Systolic Blood Pressure Intervention Trial (SPRINT) Am J Kidney, DiS. 2020 Dec;76(6):765-774.
20. Sumida K,Nadkarni G,Grams Me.Conversion of Urine Protein‑Creatinine Ratio or Urine Dipstick Protein to Urine Albumin‑Creatinine Ratio for Use in Chronic Kidney Disease Screening and Prognosis: An Individual Participant‑Based Meta‑analysis Annals of Internal Medicine 2020;6 : 173,426-465.
21. Glen P, Prashar A, Hawary A et al.Sterile pyuria: a practical mangement guide Br J Gen Pract. 2016 Mar; 66(644): e225-e227.
22. Judge C, Cifu AS, Faris S Management of Patients With Microhematuria JAMA. 2021;326(6):563-564.
23. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease Kidney Int Supl. 2012; 283-287.
24. KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease–Mineral and Bone Disorder (CKD‑MBD) Kidney Int. Supl.2017;1-60.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue E-1-
All articles in this issue
- Zanechání kouření a riziko diabetes mellitus 2. typu
- Etické konotace provádění klinických hodnocení léčivých přípravků během pandemie onemocnění covid-19
- Možnosti cvičenia v liečbe ankylozujúcej spondylitídy
- Vyšetření renální funkce v praxi
- Muž s dýmkou, prof. MUDr. Pavel Klener, DrSc., se v dubnu 2022 dožívá 85 let
- Závažné zlyhávanie srdca a arytmia po protinádorovej liečbe podávanej v detstve
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vyšetření renální funkce v praxi
- Možnosti cvičenia v liečbe ankylozujúcej spondylitídy
- Zanechání kouření a riziko diabetes mellitus 2. typu
- Závažné zlyhávanie srdca a arytmia po protinádorovej liečbe podávanej v detstve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

