-
Medical journals
- Career
Venózní tromboembolismus u antifosfolipidového syndromu
Authors: Alena Buliková; Miroslav Penka
Authors‘ workplace: Oddělení klinické hematologie Fakultní nemocnice Brno ; Interní hematologická a onkologická klinika Masarykovy univerzity v Brně ; Alena Buliková, Miroslav Penka
Published in: Vnitř Lék 2022; 68(8): 493-497
Category: Main Topic
doi: https://doi.org/10.36290/vnl.2022.106Overview
Antifosfolipidový syndrom (APS) je definován přítomností klinických a laboratorních kritérií, tj. přítomností antifosfolipidových protilátek. Venózní tromboembolismus patří k nejčastějším klinickým manifestacím tohoto syndromu. Jsou shrnuty základní patofyziologické mechanizmy vzniku žilní trombózy a plicní embolie, epidemiologie APS, resp. i situace, kdy má být tento syndrom zvažován. Jsou zmíněna možná úskalí laboratorní diagnostiky a dopad na léčbu.
Klíčová slova:
diagnostika – léčba – antifosfolipidový syndrom
Úvod
Antifosfolipidový syndrom (APS) je klinicko‑patologickou jednotkou, která je charakterizována přesně definovanými klinickými nálezy v přítomnosti antifosfolipidových protilátek. Byl popsán Hughesem v roce 1983, proto je taktéž nazýván jako Hughesův syndrom. Kritéria pro definici tohoto syndromu od svého prvního popisu doznala řadu změn. V současné době však stále platí mezinárodní konsenzus kritérií definitivní diagnózy APS, který byl ustanoven pracovní skupinou na workshopu, který předcházel 11. kongresu o antifosfolipidových protilátkách v Sydney v roce 2005. Tento konsenzus byl publikován krátce na to, na začátku roku 2006 (1) a jeho hlavní principy shrnuje tabulka 1. Nicméně nárůst poznatků o problematice v patofyziologii, klinické manifestaci a zejména v laboratorní diagnostice se vynutil mezioborovou a mezinárodní spolupráci nad tvorbou nových kritérií, přičemž toho úsilí probíhá koordinovaně již od roku 2013. Nová diagnostická a klasifikační kritéria měla původně být sumarizována v letošním roce. Nicméně proběhlá pandemie covidu-19 zamíchala se záměry odborníků pro hemostázu nevídanou silou, včetně nevyjasněného vztahu této infekce k antifosfofolipidovým protilátkám, které se zdály být v jisté fází vývoje poznatků jednou z příčin neobvykle vysoké manifestace žilního tromboembolismu. Proto se zdá, že i předpokládaná doba ukončení práce na nových kritériích APS v organizaci Evropské ligy proti revmatismu (EULAR) by mohla být zpožděna. To nás nutí vycházet z aktuálních informací dle literatury a nedržet se striktně řadu let starých diagnostických schémat (2).
Table 1. Diagnostická kritéria antifosfolipidového syndromu 
Pro diagnózu je nutné splnění nejméně jednoho klinického a jednoho laboratorního kritéria
LA – lupus antikoagulant, ACLA – antikardiolipinové protilátky, antiβ2-GP I – protilátky proti iβ2-glykoproteinu I, GPL‑ fosfolipidové jednotky ve třídě IgG, MPL – fosfolipidové jednotky ve třídě IgMPatofyziologie trombotických komplikací v přítomnosti antifosfolipidových protilátek
V první řadě je nutno připomenout známou skutečnost, že klinická manifestace venózního tromboembolismu je multifaktoriální geneze a že průkaz antifosfolipidových protilátek (APA) u klinické manifestace žilní trombózy a/nebo plicní embolie je jen jedním z kamínků složité mozaiky ovlivnění klasické Wirchovovy triády. Jak mohou APA ovlivňovat hemostázu ve smyslu zvýšení trombotické tendence, je shrnuto velmi rámcově v tabulce 2. Kromě zvýšené protrombotické tendence mohou APA působit na buněčné úrovni na celou řadu tkání (mimo jiné přímá aktivace neuronu, přímé ovlivnění syncicio‑trofoblastu, ovlivnění destičkových glykoproteinů a další), což se může podílet na pestré klinické manifestaci nemocných s nálezem APA, resp. s diagnózou APS. Nutné informace v péči nemocné s venózním tromboembolismem (VTE) se dále jiné opírají o zjištění, zda jde o neprovokovanou či provokovanou příhodu, případně zda jsou přítomny další choroby, které mohou samy o sobě, nebo jejich léčba, zvyšovat riziko tromboembolismu.
Table 2. Protrombotické působení antifosfolipidových protilátek 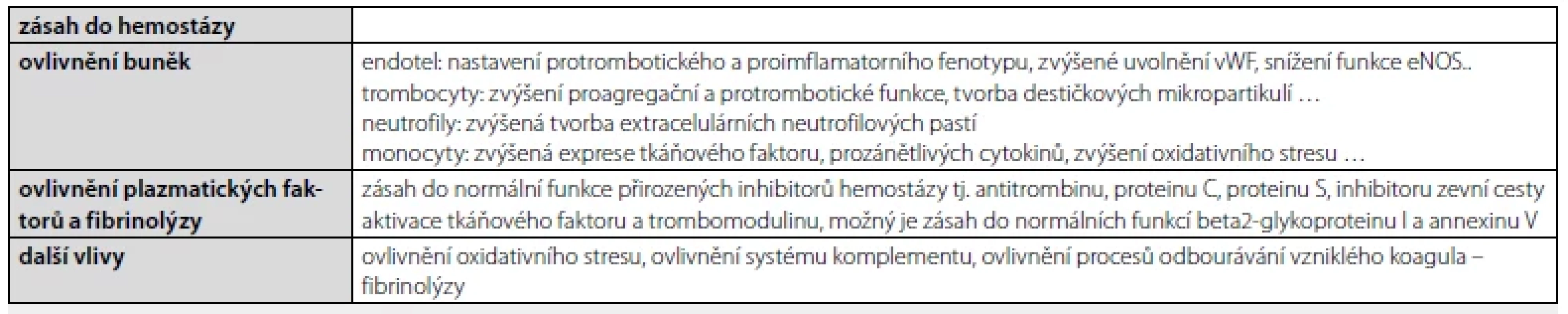
vWF– von Willebrandův faktor, eNOS – endoteliální syntáza oxidu dusíku Asi v polovině případů je důvod ke tvorbě antifosfolipidových protilátek nejasný. Mohou se však vyskytovat i u zdravých osob běžné populace a jejich nárůst, resp. procento výskytu je závislé na rase a zejména věku jejich nositele; tak jako u jiných autoprotilátek jejich výskyt ve stáří narůstá, ale častý je jejich transientní, a v tomto případě většinou neškodný, výskyt i v dětském věku (3). Nicméně v řadě případů lze identifikovat, proč tyto protilátky, a v některých případech s malou klinickou významností a/nebo s přechodným působením, vznikly.
Kromě systémových a revmatických procesů, kdy tito nemocní APA mohou exprimovat ve 30–40 % případů, je tento typ autoprotilátek popisován u nádorových onemocnění, ať již solidních či hemo - či lymfopoetických.
APA mohou být indukovány řadou infekčních agens, kdy tyto nálezy většinou jsou, ale ne výlučně, transientní a nesymptomatické, nicméně jsou popisovány i situace spojené s tromboembolickými komplikacemi (popisy případů u HIV, lepra, ricketsióza a Q horečka), nebo mohou asociovány se spuštěním katastrofické varianty APS (CAPS – bezmála polovina těchto komplikací je takto indukována). Přehled přináší tabulka 3 (4). Hodně diskuzí o detekci APA u virových onemocnění rozvířila pandemie covidu-19, kdy u akutně nemocných hospitalizovaných případů byla tato pozitivita, zejména LA, popisována u poloviny nemocných. Nicméně meta‑analýza těchto případů neprokázala vyšší incidenci venózního tromboembolismu u hospitalizovaných pacientů s covidem-19 při porovnání APA pozitivních a negativních nemocných (5).
Table 3. Infekční agens spojená s výskytem antifosfolipidových protilátek 
HCV – virus hepatitidy C, HBV – virus hepatitidy B, CMV – cytomegalovirus, EBV – virus Ebstein- Barrové, HLTV1 – virus lidské T leukemie, H1N1 – typ virus chřipky, HSV – virus herpes-simplex-varicella, SARS-CoV2 – virus indukující onemocnění covid-19, E – esecherichia, H – helicobacter, M – mykobakterium
tučně uvedená agens jsou zmiňována s asociací s venózním tromboembolismem a/nebo s indukcí katastrofického antifosfoslipidového syndromuAPA mohou být taktéž spojeny s celou řadou léků. Přehled přináší tabulka 4. Role takto indukovaných protilátek je sporná. V řadě případů je poléková indukce APA přechodná, tudíž z klinického pohledu málo zajímavá (6). Více trombotických komplikací je spojeno s medikací antipsychotik (7) či inhibitorů TNFα. Nicméně v těchto případech může být trombotická tendence způsobena více základním onemocnění, pro něž je léčba zaváděna, než vlastní medikací.
Table 4. Léky, které mohou být spojovány s indukcí antifosfolipidových protilátek 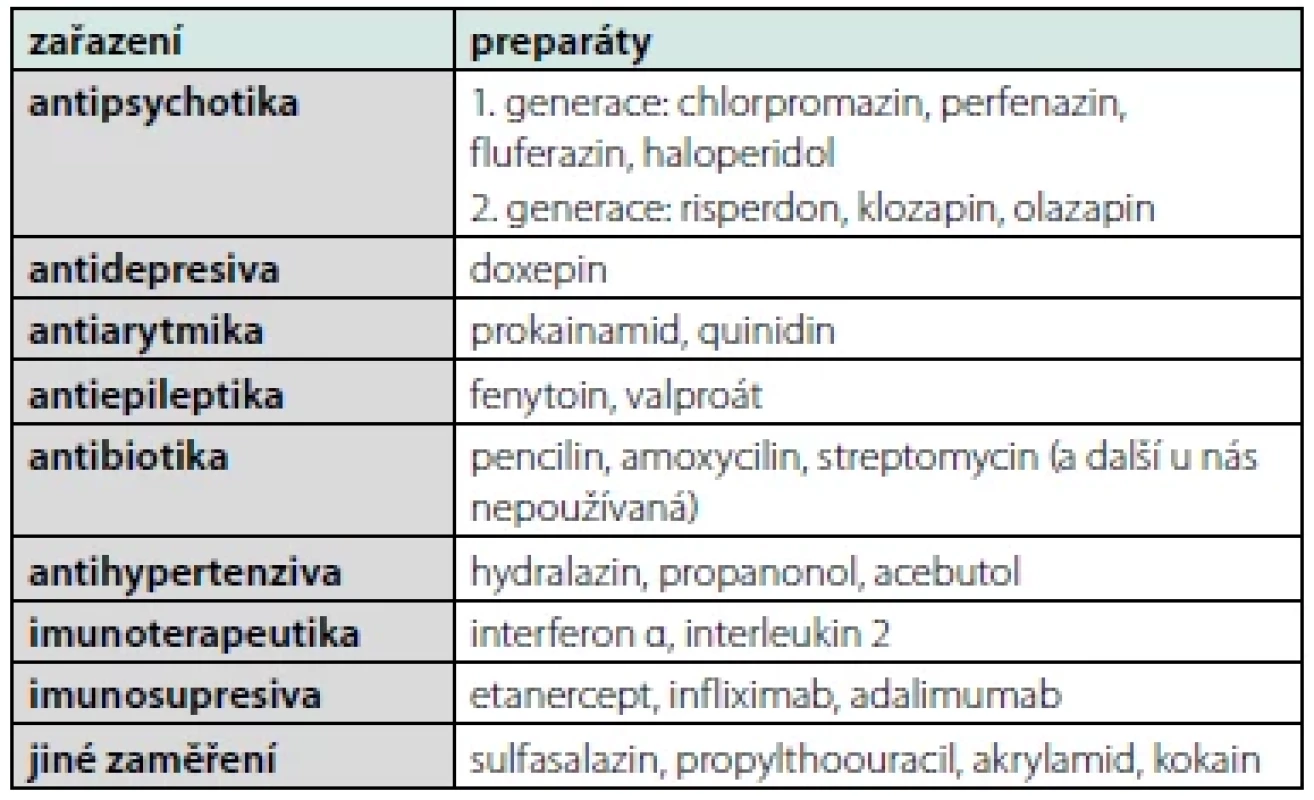
Klinická manifestace APA
APA mohou být u svých nositelů klinicky zcela němé u 1–10% případů, kdy tato prevalence byla obvykle stanovena na relativně zdravé populaci, většinou u dárců krve či těhotných ženách s normálním průběhem gravidity. Pozitivita záleží na věku (vyšší u starších jedinců), rase (vyšší u černošské populace) a typu detekované autoprotilátky (vyšší u sérologických nálezů zejména třídy IgM v porovnání s detekcí lupus antikoagulant). Incidence klinicky zjevného APS je odhadována na 2,1 na 100 000 ročně, prevalence 50 na 100 000 obyvatel (8).
Trvalá pozitivita antifosfolipidových protilátek v případě venózního tromboembolismu se nezdá být dramaticky vyšší než v běžné populaci a i u relativně mladých lidí a neprovokované příhodě je udávána v 9,0 % (9). Nicméně z pohledu diagnostiky a sledování nemocných s antifosfolipidovým syndromem, je žilní tromboembolismus nejčastější klinickou manifestací. Ve studii „Euro‑phosholipid project“, na níž participuje 13 evropských zemích, je sledováno dlouhodobě 1000 pacientů s jasně naplněnou diagnózou antifosfolipidového syndromu (10). V tomto projektu mělo při vstupu do sledování hlubokou žilní trombózu (DVT) 38,9% nemocných a plicní embolii (PE)14,1 %. Pro srovnání – cévní mozkovou příhodu mělo 19,8 % a transitorní ischemickou ataku 11,1 % zařazených jedinců. Nutno připomenout, že jde o klinická kritéria pro stanovení vlastní diagnózy APS, proto jde o čísla vyšší, než jsou očekávána v běžné populaci, resp. i u nemocných s VTE. V desetiletém sledování došlo k další klinické manifestaci DVT u 4,3 %, resp. i EP u 3,5 %, nemocných. Tato čísla jasně dokladují skutečnost, že přestože není vyšetření APA indikováno ve všech případech VTE, může mít toto vyšetření zásadní dopad v přesně vymezených klinických situacích. Navíc rozhodně hraje roli i skutečnost, zda byla některá z antifosfolipidových protilátek detekována jako izolovaný laboratorní nález, či zda jde o vícenásobný průkaz různých APA. U nemocných, kde byla prokázána trojnásobná pozitivita těchto autoprotilátek, tzv. „triple pozitivita“, což značí současný výskyt inhibitoru lupus antikoagulant (LA), vysoké titry protilátek proti kardiolipinu a protilátek proti beta-2glykoproteinu I ve stejné třídě imunoglobulinu (tedy buď IgG nebo IgM), je zřetelně vyšší riziko rekurence tromboembolismu; kumulativně 12,2 % po roce sledování, 26,1 % po 5 letech a 44,2 % po 10 letech (11).
Kromě žilního tromboembolismu se mohou APA projevovat celou řadou symptomů, jejichž přehled přináší tabulka 5. Z ní jednoznačně vyplývá, že APS je systémové onemocnění.
Table 5. Spektrum klinické manifestace spojené s trvalou přítomností antifosfolipidových protilátek (opakovaný průkaz v časovém odstupu 12 a více týdnů) 
HELLP – syndrom spojený s hemolýzou, zvýšením jaterních enzymů a poklesem trombocytů (hemolysis, elevated liver enzyme, low platelet), APA – antifosfolipidové protilátky, iCMP – ischemická cévní mozková příhoda, AIHA – autoimunitní hemolytická anémie, DIC – diseminovaná intravaskulární koagulace Limitace standardní akutní léčby VTE u APS/ APA
U pacientů se známou „triple“ pozitivitou antifosfolipidových protilátek a s první neprovokovanou příhodou VTE by neměla být léčba zahajována přímými orálními antrombotiky (DOAC), byť v jiných případech vzniku DVT či PE je tato léčba po vyhodnocení klinické závažnosti stavu upřednostňována. DOAC nejsou lékem první volby ani u nemocných s APA, kteří mají v anamnéze trombózu tepennou, postižení malých cév, s APA asociovanou chorobou srdečních chlopní (1, podrobně viz tabulka 5), ale ani u nemocných, kterým selhala léčba kumariny, případně u těch, kteří nejsou adherentní k léčbě Warfarinem (12, 13).
V případech, kdy je nutné při těžším průběhu léčby plicní embolie použít přechodně nefrakcionovaný heparin, musíme počítat s tím, že nelze využít aktivovaný parciální tromboplastinový čas (aPTT) k monitorování této léčby u nemocných, kteří mají LA. Aktuální hodnota testu je tímto inhibitorem ovlivněna, a to nepředvídatelným způsobem, takže neodráží vlastní vliv heparinu. V těchto případech je nezbytná kontrola stanovením anti‑Xa aktivity, která je kalibrována na nefrakcionovaný heparin s cílovou terapeutickou hodnotou 0,3–0,7 U/ml.
Jinou limitací akutní léčby VTE u APS může být trombocytopenie. Tato je u nemocných s APS relativně častá, provází 20–25 % případů v případě primárního APS, resp. až 30–40 % sekundárního APS, tedy tam, kde nález APA provází systémová onemocnění. V „Euro‑phosholipid‑project“ byl pokles trombocytů vstupně zjištěn 29,6 % zařazených jedinců a u dalších 8,7 % nemocných tento nález vznikl v desetiletém sledování (10). Trombocytopenie však naštěstí bývá nejčastěji lehká nebo středně významná (obvykle vyšší než 50 × 109/l), takže antitrombotickou medikaci je obvykle možné zavést, nicméně část nemocných vyžaduje přechodnou nebo trvalou imunosupresi, případně jinou léčbu k udržení náležitého počtu destiček.
Krvácivé komplikace u APS mohou vznikat i z jiných důvodů, jako jsou sekundární hypoprotrombinemie navozená lupus antikoagulant, trombocytopatie navozená vazbou APA na destičkové glykoproteiny, resp. i velmi obávaná difusní alveolární hemoragie. Řešení trombo‑hemorhagické klinické manifestace těchto stavů si již obvykle vyžaduje multioborovou spolupráci.
Sekundární profylaxe VTE u APS
V případě neprovokované příhody VTE u APS jsou lékem volby antagonisté vitamínu K, kumariny, s cílovým INR 2–3 (12), a to podávané doživotně. U trombózy či plicní embolie provokované je příhoda řešena stejně dlouho, jak to určují běžná národní či mezinárodní doporučení s tím, že před jejím ukončením musí být uváženo, zda byly odstraněny vyvolávající rizikové faktory, resp. zda byl či nebyl zjištěn vysoce rizikový profil APA. Toto posouzení může vyústit v protrahovaní antitrombotické medikace (12).
O použití DOAC u nemocných s APS jsou stále vedeny diskuze. Ty otevřela zejména studie TRAPS (14), která srovnávala léčbu trombotických projevů APS rivaroxabanem a warfarinem u nemocných s vysoce rizikovým profilem APA, tedy s „triple“ pozitivitou a byla předčasně ukončena pro nesrovnatelně vyšší výskyt trombóz zejména v arteriálním řečišti u pacientů na standardních dávkách Xarelta. Taktéž studie ASTRO‑APS, která srovnávala použití apixabanu v porovnání s warfarinem při trombotických projevech APS, a přes různé změny dávkování, limitace zařazených pacientů atd. byla taktéž předčasně ukončena pro vyšší výskyt ischemických cévních mozkových příhod ve skupině nemocných s Eliquisem. Bylo provedeno několik meta‑analýz publikovaných případů a žádná z nich nevyzněla ve prospěch DOAC. Proto taktéž Evropská kardiologická společnost (European Society of Cardiology – ESC) a Americká hematologická společnost (American Society of Hematology – ASH) vydaly doporučení, že DOAC nemají být používány u všech nemocných s APS (16). Jisté zvážení těchto léků připouští EULAR (12), mezinárodní společnost pro trombózu a hemostázu (International Society of Thrombosis and Haemostasis – ISTH) (13), resp. i Britská hematologická společnosti (BSH). Obvykle jde o nemocné, kteří nemají vysoký rizikový profil APA zejména přítomnost LA, jsou dlouhodobě stabilní na zavedené léčbě DOAC pro žilní trombózu a byli náležitě informováni o možných rizicích tepenné trombózy přes zavedenou medikaci (13).
Existuje řada teoreticky zvažovaných možných dalších léčebných postupů, které jsou brány v úvahu v případech, kdy běžná antitrombotická medikace pacientům nepomáhá. Kromě vyššího dávkování kumarinů s cílovým INR 2,5–3,5 jsou jako přídatná medikace k antitrombotickým postupům nejčastěji používány hydroxychloroquin, statiny, vitamin D, je taktéž používána léčba biologická, zde nejčastěji rituximab, belimumab či blokace TNFα. Blokace komplementu – eculizumab – byla rovněž použita, a to jak na trombotické, porodnické, ale i na mikrovaskulární klinické projevy. Je zmiňovány i koenzym Q10, resp. po té, co byla zjištěna role extracelulárních neutrofilových pastí, tedy základního mechanismu působení periferních neutrofilů k zachycení různých patogenů, i v patofyziologii APS, uvažuje se i posílení role adenosinu či použití agonistů adenozinových receptorů, což protrombotické nastavení u pacientů s APA může ovlivňovat (17).
Vyšetřování antifosfolipidových protilátek u nemocných s žilním tromboembolismem
Plošná screeningová vyšetření výskytu APA u každé DVT či EP jsou vysoce nedoporučována (18). Zejména u starších jedinců, u nichž je častý nález nepatogenních APA, resp. u nemocných v akutním stavu, kdy může být pozitivita APA tranzientní nebo „falešně pozitivní“, může být aktuální stanovení APA zavádějící a vést k nesprávnému léčebnému rozhodnutí. Souhrn indikací k vyšetření APA u DVT či EP se pokouší shrnout tabulka 6. Výše uvedené však neupozorňuje na limitace a nutné procesy. Jedním se základů diagnostického schématu je podmínka, že pro diagnózu APS je nezbytně nutné opakované stanovení APA v časovém úseku 12 a více týdnů. Toto je „sine qua non“ diagnostiky APS a tím respektování výše uvedených léčebných doporučení.
Table 6. Indikace pro vyšetření antifosfolipidových protilátek u VTE 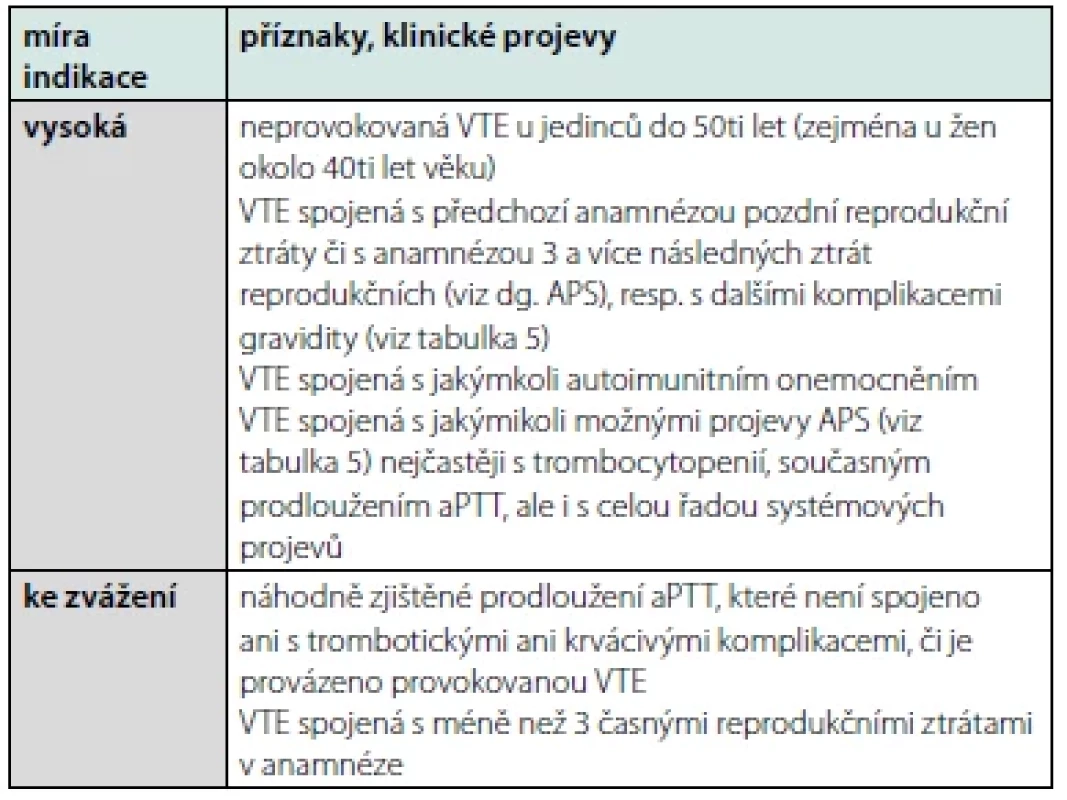
Nicméně diagnostika zejména lupus antikoagulant (LA) není jednoduchá a v případě akutní manifestace VTE není vůbec doporučena, neboť celá řada vlivů, jako je vyšší CRP, použití katecholaminů, antitrombotická medikace, zánětlivé procesy a jiné situace, mohou být provázeny falešnou pozitivitou i negativitou testování (19). Průkaz APA může být problematický zejména v graviditě, kdy vysoká hladina faktoru VIII navozená těhotenstvím může limitovat průkaz LA, ale i vazba jiných APA na cílové struktury může titry APA snižovat, což se projeví ve falešné negativitě jejich průkazu.
I testování LA na jakékoli antitrombotické léčbě (ať již se jedná o testování na nefrakcionovaném heparinu, nízkomolekulárním heparinu, při léčbě pentasacharidem, na kumarinech či DOAC) může být potencionálně ovlivněno. Proto je nutná úzká spolupráce kliniků s hemostazeologickou laboratoří, která by měla mít nastaven systém limitních nálezů (cut off) pro určení pozitivních a negativních výsledků v jednotlivých situacích včetně limitací terapeutickým ovlivněním. Je doporučena řada postupů, jak eliminovat vliv DOAC na stanovení přítomnosti LA, žádná z nich nefunguje na 100 %.
Závěr
Antifosfolipidové protilátky mohou být kauzální příčinou vzniku žilní tromboembolismu a jejich průkaz je v tom případě součástí diagnózy APS, která u nemocného může být důvodem ke změně léčebné strategie. Nicméně průkaz APA je u těchto nemocných relativně řídký a vyloučení APS u nemocných s klinickou manifestací žilní trombózy/ a nebo plicní embolizace je nutno uvážit dle řady dalších klinických a laboratorních nálezů.
Podpořeno MZ ČR – RVO (FNBr, 65269705)
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Alena Buliková, Ph.D.
Oddělení klinické hematologie, Fakultní nemocnice Brno
Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék. 2022;68(8):493-497
Článek přijat redakcí: 22. 9. 2022
Článek přijat po recenzích: 10. 11. 2022
Sources
1. Miyakis S, Lockshin D, Atsumi T et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4 : 295-306.
2. Garcia D, Erkan D. Diagnosis and management of the antiphosholipid syndrome. NEJM. 2018;378 : 2010-2021.
3. Rumsey DG, Myones B, Massicotte P. Diagnosis and treatment of antiphosholipid syndrome in childhood: A review. Blood Cells Mol, DiS. 2017;67 : 34-40.
4. Rauch et al. Origin of antiphoshopilid antibodies. In Ercan G, Loschin MD. Antiphosholipid syndrome. Current research highlights and clinical insights. Springer international publishing 2017; pp 29-52. DOI: 1007/978-319-55442-6.
5. Taha M, Samavati L. Antiphosholipid antibodies in COVID-19: a meta‑analysis and systematic review. RMD Open 2021;7:e001580.
6. Risse J, Viera M, Beuret F et al. Reversible drug ‑ induced antiphosholipid syndrome. Lupus. 2018;27 : 333-33.
7. Malý R, Masopust J, Hosák L, Konupčíková K. Assessment of a risk of a venous thromboembolism and its possible prevention in psychiatric patients. Psychiatry Clin Neurosci. 2008;62 : 3-8
8. Duarte‑Garcia A, Pham MM, Crowson CS et al. The epidemiology of antipshopholipid syndrome: A population‑based study. Arthrit Rheumatol. 2019; 71 : 1545-1552
9. Miranda S, Park J, Le Gal G et al. Prevalence of confirmed antiphosholipid syndrome in 18-50 years unselected patients with first unprovoked venous thromboembolism. J Thromb Haemost. 2020;18 : 916-930.
10. Cervera R, Serrano R, Pons‑Estel GI et al. Morbidity and mortality in the antiphosholipid syndrome during a 10-year period: a multicentre prospective study of 1000 patients. Ann Rheumat, DiS. 2015;74 : 1011-1018.
11. Pengo V, Ruffatti A, Lenani C et al. Clinical course of high‑risk patients diagnosed with antiphosholipid syndrome. J Thromb Haemost. 2009;8 : 237-242.
12. Tektonidou MG, Andreoli L, Limper M et a. EULAR recommendations for the management of antiphosholipid syndrome in adults. Ann Rheum, DiS. 2019;78 : 1296-1304.
13. Zuily S, Cohen H, Isenbergr D et al. Use of direct oral anticoagulants in patients with thrombotic antiphosholipid syndrome: Guidance from the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost. 2020;18 : 2126-2137.
14. Pengo V, Denas D, Zopplellaro G et al. Rivaroxaban vs warfarin in high risk patients with antiphospholipid syndrome. Blood 2018. doi: 10.1182/Blood-2018-04-848333.
15. ASTRO‑APS investigators. Apixaban compared with warfarin to prevent thrombosis in thrombotic antiphospholipid syndrome: a randomized trial. Blood Advances 2021. doi: 10.1182/bloodadvances.2021005808/1829277
16. Pastori D, Menichelli D, Cammisotto V, Pignatelli P. Use of direct oral anticoagulants in patients with antiphosholipid syndrome: A systematic review and comparison of the international Guidelines. Front Cardiovasc Med. 2021; doi: 10.3389/fcvm.2021. 715878.
17. Cohen H, Cuadrado MJ, Erkan D et al. 16th International congress on antiphosholipid antibodies task force report on antiphosholipid antibodies treatment trends. Lupus. 2020;29 : 1571-1593.
18. Keeling D, Mackie I, Moore GW et al. Guidelines on the investigation and management of antiphospholipid syndrome. BJH 2012;157 : 47-58.
19. Pengo V, Tripodi A, Reber G et al. Up‑date of the guidelines for lupus anticoagulant detection. J |Thromb Haemost. 2009;7 : 1737-1740.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 8-
All articles in this issue
- Hlavní téma – Hematologie
- Dnešní pohled na dědičné trombofilie
- Venózní tromboembolismus u antifosfolipidového syndromu
- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Vývoj léčby žilní trombózy od pijavic k mechanické trombektomii
- Tradiční a nové biomarkery kongesce u srdečního selhání
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Plicní střádání
- Porucha kognitivních funkcí a hrozba pandemie demence aneb cesta hypertoniků k nesoběstačnosti
- Antitrombotická léčba a digestivní endoskopie
- Jak dobře jsme léčili hypertenzi v posledních 25 letech?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Dnešní pohled na dědičné trombofilie
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Antitrombotická léčba a digestivní endoskopie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

