-
Medical journals
- Career
Reaktivní, infekční nebo postinfekční artritida?
Authors: Štefan Alušík
Authors‘ workplace: Katedra vnitřního lékařství, IPVZ Praha
Published in: Vnitř Lék 2022; 68(7): 449-453
Category: Review Articles
doi: https://doi.org/10.36290/vnl.2022.094Overview
Problematika reaktivních artritid patří k nejkomplikovanějším v revmatologii. I když původní koncepce reaktivních artritid jako „sterilní artritidy“ byla již překonaná, je zde stále mnoho nejasného. Nejednotná terminologie, nadále neexistující klasifikační a diagnostická kritéria včetně jednotného doporučení pro léčbu poskytly prostor pro různé interpretace této problematiky a pro nerevmatology (internisty a praktické lékaře) je pak obtížné zorientovat se. Přehledný referát pojednává o nejnovějších poznatcích od etiologie až po léčbu reaktivních artritid. Věnuje se i výše uvedeným kontroverzím od terminologie až po nejnovější seznam vyvolávajících patogenů, včetně virů, parazitů i vakcín.
Klíčová slova:
diagnostika – léčba – reaktivní artritida – postinfekční artritida – nové vyvolávající patogeny
Úvod
Reaktivní artritida (dále ReaA) je zánětlivé onemocnění kloubů (obvykle oligoartritida), kterému předcházelo infekční onemocnění, nejčastěji urogenitální nebo gastrointestinální. Ke vzniku artritidy dochází za několik dnů až týdnů po prvotní infekci. Významné práce v historii poznávání choroby jsou uvedeny v tab. 1.
Table 1. Významné práce v dosavadní historii ReA 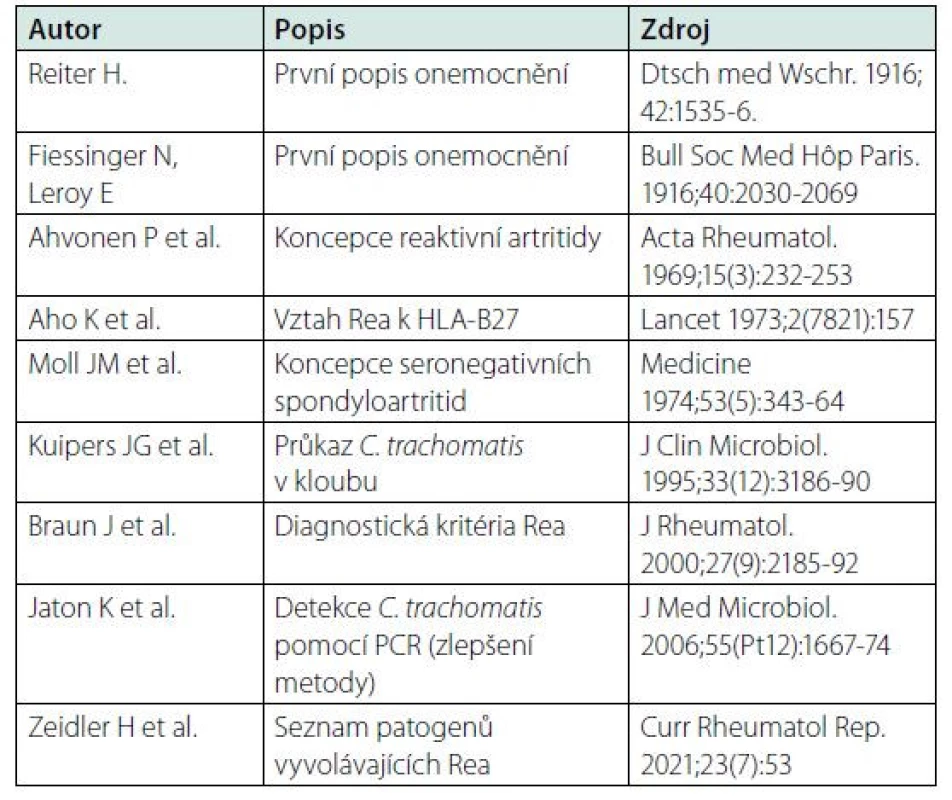
Významným milníkem pro pochopení vzniku artritidy byla nová koncepce finských autorů – reaktivní artritida. Zánět kloubů byl pokládán za sterilní, protože z výpotku nebylo možné kultivovat původce předcházející infekce. Koncem osmdesátých a v devadesátých letech se moderními vyšetřovacími metodami podařilo prokázat přítomnost části nebo i celého vyvolávajícího patogena v kloubním výpotku nebo v synovii (1), čímž byla zpochybněna výše uvedená definice reaktivních artritid. Ve snaze ujasnit rozdíl mezi ReA a postinfekční artritidou navrhli Kuipers a kol. (2) rozdělení ReA na dvě skupiny: a) „infekční ReA“, charakterizovanou intraartikulární perzistencí živého, ale nekultivovatelného mikroba, b) infekcí vyvolanou ReA, kdy bakteriální antigen se dostává diseminací z ložiska infekce kdekoliv v organismu a v kloubu vyvolá imunitně zprostředkovaný zánět. Rozlišení mezi ReA a postinfekční artritidou se tím ješte více zkomplikovalo.
Později se ReA staly již pevnou součástí skupiny seronegativních spondyloartritid. V současnosti neexistují žádná nová diagnostická a klasifikační kritéria pro ReA. Nejznámější jsou tzv. Braunova kritéria z r. 1999 (3) a již v době vzniku nebyla všemi akceptována. Panel expertů se shodl na tom, že termín ReA sa má používat jen tehdy, když pacient má typický klinický obraz a předcházející infekce je vyvolána klasickými patogeny. Doporučili rozlišovat mezi akutní a chronickou formou ReA a jako hranici mezi nimi stanovili 6 měsíců. Anamnézu předcházející symptomatické infekce pokládali za nejdůležitější faktor pro diagnózu ReA. Minimální interval mezi předchozími příznaky a artritidou byl navržen na 1–7 dní, maximálně 4 týdny. V celé řadě dalších otázek nedošlo ke shodě, včetně významu hodnocení serologických a PCR testů (kloubní výpotek, krevní sérum).
Po celou dobu až do současnosti se rozšiřoval a rozšiřuje seznam vyvolávajících patogenů ReA, a to nejen bakteriálních, ale i parazitů a virů, včetně covidu-19. Jimi vyvolané artritidy nemusí mít charakteristický klinický obraz. Proto někteří autoři upřednostňují širokou definici ReA: „Každá nová artritida, kterou předcházela jakákoliv infekce jakékoliv sliznice, je ReA“. Volání pro novou, silnou a jednotně používanou definici ReA se tak ještě více zintenzivnilo (4).
To dále komplikuje situaci a část autorů jako ReA považuje jen artritidy vyvolané klasickými patogeny s typickou gastro - nebo urogenitální infekcí a klasickým klinickým obrazem. Pro ostatní aseptické artritidy vyvolané infekcí používají termín postinfekční artritidy. Většina autorů však používá termín reaktivní artritida pro obě entity (5) a někteří významní odborníci pokládají termín postinfekční artritida již za zbytečný. To vše u internistů a praktických lékařů může vyvolat zmatek. Ten zvyšují i názory některých odborníků, že jde o infekční, a ne reaktivní artritidu. Morrison a Inman (6) pokládají chlamydiemi vyvolanou ReA za infekční (variantu septické artritidy) a podle Mezinárodní klasifikace nemocí navrhují její zařazení mezi Infekční artropatie – M01. Podobně Bojovič et al. (7) pokládají toto onemocnění za „více infekční“ než „reaktivní“.
V následujícím textu probereme základní novinky od epidemiologie až po léčbu ReA.
Epidemiologie
Epidemiologické údaje jsou nepřesné a v jednotlivých zemích se značně liší, neboť je ovlivňuje celá řada faktorů, zejména geografie, vyvolávající infekční patogen a přítomnost HLA‑B27 v populaci, možnosti diagnostiky atd. Proto se roční incidence onemocnění v literatuře uvádí v širokém intervalu od 0,6–27/100 000. Ke zvýšení incidence ReA došlo v sub‑Saharské oblasti Afriky, a to v souvislosti s HIV infekcí (častější výskyt infekcí u této nemoci). Na rozdíl od bělochů šlo téměř ve všech případech o HLA‑B27 negativní jedince. Naproti tomu ve vyspělých zemích incidence ReA pomalu klesá. V USA frekvenci ReA odhadují na 3,5–5 případů na 100 000 obyvatel. Incidence ReA v ČR u dospělých byla 9,3/100 000/rok, prevalence 91,3 /100 000/rok (8). Údaje o výskytu ReA v rozvojových zemích se pokládají za podhodnocené. Z hlediska místa infekce dochází k ReA nejčastěji po urogenitální (kolem 3–8 %) a po gastrointestní infekci (kolem 1–1,5 %).
Etiologie
Seznam vyvolávajících patogenů při vzniku koncepce ReA ještě nebyl stanoven a vznikl až mnohem později po shodě expertů a zahrnoval seznam gastrointestinálních a urogenitálních patogenů (3). Mezi nejčastější vyvolávající agens patří Chlamydia trachomatis, z gastrointestinálních Shigella, Salmonella, Yersinia a Campylobacter. V tabulce 2 jsou uvedeny patogeny vyvolávající ReA od klasických po méně časté, nebo vzácně vyvolávající ReA (9–10). Seznam patogenů se neustále rozšiřuje. Kromě mikrobiálních patogenů (Calmette – Guerin Bacillus, Borrelia burgdorferi) a parazitů (Cryptosporidium, Giardia lamblia, Strongyloides sp.) jsou to i viry (HIV, Parvovirus B19, Chikungunya virus a také i SARS-Cov-2 atd. Předpoklad, že viry mohou vyvolávat „reaktivní artritidy“, je značně kontroverzní a ani mezi odborníky není na tento problém jednoznačný názor. Část z nich viry jako patogen ReA odmítá a tyto artritidy zařazuje mezi postinfekční (11). Argumentují, že klinická manifestace u virových artritid je odlišná od klasického průběhu ReA. Kromě toho v kloubním výpotku byla zjištěna přítomnost viru (rubivirus, varicella zoster, herpes simplex virus, cytomegalovirus atd.), a v těchto případech se jedná o intrainfekční artritidu. U některých jiných virových artritid (hepatitis B virus, adenovirus typ 7) byla v kloubním výpotku zjištěna přítomnost imunokomplexů (antigen‑protilátka), což vedlo ke spekulacím o jejich možné úloze v patogeneze postvirové artritidy.
Table 2. Infekce asociované s ReA (upraveno podle 9 a 10) 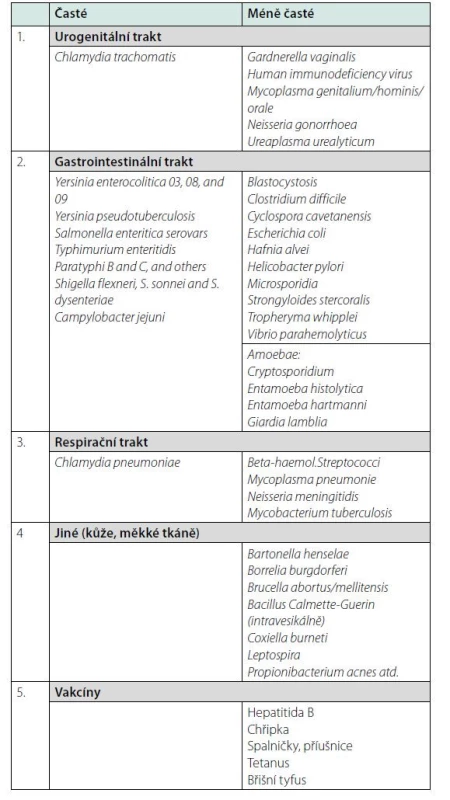
Na druhé straně oponenti zdůrazňují, že termín ReA je možné použít v širším kontextu pro všechny imunitně zprostředkované artritidy, a to po jakékoliv vyvolávající infekci. Zdůrazňují, že podstatou je, že patogen nenapadá kloub přímo. V tabulce 2 jsou mezi patogeny zařazeny i vakcíny. Důležitou součástí vakcín jsou adjuvantní látky (12), které zvyšují specifickou imunitní odpověď na antigen a mohou také vyvolávat tzv. autoimunitní syndrom indukovaný adjuvanty (ASIA syndrom). Spekuluje se o tom, že ReA po vakcíně je častěji vyvolána imunitní reakcí na látky obsažené v jejím vehikulu než proti infekčnímu patogenu resp. jeho části v ní obsažené.
Někteří autoři mezi patogeny zařazují kromě vakcín i léky, např. interferon alfa. Pokud připustíme, že vyvolávající popud nemusí být infekce, ale i jiný činitel narušující imunitu jedince (např. léčba inhibitory imunitních kontrolních bodů, které vyvolávají u léčených podobný typ artritidy, jako je ReA), dostaneme se velmi daleko od původní definice ReA.
Kontroverzní je také zařazení patogenů Borrelia burgdorferi, Neisseria gonorrhoeae a Tropheryma whipplei mezi patogeny schopné vyvolat reaktivní artritidu. Infekce a revmatická manifestace je u nich léčitelná antimikrobiální léčbou, přestože kultivace kloubního výpotku je negativní. U lymské boreliózy jsme přítomnost borelií v synovii prokázali již před více než 30 lety (13). I když byly tyto nemoci zařazeny mezi ReA již dříve, je nutné mít na paměti odlišný terapeutický postup a jejich překrývání se s infekčními nemocemi.
V současnosti je značná pozornost věnována zejména poststreptokokové ReA, Poncetové nemoci a ReA indukované při intravezikální aplikaci BCG vakcíny u léčby karcinomu močového měchýře.
Patogeneze
Patogeneze ReA je komplexní proces, doposud ne zcela objasněný. Při vzniku ReA se uplatňují čtyři hlavní faktory: anamnéza infekčního onemocnění (etiologické agens), úloha cytokinů, genetická predispozice (HLA - B27) a střevní mikroflóra. HLA B27 je vysoce polymorfní molekula a v současnosti známe více než 223 různých podtypů. Riziko vzniku ReA je až 50× vyšší v porovnání s jedinci s negativním HLA‑B27. V patogenezi ReA se nejčastěji tradují tři hypotézy (14):
• hypotéza artritogenního patogenu (nejstarší), kdy dochází k aberantní prezentaci antigenu, která vede k autoimunitě a zánětu,
• hypotéza o špatném skládání molekul HLA B27 a jejich skladování v endoplazmatickém retikulu, kde se hromadí a mohou indukovat stressovou odpověď,
• hypotéza „tvorby homodimerů“. Podle této hypotézy se těžké řetězce HLA‑B27 homodimerizují na buněčném povrchu, kde působí jako prozánětlivé ligandy pro humorální nebo buňkami zprostředkované autoimunitní odpovědi.
U klasických patogenů vyvolávajících ReA jsme získali celou řadu nových poznatků (15). Např. u nejčastějšího původce C. trachomatis se zjistilo, že chlamydie jsou z místa infekce do kloubů transportovány monocyty/ makrofágy. Chlamydie během transportu a usazování v synovii jsou ve zvláštním metabolickém stavu‑tzv. „perzistence“, který je charakterizován abnormální genovou expresí a také částečnou odolností vůči antibiotikům. Proč nedochází k destrukci chlamydií není jasné. Vysvětluje se to schopností chlamydií inhibovat fagozomy a lysozomy, což umožňuje jejich perzistenci v buňkách. Důležité jsou i nové poznatky o mechanismu kolonizace gastrointestinálního traktu chlamydiemi.
Na rozdíl od chlamydií se bakteriální patogeny do kloubu nedostanou v životaschopném a neporušeném stavu. Do synovie se dostanou jen jejich části, včetně tzv. artritogenních peptidů. V součinnosti s HLA B27 mohou vyvolat zánět. Je třeba poznamenat, že pozitivita HLA‑B27 u Rea je nižší než u ankylozující spondylitidy (30–50 % versus 80 % a více). Proto se předpokládají i jiné mechanismy vzniku artritidy a jedním z dalších uplatňujících se faktorů je např. změna střevního mikrobiomu (16). Ten má klíčovou roli v zajištění hormonální, metabolické a imunologické homeostázy organismu. Přetrvávání bakteriálních antigenů (bakteriální DNA, antigenní proteiny a lipopolysacharidy) v kloubním výpotku a synovii jsou nepříznivými prognostickými faktory, kdy nemoc přechází do chronické fáze.
Klinické projevy
Klinické projevy jsou dobře známé a odpovídají dřívějšímu Reiterovu syndromu. K tomu dochází obvykle za 1–4 týdny po překonané urogenitální nebo gastrointestinální infekci. Z celkových příznaků se mohou vyskytovat: zvýšená teplota/horečka, únava, pokles hmotnosti. Artritida se nejčastěji manifestuje ve formě asymetrické oligoartritidy s predilekčním postižením dolních končetin. Mezi nejčastěji postižené klouby patří koleno a kotník (talokrulární kloub). Časté a diagnosticky důležité jsou extraartikulární projevy. Charakteristická je entezitida (v místě úponu šlachy na kost, zejména úponu Achillovy šlachy) a daktilitida (párkovitý prst), kde typický tvar prstu je podmíněný hlavně přítomnou tenosynovitidou. Z očních příznaků je častá konjunktivitida, vzácnější je uveitida, keratitida nebo ulcerace rohovky. Z kožních projevů se mohou vyskytovat léze napodobující (makro i mikroskopicky) psoriázu na dlaních rukou a ploskách nohou (keratoderma blenorrhagica). Změny na nehtech zahrnují onycholýzu, subunguální keratózu nebo tečkování nehtů. V ústní dutině se mohou vyskytnout aftózní ulcerace. U mužů se může objevit balanitis circinata (až 40 % postižených), často probíhá asymptomaticky a není specifická jen pro ReA. Na srdci se vzácně mohou vyskytnout aortitida a perikarditida.
U většiny pacientů onemocnění probíhá v akutní formě a spontánně odezní do 6 měsíců. U menší části (10–30 %) onemocnění trvá déle než 6 měsíců, mluvíme o chronické formě ReA. Za rizikové faktory pro přechod od reaktivní artritidy do chronické formy a vzniku ankylozující spondyloartritidy jsou:
• infekce Chlamydia trachomatis a Ureaplasma urealyticum,
• akutní přední uveitida,
• sakroileitda.
Ke vzniku sakroileitidy dochází obvykle až po několika měsících trvání onemocnění, včasné změny lze zaznamenat při vyšetření magnetickou rezonancí.
Diagnostika
V současnosti neexistují obecně akceptovaná kritéria pro reaktivní artritidy, ani žádný specifický test potvrzující diagnózu. Proto diagnostika reaktivní artritidy může být někdy obtížná. Zdůrazníme, že v současnosti je diagnostika ReA výlučně klinickou záležitostí, t.j. diagnózu stanovujeme na základě pečlivé anamnézy a klinického nálezu. Zdůrazňujeme význam předcházející infekce v anamnéze. U části nemocných může infekce probíhat asymptomaticky a diagnóza ReA je pak obtížná. Proto se doporučuje diferenciálně diagnosticky zvažovat ReA vždy při výskytu nejasného zánětu kloubů na dolních končetinách (Tab. 3).
Table 3. Diagnostická kritéria ReA (3) 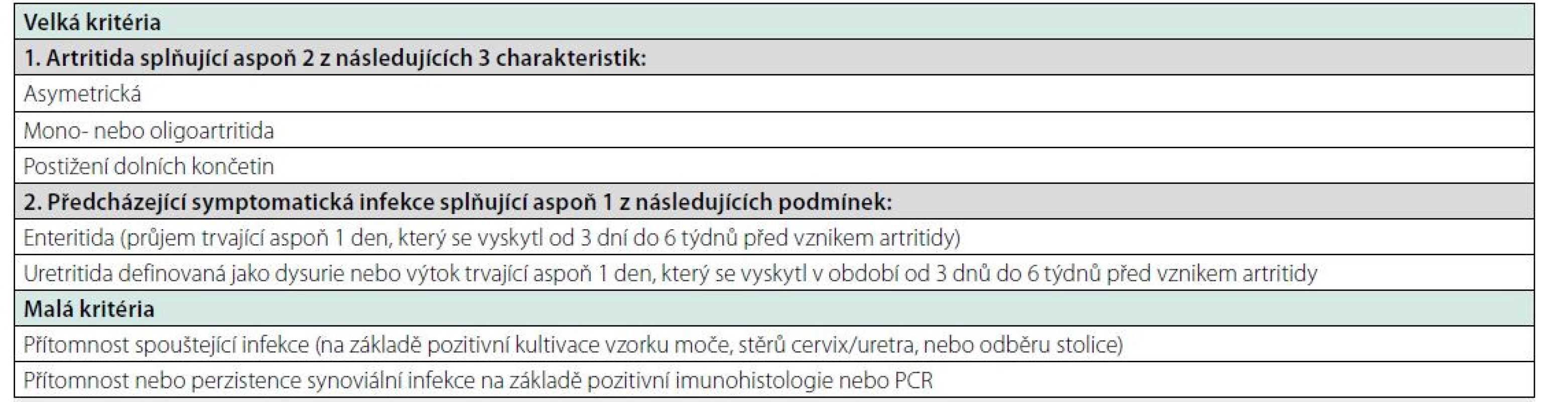
Pro definitivní diagnózu ReA musí být splněna dvě hlavní kritéria a aspoň 1 malé, pro diagnózu pravděpodobnou dvě velká nebo 1 velké a 1 malé kritérium. Na podporu diagnózy se prováději různé laboratorní testy z různých materiálů (moč/výtěr z uretry, stolice, kloubní výpotek, případně vzorek synovie) k detekci možných patogenů, které potvrzují souběžné nebo předchozí infekce.
K detekci Chlamydia trachomatis se používají testy amplifikace nukleových kyselin (17, 18). Z amplifikačních testů nukleových kyselin se nejčastěji používá polymerázová řetězová reakce – PCR (real time). Proti konveční PCR má výhody především pro svoji rychlost, automatizaci, snížení rizika kontaminace a možnost kvantifikace. V současnosti se jedná o nejspolehlivější metodu při dodržení správných postupů odběru materiálů (moče, stěrů z uretry, cervixu, plodové vody, rekta, spojivek, nazofaryngeálních výtěrů, sputa, BAL, biopsie apod.). Senzitivita a specificita vyšetření je vysoká a pohybuje se kolem 99 %. Musíme mít na paměti, že až 36 % chlamydiálních a 26 % enterálních vyvolávajících patogenů má asymptomatický průběh, což ztěžuje diagnostiku.
Serologické testování na Chlamydia trachomatis má omezenou hodnotu kvůli serologické zkřížené reaktivitě mezi Chlamydia trachomatis a Chlamydia pneumoniae, nemožnosti rozlišit minulou a současnou infekci podle perzistence protilátek a nižší nebo chybějící protilátkové odpovědi u infekcí dolních močových cest. Dnes se tyto testy nemají používat.
U enterálních patogenů (Campylobacter, Salmonella, Shigella a Yersinia) se používá kombinace metod serologických testů (enzymová imunoanalýza) a kultivačních metod. Připomeneme, že artritida se může objevit až v době, kdy vyvolávající infekce již odezněla a mikrobiální testy na vyvolávajícího patogena mohou být negativní.
Standardně provádíme vyšetření antigenu HLA‑B27. Zdůrazníme, že jeho pozitivita není diagnostický marker, ale vztahuje se k prognóze onemocnění. Z běžně prováděných vyšetření můžeme zjistit anémii v krevním obraze nebo zvýšené některé markery zánětu, např. C‑reaktivní protein apod. Při vyšetření kloubů se stále více uplatňují zobrazovací metody – od prostého rtg snímku, přes ultrasonografii (USG) až po počítačovou tomografii (CT) a magnetickou rezonanci (MRI). Předmětem vyšetření jsou obvykle postižené drobné klouby rukou a nohou, oblast patní kosti, kotníku, kolene, lokte a sakroiliakálních kloubů. Prostý rtg snímek může prokázat zánětlivé změny v kloubu včetně sakroileitidy, v časném stadiu onemocnění je však jeho přínos malý a spočívá zejména ve vyloučení jiných příčin bolesti kloubů. USG vyšetření může znázornit chrupavku, synovitidu a tenosynovitidu, entezopatie, kostní eroze a burzitidy. CT vyšetření zaznamená zejména strukturální změny v kortikální i spongiální kosti. CT je výhodné zejména z hlediska zjištění rozsahu komplikací (např. ankylóza kloubu), pokud je rtg vyšetření nedostačující. MRI kromě časných změn na kloubech znázorní i edém kostní dřeně. Vyznačuje se vysokou senzitivitou, ale nízkou specificitou. Všechny nálezy je nutné korelovat s klinikou a odlišit od jiných seronegativních artropatií.
Léčba
Na úvod zdůrazníme, že v současnosti neexistuje žádná kurativní léčba ReA, a také pro ni nemáme žádné doporučené postupy. V případě, že je ještě přítomná doznívající infekce a je známý vyvolávající patogen, používáme léčbu antibiotiky. U chlamydiálních infekcí léčíme i sexuálního partnera. V roce 2010 byly publikovány výsledky studie ReA vyvolané C. trachomatis po 6měsíční léčbě kombinací antibiotik (19). V léčené skupině došlo ke zlepšení u 63 % pacientů v porovnání s 20 % v placebové skupině. Podobně i v jiné studii (7) byly výsledky léčby pozitivní. Naproti tomu výsledky metaanalýzy klinických studií (20) nepotvrdily pozitivní efekt dlouhodobé léčby a otázka efektu antibiotik u chlamydiálních infekcí zůstává nadále otevřená.
U vlastní ReA používáme 4 skupiny léčiv. U pacientů s lehkým průběhem často vystačíme s nesteroidními antirevmatiky (NSA), např. ibuprofen, diklofenak, naproxen, které se pokládají za léčbu první linie. Léčbu NSA můžeme prohlásit za neúčinnou, pokud ji pacient dostává v maximálních dávkách po dobu 2 týdnů bez dostatečného klinického efektu. Jiní autoři doporučují změnu až po užívání 2–3 měsíců NSA nebo glukokortikoidů.
U pacientů se závažnějším průběhem můžeme uspět s glukokortikoidy, které se doporučují hlavně intraartikulárně. Pokud je nutno podávat perorálně, podáváme je co nejkratší dobu, optimálně jen několik dní, ale v praxi se podávají i několik týdnů až měsíců. Obvyklá dávka je 20 mg/d, kterou postupně titrujeme na nejnižší dávku, která kontroluje symptomy onemocnění. Ke změně přistupujeme obvykle po 2–3 měsících neúspěšné léčby. U pacientů se závažnějším průběhem trvajícím i několik měsíců používáme v léčbě sulfasalazin nebo metotrexát. Oba přípravky se často nasazují a kombinují s glukokortikoidy při nedostatečné odpovědi na samotné glukokortikoidy. U pacientů se závažnějším průběhem se začíná prosazovat cílená a biologická léčba, která je účinná jak u artritidy, tak i u kožních změn. Nevýhodou této léčby je poměrně krátká terapeutická odpověď. Proto někteří autoři vyzývají k intenzivnímu výzkumu široké problematiky ReA, který povede k lepšímu poznání tohoto onemocnění včetně jeho léčby (21).
Prognóza
Průměrná doba onemocnění je 3–5 měsíců. U většiny nemocných (80 %) vymizí projevy onemocnění za 6–12 měsíců, u 15–20 % pacientů přechází do chronické formy. I po odeznění artritidy mívají bolesti v kloubech, v místě úponů šlach a oblasti páteře.
Závěr
Seznam vyvolávajících patogenů ReA se neustále rozšiřuje, a to nejen z oblasti mikrobů, ale i virů, parazitů a vakcín, u nichž klinický obraz nemusí být typický a může způsobit diferenciálně diagnostické obtíže. To umocňuje i fakt, že pro toto onemocnění nadále nemáme klasifikační a diagnostická kritéria ani jednotná doporučení pro léčbu. Nové poznatky získané v posledních letech ukázaly, že pojetí ReA jako „sterilní artritidy“ je dnes už překonané. Na druhé straně víme, že ReA není jen onemocnění kloubů, ale zahrnuje zánětlivé syndromy postihující mnoho orgánů. Určité rysy těchto onemocnění byly popsány u tzv. „dlouhého kovidu“ a vzácně i po očkování proti covidu-19. Přes nesporné úspěchy nejsou naše znalosti o tomto onemocnění takové, abychom je mohli využít k účinnější a cílenější léčbě.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Štefan Alušík, CSc.
Katedra vnitřního lékařství IPVZ
Ruská 85, 100 05 Praha 10
Cit. zkr: Vnitř Lék. 2022;68(7):449-453
Článek přijat redakcí: 22. 8. 2022
Článek přijat po recenzích: 12. 9. 2022
Sources
1. Kuipers JG, Scharmann K, Wollenhaupt J et al. Sensitivities of PCR, MicroTrak, Chlamydia EIA, IDEIA, and PACE 2 for purified Chlamydia trachomatis elementary bodies in urine, peripheral blood, peripheral blood leukocytes, and synovial fluid. J Clin Microbiol. 1995;33(12):3186-90.
2. Kuipers JG, Kohler L, Zeidler H. Reactive or infectious arthritis. Ann Rheum Dis. 1999;58 : 661-664.
3. Braun J, Kingsley G, van der Heijde D et al. On the difficulties of establishing a consensus on the definition of and diagnostic investigations for reactive arthritis. Results and discussion of a questionnaire prepared for the 4th International Workshop on Reactive Arthritis, Berlin, Germany, July 3-6, 1999. J Rheumatol. 2000;27(9):2185-92.
4. Bekaryssova, D., Yessirkepov, M., Zimba, O. et al. Reactive arthritis before and after the onset of the COVID-19 pandemic. Clin Rheumatol. 2022; 41(6):1641–1652.
5. Ferreira A, Monteiro M, Vita P et al. al. Post‑infectious arthritis and reactive arthritis. Infection and Autoimmunity.(Second Edit.). Elsevier 2015; 807 – 828. Available from: www:https:// doi.org/10.1016/B978-0-444-63269-2.00050-7
6. Morris D, Inman RD. Reactive arthritis: developments and challenges in diagnosis and treatment. Curr Rheumatol Rep. 2012;14(5):390–4.
7. Bojović J, Strelić N, Pavlica L. Reiter’s syndrome- - disease of young men- - analysis of 312 patients. Med Pregl. 2014;67(7-8):222-30
8. Hanova P, Pavelka K, Holcatova I et al. Incidence and prevalence of psoriatic arthritis, ankylosing spondylitis, and reactive arthritis in the first descriptive population‑based study in the Czech Republic. Scand J Rheumatol. 2010;39(4):310-7.
9. Zeidler H, Hudson AP. Reactive Arthritis Update: Spotlight on New and Rare Infectious Agents Implicated as Pathogens. Curr Rheumatol Rep. 2021;23(7):53
10. Jubber A, Moorthy A. Reactive arthritis: a clinical review. J R Coll Physicians Edinb. 2021;51(3):288-297.
11. Kobayashi S, Taniguchi Y, Kida I et al. SARS‑CoV2 - triggered acute arthritis: Viral arthritis rather than reactive arthritis. J Med Virol. 2021;93(12):6458-6459.
12. Facciolà A, Visalli G, Laganà A et al. An Overview of Vaccine Adjuvants:Current Evidence and Future Perspectives. Vaccines 2022;10, 819. Available from: www: https://doi. org/10.3390/vaccines10050819.
13. Valesová M, Trnavský K, Hulínská D et al. Detection of Borrelia in the synovial tissue from a patient with Lyme borreliosis by electron microscopy. J Rheumatol. 1989;16(11):1502-5.
14. Sharip A, Kunz J. Understanding the Pathogenesis of Spondyloarthritis. Biomolecules. 2020;10(10):1461. Available from: www: https://doi.org/10.3390/biom10101461.
15. Brockett MR, Liechti GW. Persistence Alters the Interaction between Chlamydia trachomatis and Its Host Cell. Infect Immun. 2021;89(8):e0068520. Available from: www: https:// www.ncbi.nlm.nih.gov/pmc/articles/PMC8281235/.
16. Manasson J, Shen N, Ferrer HRG et al. Gut microbiota perturbations in reactive arthritis and post‑infectious spondyloarthritis. Arthritis Rheumatol. 2018;70(2):242-54.
17. Shetty S, Kouskouti C, Schoen U et al. Diagnosis of Chlamydia trachomatis genital infections in the era of genomic medicine. Braz J Microbiol. 2021;52(3):1327-1339.
18. Kebbi‑Beghdadi C, Aeby S, Baud D, Greub G. Evaluation of a Multiplex Real‑Time PCR Assay for Detecting Chlamydia trachomatis in Vaginal Samples. Diagnostics (Basel). 2022;12(5):1141.
19. Carter JD, Espinoza LR, Inman RD et al. Combination antibiotics as a treatment for chronic Chlamydia‑induced reactive arthritis: a double‑blind, placebo‑controlled, prospective trial. Arthritis Rheum. 2010;62(5):1298-307.
20. Barber CE, Kim J, Inman RD et al. Antibiotics for treatment of reactive arthritis: a systematic review and metaanalysis. J Rheumatol. 2013;40(6):916-928.
21. Zeidler H, Hudson AP. Quo vadis reactive arthritis? Curr Opin Rheumatol. 2022;34(4): 218-224.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 7-
All articles in this issue
- Hlavní téma – Nefrologie
- Current options for slowing the progression of chronic kidney disease
- Expert opinion on the cooperation of diabetologists and internists with nephrologists in the care of patients with chronic kidney diseases
- Glomerulonephritides associated with infections
- New developments in anaemia treatment – erythropoietin versus prolyl hydroxylase inhibitors?
- Covid-19 in kidney transplant recipients
- Reactive, infectious, or post‑infectious arthritis?
- Effect of SGLT2 inhibitor empagliflozin on the stabilization of heart failure progress with the possibility of further interventions in a patient with HFrEF – a case report
- New technology in the hypolipidemic drugs development. Inclisiran (LEQVIO)
- Therapy of hypertension in elderly population and its potential risks
- Thyroid incidentalomas
- Můžeme novou léčbou ovlivnit dosavadní terapií neřešený zánět a fibrózu u pacientů s DM2 a CKD?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Reactive, infectious, or post‑infectious arthritis?
- Thyroid incidentalomas
- New developments in anaemia treatment – erythropoietin versus prolyl hydroxylase inhibitors?
- Current options for slowing the progression of chronic kidney disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

