-
Medical journals
- Career
Endoskopická léčba časného kolorektálního karcinomu
Authors: Přemysl Falt
Authors‘ workplace: II. interní klinika – gastroenterologická a geriatrická, FN a LF UP Olomouc
Published in: Vnitř Lék 2022; 68(6): 355-362
Category: Main Topic
doi: https://doi.org/10.36290/vnl.2022.075Overview
Časné kolorektální neoplazie jsou lokalizované prekancerózní léze tlustého střeva se zanedbatelným rizikem lymfatické nebo systémové diseminace. Mezi časné neoplazie patří adenomy s lehkou a těžkou dysplazií, intramukózní adenokarcinom a adenokarcinom s invazí do povrchové části submukózy bez jiných rizikových histologických známek. Časné neoplazie jsou v drtivé většině případů detekovány koloskopicky a metodou volby v jejich léčbě je endoskopická resekce, která z velké části nahradila resekci chirurgickou. Během diagnostické koloskopie jsou užívány morfologické klasifikace umožňující odhad rizika přítomnosti invazivního karcinomu a volbu správné resekční techniky. V běžné klinické praxi je užívána endoskopická polypektomie a endoskopická slizniční resekce (EMR), v terciárních endoskopických centrech endoskopická submukózní disekce (ESD) a endoskopická transmurální resekce (FTR). Finálním arbitrem úspěšnosti léčby je histologické vyšetření resekátu, v některých případech může být indikována následná chirurgická resekce s lymfadenektomií. Vzhledem k riziku lokální recidivy a metachronních lézí je nutná následná dispenzarizace nemocných.
Klíčová slova:
koloskopie – kolorektální karcinom – endoskopická submukózní disekce – endoskopická transmurální resekce – endoskopická polypektomie – endoskopická slizniční resekce
Úvod
Kolorektální karcinom (KRK) je jednou z nejčastějších onkologických diagnóz a ve vyspělých zemích představuje významnou zdravotní i socioekonomickou zátěž. V České republice je ročně diagnostikováno asi 7 400 nových případů KRK a bohužel asi 3 500 nemocných na něj umírá (1, 2). Pozitivním epidemiologickým jevem je pokles incidence o 2,8 % a mortality dokonce o 21,9 % mezi lety 2006 a 2016, pravděpodobně i důsledkem screeningového programu zavedeného v roce 2000, který nadále úspěšně pokračuje (3). Jako u jiných nádorů má na prognózu nemocných klíčový vliv stadium, ve kterém je diagnostikován. Zatímco v klinickém stadiu I (T1/2 N0 M0) je 5leté přežití přes 90 %, ve stadiu IV (M1) je necelých 16 %. Bohužel, podíl nemocných diagnostikovaných ve stadiu III a IV se stále blíží polovině případů (2).
Tlusté střevo nám na rozdíl od jiných orgánů (instruktivním příkladem mohou být pankreatogenní nádory) skýtá možnost většinu neoplazií diagnostikovat ve stadiu, ve kterém jsou minimálně invazivně (obvykle prostředky digestivní endoskopie) nebo chirurgicky resekovatelné s následnou vynikající prognózou. Většina lézí roste epiteliálně, je tedy intraluminálně detekovatelná dobře dostupnou a metodicky propracovanou koloskopií. Celý průběh kancerogeneze trvá v typických případech dlouho (až 10–20 let) a poskytuje nám tak dostatečný čas k diagnostice (4). Vzhledem k tomu, že většina časných lézí není provázena specifickými klinickými příznaky, je nutné vyšetřovat asymptomatické jedince ve věku s dostatečně vysokou pravděpodobností přítomnosti neoplazie. V České republice screeningový program začíná ve věku 50 let buď formou screeningové koloskopie, nebo testu na okultní krvácení ve stolici. Další skupinou jsou nemocní ve zvýšeném riziku KRK, tedy nemocní s hereditárními formami KRK, pozitivní rodinnou anamnézou, s osobní anamnézou kolorektální neoplazie a pacienti s dlouhotrvající kolitickou formou idiopatického střevního zánětu (IBD). U části nemocných je kolorektální neoplazie detekována při koloskopii nebo jiném vyšetření prováděných pro nesouvisející symptomy (5–7). Cílem této práce je definovat časné kolorektální neoplazie a KRK a popsat současný stav jejich diagnostiky a endoskopické léčby.
Časný kolorektální karcinom
Definice časné kolorektální neoplazie a KRK není univerzální a lze je vnímat z různých pohledů. Za časnou kolorektální neoplazii (ne karcinom) z praktických důvodů považujeme benigní nebo nízkorizikové maligní afekce, které jsou bezpečně endoskopicky resekovatelné a nejsou zatíženy významnějším rizikem lymfatické nebo systémové diseminace. Jedná se tedy o adenomy s lehkým a těžkým stupněm intraepiteliální neoplazie („dysplazie“), intramukózní adenokarcinom nebo karcinom invadující do povrchové části submukózy bez jiných rizikových endoskopických známek (8). Optimálním cílem endoskopické resekce je tzv. „pokročilý adenom“ definovaný jako adenom ≥ 10 mm, s vilózní strukturou a/nebo těžkou dysplazií, který je zatížen signifikantním rizikem maligní transformace 25–40 % za 10 let (9) a je ve většině případů snadno léčitelný, obvykle přímo během diagnostické koloskopie. Některé léze ale stále nelze přes příznivou histologii řešit endoskopicky a je nutná resekce chirurgická, důvodem je nejčastěji nepříznivá lokalizace, velikost léze nebo fibrotické změny v submukóze.
Časný KRK je obvykle chápán jako z resekátu histologicky potvrzený karcinom invadující maximálně do povrchové části (třetiny) submukózy (sm1) bez dalších rizikových histologických známek (nepříznivý grading, lymfatická nebo vaskulární invaze, budding vyššího stupně). Předpokládané riziko lymfatické diseminace je u takové léze < 3 % (10) a nepřevyšuje tak vlastně riziko chirurgické resekce. Konsenzuálně je za hranici svrchní třetiny submukózy považováno 1000 μm (1 mm) měřených od lamina muscularis mucosae. Intramukózní karcinom je dle revidované Vídeňské klasifikace z pohledu rizikovosti kladen na úroveň těžké stupně dysplazie (11) a takové léze nejsou v kolorektu považovány za maligní. V širším slova smyslu lze za časný KRK považovat i invazivní karcinom kurativně léčitelný chirurgickou resekcí bez nutnosti následné onkologické léčby, tedy karcinom s hlubokou submukózní invazí (sm2–3) nebo s invazí do muscularis propria (T2) (klinické stadium I) bez nálezu lymfatických nebo vzdálených metastáz. Hraniční je nízkoriziková podskupina T3 karcinomů (klinické stadium II), které obvykle také nejsou indikovány k adjuvantní léčbě. Každý případ invazivního karcinomu by měl být bez ohledu na způsob resekce probrán na multioborovém panelu daného zařízení.
Správný endoskopický management kolorektálních lézí spočívá v jejich spolehlivé detekci, charakterizaci (zejména ve smyslu rizika přítomnosti invazivní neoplazie), optimálně zvolené technice endoskopické resekce a následné dispenzarizaci nemocných.
Detekce a charakterizace kolorektálních lézí
Kolorektální neoplazie jsou nejčastěji detekovány v průběhu koloskopie indikované z důvodů uvedených výše. Podstatně méně k detekci vedou alternativní metody jako CT kolografie nebo kapslová koloskopie, důvodem je obvykle volba nemocného nebo nemožnost provést klasickou koloskopii. V případě objemnějších lézí může být nález náhodný při vyšetření z jiného důvodu (CT, MR, PET‑CT).
Koloskopie s detekcí a eradikací adenomových lézí snižuje incidenci a mortalitu na KRK (12). Problémem zůstává, že během koloskopie dochází k přehlédnutí až 20–27 % adenomů, 10 % pokročilých adenomů, a dokonce až 6 % karcinomů (13, 14). Záchyt adenomů je proto jedním ze základních parametrů kvality koloskopie (ADR, Adenoma Detection Rate). Ze studií je patrná velká variabilita ADR mezi endoskopisty a významná negativní korelace mezi ADR a tzv. intervalovým KRK, který je definován jako KRK diagnostikovaný v období mezi negativní koloskopií a plánovanou dispenzární koloskopií (15, 16). Detekční úspěšnost koloskopie je komplexní proces a kromě individuálních schopností endoskopisty záleží na kvalitě střevní očisty, prohlížecím čase a kvalitě zobrazení sliznice tlustého střeva. S různou úspěšností jsou studovány a v klinické praxi využívány techniky potenciálně zvyšující záchyt neoplastických lézí (klasická a virtuální chromoendoskopie, nástavce na distálním konci endoskopu, zvětšovací techniky, změna úhlu rozhledu, vodou asistované zavádění) (17, 18).
Charakterizace spočívá v makroskopickém rozlišení neoplastických a non‑neoplastických lézí, ohraničení jejich okrajů (delineace) a odhadu histologické pokročilosti, zejména ve smyslu rizika přítomnosti invazivního adenokarcinomu. Správná charakterizace vede k volbě vhodné techniky endoskopické resekce. Léze zvažované k endoskopické léčbě obvykle nejsou bioptovány z důvodu rizika následných fibrotických změn, klešťová biopsie navíc nereprezentuje histologii celé léze. Charakterizace by měla vést i k identifikaci malignizovaných lézí s hlubokou invazí, které není možno kurativně odstranit endoskopicky a jsou indikovány přímo k chirurgické resekci. U takových lézí je naopak biopsie vhodná a v některých lokalizacích jsou i označeny tetováží k usnadnění orientace během operace.
Za standardní je dnes považováno zobrazení s vysokým rozlišením a jednou z forem virtuální chromoendoskopie, která prakticky nahradila klasickou chromoendoskopii s využitím reliéfových nebo absorpčních barviv. K charakterizaci neoplastických lézí je využívána řada endoskopických klasifikací. Pařížská klasifikace je základní morfologickou klasifikací rozlišující polypoidní léze, které jsou stopkaté (0-Ip), polopřisedlé (0-Isp) nebo přisedlé (0-Is); a nepolypoidní léze (0-II), které svojí výškou nepřesahují 2,5 mm nad úroveň okolní sliznice. Nepolypoidní léze mají variantu lehce vyvýšenou (0-IIa), plochou (0-IIb) a lehce sníženou (0-IIc). Léze vyhloubené až ulcerované jsou označeny jako 0-III (19). Z Pařížské klasifikace vychází tzv. LST klasifikace nepolypoidních lézí ≥ 10 mm (Laterally Spreading Tumors), která rozlišuje řasu subtypů (LST‑GH, LST‑GM, LST‑NGF, LST‑NGPD) (20). Klíčové je, že velikost a morfologický typ léze korelují s rizikem přítomnosti invazivního karcinomu. Například u lézí typu 0-IIa / LST‑GH je riziko < 1 %, u lézí typu LST‑GM 19 % a léze typu 0-IIc / LST‑NGPD jsou provázeny 45% a při velikosti ≥ 30 mm dokonce až 88% rizikem. Ložisko invazivního karcinomu je obvykle přítomno v polypoidní (0-Is) nebo naopak vkleslé části (0-IIc) lézí (21). Ze zvětšovací klasické chromoendoskopie vychází klasifikace vzoru epiteliálních jamek („pit pattern“) dle Kuda na povrchu lézí (typ I, II, IIIs, IIIL, IV, Vi, Vn), které korelují s histologickou pokročilostí léze. Například typ Vi je typický pro adenomy s těžkou dysplazií až povrchově submukózně invadující karcinom a dezorganizovaný typ Vn signalizuje přítomnost hluboce invadujícího karcinomu (22). Vzhledem k dobré dostupnosti virtuální chromokoloskopie (zejména NBI, Narrow Band Imaging) je v klinické praxi čím dál častěji využívána tzv. NICE (NBI International Colorectal Endoscopic) klasifikace. Typ I odpovídá pilovitým lézím a hyperplastickým polypům, typ 2 adenomům s lehkou dysplázií až povrchově submukózně invadujícímu karcinomu a typ 3 karcinomu s hlubokou invazí (23). Tzv. JNET (Japan NBI Expert Team) modifikace ještě rozděluje typ 2 na 2 A odpovídající adenomu s lehkou dysplazií a 2 B odpovídající adenomu s těžkou dysplazií až povrchově invadujícímu karcinomu (24) (Obr. 1-4).
Image 1. Léze 0-IIa sigmoidea v módu NBI odpovídající typu 1 dle NICE / JNET klasifikace, histologicky hyperplastický polyp 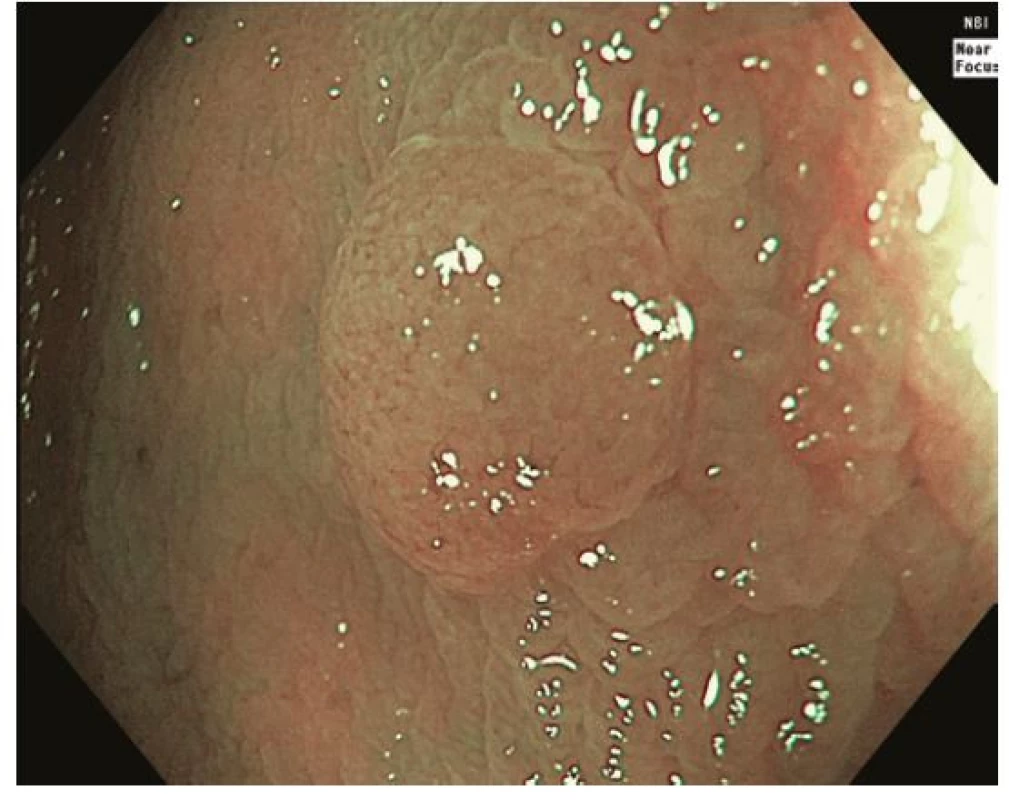
Image 2. Léze sigmoidea 0-IIa v módu NBI odpovídající typu 2A dle NICE / JNET klasifikace, histologicky tubulární adenoma s lehkou dysplazií 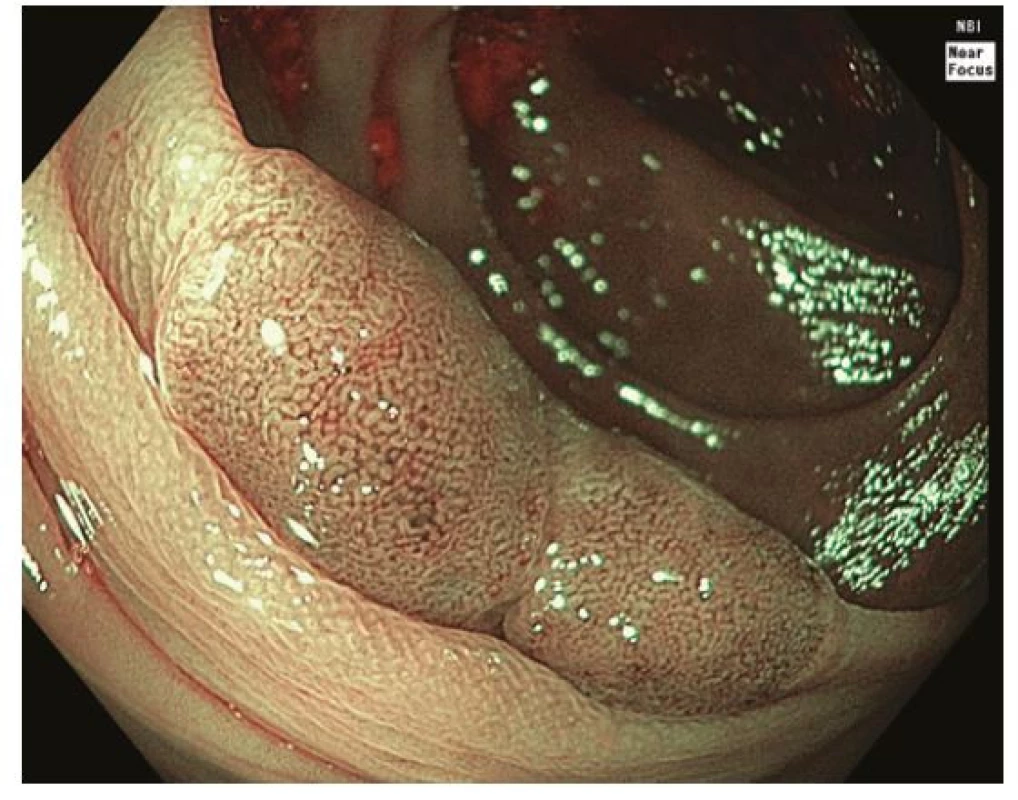
Image 3. Léze sigmoidea 0-Is v módu NBI odpovídající typu 2B dle NICE / JNET klasifikace, histologicky adenokarcinom s povrchovou submukózní invazí 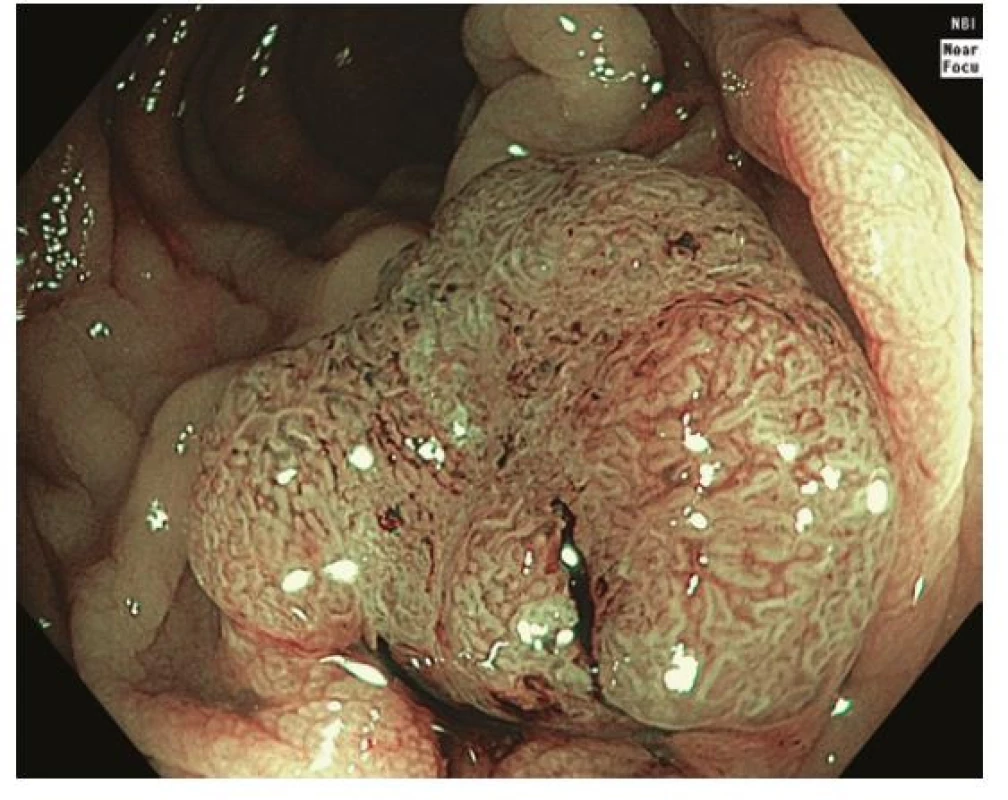
Image 4. Léze descendens 0-IIa + IIc v módu NBI odpovídající typu 3 dle NICE / JNET klasifikace, histologicky adenokarcinom s hlubokou submukózní invazí 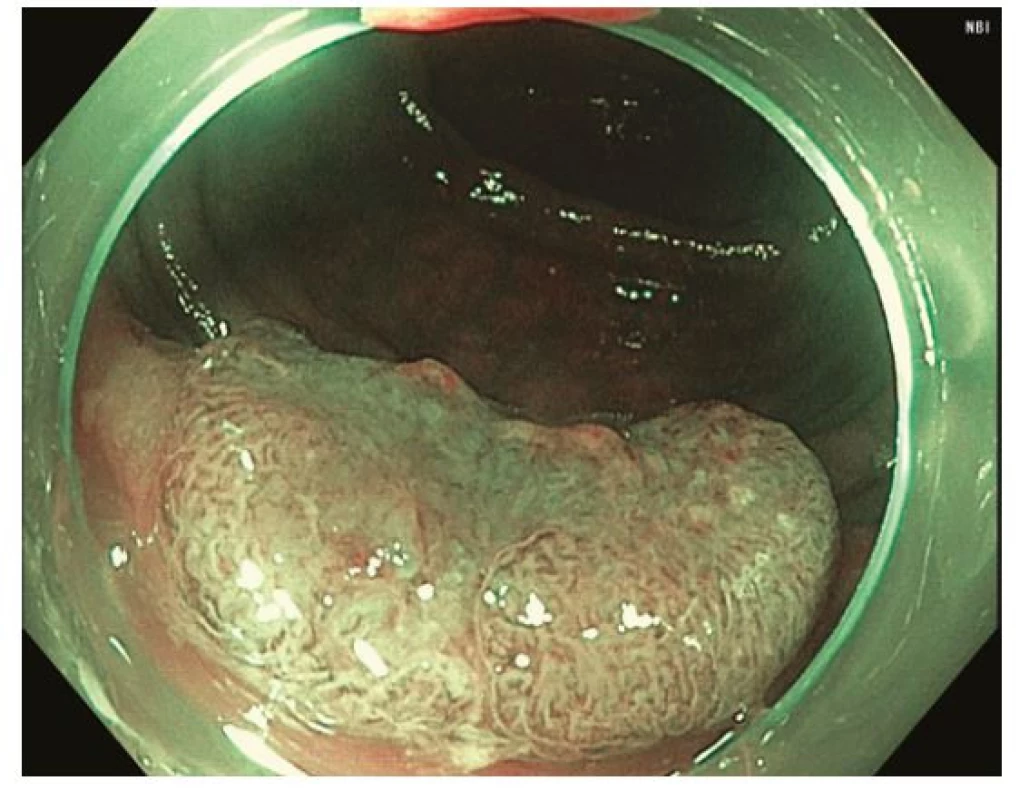
K posouzení hloubky invaze lze využít i různé formy endosonografie. Klasickou radiální endosonografii lze využít při stagingu lézí rekta, v orálních částech tračníku lze využít vysokofrekvenční sondy (12–30 MHz) zavedené pracovním kanálem koloskopu. Endosonografie je vhodná zejména k vyloučení hluboké submukózní invaze a invaze do muscularis propria, při odhadu povrchové invaze není příliš přesná (25).
Endoskopická léčba
Endoskopická léčba je v současné době metodou volby v léčbě časných neoplazií tračníku, její výhodou je mini‑invazivita se zachováním funkčního orgánu (zejména v případě rekta), prakticky nulová letalita, nízká morbidita a použitelnost i u interně rizikových nemocných. Základním předpokladem je lokalizovaná slizniční neoplazie s nízkým rizikem diseminace a reálnou možností kompletní resekce s nízkým rizikem komplikací. Cílem endoskopické léčby je kompletní resekce hodnocená endoskopicky, R0 resekce s negativními laterálními a vertikálními okraji a kurativní resekce, kterou definujeme jako kompletní nebo R0 resekci bez jiných rizikových známek (nízká diferenciace, lymfatická nebo vaskulární invaze a budding vyššího stupně). V současné době jsou využívány téměř výhradně resekční techniky poskytující resekát k histologickému vyšetření, které je stále finálním arbitrem kurativnosti resekce. Endoskopická ablace byla v tlustém střevě prakticky opuštěna s výjimkou argonové plazmakoagulace (APC) při ošetření drobných benigních reziduálních neoplazií.
Z již uvedeného vyplývá, že endoskopicky resekovatelné jsou adenomy s lehkou dysplazií až karcinomy s povrchovou submukózní invazí (sm1). V případě významného rizika přítomnosti invazivního karcinomu (0-Is, 0-IIc, LST‑GM, LST‑NGPD, PP Vi, NICE 2, JNET 2 B) je snahou lézi resekovat en bloc, kdy získáme optimální resekát k lokálnímu stagingu a současně dosáhneme nízké riziko lokální reziduální neoplazie. Nízkorizikové léze (0-IIa, LST‑GH, PP III/IV, NICE 1-2, JNET 2 A) lze v případě nutnosti resekovat po částech („piecemeal“). Léze s vysokým rizikem hluboké invaze (0-III, PP Vn, NICE/JNET 3) je nutné zvážit přímo k operačnímu řešení (8, 26).
V průběhu let vznikla řada základních technik endoskopické resekce jako endoskopická polypektomie, endoskopická slizniční resekce, endoskopická submukózní disekce a endoskopická transmurální resekce.
Endoskopická polypektomie (EPE) je základní a nejčastěji užívanou terapeutickou intervencí v digestivní endoskopii. EPE spočívá v naložení polypektomické kličky na stopku stopkatého polypu (0-Ip), která je tvořena zdravou sliznicí a submukózou a je následně přerušena kombinací mechanické síly při uzavření kličky a elektrokoagulačního proudu („hot snare“). Ke snížení rizika krvácení lze stopku před resekcí infiltrovat roztokem adrenalinu, nasadit na ní endoklipy nebo odnímatelnou smyčku (tzv. „endoloop“) (27) (Obr. 5–8). EPE je užívána i k resekci malých plochých nebo přisedlých lézí (0-IIa, 0-Is) ≤ 10 mm, a to obvykle pouze mechanicky bez použití elektrokoagulace („cold snare“) s následným nižším rizikem opožděného krvácení nebo koagulačního syndromu (28). V minulosti často užívaná „resekce“ diminutivních lézí bioptickými kleštěmi byla prakticky opuštěna pro riziko inkompletní resekce a nahrazena právě „cold snare“ polypektomií (8).
Image 5. Endoskopická polypektomie – objemný stopkatý polyp 0-Ip sigmoidea diagnostikovaný u pacienta s hematochezií 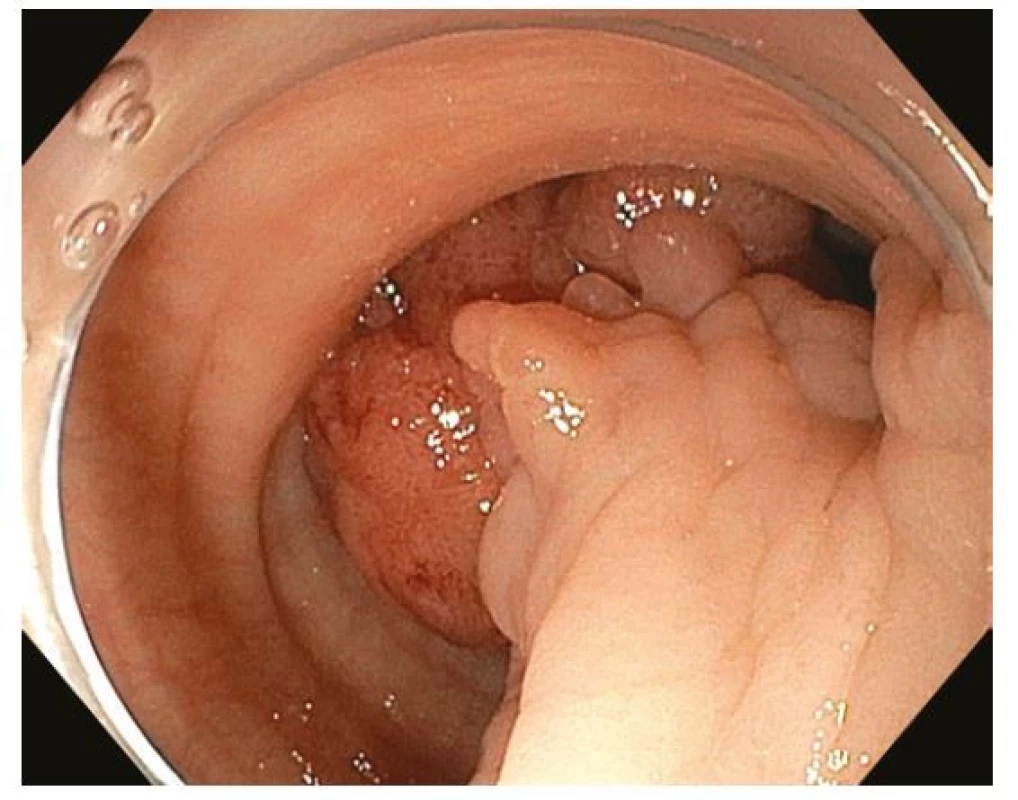
Image 6. Endoskopická polypektomie – nasazení odnímatelné smyčky (endoloop) na bázi stopky polypu 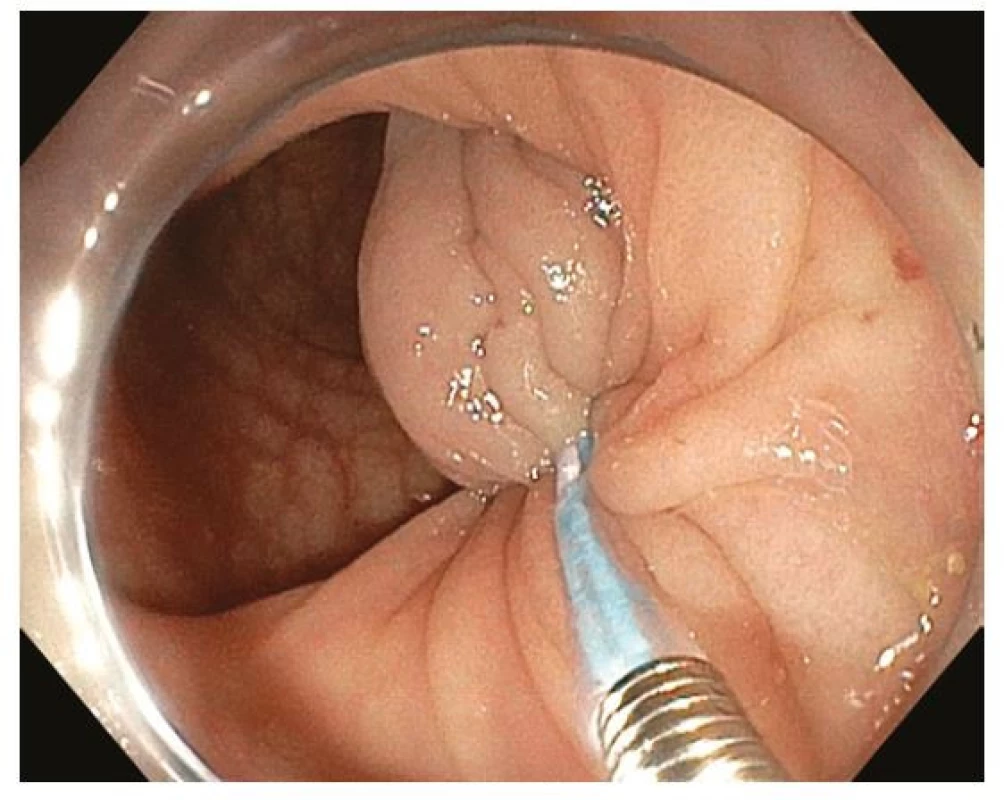
Image 7. Endoskopická polypektomie – přerušení stopky nad nasazenou smyčkou polypektomickou kličkou 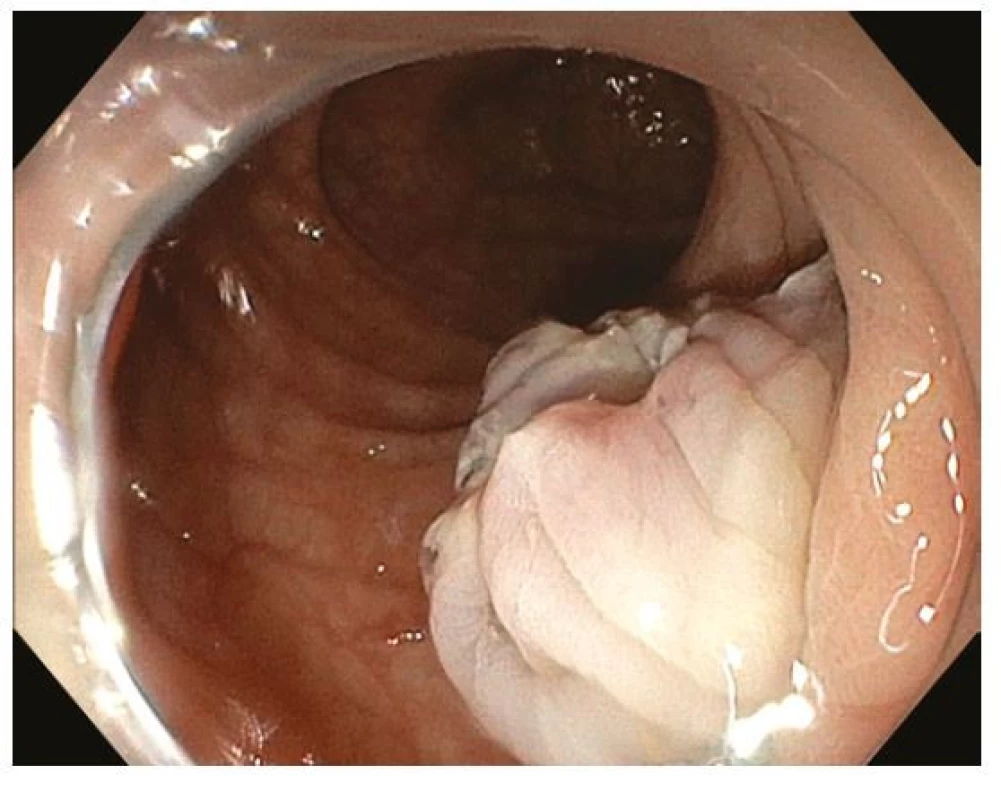
Image 8. Endoskopická polypektomie – vybavený resekát s patrnou zdravou sliznicí stopky polypu, histologicky R0 resekce intramukózního adenokarcinomu 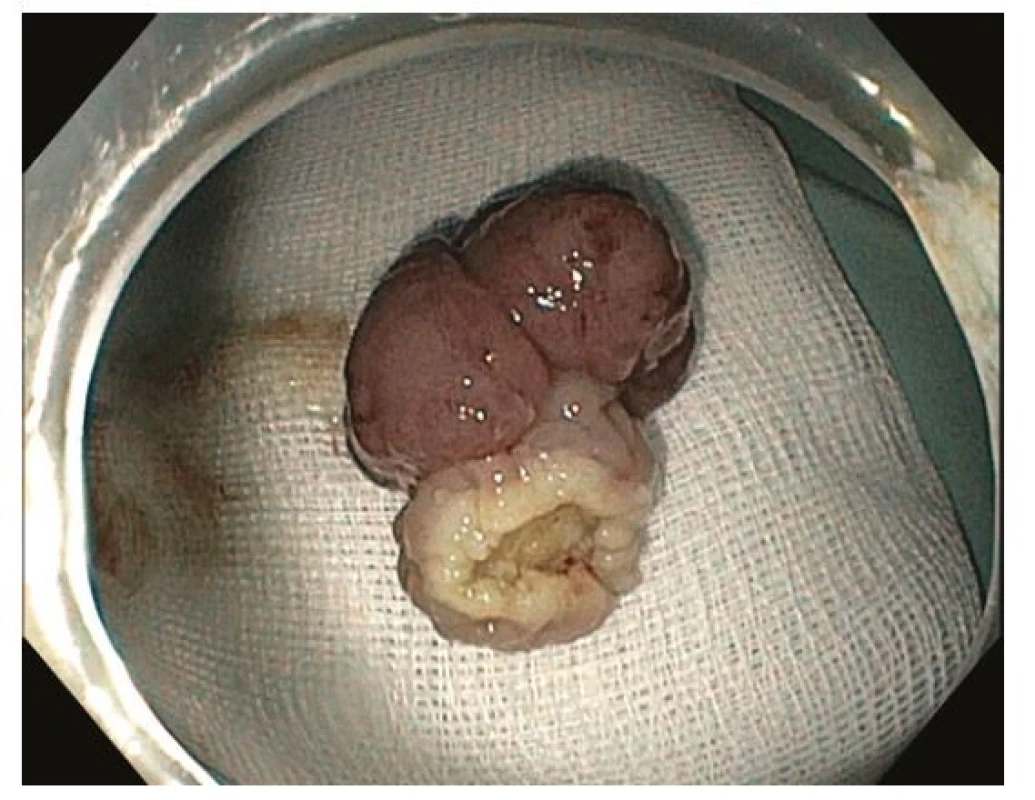
Endoskopická slizniční resekce (EMR, Endoscopic Mucosal Resection) je modifikací EPE pro léze > 10 mm, které nejsou vhodné ke klasické polypektomii. Podstatou EMR je různými způsoby vytvořit z nepolypoidní léze pseudopolyp, který lze uchopit a snést různým typem polypektomické nebo mukozektomické kličky (29). V tlustém střevě je prakticky výhradně užívána tzv. „lift and cut“ technika spočívající v submukózním podpichu různých roztoků s následným uchopením elevované léze pomocí kličky. Jako podpichový roztok lze použít fyziologický roztok, roztok glukózy a glycerolu, ředěného adrenalinu nebo gelatinózní substance. Do roztoku se často přidává modré barvivo (metylenová modř nebo indigokarmín) k lepší orientaci v submukóze. Při podpichu dojde k rozvolnění submukózy, které nazýváme jako příznak „liftingu“, v případě fixace (v důsledku fibrózy nebo hluboké nádorové invaze) k „liftingu“ nedochází a bezpečná resekce je obtížná až nemožná (30). Fibrotické změny mohou být i následkem předchozí manipulace s lézí jako klešťové biopsie nebo neúspěšného pokusu o resekci. Další modifikací EMR je použití průhledného nástavce se speciální kličkou (EMR‑C, „suck and cut“) a nebo vytvoření pseudopolypu pomocí ligátoru (EMR‑L, „ligate and cut“), v obou případech je ale použití v tračníku výjimečné. Perspektivní platformou je EMR po nařasení sliznice a submukózy po naplnění lumen tračníku vodou („underwater“). V klinické praxi je EMR používána k en bloc resekci lézí < 20–25 mm, které lze bezpečně uchopit do kličky, a k resekci plošných nízkorizikových lézí (LST‑GH) po částech („piecemeal“) (8). Spodinu po EMR lze profylakticky ošetřit za použití endoklipů, v případě rizikových lézí tak pravděpodobně snížíme riziko opožděného krvácení (lokalizace v pravé části tračníku, velikost > 20 mm, antitrombotická léčba) (31).
Endoskopická submukózní disekce (ESD) je technika endoskopické resekce spočívající v postupném submukózním podpichu obdobném jako při EMR, cirkulární incizi sliznice v okolí léze a postupné submukózní disekci, tedy oddělení léze od svalové vrstvy, pomocí různých typů tzv. ESD nožů (Obr. 9–11). K lepšímu přehledu v submukóze je na konec endoskopu nasazen průhledný nástavec různého tvaru (tzv. „cap“). Výhodou ESD je oproti EMR teoreticky neomezený horizontální rozsah en bloc resekce, je tedy preferovanou technikou u lézí s rizikem přítomnosti invazivního karcinomu, které nelze pro jejich velikost, morfologii nebo lokalizaci snést en bloc pomocí EMR (26, 32). Nevýhodou je vysoká technická obtížnost vyžadující extenzivní trénink a délka výkonu. ESD je dostupné jen ve specializovaných terciárních centrech. Technika ESD pochází z Japonska, kde je hlavní metodou léčby časného karcinomu žaludku, jehož incidence a detekce je v západním světě nízká. Obtížnost ESD je různá v různých částech tračníku, nejvýhodnější jsou léze lokalizované v rektu, ale ESD je čím dál častěji užíváno i v jiných částech tračníku. Ke zjednoduššení ESD byla vyvinuta řada modifikací jako „precut“ ESD s cirkulární incizí s následnou resekcí kličkou vloženou do incize nebo hybridní ESD (S‑ESD, „simplified“ ESD) s cirkulární incizí, parciální disekcí směrem k centru léze a následnou resekcí kličkou. Zajímavou technikou je tzv. „pocket creation“, kdy se pod lézí vytvoří z malé incize submukózní kapsa a cirkulární incize je dokončena až ve druhé době.
Image 9. Endoskopická submukózní disekce – přisedlý polyp s centrální depresí (0-Is + IIc) v rektu 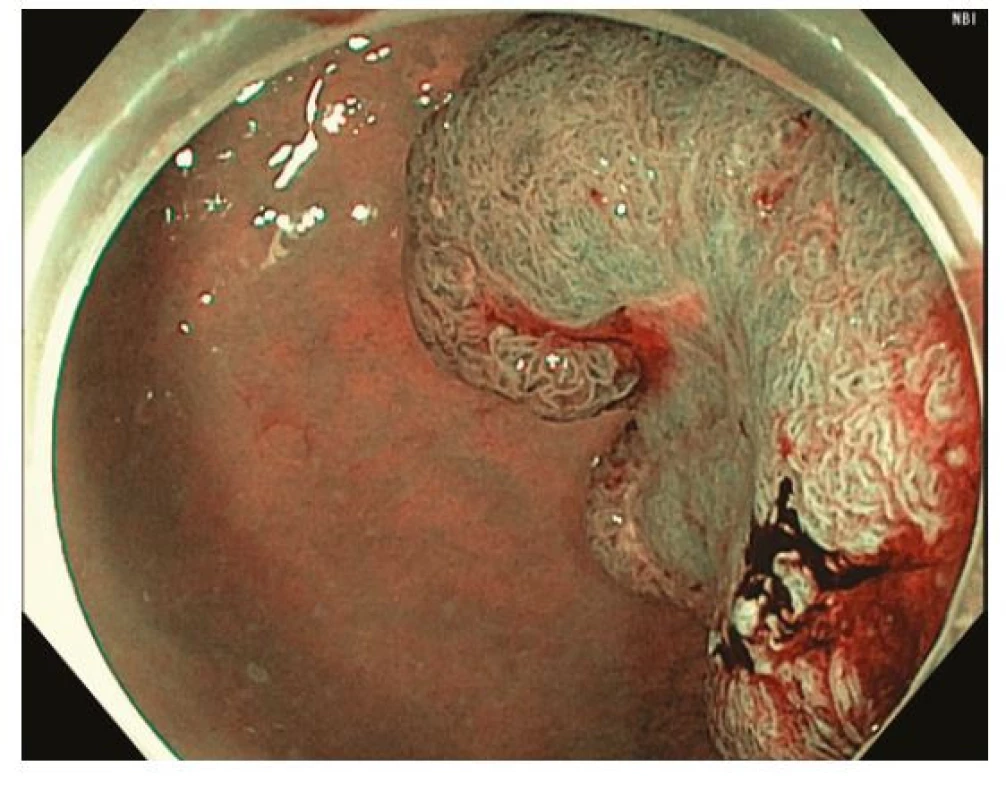
Image 10. Endoskopická submukózní disekce – spodina po disekci s patrnými endoklipy nasazenými pro intraprocedurální arteriální krvácení 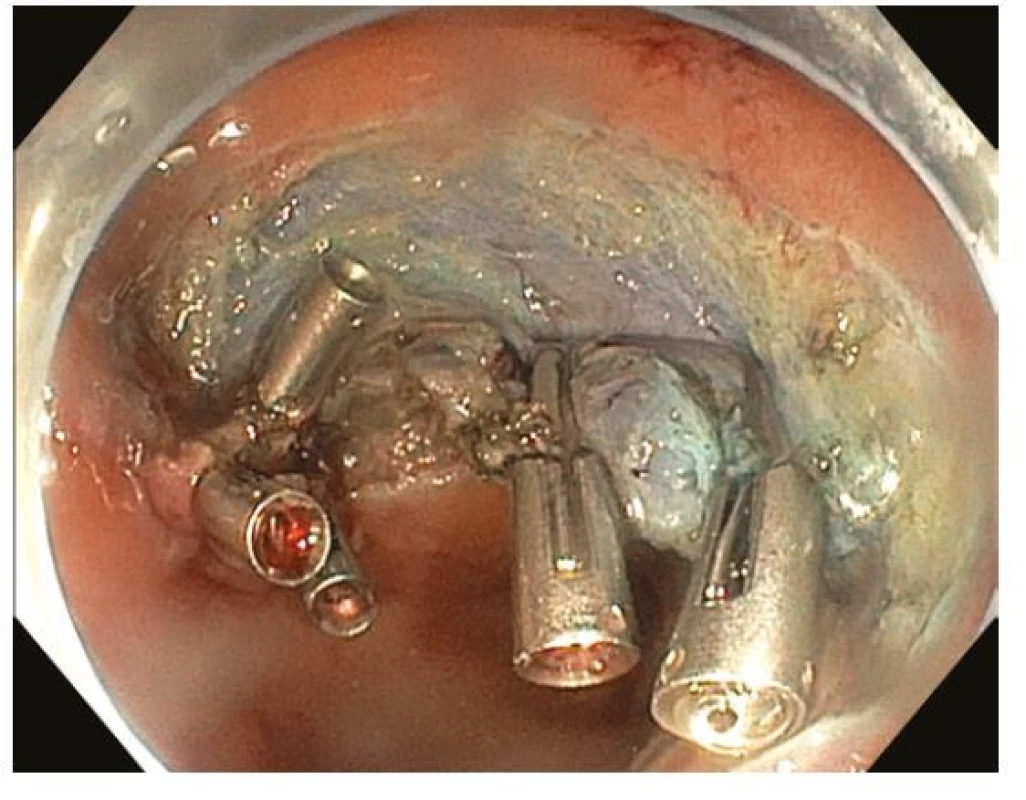
Image 11. Endoskopická submukózní disekce – vybavený resekát našpendlený na korkovou podložku, histologicky R0 resekce adenokarcinomu s povrchovou submukózní invazí 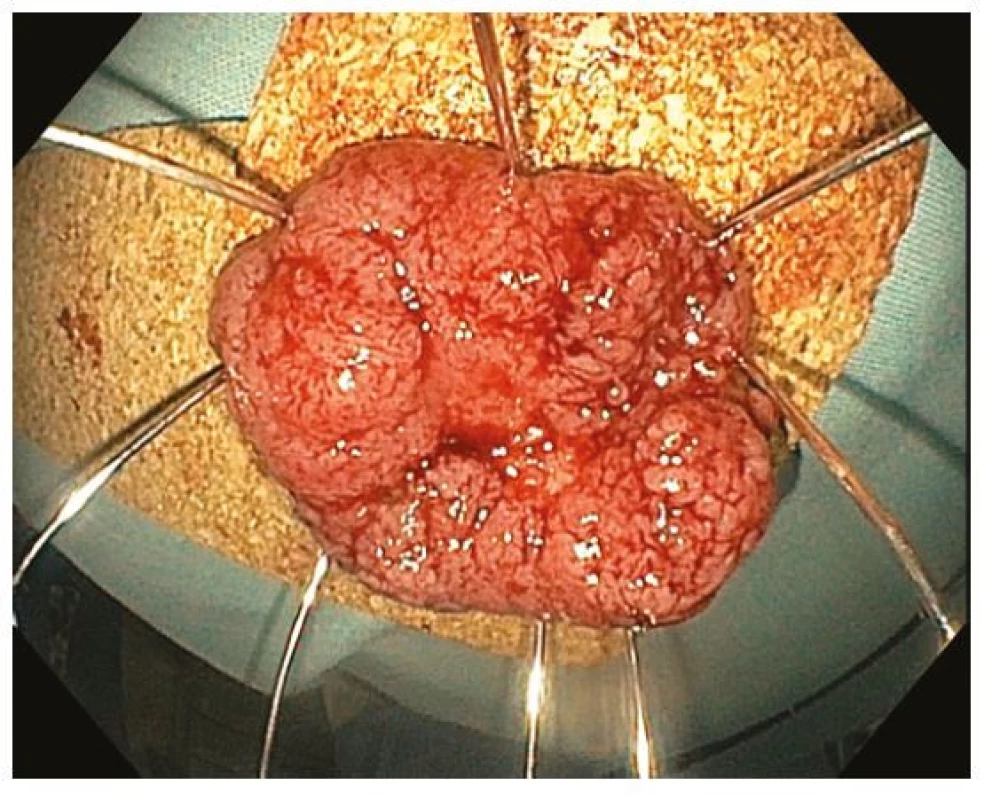
Poslední z technik endoskopické resekce je endoskopická transmurální resekce (FTR, Full‑Thickness Resection) umožňující různými principy vytnutí střevní stěny v celé její tloušťce bez vytvoření otevřené perforace. Nejvíce zkušeností je s tzv. FTRD (FTR Device), které spočívá ve vytvoření duplikatury střevní stěny vtažením do průhledného nástavce, nasazení OTS (Over‑The‑Scope) klipu a resekci speciální kličkou nad nasazeným klipem. Perforace střevní stěny je tak vlastně uzavřena ještě předtím než vznikne (33) (Obr. 12–13). Indikací k FTR jsou léze < 25(30) mm, které nejsou vhodné ke klasické EMR. Důvodem může být fixace léze bez možnosti liftingu, recidiva po předchozí endoskopické resekci nebo nepříznivá lokalizace (periapendikulární a peridivertikulární). FTRD se v západních zemích ukazuje jako výhodná, efektivní a bezpečná alternativa k ESD u lézí < 30 mm, za hlavní výhodu je považována menší technická obtížnost a významně kratší trvání výkonu (34).
Image 12. Endoskopická transmurální resekce – spodina po resekci léze z obrázku 3, patrné všechny vrstvy střevní stěny a nasazený kovový OTS klip 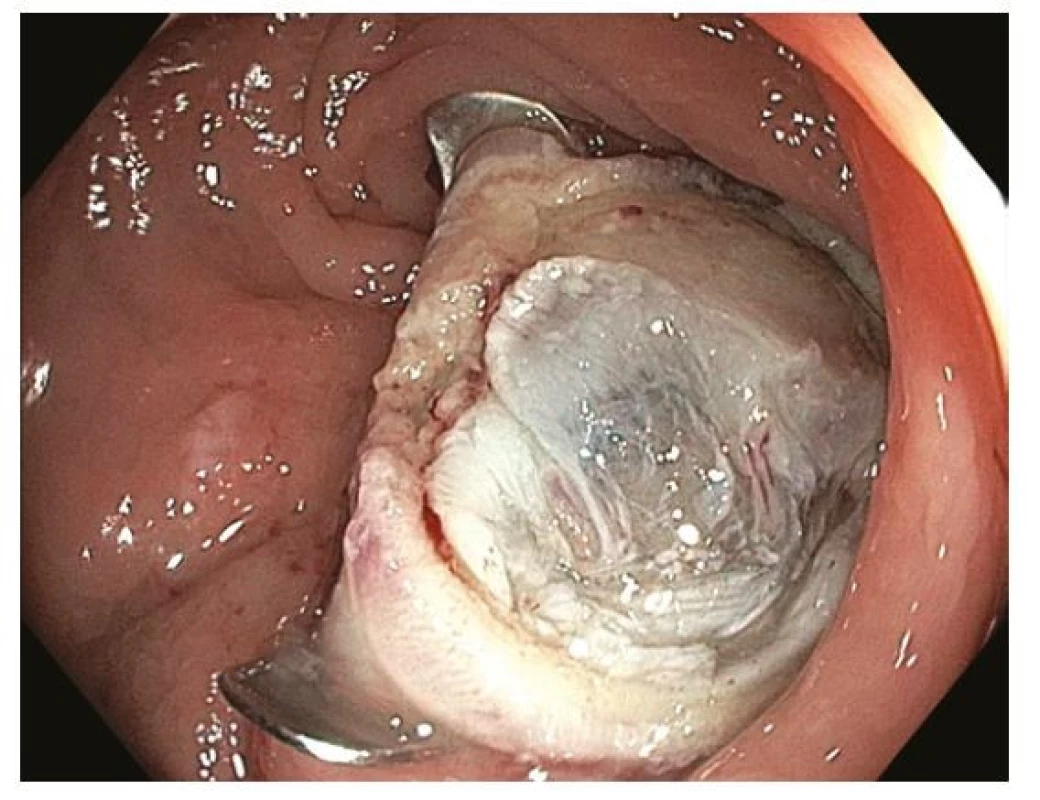
Image 13. Endoskopická transmurální resekce – vybavený resekát našpendlený na korkovou podložku, histologicky R0 resekce adenokarcinomu s povrchovou submukózní invazí 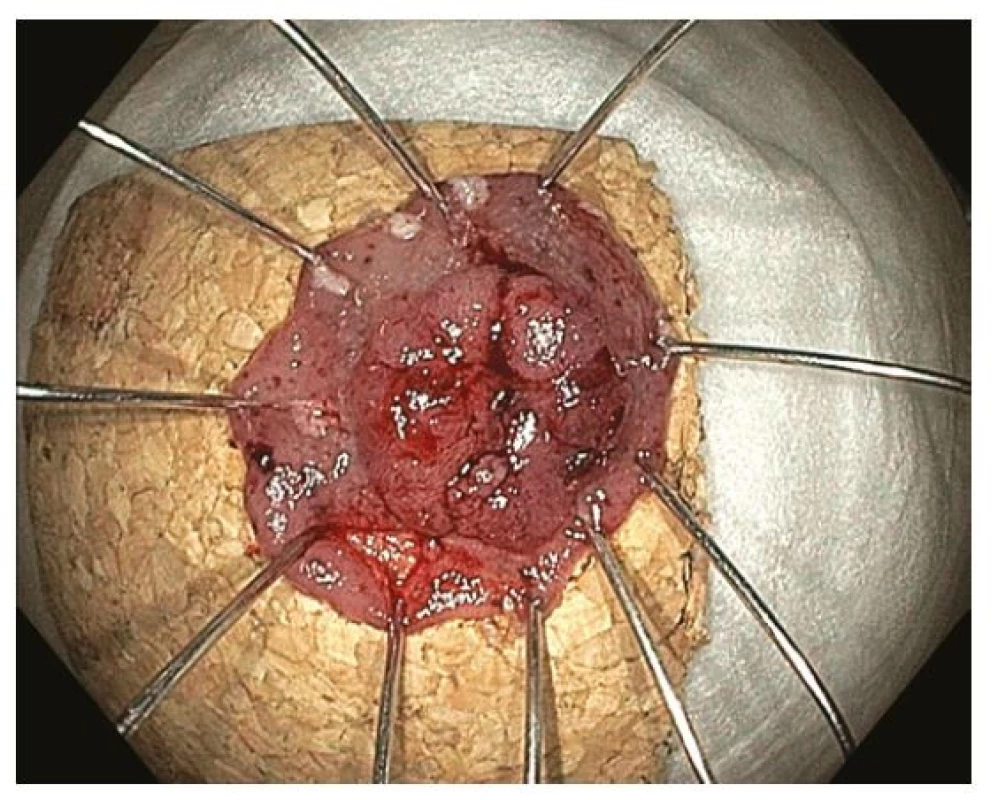
Endoskopická resekce je ve všech svých podobách provázena rizikem komplikací, jejichž výskyt lze do určité míry ovlivnit přípravou k výkonu, volbou správné techniky a sledováním po výkonu. Intraprocedurální krvácení není považováno za komplikaci v případě, že je během výkonu úspěšně vyřešeno. Opožděné krvácení je typickou komplikací vyskytující se v jednotkách procent a jeho výskyt koreluje s velikostí a lokalizací snesené léze, jeho výskyt lze ovlivnit například správným poměrem koagulačního a řezného proudu, resekcí za studena, ošetřením spodiny pomocí klipů nebo podvazem stopky před polypektomií. Opožděné krvácení se vyskytuje vzácně po FTRD vzhledem ke kompresi nasazeným OTS klipem. Nejobávanější lokální komplikací je perforace, která je obvykle identifikována během resekce a ve většině případů je vyřešena endoskopicky. Při komplikovaném průběhu ale může být nutná chirurgická revize. Další komplikací může být koagulační syndrom projevující se jako fokální peritoneální iritace beze známek otevřené perforace. Koagulační syndrom je řešen konzervativně a ve sporných případech je vhodné provedení nativního CT břicha k vyloučení přítomnosti extraluminálního plynu svědčícího pro opožděnou perforaci (35). Specifickou komplikací je akutní apendicitida, která může komplikovat téměř pětinu FTRD periapendikulárních lézí (36). Za komplikaci endoskopické resekce lze považovat i tzv. lokální reziduální neoplazie (LRN), jejichž další léčba je komplikována jizevnatou retrakcí a fixací (Obr. 14). Díky aktivní kontrole resekčních okrajů je výskyt LRN nejnižší (1 %) po ESD, naopak nejvyšší riziko vzniku LRN provází piecemeal EMR větších plochých lézí a může se blížit 20 % (37).
Image 14. Lokální reziduální neoplazie v jizvě po endoskopické slizniční resekci v ascendens 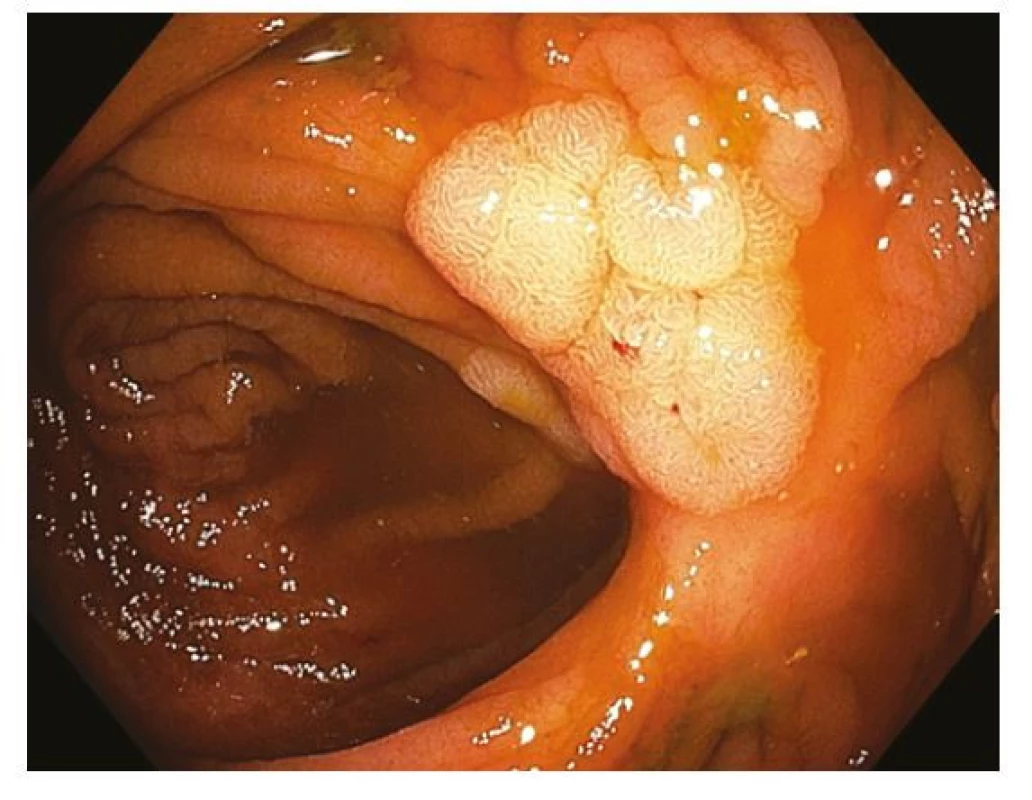
Po každé resekci je nezbytná extrakce co nejlépe zachovaného resekátu, jeho našpendlení spodní stranou na korkovou podložku (Obr. 11, 13) a fixace formalínem. Žádanka by měla obsahovat klíčové klinické informace a histopatologický popis by měl být strukturovaný a měl by obsahovat všechny klíčové informace, jako je hodnocení horizontálních a vertikálních okrajů (R0 resekce), diferenciace, lymfatické a vaskulární invaze a buddingu. V případě invaze do submukózy je vhodné změření její hloubky, což je možné pouze u kvalitního en bloc resekátu. Histopatologické vyšetření je stále finálním arbitrem úspěšnosti endoskopické resekce a v některých případech rizikové neoplazie je (i přes R0 resekci) třeba provést následnou resekci s příslušnou lymfadenektomií. Ve sporných případech je vhodná účast patologa v multidisciplinárním týmu a někdy je vyžadováno i druhé čtení resekátu na jiném pracovišti.
Dispenzarizace
Nemocné po endoskopické resekci kolorektální neoplázie je nutné sledovat pro riziko přítomnosti lokální reziduální neoplazie a metachronních lézí. V případě nálezu invazivního karcinomu je i přes předpokládanou kurativnost endoskopické resekce nutné o dalším postupu rozhodnout v rámci multioborového indikačního semináře a situaci prodiskutovat s nemocným. Vždy by mělo být provedeno CT nebo MR břicha a malé pánve k vyloučení známek generalizace. V hraničních případech je vždy nutné přihlédnout k internímu stavu nemocného a s ní související perioperační rizikovosti. Sledování je obdobné jako po chirurgické resekci KRK, za 3–6 měsíců k vyloučení lokální recidivy a poté za 1, 3 a 5 let (38). Po endoskopické resekci léze > 10 mm po částech je vzhledem k riziku vzniku lokální reziduální neoplazie doporučena kontrola za 3–6 měsíců. Další sledování se řídí individuální rizikovostí nemocného (počet, velikost a histologická pokročilost všech lézí, rodinná anamnéza) (39).
Závěr
Časné neoplazie tlustého střeva jsou detekovány koloskopicky a metodou volby v jejich léčbě jsou techniky endoskopické resekce, jako je endoskopická polypektomie, endoskopická slizniční resekce, endoskopická submukózní disekce a endoskopická transmurální resekce. Volba resekční metody je dána velikostí, lokalizací léze a rizikem přítomnosti invazivního karcinomu, které lze odhadnout na základě běžně užívaných morfologických klasifikací. Kurativnost resekce, případná nutnost dodatečné chirurgické resekce a sledování nemocného je voleno na základě histopatologického vyšetření resekátu.
Práce byla podpořena výzkumným grantem Agentury pro zdravotnický výzkum Ministerstva zdravotnictví České republiky NV18-08-00246.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Přemysl Falt, Ph.D.
II. interní klinika – gastroenterologická a geriatrická FN a LF UP Olomouc
I. P. Pavlova 185/6, 779 00 Olomouc
Cit. zkr: Vnitř Lék. 2022;68(6):355-362
Článek přijat redakcí: 20. 6. 2022
Článek přijat po recenzích: 15. 8. 2022
Sources
1. Epidemiologie kolorektálního karcinomu v České republice (http://www.kolorektum.cz/ index.php?pg=pro‑odborniky - epidemiologie‑kolorektalniho‑karcinomu - epidemiologie‑kolorektalniho‑karcinomu‑v‑cr)
2. Ústav zdravotnických informací a statistiky ČR: Národní onkologický registr (NOR) (11. 5. 2018) (http://www.uzis.cz/registry‑nzis/ nor)
3. Suchánek Š, Grega T, Zavoral M. Colorectal cancer screening. Vnitr Lek 2018, 64(6):679-683.
4. Tanaka T. Colorectal carcinogenesis: Review of human and experimental animal studies. J Carcinog. 2009; 8 : 5.
5. Suchánek Š, Vojtěchová G, Zavoral M. Dispenzární koloskopie. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
6. Vojtěchová G, Suchánek Š, Zavoral M. Preventivní koloskopie. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
7. Kliment M. Koloskopie u symptomatických pacientů. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
8. Ferlitsch M, Moss A, Hassan C, Bhandari P, Dumonceau JM, Paspatis G, Jover R, Langner C, Bronzwaer M, Nalankilli K et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2017;49(3):270-297.
9. Brenner H, Hoffmeister M, Stegmaier C, Brenner G, Altenhofen L, Haug U. Risk of progression of advanced adenomas to colorectal cancer by age and sex: estimates based on 840,149 screening colonoscopies. Gut. 2007;56(11):1585-1589.
10. Kikuchi R, Takano M, Takagi K, Fujimoto N, Nozaki R, Fujiyoshi T, Uchida Y. Management of early invasive colorectal cancer. Risk of recurrence and clinical guidelines. Dis Colon Rectum. 1995;38(12):1286-1295.
11. Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut 2002, 51(1):130-131.
12. Zauber AG, Winawer SJ, O‘Brien MJ, Lansdorp‑Vogelaar I, van Ballegooijen M, Hankey BF, Shi W, Bond JH, Schapiro M, Panish JF et al: Colonoscopic polypectomy and long‑term prevention of colorectal‑cancer deaths. N Engl J Med. 2012;366(8):687-696.
13. van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, van Deventer SJ, Dekker E. Polyp miss rate determined by tandem colonoscopy: a systematic review. Am J Gastroenterol. 2006;101(2):343-350.
14. Bressler B, Paszat LF, Chen Z, Rothwell DM, Vinden C, Rabeneck L. Rates of new or missed colorectal cancers after colonoscopy and their risk factors: a population‑based analysis. Gastroenterology. 2007;132(1):96-102.
15. Kaminski MF, Regula J, Kraszewska E, Polkowski M, Wojciechowska U, Didkowska J, Zwierko M, Rupinski M, Nowacki MP, Butruk E. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med. 2010;362(19):1795-1803.
16. Corley DA, Jensen CD, Marks AR, Zhao WK, Lee JK, Doubeni CA, Zauber AG, de Boer J, Fireman BH, Schottinger JE et al. Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med. 2014;370(14):1298-1306.
17. Vítek P, Urban O, Kopáčová M, Falt P. Alternativní zobrazení při koloskopii. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
18. Cadoni S, Falt P, Rondonotti E, Radaelli F, Fojtik P, Gallittu P, Liggi M, Amato A, Paggi S, Smajstrla V et al. Water exchange for screening colonoscopy increases adenoma detection rate: a multicenter, double‑blinded, randomized controlled trial. Endoscopy 2017, 49(5):456-467.
19. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc. 2003;58(6 Suppl):S3-43.
20. Kim BC, Chang HJ, Han KS, Sohn DK, Hong CW, Park JW, Park SC, Choi HS, Oh JH. Clinicopathological differences of laterally spreading tumors of the colorectum according to gross appearance. Endoscopy. 2011;43(2):100-107.
21. Yamada M, Saito Y, Sakamoto T, Nakajima T, Kushima R, Parra‑Blanco A, Matsuda T. Endoscopic predictors of deep submucosal invasion in colorectal laterally spreading tumors. Endoscopy. 2016;48(5):456-464.
22. Kashida H, Kudo SE. Early colorectal cancer: concept, diagnosis, and management. Int J Clin Oncol. 2006;11(1):1-8.
23. Hayashi N, Tanaka S, Hewett DG, Kaltenbach TR, Sano Y, Ponchon T, Saunders BP, Rex DK, Soetikno RM. Endoscopic prediction of deep submucosal invasive carcinoma: validation of the narrow‑band imaging international colorectal endoscopic (NICE) classification. Gastrointest Endosc. 2013;78(4):625-632.
24. Sano Y, Tanaka S, Kudo SE, Saito S, Matsuda T, Wada Y, Fujii T, Ikematsu H, Uraoka T, Kobayashi N et al. Narrow‑band imaging (NBI) magnifying endoscopic classification of colorectal tumors proposed by the Japan NBI Expert Team. Dig Endosc. 2016;28(5):526-533.
25. Urban O, Kliment M, Fojtik P, Falt P, Orhalmi J, Vitek P, Holeczy P. High‑frequency ultrasound probe sonography staging for colorectal neoplasia with superficial morphology: its utility and impact on patient management. Surg Endosc. 2011;25(10):3393-3399.
26. Pimentel‑Nunes P, Dinis‑Ribeiro M, Ponchon T, Repici A, Vieth M, De Ceglie A, Amato A, Berr F, Bhandari P, Bialek A et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2015;47(9):829-854.
27. Kliment M: Endoskopická polypektomie. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
28. Horiuchi A, Nakayama Y, Kajiyama M, Tanaka N, Sano K, Graham DY. Removal of small colorectal polyps in anticoagulated patients: a prospective randomized comparison of cold snare and conventional polypectomy. Gastrointest Endosc 2014;79(3):417-423.
29. Urban O, Vítek P. Endoskopická slizniční resekce. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
30. Uno Y, Munakata A. The non‑lifting sign of invasive colon cancer. Gastrointest Endosc 1994, 40(4):485-489.
31. Liaquat H, Rohn E, Rex DK. Prophylactic clip closure reduced the risk of delayed postpolypectomy hemorrhage: experience in 277 clipped large sessile or flat colorectal lesions and 247 control lesions. Gastrointest Endosc 2013;77(3):401-407.
32. Urban O. Endoskopická submukózní disekce. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
33. Schmidt A, Beyna T, Schumacher B, Meining A, Richter‑Schrag HJ, Messmann H, Neuhaus H, Albers D, Birk M, Thimme R et al: Colonoscopic full‑thickness resection using an over‑the‑scope device: a prospective multicentre study in various indications. Gut 2018;67(7):1280-1289.
34. Falt P, Zapletalova J, Urban O. Endoscopic full‑thickness resection versus endoscopic submucosal dissection in the treatment of colonic neoplastic lesions </= 30 mm‑a single‑center experience. Surg Endosc 2022;36(3):2062-2069.
35. Falt P. Komplikace koloskopie. In: Koloskopie. edn. Edited by Falt P, Urban O, Vítek P. Praha: Grada Publishing; 2015.
36. Ichkhanian Y, Barawi M, Seoud T, Thakkar S, Kothari TH, Halabi ME, Ullah A, Edris W, Aepli P, Kowalski T et al. Endoscopic full‑thickness resection of polyps involving the appendiceal orifice: a multicenter international experience. Endoscopy 2022;54(1):16-24.
37. Urban O, Pipek B, Kajzrlikova IM, Falt P, Fojtik P, Vitek P. The efficacy of treatment of local residual neoplasia under standardized conditions. Vnitr Lek 2016;62(5):365-369.
38. Kahi CJ, Boland CR, Dominitz JA, Giardiello FM, Johnson DA, Kaltenbach T, Lieberman D, Levin TR, Robertson DJ, Rex DK. Colonoscopy surveillance after colorectal cancer resection: recommendations of the US multi‑society task force on colorectal cancer. Gastrointest Endosc 2016;83(3):489-498 e410.
39. Hassan C, Antonelli G, Dumonceau JM, Regula J, Bretthauer M, Chaussade S, Dekker E, Ferlitsch M, Gimeno‑Garcia A, Jover R et a.: Post‑polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy 2020;52(8):687-700.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 6-
All articles in this issue
- Hlavní téma – Digestivní endoskopie
- Endoskopická léčba časného kolorektálního karcinomu
- Časný karcinom žaludku
- Komplexní přístup k pacientovi s arteriální hypertenzí a dyslipidemií
- Aká srdcová frekvencia je riziková v rôznych štádiách kardiovaskulárneho kontinua?
- SGLT-2 inhibice užitečným nástrojem v léčbě srdečního selhání se sníženou i zachovalou ejekční frakcí
- Chronická plicní onemocnění a spánek
- Spontánní koronární disekce, kazuistiky dvou případů u mužů
- Jaký je cílový krevní tlak pro pacienty po transplantaci ledviny?
- Opustil nás MUDr. Tomáš Klíma
- Současné trendy v diagnostice karcinomu pankreatu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Časný karcinom žaludku
- Endoskopická léčba časného kolorektálního karcinomu
- Komplexní přístup k pacientovi s arteriální hypertenzí a dyslipidemií
- Současné trendy v diagnostice karcinomu pankreatu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

