-
Medical journals
- Career
Kolorektální karcinom u pacientů s diabetes mellitus – epidemiologie, patofyziologie a implikace pro praxi
Authors: Alexandra Romanová 1; Jana Malinovská 1; Michala Lustigová 2,3; Jana Urbanová 4; Ludmila Brunerová 4; Veronika Vejtasová 5; Ankita Verma 1; Tung A. Duong 1; Jan Šťovíček 1; Jan Brož 1
Authors‘ workplace: Interní klinika 2. LF UK a FN v Motole, Praha 1; Státní zdravotní ústav, Praha 2; Přírodovědecká fakulta UK, Praha 3; Interní klinika 3. LF UK a FNKV, Praha 4; Kardiologická klinika 2. LF UK a FN v Motole, Praha 5
Published in: Vnitř Lék 2022; 68(2): 116-122
Category: Review Articles
Overview
Diabetes mellitus (zejména diabetes mellitus 2. typu) a kolorektální karcinom jsou v naší populaci relativně častými onemocněními. Tyto jednotky zároveň sdílejí některé společné rizikové faktory, jako je např. obezita, nedostatek fyzické aktivity a hyperinzulinemie. Dostupná data ukazují, že pacienti s diabetem mají zvýšené riziko výskytu kolorektálního adenomu a karcinomu, zvýšené riziko výskytu kolorektálního karcinomu v nižším věku, jakož i zvýšené riziko recidivy a zvýšenou mortalitu při karcinomu kolorekta. Článek předkládá aktuální pohled na vztah diabetu a kolorektálního karcinomu s důrazem na informace podstatné pro klinickou praxi, zejména na screening kolorektálního karcinomu a režimová doporučení pro pacienty s diabetem.
Klíčová slova:
léčba – chemoterapie – primární prevence – Trousseaův syndrom – paraneoplastická tromboembolická nemoc – nízkomolekulární hepariny – DOAC.
Úvod
Diabetes mellitus (DM) má v české populaci vysokou prevalenci – podle správy ÚZIS z roku 2018 jím trpí přibližně 1 000 000 osob – tedy přibližně 10 % populace, obdobná prevalence je pozorována celosvětově (1, 2). Podle výsledků řady studií je toto onemocnění spojeno se zvýšeným rizikem vzniku některých malignit, zejména se zvýšeným rizikem kolorektálního karcinomu (colorectal carcinoma – CRC), pankreatu, žlučníku, jater, endometria, ledviny, močového měchýře, žaludku a prsu u žen (3). DM je u nádorových onemocnění také asociovaný se zvýšeným rizikem úmrtí (4).
Záměrem tohoto článku je poukázat na dostupná data, týkající se incidence, mortality a základních patofyziologických principů vzniku CRC u pacientů s DM. Zároveň bychom chtěli zdůraznit důležitost prevence a screeningu CRC u těchto pacientů.
Diabetes mellitus (DM)
Nejčastější typ diabetu, diabetes mellitus 2. typu (DM2), je polygenně podmíněný a hyperglykemie je vyvolána zejména dvěma mechanismy – inzulinovou rezistencí a nedostatečnou produkcí inzulinu β‑buňkami. Inzulinová rezistence je většinou asociována s abdominální obezitou a může se rozvíjet roky. Současně dochází k postupnému poklesu množství β‑buněk, způsobenou zejména glukolipotoxicitou (toxickým účinkem volných mastných kyselin a hyperglykemie na β‑buňky) a prozánětlivými cytokiny. Tento proces následně může vést až k absolutnímu nedostatku inzulinu (5).
Diabetes mellitus 1. typu (DM1) je mnohem méně častý (přibližně 4–7 % případů) a nedostatek inzulinu vzniká na podkladě autoimunitní destrukce β‑buněk pankreatu T‑lymfocyty. Další typy DM (např. sekundární diabetes, MODY – Maturity Onset Diabetes of the Young) jsou ještě vzácnější (5, 6).
Většina dostupných prací hodnotí výskyt CRC u pacientů s DM bez rozlišení typu, pokud některé typ DM specifikují, jedná se nejčastěji o DM2. Studií, které sledují výskyt CRC výlučně u pacientů s DM1, je k dispozici velmi málo. Typ DM, ke kterému se daná informace vztahuje, je v tomto textu u konkrétních údajů vždy specifikován.
Kolorektální karcinom (CRC)
CRC je druhým nejčastějším nádorovým onemocněním v České republice u mužů i žen (1).
Vzniká na podkladě genetických změn (genu APC, BRAF, RAS atd.) a abnormální aktivace signálních drah v buňkách epitelu tlustého střeva (např. porucha degradace β‑kateninu) (7). Nejčastěji k těmto změnám dochází v epitelu střevních žlázek, proto většinou hovoříme o adenokarcinomu (8). Genetické změny a dysregulace signálních drah vedou ke zvýšené proliferaci epitelových buněk střevní sliznice, tvorbě kolorektálního adenomu (v angličtině colorectal adenoma – CRA) a následně invazivního CRC (9).
CRC se ve většině případů (cca 90 %) vyskytuje sporadicky, jsou však známy i jeho hereditární formy, které tvoří zbylých přibližně 10 % případů (8).
Mezi významné rizikové faktory sporadického CRC patří vyšší věk, mužské pohlaví, obezita, kouření, alkohol, častá konzumace červeného masa, vysoký příjem živočišných tuků a nedostatek pohybu. Pacienti s idiopatickými střevními záněty, po ozáření abdominopelvické oblasti a po transplantaci ledviny mají taktéž zvýšené riziko vzniku CRC (10). Významným rizikovým faktorem je také hyperinzulinemie a DM, kterému je věnován tento článek (10, 11).
Hereditární formy CRC jsou asociovány s tzv. hereditárními karcinomovými syndromy, které zahrnují střevní polypózy (zvýšený výskyt střevních polypů s rizikem maligního zvratu, např. familiární adenomatózní polypóza) a hereditární nepolypózní CRC známý jako Lynchův syndrom. U těchto pacientů je možné sledovat familiární výskyt nádorů tlustého střeva. Střevní polypózy jsou asociovány se signifikantně vyšším rizikem CRC, jeho výskytem v mladším věku, vícečetným výskytem nádorů a vyšším rizikem vzniku extraintestinálních nádorů (7).
Hereditární nepolypózní CRC, neboli Lynchův syndrom, je autozomálně dominantně dědičné onemocnění, u kterého se nevyskytuje polypóza a první manifestací je až maligní nádor. Kromě CRC mají tito pacienti také zvýšené riziko jiných malignit, (např. endometria, pankreatu, mozku apod.,) CRC se objevuje v mladším věku a výskyt nádoru je často vícečetný. (7) Poslední studie ukazují, že pro pacienty, kteří mají zároveň Lynchův syndrom a DM2, je riziko vzniku CRC ještě vyšší než u pacientů, kteří mají jen samotný Lynchův syndrom (12).
Pro úplnost je vhodné zmínit zajímavá data, týkající se epidemiologie CRC v USA, která nabídlo tamní letos vydané doporučení pro screening CRC (Screening for Colorectal Cancer: US Preventive Services Task Force Recommendation Statement): CRC je v USA třetí nejčastější příčinou smrti u mužů i žen. Je nejčastěji diagnostikován ve věkové skupině 65–74 let, ale odhaduje se, že 10,5 % CRC se objevuje ve věku pod 50 let. V r. 2016 nebyl u 26 % indikované populace screening proveden (13).
Epidemiologie kolorektálního adenomu (CRA) u pacientů s DM
V metaanalýze 17 studií s 28 999 účastníky, zahrnující pacienty s DM2, autoři uvádějí pro CRA RR = 1,52 (95 % CI: 1,29–1,80) a pro pokročilý CRA (pokročilý CRA je adenom s alespoň jednou z následujících charakteristik: a) velikost ≥ 10 mm, b) přítomnost vysokého stupně dysplazie (high‑grade dysplasia), c) vilozní architektura nebo histologie) RR = 1,41 (95 % CI: 1,06–1,87) (14). Pacienti s DM2 mají tedy podle výsledků této práce významně zvýšené riziko CRA. Podle zahrnutého typu studie byly statisticky významné výsledky u retrospektivních (RR: 1,57; 95 % CI: 1,30–1,89) a průřezových studií (RR: 1,46; 95 % CI: 1,21–1,89), ne však u prospektivních studií (RR: 1,27; 95 % CI: 0,77–2,10). Nebyl zaznamenán rozdíl v riziku CRA mezi muži a ženami (15).
Zvýšené riziko vzniku CRA u pacientů s DM (nedefinovaný podtyp) uvádí i jiná, níže zmíněná metaanalýza (RR: 1,26; 95% CI: 1,11–1,44) (16).
Epidemiologie CRC u pacientů s DM
Výsledky studií ukazují, že pacienti s DM mají zvýšené riziko vzniku CRC (3, 16). Riziko je podle těchto publikovaných dat zvýšeno u pacientů s DM1 i DM2.
CRC a DM1
Riziku CRC u diabetiků 1. typu se věnuje relativně málo prací.
Australská studie zahrnující 80 676 pacientů s DM1 pro populaci z let 1997–2008 uvádí pro tyto pacienty SIR (standardized incidence ratio, česky standardizovaný poměr incidencí) CRC vůči běžné australské populaci SIR = 1,21 (95% CI: 1,06–1,37). Specificky pro muže uvádí SIR = 1,09 (95% CI: 0,92 – 1,29) a pro ženy SIR 1,39 (95 % CI: 1,15 – 1,68) (17).
Další významnou studií, která se věnuje vzniku různých typů malignit u diabetiků 1. typu, je analýza jejich populací v několika zemích (Austrálie (2000–2008); Dánsko (1995–2012); Finsko (1972–2010); Skotsko (1995–2011) a Švédsko (1987–2012)). Tato práce ukazuje v porovnání s běžnou populací zvýšené riziko CRC u mužů – HR = 1,14 (95 % CI: 1,04–1,24), u žen nebyl výsledek statisticky významný (HR = 1,09; 95% CI: 0,99-1,21). (11)
Pacienty s DM1 analyzovala v letech 2000–2008 také retrospektivní studie z Taiwanu, která zahrnovala 14 619 těchto pacientů. Autoři uvádí zvýšené riziko karcinomu tlustého střeva u mužů (SIR = 1,50 (95% CI: 1,02–2,14)) i u žen (SIR = 1,95 (95% CI: 1,39–2,67)) a karcinomu rekta u mužů (SIR = 1,64 (95% CI: 1,08-2,38)). U žen nebylo vypočtené SIR pro karcinom rekta statisticky významné (SIR = 1,07 (95% CI: 0,60–1,77)) (18).
CRC a DM2
Vyšší riziko vzniku CRC u pacientů s DM2 potvrzuje již velké množství studií.
Nejrozsáhlejší publikovaná metaanalýza, která zahrnovala 29 prací, ukázala zvýšené riziko CRC u pacientů s DM – RR = 1,37 (95 % CI: 1,30–1,45). Publikace zároveň analyzovala jednotlivé práce podle toho, zda se týkaly nedefinovaného typu DM, nebo výlučně DM2. Relativní riziko CRC v pracích, zahrnujících výlučně pacienty s DM2, a v pracích, které nedefinovaly podtyp DM u respondentů, bylo přibližně stejné – RR = 1,34 (95% CI: 1,27–1,42) pro skupinu pacientů s DM2 a RR = 1,35 (95% CI: 1,24–1,47) pro skupinu pacientů s nedefinovaným podtypem DM. Riziko CRC u žen s DM oproti ženám bez DM bylo vyšší (RR = 1,46; 95% CI: 1,26–1,68). U mužů s DM bylo oproti mužům bez DM riziko také zvýšeno (RR = 1,21; 95% CI: 1,05–1,38), ale méně než při porovnání žen s DM a bez DM. Autoři práce jako možné částečné vysvětlení rozdílu v riziku CRC mezi muži a ženami s DM uvádí zvýšení objemu viscerálního tuku u žen po menopauze (objem viscerálního tuku je jedním z rizikových faktorů CRC a DM2) (16).
Studie též přinesla data o riziku vzniku CRC u diabetiků s ohledem na geografickou oblast: pro Evropu bylo riziko nejvyšší – RR = 1,41 (95% CI: 1,22–1,64), pro Severní Ameriku (RR = 1,34 (95% CI: 1,24–1,44) a pro Asii (RR = 1,34 (95% CI: 1,22–1,46)) bylo přibližně stejné (16).
Porovnatelně velká metaanalýza, zahrnující 25 prací a studující pacienty s nedefinovaným podtypem DM, však uvádí, že mezi rizikem CRC pro ženy s DM a pro muže s DM není prokazatelný rozdíl (p = 0,618). Ženy s DM však mají podle této metaanalýzy nižší riziko karcinomu colon než muži s DM (RRR: 0,93; 95% CI: 0,86–1,00; p = 0,050) (19).
Recentní metaanalýza 7 prospektivních studií, zahrnující populaci 667 916 pacientů s nedefinovaným podtypem DM ve vyšším věku (medián věku při vnstupu do studie 62,3 let) ukazuje, že riziko CRC u diabetiků je zvýšeno pro muže – HR = 1,17 (95% CI: 1,08–1,26). U žen je HR = 1,13 (95% CI: 0,82–1,56), jde tedy o pozitivní asociaci, výsledek ale nebyl statisticky významný (20).
Co se týče dřívějších prací – např. kohortová studie, zahrnující 87 523 žen a 47 240 mužů, týkající se pacientů s DM2, ukazuje, že zatímco u mužů s DM2 a rizikem CRC je významná asociace (HR = 1,42 (95 % CI: 1,12–1,81)), u žen s DM2 je asociace sice pozitivní, ale ne statisticky významná (HR = 1,17 (95% CI: 0,98–1,39)) (21).
Problematika rizika incidence CRC u žen – diabetiček a mužů – diabetiků je tedy složitá. Mnohé starší práce uvádí, že mezi ženami a muži s DM nejsou v riziku CRC významné rozdíly (22, 23), některé další pak uvádí, že ženy s DM mají riziko vzniku CRC vyšší než muži (24) a některé výše zmíněné naopak, že u žen je riziko nižší (20, 21).
DM a lokalizace CRC
V lokalizaci diagnostikovaného CRC u pacientů s DM2 existují také rozdíly. CRC můžeme podle lokalizace obecně charakterizovat jako proximální a distální (resp. pravostranný a levostranný), přičemž hranicí mezi proximální (pravou) a distální (levou) oblastí tlustého střeva je flexura splenica. Tématu se věnovala kohortová studie zahrnující více než 265 000 účastníků. Při porovnání s kontrolní skupinou bez DM měli muži s DM2 vyšší riziko rozvoje distálního CRC (HR = 1,42; 95% CI: 1,08–1,88), zatímco ženy s DM2 nikoliv (HR = 0,86; 95% CI: 0,55–1,35). Při porovnání s kontrolní skupinou bez DM měli ženy s DM2 vyšší riziko vzniku proximálního CRC (HR = 1,58; 95% CI: 1,13–2,19), zatímco u mužů s DM2 nebylo zvýšení rizika statisticky významné (HR = 1,20; 95% CI: 0,87–1,65). Ženy i muži s DM2 měli oproti skupinám bez DM podle této práce také zvýšené riziko karcinomu rekta, výsledek však nebyl ani v jedném případě statisticky významný (pro muže HR = 1,06; 95% CI: 0,77–1,47 a pro ženy HR = 1,33; 95% CI: 0,88–2,02) (25).
CRC, DM a věk
Kohortová studie švédské populace, zahrnující data z let 1958–2015 od 12 614 256 účastníků, ukazuje, že časnější věk diagnózy DM je asociován s vyšším rizikem vzniku CRC v mladším věku. Pacienti, kterým byl diagnostikovaný DM před 50. rokem života (nespecifikovaný typ DM), měli téměř dvojnásobně vyšší riziko vzniku CRC před 50. rokem života (SIR = 1,9; 95% CI: 1,6–2,3) a o 30 % vyšší riziko vzniku CRC v/po 50. roce života (SIR = 1,3 (95% CI: 1,2–1,4)). Pacienti, kterým byl diagnostikován DM před 50. rokem života a měli zároveň v rodinné anamnéze výskyt CRC, měli pro vznik CRC před 50. rokem života SIR = 6,9 (95% CI: 4,1–12) a SIR = 1,9 (95% CI: 1,4–2,5) pro vznik CRC v/po 50. roce života. Pacienti s DM měli zároveň podobné kumulativní riziko vzniku CRC před 50. rokem života (CR = 0,4 %; 95% CI: 0,3–0,4 %) jako pacienti, kteří měli jenom výskyt CRC v rodinné anamnéze (CR = 0,5 %; 95% CI: 0,5–0,5 %), tedy dvojnásobné oproti běžné populaci (0,2 %; 95% CI: 0,2–0,2 %) (26).
Tato studie dále blíže analyzovala období let 1997–2015, u kterého byly dostupné údaje o typu DM účastníků. Pro pacienty s DM2 bylo pro vznik CRC před 50. rokem života SIR = 3,5 (95% CI: 2,3–5,1) a pro pacienty s DM2 a zároveň výskytem CRC v rodinné anamnéze bylo pro časný vznik CRC SIR = 18 (95% CI: 5,9–42). Pro pacienty s DM1 nebylo zjištěno zvýšené riziko pro vznik CRC před 50. rokem života; nicméně pacienti s DM1 a výskytem CRC v rodinné anamnéze měli pro časný vznik CRC SIR = 8,6 (95% CI: 2,3–21) (26).
Recentní kohortová studie ze švédské populace (12 614 256 osob, období 1964–2015), ukázala, že pacienti s DM (bez specifikovaného podtypu), dosáhli stejnou úroveň rizika CRC jako 50leté osoby v populaci (což je celosvětově nejčastější věk zahájení populačního screeningu CRC) o 5 let dříve (muži), resp. o 4 roky dříve (ženy). Pacienti s DM, kteří měli zároveň výskyt CRC v rodinné anamnéze, dosáhli stejného rizika jako 50letí členové běžné populace o 18 let dříve (muži), resp. o 12 let dříve (ženy) (27).
Retrospektivní studie dat z let 1998–2010 u 41 716 pacientů s DM a 325 054 nediabetiků ukázala vyšší riziko CRC pro diabetiky bez rozdílu v pohlaví (HR = 1,3; 95% CI: 1,2–1,5), které bylo dále vyšší u osob do 6 měsíců po diagnóze DM. Riziko CRC bylo také vyšší u mužů mladších 55 let (HR = 2,0; 95% CI: 1,0–3,8) (28).
Recidiva CRC a DM
Pacienti s DM léčeni na CRC mají zároveň vyšší riziko recidivy. Metaanalýza 82 studií (5 267 980 účastníků), zahrnující pacienty s DM1 i DM2, uvádí u pacientů s DM pro recidivu CRC HR = 1,09 (95% CI: 1,02–1,16) (29).
DM, CRC a výskyt duplicitní malignity
Retrospektivní studie českých autorů, zahrnující 1 174 pacientů s mediánem follow‑upu 10,1 roku a mediánem věku 63 let, porovnávala incidenci duplicitní malignity u pacientů s CRC bez DM a u pacientů s CRC a DM (nespecifikovaný podtyp). Duplicitní malignita znamená, že další nádor vzniká na jiném místě, resp. patří do jiné histologické nebo morfologické skupiny. Výsledky této studie ukazují, že pacienti s CRC a DM měli vyšší incidenci duplicitní malignity než pacienti s CRC bez DM. Nejčastějšími sekundárními malignitami byli další CRC, malignity ledviny, plic, močového měchýře a nemelanomové kožní nádory, ale jenom výsledky pro karcinom jater a intrahepatálních žlučovodů byly statisticky významné (pro karcinomy jater a intrahepatálních žlučovodů incidence 4,6 % u pacientů s DM vs. 0,5 % u pacientů bez DM). Další duplicitní malignity, kterých incidence byla zvýšena u pacientů s DM a CRC, byli non‑Hodgkinské lymfomy a leukemie. Zvýšená incidence těchto nádorů však ani v tomto případě nebyla statisticky významná (30).
Mortalita CRC a DM
Výše zmíněná metaanalýza, zpracovávající 82 observačních studií (5 267 980 účastníků), zahrnovala pacienty s jakýmkoliv typem DM (DM2 nebo DM1). Mezi pacienty s diagnózou CRC měli pacienti s DM o 21 % vyšší riziko úmrtí (HR = 1,21; 95% CI: 1,17–1,25). Zvýšená mortalita CRC u pacientů s DM může být však také podle autorů asociována i s jinými komplikacemi DM, např. s vyšším výskytem přidružených kardiovaskulárních komplikací, pooperačních komplikací, vyšší celkovou mortalitou spojenou s DM, prognosticky horšími pravostrannými nádory kolorekta (nádory lokalizované proximálně od flexura splenica), méně častou indikací k adjuvantní terapii a horší compliance pacientů (29).
Jiná metaanalýza, zahrnující 42 studií (více než 240 000 pacientů), uvádí u pacientů s DM a CRC zvýšenou mortalitu z jakékoliv příčiny, tedy nejen na samotný CRC (ACM, all cause mortality), o 21 % (OR = 1,21; 95% CI: 1,15–1,28). Autoři tento parametr (ACM) definují jako čas od diagnózy CRC po smrt z jakékoliv příčiny. Práce uvádí u pacientů s DM a CRC také zkrácené přežívání bez CRC (disease free survival, DFS) o 75 % (OR = 1,75; 95% CI: 1,33–2,31). Tento parametr je v práci definován jako čas od začátku terapie CRC po relaps nádoru, vznik nového primárního CRC nebo smrt z jakékoliv příčiny (31).
Nebyl však zaznamenán rozdíl mezi pacienty s DM a CRC a bez DM a CRC specificky v přežívání s CRC (CSS, cancer specific survival) – OR = 1,10; 95% CI: 0,98–1,23 – které bylo definováno jako čas od diagnózy CRC po smrt na CRC. Rozdíl u těchto dvou skupin nebyl také zaznamenán v délce období od začátku terapie, po kterém došlo k relapsu CRC nebo vzniku nového primárního CRC (relapse free survival, RFS) – OR 1,12, 95% CI 0,91–1,38. Tato studie na základě výše uvedených dat konstatuje, že pravděpodobnou příčinou zvýšené mortality pacientů s DM a CRC je zvýšená povšechná mortalita pacientů s DM. Metaanalýza také ukázala, že u pacientů s DM a CRC je oproti pacientům bez DM méně využívaná adjuvantní a neoadjuvantní terapie (31). Přehled rizik v souvislosti s CRC u pacientů s DM ve vybraných studiích uvádí tabulka 1.
Table 1. Přehled rizik v souvislosti s CRC u pacientů s DM ve vybraných studiích 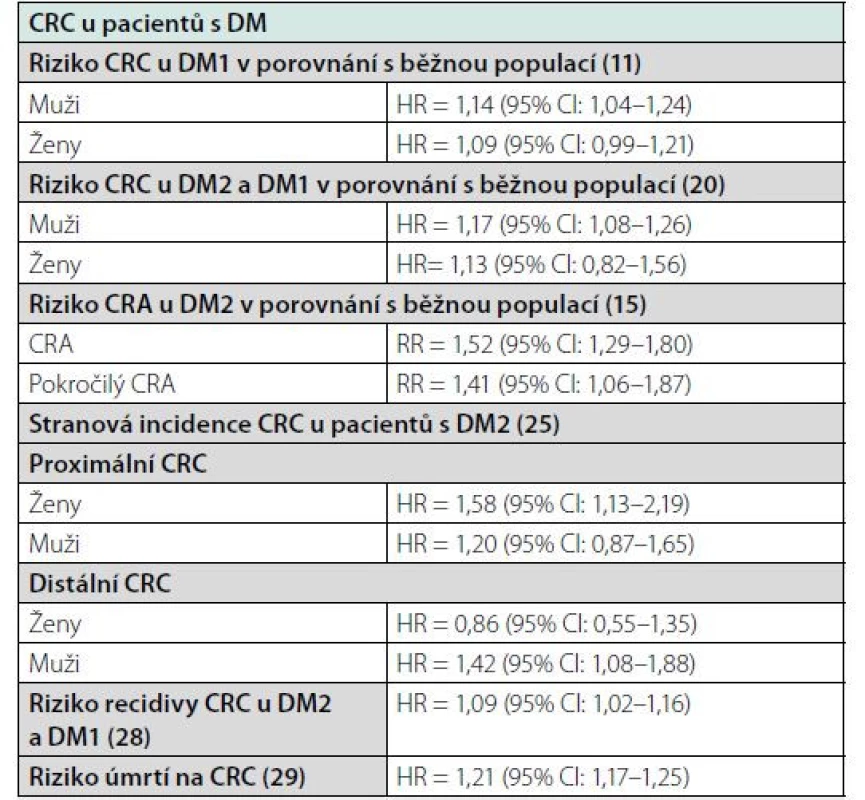
CRC – kolorektální karcinom; DM – diabetes mellitus; DM1 – diabetes mellitus 1. typu; DM2 – diabetes mellitus 2. typu; CRA – kolorektální adenom Patofyziologický podklad vztahu DM a CRC
Patofyziologický podklad zvýšeného výskytu CRC u pacientů s DM není zatím zcela objasněn. Podle dosavadních studií ke vzniku CRC u diabetiků pravděpodobně přispívá několik mechanismů. Schematicky je znázorňuje Obr. 1.
Image 1. Faktory podílející se na vzniku CRC u DM. Zeleně jsou zvýrazněné nejdůležitější rizikové faktory. Upraveno podle (45) 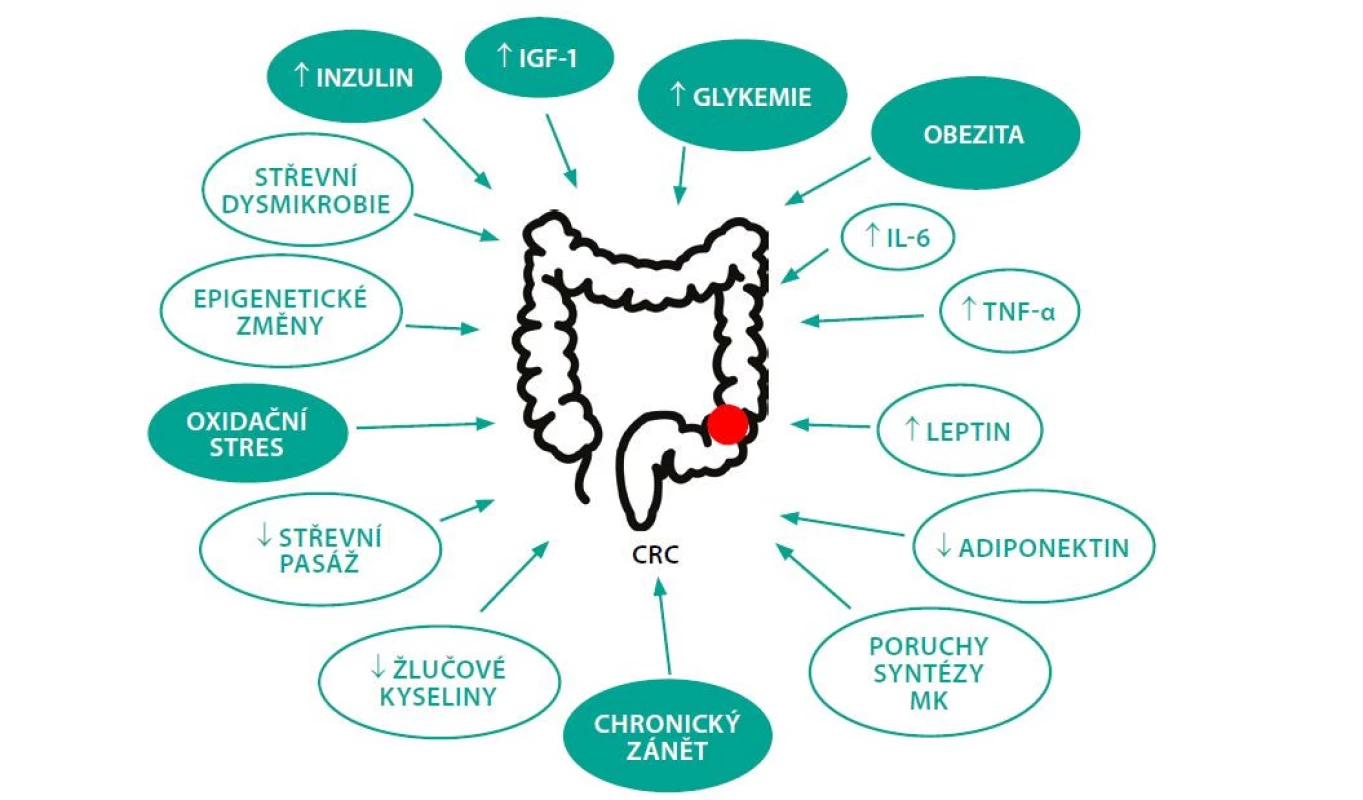
Hyperinzulinemie
Hlavními faktory jsou zřejmě hyperinzulinemie a vysoká hladina IGF-1 (insulin‑like growth factor-1) (32). Ty mají za následek zvýšenou proliferaci buněk sliznice tlustého střeva, což by mohlo vysvětlovat častější výskyt jak CRC, tak i CRA u pacientů s DM (33, 16).
Chronická hyperglykemie
Významným rizikovým faktorem je také chronická hyperglykemie. Vysoké hladiny glukózy v krvi indukují vznik volných radikálů, poškození DNA a buněčnou proliferaci (34). Vyšší hladina glukózy v krvi poskytuje nádorovým buňkám, které získávají energii pomocí anaerobní glykolýzy (Warburgův efekt), dobré podmínky na prožití a proliferaci (35). Každé zvýšení hodnoty náhodně naměřené glykemie o 1 mmol/l bylo podle některých studií asociováno se 4% nárůstem rizika vzniku CRC (34, 36). Včasný záchyt hyperglykemie může mít teda význam nejen pro prevenci a léčbu DM, ale také pro prevenci CRC (34).
Důležité je také zmínit hladinu glykovaného hemoglobinu (HbA1c). Metaanalýza, zahrnující 820 317 účastníků, uvádí, že hladina HbA1c je asociovaná se zvýšeným rizikem CRC (RR = 1,22; 95% CI: 1,02–1,47) (37).
Přehledový článek, zahrnující 8 prací, konstatuje, že zvýšená hladina HbA1c je asociována s vyšším rizikem CRC. Nevylučuje však ani reverzní asociaci a uvádí, že zvýšená hladina HbA1c u pacientů s CRC může být také způsobena sideropenickou anémií, která je u CRC častá, a také samotnou malignitou (38). Studie případů a kontrol, zahrnující 203 diabetiků, porovnávala hladiny HbA1c u diabetiků s jakoukoliv malignitou a u diabetiků, kteří žádnou malignitu neměli. Bylo pozorováno významně zvýšené riziko malignity u diabetiků s hladinou Hba1c ≥ 8,5 % (OR = 1,802; 95% CI: 1,030–3,153) (39).
Obezita
Obezita, která je často přítomna u pacientů s DM2 a její výskyt stoupá i u pacientů s DM1, může také přispívat ke zvýšení rizika CRC, máme‑li na zřeteli fakt, že obezita je samostatným rizikovým faktorem pro vznik mnohých nádorů, včetně CRC (8, 11, 40). Obezita souvisí s dalšími patofyziologickými mechanismy zvýšení rizika CRC. Tuková tkáň produkuje prozánětlivé cytokiny (např. IL-6, TNF‑α, CCL2, PAI-1) a adipokiny. Dochází také ke zvýšení hladin inzulinu, IGF a leptinu a ke snížení hladiny adiponektinu. Obezita indukuje střevní dysmikrobii – dochází k posílení patogenních kmenů a zvýšení hladiny jejich metabolitů (lipopolysacharid), přičemž populace protektivních bakterií (Akkermansia) a jejich metabolitů (mastné kyseliny s krátkým řetězcem) klesá. Při obezitě se zvyšuje také hladina některých žlučových kyselin, což je rizikovým faktorem pro vznik CRC. V nádorovém mikroprostředí jsou adipocyty zdrojem energie pro růst CRC (41).
Cytokiny tukové tkáně
Viscerální obezita i hyperinzulinemie můžou zvyšovat produkci prozánětlivých cytokinů. Ty napomáhají proliferaci, růstu a přežívání nádorových buněk a usnadňují tvorbu metastáz. S nádorovou proliferací jsou asociovány zejména dva prozánětlivé cytokiny tukové tkáně, indukující inzulinovou rezistenci: interleukin-6 (IL-6) a tumor necrosis factor alpha TNFα (35).
Druhou skupinou cytokinů, produkovaných tukovou tkání, jsou inzulin‑senzitizující cytokiny, zejména leptin a adiponektin. Leptin je kromě jiného asociován se zvýšenou buněčnou proliferací, inhibicí apoptózy a angiogenezí. Adiponektin naopak inhibuje buněčný růst a indukuje apoptózu. Někteří autoři uvádějí zvýšené riziko CRC asociováno s vysokou sérovou hladinou leptinu, resp. nízkou hladinou adiponektinu (42, 43). Recentní metaanalýza však asociace sérové hladiny leptinu a adiponektinu s rizikem CRC neprokázala (44).
Další možné vlivy
Porucha regulace syntézy mastných kyselin, oxidační stres, chronický zánět, epigenetické změny a střevní dysmikrobie se také mohou podílet na vzniku CRC u diabetiků (34, 40). Vliv může mít také pomalejší střevní pasáž, která prodlužuje kontakt obsahu trávicí trubice se střevní sliznicí, a vysoká koncentrace žlučových kyselin ve stolici, která byla u diabetiků zaznamenána (40).
Terapie DM a CRC – dostupná data
Metformin
Patofyziologické principy vzniku CRC u diabetiků se také odrážejí v údajích o terapii a mortalitě. Inzulinový senzitizátor metformin podle dosavadních studií snižuje riziko recidivy a úmrtí na CRC a má pravděpodobně i protektivní efekt (29, 46). Metaanalýza, zahrnující 1 733 229 účastníků, obsahovala 58 prací (randomizované kontrolní studie, kohortové studie a studie případů a kontrol), které porovnávaly uživatele metforminu s těmi, kteří jej neužívali, uživatele metforminu s lidmi bez DM a uživatele metforminu s diabetiky, kteří měli DM kompenzován jenom dietou. U pacientů, kteří užívali metformin, bylo významně sníženo riziko CRA (RR = 0,77; CI: 0,67–0,88), pokročilého CRA (RR = 0,61; CI: 0,42–0,88) a CRC (RR = 0,76; CI: 0,69–0,84) než u pacientů, kteří metformin neužívali. Pacienti s CRC užívající metformin měli vyšší přežívání (HR = 0,66; CI: 0,59–0,74), než ti, kteří metformin neužívali. Vyšší přežívání platí i pro metastatický CRC (HR = 0,77; CI: 0,68–0,87) (47).
Účinky metforminu na nádorové buňky jsou mnohaúrovňové. Metformin způsobuje těmto buňkám oxidační stres, čímž indukuje jejich apoptózu, ovlivňuje jejich proliferaci a má na ně také přímé destrukční účinky (47).
Podle retrospektivní studie českých autorů však metformin nemá efekt na incidenci duplicitní malignity u pacientů s DM a CRC (30).
Inzulin
Metaanalýza, zahrnující 12 studií (kohortové studie a studie případů a kontrol) a 491 384 účastníků, uvádí zvýšené riziko pro vznik CRC u pacientů s DM2 užívajících inzulin (RR = 1,69; 95% CI: 1,25–2,27). Při analýze podle typu studií bylo riziko zvýšeno u studií případů a kontrol (RR = 2,15; 95% CI: 1,41–3,26), u kohortových studií nebylo vypočtené riziko statisticky významné (RR = 1,25; 95% CI: 0,95–1,65) (48).
V již zmíněné metaanalýze, která zahrnovala převážně diabetiky 2. typu, ale i 1. typu (5 267 980 účastníků, 82 studií), měli pacienti s inzulinovou terapií a CRC zaznamenáno vyšší riziko úmrtí na CRC oproti běžné populaci (HR = 1,89; 95% CI: 1,29–2,78) (29).
Zvýšení rizika vzniku CRC při terapii inzulinem uvádí i jiné práce (49), existují i práce, poukazující na zvýšení rizika pro vznik malignity obecně (50).
Thiazolidindiony
Thiazolidindiony jsou inzulinové senzitizátory, které se váží na jaderné receptory PPAR‑γ (peroxisome proliferator‑activated receptors gamma), čím ovlivňují expresi některých genů. Předpokládá se, že by mohly indukovat diferenciaci a apoptózu buněk CRC a senzitizovat nádorové buňky na chemoterapii. Metaanalýza 10 observačních studií, zahrnující 2 470 768 pacientů s DM (bez specifikovaného podtypu), ze kterých mělo 18 972 pacientů CRC, uvádí snížení rizika vzniku CRC u pacientů s DM užívajících thiazolidindiony o 9 % (RR = 0,91; 95% CI: 0,84–0,99). Tento efekt byl vypočten také pro podskupinu kohortových studií (RR = 0,89; 95% CI: 0,80–0,99), ne však pro skupinu studií případů a kontrol zahrnutých v této metaanalýze. Snížení rizika CRC bylo statisticky významné u ne‑pioglitazonových thiazolidindionů (např. rosiglitazon) (RR = 0,88; 95% CI: 0,82–0,95), ne však u pioglitazonů (RR = 0,95; 95% CI: 0,89–1,01) (51).
Výsledky by mohly být odůvodněny mechanismem účinku jednotlivých thiazolidindionů. Rosiglitazon účinkuje na receptor PPAR‑γ a působí tedy antiproliferačně, induukuje apoptózu a stimuluje diferenciaci nádorových buněk. Naopak, pioglitazon má duální PPAR‑α - γ aktivitu, která byla na zvířecích modelech spojena s karcinogenním efektem, zejména se vznikem karcinomu močového měchýře (zvýšení rizika vzniku karcinomu močového měchýře u lidí však nebylo prokázáno) (51). V ČR je v současnosti dostupný jenom pioglitazon.
Deriváty sulfonylurey
Metaanalýza, zahrnující 840 787 účastníku z 15 studií (randomizované kontrolované studie, kohortové studie, studie případů a kontrol), uvádí trend směrem ke zvýšenému riziku CRC, vypočtené OR však nebylo statisticky významné (OR = 1,11; 95% CI: 0,97–1,26) (52). Jiná výše zmíněná metaanalýza uvádí zvýšené riziko vzniku malignity obecně (50).
Inhibitory alfa glukosidáz
Podle kohortové studie Taiwanských vědců snižovala akarbóza riziko vzniku CRC u pacientů s DM v závislosti na dávce (53). Jiná metaanalýza observačních studií poukázala na snížené riziko vzniku gastrointestinálních malignit při užívání inhibitorů alfa‑glukosidáz, specifické snížení rizika vzniku CRC však nebylo statisticky významné (54).
Inhibitory SGLT2 (Glifloziny)
Dostupné metaanalýzy neprokázaly zvýšené riziko malignity u pacientů užívajích glifloziny (55, 56). Jedna metaanalýza však poukázala na možné zvýšení rizika vzniku malignity trávicího traktu při užívání empagliflozinu (56).
Inkretiny
V metaanalýze 84 studií nebylo prokázáno zvýšené riziko vzniku malignit trávicího systému u pacientů užívajících inkretiny (57). Jiná metaanalýza však poukázala na signifikantně nižší riziko vzniku CRC při užívání gliptinů (inhibitorů DPP-4) (58).
Implikace pro praxi
Léčba DM ovlivňující riziko CRC
Režimová opatření zlepšující prognózu CRC a podílející se zároveň na snížení glykemie a zlepšení prognózy DM zahrnují snížení hmotnosti, pravidelný pohyb, snížený příjem rafinovaného cukru, bílé mouky a bílé rýže a zvýšený příjem vlákniny (29, 59, 60).
Table 2. Vztah terapie DM a CRC – přehled dostupných dat 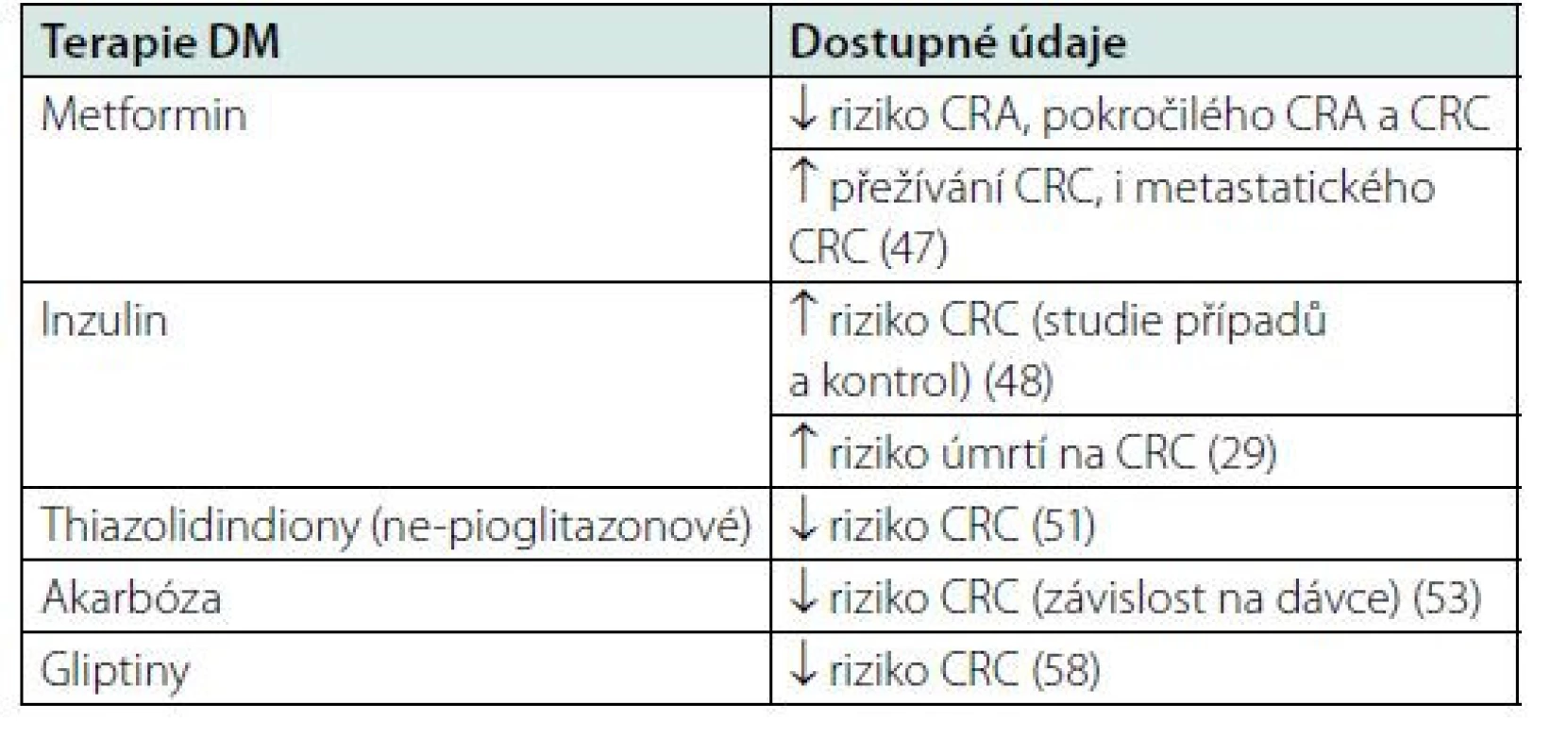
Fyzická aktivita střední až vysoké intenzity, snížení hmotnosti a zvýšení fyzické zdatnosti vede ke zvýšení inzulinové senzitivity, snížení hladiny glykovaného hemoglobinu, úpravě lipidového profilu a snížení krevního tlaku, co má za následek zlepšení prognózy DM2, snížení jeho komplikací až jeho remisi (59, 61). Pohybová aktivita je také přímo asociována se snížením rizika vzniku CRC (62).
Příjem vlákniny, zejména ve formě obilnin, má obdobně za následek zvýšení inzulinové senzitivity, úpravu lipidového profilu, snížení endoteliální dysfunkce a kontrolu prozánětlivého stavu, co má příznivý vliv jak na DM, tak na jeho kardiovaskulární a onkologické komplikace (63).
Jak už bylo zmíněno, při kontrole DM vykázal snížení rizika recidivy, úmrtí a pravděpodobný protektivní účinek před rozvojem CRC metformin (29, 46).
Screening CRC u diabetiků
U pacientů s DM je tedy nutné myslet na zvýšené riziko rozvoje malignit (3).
Letos vydaná doporučení pro screening CRC v USA snižují věk pro nabízení populačního screeningu bez ohledu na nepřítomnost rizikových faktorů na 45 let a výše, přičemž DM je zde uveden jako „jiný rizikový faktor“ společně s obezitou, dlouhodobým kouřením a škodlivým pitím alkoholu (13). Aktuální doporučené postupy v České republice však DM jako rizikový faktor vzniku malignit zatím specificky nezohledňují.
Samostatným problémem je také kompenzace diabetu – v prospektivní observační studii, zahrnující 1 459 diabetiků z české a slovenské populace, dosahovalo z hlediska doporučených hodnot uspokojivé hladiny HbA1c < 53 mmol/mol (< 7 %) jen 29,9 % pacientů s DM1 a 33,4 % pacientů s DM2 (64, 65). Jiná observační studie z České republiky, zahrnující 1 055 pacientů s DM2, analyzovala také hladinu postprandiální glukózy (optimální hodnota < 7,5 mmol/l zjištěna u 19,9 % pacientů) a hladiny glukózy nalačno (optimální hodnota < 6 mmol/l zjištěna u 23,7 % pacientů) (66). Další práce z našeho prostředí ukázala, že zahájení inzulinoterapie u pacientů s DM2 je provedeno při relativně vysoké hodnotě HbA1c 77,2 ± 15,1 mmol/mol (67). Z uvedených dat je možné soudit, že kompenzace DM u nás není u velké části diabetiků dostatečná.
Je tedy individuální odpovědností příslušného lékaře poskytnout pacientovi s DM optimální péči a zachytit případnou malignitu v co nejdřívějším stadiu. Potřebné je v co nejvyšší míře zajistit spolupráci pacienta a jeho účast na preventivních prohlídkách a screeningovém programu. V České republice má aktuální screeningový program CRC dvě varianty – kolonoskopie a test na okultní krvácení. Kolonoskopie je pro pacienty od 50 let hrazena zdravotní pojišťovnou jednou za 10 let, test na okultní krvácení je hrazen pro pacienty od 50 do 54 let jednou za rok, od 55 let jednou za 2 roky (68). Jak už bylo zmíněno, účast na tomto preventivním programu má pro pacienty s DM zásadní význam. Je potřeba pacienta v dostatečné míře edukovat a obeznámit ho s riziky onkologického onemocnění v souvislosti s DM, benefity účasti na screeningovém programu, jako i s dostupnými vyšetřovacími metodami, jejich přínosy a riziky.
V souvislosti s vyšším rizikem CRC a nižším věkem jeho manifestace (27, 28) stojí před námi otázka zvážení modifikace frekvence screeningu CRC u pacientů s DM, případně zahájení screeningu v nižším věku (3).
Je potřebné zároveň aktivně pátrat po anamnestických údajích, které by mohly poukazovat na CRC. Počátečními nespecifickými příznaky CRC mohou být únava, slabost, hubnutí, bolesti břicha, zácpa, průjem nebo tenezmy. Dalším příznakem může být i změna frekvence či charakteru stolic – pacient má stolici méně často či naopak častěji než obvykle, nebo se mění její konzistence. Laboratorním nálezem může být sideropenická anémie. Příznaky pokročilého karcinomu zahrnují enterorhagii až rectorhagii a nádorovou kachexii. Projevem pokročilého karcinomu kolorekta může být také ileus (7). Pacienti s DM by měli být poučeni o možných projevech malignity kolorekta a o potřebě vyhledat lékaře při zaznamenání výše zmíněných příznaků. Významným prvkem zvyšujícím riziko CRC nejenom u těchto pacientů je pozitivní rodinná anamnéza tohoto onemocnění (27).
Zvýšené riziko incidence, recidivy a mortality CRC u pacientů s DM ukládá jejich ošetřujícím lékařům odpovědnost zabezpečit jeho prevenci, včasný záchyt a léčbu. Je potřebné edukovat pacienta o možnostech screeningu CRC a snažit se zajistit jeho adherenci. Optimální screening a pátrání po příznacích CRC může pacientům s DM prodloužit život a zvýšit jeho kvalitu.
Závěr
Zvýšené riziko CRC u pacientů s DM je dnes doloženo množstvím kvalitních dat. Pacienti s DM mají zároveň vyšší riziko prognosticky závažnějšího typu CRC, recidivy CRC a vyšší riziko úmrtí na CRC. Z antidiabetické terapie je indikován na snížení incidence a mortality CRC metformin. Z těchto důvodů je důležitý včasný záchyt hyperglykemie, režimová opatření, optimální kontrola rozvinutého DM a pečlivý screening CRC u pacientů s DM.
KORESPONDENČNÍ ADRESA AUTORA:
As.MUDr. Jan Brož
Interní klinika 2. LF UK a FN v Motole
V Úvalu 84, 150 00 Praha 5
Cit. zkr: Vnitř Lék 2022;68(2):116-123
Článek přijat redakcí: 5. 12. 2021
Článek přijat po recenzích: 16. 3. 2022
Sources
1. Zdravotnická ročenka České republiky 2018. Praha: ÚZIS ČR, 2019. ISSN ISSN 1210-9991.
2. Ogurtsova K, da Rocha Fernandes JD, Huang Y et al. IDF Diabetes Atlas: global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract.2017; 128,40-50.
3. Ling S, Brown K, Miksza J et al. Risk of cancer incidence and mortality associated with diabetes: A systematic review with trend analysis of 203 cohorts. Nutrition, Metabolism & Cardiovascular Diseases. 2021;31(1),14-22.
4. Coughlin S, Calle E, Teras L et al. Diabetes Mellitus as a Predictor of Cancer Mortality in a Large Cohort of US Adults. American Journal of Epidemiology. 2004;159(12),1160-1167.
5. Hammer G, McPhee S et al. Pathophysiology of Disease: An Introduction to Clinical Medicine. Eighth Edition. China: The McGraw‑Hill Companies. 2019 : 553-581. ISBN 978-1-260-02950-4.
6. Urbanová J, Brunerová L, Brož J. Hidden MODY ‑ Looking for a Needle in a Haystack. Front Endocrinol (Lausanne). 2018;Jul 2;9 : 355.
7. Zámečník J, ed. Patologie. Praha: LD Prager Publishing. 2019 : 461-526. ISBN 978-80-270-6457-1
Další literatura u autorů a na www.casopisvnitrnilekarstvi.cz
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 2-
All articles in this issue
- Editorial
- Prediabetes
- Co nového přinášejí ADA standardy péče o pacienty s diabetem z roku 2022?
- Orální semaglutid – Rybelsus®, první agonista GLP-1 receptoru pro perorální použití v klinické praxi
- SGLT-2 inhibitory a jejich uplatnění v praxi – update 2022
- Co internistům přinášejí nová doporučení ESC pro léčbu srdečního selhání 2021?
- Antikoagulace u onkologických pacientů, nová doporučení na základě randomizovaných klinických studií
- Kolorektální karcinom u pacientů s diabetes mellitus – epidemiologie, patofyziologie a implikace pro praxi
- Co čekat od silnějšího dulaglutidu?
- Incidentalomy hypofýzy
- Možnosti farmakologického využití vitaminu C v onkologii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Orální semaglutid – Rybelsus®, první agonista GLP-1 receptoru pro perorální použití v klinické praxi
- SGLT-2 inhibitory a jejich uplatnění v praxi – update 2022
- Antikoagulace u onkologických pacientů, nová doporučení na základě randomizovaných klinických studií
- Prediabetes
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

