-
Medical journals
- Career
Pacient s jaterní cirhózou na interním oddělení
Authors: Karel Dvořák 2; Přemysl Falt 3; Pavla Paterová; Štěpán Šembera 1; Michal Šenkyřík 5; Jiří Cyrany 1
Authors‘ workplace: II. interní gastroenterologická klinika, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Hradec Králové 1; Oddělení gastroenterologie a hepatologie, Krajská nemocnice Liberec, a. s. 2; II. interní klinika – gastroenterologická a geriatrická, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc 3; Ústav klinické mikrobiologie, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Hradec Králové 4; Interní gastroenterologická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 5
Published in: Vnitř Lék 2022; 68(1): 19-25
Category: Main Topic
Overview
Jaterní cirhóza představuje časté onemocnění s významnou mortalitou. Mezi hlavní důvody hospitalizace pacienta s jaterní cirhózou na interním oddělení patří vznik a progrese ascitu, jaterní encefalopatie nebo krvácení do trávicího traktu. Další specifickou oblast u pacientů s jaterní cirhózou představují infekce. Včasná a správná diagnostika a léčba těchto stavů jsou základními předpoklady pro optimální terapeutický výsledek. Objevení se komplikací jaterní cirhózy významně zhoršuje prognózu pacienta. Ascites vzniká při portální hypertenzi jako následek retence natria a následně vody. Terapie zahrnuje restrikci příjmu natria, podávání kombinace diuretik spironolaktonu a furosemidu, popřípadě velkoobjemové paracentézy. Jaterní encefalopatie představuje spektrum neuropsychiatrických abnormalit od mírných změn přes zjevnou encefalopatii s desorientací a flapping tremorem až po jaterní kóma. Terapie spočívá v odstranění vyvolávající příčiny, podávání nevstřebatelných disacharidů nebo rifaximinu. Nejčastější příčinou krvácení u pacienta s jaterní cirhózou je krvácení z jícnových varixů. Terapie je komplexní a zahrnuje hemodynamickou stabilizaci, antibiotickou profylaxi, vasoaktivní léčbu a endoskopickou terapii. Častou příčinou dekompenzace i vzniku komplikací u pacientů s jaterní cirhózou bývají infekce. Nepříznivá prognóza těchto infekcí je podmíněna komplexní poruchou imunity cirhotiků. Specifickým typem infekce při jaterní cirhóze je spontánní bakteriální peritonitida a je ji vždy nutné vyloučit u pacienta s ascitem diagnostickou paracentézou. Základem léčby infekcí je časná a razantní širokospektrá antibiotická terapie, která může výrazně zlepšit jinak nepříznivou prognózu těchto nemocných.
Klíčová slova:
krvácení – cirhóza – Ascites – infekce – encefalopatie
Úvod
Co do počtu úmrtí ročně je jaterní cirhóza v České republice významným onemocněním srovnatelným například s chronickou obstrukční chorobou bronchopulmonální nebo karcinomem prsu. Prognózu pacienta s jaterní cirhózou dramaticky zhoršuje první dekompenzace. V textu se autoři věnují čtyřem klinickým syndromům (ascites a retence tekutin, jaterní encefalopatie, krvácení do gastrointestinálního traktu a infekcím v širším slova smyslu) u pacienta s jaterní cirhózou a jejich diagnostikou a terapií. U všech pacientů s dekompenzovanou jaterní cirhózou (objevení se ascitu, jaterní encefalopatie nebo krvácení do trávicího traktu) je na místě úvaha, zda jeho jaterní choroba optimálně léčena a zda by byl pacient potenciálním kandidátem k jaterní transplantaci. Pokud nejsou shledány jednoznačné kontraindikace k jaterní transplantaci má být pacient odeslán k vyšetření do transplantačního centra.
Ascites
Objevení se ascitu zvyšuje pravděpodobnost úmrtí v následujícím roce z 1–3 % na 20 % (Obr. 1) (1, 2). Jaterní cirhóza s portální hypertenzí bývá příčinou většiny případů ascitu (kolem 85 %). Do 10 let od diagnózy kompenzované jaterní cirhózy vyvine ascites cca 60 % pacientů.
Image 1. Klíčový bod – první dekompenzace podle (1) a (2) 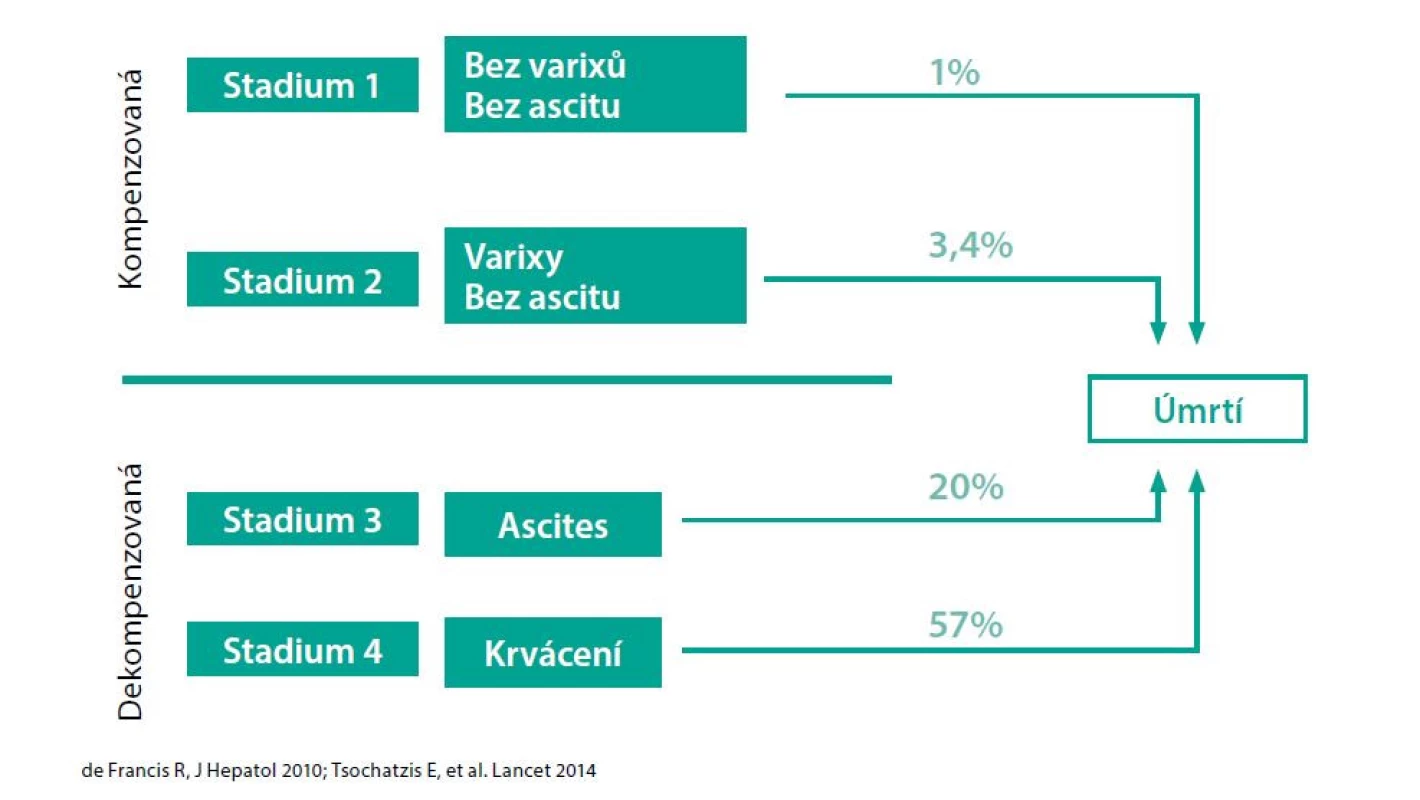
Kromě anamnézy, fyzikálního vyšetření a základního laboratorního vyšetření zahrnujícího také stanovení bilirubinu, albuminu a koagulační parametrů, patří k úvodnímu vyšetření rovněž sonografie břicha. Kromě sonografických známek jaterní cirhózy a portální hypertenze (Tabulka 1) pátráme také po možných komplikacích cirhózy, jako jsou trombóza portální žíly nebo hepatocelulární karcinom.
Table 1. Sonografické známky jaterní cirhózy a portální hypertenze 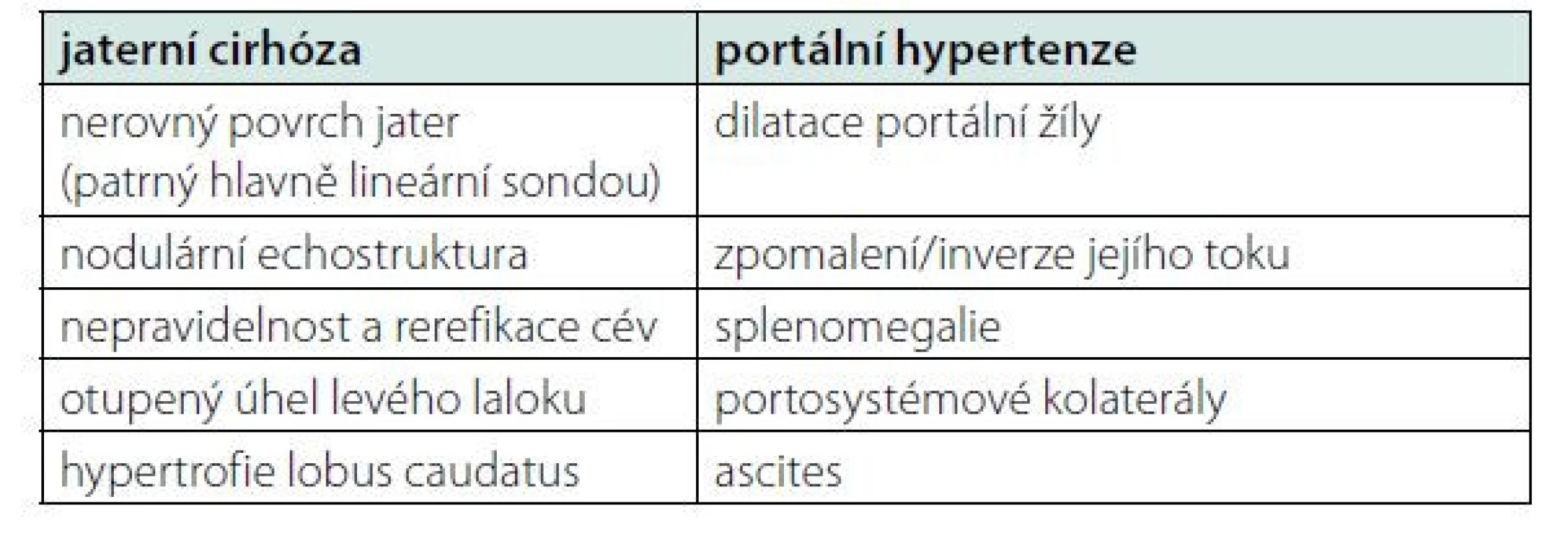
Častou příčinou dekompenzace jsou infekce, zejména spontánní bakteriální peritonitida (viz kapitola infekce). U pacienta s dekompenzovanou jaterní cirhózou má být proveden běžný screening infekcí zahrnující kultivace, skiagram hrudníku, při sub-/febriliích odběr hemokultur a diagnostická punkce ascitu, která prakticky nemá kontraindikace (3).
Iniciální léčba
Ascites je následek renální retence sodíku. Když je exkrece sodíku do moči významně nižší, než je jeho dietní příjem, vede to k akumulaci sodíku a vody. Odstranění ascitu tak vyžaduje navození negativní sodíkové bilance. Následující doporučení jsou založena na doporučeních EASL (Evropské společnosti pro studium jater) (1). Klíčovým opatřením je restrikce sodíku (2 g/den). A protože tekutina následuje sodík pasivně, není obecně indikována restrikce tekutin. Ta může být vhodná pro pacienty s velmi nízkou hladinou natria (pod 120 mmol/l).
Nedílnou součástí farmakologické léčby jsou také diuretika, a to kombinace v poměru 100 mg spironolaktonu: 40 mg furosemidu podávaných perorálně ráno. Dávka má být titrována podle efektu, maximální dávka je 400 mg spironolaktonu a 160 mg furosemidu. Diuretika podáváme pouze jednou denně pro dlouhý poločas spironolaktonu a ke snížení nykturie. Je vhodnější podávat i furosemid perorálně, protože intravenózní podávání furosemidu může vést k akutnímu snížení renálních funkcí. Poměr 100 : 40 obvykle nevede k hyperkalemii, u pacientů s těžkou hypokalemií lze iniciálně zahájit léčbu pouze spironolaktonem. Iniciální léčbu podáváme po dobu 3 až 5 dnů. Na druhou stranu u pacientů s jinou příčinou ascitu (např. při karcinomatóze peritonea) vede restrikce tekutin a diuretická léčba k depleci intravaskulárního objemu bez efektu na mobilizaci ascitické tekutiny. U pacientů s tenzním ascitem provádíme rovněž velkoobjemovou paracentézu. Významným léčebným opatřením je také abstinence alkoholu. Je zásadním opatřením u alkoholové jaterní cirhózy, ale může mít podstatný význam i u ostatních pacientů.
Součástí terapie je také úprava ostatní medikace. U cirhotiků je nižší krevní tlak asociován s horším přežitím. Se vzrůstající závažností jaterní cirhózy klesá systémový krevní tlak, což je spojeno s poklesem renální perfuze a glomerulární filtrace a k vzestupu aktivity renin‑angiotenzin‑aldosteronového systému a ke zvýšené hladině vazokonstriktorů v séru. To napomáhá kompenzovat vazodilatační efekt přítomného oxidu dusnatého. Obecně je možno konstatovat, že ACE inhibitory a blokátory AT1 receptorů je potřeba pacientům s ascitem vysadit. To platí i pro neselektivní betablokátory užívané k profylaxi krvácení z jícnových varixů. To nejpodstatnější je zabránit hypotenzi, která dramaticky zhoršuje přežití.
Dalším univerzálním opatřením je vysazení a nepodávání nesteroidních antirevmatik. Ty inhibují syntézu renálních prostaglandinů a vedou k renální vazokonstrikci, nižší odpovědi na diuretika a mohou způsobit akutní renální selhání nebo i krvácení z jícnových varixů. Při léčbě jsou rovněž kontraindikována potenciálně nefrotoxická antibiotika.
Pokud je terapeutická odpověď příznivá a je navozena negativní tekutinová bilance, je vhodná časná ambulantní kontrola za 1–2 týdny a následně při regresi ascitu nejprve redukujeme diuretickou terapii na polovinu (50 mg spironolaktonu: 20 mg furosemidu) a poté diuretika vysazujeme. Na iniciální terapii příznivě odpoví většina pacientů.
Rezistence na diuretika
Pokud u pacienta není přítomna významnější reverzibilní komponenta jaterního onemocnění, dochází k postupnému zhoršování stavu. Diuretika je nutno vysadit, pokud dojde k manifestaci jaterní encefalopatie (diuretická léčba bývá významným vyvolávajícím faktorem), při těžké hyponatremii (< 120 mmol/l) nebo při progresi renálních parametrů (kreatitin > 180 μmol/l). V případě, že pacient neodpoví na iniciální terapii nebo pokud terapeutická odpověď vymizí, opakovaně hodnotíme compliance pacienta zejména s ohledem na restrikci sodíku. Vhodné je vyšetření odpadů natria do moči. Noncompliantní pacienti mají i přes retenci tektutin exkreci normální nebo zvýšenou. Při rezistenci na diuretika je exkrece sodíku snížena a event. navyšování diuretik nemá smysl. Pokud jsou odpady natria normální nebo vyšší, navyšujeme diuretika do maximální tolerované dávky. Pokud je nutno diuretika vysadit, ponecháváme pouze restrikci natria a pacient je indikován k velkoobjemovým paracentézám nebo TIPSu (transjugulární intrahepatální portosystémový shunt; Tabulka 2).
Table 2. Indikace TIPS pro refrakterní ascites 
Jaterní encefalopatie
Jaterní encefalopatie (JE) je označení pro mozkovou dysfunkci vznikající při jaterní insuficienci a/nebo portosystémovém zkratu. Změny, které v mozku nastávají, nemusí být vždy, rychle a plně reverzibilní, a to ani po úspěšné jaterní transplantaci. JE představuje na tíži jaterního onemocnění nezávislý prognostický faktor zvyšující mortalitu a náklady na léčbu.
Podle některých údajů je JE nejčastější komplikací, která přivádí cirhotika k hospitalizaci (incidence 11,6/100). Pravděpodobnost jejího výskytu je 10–14 % při diagnóze cirhózy, 16–21 % při její dekompenzaci a v 10–80 % případů u pacientů s TIPS. Čtvrtina pacientů rozvine encefalopatii do 5 let od diagnózy cirhózy. S manifestací encefalopatie stoupá riziko recidivy – 42 %/rok po první epizodě, 43 %/6 měsíců po každé další atace (4).
Patofyziologicky je za hlavní příčinu stále považována hyperamonemie ze zvýšené dostupnosti, resp. produkce amoniaku, při jeho nedostatečné eliminaci v organismu, i když přesný mechanismus vzniku JE neznáme. Významný podíl má však systémová inflamace, resp. sekundární neurinflamace a oxidativní stres, které mění vlastnosti hematoencefalické bariéry. Systémové faktory, které dále ovlivňují rozvoj JE jsou: malnutrice (katabolismus uvolňující amoniak ze svalů), elektrolytové dysbalance (hyponatremie, hyperkalemie, renální selhání), precipitující události (krvácení, obstipace, infekce), léky (benzodiazepiny, opiáty) a střevní mikrobiom, resp. střevo (nadprodukce amoniaku, porucha enterohepatálního oběhu žlučových kyselin). Hromadění hypertonického glutaminu (z amoniaku) a laktátu vedou ke změně složení mozkomíšního moku, edému a diskonexi astrocytů s poruchami metabolismu a neurotransmise. Hyperamonemie má toxický vliv na játra, svaly, imunitní systém, poškozuje buňky a indukuje stárnutí astrocytů (5).
Při pozvolnějším vzniku jaterní léze je obvykle rozvoj JE pozvolný, nedochází k rozvoji edému mozku (chronická JE). Akutní jaterní poškození vede k rychlým změnám a oxidativnímu stresu s rizikem intrakranální hypertenze a fatálního otoku mozku (akutní JE). Akutní rozvoj může potencovat alkohol, přítomnost nealkoholové steatohepatitidy, diabetu mellitu, obezity, virová hepatitida C, věk, konkomitantní medikace.
JE můžeme rozdělit na typ A při akutním selhání jater, typ B (= bypass) při portosystémovém zkratu a typ C u chronického onemocnění jater, cirhózy. Zvláštní postavení má JE při ACLF (acute‑on ‑ chronic liver failure) s obvykle dramatičtějšími projevy a vyšší mortalitou. Z hlediska časového výskytu lze hovořit o JE epizodické, rekurentní (< 6 měsíců) a perzistentní. A z hlediska precipitujících faktorů pak o JE spontánní a precipitující. Klasické je dělení JE do 4 stupňů podle přítomnosti neuropsychických projevů (WHC, West Haven Criteria) nebo na skrytou (covert) a manifestní (overt) dle ISHEN (International Society for Hepatic Encephalopathy and Nitrogen metabolism criteria). Problém je zejména se subklinickou, nemanifestní JE, která je však asociovaná s potížemi ve všedním životě, kvalitou života a nezávisle také s mortalitou.
Diagnostika bývá obtížná, pokud je JE menší než 2. stupně (dle WHC kritérií). Neurofyziologické testy jsou v rutinní praxi běžně nepoužitelné a moderní zobrazovací metody stále ve stadiu výzkumu. V praxi, zvl. u manifestní formy, poukáže na diagnózu anamnéza, klinický stav, neurologické vyšetření (mj. typická ztráta orientace v čase a prostoru), příp. zobrazovací metody k vyloučení mozkového edému (CT, MR mozku, UZV optického nervu). Doporučený Number Connecting Test (NCT) se jeví obsolentní, použitelný jen u chronických forem JE. Hladina amoniaku v krvi sice přímo nekoreluje s tíží JE, ale je vždy zvýšená, a na rozdíl od původních doporučení AASLD/EASL z roku 2014 je její odběr vhodný (dle literatury lépe koreluje arteriální stanovení, lze však použít i venózní či kapilární odběr) (6).
V diferenciální diagnostice je třeba vyloučit alkohol (předávkování, odnětí, chronické změny), léky (nežádoucí účinky nebo předávkování, zvl. benzodiazepiny, neuroleptika, opiáty; diuretika), poruchy vnitřního prostředí (hyponatremie) a psychiatrická onemocnění (7).
V terapii, kromě úpravy diety a režimových opatření, dominují nevstřebatelné disacharidy (laktulóza, lactitol) tak, aby zajistily 2–3 vláčné stolice denně (dávkování obvykle 15–20 ml po 8–12 h). Rifaximin lze použít ke střevní dekontaminaci a redukci patogenní mikrobiální flóry (dávka 1200 mg/den). Současně potencuje efekt samotné laktulózy. Podpůrnou léčbou můžou být probiotika, větvené aminokyseliny (VLI – valin, leucin, isoleucin), L‑ornitin L‑aspertát (LOLA) nebo albumin. Albuminová dialýza se obvykle používá v rámci bridging terapie jaterního selhání před transplantací.
Prevence JE je nezbytnou součástí terapie po již proběhlé atace encefalopatie (sekundární profylaxe). Uplatňují se laktulóza a rifaximin. Efekt probiotik je nejistý, i když bývají podávána. Pro primární profylaxi není t.č. dostatečná evidence – prediktory rozvoje JE jsou stadium Child‑Pugh B/C chronického jaterního onemocnění a přítomnost minimální JE (8). V prevenci i léčbě má význam i ovlivnění precipitujících faktorů a stavů potencujících rozvoj JE.
Infekce
Infekce představuje jeden z nejčastějších důvodů hospitalizace na interním oddělení, proto je pro rychlejší a snazší orientaci vhodné mít k dispozici aktualizovaná schémata empirické antibiotické terapie nejčastějších infekcí. Pacienti s jaterní cirhózou však v tomto ohledu vykazují některá specifika diagnostiky i léčby, kterým se věnujeme v následujícím textu. Vycházíme z doporučení Evropské asociace pro studium jater (EASL) pro léčbu dekompenzace jaterní cirhózy (3) se zohledněním některých nových doporučení léčby infekcí (8, 9) a lokálních podmínek antibiotické rezistence.
Infekce jsou u pacientů s jaterní cirhózou časté, vyskytují se přibližně u třetiny hospitalizovaných cirhotiků. Jsou také nejčastější příčinou dekompenzace cirhózy, včetně její nejzávažnější formy – ACLF. Infekce zde může být příčinou, modifikujícím činitelem i důsledkem. Infekce je také častou příčinou rozvoje hepatorenálního syndromu. Specifika vzniku a průběhu infekce u pacientů s jaterní cirhózou jsou dána řadou etiopatogenetických faktorů. Zdrojem infekce bývá bakteriální translokace přes poškozenou střevní bariéru z alterovaného střevního mikrobiomu v podmínkách jaterní dysfunkce a portální hypertenze. Imunita cirhotika je kompromitována ve složce celulární i humorální, nejen alterací retikuloendoteliálního systému, ale i abnormální reakcí na infekci s modifikovanou cytokinovou odpovědí, vliv může mít i hepato‑adrenální syndrom s relativní insuficiencí nadledvin.
Příznaky infekce u cirhotika mohou být mitigované. Je nutné vždy infekci a podání antibiotik zvažovat, pokud nenacházíme jinou příčinu dekompenzace (nejčastěji krvácení, intoxikace včetně pokračujícího abúzu alkoholu a léků, hepatocelulární karcinom). Včasná diagnostika a léčba infekce je pro pacienta s jaterní cirhózou zásadní, protože jejich prognóza je závažná: 2/3 pacientů po epizodě infekce zemřou do jednoho roku, z toho polovina do 30 dnů. Každého pacienta je nutno pečlivě zhodnotit stran kritérií sepse (SOFA, qSOFA) a zvážit zajištění na jednotce intenzivní péče, zvláště v prvních hodinách. Základním článkem léčby je včasná, razantní a racionální antibiotická terapie. Předpokladem úspěšné antibiotické terapie je maximální snaha o zjištění etiologie infekce, což vyžaduje odběr vhodných vzorků na kultivaci (krev na hemokultivaci, ascites, moč, hnis, výtěr z rány, sputum a další podle charakteru a lokalizace infekce). Pro výběr vhodného antibiotika pro počáteční léčbu bez znalosti etiologie (empirická terapie) je třeba zohlednit lokalizaci infekce, typ ve vztahu ke zdravotní péči (komunitní/ asociovaná se zdravotní péčí/nozokomiální), osídlení pacienta (možné využít předchozí kultivace). Zároveň je vhodné znát a respektovat regionální i lokální data o rezistenci bakterií. Nemocní s jaterní cirhózou jsou rizikoví pro podání nefrotoxických antibiotik (parenterální vankomycin, aminoglykosidy), jejich použití se proto snažíme pokud možno vyhnout.
Zvláštní postavení v terapii u cirhotiků zaujímají chinolony. Tato antibiotika jsou efektivně využívána k léčbě a profylaxi spontánní bakteriální peritonitidy. V profylaxi na rozdíl od mezinárodních doporučení navrhujeme upřednostnit ciprofloxacin před norfloxacinem, který vykazuje vyšší inducibilitu rezistence enterobakterií. S ohledem na celosvětově vysokou úroveň rezistence Escherichia coli považujeme chinolonová antibiotika v léčbě ostatních infekcí (zvláště infekcí močových a dýchacích cest) za spíše nevhodnou první volbu. Nutno zohlednit také obecně varovný postoj lékových autorit k použití fluorochinolonů. Státní ústav pro kontrolu léčiv (10) ve shodě se stanoviskem Evropské lékové agentury EMA (11) v roce 2018 doporučil vzhledem k popisovaným nežádoucím účinkům preferovat jiná antibiotika než chinolony tam, kde je to možné.
Zvýšená pozornost by měla být věnována také prevenci infekcí. Inhibitory protonové pumpy zvyšují riziko infekcí, především spontánní bakteriální peritonitidy, ale i pneumonií. Proto by se jejich podání u cirhotika mělo opírat o robustní indikaci jakou je např. vředová choroba gastroduodena.
Nejčastější infekce a jejich léčba
Močový trakt je nejčastějším místem infekce u cirhotika: v uvedených antibiotických schématech zohledňujeme recentní doporučení Evropské urologické asociace (EAU) (12). U nekomplikované infekce dolních močových cest (cystitida) EAU doporučuje staro/nová antibiotika fosfomycin, pivmecilinam a nitrofurantoin, u mužů cotrimoxazol. V této indikaci bychom neměli používat chinolony ani aminopeniciliny. EAU definuje infekci dolních a horních močových cest jako komplikovanou u pacientů s těmito rizikovými faktory: mužské pohlaví, gravidita, anatomická nebo funkční abnormalita močových cest, zavedený močový katétr, výkon v močových cestách, onemocnění ledvin, onemocnění predisponující k infekci (např. diabetes mellitus). Z tohoto pohledu je tedy vhodné i jaterní cirhózu považovat za rizikový faktor a infekci u těchto nemocných klasifikovat jako komplikovanou. Léčbu pyelonefritidy lze zahájit ciprofloxacinem perorálně (velmi dobrá biologická dostupnost) nebo parenterálně, u hospitalizovaného nemocného dáváme přednost cefalosporinům 3. generace (cefotaxim 3x 2 g i.v. 10 dní) vzhledem k výše uvedeným výhradám k chinolonům. Komunitní urosepsi léčíme také cefalosporinem 3. generace nebo piperacilin/tazobaktamem (3x 4,5 g i.v. 10 dní), v případě nozokomiální urosepse je další možností meropenem (3x 1 g i.v. 10–14 dní) v kombinaci s glykopeptidem (vankomycin). Odběr moči na kultivaci před podáním antibiotika je nezbytný pro další zacílení antibiotické terapie.
Infekce kůže a měkkých tkání představují široké spektrum chorobných jednotek, nejčastěji se setkáváme s erysipelem/celulitidou. V empirické terapii vždy nutno myslet na častější výskyt stafylokokové infekce u cirhotiků. Komunitní infekci tohoto typu léčíme empiricky kombinací 3. generace cefalosporinů s oxacilinem případně monoterapií piperacilin/tazobaktamem. Stejným antibiotikem zahajujeme léčbu v případě nozokomiální infekce měkkých tkání, alternativou je ceftazidim či cefepim v kombinaci s oxacilinem nebo meropenem. Při vysokém riziku etiologického podílu Staphylococcus aureus MRSA přidáváme do kombinace vankomycin nebo linezolid. U komunitních i nozokomiálních infekcí lze zvážit přisazení clindamycinu. Cílená terapie celulitidy je komplikovaná, v případě závažné infekce je vhodné odebrat hemokulturu. Kultivaci provádíme z infikovaných ložisek s porušeným kožním krytem a defektů.
Léčbu komunitní pneumonie u cirhotika empiricky zahajujeme dvojkombinací cefalosporinu 3. generace (ceftriaxonu nebo cefotaximu) s makrolidem (klaritromycinem nebo azitromycinem). U osob s vysokým rizikem pseudomonádové infekce (předchozí kultivace Pseudomonas aeruginosa z jakékoliv lokalizace, pacienti s chronickou obstrukční plicní nemocí, nemocní opakovaně hospitalizovaní nebo přeložení z jiného zdravotnického zařízení) volíme antibiotikum s protipseudomonádovým účinkem – piperacilin/tazobaktam, respirační chinolony (levofloxacin) indikujeme jako náhradu této kombinace jen v případě jasné alergie na makrolidy nebo betalaktamy. V případě pozdní nozokomiální pneumonie léčbu zahajujeme piperacilin/tazobaktamem, cefalosporinem 3. generace s protipseudomonádovým účinkem (ceftazidim, cefepim) nebo meropenemem, vždy v kombinaci s respiračním chinolonem (levofloxacin). Při vysokém riziku infekce MRSA přidáváme do kombinace ještě vankomycin nebo linezolid. Kultivace je zvláště významná v případě nozokomiální infekce, kdy umožňuje zacílit antibiotickou terapii proti případným rezistentním původcům.
Spontánní bakteriální peritonitida (SBP) je definována jako bakteriální (zřídka mykotická) infekce ascitické tekutiny při jaterní cirhóze bez chirurgicky léčitelného nitrobřišního zdroje. Etiologicky se podílí dominantně bakteriální translokace ze střevního mikrobiomu (Escherichia coli, streptokoky, enterokoky, Klebsiella pnemoniae). Prevalence tohoto onemocnění je u ambulantních pacientů 2,5 %, u hospitalizovaných kolem 10 %; komunitní a nozokomiální případy infekce jsou přibližně stejně časté. Letalitu lze pečlivou diagnostikou a léčbou snížit z 90 % na 20 %, roční přežití pacientů s SBP je odhadováno na 30–50 %. Základem diagnostiky je diagnostická paracentéza ascitu u všech pacientů akutně hospitalizovaných nebo vyšetřených pro dekompenzaci. Příznakem nemusí být jen klasická triáda horečky, bolestí břicha a nárůstu ascitu. SBP se může projevit i krvácením do GIT, jaterní encefalopatií, zhoršením jaterní či renální funkce nebo šokovým stavem, může ale také probíhat inaparentně a manifestovat se pouze přítomnou dekompezací. Diagnostickým kritériem je počet polymorfonukleárních leukocytů (neutrofilů) v ascitu nad 250/mm3. Kultivaci ascitu zakládáme vzhledem k předpokládané nízké denzitě agens vždy do hemokultivačních lahviček v objemu 10 ml do jedné lahvičky. Při průkazu zvýšeného počtu neutrofilů svědčícím pro SBP odebíráme před nasazením antibiotik také klasickou hemokulturu (2 + 2 lahvičky). Pozitivní kultivace však není podmínkou pro diagnózu SBP (postačí průkaz dostatečného počtu neutrofilů). Případy výskytu ascitu s pozitivní kultivací bez splnění kritéria počtu neutrofilů označujeme jako bakterascites. Ten může být jen přechodnou spontánně reverzibilní kolonizací ascitu, vyvinout se v SBP, někdy se může jednat o sekundární infekci z extraperitoneálního zdroje. K bakterascitu přistupujeme stejně jako k SBP. Obdobou SBP u pacientů s fluidothoraxem je spontánní bakteriální hrudní empyém. Diagnostickým kritériem je počet neutrofilů nad 250/mm3 při pozitivní kultivaci a nad 500/mm3 bez kultivačního průkazu; podmínkou diagnózy je absence pneumonické infiltrace.
Pro správný postup je kritické odlišení spontánní (SBP) od sekundární bakteriální peritonitidy, tedy infekce ascitu s chirurgicky léčitelným zdrojem (absces, perforace trávicí trubice apod.). Pro sekundární bakteriální peritonitidu je charakteristická polymikrobiální kultivace, vysoký počet leukocytů (nad 500/mm3) s vysokým podílem neutrofilů (nad 50 %), vysoký protein a laktátdehydrogenáza a nízká glykemie v ascitu nebo nedostatečná reakce na terapii podle kontrolní paracentézy. Podezření na sekundární bakteriální peritonitidu by mělo být důvodem pro neodkladné provedení CT břicha a případně chirurgickou exploraci.
Diagnostickou paracentézu lze provádět bez přípravy i při běžné alteraci koagulačních parametrů u cirhotika (trombocytopenie a prodloužení protrombinového času), kontraindikací jsou extrémní případy diseminované intravaskulární koagulopatie a fibrinolýzy. Paracentézu bychom měli provést bezprostředně při podezření na jakoukoliv dekompenzaci jaterní cirhózy a u nově vzniklého, klinicky patrného ascitu. Kromě počtu neutrofilů a odběru kultivací stanovujeme v ascitu také další biochemické parametry (vždy celkový protein a albumin; výběrově glukózu, laktátdehydrogenázu, amylázu, bilirubin a triacylglyceroly). Pro diferenciální diagnostiku ascitu je klíčový gradient albuminu mezi sérem a ascitem (serum‑ascites albumin gradient – SAAG), při prvním vyšetření odesíláme i vzorek na cytologii. Stanovení neutrofilů je mandatorní při každé punkci ascitu, polovina SBP vzniká až v průběhu hospitalizace.
Antibiotickou terapii zahajujeme u komunitní infekce cefalosporinem 3. generace (cefotaxim, ceftriaxon) nebo piperacilin/tazobaktamem; pro léčbu nozokomiální SBP volíme opět piperacilin/tazobaktam nebo meropenem, v závažných případech, sepsi a podezření na gram‑pozitivní etiologii přidáváme do terapie linezolid nebo vankomycin. Antibiotickou terapii deeskalujeme nebo měníme ihned po zjištění citlivosti původce. Kontrolní diagnostickou paracentézu je vhodné provést za 48 hodin a úspěšná terapie je charakterizována poklesem hodnoty neutrofilů o nejméně 25 %, kontrola po týdnu by měla prokázat pokles neutrofilů pod 250/mm3. Antibiotická léčba by měla trvat nejméně 5–7 dnů, na ni navazuje antibiotická profylaxe (viz níže). Při léčbě SBP není indikována velkoobjemová evakuační punkce ascitu, protože zvyšuje riziko vzniku hepatorenálního syndromu. Prognózu nemocných s SBP lze zlepšit současným podáním albuminu – volumexpanze snižuje především riziko rozvoje hepatorenálního syndromu 1. typu – letalitu lze snížit z 30 na 10 %. Benefit je největší u pacientů s bilirubinem ≥ 70 μmol/l a/nebo kreatininem ≥ 90 μmol/l. Tento efekt se podařilo prokázat pro dávku 1,5 g/kg první den a 1 g/kg třetí den léčby. V praxi jsou však užívány dávky nižší (většinou 2 x 20 g denně) s ohledem na riziko oběhového přetížení s plicním edémem a vyšší náklady.
Pacient po zaléčení spontánní bakteriální peritonitidy je indikován k dlouhodobé sekundární antibiotické profylaxi (tj. do vymizení ascitu, do transplantace jater nebo doživotně – největší efekt je však v prvním roce podávání) s cílem redukovat jinak 70% riziko recidivy. Primárně profylaktické podávání antibiotik je indikováno u pacientů s jaterní cirhózou a krvácením (zde není vázáno na existenci ascitu, ceftriaxon 1 g denně i.v.) a u pacientů s nízkou hodnotou proteinu v ascitu (< 15 g/l) a pokročilým jaterním onemocněním (Child‑Pugh ≥ 9 a bilirubin ≥ 50 μmol/l) nebo renálním selháním či hyponatremií. Z antibiotik pro dlouhodobou profylaxi SBP volíme ciprofloxacin 500 mg den nebo cotrimoxazol 960 mg/den. V některých studiích byl prokázán efekt rifaximinu 3 x 400 mg denně, případně střídání chinolonu a rifaximinu (9) – EASL ale jeho rutinní použití v primární ani sekundární profylaxi dosud nedoporučuje (3). Dlouhodobé užívání antibiotik však kromě účinné profylaxe přináší i zvýšené riziko infekce Clostridioides difficile a selekce rezistentních kmenů.
Krvácení do gastrointestinálního traktu
Krvácení je známou a prognosticky závažnou komplikací nemocných s jaterní cirhózou, nejčastějším zdrojem krvácení je gastrointestinální trakt. Jaterní cirhóza a zejména její pokročilá stadia jsou provázena komplexní poruchou hemostázy, kterou nelze definovat jako prostou „auto‑antikoagulaci“. Jsou postiženy nejen prokoagulační, ale i antikoagulační faktory (faktor II, IX, XI, XII, XIII, protein C a S, AT, TAFI, faktor VIII, PAI, D‑dimery a další), pacienti navíc pravidelně trpí trombocytopenií a trombocytopatií. Lépe než standardními koagulační parametry (aPTT, INR) je hemostatická porucha vyjádřená vyšetřením viskoelastických vlastností celé krve. Nemocní s jaterní cirhózou jsou ale ohroženi i trombotickými komplikacemi – typická je trombóza portální žíly, jejímž prvním projevem může být právě krvácení do gastrointestinálního traktu. Nejvýznamnějším predisponujícím faktorem krvácení je portální hypertenze. Klinicky významná portální hypertenze (portohepatální gradient – HVPG –hepatic venous pressure gradient ≥ 10 mm Hg) je spojena s tvorbou anatomicky predefinovaných tzv. portosystémových kolaterál, z nichž nejvýznamnější jsou gastro/ezofageální varixy. Se stoupajícím HVPG se zvyšuje riziko krvácení spojené s portální hypertenzí a jeho recidivy (13).
Charakteristickým a nejčastějším krvácením při jaterní cirhóze je krvácení z gastroezofageálních varixů (60–65 %). U nemocného s cirhózu bychom ale neměli zapomenout ani na možnost nevarikózního krvácení (30 %). Dalším nálezem je u většiny nemocných portální hypertenzní gastropatie, která častěji vede spíše k chronické anemizaci než k významnému akutnímu krvácení. S jaterní cirhózou může být asociován i tzv. syndrom gastrických antrálních vaskulárních ektázií (GAVE), který nekoreluje se stupněm portální hypertenze, má jiný endoskopický obraz a jeho léčba je lokální. Používá se některá z endoskopických ablačních technik. Vzácněji můžeme detekovat krvácení z dolní části GIT (portální kolopatie, anorektální varixy). Krvácení z jiných zdrojů klinicky odpovídá krvácení, které vídáme u jiných nemocných spíše při trombocytopenii než koagulopatii (rekurentní epistaxe, purpura, metroragie a pooperační krvácení).
Gastroezofageální varixy jsou přítomny asi u poloviny nemocných s jaterní cirhózou, z toho u jedné třetiny vedou ke krvácení. U kompenzovaného onemocnění je riziko asi 4 % za rok, při velkých varixech dosahuje více než 15 % a u pokročilé jaterní cirhózy může dosahovat až 80 %. Epizodou krvácení se zásadně mění další prognóza nemocných, 15–20 % z nich umírá během 6 týdnů od krvácení a při pokročilém jaterním onemocnění letalita stoupá až ke 40 %. Krvácení se v první fázi často (50 %) spontánně zastavuje, ale k recidivě krvácení dochází ve 26 % případů, z toho nejčastěji v prvních 5 dnech a je spojena s prakticky dvojnásobnou letalitou.
Nemocní s krvácením z gastroezofageálních varixů by měli být hospitalizováni na jednotce intenzivní péče interního typu. Samozřejmostí je volumová resuscitace a restriktivní substituce hemogramu s cílovou hladinou hemoglobinu 70–80 g/l, u nemocných v kardiovaskulárním riziku je obvykle cílem 100 g/l. Korekce přítomné koagulopatie je sporná a není všeobecně doporučována. Všichni nemocní s podezřením na varikózní krvácení by během prvního kontaktu měli kromě vazoaktivní léčby dostat také antibiotickou profylaxi. Základem farmakoterapie je vazoaktivní léčba podávaná ihned při podezření na krvácení spojené s portální hypertenzí a léčba obvykle pokračuje po dobu 5 dní v době nejvyššího rizika recidivy krvácení. Vazoaktivní léčba je účinná k dosažení hemostázy, ke snížení rizika recidivy krvácení a ke snížení letality. U terlipresinu navíc ke snížení rizika rozvoje hepatorenálního syndromu. V českém prostředí je tradičně využíván syntetický analog vazopresinu terlipresin v dávce 1–2 mg i.v. každé 4 hodiny. Terlipresin vede ke splanchnické vazokonstrikci a tím ke snížení portálního tlaku a průtoku v portosystémových kolaterálách. Rizikem je možný výskyt komplikací v podobě myokardiální nebo periferní ischemie, dekompenzované hypertenze nebo diluční hyponatremie. Další možností je použití somatostatinu v bolusové dávce 250–500 μg s následnou kontinuální infuzí 250–500 μg/hod. Somatostatin vede k poklesu HVPG inhibicí sekrece glukagonu. Jeho nevýhodou je krátký poločas s nutností kontinuálního podávání, výhodou srovnatelná účinnost s terlipresinem a jednoznačně výhodnější bezpečnostní profil. Nežádoucí účinky jsou relativně vzácné a nezávažné (hypoglykemie, průjem, návaly horka). Podle limitovaných dat se zdá, že podání inhibitorů protonové pumpy snižuje riziko recidivy varikózního krvácení a v běžné praxi jsou tyto léky obvykle podávány. U rizikových nemocných je vhodné zvážit prevenci jaterní encefalopatie laktulózou a/nebo rifaximinem.
Další modalitou v léčbě akutního krvácení je horní endoskopie, při které je kromě určení zdroje krvácení možná i okamžitá endoskopická léčba. Načasování endoskopie je individuální, obvykle je doporučováno do 12 hodin od přijetí. Klíčová je hemodynamická a interní stabilizace nemocného a podání odpovídající farmakologické léčby před výkonem. Individuálně, zejména při riziku aspirace nebo neklidu nemocného, je nutné zvážit různý stupeň analgosedace, nejlépe za asistence anesteziologa. Metodou volby v endoskopické léčbě ezofageálních nebo gastroezofageálních varixů je endoskopická ligace. V případě, že ligace není možná nebo úspěšná, lze použít intravenózní injekční sklerotizaci polidokanolem. Gastrické varixy jsou ošetřovány intravarikózní aplikací tkáňového lepidla (cyanoakrylát) (14). V případě, že ani po adekvátním endoskopickém ošetření nebylo dosaženo zástavy krvácení z esofageálních varixů nebo došlo k jeho časné recidivě, je indikována mechanická tamponáda. Použití balonkové tamponády (nejčastěji Blakemore‑Sengstakenovy sondy) bylo na většině pracovišť nahrazeno zavedením celopovlečeného teflonového Danišova stentu. Další možnou metodou je akutní TIPS, který vede k okamžitému poklesu portosystémového gradientu a tím k zástavě krvácení a snížení rizika jeho recidivy (15).
Podpořeno grantem KNL VR 180310.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Karel Dvořák, Ph.D.
Oddělení gastroenterologie a hepatologie, Krajská nemocnice Liberec, a. s. Husova 399/10, 460 01 Liberec
Cit. zkr: Vnitř Lék 2022;68(1):19-25
Článek přijat redakcí: 23. 12. 2021
Článek přijat po recenzích: 10. 1. 2022
Sources
1. Tsochatzis E A, J Bosch, and A K Burroughs. Liver cirrhosis. Lancet, 2014;383(9930):1749 - 1761.
2. de Franchis R, and V F Baveno. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol, 2010;53(4):762-768.
3. European Association for the Study of the Liver. Electronic address, e.e.e. and L. European Association for the Study of the, EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol, 2018;69(2):406-460.
4. Rose C F et al. Hepatic encephalopathy: Novel insights into classification, pathophysiology and therapy. J Hepatol,2020;73(6):1526-1547.
5. Cordoba J et al. Characteristics, risk factors, and mortality of cirrhotic patients hospitalized for hepatic encephalopathy with and without acute‑on ‑ chronic liver failure (ACLF). J Hepatol,2014;60(2):275-281.
6. Ge P S, B A Runyon. Treatment of Patients with Cirrhosis. N Engl J Med,2016;375(21): 2104-2105.
7. Gluud L L, H Vilstrup and M Y Morgan. Non‑absorbable disaccharides versus placebo/ no intervention and lactulose versus lactitol for the prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev,2016;(5):CD003044.
8. Cannon M D, P Martin and A F Carrion. Bacterial Infection in Patients with Cirrhosis: Don’t Get Bugged to Death. Dig Dis Sci,2020;65(1):31-37.
9. Mattos A A et al. Spontaneous bacterial peritonitis and extraperitoneal infections in patients with cirrhosis. Ann Hepatol,2020;19(5):451-457.
10. Státní ústav pro kontrolu léčiv. Fluorochinolonová antibiotika – omezení používání potvrzeno. Státní ústav pro kontrolu léčiv [online]. Copyright © 2018 [cit. 09. 12. 2021]. Dostupné z: https://www.sukl.cz/fluorochinolonova‑antibiotika‑omezeni‑pouzivani‑potvrzeno
11. European medicines agency. Disabling and potentially permanent side effects lead to suspension or restrictions of quinolone and fluoroquinolon antibiotics. European medicines agency [online]. Copyright © 2019 [cit. 09. 12. 2021]. Dostupné z: https://www.ema.europa. eu/en/documents/referral/quinolone‑fluoroquinolone‑article - 31-referral‑disabling‑potentially‑permanent‑side‑effects‑lead_ en.pdf
12. Bonkat G. EAU guidelines on urological infections. European association of urology [online]. Copyright © 2021 [cit. 09. 12. 2021]. Dostupné z: https://uroweb.org/guideline/ urological‑infections/
13. de Franchis R, Baveno VIF: Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol 2015;63(3):743-752.
14. Karstensen JG, Ebigbo A, Bhat P et al. Endoscopic treatment of variceal upper gastrointestinal bleeding: European Society of Gastrointestinal Endoscopy (ESGE) Cascade Guideline. Endosc Int Open 2020;8(7):E990-E997.
15. Fejfar T, Vaňásek T, Brůha R et al. Léčba krvácení v důsledku portální hypertenze při jaterní cirhóze - aktualizace doporučených postupů ČHS ČLS JEP. Gastroenterol Hepatol 2017,71(2):105-116.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 1-
All articles in this issue
- Ohlédnutí za XXVIII. kongresem ČIS ČLS JEP
- How to run an internal medicine department: head physician – trainer
- Operating a modern performance-oriented internal medicine outpatient unit
- A cirrhotic patient in an internal medicine ward
- Direct costs in patients with nonvalvular atrial fibrillation newly indicated to apixaban: a retrospective‑ prospective single‑ arm cohort study
- Recommendations of the European Society of Hypertension for measuring blood pressure in the medical office and outside the medical facility
- Multicentric Castleman’s disease. Symptoms, diagnostics and therapy
- Cholesterol measurement and current guidelines
- Differential diagnosis of pituitary enlargement
- Advances of the contemporary treatment of hypertension and hypercholesterolemia by a new fixed combination
- Levotyroxin
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A cirrhotic patient in an internal medicine ward
- Cholesterol measurement and current guidelines
- Differential diagnosis of pituitary enlargement
- Levotyroxin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

