-
Medical journals
- Career
Cílené a biologické léky v léčbě zánětlivých revmatických onemocnění
Authors: Karel Pavelka
Authors‘ workplace: Revmatologický ústav, Praha
Published in: Vnitř Lék 2021; 67(4): 195-200
Category: Main Topic
Overview
Cílem přehledové práce je poskytnout přehled o současně v Česku registrovaných biologických a cílených lécích pro léčbu zánětlivých revmatických onemocnění. Konkrétně je podán přehled o léčbě revmatoidní artritidy (RA), ankylozující spondylitidy (AS) a psoriatické artritidy (PsA).
V indikaci RA je v současné době registrováno 5 anti TNF léků a dále 4 biologické léky s jiným mechanismem účinku (abatacept, rituximab, 2 IL-6 inhibitory). V posledních 2 letech pak vstoupily do klinické praxe léčby RA inhibitory januskináz (JAK), konkrétně tofacitinib, baricitinib, upadacitinib a filgotinib. Jde o malé molekuly nebiologického původu, které vstupují do buňky a blokují signální transdukci. Indikací k biologické či cílené léčbě RA je selhání konvenční léčby a minimálně střední či vysoká aktivita RA. Pro léčbu spondyloartritid je indikováno 5 anti TNF preparátů. Mají prokazatelně stejnou účinnost s výjimkou etanerceptu, který není účinný na současně přítomný idiopatický střevní zánět. Nově byly zavedeny do léčby axiální spondyloartritidy inhibitory IL-17 secukinumab a ixekizumab. Jejich účinnost na pohybový systém je podobná jako anti TNF, jsou účinnější v léčbě psoriázy. Pro léčbu psoriatické artritidy byly zavedeny inhibitory TNF, dále pak léky modulující osu 12/23 (IL-12/23) a inhibitory interleukinu 17. Dále se při léčbě PsA používají cílené syntetické léky, a to inhibitor fosfodiesterázy 4 – apremilast, který má ale slabší účinnost, a nově se zavádí inhibitor JAK1-3 tofacitinib.
Jednotlivé kapitoly jsou doplněny o základní bezpečnostní rizika těchto léků a principy monitorování bezpečnosti léčby.
Klíčová slova:
cílená a biologická léčba – ankylozující spondylitida – revmatoidní artritida – psoriatická artritida – inhibitory JAK
Úvod
Základním pilířem léčby zánětlivých revmatických onemocnění se staly tzv. chorobu modifikující léky, které jsou českým překladem anglického disease modifying antirheumatic drugs (DMARDs). České zkratky se příliš neujaly, a proto se rozšířila zkratka DMARDs. Podle původu se DMARDs dělí na biologická (bDMARDs) a na syntetická DMARDs. Aby se rozlišily starší necílené preparáty, jako je např. methotrexát (MTX), od nových cílených, jako jsou např. inhibitory Janusových kináz, vytvořily se kategorie konvenčních (conventional) DMARDs pod zkratkou csDMARDs a cílených/targeted DMARDs pod zkratkou tsDMARDs (Obr. 1). Tento úvod jsem zařadil také proto, protože v nomenklatuře vidíme někdy rozdíly v literatuře onkologické a revmatologické. V onkologii se totiž často používá výraz cílená biologická léčba, protože každá biologická léčba cílí na určitý cíl (buňku, receptor, cytokin). Stejné platí i pro některé malé molekuly používané v revmatologii, které však nejsou biologického původu, ale vznikly chemickou syntézou.
Image 1. Rozdělení registrovaných chorobu-modifikujících léků (DMARD) pro revmatoidní artritidu 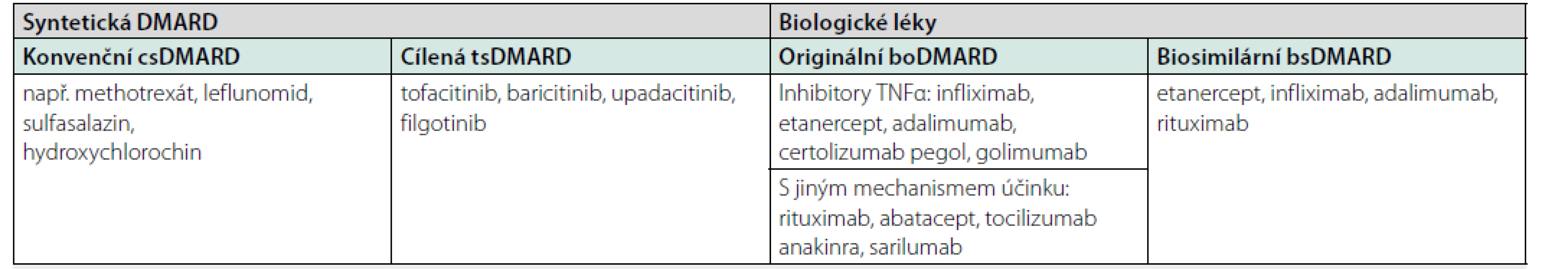
TNFα: tumor nekrotizující faktor alfa
Vysvětlení zkratek vycházejících z anglické nomenklatury: DMARD – disease-modifying antirheumatic drugs, csDMARD – conventional synthetic DMARD, tsDMARD – targeted synthetic DMARD, boDMARD – biological original DMARD, bsDMARD – biosimilar DMARD.
Upraveno podle: Smolen JS, van der Heijde D, Machold KP et al. Proposal for a new nomenclature of disease-modifying antirheumatic drugs. Ann Rheum Dis. 2014; 73: 3–5.V další části textu by bylo možné pokračovat podle jednotlivých preparátů nebo podle jednotlivých diagnóz. Zvolil jsem nakonec druhou variantu, která je pro tento typ publikace a předpokládanou čtenářskou obec asi vhodnější.
Revmatoidní artritida
Účinnost biologických léků
Revmatoidní artritida (RA) je nejčastějším zánětlivým revmatickým onemocněním, které postihuje asi 1 % populace a je zatížena vysokou morbiditou, disabilitou, zhoršením kvality života, ale i zkrácením střední délky života (1). Většinou má progresivní charakter a pacienti jsou léčeni kombinací léků, kam řadíme glukokortikoidy, csDMARDs, bDMARDs nebo tsDMARDs, nesteroidními antirevmatiky a dalšími pomocnými léky, jako jsou analgetika, antidepresiva, antiporotika a inhibitory protonové pumpy. Základním pilířem léčby jsou však DMARDs. Tato by se měla podávat u všech aktivních forem RA, časně, dlouhodobě a v kombinacích. Lékem první volby je stále MTX (2). Pokud není v prvním kroku léčby vhodný, je možné použít jiná csDMARDs (sulfasalazin, leflunomid, antimalarika).
Podle Doporučení EULAR (3) i České revmatologické společnosti (ČRS) (4) se doporučuje v prvním kroku kombinovat metotrexát s glukokortikoidy (obrázek 2a, b, c). Strategie léčby by se měla řídit konceptem Léčba k cíli (5), tzn. dosáhnout určitého cíle léčby nejpozději po 6 měsících, přičemž patrné zlepšení by mělo být již po 3 měsících léčby. Pokud není cíle dosaženo a jsou přítomny rizikové faktory ve smyslu rychlejší progrese onemocnění, měla by být aplikována biologická nebo cílená léčba. V dnes již historických doporučeních byla uváděna jako prahová hodnota pro biologickou léčbu hodnota DAS 28 > 5,1, později se ukázalo, že je nutné léčit již pacienty se střední aktivitou, tzn. s hodnotou DAS 28 v rozmezí 3,2–5,1. Důvodů je více. Bylo totiž prokázáno, že pacienti s dlouhodobou střední aktivitou onemocnění nadále progredují a zhoršují se i funkčně. Druhým argumentem je i fakt, že u pacientů se střední aktivitou se častěji dosáhne cíle léčby, tzn. stavu nízké aktivity nebo remise, jak potvrzují i naše poslední výsledky z národního registru biologické léčby ATTRA (6). Anti TNF léky působí rychle, robustně a dlouhodobě. Kromě symptomatického účinku, tzn. potlačení bolesti a ztuhlosti, zlepšují i funkci, kvalitu života a zpomalují rentgenovou progresi onemocnění (7). Lékem první volby zatím v oblasti biologických DMARDs zůstávají anti TNF preparáty a preparáty s jiným mechanismem účinku (rituximab, IL-6 inhibitory, abatacept) zůstávají léky druhé volby po selhání anti TNF. Výjimkou jsou situace, kdy je anti TNF nevhodný a kdy je možné použít lék druhé linie již v linii první (příkladem je situace, kdy má pacient lymfom v anamnéze a je vhodnější aplikovat rituximab). Dlouhodobého dobrého efektu je dosaženo asi u 70 % pacientů, ale u 30 % není dosaženo cíle léčby a mluvíme o tzv. „selhání“. Toto selhání je buď primární, tzn. že není vůbec dosaženo cíle léčby, anebo je sekundární, kdy je sice cíle léčby dosaženo, ale tento efekt je pak ztracen. Důvodů může být více, ale jedním z nich je i tvorba protilátek proti léku, jinými slovy imunogenicita preparátu. Při selhání léčby je vhodné změnit biologický lék a pro tuto změnu se používá v anglické literatuře a stále častěji i v české výraz switch. Zatím nebylo jednoznačně prokázáno, jestli je účinnější switchovat na bDMARDs se stejným mechanismem účinku, nebo s jiným mechanismem účinku (například po selhání anti TNF použít IL-6 inhibitor). Jinou otázkou strategie biologické léčby je otázka, jak postupovat u pacientů, u kterých je dosaženo trvalé remise či stavu nízké aktivity. Výrazem trvalé se myslí nejméně 6 měsíců léčby a nízká aktivita nejméně při dvou vyšetřeních v intervalu 3 měsíců. Při vysazení biologické léčby dochází velmi často ke vzplanutí aktivity, a proto se příliš nedoporučuje. Výhodnější strategií je asi detrakce dávek, čímž myslíme snížení dávky či prodloužení intervalu biologické léčby. Nejméně u poloviny pacientů je možné v této strategii dlouhodobě pokračovat a vede to ke značnému ušetření nákladů, jak například prokázal J. Závada ve své studii z národního registru ATTRA (8). Biologická léčba by měla být vždy, pokud je to možné, podávána v kombinaci s MTX, a u některých preparátů je to dokonce povinnost (infliximab, rituximab, abatacept). Nicméně zkušenosti z evropských registrů ukazují, že asi 1/3 pacientů je na vynucené monoterapii. Určitá data ze studií signalizují, že v případě monoterapie je výhodnější používat inhibitory IL-6 než anti TNF preparáty (9).
Obr. 2a. EULAR doporučený algoritmus léčby revmatoidní artritidy 2016
Smolen J, Ann Rheum Dis 2020; 79: 685–699
EULAR – Evropská liga proti revmatismu Obr. 2b. EULAR doporučený algoritmus léčby revmatoidní artritidy 2016
Smolen J, Ann Rheum Dis 2020; 79: 685–699
EULAR – Evropská liga proti revmatismu Obr. 2c. EULAR doporučený algoritmus léčby revmatoidní artritidy 2016
Smolen J, Ann Rheum Dis 2020; 79: 685–699
EULAR – Evropská liga proti revmatismu Bezpečnost biologických léků
Dvacetiletá zkušenost s biologickými léky již přinesla dostatek bezpečnostních dat. Zatímco zlatým standardem pro průkaz účinnosti biologických léků zůstávají randomizované, placebem kontrolované studie, v oblasti bezpečnosti jsou to pak navíc data z dlouhodobých extenzí těchto studií a především data z registrů, která odrážejí zkušenosti z běžné klinické praxe i neselektované populace.
Biosimilární léky prokázaly v přímých srovnávacích studiích s originálními preparáty stejnou účinnost i stejné bezpečnostní ukazatele.
Bezpečnost anti TNF preparátů
Globálně lze říci, že anti TNF preparáty jsou relativně bezpečné a poměr účinnost/riziko je vysoce kladný. Nicméně se mohou zřídka vyskytnout i závažné nežádoucí účinky. Nejdůležitější potenciální rizika při anti-TNF léčbě zahrnují infekce, malignity, infuzní reakce nebo reakce v místě vpichu, neurologické projevy, indukovaná autoimunitní onemocnění, kardiovaskulární nežádoucí účinky, hematologické projevy a kožní reakce, plicní, případně další komplikace.
Nejčastější je výskyt nezávažných infekcí. Závažné infekce se vyskytují ve 2–4 % a jsou jen mírně častější než u pacientů s RA neléčených anti TNF preparáty. Častější závažné infekce jsou na kůži, měkkých tkáních a kloubech. Obecně je zvýšená tendence ke granulomatózním infekcím, jako je tuberkulóza, listerióza a nokardióza. Anti TNF léčba je spojena s vyšším výskytem tuberkulózy, který se ale velmi liší podle epidemiologické situace v jednotlivých státech. Riziko tuberkulózy je vyšší po monoklonálních protilátkách proti anti TNF než po etanerceptu (10). Riziko vzniku tuberkulózy (ať již reaktivace starého procesu, nebo vznik nové) se podstatně snížilo skrínováním na latentní tuberkulózu. Mírně může být také zvýšena frekvence infekce herpes zoster a pravděpodobná je zvýšená frekvence chronické infekce hepatitidou B. Proto se doporučuje před zahájením léčby vyšetření k vyloučení virové hepatitidy. Nejúčinnější prevencí infekce je očkování a pacientům se doporučuje před zahájením biologické léčby očkování proti pneumokoku, chřipce a u rizikových pacientů proti hepatitidě.
Infuzní a injekční reakce jsou asociovány s imunogenicitou preparátu. Lokální reakce jsou vzácné a většinou nevedou k nutnosti přerušit léčbu. Závažnější infuzní reakce při aplikaci infliximabu se vyskytují v méně než 1 % případů, ale je nutné být na ně připraveni.
Ani dlouhodobá zkušenost z registrů nepotvrdila vyšší výskyt lymfomů ani vyšší výskyt solidních nádorů. Mírně zvýšený je pouze výskyt melanomových a nemelanomových kožních nádorů (11).
Při léčbě anti TNF preparáty mohou vznikat i autoimunitní komplikace a někdy i onemocnění, z nichž nejčastější je léky indukovaný lupus, ale jde o velmi vzácný výskyt, většinou bez závažnější orgánové manifestace (12). Vyskytovat se může i psoriáza.
Výskyt demyelinizačních onemocnění je velmi vzácný, ale existující demyelinizační onemocnění je kontraindikací k zahájení léčby. Diskutována je i kardiovaskulární bezpečnost anti TNF preparátů.
Anti TNF léky mohou zhoršovat kardiální selhávání, a proto jsou kontraindikovány u pacientů s NYHA 3 a 4. Na druhé straně při úspěšné léčbě anti TNF preparáty a snížení aktivity nemoci pravděpodobně dochází ke snížení kardiovaskulárního rizika (infarktu a ischemické choroby srdeční) (13).
Bezpečnost léčby rituximabem
Bezpečnostní profil rituximabu je podobný jako u anti TNF s některými odlišnostmi. Relativně častější jsou infuzní reakce, které se mohou vyskytnout až u 30 % pacientů při prvním podání, jsou však většinou nezávažné, i když zřídka se vyskytují i těžší reakce. Výskyt závažných infekcí po rituximabu je stejný nebo mírně vyšší jako po anti TNF preparátech. Stále je diskutován výskyt infekcí v kontextu dlouho trvající deplece B buněk a imunoglobulinu IgM a IgG. Monitorování hladin imunoglobulinů je stále doporučováno. Není žádná evidence o tom, že by rituximab zvyšoval riziko malignit, a proto se často používá u pacientů s malignitami v anamnéze, kde je anti TNF léčba nevhodná. Byly také popsány případy progresivní multifokální leukoencefalopatie, ale vzácně u pacientů s revmatoidní artritidou, častěji u pacientů onkologické indikace nebo SLE. Rituximab také snižuje účinnost očkování.
Bezpečnost tocilizumabu
Tocilizumab se zpočátku podával převážně v infuzích, vyskytovaly se infuzní reakce. V současné době má většina pacientů subkutánní podávání, kde se mohou občas vyskytnout lokální bolestivé reakce. Tocilizumab může vyvolávat hepatopatie. Byly také popsány perforace střeva při divertikulitidě a divertikulóza je kontraindikací léčby tocilizumabem. Při aplikaci tocilizumabu také dochází ke změnám lipidového spektra a zvýšení celkového cholesterolu, HDL cholesterolu, LDL cholesterolu a triacyglycerolu, přičemž výskyt ve studiích byl 15–24 %. Část pacientů musí být léčena statiny. Prospektivní studie ENTRACTE však zvýšený výskyt kardiovaskulárních komplikací léčby oproti anti TNF léčbě neprokázala (14).
Bezpečnost abataceptu
Abatacept byl rovněž zpočátku aplikován intravenózně a v pozdější době subkutánně, takže lokální reakce jsou možné. Nebyl zaznamenán vyšší výskyt malignit. Některé studie z registrů ukazují mírně snížené riziko závažných infekcí, a proto je abatacept doporučován u pacientů, kteří prodělali závažnou infekci v první linii biologické léčby.
JAK inhibitory
JAK inhibitory vstupují do cytoplazmy buněk a inhibují signální transdukci (Obr. 3). Různé cytokiny se váží na receptory na povrchu buněk a aktivují různé signální dráhy. V patofyziologii RA se uplatňuje celá řada prozánětlivých cytokinů včetně TNF alfa IL-1, IL-6, IL-7, IL-15, IL-17, IL-18, IL-21, IL-23, IL-32, IL-33 a GM-CSF, které fungují tak, že po vazbě na receptor buňky aktivují jeden enzym z rodiny tyrozinkináz JAK 1, JAK 2, JAK 3 a TYK 2. Tyto pak aktivují molekuly STAT, které pak stimulují sekreci genové exprese v jádře. V současné době jsou již v klinické praxi uvedeny 4 inhibitory januskináz nazývané také JAK inhibitory. Někdy se člení na JAK inhibitory první generace, mezi které patří inhibitory JAK 1–3 tofacitinib (15), inhibitor JAK1, JAK 2 baricitinib (16), a dále inhibitory druhé generace, které selektivně inhibují JAK 1, tzn. upadacitinib (17) a filgotinib (18). JAK inhibitory prokázaly velmi dobrou účinnost u celého spektra pacientů s revmatoidní artritidou, tzn. MTX naivních, MTX selhávajících i TNF selhávajících. V komparativních studiích byl tofacitinib (19) a filgotinib (20) nejméně tak účinný jako adalimumab, baricitinib (21) a upadacitinib (22) pak účinnější. Kromě symptomatického účinku také výrazně zpomalují strukturální progresi revmatoidní artritidy.
Obr. 3. Biologie a mechanismus účinku IL-17 inhibitorů
Podle Patel DD et al. Ann Rheum Dis 2013; 72: iii116–123
Postavení JAK inhibitorů v algoritmu léčby RA
Z výše uvedených srovnávacích studií vyplývá, že JAK inhibitory jsou nejméně tak účinné nebo dokonce účinnější než anti TNF léky. V nových Doporučeních EULAR (3) jsou proto kladeny na úroveň biologických léků v první linii biologické či cílené léčby. Zvláště jsou vhodné pro pacienty s vynucenou monoterapií (většinou nesnášenlivostí MTX). Výhodou může být i perorální aplikace, což je důležité zvláště v době covid krize, protože JAK inhibitory lze, na rozdíl od biologických léků, poslat e-receptem. Nevýhody JAK inhibitorů mohou spočívat ve faktu, že je zatím méně dlouhodobých bezpečnostních dat. Problémem může být i vyšší cena.
Bezpečnost JAK inhibitorů
Dosavadní výsledky ukazují, že bezpečnost JAK inhibitorů je srovnatelná s biologickými DMARDs. Frekvence infekcí a závažných infekcí je obdobná. Výjimku představují častější infekce herpes zoster (23). Toto nebezpečí je především u starších pacientů a u pacientů s asijským původem. Některé studie prokázaly zvýšené riziko hluboké žilní trombózy a plicního embolismu a tyto preparáty mají upozornění na riziko u starších pacientů (24). Z laboratorních rizik je nutné upozornit na možné zvýšení lipidů v séru. Určitá opatrnost je doporučena u i pacientů s divertikulózou (25). Nebyl zjištěn zvýšený výskyt nádorů.
Axiální spondyloartritidy
Anti TNF preparáty
Podle nových Doporučení pro klasifikaci spondyloartritid dělíme tato onemocnění na formu axiální, kam řadíme formu ankylozující spondylitidy (AS) a tzv. non-radiografické axiální spondyloartritidy, a na formu převážně periferní, kam patří reaktivní artritida (ReA) a psoriatická artritida (PsA) (26). Na rozdíl od RA je většina tzv. csDMARDs u ax SpA neúčinných, a to včetně metotrexátu (MTX). Určitá evidence je pouze u efektu sulfasalazinu u forem axiálních, které mají částečně i periferní artritidu (27). Neúčinné jsou rovněž systémově podávané glukokortikoidy, které se uplatňují pouze v léčbě lokální.
Proto zavedení anti TNF preparátů do léčby AS v roce 2003 znamenalo revoluci v léčbě tohoto onemocnění (28). Efekt anti TNF léčby u AS je rychlý, robustní a pokrývá celé široké spektrum manifestace AS, tzn. jak symptomy axiální (bolesti v zádech), tak periferní (artritida, entezitida, daktilitida) i extraartikulární manifestace (idiopatické střevní záněty, psoriázu a uveitidu). Účinnost anti TNF preparátů u AS je obdobná, s výjimkou etanerceptu, který není účinný u pacientů s AS a idiopatickým střevním zánětem. Novější studie prokázaly stejně dobrou účinnost anti TNF preparátů u forem radiografických (AS) a tzv. non-radiografických (29). Při léčbě anti TNF preparáty však vznikají i určité problémy. Část pacientů (kolem 30 %) selhává na léčbě a není dosaženo cíle, proto se hledaly i biologické léky s jiným mechanismem účinku a šlo vesměs o preparáty, které byly primárně zkoušeny u revmatoidní artritidy. Všechny studie však byly negativní a žádný z nich se u spondyloartritid neuplatnil (IL-1, IL-6 inhibitory, rituximab, abatacept).
Inhibitory IL-17
Prvními biologickými léky s jiným mechanismem účinku, které prokázaly účinnost u spondyloartritid, byly až inhibitory IL-17 (30) (Obr. 3).
Naše znalosti o důležitosti osy IL-17 / IL-23 se zvýšily po získání experimentálních dat o tom, že hraje klíčovou roli u SpA. Secukinumab je plně humánní, monoklonální protilátka, která blokuje membránově vázaný i volný cytokin IL-17A. Secukinumab je k dispozici ve formě intravenózní nebo subkutánní. Postupem času převládla jednoznačně forma subkutánní. Podává se v týdenních intervalech subkutánně v dávce 150 mg první měsíc v tzv. indukční fázi a v udržovací fázi potom 1× měsíčně. Prokázal výbornou klinickou účinnost na axiální i periferní projevy ax SpA (31). Kromě klinické účinnosti bylo zjištěno i zpomalení strukturální progrese AS (32). Zatím nebyl prokázán příznivý vliv na ovlivnění idiopatických střevních zánětů a dokonce někdy může docházet k jejich zhoršení. Naopak je velmi účinný na psoriázu, a proto je s výhodou podáván u pacientů se spondyloartritidou a psoriázou. Kromě ankylozující spondylitidy byl secukinumab úspěšně aplikován ve dvojslepé studii v léčbě tzv. non-radiografické axiální SpA.
Ixekizumab je monoklonální, humánní protilátka IgG4, která blokuje IL-17A s vysokou vazebnou kapacitou. Inhibice 1L-17 ixekizumabem účinně blokuje artritidu, entezitidu, inhibuje degradaci kloubní chrupavky a subchondrální kosti a potenciálně inhibuje i ektopickou kostní formaci. Ixekizumab byl zkoušen ve třech randomizovaných, kontrolovaných studiích, a to u pacientů s ankylozující spondylitidou naivních na biologickou léčbu (33), pacientů se selháním anti TNF (34) a pacientů s non-radiografickou SpA (35).
Bezpečnost léčby IL-17 inhibitory
Bezpečnost léčby je obdobná jiným biologickým lékům. Některé studie zjistily vyšší výskyt kandidové infekce. Většina z nich byla mírně nebo středně závažných. Byly také zaznamenány exacerbace idiopatických střevních zánětů. Může se také vyskytnout neutropenie.
Strategie léčby biologickými preparáty u axiálních spondyloartritid
K biologické léčbě jsou indikováni pacienti, u kterých dochází k selhání konvenční léčby a kteří mají aktivní onemocnění (Obr. 4). Při volbě prvního biologického léku je možné zvolit buď anti TNF, nebo IL-17 inhibitor. Jelikož nebyly provedeny srovnávací studie, je nutné považovat oba preparáty za rovnocenné. U pacientů s idiopatickými střevními záněty jsou IL-17 inhibitory nevhodné, naopak u pacientů s psoriázou jsou výhodnější IL-17 inhibitory. Po selhání první biologické léčby je vhodné podat v druhé linii druhý biologický lék, přičemž zatím není prokázáno, zdali to má být biologický lék se stejným či jiným mechanismem účinku. I když v teoretické rovině by bylo možné předpokládat výhodnější změnu biologického léku s jiným mechanismem účinku.
Obr. 4. ASAS/EULAR Doporučení pro bDMARD u ax SpA
Van der Heijde D et al. Ann Rheum Dis 2017; 0: 1–14
Psoriatická artritida
Psoriatická artritida (PsA) je chronické, zánětlivé, muskuloskeletální onemocnění asociované s kožní psoriázou. Zahrnuje různé formy od mírných, nedestruktivních, oligoartriálních až po závažné mutující artritidy vedoucí k invaliditě. Výskyt artritidy u pacientů s psoriázou kolísá od 10 % od 42 %, nejčastěji kolem 30 %. Ke klasifikaci a diagnostice PsA se nejčastěji používají kritéria CASPAR (36). Podobně jako další spondyloartritidy má i PsA přítomné časté komorbidity, jako je akutní přední uveitida, idiopatický střevní zánět a častější kardiovaskulární komplikace.
Terapie psoriatické artritidy konvenčními léky
K léčbě psoriatické artritidy se používají nesteroidní antirevmatika, glukokortikoidy, csDMARDs, bDMARDs a tsDMARDs. Mezi konvenční, syntetické, chorobu modifikující léky csDMARDs, které se používají k léčbě PsA, řadíme sulfasalazin, metotrexát a leflunomid. U žádného z uvedených farmak, ale nebyla prokázána možnost zpomalit nebo dokonce zastavit rentgenovou progresi. Podobně u nich nebyla prokázána schopnost ovlivnit entezitidy a axiální syndrom, daktylitidy jen částečně. U všech je třeba zohlednit jejich toxicitu.
Terapie psoriatické artritidy biologickými léky
Biologická léčba psoriatické artritidy bDMARDs zahrnuje především inhibitory TNF, modulaci interleukinu 12/23 (IL-12/23) a inhibitory interleukinu 17 (IL-17i) (Obr. 5).
Obr. 5. Biologická DMARDs v léčbě psoriatické artritidy
Podle: EMA website. European Publis Assessment Reports
Červeně uvedené molekuly zatím nejsou na českém trhu Anti TNF léčba je indikována v případě selhání léčby nižších úrovní, tedy z pravidla konvenčními syntetickými DMARDs v průběhu 3–6 měsíců. Selháním léčby se rozumí nedosažení léčebného cíle, tzn. remise nebo stavu minimální aktivity. Anti TNF jsou účinné i u entezitid a daktylitid (37). Vzhledem k tomu, že chybí doklady o účinnosti csDMARDs u pacientů s tímto typem postižení, může být léčba anti TNF indikována i bez předchozího léčebného pokusu csDMARDs. Na rozdíl od situace u revmatoidní artritidy nejsou žádné doklady o vyšší účinnosti TNF inhibitorů v kombinaci s csDMARDs ve srovnání s TNF v monoterapii. Je tedy otázkou, jak postupovat u pacientů se selháním metotrexátu, zda biologický lék přidat nebo léčbu metotrexátem ukončit a dále postupovat v monoterapii. Přesto, že není doklad o vyšší účinnosti kombinace než monoterapie anti TNF, některé studie ukazují lepší retenci na léku v kombinaci (38).
Modulace interleukinu 12/23
Nadměrná produkce IL-23 je jedním z důležitých patogenetických mechanismů v celé skupině SpA a současně je známa vyšší senzitivita na jeho působení u psoriázy, ale také u AS i u idiopatických střevních zánětů. Dosud jediným preparátem v této skupině je ustekinumab (39).
Ustekinumab
Ustekinumab je plně humánní monoklonální protilátka IgG1κ se specifickou afinitou k podjednotce p40 cytokinů IL-12 a IL-23, kterým tak brání navázat se na receptory exprimované na povrchu imunitních buněk. Podává se v subkutánních injekcích v dávce 45 mg v týdnu 0 a 4 a následně 45 mg po 12 týdnech (40). Ustekinumab byl zkoušen ve dvou randomizovaných klinických studií u PsA v PSUMMIT I a PSUMMIT II. Jeho účinnost na PsA se zdá slabší než u anti TNF a v České republice je zatím hrazen pouze v indikaci psoriázy, nikoliv psoriatické artritidy.
IL-17 inhibitory
Interleukin 17 je prozánětlivý cytokin, který hraje významnou roli v patogenezi psoriázy a psoriatické artritidy. Zvýšená exprese IL-17 byla nalezena jak v synovialis kloubu u pacientů s PsA, tak v synoviálních lézích. Secukinumab byl zkoušen ve studiích FUTURE I a FUTURE II a zlepšil všechny domény „psoriatické nemoci“ včetně kožních, kloubních a extraartikulárních manifestací (41, 42). U více než 80 % pacientů nebyla pozorována žádná rentgenová progrese. Secukinumab byl účinný bez ohledu na současnou léčbu MTX či předchozí léčbu inhibitory TNF. Podává se v dávce 150 mg subkutánně s iniciálním podáním v týdnech 0, 1, 2 a 3, následovaná měsíční udržovací dávkou od týdne 4. U pacientů se současně přítomnou středně těžkou až těžkou ložiskovou psoriázou nebo u pacientů nedostatečně odpovídajících na anti TNF (IR) je doporučená dávka 300 mg se stejným schématem. Každá dávka 300 mg je podána ve dvou dílčích subkutánních injekcích po 150 mg.
Druhým IL-17 inhibitorem registrovaným v indikaci PsA je ixekizumab, což je humanizovaná monoklonální protilátka IL-17. Je vysoce účinný u psoriázy, kde 30–50 % pacientů dosáhne úplného vymizení psoriázy (PASI 100). Výsledky ukazují na dobrou účinnost i u psoriatické artritidy, entezitid a daktylitid (43). Ve srovnání s placebem signifikantně zpomaluje rentgenovou progresi. Podává se v iniciální dávce 160 mg s. c. a dále 80 mg po 4 týdnech. V přímé srovnávací studii proti adalimumabu byl při hodnocení komplexního ukazatele ACR 50 a PASI 100 účinnější než adalimumab (44).
Cílené syntetické chorobu modifikující léky
Apremilast je specifický inhibitor fosfodiesterázy 4, který modeluje expresi prozánětlivých cytokinů prostřednictvím zvýšené hladiny intracelulárního cAMP s následným snížením hladiny TNF, IL-12 a IL-23. V rámci výzkumného projektu PALACE byl zkoušen celkem ve 4 randomizovaných, kontrolovaných studiích v dávce 2 × 30 mg denně. Dobrá odpověď byla na kožní postižení a entezitidy, nebyla ale dobrá pro daktylitidy (45). V současné době je považován za lék méně účinný a jen pro středně těžké formy PsA. Nově byl schválen pro léčbu aktivní PsA tofacitinib (aktuálně zatím bez úhrady) v dávce 2 × 5 mg denně tam, kde nebylo dosaženo dostatečného cíle konvenčními DMARDs nebo kde nebyly tolerovány. Při změně byly prokázány periferní artritidy, entezitidy a daktylitidy. Zároveň došlo k výraznému zlepšení psoriázy. Účinnost byla prokázána až do 30 měsíců podávání (46). Docházelo i ke zpomalení rentgenové progrese. Bezpečnostní profil tofacitinibu u PsA je podobný jako u revmatoidní artritidy (viz výše).
Práce byla podpořena projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 00023728 Revmatologický ústav.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
Na Slupi 4, 128 00 Praha 2 Nové Město
Článek přijat redakcí: 29. 1. 2021
Článek přijat po recenzích: 18. 5. 2021
Sources
Literatura u autora a na www.casopisvnitrnilekarstvi.cz
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 4-
All articles in this issue
- Použití léků vyvinutých pro jiné indikace v léčbě infekce covid-19
- Targeted and biological drugs in the treatment of inflammatory rheumatic diseases
- Treating inflammatory bowel diseases in the 21st century: individualized therapy and telemedicine
- Biologic therapy for dyslipidemia
- Monitoring the dynamics of clinical and laboratory markers of chronic heart failure during 12 months of sacubitril/valsartan treatment
- Importance and efficiency of blood pressure control not only in type 2 diabetes patients
- Giant cell arteritis: controversial issues
- Chronic obstructive pulmonary disease: diagnosis and treatment of stable phase of disease; personalized treatment approach using phenotype features of the disease Summary of the 2020–2021 Czech Pneumological and Phthiseological Society position paper
- Thymoma – disease of many faces
- An effective communication between the physician and the patient in an early intervention of hypertension and dyslipidemia
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chronic obstructive pulmonary disease: diagnosis and treatment of stable phase of disease; personalized treatment approach using phenotype features of the disease Summary of the 2020–2021 Czech Pneumological and Phthiseological Society position paper
- Thymoma – disease of many faces
- Targeted and biological drugs in the treatment of inflammatory rheumatic diseases
- Biologic therapy for dyslipidemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

