-
Medical journals
- Career
Jaké jsou cílové hodnoty krevního tlaku u pacientů s chronickým onemocněním ledvin?
Authors: Ivan Rychlík; Petra Bachroňová; Anna Maršáková; Lidmila Francová; Karolína Krátká
Authors‘ workplace: I. interní klinika 3. LF UK a FN Královské Vinohrady Praha
Published in: Vnitř Lék 2020; 66(3): 200-204
Category:
Overview
Kardiovaskulární (KV) onemocnění zůstávají hlavní příčinou mortality a morbidity u pacientů s i bez chronického onemocnění ledvin (chronic kidney disease – CKD) a hypertenze představuje jeden z jejich rizikových faktorů. Navzdory nedostatku jednoznačných důkazů o tom, že intenzivní snižování krevního tlaku (TK) zlepšuje/udržuje renální funkci, lze souhlasit s doporučeními, která udávají hodnoty TK < 130/80 mm Hg jako cílové u většiny dospělých s CKD s cílem prevence komplikací KV onemocnění. Studie SPRINT ukázala, že intenzivnější kontrola systolického TK snižuje výskyt KV příhod i úmrtnost včetně pacientů s CKD. Na druhou stranu však intenzivní kontrola TK může vést k rychlejšímu poklesu eGFR i výskytu AKI (acute kidney injury). Tyto nežádoucí účinky (NÚ) jsou obvykle reverzibilní, s nízkým výskytem stran jejich absolutního počtu, ale s nejasnou klinickou relevancí, navíc i určitou konsekvencí ekonomických nákladů léčby NÚ. Zejména rizikovou skupinou jsou pacienti se srdečním selháním, s pokročilými stadii CKD a senioři obecně. Lze proto uzavřít, že pozitivní vliv intenzivní kontroly TK ve většině případů převáží nad nežádoucími renálními i ostatními účinky, ale že intenzita léčby hypertenze a cílové hodnoty TK by vždy měly být individualizované a měly by respektovat specifická rizika a přínosy pro daného pacienta.
Klíčová slova:
hypertenze – chronické onemocnění ledvin – krevní tlak
Úvod
Hypertenze je známým rizikovým faktorem kardiovaskulárních (KV) úmrtí stejně jako druhá nejčastější běžná příčina chronického selhání ledvin (end‑stage kidney disease – ESKD) v USA. Snižování systolického krevního tlaku (TK) pod 140 mm Hg, či dokonce pod 130 mm Hg je spojováno s pomalejší progresí chronického onemocnění ledvin (chronic kidney disease – CKD) v celém spektru závažnosti onemocnění ledvin (1). V řadě studií s pacienty s nediabetickou CKD byla testována hypotéza, zda nižší TK tlak je spojen s pomalejší progresí CKD, nicméně všechny byly s negativním výsledkem (2). Výjimku snad tvoří skupina pacientů s proteinurií > 1,0 g/24 h, kde post hoc analýza naznačila pomalejší progresi CKD při dosažení nižších hodnot TK. Jako jediný nežádoucí účinek byla zaznamenána hyperkalemie (3).
V listopadu roku 2017 zveřejnila American College of Cardiology/ American Heart Association (ACC/AHA) nová doporučení (4) snižující cílové hodnoty krevního tlaku (TK) na 130/80 mm Hg prakticky pro všechny dospělé včetně pacientů s chronickou chorobou ledvin (chronic kidney disease – CKD). Tato doporučení byla z velké části založena na výsledcích z Systolic BP Intervention Trial (SPRINT) (5). Cílem následujícího článku je diskutovat, jaké konsekvence tato doporučení přináší pro každodenní klinickou praxi.
Hypertenze a chronické onemocnění ledvin
Kontrola TK je dlouhodobou, zcela zásadní součástí péče o pacienty s CKD. U významné většiny těchto pacientů dojde v průběhu času k rozvoji nerovnováhy sodíku a tlakových mechanismů kontroly TK vedoucích k vyššímu arteriálnímu tlaku, zatímco glomerulární filtrace (glomerular filtration rate – GFR) klesá (6). I mírné zvýšení krevního tlaku vede dlouhodobě k vyšší incidenci ESKD (Obr. 1).
Image 1. Mírné zvýšení krevního tlaku (TK) vede dlouhodobě k vyšší incidenci chronického selhání ledvin (ESKD), zobrazena verze pouze pro muže (podle (29)) 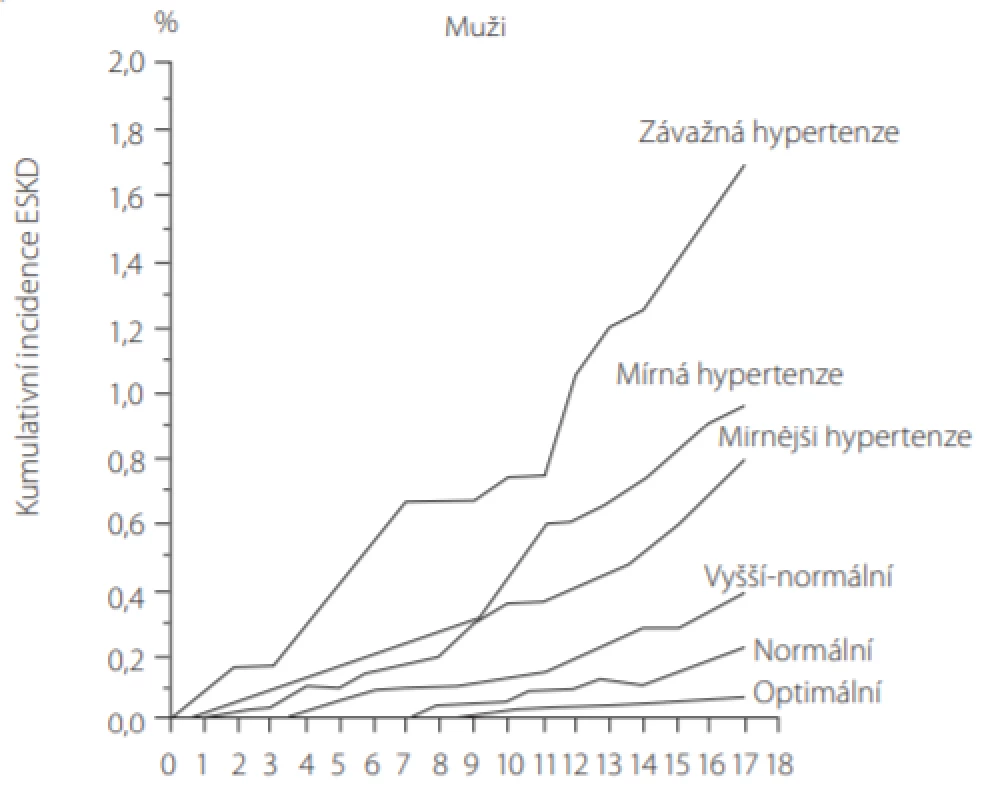
Vyšší TK souvisí s vyšším výskytem klasických kardiovaskulárních (KV) rizikových faktorů běžných u pacientů s CKD i s výskytem dalších, nově identifikovaných rizikových faktorů, které se typicky vyskytují u pacientů s CKD a které dále zvyšují jejich riziko KV příhod na úroveň vyšší, než mají pacienti bez CKD. Rozpoznání tohoto vyššího rizika vedlo v roce 2003 Joint National Committee (JNC) k určení CKD jako KV „risk equivalent“ u manifestních KV onemocnění a empirickému doporučení cílové hodnot TK < 130/80 mm Hg (7). Nicméně optimální cíle léčby TK u pacientů s CKD stále zůstávají kontroverzní.
Vztah mezi TK a KV příhodami u pacientů s CKD je komplexnější a také se může lišit v závislosti na věku pacientů. Několik velkých observačních studií identifikovalo Uči J‑křivky se zvyšující se úmrtností u CKD pacientů, u nichž se systolický TK (TKs) snížil pod < 120 mm Hg a diastolický TK (TKd) klesl pod 60 mm Hg (8). U pacientů starších 75 let se vyšší TKs prakticky vůbec neprojevuje rizikově, neboli nezvyšuje KV riziko (9). Některé léčebně zaměřené studie u pacientů s CKD, včetně studie MDRD (Modification of Diet in Renal Disease) a AASK (African‑American Study of Kidney Disease), cíleně testovaly hypotézu, zda intenzivní snížení TK povede ke zpomalení progrese CKD, resp. rychlosti poklesu GFR. U pacientů bez proteinurie obě studie žádné pozitivní účinky neprokázaly (10, 11). Studie ACCORD (Action to Control Cardiovascular Risk in Diabetes) (12) provedená u pacientů s diabetem s hypertenzí srovnala intenzivní antihypertenzní terapii (s cílovým TKs 120 mm Hg) s konvenční terapií (cílový TKs 140 mm Hg) a rovněž obecně neprokázala pozitivní účinky na výskyt KV příhod či na mortalitu. Naopak, výsledky naznačily, že ošetřující lékaři by měli být opatrní při intenzivním snižování TK, protože může dojít k riziku hypotenze a AKI (acute kidney injury). Tato pozorování vedla výbor JNC 8 v roce 2014 k vyhlášení zvýšení doporučeného (evidence based) cílového TK na 140/90 mm/Hg u pacientů mladších 60 let s CKD (a na 150/90 mm/Hg u starších pacientů) kvůli nedostatku dat potvrzujících benefit z dosažení nižších hodnot TK (13).
Studie Cheunga et al (14) je v současnosti nejrozsáhlejší randomizovanou studií (n = 2 646 subjektů s eGFR mezi 20 a 59 ml/min/1,73 m2 ), která posuzovala různé cílové hodnoty TK na KV a renální výstupy u pacientů s CKD. Studie byla zaměřena na starší pacienty (průměrný věk 71,9 let, 43,9 % starších než 75 let) se zvýšeným KV rizikem, kteří měli TKs v rozmezí mezi 120–180 mm Hg. Nezahrnula ovšem pacienty s diabetem, s proteinurií > 1,0 g/24 h, s polycystickou chorobou ledvin, s předchozí anamnézou iktu, se symptomatickým srdečním selháním nebo s ejekční frakcí < 35 %. Jako cílová hodnota TKs bylo zvoleno 140 mm Hg ve standardně léčené skupině a 120 mm Hg v intenzivně léčené skupině. U obou skupin bylo těchto hodnot rychle dosaženo, přestože počet antihypertenziv byl nízký – průměrně 2,0 léky ve standardní skupině a 2,9 léky u intenzivní skupiny. Studie byla předčasně ukončena z důvodu signifikantně snížené celkové a KV mortality a KV kompozitních výstupů ve skupině s intenzivní léčbou ve srovnání se skupinou se standardní léčbou. Tento pozitivní efekt léčby na úmrtnost byl patrný též u CKD kohorty, když byla posuzována samostatně a ještě více u starších > 75 let. Nicméně, intenzivní snižování TKs bylo spojeno s vyšším rizikem poklesu eGFR o 30 %, což ale nebylo patrné pro ještě výraznější zhoršení eGFR (40% a 50% snížení). K poklesu eGFR došlo brzy po zahájení studie a byl následován nižším průběžným jednoletým úbytkem eGFR v souladu s podobným poklesem u standardní skupiny. Autoři studie se domnívají, že časný úbytek eGFR pravděpodobně odráží funkční nárůst hladiny sérového kreatininu spojovaného s intenzivnější diuretickou terapií a/nebo s blokátory renin‑angiotenzin‑aldosteronového systému. Stran nově vzniklé albuminurie nebyly pozorovány žádné rozdíly. Nikoliv překvapivě, intenzivnější antihypertenzní léčba sice vedla ke snížení TK, ale byla též spojena s nárůstem specifických nežádoucích událostí, konkrétně změn hladiny sérového draslíku (jak ve smyslu hypokalemie, tak ve smyslu hyperkalemie) a akutního selhání ledvin.
Jak tyto závěry interpretovat pro běžnou klinickou praxi? Skutečnost, že žádné podobné pozitivní účinky nebyly pozorovány u diabetiků ve výše zmíněné studii ACCORD, ačkoli měla podobné léčebné cíle, a dokonce měla vyšší výskyt nežádoucích účinků, vedla k určité rezervovanosti v doporučování intenzivní terapie hypertenze. Někteří autoři upozorňují, že studie ACCORD mohla některé aspekty podcenit, zejména z pohledu statistické síly studie nutné k hodnocení signifikance rozdílů mortality (15), protože v obou skupinách byly výsledky víceméně podobné, ale ve skupině s intenzivní léčbou s vyšším výskytem synkop a hypotenze. SPRINT data také potvrzují, že progrese nediabetické CKD s minimální proteinurií se nesnižuje/nezastavuje pouze snížením cílového TK.
Obecně řečeno, výsledky studie SPRINT z podmnožiny populace pacientů s CKD svědčí o pozitivních KV výsledcích díky intenzivnějšímu snižování TKs, je ale nutno zvážit, za jakou cenu. Můžeme konstatovat, že tyto výsledky naznačují, že se konečně blížíme k nalezení rovnováhy, resp. kompromisu, mezi přínosem pozitivních účinků, relativně malých, versus téměř identický výskyt nežádoucích účinků. Dále je i jisté, že současná situace vyžaduje pečlivé společné rozhodování o léčbě mezi lékařem a pacientem.
Cílové hodnoty krevního tlaku a nově vzniklá CKD
U pacientů zařazených do studie SPRINT, kteří vstupně měli normální renální funkci (n = 3 304), vedlo intenzivní snižování TK k 3,5násobně vyšší míře následného výskytu CKD definovaném jako ≥ 30% snížení eGFR pod hranici 60 ml/min/1,73 m2 (16). Současně i nově vzniklá CKD byla výraznější dle intenzity snížení středního arteriálního tlaku (Obr. 2).
Image 2. Nově vzniklá CKD (chronic kidney disease): výraznější snížení středního arteriálního tlaku (mean arterial pressure – MAP) bylo signifikantně asociováno s vyšší incidencí zhoršení funkce ledvin u 3 304 účastníků studie SPRINT, kteří v úvodu studie neměli známky CKD a byli randomizováni do skupiny s intenzivní léčbou TK. Zhoršení funkce ledvin bylo definováno jako 30% snížení eGFR (estimated glomerular filtration rate) pod 60 ml/min/1,73 m2 ve dvou konsekutivních měřeních ve 3měsíčním intervalu (podle (30)) 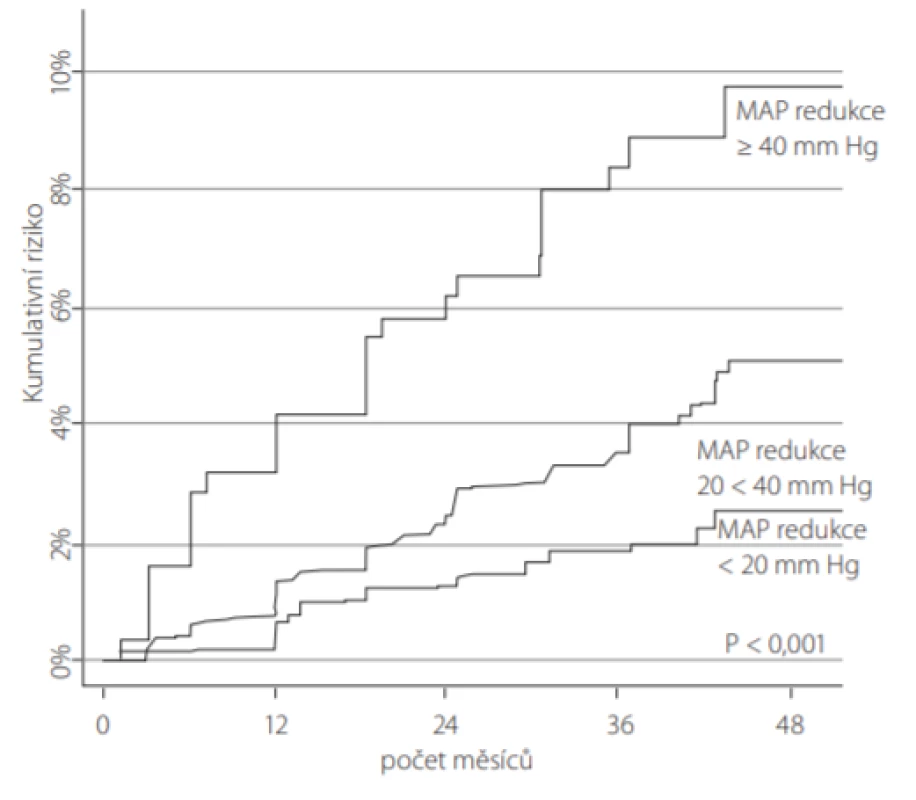
Podobně tomu bylo i ve studii ACCORD BP (Action to Control Cardiovascular Risk in Diabetes BP Trial), kdy ve skupině s intenzivní kontrolou TK mělo více účastníků eGFR < 30 ml/min/1,73 m2 (4,2 % vs. 2,2 %; p < 0,001) (12). Je obtížné určit, zda větší pokles eGFR při intenzivním snížení TK odráží reverzibilní hemodynamický účinek nebo zda vede ke skutečnému zvýšenému výskytu nově vzniklé CKD. Znalosti z fyziologie ledvin nám ukazují, že ačkoliv systolický TK v rozsahu 80–150 mm Hg by měl zachovat stejnou GFR, velké akutní změny v průtoku plazmy ledvinami mohou být spojovány s akutními změnami autoregulace ledvin a následné změny průtoku plazmy, a tedy i GFR (17). Navíc, nejčastěji užívaná antihypertenziva jsou blokátory renin‑angiotenzinového systému a diuretika, která sama o sobě mohou přispět k výraznému poklesu GFR.
Ze 140 pacientů studie SPRINT, u nichž se ve skupině s intenzivní kontrolou TK rozvinulo CKD, u 25 % z nich došlo k takovému následnému zlepšení eGFR, že dokonce již dále ani nesplňovali definici výskytu CKD. Současně u žádného z nich nedošlo k rozvoji ESKD v období follow‑upu s mediánem sledování 3,3 roku (16). Ve studii ACCORD (12) se výskyt ESKD nelišil napříč randomizovanými skupinami (2,5 % vs. 2,4 %; p < 0,93).
Cílové hodnoty krevního tlaku a progrese CKD
Studie The Modification of Diet in Renal Disease (MDRD) Study (18) a African American Study of Kidney Disease and Hypertension (AASK) (19) cílily léčbu na střední arteriální tlak ≤ 92 mm Hg (ekvivalentní TK asi 125/75 mm Hg), resp. 102–107 mm Hg (140/90 mm Hg). Ani jedna z nich neprokázala pozitivní účinky intenzivní kontroly TK na progresi CKD v průběhu trvání studie, avšak při prodloužení follow‑upu se ukázalo, že intenzivnější kontrola TK se pojila s nižším výskytem ESKD ve studii MDRD a v případě studie AASK došlo u pacientů s proteinurií k nižšímu výskytu kompozitního endpointu (definovaného jako vznik ESKD, zdvojení sérového kreatininu či úmrtí). Metaanalýza zahrnující tyto dvě i jiné studie došla k závěru, že u pacientů s CKD a proteinurií může intenzivnější kontrola TK zpomalit progresi CKD (20). Tento závěr byl v souladu s doporučeními Kidney Disease Improving Global Outcomes guidelines z roku 2012, které u pacientů s proteinurií doporučily cílovou hladinu TK < 130/80 mm Hg.
Mezi pacienty zařazenými do studie SPRINT se vstupně přítomnou CKD (stadium 3–5, celkem 2 646 pacientů) došlo u skupiny s intenzivní kontrolou TK k vyššímu poklesu eGFR (-0,47 vs. -0,32 ml/min/1,73 m2 /rok) (Obr. 3), ale žádné rozdíly nebyly pozorovány u výskytů ≤ 30%, 40% nebo 50% poklesu eGFR mezi randomizovanými skupinami. Tyto výsledky tedy nenaznačují žádné dlouhodobé poškození ledvin způsobené intenzivním snižováním TK, ale zároveň neukazují na zřejmé pozitivní účinky ve smyslu zpomalení progrese CKD u pacientů bez klinicky signifikantní proteinurie. Přesto však u pacientů s pokročilým CKD vedlo 20% snížení eGFR vzniklé v rané fázi léčby a následně trvale přítomné, k horšímu renálnímu výstupu, a to bez ohledu na intenzitu snížení BP (21). Tato změna v eGFR může jednoduše odrážet přítomnost závažného primárního aterosklerotického postižení ledvin, což je stav velmi citlivý i na malé intraarteriální změny průtoku, které pak vedou k výrazným změnám eGFR, což není patrné ve velkých studiích (22).
Image 3. Porovnání poklesu eGFR (estimated glomerular filtration rate) v průběhu studie SPRINT ve skupině pacientů se vstupní CKD stadia 3–5 s intenzivní (n = 1 330) vs. standardní (n = 1 316) léčbou TK (podle (14)) 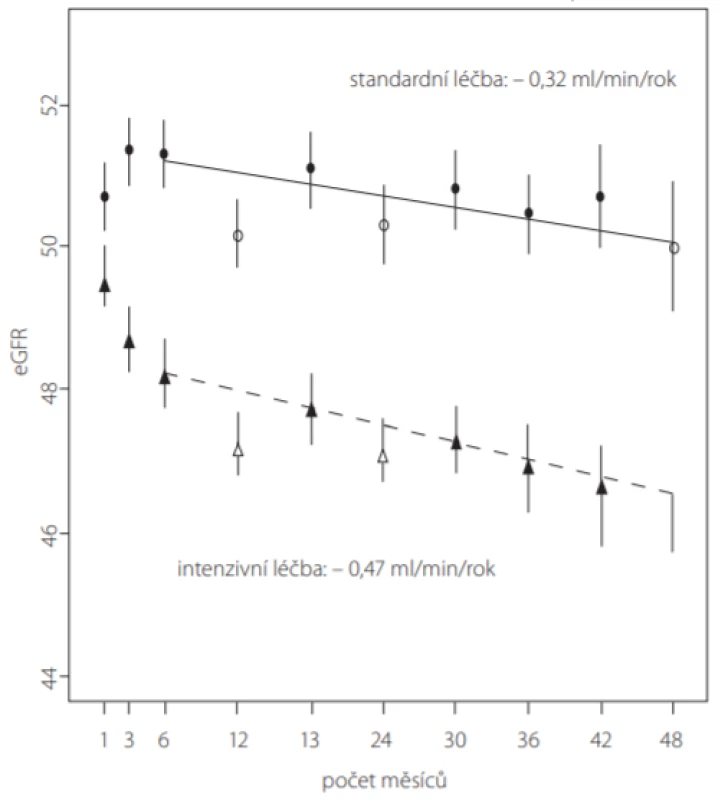
Cílové hodnoty krevního tlaku u pacientů s akutním zhoršením nebo s rychlou deteriorací funkce ledvin
Ve studiích SPRINT (Obr. 4) a ACCORD BP vedlo intenzivní snižování TK k častějším epizodám AKI (acute kidney injury), což je znepokojující vzhledem ke známému sepjetí AKI s obecně nežádoucími událostmi, s delšími pobyty v nemocnici a s vyššími náklady na zdravotní péči (5, 12). Nicméně u 288 pacientů studie SPRINT se vznikem AKI sice většina měla AKI jen mírného stupně a u > 90 % z nich došlo k úplné či částečné reparaci renální funkce, ale ze 14 pacientů s AKI vyžadujícím léčbu hemodialýzou polovina nich potřebovala dialyzační léčbu i po propuštění z nemocnice. Podíl pacientů s nejvážnějšími formami AKI byl však podobný napříč randomizovanými skupinami (23).
Image 4. Kumulativní incidence AKI (acute kidney injury) u pacientů ve studii SPRINT. Srovnání intenzivní (n = 4 683) vs. standardní léčba (n = 4 678). Úroveň ohrožení (hazard ratio) při intenzivní léčbě 1,64 (95 % IS: 1,30–2,1 p < 0,001) (podle (23)) 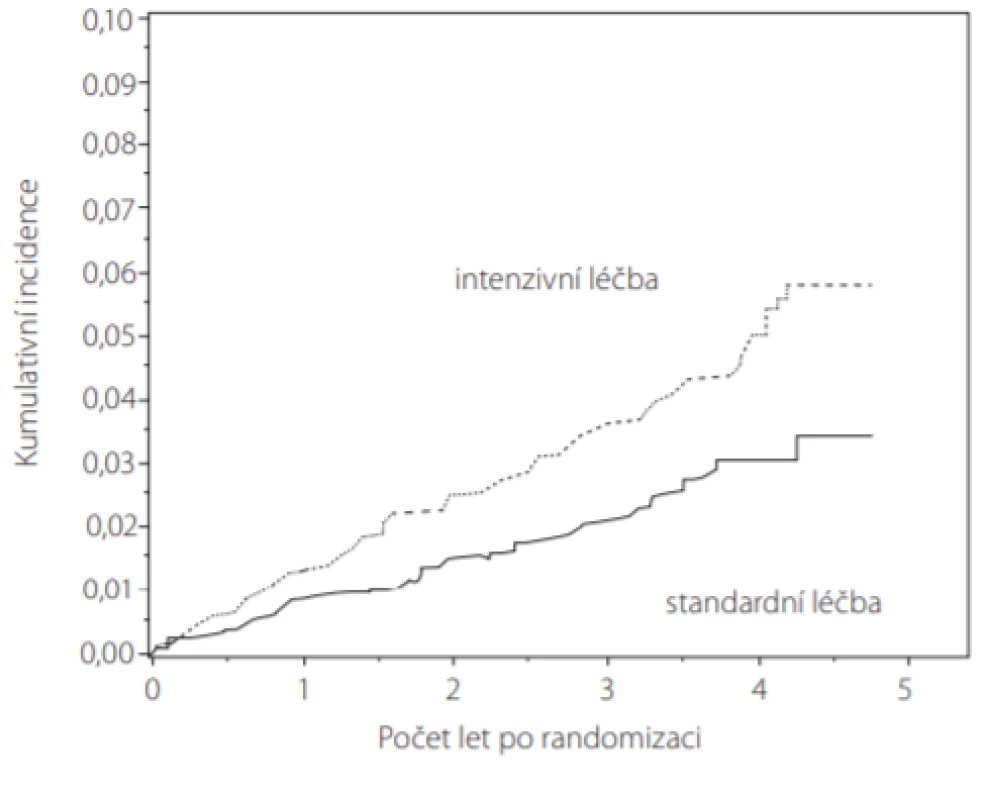
Post‑hoc observační analýza studií AASK a MDRD (24) ukázala, že pacienti s intenzivní léčbou TK skupině s > 20% poklesem eGFR během prvních 3 měsíců měli signifikantně vyšší adjustované riziko rozvoje ESKD ve srovnání s pacienty se standardní léčbou s < 5% poklesem eGFR. Tyto výsledky naznačují, že velké poklesy eGFR během intenzifikace léčby TK mohou signalizovat vyšší riziko budoucí ESKD, ale i to, že volnější limity TK u těchto pacientů snižují toto riziko, je nejisté a může být za cenu vyššího rizika kardiovaskulárních onemocnění.
Nicméně KV onemocnění zůstávají hlavní příčinou mortality a morbidity, a proto by jejich rizikové faktory, zejména nedostatečně kontrolovaný TK, měly být agresivně intervenovány. Někteří výzkumníci (25) se proto domnívají, že pacientům by neměl být takový přístup odepírán kvůli obavám z poklesu eGFR. Uvádějí, že, kromě pacientů hospitalizovaných se srdečním selháním a/nebo s pokročilým stupněm CKD, snižování TK doprovázené > 20% nárůstem sérového kreatininu neovlivňuje signifikantně dlouhodobou funkci ledvin. Navíc zdůrazňují, že profit ze snížení KV rizika významně převažuje nad rizikem progrese CKD.
Závěr
Co vyplývá z výše uvedeného pro klinické lékaře? Navzdory nedostatku jednoznačných důkazů o tom, že intenzivní snižování TK zlepšuje/udr ‑ žuje renální funkci, lze souhlasit s ACC/AHA doporučeními, která udávají hodnoty TK < 130/80 mm Hg jako cílové u většiny dospělých s CKD s cílem prevence výskytu/komplikací kardiovaskulárních onemocnění. Pacienti s CKD mají větší riziko kardiovaskulárních příhod a studie SPRINT společně s několika dalšími (26) ukázala, že intenzivnější kontrola systolického TK snižuje výskyt kardiovaskulárních příhod i úmrtnost včetně pacientů s CKD. Ačkoliv intenzivní kontrola TK může vést k mírně rychlejšímu poklesu eGFR i výskytu AKI, tyto nežádoucí účinky jsou často reverzibilní, s nízkým výskytem stran jejich absolutního počtu a s nejasnou klinickou relevancí. Proto lze konstatovat, že pozitivní vliv intenzivní kontroly TK ve většině případů převáží nad nežádoucími renálními i ostatními účinky (Obr. 5). Optimální frekvence monitorace funkce ledvin se stále diskutuje, ale častější kontroly krátce po zavedení intenzifikace antihypertenzního režimu nebo po poklesu eGFR jsou žádoucí.
Image 5. Pozitiva vs. negativa při intenzivní kontrole krevního tlaku (TK) musí být zvážena u každého pacienta individuálně. I když intenzivnější kontrola TK může snížit počet kardiovaskulárních (KV) příhod a úmrtí, musí být tato pozitiva korelována ve vztahu k vyššímu riziku možných nežádoucích účinků, jako je synkopa, hypotenze, AKI (acute kidney injury) nebo elektrolytové poruchy. Intenzivní snížení TK také zpravidla vyžaduje kombinaci více antihyperteziv, což může komplikovat adherenci nemocného a zvýšit nároky na zdravotní péči, např. častější návštěvy ošetřujících lékařů. Vztah intenzivní kontroly TK a jeho dlouhodobé účinky na funkci ledvin zůstává zatím neznámý (podle (27)) 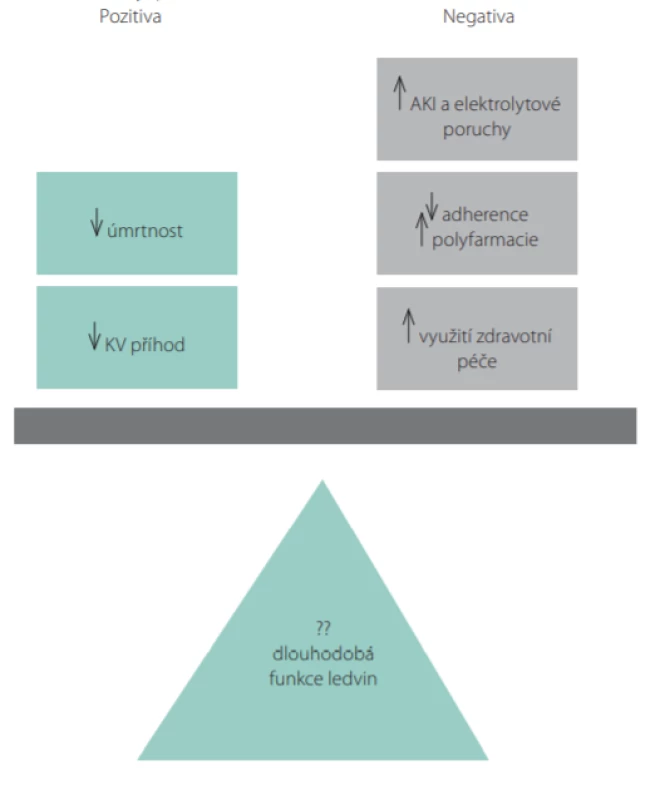
Navzdory těmto všeobecným doporučením je nutné zmínit i několik důležitých varování (27). Všechny dosud provedené studie s cílem snížit TK vyloučily pacienty s pokročilými stadii CKD (stadium 4 a 5), a proto optimální cílové hodnoty TK u těchto pacientů zůstávají stále neurčené. Studie SPRINT vyloučila pacienty s těžkou proteinurií či s diabetes mellitus, avšak analýzy z ostatních studií podporují cílení TK na hodnoty < 130/80 mm Hg. Toto doporučení platí u nediabetických pacientů s proteinurií s cílem renoprotekce, i když à priori nebyla vyslovena žádná hypotéza, proč by tento závěr neměl platit i pro pacienty s diabetes mellitus, alespoň s ohledem na jejich kardiovaskulární onemocnění. Ačkoliv studie ACCORD BP neprokázala pozitivní účinek intenzivní kontroly TK, bylo dosažení sledovaných příhod (endpointů) nižší, než se očekávalo, což na druhou stranu mohlo snížit statistickou sílu studie.
Metody měření TK v kontextu klinických studií často referují nižší hodnoty TK, než jsou obvyklé při měření v běžné klinické praxi. Je proto zřejmé, že snahy o zlepšení validity měření TK v běžné praxi jsou nutné. Cílení léčby na TK < 130/80 mm Hg raději než na systolický TK < 120 mm Hg poskytuje určitý „polštář“ (buffer) při aplikování závěrů studií do rutinní klinické praxe. Navíc doporučení nemohou vždy držet krok s aktuálními vědeckými poznatky, protože výsledky budoucích studií vždy přinesou nová data a informace ke zvážení, podobně jako tomu recentně bylo u výsledků kognitivních funkcí ve studii SPRINT (28).
Konečně, jako vždy, intenzita léčby hypertenze a cílové hodnoty TK by vždy měly být individualizované a měly by respektovat specifická rizika a přínosy pro daného pacienta.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Ivan Rychlík, CSc., FASN, FERA,
I. interní klinika 3. LF UK a FN Královské Vinohrady,
Šrobárova 50,
100 34 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(3): 200–204
Článek přijat redakcí: 17. 2. 2019
Článek přijat k publikaci: 15. 11. 2019
Sources
1. Xie X, Atkins E, Lv J, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: Updated systematic review and meta‑analysis. Lancet 2016; 387 : 435–443.
2. Upadhyay A, Earley A, Haynes SM, et al. Systematic review: Blood pressure target in chronic kidney disease and proteinuria as an effect modifier. Ann Intern Med 2011; 154 : 541–548.
3. Lazich I, Bakris GL Prediction and management of hyperkalemia across the spectrum of chronic kidney disease. Semin Nephrol 2014; 34 : 333–339.
4. Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/ APhA/ASH/ ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2018; 71: e127–e248.
5. Wright jr. JT, Williamson JD, Whelton PK, et al. SPRINT Research Group: A randomized trial of intensive versus standard blood‑pressure control. N Engl J Med 2015; 373 : 2103–2116.
6. Go AS, Chertow GM, Fan D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351 : 1296–1305.
7. Chobanian AV, Bakris GL, Black HR, et al. Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. National Heart, Lung, and Blood Institute; National High Blood Pressure Education Program Coordinating Committee: Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension 2003; 42 : 1206–1252.
8. Weiss JW, Peters D, Yang X, et al. Systolic BP and mortality in older adults with CKD. Clin J Am Soc Nephrol 2015; 10 : 1553–1559.
9. Kovesdy CP, Alrifai A, Gosmanova EO, et al. Age and outcomes associated with BP in patients with incident CKD. Clin J Am Soc Nephrol 2016; 11 : 821–831.
10. Klahr S, Levey AS, Beck GJ, e al. Modification of Diet in Renal Disease Study Group: The effects of dietary protein restriction and blood‑pressure control on the progression of chronic renal disease. N Engl J Med 1994; 330 : 877–884.
11. Wright jr. JT, Bakris G, Greene T, et al. Effect of blood pressure lowering and antihypertensive drug class on progression of hypertensive kidney disease: Results from the AASK trial. JAMA 2002; 288 : 2421–2431.
12. Cushman WC, Evans GW, Byington RP, et al. ACCORD Study Group: Effects of intensive blood‑pressure control in type 2 diabetes mellitus. N Engl J Med 2010; 362 : 1575–1585.
13. James PA, Oparil S, Carter BL, et al. 2014 evidence‑based guideline for the management of high blood pressure in adults: Report from the panel members appointed to the Eighth Joint National Committee (JNC 8). JAMA 2014; 311 : 507–520.
14. Cheung AK, Rahman M, Reboussin DM, et al. Effects of intensive BP control in CKD. J Am Soc Nephrol 2017; 28 : 2812–2823.
15. Perkovic V, Rodgers A. Redefining blood‑pressure targets–SPRINT starts the marathon. N Engl J Med 2015; 373 : 2175–2178.
16. Beddhu S, Rocco MV, Toto R, et al. SPRINT Research Group: Effects of intensive systolic blood pressure control on kidney and cardiovascular outcomes in persons without kidney disease: A secondary analysis of a randomized trial. Ann Intern Med 2017; 167 : 375–383.
17. Palmer BF Renal dysfunction complicating the treatment of hypertension. N Engl J Med 2002; 347 : 1256–1261.
18. Sarnak MJ, Greene T, Wang X, et al. The effect of a lower target blood pressure on the progression of kidney disease: Long‑term follow‑up of the modification of diet in renal disease study. Ann Intern Med 2005; 142 : 342–351.
19. Appel LJ, Wright jr. JT, Greene T, et al. AASK Collaborative Research Group: Intensive blood‑pressure control in hypertensive chronic kidney disease. N Engl J Med 2010; 363 : 918–929.
20. Lv J, Ehteshami P, Sarnak MJ, et al. Effects of intensive blood pressure lowering on the progression of chronic kidney disease: A systematic review and meta‑analysis. CMAJ 2013; 185 : 949–957.
21. Ku E, Bakris G, Johansen KL, et al. Acute declines in renal function during intensive BP lowering: Implications for future ESRD risk. J Am Soc Nephrol 2017; 28 : 2794–2801.
22. Adams PL, Adams FF, Bell PD, et al. Impaired renal blood flow autoregulation in ischemic acute renal failure. Kidney Int 1980; 18 : 68–76.
23. Rocco MV, Sink KM, Lovato LC, et al. SPRINT Research Group: Effects of intensive blo ‑ od pressure treatment on acute kidney injury events in the systolic blood pressure intervention trial (SPRINT). Am J Kidney Dis 2018; 71 : 352–361.
24. Ku E, Bakris G, Johansen KL, et al. Acute declines in renal function during intensive BP lowering: Implications for future ESRD risk. J Am Soc Nephrol 2017; 28 : 2794–2801.
25. Hala Yamout H, Bakris GL. Consequences of Overinterpreting Serum Creatinine Increases when Achieving BP Reduction. Balancing Risks and Benefits of BP Reduction in Hypertension. Clin J Am Soc Nephrol 2018; 13 : 9–10.
26. Malhotra R, Nguyen HA, Benavente O, et al. Association between more intensive vs less intensive blood pressure lowering and risk of mortality in chronic kidney disease stages 3 to 5: A systematic review and meta‑analysis. JAMA Intern Med 2017; 177 : 1498–1505.
27. Chang TI, Sarnak MJ. Intensive blood pressure targets and kidney diseases. Clin J Am Soc Nephrol 2018; 13 : 1575–1577.
28. Stephen C, Textor SC, Schwartz GL. BP Targets in CKD, Mortality, and SPRINT: What Have We Learned? J Am Soc Nephrol 2017; 28 : 2561–2563.
29. Tozawa M, Iseki K, Iseki C, et al. Blood pressure predicts risk of developing end‑stage renal disease in men and women. Hypertension 2003; 41 : 1341–1345.
30. Magrico R, Bigotte Vieira MB, Viegas Dias CV, et al. BP Reduction, Kidney Function Decline, and Cardiovascular Events in Patients without CKD. Clin J Am Soc Nephrol 2018; 13 : 73–80.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 3-
All articles in this issue
- „All‑in‑one“ koncept funkčně vedené revaskularizace myokardu v katetrizační laboratoři
- Prodlužování agresivní antitrombotické léčby po infarktu myokardu: proč, komu a jakou léčbu vybrat?
- Jsou inhibitory protonové pumpy účinným a bezpečným lékem nejen v profylaxi gastrointestinálního krvácení při antitrombotické léčbě?
- Psychické reakce nemocných na negativní informaci typu: „Máte maligní nemocnění“
- Čo sa skrýva za autoinflamáciou?
- Postižení srdce při hypereozinofilii
- Význam dechových testů k hodnocení jaterních funkcí u pacientů s chronickým onemocněním ledvin
- Adherence k principům kardiovaskulární prevence u osob s vysokým rizikem
- Prvé prípady geneticky potvrdenej kongenitálnej hnačky so stratou chloridov na Slovensku
- Stresová kardiomyopatia vyprovokovaná netypickou situáciou
- Hepatorenální syndrom – update 2020
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- Jaké jsou cílové hodnoty krevního tlaku u pacientů s chronickým onemocněním ledvin?
- Proteinurie z pohledu internisty
- Proteinurie z pohledu internisty
- Euvascor – časná intervence u hypertonika s dyslipidemií, resp. dyslipidemika s hypertenzí (fixní kombinace atorvastatinu a perindoprilu)
- Rivaroxaban ve studii COMPASS
- Arteriální hypertenze a infekce COVID-19: Stručný komentář
- Vnitřní lékařství v době koronavirové
- Vážení a milí čtenáři Vnitřního lékařství,
- Miroslav Souček, Petr Svačina a kolektiv. Vnitřní lékařství v kostce. Grada; Praha 2019; 462 stran; ISBN 978-80-271-2289-9 (print)
- Profesorka MUDr. Sylvie Opatrná, PhD. – in memoriam (1959–2020)
- Distanční léčba diabetu: Co mohou pacient, lékař a sestra zvládnout na dálku?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Čo sa skrýva za autoinflamáciou?
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- Proteinurie z pohledu internisty
- Hepatorenální syndrom – update 2020
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

