-
Medical journals
- Career
Prodlužování agresivní antitrombotické léčby po infarktu myokardu: proč, komu a jakou léčbu vybrat?
Authors: Ivo Varvařovský
Authors‘ workplace: Kardiologické centrum Agel, Pardubice
Published in: Vnitř Lék 2020; 66(3): 160-168
Category: Main Topic
Overview
Prognóza nemocných za rok po prodělaném infarktu myokardu je individuálně velmi rozdílná a vyžaduje pečlivou stratifikaci nemocných. Pro pacienty se zvýšeným ischemickým rizikem dnes máme k dispozici různé možnosti kombinované antitrombotické léčby, která prokazatelně zlepšuje osud těchto pacientů za cenu vyššího rizika krvácení.
Klíčová slova:
protidestičková léčba – antikoagulační léčba – akutní infarkt myokardu
Úvod
Pozornost kardiovaskulárního výzkumu byla v posledních desetiletích zaměřena především do akutní a subakutní fáze akutního infarktu myokardu (STEMI). Zlepšování přednemocniční a nemocniční péče o nemocné s akutním infarktem myokardu vede ke stále se zvětšujícímu počtu nemocných, kteří překonají akutní fázi nemoci a dožívají se poté dalších let. Podle českého Národního registru kardiovaskulárních intervencí (NRKI) byl roční nárůst této populace nemocných v posledním desetiletí relativně stabilní. Ročně se dožívá prvního roku po infarktu myokardu 88,3–89,5 % pacientů (v absolutních počtech přibližně 4450 nemocných při poměrně stabilním počtu kolem 5000 prvních přímých koronárních angioplastik v České republice ročně). Podobný růst populace nemocných s prodělaným infarktem myokardu v anamnéze se týká všech zemí s dobrou úrovní kardiovaskulární péče, a proto se pozornost kardiovaskulárního výzkumu začíná více obracet tímto směrem.
Charakteristika populace nemocných s prodělaným infarktem myokardu
Složení populace nemocných s akutním infarktem myokardu v anamnéze dobře popisují zdravotnické registry (švédský národní SWEDEHEART, celosvětový REACH, japonský OACIS). Nejrozsáhlejší švédský registr ukazuje populaci pacientů ve věku nad 70 let, kteří mají poměrně často i významná přidružená onemocnění (fibrilace síní, onkologická onemocnění). Klinická manifestace aterosklerózy v dalších cévních oblastech postihuje 6 % nemocných, chronická renální insuficience je v této populaci poměrně vzácná. V průběhu dalších let po infarktu se složení této populace mění jen mírně, především vlivem úmrtí nejvíce rizikových a nejstarších pacientů.
Pacienti jsou po prodělaném infarktu myokardu léčeni revaskularizační léčbou a pomocí opatření sekundární prevence aterosklerózy. Ve všech registrech je penetrace revaskularizační léčby lehce nad 50 % nemocných, statiny užívá kolem 80 % pacientů a protidestičkovou monoterapií je léčeno nad 90 % nemocných. Přes tato opatření osud nemocných stále není zcela prostý rizika. Podle retrospektivního švédského registru z let 2006–2011 prodělá další ischemickou příhodu (úmrtí, infarkt myokardu, cévní mozkovou příhodu) v prvním roce po prvním infarktu myokardu 18,3 % nemocných. V následujících 3 letech postihuje nová ischemická příhoda dalších 20 % pacientů (1). Podobná data vyplývají z prospektivní observační studie REACH (Obr. 1), kdy nejvyšší riziko ischemických příhod je v prvním roce po infarktu myokardu, ale jen o málo menší riziko je stále přítomno i v následujících 3 letech (2). Z obou velkých registrů je přesvědčivě patrné, že riziko další ischemické příhody je sice nejvyšší v prvním roce po infarktu myokardu, ale zůstává velmi vysoké i v následujících letech.
Image 1. Ischemické příhody v dalších letech po infarktu myokardu podle registru REACH (2) 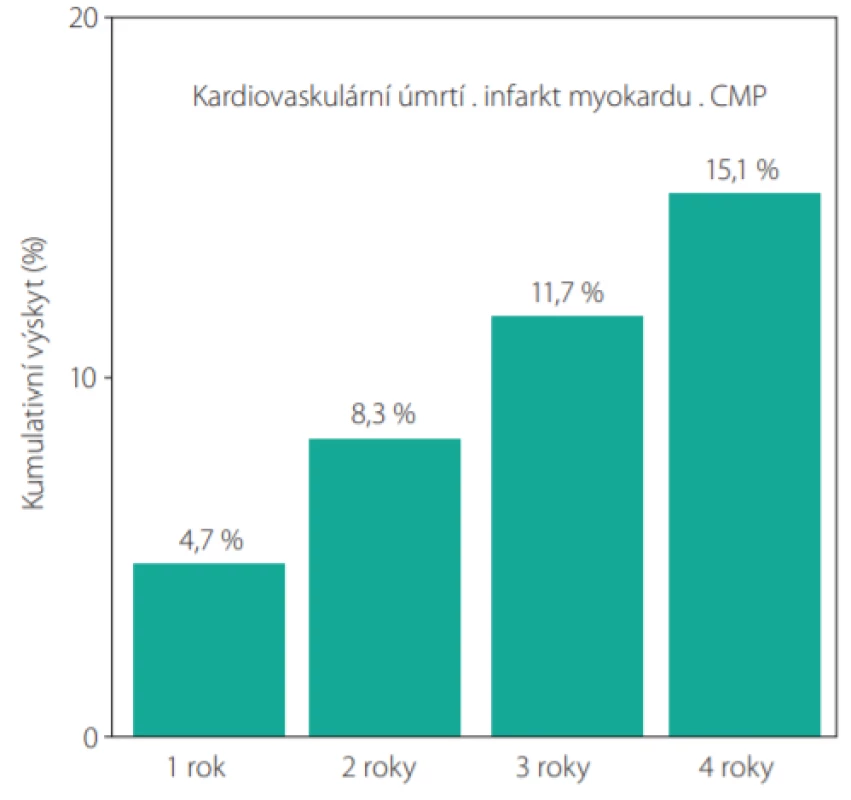
Nejvýraznějším rizikovým faktorem pro prodělání další ischemické příhody je věk nemocného. S každým prodělaným rokem života narůstá pravděpodobnost další ischemické příhody po infarktu myokardu o 2 %. Revaskularizační léčba snižuje významně pravděpodobnost další koronární příhody. Pacienti léčení při infarktu přímou PCI mají pravděpodobnost opakování infarktu v prvním roce přibližně stejnou pro původní stenózu („culprit lesion“, CL) i pro jinou koronární stenózu („non‑culprit lesion“, NCL). V dalších letech ale výrazně narůstá pravděpodobnost infarktu, který vznikne na stenózách neošetřených PCI. Samotná stenóza ošetřená přímou PCI má pravděpodobnost dalšího infarktu poloviční ve srovnání s neošetřenými stenózami (Obr. 2).
Image 2. Riziko dalšího infarktu myokardu ve stenózách ošetřených a neošetřených PCI (3) 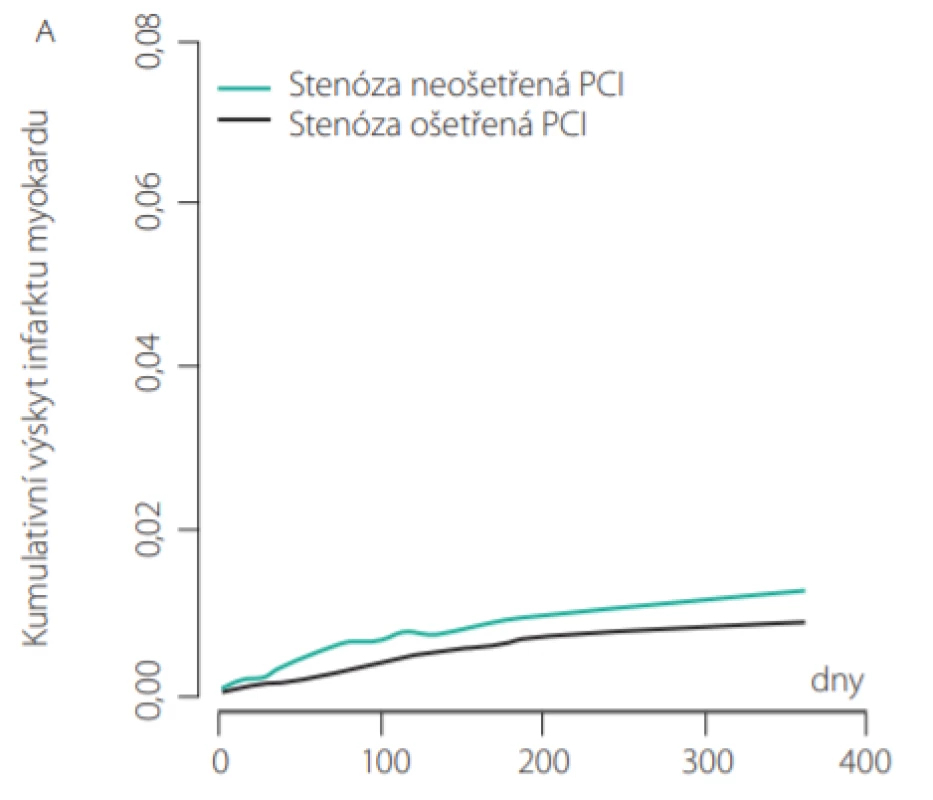
Jako další rizikový faktory nepříznivého průběhu u pacienta po infarktu myokardu byly v registrech identifikovány diabetes mellitus (zvýšení rizika o 38–100 %), srdeční selhání (o 68–93 %), další infarkt myokardu v anamnéze (o 31–76 %) a klinická manifestace aterosklerózy v jiném cévním povodí (ischemická choroba dolních končetin, ischemická cévní příhoda mozková).
Dlouhodobý osud nemocných po prodělaném infarktu myokardu při využití současných léčebných možností tedy není zcela dobrý. Jsme však schopni identifikovat rizikové faktory, které zásadně zvyšují pravděpodobnost opakování ischemické příhody. Je zcela oprávněné, hledat další způsoby ke zlepšení prognózy této populace nemocných. Jednou z cest může být prodloužení antitrombotické léčby a zvýšení její agresivity.
Prodloužení duální protidestičkové léčby (DAPT) nad 12 měsíců: kyselina acetylsalicylová (ASA) a thienopyridiny
Studie CHARISMA byla prvním pokusem prokázat přínos takové strategie. Zařazováni byli nemocní s prodělaným kardiovaskulárním onemocněním nebo s kumulací rizikových faktorů aterosklerózy. Po dobu 28 měsíců byli léčeni buď samotnou monoterapií kyselinou acetylsalicylovou (ASA) nebo duální protidestičkovou léčbou ASA s klopidogrelem. Pokud byli DAPT léčeni pacienti pouze s rizikovými faktory aterosklerózy bez prodělaného kardiovaskulárního onemocnění, byla léčba škodlivá (5). Pokud však byla DAPT použita u nemocných s prodělaným infarktem myokardu, dokázala významně zlepšit další průběh onemocnění (6). Pacienti měli v době randomizace průměrnou dobu od infarktu myokardu 23 měsíců. Riziko úmrtí, infarktu myokardu a cévní mozkové příhody bylo u takových nemocných významně sníženo při dlouhodobé DAPT ve srovnání s ASA (6,6 % vs. 8,3 %, HR=0,77; 95% CI 0,61–0,98), riziko vážného krvácení bylo srovnatelné (Obr. 3).
Image 3. Vliv DAPT (klopidogrel + ASA) na riziko dalších ischemických příhod u pacientů po infarktu myokardu ve studii CHARISMA (6) 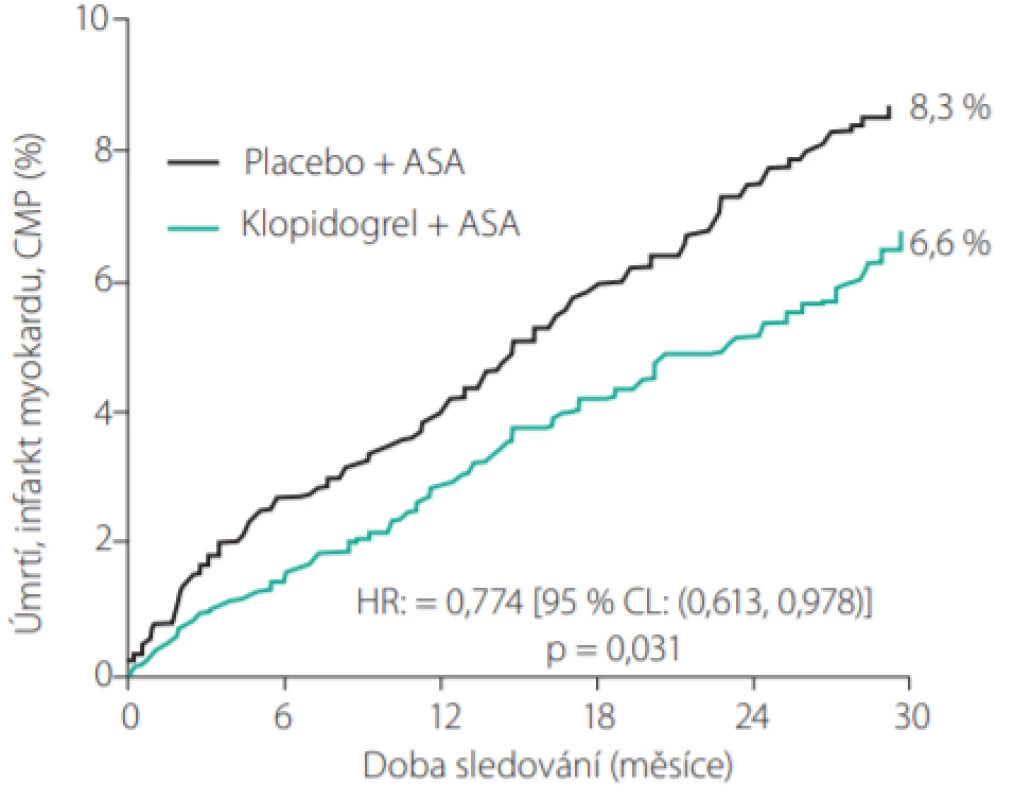
Pacienti s ischemickou chorobou srdeční, kteří ale neprodělali infarkt myokardu, neměli z přidání klopidogrelu k ASA žádný prospěch – jejich osud z hlediska ischemických příhod byl stejný jako při monoterapii kyselinou acetylsalicylovou.
Celkový rozsah aterosklerózy hrál ve studii CHARISMA významnou roli. Pokud měli pacienti postiženu více než jednu cévní oblast (byla‑li navíc přítomna ischemická choroba dolních končetin nebo prodělaná cévní příhoda mozková), prospěch z DAPT byl výrazně větší (10,6 % vs. 18,5 %, HR = 0,55; 95% CI 0,33–0,91). Poprvé zde tak byl popsán fenomén většího přínosu agresivnější antitrombotické léčby při větším rozsahu klinicky manifestního aterosklerotického postižení.
Prasugrel má silnější a lépe předpověditelný protidestičkový účinek než clopidogrel. Při použití revaskularizační léčby byl prasugrel účinnější než clopidogrel v prevenci ischemických příhod v prvních 12 měsících po infarktu myokardu. Avšak srovnání léčby prasugrelem a klopidogrelem po dobu 30 měsíců u nemocných po akutní koronární příhodě bez revaskularizační léčby ve studii TRILOGY ukázalo prakticky srovnatelné klinické výsledky. Přestože po roce od ACS začalo být pozorováno numericky méně ischemických příhod při léčbě prasugrelem, rozdíl nedosáhl ani v dalším roce statistické významnosti. Riziko ischemické příhody (HR = 0,96; 95% CI 0,86–1,07) i riziko vážného krvácení (HR = 1,23; 95% CI 0,84–1,81) tak byly po dvou letech od infarktu myokardu prakticky srovnatelné. Dlouhodobá DAPT (delší 12 měsíců) po prodělaném infarktu myokardu je tedy stejně účinná i bezpečná při použití klopidogrelu i prasugrelu (7).
Prodloužení DAPT nad 12 měsíců: kyselina acetylsalicylová a tikagrelor
Tikagrelor byl pro indikaci dlouhodobé DAPT testován ve studii PEGASUS‑TIMI 54, která cíleně zařazovala pouze nemocné 1–3 roky po prodělaném infarktu myokardu (8). Kromě prodělaného infarktu myokardu bylo pro zařazení potřeba dalšího rizikového faktoru, za který byl pro účely studie považován věk nad 65 let, léčený diabetes mellitus, další prodělaný infarkt v anamnéze, postižení více koronárních tepen nebo chronická renální insuficience s glomerulární filtrací (GF) pod 60 ml./min. Nebyli zařazováni nemocní se zvýšeným rizikem krvácení (trvalá antikoagulační terapie, krvácení z trávicího traktu v posledních 6 měsících, jakákoliv cévní mozková příhoda v anamnéze). Takto vybraní nemocní byli kromě trvalé léčby kyselinou acetylsalicylovou 75–150 mg denně léčeni dále třemi způsoby: placebem, tikagrelorem 2× 90 mg denně nebo tikagrelorem 2× 60 mg denně.
Jako nejvýhodnější dlouhodobá strategie u rizikových nemocných po prodělané koronární příhodě se ukázala léčba nižší dávkou tikagreloru ve spojení s kyselinou acetylsalicylovou. Proti standardní monoterapii ASA bylo prokazatelné snížení všech ischemických příhod o 16 %, dalších infarktů myokardu o 16 % a cévních mozkových příhod o 25 %. Za tento prospěch byla zaplacena daň více než dvojnásobného rizika závažných krvácení, ale nedošlo ke zvýšení krvácení intrakraniálních, ani ke zvýšení krvácení fatálních. Při léčení 10000 nemocných po dobu 1 roku tak zabráníme 42 ischemickým příhodám za cenu vyvolání 31 závažných krvácení. Pokud však nepřerušíme léčbu inhibitory P2Y12 za 12 měsíců po infarktu, a ihned pokračujeme léčbou tikagrelorem, potom při stejném riziku krvácivých příhod dosáhneme zásadně vyšší antiischemické účinnosti (7,7 % vs. 9,9 %, HR = 0,73; 95% CI 0,61–0,87). Pokud je léčba tikagrelorem zahájena více než rok po skončení DAPT (tedy více než 2 roky po prodělaném infarktu myokardu), potom již není prokazatelný žádný prospěch (9). Nepřerušené pokračování v DAPT tikagrelorem ve 12. měsíci po infarktu myokardu se navíc odrazí nejen ve větším snížení všech ischemických příhod, ale odrazí se i ve snížení kardiovaskulární a dokonce i celkové mortality – celková mortalita je snížena o 20 %, kardiovaskulární mortalita dokonce o 29 % (10). Zvláštní prospěch potom mají pacienti se sníženou renální funkcí a pacienti s onemocněním periferních tepen (PAD): díky zachované relativní redukci rizika dochází u těchto pacientů k vysokému absolutnímu snížení ischemických příhod. Pacienti s renální insuficiencí mají absolutní pokles ischemických příhod o 2,7 %, zatímco absolutní zvýšení rizika vážných krvácení zůstává stejné jako u ostatních pacientů ve studii (11). Nemocní s PAD mají absolutní pokles rizika ischemických příhod dokonce o 4,1 %, přitom ale nárůst vážných krvácení proti placebu je minimální a činí pouze 0,12 %. K zamezení jedné ischemické příhody tak stačí léčit pouze 25 nemocných, zatímco jednu vážnou krvácivou příhodu navíc u těchto nemocných vyvoláme až při léčení 834 nemocných (12). Evropské doporučené postupy reflektují výsledky této studie a doporučují kombinaci ASA a 2× 60 mg tikagreloru rizikovým nemocným po infarktu myokardu, kteří dobře tolerovali roční DAPT bez krvácivých komplikací (13, 14).
Kombinace antikoagulační a protidestičkové léčby
Myšlenka kombinování protidestičkové a antikoagulační léčby pochází již z konce minulého století. Ve studii WARIS II byli randomizovaně hodnoceni nemocní léčení za 6 týdnů po prodělaném infarktu myokardu warfarinem, kyselinou acetylsalicylovou nebo kombinací obou léků (15). Mortalita všech postupů byla srovnatelná, warfarin byl účinnější kyseliny acetylsalicylové ve snížení rizika infarktu myokardu i cévní příhody mozkové. Kombinace ASA s warfarinem dále snižovala riziko infarktu myokardu, ne však už riziko cévní mozkové příhody. Pravděpodobnost vážného krvácení byla nejmenší při monoterapii ASA, warfarin i kombinace warfarinu s ASA potom zvyšovaly riziko vážného krvácení čtyřnásobně (0,17 % ročně při ASA, 0,68 % při warfarinu a 0,57 % při kombinaci ASA s warfarinem; počet léčených nemocných na vyvolání jednoho vážného krvácení (NNH) byl pro warfarin 200 a pro kombinovanou léčbu 250). Monoterapie warfarinem však měla cílové rozpětí INR 2,8–4,2 (průměr ve studii 2,8), kombinovaná léčba potom INR 2,0–2,5 (průměrné INR ve studii 2,2). Zdá se tedy, že zásadní vliv na riziko krvácení má spíše intenzita antikoagulační léčby než kombinace s kyselinou acetylsalicylovou. Celková mortalita zůstávala přitom nezměněná, kombinace warfarinu s ASA však snižovala u pacientů bez revaskularizační léčby riziko dalšího infarktu myokardu i cévní příhody mozkové o polovinu (16). S rozvojem intervenční léčby akutních koronárních syndromů a s nástupem duální protidestičkové léčby však kombinace antikoagulační léčby s ASA ustoupila načas stranou.
Perorální antikoagulační léky nezávislé na vitaminu K (NOAC) ukázaly při léčbě pacientů s fibrilací síní minimálně stejnou účinnost jako warfarin v ochraně před trombotickými komplikacemi, zároveň ale dokázaly významně snížit výskyt vážných krvácivých komplikací. Záhy po tomto průkazu byly všechny testovány v léčbě nemocných po prodělaném akutním koronárním syndromu s nadějí, že nižší krvácivé riziko umožní bezpečnější kombinaci s protidestičkovou léčbou. Nabízela by se tím možnost využít antiischemický potenciál kombinované antikoagulační a protidestičkové léčby bez podstatného zvýšení rizika krvácení.
Ukázalo se však, že kombinace obvyklých dávek NOAC s protidestičkovou léčbou je spojena s velmi vysokým rizikem vážných krvácení, ať už jde o kombinaci s protidestičkovou monoterapií nebo s DAPT. Pro vysoký výskyt krvácení bylo v indikaci sekundární prevence ACS ukončeno testování dabigatranu ve fázi II po studii RE‑DEEM (17). Standardní dávky apixabanu byly klinicky testovány ve studii APPRAISE-2, avšak došlo pouze k nárůstu vážných krvácení bez pozorovatelného snížení rizika ischemických příhod (18).
Při hledání optimální dávky rivaroxabanu do kombinace s DAPT se ve studii fáze II ATLAS ACS‑TIMI 46 zdály nadějné spíše nižší dávky léku. Ve studii fáze III ATLAS ACS‑TIMI 51 tak byly zvoleny dávky 2× 5 mg a 2× 2,5 mg rivaroxabanu (19). Přidání velmi nízké dávky rivaroxabanu (2× 2,5mg) k DAPT vedlo k zajímavým výsledkům: primární ukazatel kardiovaskulárního úmrtí, infarktu myokardu a cévní mozkové příhody byl v prvním roce po koronární příhodě snížen o významných 16 %, kardiovaskulární mortalita o 34 % a celková mortalita o 32 %. Takového výsledku bylo dosaženo za cenu trojnásobného zvýšení rizika vážných (1,8 % vs. 0,6 %, HR = 3,46; 95% CI 2,08–5,77) a mozkových krvácení (0,4 % vs. 0,2 %, HR = 2,83; 95% CI 1,02–7,86). Dávka 2× 5 mg rivaroxabanu byla vyřazena z dalšího zkoumání, protože vedla k vyššímu nárůstu vážných krvácení a neměla přitom žádný přínos z hlediska celkové či kardiovaskulární mortality. Je potřeba mít na paměti, že do této studie ke kombinaci s DAPT byli velmi pečlivě vybíráni pacienti s nižším rizikem krvácení (průměrný věk pacientů byl pouze 61 roků a vyloučeni byli nemocní s anémií, chronickou renální insuficiencí, po jakékoliv předchozí mozkové příhodě nebo při krvácení z trávicího traktu v posledních 12 měsících). Kombinace nízkých dávek rivaroxabanu a DAPT se potom jako léčebná možnost objevila pouze v evropských doporučených postupech pro léčbu ACS z roku 2015, avšak nebyla nikdy součástí doporučení amerických.
Nadějné výsledky velmi nízkých dávek rivaroxabanu v prvním roce po ACS („vaskulární dávka“) vedly k dalšímu testování v sekundární prevenci aterosklerózy. Do studie COMPASS byli zařazováni již nemocní ve stabilní fázi onemocnění koronárních nebo periferních tepen (20). Průměrná doba od infarktu myokardu do zařazení pacienta byla 7,1 roku a pouze 5 % nemocných bylo léčeno do 12 měsíců od koronární příhody. Efekt léčby pro skupinu nemocných do 2 let od infarktu myokardu byl na hranici statistické významnosti (primární ukazatel KV úmrtí, infarktu myokardu a cévní mozkové příhody: rivaroxaban 2× 2,5 mg + ASA 49.1218, monoterapie ASA 67.1205; HR = 0,70; 95% CI 0,48–1,01). Statisticky ale nebyla pozorována významná interakce mezi dobou od infarktu myokardu a výslednou účinností či bezpečností léčby. Protože celkové výsledky studie COMPASS byly robustní (prokazatelná účinnost nízkých dávek rivaroxabanu pro snížení celkové mortality, kardiovaskulární mortality, rizika cévní mozkové příhody, rizika amputace končetiny) při dobré bezpečnosti léčby (zvýšení vážných krvácení o 70 % bez zvýšení krvácení fatálních a intrakraniálních), bude jistě zvažována léčba nízkými dávkami rivaroxabanu i v sekundární prevenci akutních koronárních syndromů.
Jak dál po 12 měsících od akutního koronárního syndromu: protidestičková monoterapie, prodloužená DAPT, nízké dávky rivaroxabanu s ASA?
Pokud pacient dobře toleroval 12měsíční DAPT a pokud jeho ischemické riziko hodnotíme jako zvýšené, budeme vystaveni otázce o způsobu dalšího pokračování antitrombotické léčby. Prvním krokem nutně musí být identifikace pacienta, který z prodloužení léčby bude mít prospěch – tedy takového pacienta, kde prodloužením léčby dokážeme ischemické riziko snížit a zároveň ho neohrozíme zvýšeným rizikem krvácení.
Doporučené postupy pro duální protidestičkovou léčbu (2017) předkládají pro rozhodnutí o prodloužení léčby skórovací systém, který vychází se stejnojmenné stude DAPT (Obr. 4). Výhodou tohoto systému je, že při rozhodování o prodloužení DAPT slučuje údaje o ischemickém i krvácivém riziku konkrétního pacienta. Podle tohoto systému mladší pacienti profitují z prodloužení více, zatímco starší potřebují větší kumulaci ischemického rizika pro dosažení prospěchu z prodloužení léčby. Limitující pro používání tohoto skórovacího systému je ale skutečnost, že DAPT studie zahrnovala pacienty ošetřené PCI (tedy nemocné stabilní i nemocné s ACS), používala pro dlouhodobou léčbu prasugrel a klopidogrel, a prospěch z léčby nebyl prokazatelný při použití lékových stentů II. generace. Použití skórovacího systému DAPT pro všechny nemocné rok po infarktu myokardu je tak nutno považovat za problematické (13).
Image 4. Skórovací systém DAPT (13) 
Pro rozhodování může být prospěšnější klinická úvaha, která vychází z výše uvedených klinických registrů. Hlavním rizikovým faktorem dalšího průběhu po 1 roce od infarktu myokardu je vždy věk, následovaný neprovedenou nebo neúplnou revaskularizační léčbou. Další rizikové faktory následují s proměnlivou silou, ale vždy je za ně možné považovat přítomnost diabetes mellitus, srdečního selhávání, dalšího předchozího infarktu myokardu, manifestaci extrakoronární aterosklerózy nebo cévní příhody mozkové.
Třetí možností při hledání rizikového pacienta je použít vstupních kriterií studií, které prokázaly prospěch z prodloužení intenzivní antitrombotické léčby. Studie PEGASUS‑TIMI 54 byla zaměřena na rizikové pacienty 1–3 roky po prodělaném infarktu myokardu, studie COMPASS na široké spektrum stabilních nemocných s koronární i extrakoronární aterosklerózou. Zatímco vstupní kritéria se zásadně lišila a vytvořila rozdílné populace nemocných, vylučující kriteria byla až na drobné detaily prakticky shodná.
Pokud tedy shledáme ischemické riziko pacienta při ukončování 12měsíční DAPT za nízké, budeme pokračovat protidestičkovou monoterapií (kyselina acetylsalicylová nebo inhibitor P2Y12). Pokud budeme další ischemické riziko hodnotit jako zvýšené, nabízí se dnes dvě možnosti pokračování: prodloužená duální protidestičková léčba (ASA + 2× 60mg tikagrelor, alternativně při nesnášenlivosti léčby prasugrel nebo klopidogrel) nebo kombinace ASA + 2× 2,5mg rivaroxabanu. Pro každý z obou postupů existují dobré argumenty a rozhodnutí je v tuto chvíli na uvážení lékaře.
Podle evropských doporučení pro léčbu stabilních pacientů s ICHS z roku 2019 jsou všechny uvedené postupy postaveny na stejnou úroveň (21). Tato doporučení vychází z klinicky jednoduché stratifikace pacientů podle rizika ischémie a krvácení (Tab. 1). Síla doporučení pro dlouhodobou kombinovanou antitrombotickou léčbu pacientů s vysokým rizikem IIa A, pro léčbu pacientů se středním ischemickým rizikem IIb A.
Table 1. Léky indikované pro prodlouženou antitrombotickou léčbu (uvedený lék + kyselina acetylsalicylová 100 mg denně) u nemocných se stabilní ICHS a se středně vysokým nebo vysokým rizikem ischemie při nepřítomnosti vysokého rizika krvácení (21) 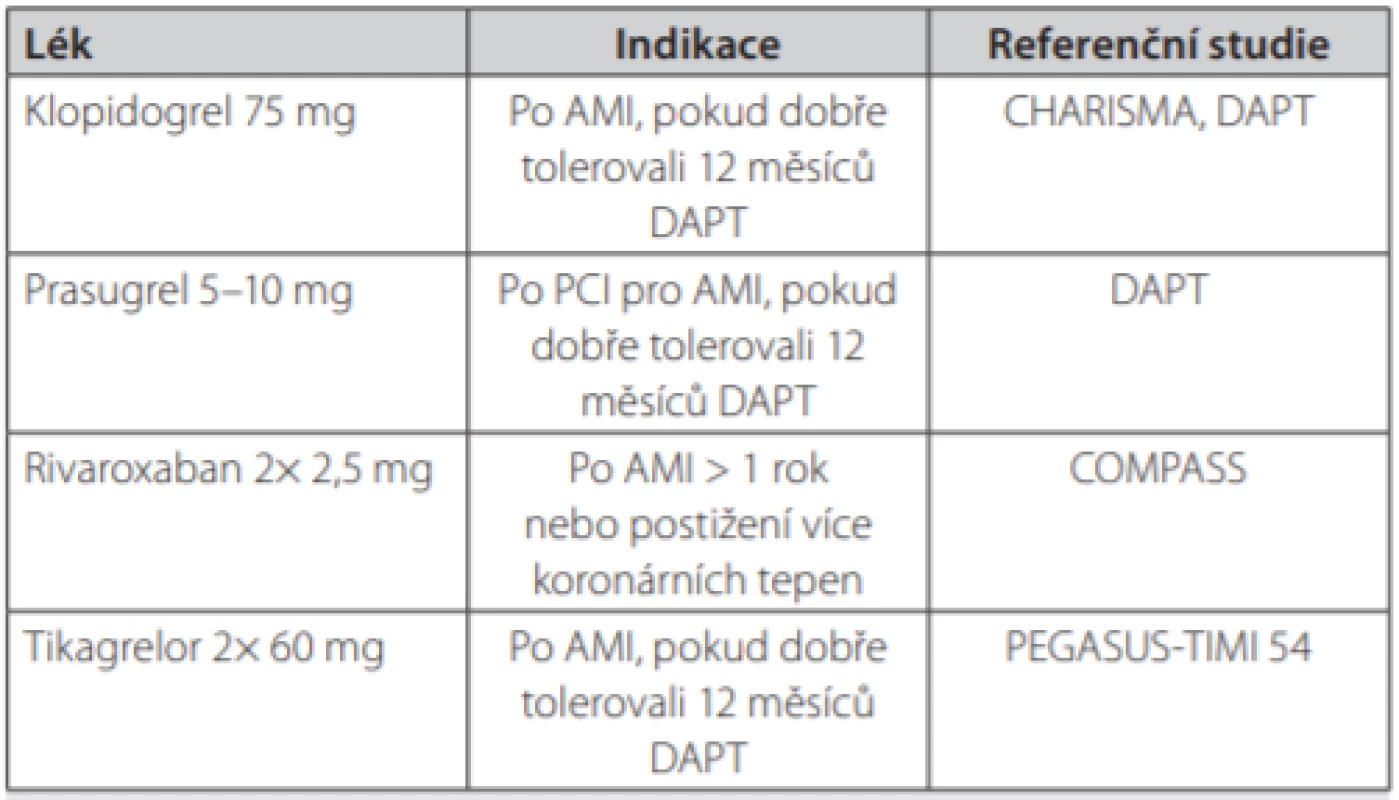
AMI – akutní infarkt myokardu; DAPT – duální protidestičková léčba Závěr
Díky kvalitní přednemocniční a nemocniční léčbě akutního infarktu myokardu se stále více nemocných dožívá přechodu do stabilní fáze ischemické choroby srdeční. Rok po infarktu myokardu zpravidla končí období podávání duální protidestičkové léčby. Osud jednotlivých pacientů je však velmi rozdílný a je potřeba odlišit nemocné s nízkým rizikem další ischemické příhody od pacientů s rizikem vysokým. Tato základní stratifikace potom rozhoduje o strategii další antitrombotické léčby: protidestičkové monoterapii pro nemocné s nízkým rizikem nebo o dlouhodobé kombinované antitrombotické léčbě pro nemocné s vyšším ischemickým rizikem. Volba mezi dlouhodobou DAPT (ASA + nízké dávky tikagreloru) nebo mezi dlouhodobou kombinací protidestičkové a antikoagulační léčby (ASA + nízké dávky rivaroxabanu) vyžaduje individuální posouzení. Klinická situace roz ‑ hodování ve 12. měsíci po infarktu myokardu je totožná se zadáním studie PEGASUS‑TIMI 54 a tato skutečnost mluví pro upřednostnění léčby aspirin + 2× 60 mg tikagreloru. Zadání studie COMPASS mířilo více do stabilního období déle po infarktu myokardu, a protože data ze studie PEGASUS‑TIMI 54 prokazují prospěch léčby po dobu 3 let, bude někde v této době okamžik ke zvážení přechodu z tikagreloru na léčbu nízkou dávkou rivaroxabanu. Pokud bude léčba tikagrelorem ve 12. měsíci ukončena a po několika měsících budeme hodnotit riziko pacienta jako zvýšené, potom již prospěšnější bude zahájit přímo léčbu ASA + rivaroxaban (léčba tikagrelorem v takové situaci již má malý prospěch). Oba způsoby léčby ukazují vynikající výsledky u podskupin nemocných s dalším onemocněním periferních tepen a s renální insuficiencí, proto tato kritéria nebudou ve 12. měsíci pro volbu rozhodující. Léčba nízkou dávkou rivaroxabanu bude ve 12. měsíci po infarktu myokardu upřednostněna i u nemalé skupiny nemocných, kteří netolerují pro dušnost léčbu tikagrelorem. Realita používání jednotlivých léčebným režimů bude jistě v průběhu času ovlivňována i úhradovými podmínkami plátců zdravotního pojištění.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Ivo Varvařovský, Ph. D.,
Kardiologické centrum Agel,
Kyjevská 44,
532 03 Pardubice
Cit. zkr: Vnitř Lék 2020; 66(3): 160–168
Článek přijat redakcí: 19. 2. 2020
Článek přijat k publikaci: 28. 2. 2020
Sources
1. Jernberg T, Hasvold P, Henriksson M. Cardiovascular risk in post‑myocardial infarction patients: nationwide real world data demonstrate the importance of a long‑term perspective. Eur Heart J 2015; 36 : 1163–1170.
2. Abtan J, Bhatt DL, Elbez Y. Residual ischemic risk and its determinants in patients with previous myocardial infarction and without prior stroke or TIA: insights from the REACH registry. Clin Cardiol 2016; 39 : 670–607.
3. Varenhorst C, Hasvold P, Johansson S. Culprit and nonculprit recurrent ischemic events in patients with myocardial Infarction: Data from SWEDEHEART. J Am Heart Assoc 2018;7: e007174. DOI: 10.1161.JAHA.117.007174.
4. Nakatani D, Sakata Y, Suna S. Incidence, predictors, and subsequent mortality risk of recurrent myocardial infarction in patients following discharge for acute myocardial infarction. Circ J 2013; 77 : 439–446.
5. Bhatt DL, Fox KA, Hacke W. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354 : 1706–1717.
6. Bhatt DL, Flather MD, Hacke W. Patients with prior myocardial infarction, stroke, or symptomatic peripheral arterial disease in the CHARISMA trial. J Am Coll Cardiol 2007;49 : 1982-8.
7. Roe MT, Armstrong PW, Fox KA. Prasugrel versus clopidogrel for acute coronary syndromes without revascularization. N Engl J Med 2012; 367 : 1297–1309.
8. Bonaca MP, Bhatt DL, Cohen M. Long‑term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015; 372 : 1791–1800.
9. Bonaca MP, Bhatt DL, Steg PG. Ischaemic risk a efficacy of ticagrelor in relation to time from P2Y12 inhibitor withdrawal in patients with prior myocardial infarction: insights from PEGASUS‑TIMI 54. Eur Heart J 2016; 37 : 1133–1142.
10. Dellborg M, Bonaca MP, Storey RF. Efficacy and safety with ticagrelor in patients with prior myocardial infarction in the approved European label: insights from PEGASUS‑TIMI 54. Eur Heart J 2017; 38(suppl): 794–795.
11. Magnani G, Storey RF, Steg PG. Efficacy and safety of ticagrelor for long‑term secondary prevention of atherothrombotic events in relation to renal function: insights from the PEGASUS‑TIMI 54 trial. Eur Heart J 2016; 37 : 400–408.
12. Bonaca MP, Bhatt DL, Storey RF. Ticagrelor in prevention of ischemic events after myocardial infarction in patients with peripheral artery disease. J Am Coll Cardiol 2016; 67 : 719–728.
13. Valgimigli M, Bueno H, Byrne RA. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J 2018; 39 : 213–254.
14. Neumann FJ, Sousa‑Uva M, Ahlsson A. 2018 ESC.EACTS guidelines on myocardial revascularization. Eurointervention 2019; 14 : 1435–1534.
15. Hurlen M, Abdelnoor M, Smith P. Warfarin, aspirin, or both after myocardial infarction. N Engl J Med 2002; 347 : 969–974.
16. Rothberg MB, Celestin C, Fiore LD. Warfarin plus aspirin after myocardial infarction or the acute coronary syndrome: meta‑analysis with estimates of risk and benefit. Ann Intern Med 2005; 143 : 241–250.
17. Oldgren J, Budaj A, Granger CB. Dabigatran vs placebo in patients with acute coronary syndromes on dual antiplatelet therapy: a randomized, double‑blind, phase II trial. Eur Heart J 2011; 32 : 2781–2789.
18. Alexander JH, Lopes RD, James S. Apixaban with antiplatelet therapy after acute coronary syndrome. N Engl J Med 2011; 365 : 699–708.
19. Mega JL, Braunwald E, Wiviott SD. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366 : 9–19.
20. Connolly SJ, Eikelboom JW, Bosch J. Rivaroxaban with or without aspirin in patients with stable coronary artery disease: an international, randomised, double‑blind, placebo‑controlled trial. Lancet 2018; 391 : 205–218.
21. The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2019; doi:10.1093.eurheartj.ehz425.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 3-
All articles in this issue
- „All‑in‑one“ koncept funkčně vedené revaskularizace myokardu v katetrizační laboratoři
- Prodlužování agresivní antitrombotické léčby po infarktu myokardu: proč, komu a jakou léčbu vybrat?
- Jsou inhibitory protonové pumpy účinným a bezpečným lékem nejen v profylaxi gastrointestinálního krvácení při antitrombotické léčbě?
- Psychické reakce nemocných na negativní informaci typu: „Máte maligní nemocnění“
- Čo sa skrýva za autoinflamáciou?
- Postižení srdce při hypereozinofilii
- Význam dechových testů k hodnocení jaterních funkcí u pacientů s chronickým onemocněním ledvin
- Adherence k principům kardiovaskulární prevence u osob s vysokým rizikem
- Prvé prípady geneticky potvrdenej kongenitálnej hnačky so stratou chloridov na Slovensku
- Stresová kardiomyopatia vyprovokovaná netypickou situáciou
- Hepatorenální syndrom – update 2020
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- Jaké jsou cílové hodnoty krevního tlaku u pacientů s chronickým onemocněním ledvin?
- Proteinurie z pohledu internisty
- Proteinurie z pohledu internisty
- Euvascor – časná intervence u hypertonika s dyslipidemií, resp. dyslipidemika s hypertenzí (fixní kombinace atorvastatinu a perindoprilu)
- Rivaroxaban ve studii COMPASS
- Arteriální hypertenze a infekce COVID-19: Stručný komentář
- Vnitřní lékařství v době koronavirové
- Vážení a milí čtenáři Vnitřního lékařství,
- Miroslav Souček, Petr Svačina a kolektiv. Vnitřní lékařství v kostce. Grada; Praha 2019; 462 stran; ISBN 978-80-271-2289-9 (print)
- Profesorka MUDr. Sylvie Opatrná, PhD. – in memoriam (1959–2020)
- Distanční léčba diabetu: Co mohou pacient, lékař a sestra zvládnout na dálku?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Čo sa skrýva za autoinflamáciou?
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- Proteinurie z pohledu internisty
- Hepatorenální syndrom – update 2020
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



