-
Medical journals
- Career
Léčba inzulinovou pumpou: edukace a její cíle
Authors: Kateřina Štechová
Authors‘ workplace: Interní klinika 2. LF UK a FN Motol, Praha
Published in: Vnitř Lék 2019; 65(4): 248-255
Category:
Overview
V dnešní době představuje léčba inzulinovou pumpou způsob podávání inzulinu, který je nejblíže fyziologické sekreci inzulinu. Tento typ intenzifikovaného inzulinového režimu je používán převážně (ne ale výhradně) u pacientů s diabetem 1. typu. Léčba inzulinovou pumpou může být efektivně propojena s kontinuální monitorací koncentrace glukózy. Máme již k dispozici i inzulinové pumpy schopné přijímat údaje o koncentraci glukózy a automaticky zastavit podávání bazální inzulinové dávky tak, aby nevznikla hypoglykemie. Tato kombinace technologií představuje způsob, jak může pacient dosáhnout hodnot glykemií blízkých fyziologické situaci bez zvýšení rizika vzniku těžké hypoglykemie. V České republice je léčba inzulinovou pumpou u pacientů splňujících daná indikační kritéria hrazena z prostředků veřejného zdravotního pojištění. K tomu, aby byl plně využit potenciál této terapie, musí být pacient i odborníci edukováni tak, aby byli komplexně seznámeni se všemi jejími technickými možnostmi, a musí si také osvojit i řadu dalších znalostí. Zvlášť důležité jsou znalosti týkající se složení potravin a jejich efektu na glykemii. Všechny tyto aspekty jsou podrobně v článku rozebírány.
Klíčová slova:
dieta – edukace – indikace léčby – inzulinová pumpa – léčebný úspěch – motivace
Úvod
Inzulinová pumpa (IP) je přístroj velikosti mobilního telefonu, který obsahuje zásobník na inzulin (poznámka – v IP jsou dnes používána výhradně rychlá inzulinová analoga). Inzulin je z IP vydáván do těla tlakem pístu na pryžový konec zásobníku.
Zásobník IP je buď propojen s podkožně zavedenou kanylou katétrem, nebo existují i tzv. bezhadičkové IP, které ale nejsou dosud v České republice (ČR) k dispozici. Firmy nabízejí ke svým přístrojům infuzní sety s různou délkou katétru i kanyly, která může být kovová nebo teflonová. Infuzní set musí být pravidelně měněn (podrobně viz dále).
Pumpa podle přednastaveného programu dávkuje automaticky tzv. bazální dávku inzulinu (bazál) a pacient vydává stiskem tlačítek pokyn pumpě k vydání prandiální dávky inzulinu k pokrytí vzestupu glykemie po jídle (tzv. bolus). IP tedy pracuje v režimu bazál-bolus a jedná se o v současnosti nejdokonalejší dostupné napodobení fyziologické sekrece inzulinu. Fotografie IP a její popis ukazuje obr.
Obr. Inzulinová pumpa. Archiv autorky 
Od doby prvních systematických klinických zkoušek této technologie (tj. po roce 1978) zaznamenala léčba inzulinovou pumpou/kontinuální podkožní infuzí inzulinu (Continuous Subcutaneous Insulin Infusion – CSII) obrovský rozmach, který byl na přelomu století dále urychlen vývojem rychlých inzulinových analog a rozvojem kontinuální monitorace koncentrace glukózy (Continuous Glucose Monitoring – CGM), která může být s technologií CSII úspěšně propojena (podrobně viz dále) [1].
Pacienti, kteří vyžadují kompletní inzulinovou substituci, tedy pacienti s diabetem 1. nebo 2. typu (DM1T, DM2T), ale i někteří pacienti s jinými typy diabetu, musí být léčeni tzv. intenzifikovaným inzulinovým režimem (Intensified Insulin Regime – IIR). IIR může být realizován buď podáváním vícečetných injekcí inzulinu (Multiple Daily [Insulin] Injections – MDI režim) nebo pomocí CSII. Jedině tak lze u pacienta vyžadujícího úplnou náhradu vlastní produkce inzulinu dosáhnout takové kompenzace diabetu, při níž jsou minimalizována rizika vzniku chronických diabetických komplikací [2]. Důraz je ovšem kladen i na to, aby intenzifikovaná inzulinoterapie významně nezvyšovala riziko vzniku zejména těžších hypoglykemií [1].
CSII je finančně dražší variantou IIR vzhledem k ceně vlastního přístroje, ale i vzhledem k nákladům na spotřební materiál (infuzní sety, zásobníky, baterie). Pro tuto léčbu existují indikační kritéria a léčba je v ČR plně hrazena z prostředků veřejného zdravotního pojištění (tab. 1). Je ale nutné schválení této léčby revizním lékařem příslušné zdravotní pojišťovny a předpis IP je vázán na pracoviště, která mají statut diabetologického centra [3,4]. Zdravotní pojišťovny rozlišují dle integrovaných funkcí IP 3 kategorií [3]. Pokud pacient splňuje indikaci k této léčbě i nadále, má nárok po opětovném schválení revizním lékařem na výměnu přístroje v intervalu 4 let. Údaje z národního Registru inzulinových pump jsou zveřejněny na webových stránkách České diabetologické společnosti, na nichž se nachází i Doporučený postup léčby inzulinovou pumpou [4,5].
Table 1. Indikace léčby IP v ČR. Upraveno podle [3] ![Indikace léčby IP v ČR. Upraveno podle [3]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/36168a5ce5b9e8355b8bfec552dd02be.jpeg)
Inzulinová pumpa sama o sobě nikoho nezkompenzuje. Klíčové je, aby byl pacient k této léčbě maximálně motivován a edukován. Edukováni musejí být ale i zdravotničtí pracovníci, kteří se léčbě pacientů s IP věnují (lékaři, sestry a další členové diabetologického týmu). V článku se budu věnovat tedy různým aspektům edukace pacientů i zdravotníků pro léčbu IP, protože dobrá edukace je základním předpokladem terapeutického přínosu CSII.
Výhody a nevýhody léčby inzulinovou pumpou
Výhody převažují nad nevýhodami, ale i ty je potřeba brát v úvahu. Zřejmou nevýhodou je nutnost nepřetržitého napojení na přístroj, byť malých rozměrů. Odpojení je možné pouze na krátkou dobu (max. 2 hod). Při nošení inzulinové pumpy nejde jen o určitý fyzický diskomfort, ale u některého člověka může nošení IP vyvolat pocit stigmatizace. Dále je potřeba počítat s tím, že pacient léčený CSII má v těle pouze malé depo rychle působícího inzulinového analoga. Pokud z nějakého důvodu dojde k přerušení dodávky inzulinu (např. zalomení kanyly), ocitá se tak pacient brzy zcela bez inzulinu a u člověka bez zbytkové sekrece inzulinu se rychle rozvíjí diabetická ketoacidóza [1,4].
Výhody léčby IP jsou dány jejími technickými možnostmi. Inzulinové pumpy mají např. různé funkce umožňující operativní reakce na měnící se inzulinovou potřebu. Těm se budu podrobně věnovat v dalším textu. Nejprve ale shrnu současnou situaci v oblasti efektivity této léčby.
Realita léčby IP ve světě a u nás
Frekvence používání CSII terapie
Ve vyspělých zemích světa se podíl pacientů léčených IP různí, přičemž jedním z rozhodujících faktorů je míra spoluúčasti pacienta na krytí finančních nákladů této léčby. Paradoxně nízká proporce uživatelů IP je v zemi, ze které tato léčba vzešla, tj. ve Velké Británii, ve které se jedná pouze o 11,7 % pacientů s DM1T a tato léčba není indikována u pacientů s DM2T [6,7]. Na opačném pólu spektra jsou např. USA, ve kterých je CSII terapií léčeno asi 40 % pacientů s DM1T, nebo Izrael [7,8]. Náš národní Registr inzulinových pump eviduje za období let 1998–2012 výsledky více než 3 900 pacientů (z čehož 8,8 % jsou pacienti s diagnózou DM2T) a jistě v něm nejsou zahrnuti úplně všichni pacienti IP skutečně léčení [5].
Naplňování léčebných cílů při CSII terapii
Vysoce sofistikovaná a finančně nákladnější léčba, kterou CSII beze sporu je, by měla vést u pacienta k dosažení očekávaných léčebných cílů. Tím je hodnota glykovaného hemoglobinu HbA1c, ale nejen ta. Světová doporučení považují glykemickou kontrolu obvykle za dobrou, pokud pacienti dosahují hodnot HbA1c < 58 mmol/mol (např. [6]). Doporučení České diabetologické společnosti z roku 2016 uvádí pro dospělé pacienty s DM1T bez ohledu na typ léčby hodnotu přísnější, a to hodnotu < 45 mmol/mol s tím, že v určitých případech (např. u osob s vysokým kardiovaskulárním rizikem) je toto doporučení benevolentnější (< 60 mmol/mol) [9]. Glykovaný hemoglobin odráží průměr glykemií za období posledních 3 měsíců a nic neříká o tzv. glykemické variabilitě (kolísání glykemií během dne), která je nyní též považována za další důležitý parametr metabolické kompenzace a může být jednoduše vyjádřena jako standardní odchylka vypočítaná z glykemických profilů, ideálně ze záznamu CGM. Pro celkové zhodnocení kompenzace pacienta je potřeba posoudit ale i další léčebné cíle (nejen metabolické). Konkrétně se jedná o počet zejména těžších hypoglykemií a důležitá je i pacientova spokojenost s léčbou (subjektivní vnímání kvality života). To vše by mělo být naplněno, pokud možno bez přítomnosti nežádoucích efektů léčby, kterými kromě hypoglykemií mohou být kožní iritace a infekce či poškození podkoží (vznik lipodystrofie) v místě aplikace kanyly; hyperglykemie, příp. diabetická ketoacidóza v důsledku technických problémů (zalomení kanyly apod) nebo významný váhový přírůstek. Tyto nežádoucí efekty jsou dost často způsobeny chybami ze strany pacienta než čistě technickými příčinami (nebo např. existencí skutečné intolerance kůže na fixační náplast kanyly) [1].
V roce 2012 byla publikována metaanalýza, která mimo jiné proti sobě porovnávala efektivitu léčby CSII a MDI [10]. Z hlediska HbA1c (ne ale hypoglykemií) hovořily výsledky lehce ve prospěch CSII, ale jen u dospělých pacientů, přičemž autoři si byli vědomi toho, že tento výsledek byl ovlivněn jednou konkrétní studií. Dlouho byl problém v tom, že CSII terapie byla porovnávána vůči MDI režimu, který obsahoval starší typy inzulinů. O 4 roky později byla publikována v Diabetes Care práce využívající data z americké databáze T1D Exchange Registry, která se zaměřila na zhodnocení vlivu paralelního využívání CGM. Autoři uvedli, že pacienti léčení CSII a užívající CGM technologii dosahovali stejných výsledků jako ti, kteří též užívají CGM, ale byli léčeni MDI režimem (s inzulinovými analogy) a jejich výsledky jsou lepší než při léčbě CSII bez CGM [11].
Vzhledem k současným terapeutickým možnostem (moderní inzuliny, inzulinové pumpy, CGM technologie) by se tedy dalo očekávat, že by podstatná část pacientů na jakékoliv formě IIT režimu měla dosahovat léčebných cílů. Skutečnost je ale jiná. Analýza opravdu robustních dat z mezinárodního srovnání metabolické kompenzace různých věkových skupin DM1T pacientů (bez ohledu na typ IIT režimu) zahrnující údaje o 324 501 pacientech z 12 zdrojů, přinesla následující zjištění. Cílových hodnot HbA1c < 58 mmol/mol dosáhlo ve věkové skupině pacientů mladších 15 let 15,7–46,4 % osob (údaje se lišily mezi jednotlivými centry). U pacientů věkové skupiny 15–24 let bylo dosahováno cílové hodnoty HbA1c u 8,9–49,5 % pacientů a u osob starších 25 let to bylo u 20,5–53,6 % pacientů [7]. A to se zabýváme jen jediným aspektem metabolické kompenzace. V České republice je jistě též co zlepšovat.
Obecně se tedy dá situace shrnout tak, že potenciál moderní léčby diabetu (nejen inzulinových pump) není plně využit a že budou existovat velké mezinárodní rozdíly, ale i rozdíly mezi jednotlivými diabetologickými centry v rámci jednoho geografického regionu.
Pokud jsou používány přístroje srovnatelné kvality, pak je potřeba logicky hledat příčinu rozdílů v člověku, a to nejen na straně pacienta, ale i na straně odborníků. Velice zajímavé výsledky poskytla studie REPOSE (The Relative Effectiveness of Pumps over MDI and Structured Education for Type-1 diabetes). Význam akronymu REPOSE lze přeložit jako „relativní efektivita pump nad MDI režimem a strukturovaná edukace u osob s DM1T“. V této studii byla klíčovou intervencí účast pacientů léčených IIT na tzv. kurzech DAFNE (Dose Adjustment for Normal Eating, tj. úprava dávek pro normální jídelní zvyklosti): pacienti léčení MDI podstoupili standardizovaný obecný 5denní DAFNE kurz a pacienti randomizovaní do CSII větve kurz adaptovaný pro uživatele IP. Po 6–8 týdnech byli účastníci pozváni na reedukační setkání a pokud bylo zapotřebí – měli pacienti i možnost individuální konzultace s odborníkem (vždy spojené s analýzou dat z pacientova glukometru anebo pumpy). Účastníci byli po této edukační intervenci sledováni po dobu 2 let. Závěr: v obou skupinách bylo pozorováno dlouhodobé zlepšení metabolické kompenzace pacientů a nižší výskyt těžších hypoglykemií. Poněkud lépe na tom byli uživatelé IP, ale rozdíl proti MDI skupině nebyl statisticky významný. Většina účastníků ale stejně nedosáhla doporučených cílových parametrů metabolické kompenzace diabetu. Doporučení pro praxi z této studie je takové, že u pacienta se špatnou metabolickou kontrolou není správné řešit situaci zavedením na IP bez předchozího pokusu o zlepšení kompenzace pomocí reedukace. Prvotní v takovém případě musí být intenzivní strukturovaná reedukace [12].
V ČR nemáme tak přesně specifikovaný edukační program s jasně daným kurikulem, jako je např. výše uváděný program DAFNE. Edukace obecně může být individuální, skupinová, jednorázová, může se jednat o kurz. Prvotní je, že pacient musí chápat smysl takových aktivit a musí o ně mít zájem. Jakékoliv vzdělávání musí být doplněno prověřením, že vzdělávaná osoba tématu rozumí a osvojila si ho v potřebné míře. Dále je nutné znalosti udržovat a optimálně i průběžně aktualizovat [13,14].
Na našem pracovišti se osvědčila trochu netradiční edukační metoda vycházející z postupu, který většina z nás zná. Jedná se o vzdělávací proces vedoucí k získání řidičského oprávnění, který je zakončen zkouškou obsahující teoretickou a praktickou část. Teoretickou část představuje znalostní test, který je generován z velkého setu otázek, který je předem znám. Je tedy možné se otázky dopředu naučit, byť je z nich pro vlastní test finálně vybrána jen malá část. I v našem případě je kompletní testovací sada otázek předem známa. Adept zahájení léčby IP nebo její výměny po 4 letech musí test obsahující 42 otázek splnit na 80 % v časovém limitu 60 min. Pokud pacient neuspěje, je možné test bez omezení opakovat, ale vždy až po týdnu, aby si mohl své neznalosti doplnit (případně aby si sjednal cílenou reedukaci). Na rozdíl od skutečného testu pro získání řidičského oprávnění se v našem případě za první ani opakované pokusy neplatí. Cílem je pacienta donutit k osvojení znalostí a k vytipování individuálně problematických oblastí, kterým je možné se pak s pacientem cíleně věnovat [15]. V dalších odstavcích se pokusím rozebrat úskalí edukace na IP, kterým je nutné se vždy více věnovat.
Úprava bazálních dávek
Bazální dávka může být rozdělena na několik časových segmentů, což umožňuje se přizpůsobit měnící se inzulinové senzitivitě během dne. Vyšší bazální dávka nad ránem je nejúčinnějším řešením tzv. dawn fenoménu. Tento fenomén úsvitu je dán fyziologicky vyšší produkcí tzv. kontraregulačních hormonů nad ránem (kortizol, růstový hormon) a je právě jedním z důvodů zahájení léčby IP. Bazální dávku je možné měnit i po hodině, to ale není efektivní, obvykle postačí 4–5 bazálních dávek za den, které odrážejí nejen fyziologické změny potřeby inzulinu během dne, ale i pacientovy denní aktivity (tab. 2). Pacient by se měl naučit upravovat si bazální dávky samostatně. To ale není vše.
Table 2. Příklad vyhovujícího nastavení bazálních dávek 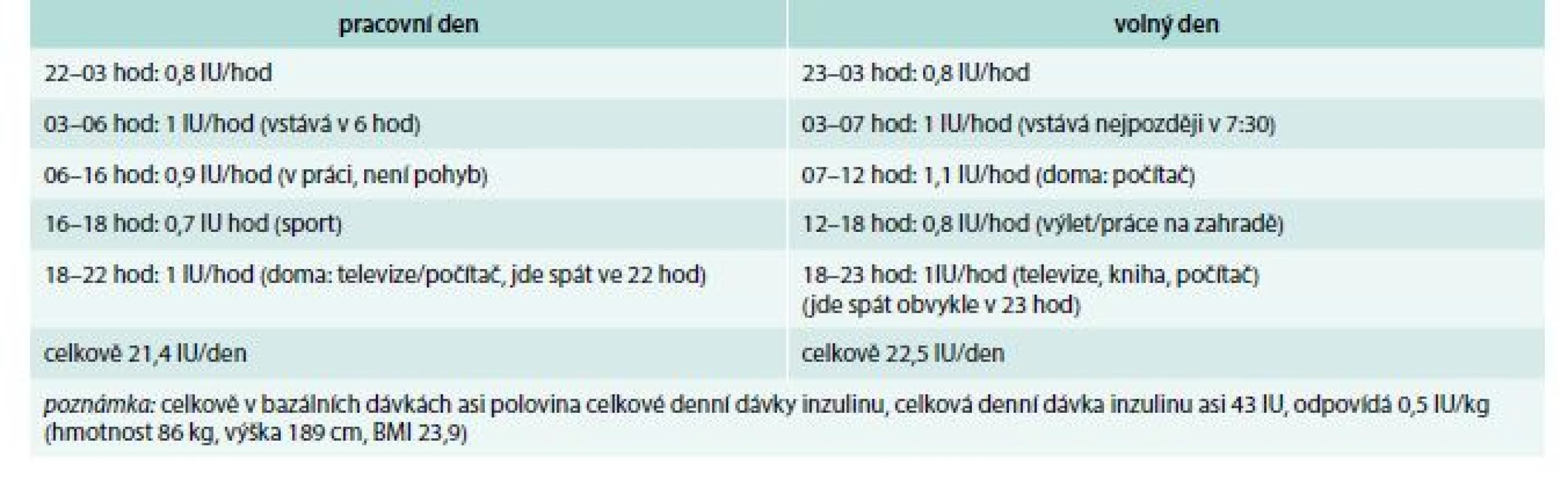
Pumpy poskytují možnost naprogramování různých bazálních profilů (jeden např. na pracovní den, druhý na víkend, tab. 2). Další velmi užitečnou funkcí je volba tzv. dočasné bazální dávky, a to ve smyslu navýšení i snížení. Dočasné snížení bazální dávky je výhodné při fyzické aktivitě. Pacienti často jako prevenci hypoglykemie při nebo po fyzické aktivitě preferují dojedení, což může vést k nežádoucímu nárůstu hmotnosti. Lepší alternativou zejména u osob s nadváhou/obezitou je proto právě použití dočasně nižší bazální dávky.
Naopak zvýšení bazální dávky je potřeba např. při nemoci či u žen během menstruace. Podle situace může pacient volit buď dočasné zvýšení bazální dávky, nebo nastavení speciálního bazálního profilu (pokud je předpoklad, že změna bude potřeba delší dobu). Dočasně vyšší bazální dávka může též posloužit k postupné korekci hyperglykemie, pacient ale musí mít jistotu, že příčinou hyperglykemie není technický problém (zalomení kanyly atd).
K efektivní samostatné úpravě bazálních dávek a k využití uvedených speciálních funkcí IP musí mít pacient následující znalosti: úplným základem je znát cílové hodnoty glykemie. Nezbytná je ochota provádět glykemický selfmonitoring v dostatečné frekvenci. Pacient léčený IP by měl podle doporučení provádět minimálně 4 měření glykemie denně. Tato minimální frekvence měření představuje spotřebu 1 460 ks proužků do glukometru za rok. Dospělý pacient léčený IP má ale nárok na úhradu pouze 1 000 ks testovacích proužků do glukometru. Navíc pro úpravu dávek inzulinu je potřeba provádět buď tzv. velké (alias 8bodové) glykemické profily (tj. pacient si měří glykemii před hlavními jídly, 2 hod po nich, před spaním a ve 2 nebo ve 3 hod v noci), ideální je mít k dispozici údaje z kontinuální monitorace glykemie. Pacient léčený IP musí tedy nejen znát problematiku glykemického selfmonitoringu, ale musí být ochoten/schopen si dokoupit testovací proužky do glukometru anebo glukózové senzory. Dále pro práci s bazálními dávkami musí pacient dobře znát efekt fyzické aktivity na glykemii a tzv. sick-day management, tj. jak postupovat v případě nemoci (stresu). Pacient musí být edukován, aby při hyperglykemii monitoroval i tvorbu ketolátek, ideálně pomocí změření hladiny β-hydroxybutyrátu v krvi. Z toho plyne, že pacient musí mít povědomí o patofyziologických pochodech při vzniku diabetické ketoacidózy [1,4,14,16,17] .
Realita je ovšem taková, že pacienti léčení IP často používají rigidně bazální profil tak, jak jim byl v nemocnici nastaven, a s bazálními dávkami vůbec nepracují. A jsou samozřejmě i pacienti léčení IP, kteří nejsou ochotni provádět glykemický selfmonitoring v dostatečné frekvenci. Tito pacienti by ovšem IP neměli být léčeni. Během každé pravidelné ambulantní kontroly pacienta s IP je zapotřebí stáhnout data z inzulinové pumpy i glukometru, a ta s pacientem rozebrat. Ideální je data hodnotit v kontextu záznamů o pohybové aktivitě, nemoci a samozřejmě v kontextu jídelníčku [1].
Úprava bolusových dávek
Inzulinové pumpy umožňují volbu různých forem bolusové dávky. Inzulin může být vydán buď jednorázově (jednoduchý bolus) nebo během určité volitelné doby (rozložený bolus) či jako bolus kombinovaný: zvolená část inzulinu je vydána ihned a zbytek za určený časový interval. Tato forma bolusu odpovídá nejvíce fyziologické situaci a je ideální k pokrytí vzestupu glykemie po konzumaci stravy obsahující potraviny s různým glykemickým indexem. Jednoduchý bolus by měl být preferován, pokud jídlo obsahuje více jednoduchých cukrů a vzestup glykemie bude tedy rychlý [1].
Tím se dostávám k okruhu znalostí, které jsou pro pacienta s diabetem (a nejen léčeného IP) zcela zásadní, a to je něco, co bych nazvala obecně „nutriční gramotností“. Úplným základem je znalost rozdílu mezi jednoduchými a složenými sacharidy a znalost (nebo schopnost si vyhledat) obsahu sacharidů v jednotlivých potravinách. Situaci dnes velmi usnadňuje existence různých volně přístupných informačních databází a také povinnost uvádět složení potravin na balených výrobcích. Pacient musí být ale schopen etikety „číst“ a informace správně interpretovat. Pacient léčený inzulinovou pumpou by měl dále jistě znát pojem glykemický index potravin i to, jak ho využívat pro dávkování. Bez této znalosti nemůže dobře volit typ bolusu. Inzulinové pumpy mají v sobě též integrovanou funkci bolusového kalkulátoru, jehož algoritmus spočítá podle přednastavených parametrů optimální bolusovou dávku. Tuto funkci mohou využívat i pacienti léčení MDI, protože existují aplikace pro mobilní telefony, které takový výpočet umožňují.
Při volbě každé dávky prandiálního inzulinu (na pumpě i při MDI režimu) by se mělo brát v potaz, kolik inzulinu pacient potřebuje na dané množství sacharidů v jídle. Lékař na začátku určí pro pacienta tzv. CIR (Carbohydrate to Insulin Ratio, tj. poměr sacharidy inzulin), neboli množství sacharidů, které pokryje 1 jednotka inzulinu. Ideální je, pokud si pacient CIR určí pokusně sám (měřením glykemie před a po konzumaci monokomponentní potraviny se známým obsahem sacharidů), nejlépe v různých fázích dne.
Pokud není glykemie před jídlem v cílovém rozmezí (je vyšší, než by měla být), je nutné připočítat korekční složku bolusu. Zde je potřeba stanovit tzv. ISF (Insulin Sensitivity Factor), kterým je údaj, o kolik mmol/l sníží glykemii aplikace 1 IU inzulinu. ISF se vypočítává podle celkové dávky inzulinu. Algoritmus bolusového kalkulátoru na pumpě ještě zohledňuje množství aktivního inzulinu z předchozích bolusů. I to (resp. čas aktivního inzulinu) je možné individuálně nastavit, stejně jako hodnoty cílové glykemie. Pokud pacient ale zadá množství sacharidů s významnou chybou, doporučí i sebelépe přednastavený algoritmus chybnou dávku. Dietní edukace by se neměla ale omezit pouze na sacharidy či glykemický index [1,4,14]. Zkušenosti i data ze zahraničních pracovišť [18] ukazují na to, že strava pacientů s DM1T má často daleko k doporučované racionální stravě. Jejich strava je často velmi energeticky denzní, a to díky vysokému zastoupení tuků. Pacienti spíše redukují ve své stravě polysacharidy než monosacharidy. Výsledkem je nárůst hmotnosti a pacient s DM1T pak získává postupně též metabolické rysy typické pro pacienty s DM2T [19].
Nezbytné je s pacientem probírat jeho stravu, a to nejen v rámci úvodní edukace. Pokud pacient v této oblasti tápe, pomohou zprvu např. vzorové jídelníčky. Postupně je ale nezbytné, aby se pacient dopracoval k samostatné a dobré orientaci v oblasti diety (racionální stravy).
Provoz inzulinové pumpy
Prvotní seznámení a uživatelský zácvik provádí s pacientem v ČR obvykle zástupce společnosti, jejíž přístroj si pacient vybral. Pacient musí být schopen vyměnit baterii, naplnit a vložit zásobník s inzulinem (či správně vložit předplněný zásobník, který je též pro některé pumpy k dispozici), provést přepich kanyly, zadat/změnit různé údaje v pumpě, podat si bolus (navolit nejen dávku, ale i formu bolusu atd). V rámci každé kontroly pacienta je třeba stáhnout data z pumpy i glukometru. Častým důvodem selhání léčby IP je totiž zapomínání aplikace bolusů (graf).
Graf. Srovnání dat stažených z inzulinové pumpy u nespolupracujícího, resp. spolupracujícího pacienta. Archiv autorky 
a) Žena, 23 let, DM1T od 13 let, studuje vysokou školu, HbA1c trvale mezi 85–90 mmol/mol, sporadicky aplikuje bolusy, neměří si glykemie, opakované reedukace, psychologická intervence, nemá zájem o svůj diabetes, léčba inzulinovou pumpou byla ukončena, zatím bez chronických komplikací
b) Žena, 36 let, DM1T od 14 let, vysokoškolské vzdělání, pracuje jako úřednice, HbA1c trvale 60 mmol/mol, aktuální 52 mmol/mol, bez chronických komplikací, téměř nepřetržitě používá CGMPokud není dosahováno léčebných cílů a v datech pumpy zjistíme, že pacient má stále stejnou bazální dávku, je potřeba ověřit, zda si vůbec bazální dávku umí změnit. Stejně tak je nutné při každé ambulantní kontrole provést inspekci místa vpichu kanyly. Kovové kanyly musí být měněny každý 2. den, teflonové pak nejdéle za 3 dny. Pacienti často nechávají kanylu zavedenou, dokud jim vystačí zásobník, nebo sice kanylu vymění, ale zásobník, pokud obsahuje ještě dost inzulinu, ponechají nebo ho jen novým inzulinem doplní. To lze snadno poznat z disproporce spotřeby kanyl a zásobníků. Pokud je kanyla ponechána déle, než je doporučováno, glykemie se budou s velkou pravděpodobností zhoršovat, a navíc hrozí infekce v místě vpichu. Účinnost inzulinu, pokud je ponechán déle v zásobníku (zejména pokud jsou vyšší nebo naopak mrazivé teploty), bude též narušena. Pacient též musí být edukován, že je nutné místa vpichu kanyly střídat a neaplikovat kanylu stále na stejné místo. Problémy v této zdánlivě jednoduché oblasti vedly dokonce k ustanovení speciálních evropských doporučení pro tuto specifickou oblast [20].
Selfmonitoring pomocí CGM
V současnosti nabízejí na českém trhu inzulinové pumpy, které slouží zároveň i jako přijímač CGM signálu, pouze dvě společnosti. (Poznámka: Tyto pumpy mohou být samozřejmě používány i bez propojení se CGM.)
Pro úplnost alespoň stručně uvedu princip CGM. Pacient má v podkoží zavedený glukózový senzor (měřena je tedy koncentrace glukózy v intersticiu, ne v krvi), který je pomocí vysílače bezdrátově propojen s přijímačem, kterým může být inzulinová pumpa, samostatný přístroj či mobilní telefon. Tento způsob se označuje jako RT-CGM (čili monitorace koncentrace glukózy v reálném čase). RT-CGM přineslo do glykemického selfmonitoringu zásadní změnu nejen v poskytovaném množství dat (registrovány jsou hodnoty koncentrace glukózy à 5 min, což za den představuje 288 údajů), ale především v tom, že je současně zobrazen trend vývoje koncentrace glukózy. Jen pro úplnost uvedu, že existuje i zaslepená verze CGM (glukózový holter) a v současnosti je i v ČR dostupná tzv. FGM technologie (Flash Glucose Monitoring), pro které jsem od pacientů slyšela celkem výstižné pojmenování „glykemické scanování“. FGM stejně jako RT-CGM umožňuje získat i informaci o vývoji koncentrace glukózy, ale pouze RT-CGM poskytuje možnost nastavení hypoglykemických (samozřejmě i hyperglykemických) alarmů, což je neocenitelné zejména pro pacienty s porušeným vnímáním příznaků hypoglykemie.
Inzulinové pumpy s integrovaným systémem CGM jedné ze dvou společností, které je na českém trhu nabízejí, umožňují určitou automatickou odezvu na glykemii, resp. na koncentraci glukózy v intersticiu (jsou to tedy pumpy té nejvyšší, tj. 3. kategorie). V prvním případě se jedná o funkci tzv. nízkého zastavení – pumpa automaticky pozastaví dávkování bazálního inzulinu, pokud je dosaženo hodnoty přednastaveného hypoglykemického prahu. V případě druhého typu pumpy dojde k zastavení bazální dávky dokonce ještě s předstihem, pokud pumpa vyhodnotí podle trendu vývoje glykemie, že je hrozba hypoglykemie reálná (funkce tzv. prediktivního zastavení). Ve vývojové řadě těchto pump následuje přístroj, který je již dostupný v USA. Tato pumpa umožňuje používat automatický mód, ve kterém pumpa sama dávkuje bazální dávku podle údajů z CGM. Jedná se tedy o zásadní krok směrem k arteficiální B-buňce [1,3,13,14].
Je prokázáno, že aby používání CGM technologie mělo efekt na kompenzaci diabetu, je nutné ho používat co nejvíce. V ČR hradí pojišťovny pro dospělé pacienty část ceny glukózových senzorů, a to až do celkového počtu 43, resp. 37 kusů za rok (podle typu senzoru, viz dále). Dostupné jsou 2 systémy RT-CGM, jejichž senzory jsou určeny pro 6denní, resp. 7denní použití. Pacient musí být pro užívání RT-CGM speciálně edukován, aby uspěchané reakce (dopichování resp. dojídání) nevedly k nežádoucímu rozkolísání glykemických profilů. Cíleně musí být upozorněn na existenci tzv. zpoždění: při rychlejších změnách glykemie nemusí hodnota ze senzoru odpovídat hodnotě naměřené glukometrem. Nejedná se přitom o chybu CGM, ale o prostý fakt, že vyrovnání koncentrace glukózy mezi oběma kompartmenty (krví a intersticiem) chvíli tvá [1,3,13,14].
Pokud si pacient osvojí znalosti a dovednosti, které mu umožní naplno využívat funkce IP přibližující tuto léčebnou modalitu fyziologické situaci, a bude provádět intenzivní selfmonitoring (ideálně bude co nejvíce používat CGM), není důvod, proč by ve většině případů nebylo možné dosáhnout léčebných cílů, a to pohodlně a diskrétně. (Pozn.: I pacient léčený IP, která není přijímačem CGM signálu, může tuto technologii využívat a jako přijímač může použít např. mobilní telefon.) Základní ovšem je, že pacient musí být ochoten se léčbě diabetu věnovat. To už je ale problematika psychologická [21]. Významnou překážkou v maximálním využití moderních technologií může být samozřejmě i diabetolog sám, protože je potřeba, aby danou technologii zvládal a zároveň aby byl niterně přesvědčen, že může jeho pacientovi skutečně prospět [22].
Práce autorky v oblasti technologií v diabetologii je podporována programovým projektem MZ ČR s reg. č. 15–25710A (P08 panel).
prof. MUDr. Kateřina Štechová, Ph.D.
Interní klinika 2. LF UK a FN Motol, Praha
Doručeno do redakce 6. 8. 2018
Přijato po recenzi 31. 1. 2019
Sources
- Štechová K (ed) et al. Technologie v diabetologii. Maxdorf: Praha 2016. ISBN 978–80–7345–479–1.
- Nathan DM, Genuth S et al. Diabetes Control and Complications Trial Research Group, The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329(14): 977–986. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199309303291401>.
- Metodika k Úhradovému katalogu VZP – ZP platnému od 1. 7. 2018, část P, Skupina 11 – Pomůcky pro diabetiky. Dostupné z WWW: <https://prod-publicweb-media.azureedge.net/media/Default/dokumenty/ciselniky/metodika_1002.pdf>.
- Rušavý Z. Doporučený postup léčby inzulínovou pumpou. DMEV 2012; 15(2): 108–110.
- Česká diabetologická společnost (ČDS). Registr inzulinových pump. Dostupné z WWW: <http://www.diab.cz/registr-inzulinovych-pump>.
- National Institute for Health and Care Excellence (NICE). Continuous subcutaneous insulin infusion for the treatment of diabetes mellitus. Technology appraisal guidance [TA151]. Dostupné z WWW: <https://www.nice.org.uk/guidance/ta151/chapter/2-Clinical-need-and-practice>.
- McKnight JA, Wild SH, Lamb MJ et al. Glycaemic control of Type 1 diabetes in clinical practice early in the 21st century: an international comparison. Diabet Med 2015; 32(8): 1036–1050. Dostupné z DOI: <http://dx.doi.org/10.1111/dme.12676>.
- Pollard DJ, Brennan A, Dixon S et al. Cost-effectiveness of insulin pumps compared with multiple daily injections both provided with structured education for adults with type 1 diabetes: a health economic analysis of the Relative Effectiveness of Pumps over Structured Education (REPOSE) randomised controlled trial. BMJ Open 2018; 8: e016766. Dostupné z DOI: <http://doi: 10.1136/bmjopen-2017–016766>.
- Škrha J, Šumník Z, Pelikánová T et al. Doporučený postup péče o diabetes mellitus 1. typu. DMEV 2016; 19(4): 156–159.
- Yeh HC, Brown TT, Maruthur N et al. Comparative effectiveness and safety of methods of insulin delivery and glucose monitoring for diabetes mellitus: a systematic review and meta-analysis. Ann Intern Med 2012; 157(5): 336–347. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–157–5-201209040–00508>.
- Thabit H, Hovorka R. Continuous subcutaneous insulin infusion therapy and multiple daily insulin injections in type 1 diabetes mellitus: a comparative overview and future horizons. Expert Opin Drug Deliv 2016; 13(3): 389–400. Dostupné z DOI: <http://dx.doi.org/10.1517/17425247.2016.1115013>.
- [REPOSE Study Group]. Relative effectiveness of insulin pump treatment over multiple daily injections and structured education during flexible intensive insulin treatment for type 1 diabetes: cluster randomised trial (REPOSE). BMJ 2017; 356: j1285. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.j1285>.
- Pelikánová T, Bartoš V (eds). Praktická diabetologie. 6. ed. Maxdorf: Praha 2018. ISBN 978–80–7345–559–0.
- Galderisi A, Schlissel E, Cengiz E. Keeping Up with the Diabetes Technology: 2016 Endocrine Society Guidelines of Insulin Pump Therapy and Continuous Glucose Monitor Management of Diabetes. Curr Diab Rep 2017; 17(11): 111. Dostupné z DOI: <http://dx.doi.org/10.1007/s11892–017–0944–6>.
- Stechova K, Vanis M, Tuhackova M et al. Lessons Learned from Implementing a New Testing/Educational Tool for Patients Using an Insulin Pump. Diabetes Technol Ther 2018; 20(8): 524–530. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2018.0095>.
- King AB. Reassessment of insulin dosing guidelines in continuous subcutaneous insulin infusion treated type 1 diabetes. Curr Diab Rep 2014; 14(6): 503. Dostupné z DOI: <http://dx.doi.org/10.1007/s11892–014–0503–3>.
- King AB, Kuroda A, Matsuhisa M et al. A Review of Insulin-Dosing Formulas for Continuous Subcutaneous Insulin Infusion (CSII) for Adults with Type 1 Diabetes. Curr Diab Rep 2016; 16(9): 83. Dostupné z DOI: <http://dx.doi.org/10.1007/s11892–016–0772–0>.
- Gilbertson HR, Reed K, Clark S et al. An audit of the dietary intake of Australian children with type 1 diabetes. Nutr Diabetes 2018; 8(1): 10. Dostupné z DOI: <http://dx.doi.org/10.1038/s41387–018–0021–5>.
- Chillarón JJ, Flores Le-Roux JA, Benaiges D et al. Type 1 diabetes, metabolic syndrome and cardiovascular risk. Metabolism 2014; 63(2): 181–187. Dostupné z DOI: <http://dx.doi.org/10.1016/j.metabol.2013.10.002>.
- Deiss D, Adolfsson P, Alkemade-van Zomeren M et al. Insulin Infusion Set Use: European Perspectives and Recommendations. Diabetes Technol Ther 2016; 18(9): 517–524. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2016.07281.sf>.
- Joshi M, Choudhary P Multiple Daily Injections OR Insulin Pump Therapy: Choosing the Best Option for Your Patient-An Evidence-based Approach. Curr Diab Rep 2015; 15(10): 81. Dostupné z DOI: <http://dx.doi.org/10.1007/s11892–015–0644-z>.
- Tanenbaum ML, Adams RN, Hanes SJ et al. Optimal Use of Diabetes Devices: Clinician Perspectives on Barriers and Adherence to Device Use. J Diabetes Sci Technol 2017; 11(3): 484–492. Dostupné z DOI: <http://dx.doi.org/10.1177/1932296816688010>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 4-
All articles in this issue
- Léčba inzulinovou pumpou: edukace a její cíle
- Diabetické těhotenství: současné možnosti léčby
- Primárna a sekundárna inzulínová rezistencia
- Strategie a taktika léčby diabetes mellitus 2. typu
- Jak dobře léčíme inzulinem v České republice a ve Slovenské republice Shrnutí výsledků a komentář originální česko-slovenské studie DIAINFORM
- Miesto agonistov GLP1 receptorov a ich fixná kombinácia s inzulínom v liečbe diabetes mellitus 2. typu
- Rámcový pohled na epidemiologii hypoglykemie u diabetes mellitus 1. a 2. typu
- Současný pohled na léčbu hypoglykemie
- Hypoglykemie jako symptom adrenální dysfunkce u pacientů s diabetes mellitus: vzácná, ale reálná situace
- Etanol a riziko hypoglykemie u pacientů s diabetes mellitus 1. typu: stručný přehled pro klinickou praxi
- Onemocnění dutiny ústní u pacientů s diabetem
- Zdravotní způsobilost k řízení motorových vozidel a diabetes mellitus: legislativní změny v roce 2018 a souhrn zdravotních aspektů
- Diabetes mellitus 1. typu: etiologie a epidemiologie
- Diabetes mellitus a chronické srdeční selhání
- Pavel Dostál et al. Základy umělé plicní ventilace
- Manažment diabetikov s končatinovocievnou artériovou chorobou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primárna a sekundárna inzulínová rezistencia
- Současný pohled na léčbu hypoglykemie
- Diabetes mellitus 1. typu: etiologie a epidemiologie
- Zdravotní způsobilost k řízení motorových vozidel a diabetes mellitus: legislativní změny v roce 2018 a souhrn zdravotních aspektů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

