-
Medical journals
- Career
Úvodní antibiotická léčba závažných bakteriálních infekcí
Authors: Jiří Beneš
Authors‘ workplace: Klinika infekčních nemocí 3. LF UK a Nemocnice Na Bulovce, Praha
Published in: Vnitř Lék 2019; 65(3): 204-209
Category:
Overview
Článek shrnuje známá fakta týkající se výběru antibiotik pro léčbu sepse a podobných závažných infekcí, jejich mechanizmu účinku, dávkování a způsobu podávaní. Zvláštní pozornost je věnována otázce včasného zahájení antibiotické léčby: několikahodinový odklad v zahájení antibiotické terapie lze tolerovat, je-li využit pro stanovení etiologie nemoci a zpřesnění léčby. U perakutně probíhajících infekcí či toxoinfekcí je však nutné podat antibiotika skutečně neodkladně; v článku jsou připomenuty diagnostické postupy, které klinik při rozvaze o volbě přípravku může využít.
Klíčová slova:
antibiotická léčba – iniciální léčba – nasycovací dávka – perakutně probíhající infekce
Úvod
Antibiotická léčba závažných infekcí by měla být účinná a rychlá. Pomiňme prozatím požadavek na účinnost a soustřeďme se na otázku, jak rychle musí být terapie zahájena. V povědomí většiny intenzivistů zaujímá klíčové místo impozantní Kumarova studie z roku 2006, podle níž každá hodina odkladu v podání antibiotika zvyšuje smrtnost u sepse o 7,6 % [1]. Podobné výsledky přinesla i další rozsáhlá observační studie [2]. Z výsledků těchto studií byl odvozen požadavek na podání antibiotik v průběhu první hodiny od zjištění sepse nebo septického šoku. Tento požadavek byl včleněn do doporučení léčby sepse, kterou přijala většina expertů z oblasti intenzivní péče (Surviving Sepsis Campaign) [3].
Pozn.: Pojem „sepse“ v tomto článku odpovídá nové definici z roku 2016 [9], čili je prakticky shodný s termínem „těžká sepse“ podle předchozí definice z roku 1992 [10].
Následné prospektivní studie [4–8] však podobnou korelaci neprokázaly, odklad v podání antibiotik v rozsahu několika hodin nezhoršoval prognózu septických nemocných. Vysvětlením uvedeného rozdílu mezi staršími observačními a novějšími prospektivními studiemi by mohla být skutečnost, že podání antibiotik je obvykle nedílnou součástí komplexní léčebné péče. Pacienti, kteří dostali antibiotika neodkladně, byli tedy pravděpodobně ošetřováni kvalitnějším způsobem, a to bylo hlavní příčinou jejich nižší mortality.
Požadavek na rychlé podání účinných antibiotik má značné praktické důsledky: jestliže ho přijmeme, musíme logicky akceptovat úvodní léčbu širokospektrým přípravkem, protože během první hodiny máme jen málokdy šanci zjistit aspoň přibližnou etiologii. Naopak, jestliže se nezbytnost časného podání antibiotik neprokáže, můžeme vyčkat několik hodin a zahájit antibiotickou terapii na základě předběžných mikrobiologických výsledků, vycházejících z mikroskopie, genetických analýz (polymerázová řetězová reakce/Polymerase Chain Reaction – PCR) nebo hmotnostní spektrometrie (Matrix Assisted Laser Desorption/Ionization Time-Of-Flight – MALDI TOF). Dále můžeme počítat s tím, že v této době již budeme znát i další laboratorní nálezy (kompletní krevní obraz s diferenciálem leukocytů, hemokoagulační parametry, hodnotu glykemie a laktatemie apod) a při diferenciálně diagnostické rozvaze se můžeme opřít o výsledky zobrazovacích vyšetření provedených statim (RTG, sonografie, CT). Diagnóza po několika hodinách intenzivní péče může být tedy mnohem určitější (tab. 1), a to umožní podstatně přesnější zacílení antibiotické léčby, i když standardní vyšetření etiologie a zejména citlivosti/rezistence, které je založeno na kultivaci, stále ještě nebude k dispozici.
Table 1. Klinická vodítka k rozlišení grampozitivní a gramnegativní etiologie sepse 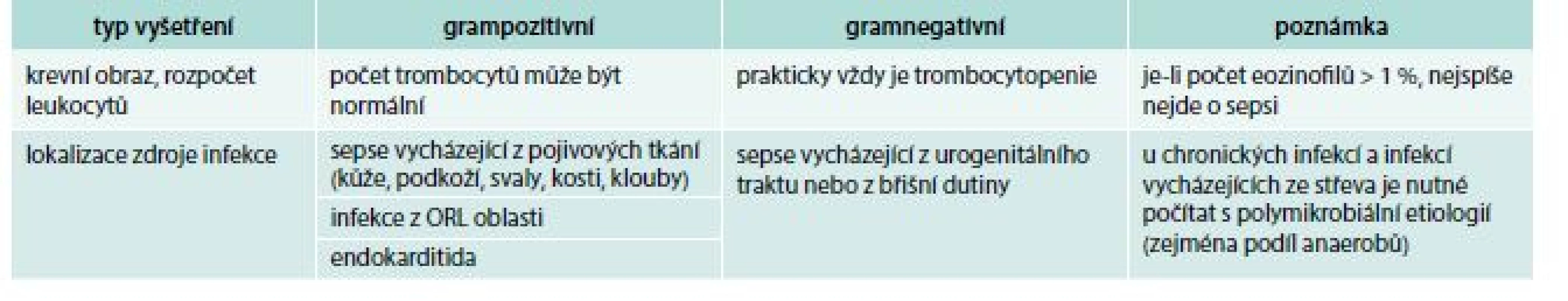
Tato vodítka spolu s předběžnými mikrobiologickými výsledky mohou být užitečná při úvodní rozvaze o výběru antibiotika. Lze je použít u akutních infekcí, které nemají iatrogenní příčinu a nevznikly jako důsledek primární poruchy imunity.
Výběr přípravků pro antibiotickou léčbu
Při výběru antibiotika pro terapii sepse a podobných závažných infekcí se upřednostňují baktericidní přípravky. Tyto přípravky je možné ještě dále rozlišit podle mechanizmu, jakým bakterie zabíjejí [11].
Beta-laktamová antibiotika (peniciliny, cefalosporiny, karbapenemy) inhibují syntézu buněčné stěny bakterií, a tím zabraňují jejich množení. Jsou oblíbená pro svoji vysokou účinnost a netoxičnost a pro léčbu sepsí se využívají nejčastěji. K dispozici je široká paleta přípravků, které se liší spektrem účinku i farmakokinetikou: je proto možné vybírat antibiotikum „na míru“, podle konkrétní potřeby. Hlavní nevýhody, které omezují používání beta-laktamů, jsou alergické reakce a výskyt rezistentních mikrobů. Alergie však obvykle nebývají zkřížené mezi jednotlivými skupinami a výskyt rezistencí, který je nejčastěji způsoben tvorbou destruujících enzymů nazývaných beta-laktamázy, se podařilo do značné míry kompenzovat syntézou odolnějších molekul antibiotika nebo přidáním inhibitorů beta-laktamáz (kyseliny klavulanové, sulbaktamu, tazobaktamu, avibaktamu a dalších).
Glykopeptidová antibiotika (vankomycin, teikoplanin, dalbavancin) inhibují syntézu bakteriální buněčné stěny jiným mechanizmem než beta-laktamy. Ve srovnání s beta-laktamy působí pomaleji a mají užší spektrum účinku – působí jen na grampozitivní bakterie. Jsou také potenciálně nefrotoxická. Jejich hlavní předností je velmi vzácný vznik rezistence; tato antibiotika se proto používají jako záložní přípravky, proti multirezistentním mikrobům. Typickou indikací je léčba závažných infekcí vyvolaných stafylokoky rezistentními k oxacilinu (methicilin rezistentní Staphylococcus aureus – MRSA).
Aminoglykosidy, polymyxiny a lipopeptidy (gentamicin, amikacin, kolistin, daptomycin) poškozují buněčnou membránu bakterií a působí tak ještě rychleji a razantněji než beta-laktamy. V porovnání s beta-laktamy vůči nim také vzácněji vzniká rezistence. Jejich hlavní nevýhodou je toxicita a z ní vyplývající úzké terapeutické rozmezí. Stejně jako předchozí skupina se tato antibiotika považují za záložní přípravky a používají se v léčbě závažných infekcí vyvolaných rezistentními mikroby.
Všechna výše zmíněná antibiotika účinkují velmi dobře v krevním řečišti a v dobře prokrvených tkáních, naopak špatně pronikají do abscesů, ischemické tkáně, do biofilmu nebo na povrch sliznic. Hodí se proto k léčbě sepsí a dalších akutních pyogenních infekcí, naopak mohou selhávat u infekcí povrchových nebo chronických a rovněž u infekcí způsobených intracelulárně žijícími mikroby.
Nitroimidazoly (metronidazol, ornidazol) nespecificky poškozují různé součásti bakteriálních buněk. Spektrum účinku je omezeno na striktně anaerobně rostoucí bakterie a také na některé prvoky. V těchto indikacích se v praxi běžně používají, jejich využití zpravidla nečiní obtíže ani pacientům ani ordinujícím lékařům. Rezistence vůči nitroimidazolům vzniká velmi obtížně.
Fluorochinolony a ansamyciny (rifampicin a jeho deriváty) zastavují činnost enzymů, které v bakteriálních buňkách obsluhují nukleové kyseliny. Obě tyto skupiny se sice počítají mezi baktericidní antibiotika, mají však slabší účinek než ostatní výše jmenované přípravky a pro léčbu sepse nejsou dostatečně spolehlivé. Jejich další nevýhodou je relativně snadný vznik rezistence. Naopak jejich předností je dobrý průnik do buněk, do biofilmu a na povrch sliznic. Nejvhodnějším využitím těchto antibiotik je léčba závažných infekcí vyvolaných intracelulárně rostoucími bakteriemi (břišní tyfus, tuberkulóza) nebo bakteriemi rostoucími v biofilmu (infekce implantátů, není-li možné vyřešit situaci extrakcí infikovaného materiálu).
Bakteriostatická antibiotika mohou být použita u některých závažných infekcí (např. makrolidová antibiotika při léčbě legionelózy, fidaxomicin při léčbě klostridiové kolitidy, tigecyklin při léčbě nitrobřišního abscesu, chloramfenikol při léčbě abscesu mozku atd), jde však o poměrně výjimečné situace a je žádoucí, aby takovou terapii schválil kompetentní odborník, ideálně lékař místního antibiotického střediska. Obecně totiž platí, že bakteriostatická antibiotika nejsou vhodná pro léčbu sepsí ani pro léčbu rychle probíhajících infekcí, jednak kvůli svému pomalejšímu účinku a dále proto, že pro úspěšné zvládnutí infekce potřebují ještě spoluúčast imunitního systému.
Dávkování a způsob podání
Dávkování se při léčbě závažných infekcí drží vždy při horní hranici terapeutického rozpětí. Toto doporučení vyplývá z předpokladu, že u závažných infekcí imunitní systém selhává (jinak by se infekce nevyvinula do závažného stadia), a tedy při léčbě nemůžeme se spoluúčastí imunity počítat. Jinými slovy, antibiotika musí být schopna usmrtit populaci patogenních bakterií sama, bez pomoci imunitního systému. V praxi je lékař často nucen řešit otázku, zda použít vyšší dávkování i za cenu rizika různých nežádoucích účinků. U život ohrožujících infekcí je zvýšené dávkování oprávněné, protože infekce představuje větší hrozbu quoad vitam než např. riziko poškození ledvin.
Při úvahách o dávkování je nutné brát v potaz i individuální farmakokinetiku nemocného. Zejména u pacientů v podmínkách intenzivní péče se farmakokinetické parametry mohou změnit natolik, že se standardní dávkování ukáže jako nadměrné nebo naopak jako nedostatečné (tab. 2). Tuto problematiku rozvinuli v 70.–80. letech minulého století Zaske et al [12,13], v současnosti existuje na toto téma množství studií i přehledových prací [14–16]. Správné dávkování pro konkrétního nemocného je možné přibližně určit pomocí různých nomogramů, nejspolehlivější však je přímé monitorování sérových hladin antibiotik (Therapeutic Drug Monitoring – TDM).
Table 2. Změny objemu extracelulární tekutiny a renální eliminace za různých stavů 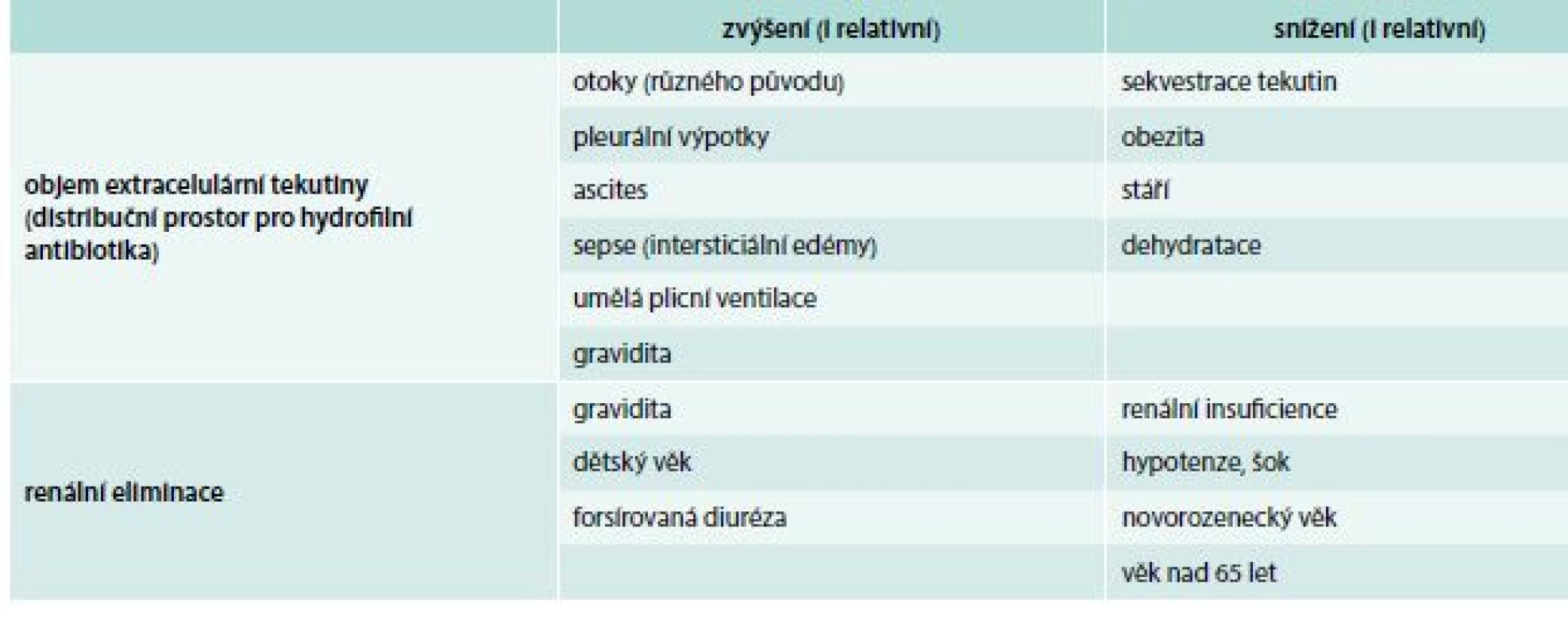
Podle účinku na citlivé bakterie se antibiotika dělí do 3 skupin:
- Přípravky, o jejichž účinku rozhoduje dosažená maximální koncentrace. Do této skupiny patří aminoglykosidy, kolistin, daptomycin, metronidazol a do jisté míry i fluorochinolony. U těchto přípravků je výhodné soustředit celkovou denní dávku do 1–2 denních dávek.
- Přípravky, o jejichž účinku rozhoduje doba, po kterou se jejich hladina v ložisku infekce udržuje nad hodnotou minimální inhibiční koncentrace (MIC). Typickými zástupci této skupiny jsou beta-laktamová antibiotika. Tyto přípravky je výhodné podávat v krátkých intervalech, v závislosti na jejich biologickém poločase (tab. 3), anebo formou prodloužených infuzí. V některých situacích se osvědčuje i kontinuální podávání, nelze ale říci, že kontinuální podávání je jednoznačně nebo obecně výhodnější [11,17–18].
- O účinnosti ostatních přípravků rozhoduje velikost plochy pod křivkou (Area Under Curve – AUC). Záleží především na celkové denní dávce, a způsob jejího rozdělení do dílčích dávek není příliš významný.
Table 3. Optimální dávkování beta-laktamových antibiotik vzhledem k jejich biologickému poločasu 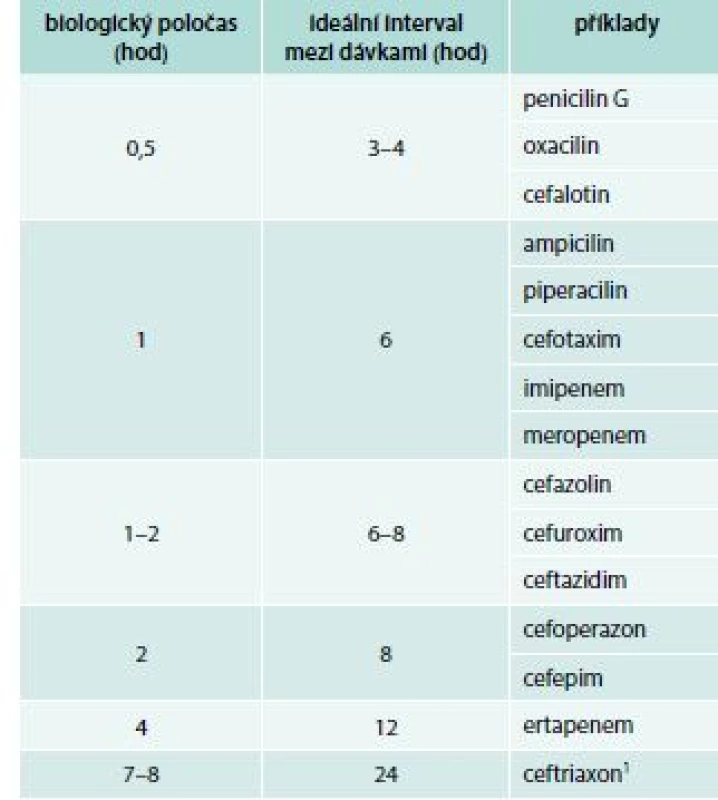
1 Dlouhý poločas ceftraxonu je umožněn vysokou vazbou antibiotika na albumin a další bílkoviny séra (≥ 95 %). Podáme-li ceftriaxon pacientovi s hypalbuminemií, je spolehlivější ho aplikovat ve 12hodinových intervalech Úvodní antibiotická léčba u závažných infekcí se vždy podává parenterálně. I když jde o přípravky podávané perorálně, u nichž výrobce deklaruje 90–100% biologickou dostupnost, musíme počítat s tím, že při závažné infekci a zejména při sepsi dochází k centralizaci oběhu a za těchto podmínek přestává být vstřebávání z gastrointestinálního traktu spolehlivé.
Význam úvodní nasycovací dávky
Při pravidelném užívání různých léků, včetně antibiotik, je plného účinku dosaženo při ustavení rovnovážného stavu (steady state), čili po uplynutí 4–5násobku biologického poločasu [19]. Při léčbě závažných bakteriálních infekcí potřebujeme dosáhnout plného antibakteriálního účinku co nejrychleji, proto se v úvodu terapie zpravidla podává tzv. nasycovací dávka, jejíž velikost je o 50–100 % větší ve srovnání s běžnou dávkou.
Přesněji vzato je velikost nasycovací dávky závislá na velikosti aktuálního distribučního objemu u daného pacienta. Jestliže má pacient např. dostávat hydrofilní antibiotikum (aminoglykosid, vankomycin nebo některý z beta-laktamů) a má přitom rozsáhlé edémy, ascites, je ventilován nebo má jinou příčinu odpovídající za zvýšení objemu extracelulární tekutiny, může být potřebná nasycovací dávka vyšší než 2násobek běžné terapeutické dávky [20].
Kromě požadavku na rychlý antibakteriální účinek existuje i další důvod pro navýšení úvodní dávky, a tím je prevence rezistence bakteriální populace. Při pomalém vzestupu koncentrace antibiotika v prostředí totiž některé bakterie dokáží aktivovat různé adaptační mechanizmy (tvorba inducibilních beta-laktamáz, zvýšení aktivity efluxních pump apod), a tak zvýšit svou odolnost. Promptní účinek baktericidního antibiotika zabrání těmto adaptacím, ale má ještě další důsledek v podobě rychlého snížení celkové bakteriální nálože. Rezistence bakterií se totiž může rozvinout nejen na základě preexistujících adaptačních mechanizmů, ale i v důsledku náhodných mutací, které se pro bakterii ukáží jako užitečné. Mutace u každého bakteriálního druhu vznikají s víceméně konstantní frekvencí, takže čím více buněk bakteriální populace obsahuje, tím je pravděpodobnost vzniku náhodných mutací větší. Buňka, v níž nastala užitečná mutace, vytvoří nový klon bakterií, který může původní populaci postupně zcela nahradit. Jestliže tedy v důsledku antibiotického zásahu klesne velikost bakteriální populace např. na 1/10, zmenší se 10krát i riziko, že se v bakteriální populaci objeví nová mutace zajišťující rezistenci.
U některých antibiotik není navýšení úvodní dávky možné kvůli omezené snášenlivosti. Vysoká úvodní dávka může např. u citlivějších osob vyvolat zvracení nebo jiné nežádoucí projevy. V takových případech je možné jako alternativní řešení zvolit zkrácení intervalů mezi jednotlivými dávkami na počátku léčby.
Perakutně probíhající infekce
Z úvodní části tohoto článku by bylo možné vyvodit, že požadavek na zahájení antibiotické terapie do 1 hodiny od stanovení diagnózy sepse nebo septického šoku je již překonaný. Domnívám se, že ve většině případů tomu tak je, existují však výjimky. Těmito výjimkami míním perakutně probíhající infekce, jejichž příklady ukazuje tab. 4. Podle našich zkušeností rozhoduje u těchto infekcí o prognóze pacientů opravdu každá hodina intervalu mezi počátkem nemoci a zahájením antibiotické léčby, záleží snad i na každé čtvrthodině.
Table 4. Příklady perakutně probíhajících infekcí. V léčbě nemocí s významnou produkcí toxinů se do terapie k beta-laktamům přidává další antibiotikum, jehož úkolem je zablokovat bakteriím proteosyntézu (podrobněji v textu) 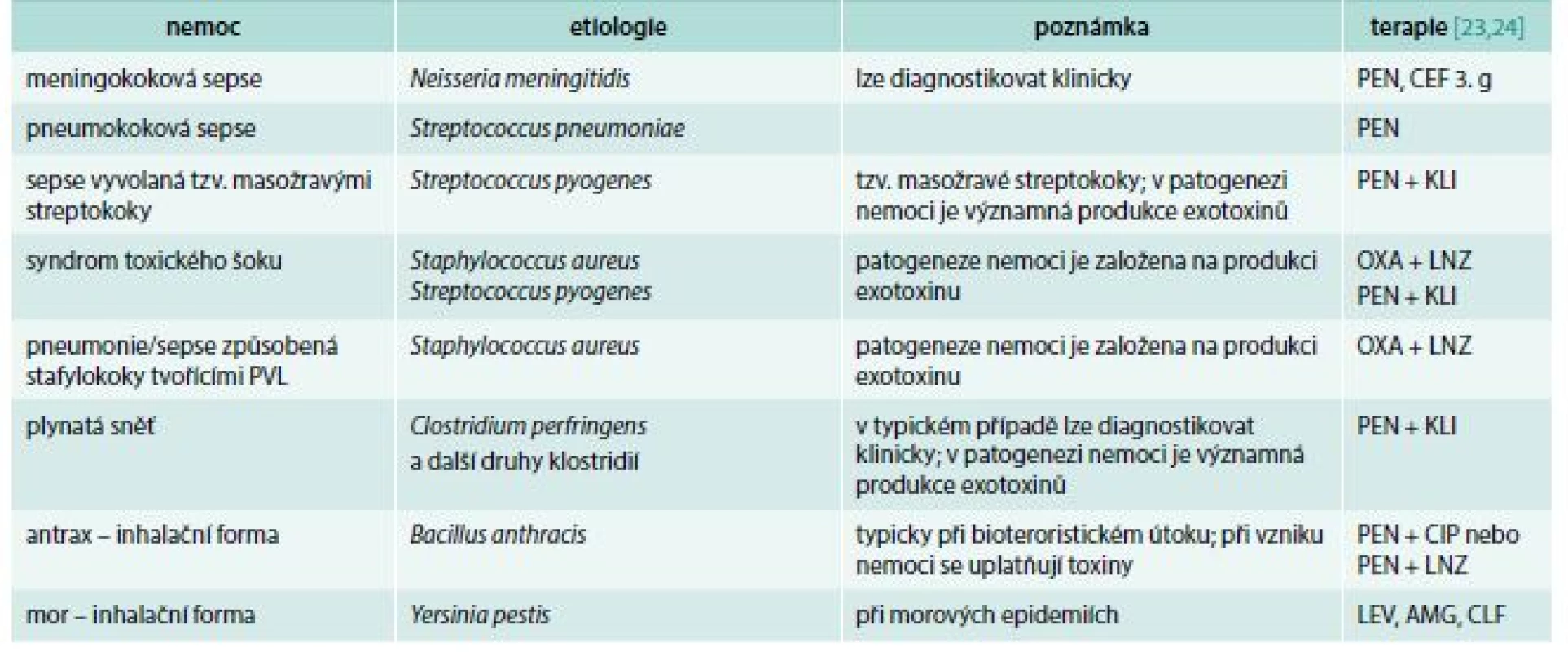
AMG – aminoglykosid CEF 3. g – cefalosporin 3. generace CIP – ciprofloxacin CLF – chloramfenikol KLI – klindamycin LEV – levofloxacin LNZ – linezolid OXA – oxacilin PEN – penicilin PVL – Pantonův-Valentinův leukocidin Z pochopitelných důvodů u těchto nemocí nejsou a pravděpodobně nikdy nebudou k dispozici dobře dokumentované, prospektivní, randomizované multicentrické studie, které by spolehlivě prokázaly nezbytnost neodkladného zahájení adekvátní antibiotické léčby. Naše doporučení proto zůstanou na úrovni pouhého odborného názoru (expert opinion). Přesto mohou být považovány nejen za správné (ve smyslu oprávněné či přijatelné), ale dokonce i za závazné.
Příčinou perakutního průběhu infekce může být závažná porucha imunity (těžká neutropenie, defekt tvorby protilátek, porucha syntézy některých složek komplementu) anebo výjimečná virulence patogenního mikroba, která může mít několik příčin:
- silné pouzdro, které dokáže bakterie ochránit před fagocytózou i před lytickým působením komplementu (Neisseria meningitidis, Streptococcus pneumoniae, Staphylococcus pyogenes, Bacillus anthracis, Yersinia pestis)
- tvorba výkonných toxinů, které usmrcují okolní buňky včetně leukocytů (Staphylococcus aureus, Staphyloccus pyogenes, Bacillus anthracis, histiotoxická klostridia)
- tvorba toxinů, které aktivují makrofágy a lymfocyty a stimulují u nich produkci TNFα a dalších prozánětlivých cytokinů (Staphyloccus aureus, Staphyloccous pyogenes, Bacillus anthracis)
- atypické místo vstupu infekce do lidského organizmu (obvykle inhalační cestou), které usnadní rychlý průnik bakterií a jejich toxinů do hlubokých tkání (Staphylococcus aureus, Bacillus anthracis, Yersinia pestis)
Znalost patogeneze je nezbytná pro výběr optimální antibiotické léčby. Základem terapie zůstávají beta-laktamová antibiotika, tato terapie však nemusí být dostačující (viz poslední sloupec tab. 2). Při léčbě infekcí, jejichž závažnost je určována produkcí toxinu, je vhodné použít antibiotika, která bakteriím zastaví proteosyntézu. I rychle působící baktericidní antibiotika totiž nezahubí celou bakteriální populaci najednou. Kdyby tomu tak bylo, stačilo by podat jen 1–2 dávky antibiotika a nemoc by tím byla vyřešena. Za normálních podmínek se ale část bakteriální populace nachází v hůře prokrvené tkáni, do které antibiotika nepronikají tak snadno, a kromě toho některé bakterie mají přirozeně pomalejší metabolizmus (perzistují), takže účinek antibiotik vůči nim je výrazně slabší [21,22].
Bakterie, které nejsou přítomností antibiotika usmrceny, ale jen stresovány, často reagují právě tím, že v sebeobraně zvýší produkci toxinů.
U infekcí vyvolaných grampozitivními bakteriemi se do kombinace s beta-laktamy zpravidla přidává klindamycin nebo linezolid. Linezolid je z této dvojice spolehlivější, protože je u něj nižší riziko rezistence, a má také výhodu výborného průniku do plicní tkáně, nezávislého na pohybu leukocytů [11].
Linezolidu se proto dává přednost před klindamycinem, pokud je podezření, že agens je rezistentní k běžným antibiotikům (MRSA), anebo tehdy, jestliže infekce probíhá v plicní tkáni.
Klinická diagnostika perakutních infekcí
Etiologii perakutně probíhající sepse lze odhadnout v případě invazivního meningokokového onemocnění podle kožních petechií a sufuzí, které se vyskytují především na obličeji a na akrálních částech končetin a kterých stále přibývá. Poměrně typický bývá také obraz plynaté sněti, zejména vznikla-li jako následek poranění: nemoc se vyznačuje silnou lokální bolestivostí, rychlou alterací celkového stavu a serózně hemoragickou nebo hematinovou sekrecí z rány. Ostatní choroby, jmenované v tab. 4, nelze klinicky identifikovat. Jedinou nadějí pro postižené osoby je rychlé rozpoznání závažného stavu, jednak na laické úrovni – např. v rodině nemocného, a dále při prvním kontaktu se zdravotníky. Z tohoto důvodu je vysoce žádoucí, aby nejen všichni zdravotníci, ale i běžní občané uměli rozpoznat projevy sepse. V praxi postačí znalost tzv. quick SOFA skóre (Sepsis-related Organ Failure Assessment – SOFA), které zahrnuje 3 jednoduché symptomy – náhle vzniklou hypotenzi, tachypnoi, poruchu vědomí, přičemž přítomnost 2 z těchto symptomů zakládá silné podezření na probíhající sepsi a je důvodem pro urgentní přijetí nemocného na oddělení intenzivní péče [9].
Perakutní sepse je charakterizována rychlým vývojem nemoci, při němž se příznaky sepse rozvíjejí z plného zdraví během několika hodin. Dalším typickým nálezem je diskrepance mezi vysokou hodnotou sérového prokalcitoninu a nízkou hladinou C-reaktivního proteinu, který ještě nestačil vzrůst. Počet leukocytů naopak není spolehlivým indikátorem závažnosti nemoci: perakutní infekce se obvykle spojena s leukocytózou, ale může být doprovázena i leukopenií, způsobenou rozpadem leukocytů vlivem mikrobiálních toxinů.
Mikrobiologická diagnostika perakutních infekcí
Z rychlých mikrobiologických diagnostických metod se pro základní orientaci velmi dobře hodí mikroskopické vyšetření hnisu nebo sekretů nahromaděných v ložisku infekce. Po obarvení preparátu podle Grama lze rozpoznat základní charakteristiku bakterií (koky vs bacily, grampozitivní vs gramnegativní) a často je možné podle charakteristické morfologie odhadnout i rod mikroba (neisserie, pneumokoky, streptokoky, stafylokoky, klostridia), a dokonce i jeho virulenci (podle tloušťky pouzdra nebo i podle toho, zda jsou bakterie fagocytovány).
Další možností u dobře vybavených mikrobiologických laboratoří je detekce mikrobiálních nukleových kyselin v různých sekretech nebo v krvi. Tyto metody klinici často nepřesně označují jako PCR diagnostiku; ve skutečnosti PCR je jen jednou z mnoha různých metod využívajících podobného principu. Předností těchto metod je exaktnost a vysoká citlivost, mezi nevýhody je nutno počítat vysokou cenu a riziko falešné pozitivity při kontaminaci vzorku. Hlavním problémem je však skutečnost, že tyto genetické metody jsou zpravidla konstruovány tak, aby prokázaly přítomnost či nepřítomnost jen jednoho nebo několika málo druhů bakterií. Jiné než předem určené bakterie tedy tato vyšetření nejsou schopna identifikovat.
V některých případech je možné prokazovat přítomnost jednotlivých bakteriálních toxinů nebo jiných mikrobiálních antigenů; typickým příkladem je průkaz pneumokokového antigenu v moči nemocných, kteří mají pneumokokovou sepsi.
Žádné ze jmenovaných mikrobiologických vyšetření však nemůže nahradit standardní kultivaci, protože nedokáže určit citlivost agens k antibiotikům. To je zejména u nozokomiálních nákaz nezbytné.
Závěr
Vždy, když se lékař rozhodně podat pacientovi antibiotikum, měl by se na okamžik v duchu zastavit a zeptat se sám sebe, jestli není možné odebrat nějaký přiměřený materiál na kultivaci. Po zahájení antibiotické léčby se možnost izolovat agens a zjistit jeho citlivost velmi rychle ztrácí.
Bez znalosti etiologie a citlivosti vyvolávajícího agens jsme odkázáni na použití širokospektrých přípravků, což je strategie krátkodobě účinná, ale dlouhodobě zhoubná, protože podporuje vznik a šíření rezistence v bakteriálních populacích.
prof. MUDr. Jiří Beneš, CSc.
Klinika infekčních nemocí 3. LF UK a Nemocnice Na Bulovce, Praha
Doručeno do redakce 13. 6. 2018
Přijato po recenzi 28. 1. 2019
Sources
-
Kumar A, Roberts D, Wood KE et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006; 34(6): 1589–1596. Dostupné z DOI: <http://dx.doi.org/10.1097/01.CCM.0000217961.75225.E9>.
-
Ferrer R, Martin-Loeches I, Phillips G et al. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: results from a guideline-based performance improvement program. Crit Care Me 2014; 42(8): 1749–1755. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000000330>.
-
Rhodes A, Evans LE, Alhazzani W et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med 2017; 45(3): 486–552. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000002255>.
-
Ryoo SM, Kim WY, Sohn CH et al. Prognostic value of timing of antibiotic administration in patients with septic shock treated with early quantitative resuscitation. Am J Med Sci 2015; 349(4): 328–333. Dostupné z DOI: <http://dx.doi.org/10.1097/MAJ.0000000000000423>.
-
Puskarich MA, Trzeciak S, Shapiro NI et al. Association between timing of antibiotic administration and mortality from septic shock in patients treated with a quantitative resuscitation protocol. Crit Care Med 2011; 39(9): 2066–2071. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e31821e87ab>.
-
de Groot B, Ansems A, Gerling DH et al. The association between time to antibiotics and relevant clinical outcomes in emergency department patients with various stages of sepsis: a prospective multi-center study. Crit Care 2015; 19 : 194. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–015–0936–3>.
-
Alam N, Oskam E, Stassen PM et al. Prehospital antibiotics in the ambulance for sepsis: a multicentre, open label, randomised trial. Lancet Respir Med 2018; 6(1): 40–50. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–2600(17)30469–1>.
-
Bolliger R, Merker M, Schuetz P. Use of antibiotics in the ambulance for sepsis patients: is earlier really better? J Thorac Dis 2018; 10(3): 1239–1241. Dostupné z DOI: <http://dx.doi.org/10.21037/jtd.2018.02.49>.
-
Singer M, Deutschman CS, Seymour CW et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315(8): 801–810. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2016.0287>.
-
Bone RC, Balk RA, Cerra FB et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992; 101(6): 1644–1655.
-
Beneš J. Antibiotika: systematika, vlastnosti, použití. Grada: Praha 2018. ISBN 978–80–271–0636–3.
-
Zaske DE, Cipolle RJ, Rotschafer JC et al. Gentamicin pharmacokinetics in 1,640 patients: method for control of serum concentrations. Antimicrob Agents Chemother 1982; 21(3): 407–411.
-
Zaske DE, Sawchuk RJ, Gerding DN et al. Increased dosage requirements of gentamicin in burn patients. J Trauma 1976; 16(10): 824–828.
-
Felton TW, Hope WW, Roberts JA. How severe is antibiotic pharmacokinetic variability in critically ill patients and what can be done about it? Diagn Microbiol Infect Dis 2014; 79(4): 441–447. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diagmicrobio.2014.04.007>.
-
Parker SL, Sime FB, Roberts JA. Optimizing dosing of antibiotics in critically ill patients. Curr Opin Infect Dis 2015; 28(6): 497–504. Dostupné z DOI: <http://dx.doi.org/10.1097/QCO.0000000000000206>.
-
Tängdén T, Ramos Martín V, Felton TW et al. The role of infection models and PK/PD modelling for optimising care of critically ill patients with severe infections. Intensive Care Med 2017; 43(7): 1021–1032. Dostupné z DOI: <http:///dx.doi.org/10.1007/s00134–017–4780–6>.
-
Chant C, Leung A, Friedrich JO. Optimal dosing of antibiotics in critically ill patients by using continuous/extended infusions: a systematic review and meta-analysis. Crit Care 2013; 17(6): R279. Dostupné z DOI: <http://dx.doi.org/10.1186/cc13134>.
-
Shiu J, Wang E, Tejani AM et al. Continuous versus intermittent infusions of antibiotics for the treatment of severe acute infections. Cochrane Database Syst Rev 2013; (3): CD008481. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD008481.pub2>.
-
Sechser T. Farmakokinetika pro lékaře. Část IV – Biologický poločas. Remedia 1992; 2(6): 312–315.
-
Reardon J, Lau TT, Ensom MH. Vancomycin loading doses: a systematic review. Ann Pharmacother 2015; 49(5): 557–565. Dostupné z DOI: <http://dx.doi.org/10.1177/1060028015571163>.
-
Tkadlec J, Melter O. Trpasličí kolonie Staphylococcus aureus. Klin Mikrobiol Infekc Lek 2013; 19(3): 96–102.
-
Beneš J, Džupová O. Bakterie tvořící drobné kolonie (small-colony variants) jako původci infekční endokarditidy a dalších závažných infekcí. Klin Mikrobiol Infekc Lék 2013; 19(2): 56–61.
-
Bennett JE, Dolin R, Blaser MJ (eds). Principles and Practice of Infectious Diseases. 8th ed. Elsevier Saunders 2015. ISBN 9781455748013.
-
Cohen J, Powderly WG, Opal SM et al (eds). Infectious Diseases. 2 voll. 4th ed. Elsevier 2017. ISBN 9780702062858.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 3-
All articles in this issue
- Nestabilní nemocný při prvním kontaktu s lékařem v nemocnici: jak rozpoznat riziko?
- Diagnostika hypovolemie a hypervolemie: od klinického vyšetření po moderní metody
- Význam ultrasonografického vyšetření v diagnostice akutních stavů
- Tekutinová léčba u akutních stavů pro neintenzivisty
- Syndrom akutní dechové tísně
- Úvodní antibiotická léčba závažných bakteriálních infekcí
- Hemoragický šok a léčba masivního krvácení
- Výživa v akutní fázi nemoci
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hemoragický šok a léčba masivního krvácení
- Tekutinová léčba u akutních stavů pro neintenzivisty
- Syndrom akutní dechové tísně
- Diagnostika hypovolemie a hypervolemie: od klinického vyšetření po moderní metody
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

