-
Medical journals
- Career
Terapeutická digestivní endoskopie I
Authors: Přemysl Falt 1,2; Ondřej Urban 1
Authors‘ workplace: II. interní klinika – gastroenterologická a hepatologická LF UP a FN Olomouc 1; II. interní gastroenterologická klinika LF UK v Hradci Králové 2
Published in: Vnitř Lék 2018; 64(6): 684-692
Category: Reviews
Overview
Digestivní endoskopií lze v současné době vyšetřit celý gastrointestinální trakt. Na bázi původně čistě diagnostických procedur se v průběhu let vyvinula řada terapeutických modalit, které v některých indikacích nahradily chirurgickou léčbu a metody invazivní radiologie. Nejvýznamnější jsou metody endoskopické resekce a ablace určené k léčbě časných neoplazií trávicí trubice, které nejsou provázeny významným rizikem lymfatické a systémové diseminace. Mezi resekční metody patří endoskopická polypektomie, endoskopická mukózní resekce, endoskopická submukózní disekce a endoskopická transmurální resekce. Z ablačních metod je v klinické praxi běžně užívána radiofrekvenční ablace v léčbě dysplastického Barrettova jícnu a argonová plazmakoagulace užívaná v léčbě symptomatických cévních malformací a drobných lokálních reziduálních neoplazií.
Klíčová slova:
digestivní endoskopie – endoskopická ablace – endoskopická mukózní resekce – endoskopická polypektomie – endoskopická resekce – endoskopická submukózní disekce – endoskopická transmurální resekce
Úvod
Moderní digestivní endoskopie umožňuje různě designovanými flexibilními endoskopy nahlížet přirozenými otvory do celého gastrointestinálního traktu (GIT). Na bázi prográdního vyšetření snadno dostupných částí GIT jako je jícen, žaludek a duodenum (horní endoskopie) a tlusté střevo (koloskopie) se postupně vyvinuly další endoskopické techniky. Jedná se o flexibilní endoskopii špatně dostupného tenkého střeva s různými mechanizmy zavádění („push“, jednobalonová, dvoubalonová a spirální enteroskopie), duodenoskopy s laterální optikou s možností sondáže žlučových a pankreatických cest pod skiagrafickou kontrolou (endoskopická retrográdní cholangiopankreatikografie – ERCP), endoskopy s miniaturizovanými ultrasonografickými sondami (endosonografie – EUSG), ultratenké endoskopy k přímé vizualizaci žlučových cest a pankreatického vývodu (cholangioskopie) a bezdrátové endoskopické techniky (kapslová enteroskopie a koloskopie). Současně dochází k postupnému zdokonalování mechanických vlastností endoskopů, endoskopického zobrazení včetně zvětšení obrazu, virtuální chromoendoskopie (Narrow Band Imaging – NBI; Fuji Intelligent ChromoEndoscopy – FICE; i-scan; AutoFluorescence Imaging – AFI) a endomikroskopie (Confocal Laser Endomicroscopy – CLE) a vzniku široké škály endoskopického příslušenství. Na bázi původně čistě diagnostických procedur se v průběhu let vyvinula řada terapeutických modalit, které v některých indikacích nahradily chirurgickou léčbu a metody invazivní radiologie. Typickým příkladem je ERCP, které je v současné době indikováno téměř výhradně s terapeutickým záměrem a její diagnostická složka byla nahrazena méně invazivními metodami (magnetickou rezonanční cholangiopankreatikografií – MRCP nebo EUSG). V poslední době se úspěšně rozvíjí i tzv. transmurální a submukózní endoskopie, při které endoskop prochází do submukózy nebo mimo stěnu trávicí trubice. Technika NOTES (Natural Orifice Transmural Endoscopic Surgery) sice změnila paradigma digestivní endoskopie a vedla k vývoji některých postupů a endoskopických akcesorií, sama však zatím v praxi nenalezla širšího uplatnění. Zato jiné transmurální techniky jako endoskopické drenáže tekutinových a nekrotických kolekcí, endoskopická transmurální resekce a POEM (PerOral Endoscopic Myotomy) v léčbě achalázie jícnu se ve specializovaných centrech pomalu stávají zavedenými modalitami.
Endoskopická resekce
Endoskopická resekce umožňuje s použitím různých technik odstranění neoplastické léze i s lemem zdravé tkáně. Současně poskytuje reprezentativní vzorek umožňující detailní histopatologické vyšetření. Základním předpokladem kurativní endoskopické resekce je endoskopická dostupnost léze, velikost umožňující její kompletní (nejlépe en bloc) odstranění a příznivý histopatologický staging. Hlavní podmínkou je minimální riziko metastazování do lymfatických uzlin, které nejsou postižitelné endoskopickou léčbou. To v zásadě splňují dysplazie, intramukózní karcinomy a dobře diferencované karcinomy s povrchovou submukózní invazí (sm1) beze známek angioinvaze a lymfangioinvaze. Pokročilejší neoplazie jsou obvykle indikovány k dodatečné chirurgické resekci. Tato hranice se ale může mezi jednotlivými orgány lišit. Např. zatímco kompletní endoskopická resekce nízkorizikového sm1 adenokarcinomu tlustého střeva je považována za kurativní, u adenokarcinomu v Barrettově jícnu a v žaludku se jedná o hraniční stav, jehož další řešení se individuálně odvíjí od dalších faktorů včetně celkové kondice nemocného, a u dlaždicobuněčného karcinomu jícnu může být při sm1 invazi riziko lymfatické diseminace nepřiměřeně vysoké. Před vlastním pokusem o endoskopickou léčbu je žádoucí odhad rizika přítomnosti pokročilé neoplazie na základě morfologického typu, velikosti a povrchové struktury léze [1]. V některých případech může být nápomocné vyšetření klasickou endosonografií nebo endosonografií pomocí vysokofrekvenčních miniprob zavedených pracovním kanálem endoskopu [2]. Někdy tak lze zabránit rizikové resekci pokročilých a endoskopicky neřešitelných nádorů. Morfologie lézí hodnocená dle Pařížské klasifikace [3] také rozhoduje o volbě resekční techniky. Stopkaté polypy (0-Ip), obr. 1, a malé přisedlé polypy (0-Is) jsou odstraňovány technikou endoskopické polypektomie (EPE), větší přisedlé polypy (0-Is), obr. 2, a ploché léze (lehce vyvýšené 0-IIa, ploché 0-IIb), obr. 3, je nutno odstranit metodou endoskopické mukózní resekce (EMR) a snížená až vkleslá morfologie (0-IIc až 0-III), obr. 4, může signalizovat přítomnost invazivní neoplazie vhodné k endoskopické submukózní disekci (ESD), transmurální resekci nebo přímo k chirurgickému řešení. Typickými komplikacemi endoskopické resekce je krvácení a perforace. Krvácení během výkonu není považováno za komplikaci a je většinou zastaveno během výkonu (obr. 5). Opožděné krvácení ale může vyžadovat hospitalizaci, opakování endoskopie i podání krevního transfuzí. Při perforaci dochází k porušení kontinuity stěny orgánu řezem přes muscularis propria a serózu s rizikem vzniku peritonitidy. Perforace jsou většinou uzavřeny ihned aplikací klipů (obr. 6). Při neúspěšném uzávěru nebo opožděné perforaci je obvykle nutná chirurgická léčba. Po resekci větších plochy sliznice může pacient vykazovat příznaky fokální peritonitidy bez prokazatelné perforace. Jde o tzv. koagulační syndrom, jehož léčba je obvykle konzervativní [4].
Obr. 1. Stopkatý polyp transversa (typ 0-Ip dle Pařížské klasifikace), histologicky tubulovilózní adenom s těžkou dysplazií 
Obr. 2. Objemný přisedlý polyp sigmoidea (typ 0-Is dle Pařížské klasifikace), histologicky tubulární adenom s těžkou dysplazií 
Obr. 3. Plochá léze rekta (typ 0-IIa + Is dle Pařížské klasifikace, tzv. LST-GM), histologicky tubulární adenom s těžkou dysplazií 
Obr. 4. Vkleslá léze ascendens (typ 0-IIc dle Pařížské klasifikace), histologicky adenokarcinom s povrchní submukózní invazí (sm1) 
Obr. 5.1. Drobná krvácející céva po endoskopické resekci polypu 
Obr. 5.2. Zástava krvácení aplikací endoklipu, mezi branžemi klipu patrný uzavřený pahýl cévy 
Obr. 6.1. Drobná perforace ve spodině po endoskopické resekci polypu 
Obr. 6.2. Uzávěr perforace a spodiny aplikací endoklipů 
Endoskopická polypektomie
Endoskopická polypektomie (EPE) je metoda primárně určená k resekci stopkatých polypů. Při EPE je na stopku tvořenou normální sliznicí nasazena polypektomická klička. Zaškrcením kličky a současnou aplikací elektrokoagulačního proudu dochází k resekci polypu (obr. 7). Riziko krvácení ze stopky snižuje elektrokoagulace probíhajících cév, u rizikových a polypů ho lze dále snížit aplikací roztoku adrenalinu do stopky, nasazením kovového endoklipu nebo odnímatelné smyčky (endoloop) na stopku. Polypektomickou kličkou jsou odstraňovány i přisedlé a ploché léze ≤ 9 mm, u kterých se zdá být výhodnější pouze mechanická resekce kličkou bez použití elektrokoagulace (cold snare polypectomy), obr. 8. Pro vysoké riziko inkompletní resekce je dříve často užívaná klešťová biopsie nyní doporučována pouze pro diminutivní polypy < 3 mm [5–7]. Adenomové polypy jsou při diagnostické koloskopii velmi častým nálezem a jejich odstranění významně snižuje riziko vzniku kolorektálního karcinomu [8]. EPE je proto nejčastějším a nejvýznamnějším terapeutickým zásahem digestivní endoskopie, který by měl ovládat každý endoskopista. Proporce pacientů podstupujících preventivní koloskopii, u kterých je nalezen alespoň 1 adenom (tzv. ADR – Adenoma Detection Rate), je také považována za hlavní parametr kvality koloskopie, který inverzně koreluje s výskytem intervalových karcinomů [7,9]. V oblasti horního GIT je EPE užívána relativně vzácně, většinou k resekci větších a symptomatických hyperplastických polypů žaludku. Časné neoplastické léze jícnu, žaludku a tenkého střeva jsou vzhledem ke své obvykle nepolypoidní morfologii většinou odstraňovány technikami EMR a ESD.
Obr. 7.1. Nasazení polypektomické kličky na stopkatý polyp zobrazený na obr. 1, s. 685 
Obr. 7.2. Zaškrcení a resekce polypu elektrokoagulačním proudem v jeho stopce 
Obr. 8.1. Nasazení „studené kličky“ na drobnou plochou lézi sigmoidea 
Obr. 8.2. Spodina po resekci kličkou bez použití elektrokoagulačního proudu 
Endoskopická slizniční resekce
Endoskopická slizniční resekce (EMR) je novější technika vyvinutá k resekci přisedlých a plochých lézí ≥ 10 mm, které nelze bezpečně odstranit prostou polypektomií. Základním principem EMR je oddálení léze od svalové vrstvy stěny trávicí trubice a poté resekce takto vytvořeného polypu kličkou a aplikací elektrokoagulačního proudu. V tlustém střevě, v němž je výskyt takových lézí nejčastější, je užívaná technika „lift and cut“ spočívající v submukózní aplikaci roztoku různého složení do submukózy pod neoplastickou lézi a po jejím vyzdvižení (lifting) je léze resekována (obr. 9). Submukózní injektáž má i diagnostický význam. Tzv. „non-lifting“ naznačuje fixaci léze buď hluboce invadující neoplazií, nebo submukózní fibrózou. Léze ≤ 20 mm většinou lze odstranit en bloc s možností přesného histopatologického posouzení resekčních okrajů. En bloc resekce větších lézí je provázena vyšším rizikem perforace, proto jsou většinou odstraňovány po částech (piecemeal) [5,7,10]. V těchto případech je ale vyšší riziko vzniku lokálních reziduálních neoplazií (LRN) [11], jejichž další řešení je znesnadněno jejich jizevnatou fixací. V léčbě časných neoplazií jícnu jsou užívány jiné modifikace EMR. Při technice „suck and cut“ (EMR-C) je na distální konec endoskopu nasazen plastový nástavec (cap), do kterého je po submukózní injekci nasáta neoplazie a resekována kličkou naloženou v okraji „capu“ (obr. 10). Technika „band and snare“ (EMR-L) je obdobná jako při ligaci jícnových varixů a spočívá v nasátí tkáně do „capu“, podvázání pseudopolypu gumovým kroužkem a resekci kličkou [1,12].
Obr. 9.1. Submukózní podpich léze (zobrazené na jeví jako efektivní ve smyslu dosažených R0 resekcí a nízobr. 3, s. 685) injektorem s použitím fyziologického roztoku s přídavkem metylenové modři, patrný kompletní „lifting“ 
Obr. 9.2. Spodina po endoskopické resekci s patrnou modře zabarvenou submukózou 
Obr. 10.1. Neoplastická léze v oblasti Z-linie, histologicky intestinální metaplazie s těžkou dysplazií 
Obr. 10.2. Nasátí léze do plastového nástavce 
Table 1. Obr. 10.3. Spodina po resekci vytvořeného pseudopolypu 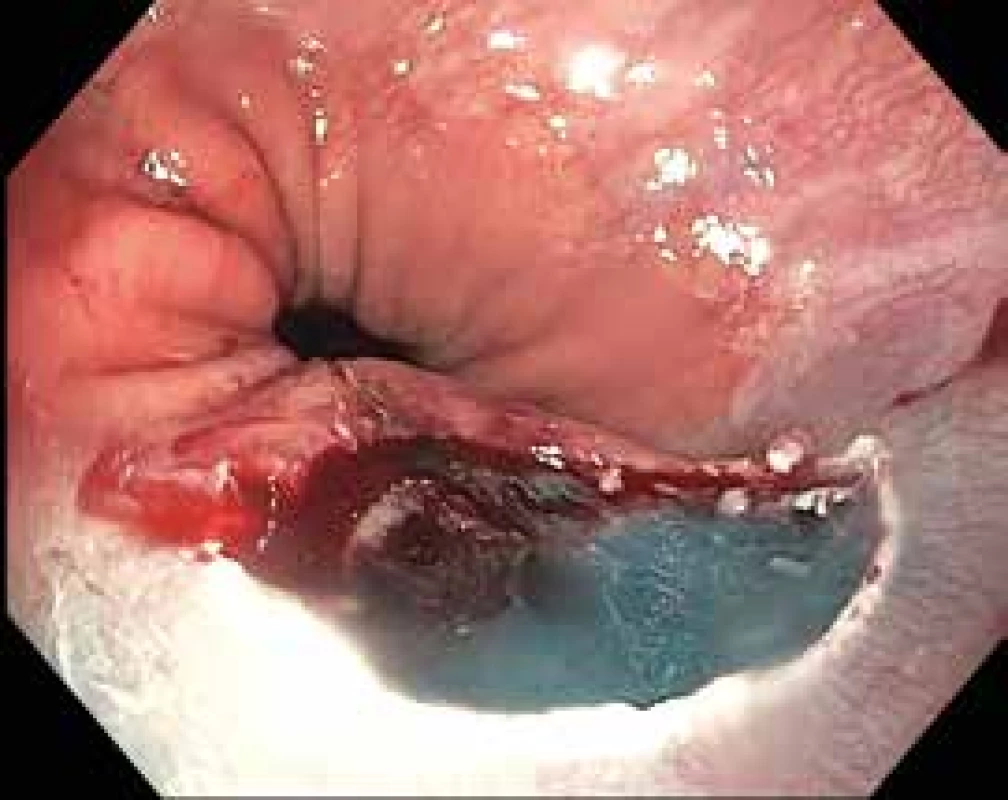
Obr. 10.4. Resekát našpendlený spodinou na korkovou podložku 
Endoskopická submukózní disekce
Endoskopická submukózní disekce (ESD) je resekční technika pracující s některým ze speciálních endoskopických nožů, jako jsou např. „IT (insulated tip) knife“ nebo „dual-knife“. Podobně jako v případě EMR začíná výkon submukózní injekcí roztoku. Následuje cirkulární incize kolem léze a submukózní disekce (obr. 11). Předností ESD je možnost en bloc snesení lézí, které by metodou EMR musely být odstraněny po částech. To je výhodné zejména u intramukózních a povrchově (sm1) invadujících karcinomů, pro které je dosažení en bloc R0 resekce podmínkou onkologicky adekvátního výkonu. Metoda ESD prakticky odstraňuje limitaci endoskopické resekce horizontálním rozměrem léze. Největší resekáty dosahují běžně několika desítek cm2. Zatímco metoda EMR je endoskopistům blízká, protože je v podstatě modifikací endoskopické polypektomie, ESD je považována za metodu nejvyšší technické obtížnosti. V současné době je ESD používána v terapii skvamózního karcinomu jícnu a adenokarcinomu žaludku. Časný adenokarcinom jícnu je k ESD indikován jen ve vybraných případech. V oblasti tlustého střeva jsou k ESD indikovány léze, u kterých lze na základě jejich endoskopické charakteristiky předpokládat přítomnost povrchově (sm1) invadujícícho karcinomu [13–15].
Obr. 11.1. Ložisko těžké dysplazie v antru žaludku, v okolí patrné označení lemu zdravé tkáně koagulačními body 
Obr. 11.2. Disekce ESD nožem patrným v levé části obrázku v modravě zabarvené submukóze po injektáži fyziologického roztoku s přídavkem metylenové modři 
Obr. 11.3. Spodina po dokončené ESD 
Obr. 11.4. Resekát našpendlený na korkovou podložku s patrnými koagulačními body 
Endoskopická transmurální resekce
Endoskopická transmurální resekce (Full-Thickness Resection – FTR) je nová technika schopná resekce celé stěny trávicí trubice. Po experimentálním užití různých technik transmurální resekce se nyní v klinické praxi rozšiřuje resekce pomocí setu FTRD (FTR Device), který kombinuje techniku OTS (Over-The-Scope) klipu, který byl primárně vyvinut k endoskopickému uzávěru perforace, a endoskopické slizniční resekce pomocí „capu“ (EMR-C). Tkáň je pomocí speciálních kleští vtažena do „capu“, přes vytvořený pseudopolyp tvořený duplikaturou střevní stěny je nasazen OTS klip a těsně nad ním je v distálním konci „capu“ resekován kličkou. Vzniklá perforace je tak vlastně uzavřena klipem ještě před tím, než je vytvořena [16,17] (obr. 12). Hlavní indikací jsou obtížné lokální reziduální neoplazie po EMR, adenomy nebo časné karcinomy tračníku s příznakem „non-liftingu“ a drobné neuroendokrinní tumory (NET). V těchto indikacích může nahradit technicky náročné ESD nebo chirurgickou resekci. V případě větších lézí ji lze kombinovat s klasickou EMR [18]. Technika se jeví jako efektivní ve smyslu dosažených R0 resekcí a nízkého výskytu komplikací [19]. Vzhledem k rozměrům setu je jeho užití limitováno na oblast tračníku, jsou však i zprávy o jeho použití v léčbě adenomů duodena [20].
Obr. 12.1. FTR set nasazený na distální konec koloskopu 
Obr. 12.2. Vtažení léze (zobrazené na obr. 4, s. 685) speciálními kleštěmi do plastového nástavce 
Obr. 12.3. Transmurální resekce uzavřená kovovým OTS klipem 
Obr. 12.4. Resekát našpendlený peritoneální stranou na korkovou podložku 
Endoskopická ablace
Endoskopická ablace spočívá v destrukci povrchu trávicí trubice různými fyzikálními principy. Oproti resekčním technikám je její výhodou možnost bezpečného a rychlého ošetření větších ploch patologické sliznice, která při hojení nahrazena její fyziologickou variantou. Na druhou stranu ablací nezískáme vzorek k histologickému vyšetření. Indikací k ablaci jsou proto pouze benigní choroby (cévní malformace), prekancerózní stavy (Barrettův jícen – BJ), povrchové neoplazie (dysplazie v terénu BJ, skvamózní dysplazie jícnu a drobné LRN tlustého střeva) anebo naopak jinak neřešitelné pokročilé nádory, u kterých chceme pouze zmenšit masu nádorové tkáně.
BJ je prekancerózní stav asociovaný s patologickým gastroezofageálním refluxem a je definován jako náhrada skvamózního epitelu jícnu epitelem kolumnárním (tzv. metaplazie). Jeho přítomnost zvyšuje riziko vzniku dysplazie až adenokarcinomu jícnu. Lokalizované časné neoplazie v terénu BJ jsou řešeny metodami endoskopické resekce popsané výše s následným histopatologickým stagingem. Reziduální plocha BJ po resekci nebo BJ bez viditelné léze jsou ošetřovány ablací, po které je sliznice BJ nahrazena neoskvamózním epitelem bez rizika maligní transformace [12]. Metodou volby je radiofrekvenční ablace (RFA). Jedná se o bipolární kontaktní aplikaci radiofrekvenčního proudu s termální destrukcí sliznice, která je aplikována buď pomocí balonu s cirkulární elektrodou, která se zavádí paralelně s endoskopem a slouží k ošetření větších ploch BJ (HALO 360), nebo pomocí ploché elektrody nasazené na konec endoskopu, která cíleně ošetřuje drobné plochy BJ (HALO 90) (obr. 13). Efektivita RFA v eradikaci neoplastických změn i samotné metaplazie byla opakovaně potvrzena, a to i randomizovanými studiemi [21,22]. Riziko komplikací je nízké, nejčastěji se vyskytují endoskopicky řešitelné stenózy jícnu. Metoda je od roku 2009 dostupná i v České republice a v několika centrech je rutinně užívána [23]. Dalšími technikami zkoušenými v léčbě BJ bez zatím většího rozšíření v praxi jsou kryoblace, fotodynamická terapie, laser a argonová plazmakoagulace [1].
Obr. 13.1. Radiofrekvenční ablace HALO 360, patrná desuflovaná balonová elektroda a cirkulární bělavé koagulum 
Obr. 13.2. Radiofrekvenční ablace HALO 90, v horní části obrázku fokální elektroda, dále distálně je patrná již ablovaná sliznice jícnu 
Vaskulární malformace trávicí trubice jsou poměrně častou patologií nalézanou při digestivní endoskopii. Nejčastější angiektázie jsou obvykle asymptomatické, ale v některých případech vedou k chronické anemizaci až manifestnímu krvácení. Metodou volby je endoskopická ablace, která vede k zajizvení a zániku malformace. Nejčastěji se jedná o sporadické angiektázie tračníku, tenkého střeva a žaludku, postradiační proktopatii a gastrické antrální vaskulární ektázie (GAVE). Vzhledem k relativně dobré dostupnosti, příznivé ceně a dlouholetým zkušenostem je v praxi nejčastěji užívána argonová plazmakoagulace (APC) [24,25]. APC je nekontaktní monopolární termální metoda využívající ionizovaného argonového plynu jako média pro průchod elektrického proudu. Katétr je zaveden pracovním kanálem endoskopu a pod endoskopickou kontrolou jsou ošetřována zvolená místa. Rizikem je transmurální poškození střevní stěny s následnou (většinou opožděnou) perforací. V případě rozsáhlejšího postižení je ošetření většinou nutno opakovat. Další techniky (kryoblace, RFA, endoskopická ligace) jsou v této indikaci využívány minimálně.
Poměrně častou klinickou situací je APC drobných LRN po endoskopické resekci adenomů tračníku, jejichž jizevnatá fixace znemožňuje další endoskopickou resekci [26]. APC může být také použita k paliativní destrukci nádorové tkáně jícnu a žaludku se snahou o zprůchodnění lumen, někdy při přerůstání nádorové nebo hyperplastické tkáně přes zavedené metalické stenty. Specifickou indikací je intraduktální RFA používaná k paliativní léčbě některých neoplazií žlučových cest
MUDr. Přemysl Falt, Ph.D.
II. interní klinika – gastroenterologická a hepatologická LF UP a FN Olomouc
Doručeno do redakce: 26. 10. 2017
Přijato po recenzi: 18. 4. 2018
Sources
- Urban O, Falt P. Endoskopická léčba prekanceróz a časných neoplazií trávicí trubice. In: Černoch J (ed.) Prekancerózy trávicího traktu – endoskopická diagnostika. Grada Publishing: Praha 2012. ISBN 978–80–247–3500–9.
- Urban O, Kliment M, Fojtik P et al. High-frequency ultrasound probe sonography staging for colorectal neoplasia with superficial morphology: its utility and impact on patient management. Surg Endosc 2011; 25(10): 3393–3399. Dostupné z DOI: <http://dx.doi.org/10.1007/s00464–011–1737–7>.
- The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58(6 Suppl.): S3-S43.
- Falt P, Urban O Komplikace koloskopie. In: Falt P, Urban O, Vítek P. Koloskopie. Grada Publishing: Praha 2015. ISBN 978–80–247–5284–6.
- Ferlitsch M, Moss A, Hassan C et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2017; 49(3): 270–297. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0043–102569>.
- Kliment M. Endoskopická polypektomie. In: Falt P, Urban O, Vítek P. Koloskopie. Grada Publishing: Praha 2015. ISBN 978–80–247–5284–6.
- Falt P, Urban O, Suchánek Š et al. Doporučené postupy České gastroenterologické společnosti JEP pro diagnostickou a terapeutickou koloskopii. Gastroent Hepatol 2016; 70(6): 523–538.
- Brenner H, Stock C, Hoffmeister M. Effect of screening sigmoidoscopy and screening colonoscopy on colorectal cancer incidence and mortality: systematic review and meta-analysis of randomised controlled trials and observational studies. BMJ 2014; 348: g2467. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.g2467>.
- Corley DA, Levin TR, Doubeni CA. Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med 2014; 370(26): 2541. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc1405329>.
- Urban O, Vítek P. Endoskopická slizniční resekce. In: Falt P, Urban O, Vítek P Koloskopie. Grada Publishing: Praha 2015. ISBN 978–80–247–5284–6.
- Urban O, Kijonkova B, Kajzrlikova IM et al. Local residual neoplasia after endoscopic treatment of laterally spreading tumors during 15 months of follow-up. Eur J Gastroenterol Hepatol 2013; 25(6): 733–738. Dostupné z DOI: <http://dx.doi.org/10.1097/MEG.0b013e32835eda96>.
- Martínek J, Falt P, Gregar J et al. Standardy České gastroenterologické společnosti – endoskopická léčba pacientů s Barrettovým jícnem a časnými neopláziemi jícnu. Gastroenterol Hepatol 2013; 67(6): 479–487.
- Urban O. Endoskopická submukózní disekce. In: Falt P, Urban O, Vítek P Koloskopie. Grada Publishing: Praha 2015. ISBN 978–80–247–5284–6.
- Bourke MJ, Neuhaus H. Colorectal endoscopic submucosal dissection: when and by whom? Endoscopy 2014; 46(8): 677–679. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0034–1377449>.
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015; 47(9): 829–854. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0034–1392882>.
- Schmidt A, Meier B, Caca K. Endoscopic full-thickness resection: Current status. World J Gastroenterol 2015; 21(31): 9273–9285. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v21.i31.9273>.
- Falt P, Urban O, Hanousek M et al. „Full-thickness“ endoskopická resekce lokální reziduální neoplázie v hepatální flexure – videokazuistika. Gastroent Hepatol 2016; 70(5): 398–401.
- Falt P, Štěpán M, Andělová R et al. Kombinace endoskopické slizniční resekce a transmurální resekce v léčbě lokálních reziduálních neoplazií tračníku – popis dvou případů. Rozhl Chir 2017; 96(9): 394–398.
- Schmidt A, Beyna T, Schumacher B et al. Colonoscopic full-thickness resection using an over-the-scope device: a prospective multicentre study in various indications. Gut 2018; 67(7): 1280–1289. Dostupné z DOI: <http://dx.doi.org/10.1136/gutjnl-2016–313677>.
- Schmidt A, Meier B, Cahyadi O et al. Duodenal endoscopic full-thickness resection (with video). Gastrointest Endosc 2015; 82(4): 728–733. Dostupné z DOI: <http://dx.doi.org/10.1016/j.gie.2015.04.031>.
- Shaheen NJ, Sharma P, Overholt BF et al. Radiofrequency ablation in Barrett‘s esophagus with dysplasia. N Engl J Med 2009; 360(22): 2277–2288. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0808145.
- Phoa KN, van Vilsteren FG, Weusten BL et al. Radiofrequency ablation vs endoscopic surveillance for patients with Barrett esophagus and low-grade dysplasia: a randomized clinical trial. JAMA 2014; 311(12): 1209–1217. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2014.2511>.
- Martínek J, Falt P, Gregar J et al. Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v České republice. Gastroenterol Hepatol 2011; 65(5): 279–285.
- Kwan V, Bourke MJ, Williams SJ et al. Argon plasma coagulation in the management of symptomatic gastrointestinal vascular lesions: experience in 100 consecutive patients with long-term follow-up. Am J Gastroenterol 2006; 101(1): 58–63. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1572–0241.2006.00370.x>.
- Urban O, Chalupa J, Vitek P et al. Treatment of chronic postirradiation proctitis with argon plasma coagulation. Vnitř Lék 2004; 50(3): 218–221.
- Urban O, Pipek B, Kajzrlikova IM et al. The efficacy of treatment of local residual neoplasia under standardized conditions. Vnitř Lék 2010; 62(5): 365
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 6-
All articles in this issue
- Současné trendy v diagnostice a léčbě refluxní nemoci jícnu
- Terapie peptického vředu
- Historie celiakie
- Celiakie v roce 2018
- Diagnostika poruch motility gastrointestinálního traktu
- Divertikulární choroba: diagnostika a léčba
- Familiární adenomatózní polypóza: komplexní péče o pacienty
- Konvenční a biologická terapie idiopatických střevních zánětů
- Péče o IBD pacienty v terénní praxi
- PSC-IBD: specifický fenotyp idiopatického střevního zánětu asociovaný s primární sklerózující cholangitidou
- Možnosti terapeutické manipulace se střevní mikrobiotou
- Prokinetika a jejich využití v gastroenterologii
- Screening kolorektálního karcinomu
- Terapeutická digestivní endoskopie I
- Terapeutická digestivní endoskopie II
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prokinetika a jejich využití v gastroenterologii
- Divertikulární choroba: diagnostika a léčba
- Diagnostika poruch motility gastrointestinálního traktu
- Současné trendy v diagnostice a léčbě refluxní nemoci jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

