-
Medical journals
- Career
Antitrombotika dnes
Authors: Miloslava Matýšková; Jana Michalcová; Miroslav Penka
Authors‘ workplace: Oddělení klinické hematologie FN Brno, pracoviště Bohunice
Published in: Vnitř Lék 2018; 64(5): 565-574
Category:
Overview
V posledních 10 letech došlo k rozšíření palety léků snižujících krevní srážení – antitrombotik. Po více než půl století byl k dispozici pouze warfarin a heparin. Lepší pochopení pochodů podílejících se na aktivaci krevního srážení, vazeb mezi těmito systémy a dopadu trombózy na zánět, vedlo k identifikaci nových cílů a vývoji nových léků, zejména nových protidestičkových léků a antikoagulancií. S příchodem nových léků do klinické praxe se rozšiřují možnosti léčby/prevence trombotických komplikací. Vždy však je nutné se s daným lékem a jeho vlastnostmi řádně seznámit a znát jeho limitace. Jenom tak můžeme nemocným nabídnout nejvhodnější postupy.
Klíčová slova:
antikoagulancia – antitrombotika – laboratorní sledování – nefrakcionovaný heparin (UFH) – nízkomolekulární hepariny (LMWH) – nová perorální antikoagulancia/non‑vitamin K dependentní perorální antikoagulancia (NOAC) – přímá perorální antikoagulancia (DOAC) – warfarin
Úvod
Trombóza, jak žilní, tak arteriální, je hlavní příčinou morbidity a mortality po celém světě. Antitrombotická prevence/léčba je postup, který by měl předejít tromboembolickým komplikacím. Představuje jedno z nejrozšířenějších medicínských opatření.
Mezi antitrombotika v širším slova smyslu patří protidestičkové a vlastní antitrombotické léky (také označované jako antikoagulancia) a někteří autoři sem řadí i trombolytika. Současně běžně dostupná antikoagulancia navozují hypokoagulační stav, brání narůstání trombu, některá napomáhají endogenní fibrinolýze, a tím přispívají k rozpouštění trombu.
Řadu let jsou k léčebnému ovlivnění krevního srážení užívaná nepřímá antitrombotika typu heparinu nebo antagonisté K vitaminu. Tlak na vývoj ideálního antitrombotika (tab. 1) vedl k usilovnému výzkumu. Vývoj přímých antitrombotik probíhá asi 50 let. Do klinické praxe se ale dostala až v posledních letech.
Table 1. Požadovaná kritéria pro ideální antitrombotikum 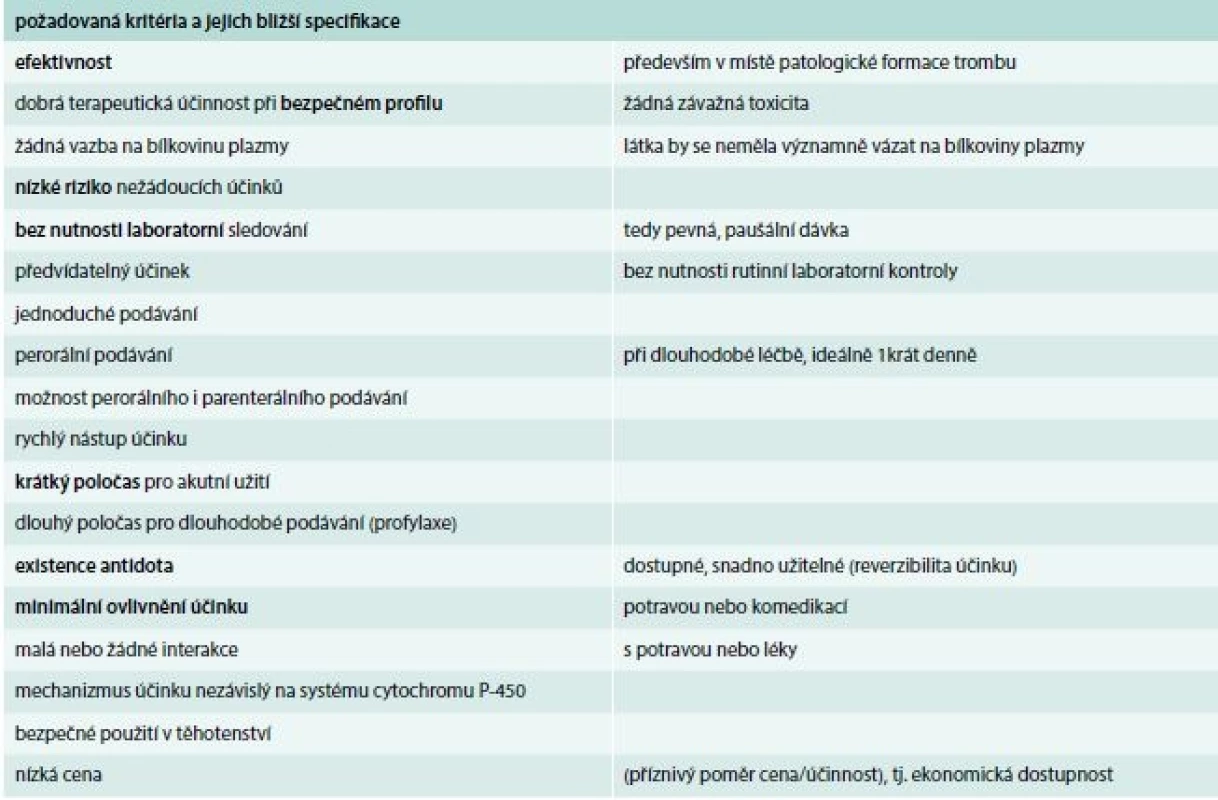
Historie
Při pohledu do historie je zřejmé, že má antikoagulační léčba velmi dlouhou tradici, která sahá ještě do období před založením evropské medicíny na vědeckých základech. Tak například užívání pijavic, které obsahují celou řadu aktivních látek včetně látek, které ovlivňují krevní srážení, najdeme již ve starém Egyptě. Jistě je zajímavé, že se jejich léčebné využívání v současnosti opět rozšiřuje.
Heparin
Nefrakcionovaný heparin
Nejdéle užívaným antitrombotickým lékem je nefrakcionovaný heparin (unfractionated heparin – UFH). Asi před 100 lety J. McLean v laboratoři prof. W. H. Howella izoloval z psích jater látku vyvolávající krvácení u zvířat [1]. V roce 1908 W. H. Howell s L. E. Holtem identifikovali podobnou látku a nazvali ji heparin (podle řeckého výrazu pro játra hepar). Po úpravě začala být komerčně dostupná v roce 1924. Způsobovala však bolesti hlavy, horečku a nevolnost. Ch. Best et al během výzkumu heparinu a jeho izolace zjistili, že jedinou „tkání“, která neobsahuje významné množství heparinu, je samotná krev. Vývoj bezpečného netoxického heparinu se uskutečnil v letech 1933–1936 v Kanadě. V roce 1937 byl poprvé podán heparin člověku bez vedlejších účinků. Erik Jorpes se snažil vyčistit heparin a vyhnout se jeho vedlejším účinkům. První závěry publikoval roku 1935 včetně zprávy o struktuře molekuly [2]. V roce 1936 začala švédská společnost Vitrium AB vyrábět parenterální heparin pro humánní použití.
Nízkomolekulární heparin
Potřeba heparin standardizovat vedla k vývoji nízkomolekulárním heparinu (Low-Molecular-Weight Heparin – LMWH).
V 70. letech minulého století začaly pracovat na LMWH tři různé skupiny ve Stockholmu, Londýně a Hamiltonu v Ontariu. LMWH se vyrábí chemickým štěpením heparinu. Má méně nežádoucích účinků než heparin a produkuje předvídatelnější odpověď po podání [1]. Do poloviny 80. let 20. století byly přípravky LMWH testovány v klinických studiích a nyní nahrazují heparin pro většinu indikací.
V roce 1976 byla identifikována unikátní pentasacharidová sekvence heparinu, která je nezbytná pro vazbu antitrombinu, a tím antikoagulační aktivitu. Ukázalo se avšak, že pentasacharidovou sekvenci obsahuje pouze jedna třetina heparinových řetězců. Data o syntetickém pentasacharidu fondaparinuxu byla publikována v roce 1997 [3].
Warfarin
Při pátrání po důvodu úhynu dobytka na krvácivost na severu USA ve 20. letech minulého století se zjistilo, že toto onemocnění způsobovala bylina Komonice lékařská (Melilotus officinalis), která byla obsažena v píci. K. P. Link pak izoloval roku 1940 z koncentrátu z komonice látku 3,3‘-metyl-bis-4-(hydroxykumarin) později nazvanou dikumarol a záhy vyrobil i její syntetickou formu. V dalších letech pak pokračoval ve vývoji účinnější látky založené na kumarinových antikoagulanciích, která by byla využitelná jako jed na hlodavce. V roce 1948 Link syntetizoval derivát warfarin, který byl pojmenován podle zkratky WARF (Wisconsin Alumni Research Foundation), za jejíž pomoci byl vyvinut, a přípony –arin, která odkazuje ke kumarinu). V roce 1951 zaznamenala americká armáda zneužití warfarinu, užívaného v té době jako prostředek k deratizaci, k pokusům o sebevraždu. Léčbou vojáků, kteří se pokusili otrávit požitím rodenticidu warfarinu, a následným prověřováním warfarinu jako možného humánního terapeutika byla zahájena éra tohoto nejrozšířenějšího perorálního antikoagulancia, která trvá až do současnosti. Jako lék byl schválen v roce 1954 a jeden z prvních pacientů, který z něj profitoval, byl americký prezident D. Eisenhower, kterému byl indikován v roce 1955 po těžkém infarktu [1]. V dnešní době by zřejmě kumariny neprošly klinickým testováním, přesto zachránily milióny životů.
Další antikoagulační látky a jejich DNA
Antikoagulační látky a jejich DNA byly také extrahovány z řady zvířat (klíšťata, pijavice, hadi a netopýři) a přeměněny na léky chemickou syntézou nebo genetickým inženýrstvím.
Specifický inhibitor trombinu hirudin produkovaný pijavicí Hirudo medicinalis, byl izolován a charakterizován jako specifický inhibitor trombinu v pozdních 50. letech 20. století [4].
První úspěšná syntetická antikoagulancia jsou fondaparinux a bivalirudin.
Přirozeně se vyskytující inhibitor faktoru Xa byl poprvé popsán v roce 1971 u měchovce (psí parazit), v roce 1987 byl izolován antistasin z pijavice Haementeria officinalis a brzy poté další přirozeně se vyskytující inhibitor (Tick Anticoagulant Protein – TAP) z klíštěte Ornithodoros moubata [5].
Další vývoj antitrombotických léků se soustředil na perorální inhibitory trombinu a FXa, které se do klinické praxe zařadily od roku 2008.
Typy antitrombotik
Antitrombotika můžeme dělit dle způsobu podání na perorální a parenterální, nebo dle jejich účinku (tab. 2, schéma 1). Pro úplnost bychom měli do postupů snižujících riziko trombózy zařadit i substituci přirozených inhibitorů – antitrombinu a proteinu C.
Table 2. Možnosti ovlivnění krevního srážení antitrombotiky 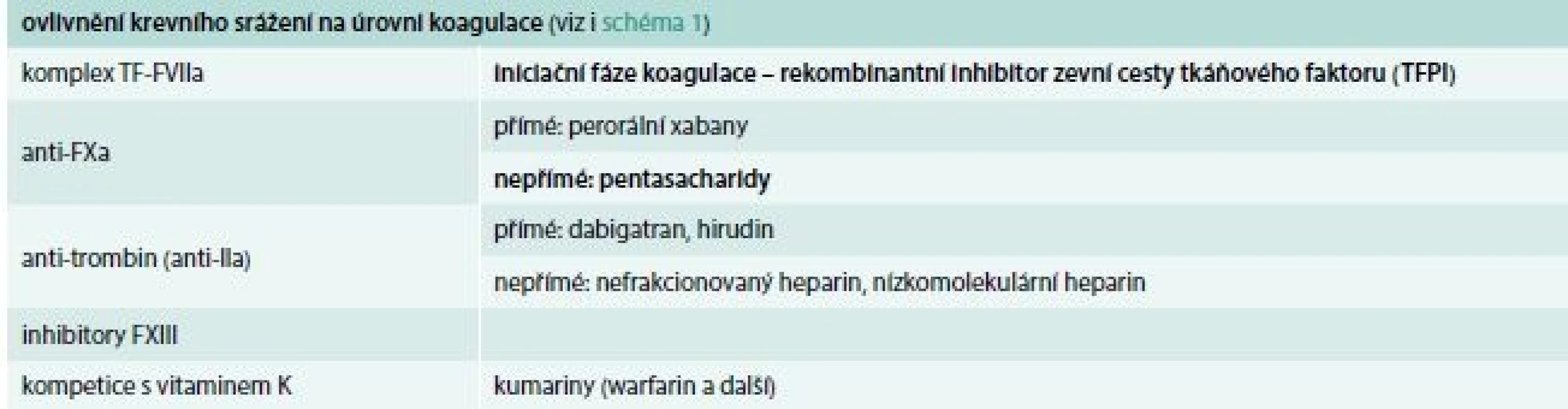
F – faktor TFPI – inhibitor tkáňového faktoru/tissue factor pathway inhibitor Schéma. Ovlivnění koagulace 
AT – antitrombin F – faktor LMWH – nízkomolekulární hepariny TF – tkáňový faktor UFH – nefrakcionovaný heparin VKA – antagonisté vitaminu K (kumariny)/vitamin K antagonists Perorální antikoagulancia
Ještě před 10 lety byl warfarin jediné dostupné perorální antikoagulans.
Od roku 2008 byly schváleny k podávání tzv. nová (per)orální antitrombotika (novel oral anticoagulant – NOAC), mezi které je řazen přímý inhibitor trombinu dabigatran a specifické inhibitory faktoru Xa (xabany). V poslední době se diskutuje o nejvhodnějším názvu pro tyto léky. V diskusích se namítá, že se de facto už nejedná o „nová“ antitrombotika, a proto v některých pracích výraz „nová“ nahradilo spojení „non vitamin K“ [6], a tak bylo možno ponechat již vžitou zkratku NOAC. Mezinárodní společnost pro trombózu a hemostázu (International Society on Thrombosis and Haemostasis – ISTH) ovšem doporučuje používat jako přesnější termín přímá (per)orální antikoagulancia (direct oral anticoagulant – DOAC) [7]. V literatuře však nalezneme i zkratky TSOAC (target-specific oral anticoagulant), ODI (oral direct inhibitor) nebo SODA (specific oral direct anticoagulant).
Parenterální antikoagulancia
Parenterálně je nutné podávat UFH, LMWH, pentasacharidy, hirudiny a argatroban.
Pentasacharidy
Pentasycharidy se vážou přímo na vazebné místo antitrombinu podobně jako LMWH, a tím zvyšují jeho inhibiční aktivitu. Dostupný je u nás fondaparinux (Arixtra®), který na rozdíl od UFH a LMWH inhibuje pouze faktor (F) Xa, nepůsobí na žádné jiné úrovni a není metabolizován v játrech [3,8]. Studie s idraparinuxem (AMADEUS) byla ukončena pro excesivní mozková krvácení.
Hirudin
Představuje přirozeně se vyskytující skupinu protisrážlivých látek nalezenou ve slinách pijavice lékařské (Hirudo medicinalis). Vysoce selektivně inhibuje volný i vázaný trombin. Vytvořený komplex je prakticky ireverzibilní. Rekombinantní hirudin se od přírodního liší přesně definovanou homogenní molekulou (např. lepirudin, desirudin). Výhody hirudinu oproti heparinu jsou tyto: nepotřebuje antitrombin jako kofaktor, není inaktivován heparinázami, neovlivňuje krevní destičky, inhibuje i trombin navázaný v krevní sraženině nebo na subendotel. Podává se parenterálně. Poločas v plazmě je 1–2 hod s maximální koncentrací asi za 10 min po intravenózním podání. Volný hirudin se vylučuje ze 70–90 % ledvinami. Vazba na bílkoviny je méně než 10 %. Neprochází hematoencefalickou bariérou, placentou přechází stopové množství, a v experimentu na zvířeti byly u plodu zaznamenány minimální koncentrace [4,9].
Bivalirudin
Jedná se o syntetický analog hirudinu (hirulog), který je reverzibilním inhibitorem trombinu. Podává se parenterálně s poločasem 25 min po intravenózní aplikaci. Je metabolizován v játrech, pouze malá část je vylučována ledvinami [9].
Argatroban
Argatroban (Novastan®) je kompetitivní přímý reverzibilní inhibitor trombinu. Váže se na aktivní místo trombinu (jak volného, tak vázaného) a současně inhibuje štěpení fibrinogenu trombinem stejně jako aktivaci trombocytů trombinem. Podává se nitrožilně, poločas v plazmě je 40–50 min Vylučování není závislé na funkci ledvin. Látka je metabolizována v játrech, a proto je nutná redukce dávkování u osob s jaterní dysfunkcí. Metabolity jsou vylučovány žlučí [10].
Přehled a základní charakteristika vybraných antitrombotik
Základní charakteristika ostatních vybraných antikoagulancií je uvedena v tab. 3.
Table 3. Antitrombotika – stručná charakteristika 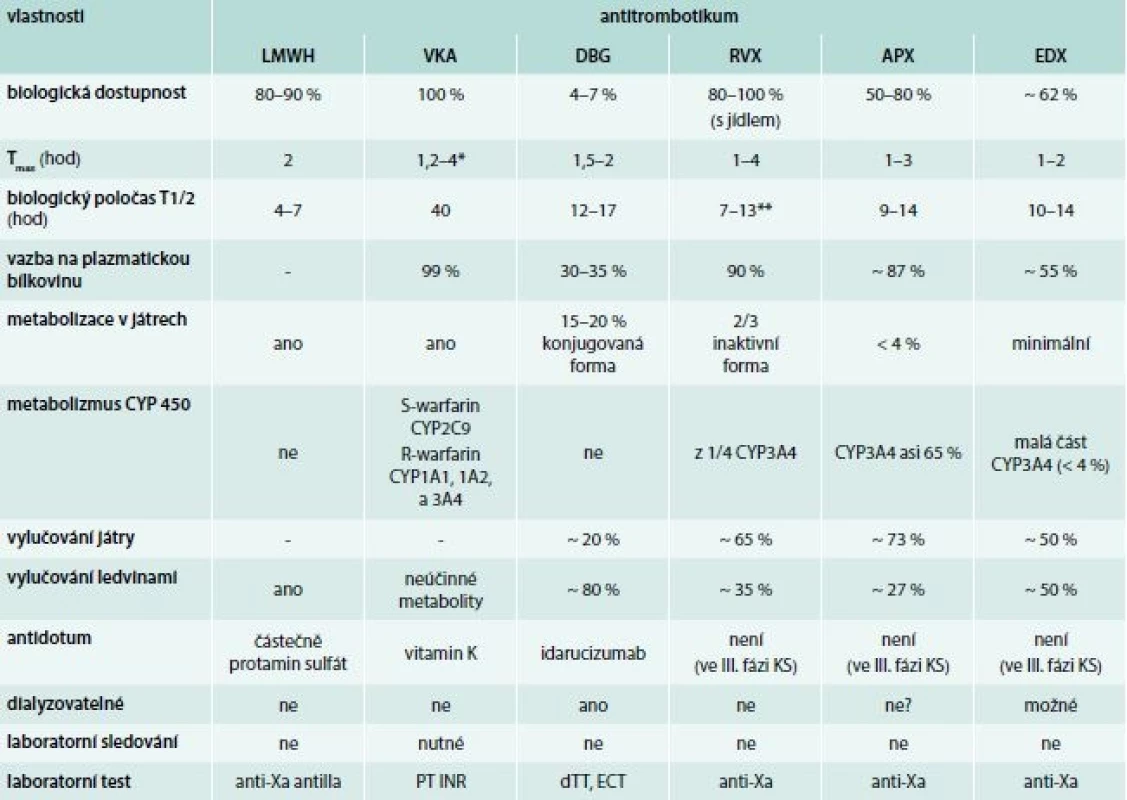
*nejedná se o maximum účinku
**závislost na věku
APX – apixaban DBG – dabigatran dTT – ředěný trombinový test ECT – ekarinový test EDX – edoxaban KS – klinické studie (klinické hodnocení) LMWH – nízkomolekulární hepariny PT – protrombinový test RVX – rivaroxaban VKA – vitamin K antagonisté/kumariny WFN – warfarinIndikace podávání antitrombotik
Indikace podávání všech antitrombotik lze shrnout jednoduše – prevence, profylaxe nebo léčba zvýšeného srážení. Přesto je nutné znát SPC, protože jednotlivé preparáty se mohou lišit (včetně LMWH mezi sebou). Zejména v posledních letech se nově definované indikace zúžily nejen na diagnózu, ale často i léčebný postup, který je zvolen.
Nejširší a obecné indikace má zřejmě i z historického hlediska UFH [10]. Např. LMWH nadroparin [11] už má indikace více specifikovány: profylaxe tromboembolické choroby, v perioperačním období, zejména v oblasti ortopedie a všeobecné chirurgie, u vysoce rizikových pacientů (např. respirační selhání a/nebo respirační infekce a/nebo srdeční selhání) upoutaných na lůžko pro akutní onemocnění nebo hospitalizovaných na jednotce intenzivní péče, léčba tromboembolické choroby, prevence krevního srážení během hemodialýzy, léčba nestabilní anginy pectoris a non-Q infarktu myokardu.
U warfarinu pochopitelně chybí indikace hemodialýzy: je indikován [12] k léčbě a prevenci hluboké žilní trombózy a plicní embolie, sekundární prevenci infarktu myokardu, prevenci tromboembolických komplikací (iktus nebo systémová embolie) po infarktu myokardu a u pacientů s fibrilací síní, onemocněním srdečních chlopní nebo s náhradou srdečních chlopní, léčbě a prevenci tranzitorních ischemických atak (TIA) a iktu.
Fondaparinux je indikován v prevenci hluboké i povrchové žilní trombózy: u nemocných po fraktuře kyčle, po náhradě kyčelního kloubu a po elektivní náhradě kolenního kloubu. Spolu s warfarinem je schválen v léčbě akutní žilní trombózy a plicní embolizace [8,14].
Jasná indikace podání hirudinu je heparinem indukovaná trombocytopenie (HIT) nebo HIT s trombózou. Jako alternativa k podávání heparinu byla účinnost hirudinu prokázána v řadě studií [9].
Indikace DOAC
- prevence cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní s jedním nebo více rizikovými faktory
- primární prevence žilních tromboembolických příhod u dospělých pacientů, kteří podstoupili elektivní totální náhradu kyčelního nebo kolenního kloubu
- léčba hluboké žilní trombózy (deep venous thrombosis – DVT) a plicní embolie (PE) a prevence rekurence DVT a PE u dospělých pacientů [15–18]
Jsou ukončeny další studie a je snaha rozšiřovat indikace podání DOAC, včetně dlouhodobého podávání (viz např. studie RE-DUAL PCI, AMPLIFY-EXT, EINSTEIN EXTENSION).
Pokud je nutný operační zákrok v průběhu léčby antitrombotiky, jsou i u DOAC vydána doporučení, jak postupovat [11–19].
Nežádoucí účinky antitrombotik
Léčba antitrombotiky přináší logicky vyšší riziko krvácení. U léčby UFH je udáváno až 5 % velkých krvácení a do 3 % smrtelných [8]. Riziko krvácení je u DOAC dle proběhlých studií menší oproti standardním antikoagulačním lékům [20,21].
Jednou z hlavních námitek proti warfarinu bylo, vedle úzkého terapeutického okna a řady interakcí, riziko krvácení, které se samozřejmě zvyšuje s mírou účinnosti léčby, a především potom s předávkování. Toto ale není jedinou příčinou rizika krvácení [22]. A v podstatě lze říct, že většina faktorů, které zvyšují riziko krvácení u warfarinu, platí i pro všechna další antitrombotika (tab. 4).
Table 4. Charakteristika pacientů s vysokým rizikem krvácení při užívání warfarinu 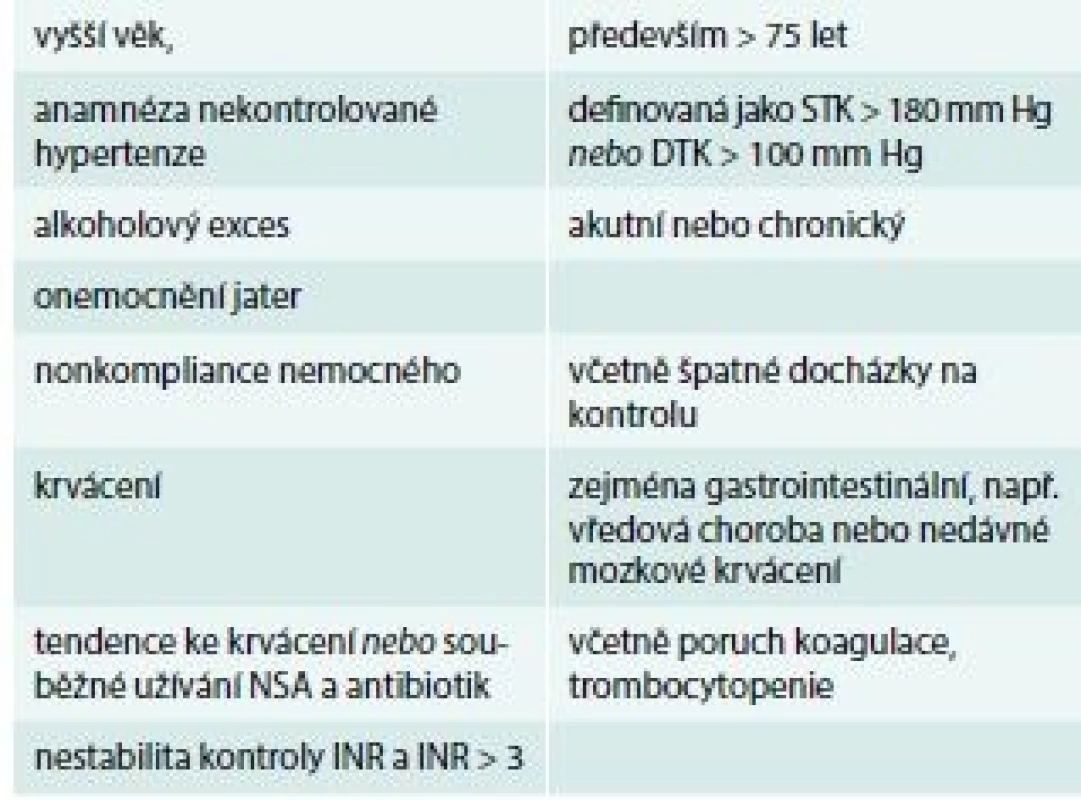
DTK – diastolický krevní tlak NSA – nesteroidních protizánětlivých léků STK systolický krevní tlak Pokud se podíváme na další možné nežádoucí účinky warfarinu, tak častější (1–10 %) jsou to gastrointestinální poruchy – nauzea, zvracení, průjem. Velmi vzácně (< 0,01 %) se můžeme setkat také s reverzibilním zvýšením jaterních enzymů, cholestatickou hepatitidou, kumarinovou nekrózou, syndromem purpurových prstů, vaskulitidou, tracheálními kalcifikacemi, reverzibilní alopecií, vyrážkou, alergickou reakcí (obvykle se projevuje kožní vyrážkou) nebo priapizmem [12].
A opět – s podobnými nežádoucími účinky se setkáváme i u dalších antitrombotik. V tab. 5 jsou uvedeny pouze ty, které jsou udávány jako časté [11–18].
Table 5. Nežádoucí účinky – časté 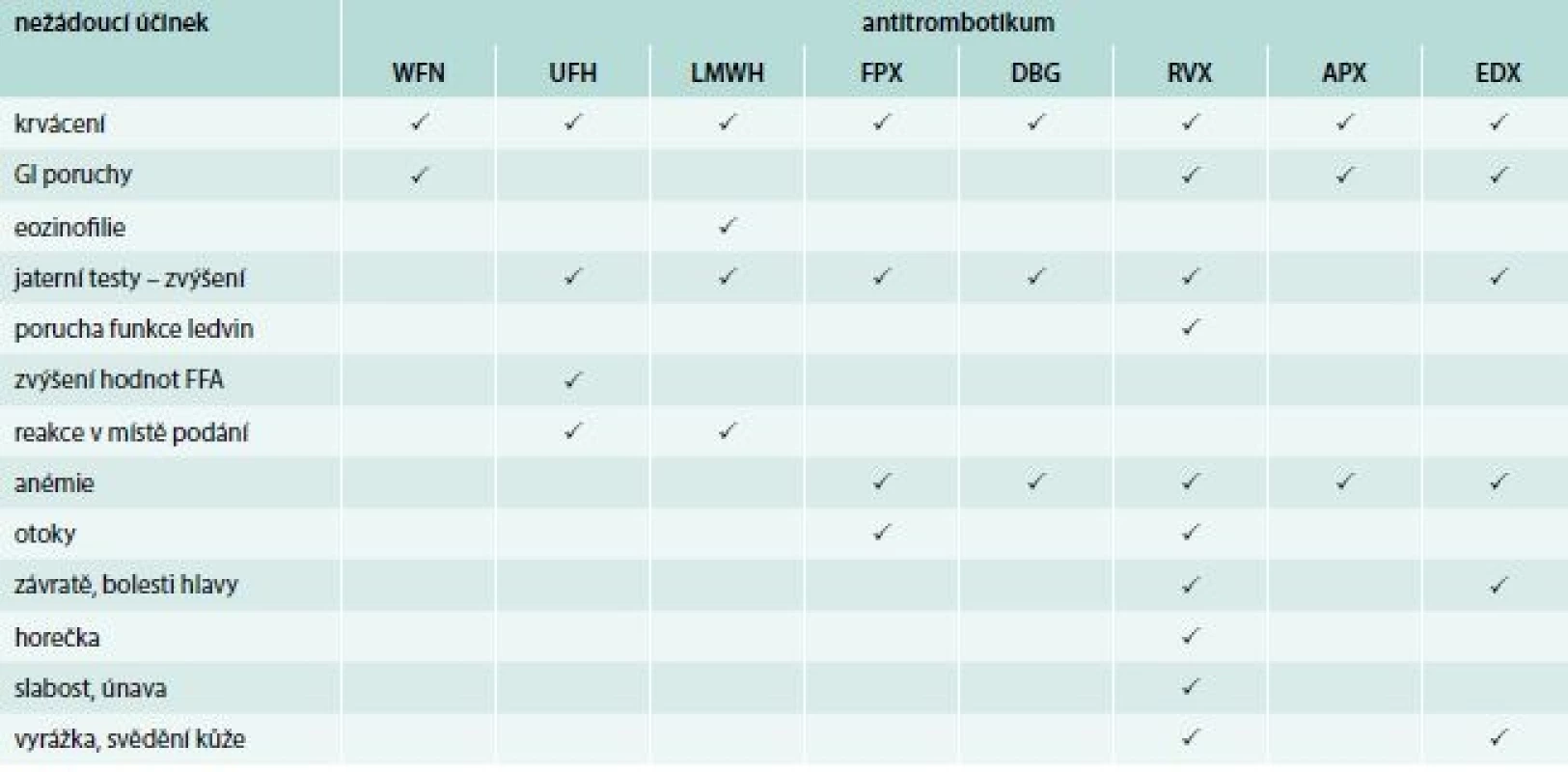
APX – apixaban DBG – dabigatran EDX – edoxaban ENO – enoxaparin FFA – volné mastné kyseliny/free fatty acids FPX – fondaparinux GI – gastrointestinální LMWH – nízkomolekulární hepariny RVX – rivaroxaban UFH – nefrakcionovaný heparin WFN – warfarin Kontraindikace antitrombotik
Udávané kontraindikace (KI) jsou často relativní a lékař musí zvažovat při podávání všechna rizika, včetně indikace monitoringu hladiny léku i v případech, v nichž není běžně nutný.
Opět mají všechna antitrombotika samozřejmě jako KI krvácivé stavy, případně stavy s vysokým rizikem krvácení, včetně souběžného podávání léků, které toto riziko zvyšují [11–18].
Ostatní se sice již různí, ne však významně (tab. 6).
Table 6. Kontraindikace podávání antitrombotik 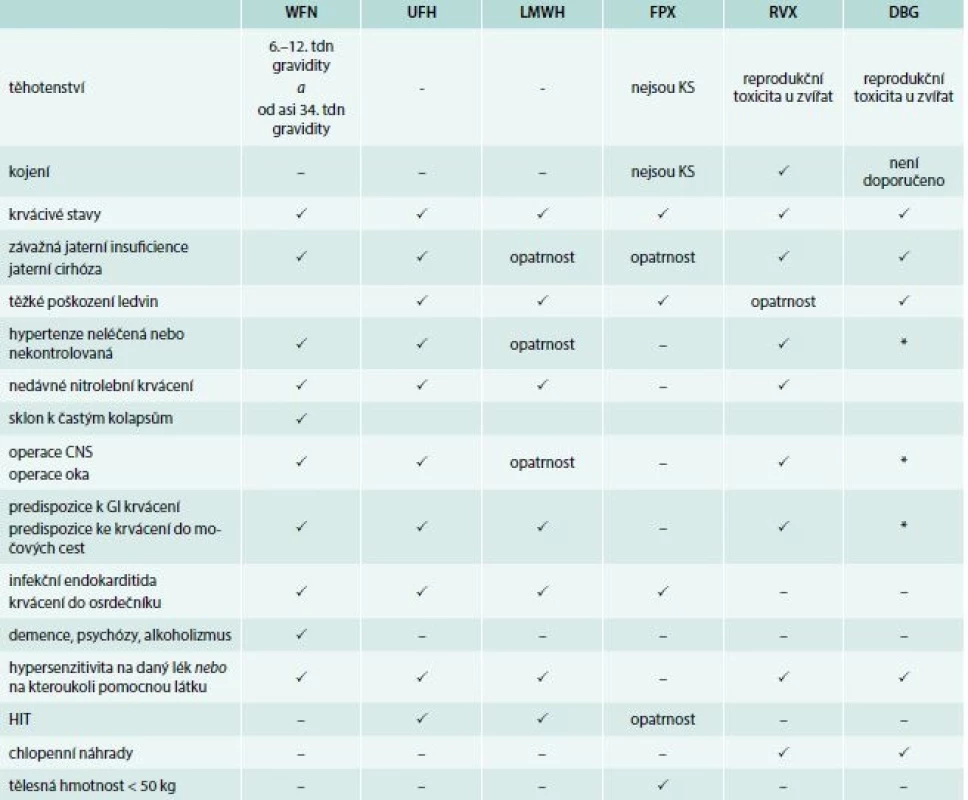
*Klinicky významné aktivní krvácení nebo stavy, jestliže jsou považovány za významné rizikové faktory závažného krvácení
DBG – dabigatran FPX – fondaparinux GI – gastrointestinální HIT – heparinem indukovaná trombocytopenie KS – klinické studie (klinická hodnocení) LMWH – nízkomolekulární hepariny UFH – nefrakcionovaný heparin tdn – týden WFN – warfarinNefropatie, zejména chronická renální insuficience (CHRI), je problematická při rozhodování o užití LMWH, které se ledvinami vylučují, podobně jako dabigatran. Xabany se vylučují ledvinami jen zčásti, přesto i zde je nutná redukce dávky a opatrnost. Také těžká hepatopatie je považována za kontraindikaci podávání většiny těchto látek.
Absolutní kontraindikací podávání UFH a LMWH je heparinem indukovaná trombocytopenie [8,23].
Podávání DOAC v těhotenství je kontraindikováno, kojení většinou není doporučeno, protože neexistují klinické studie zaměřené na tuto problematiku. LMWH sice přechází do mléka, ale je neutralizován kyselým pH žaludku. Warfarin do mléka nepřechází.
Interakce antitrombotik
Vzhledem ke zvýšenému riziku krvácení je třeba postupovat opatrně, pokud jsou pacienti současně léčeni jinými antikoagulancii nebo léky, které mohou krevní srážení ovlivňovat.
U warfarinu je kromě úzkého terapeutického okna a výrazných interindividuálních i intraindividuálních variací zásadní problém v interakcích. Tyto mohou nastat v důsledku různých ovlivnění: GIT – absorpce (antacida, preparáty obsahující Fe, Mg, Zn) nebo ovlivnění střevní mikroflóry, průjmy, vytěsnění z vazby na albumin, hypoalbuminemie, interference s metabolizmem vitaminu K, enzymatické indukce nebo inhibice mikrosomálních enzymů jaterního metabolizmu, příp. ovlivnění jiných částí hemostázy a také při řadě klinických stavů – městnavé srdeční selhání, hemodialýza, tyreopatie, horečka [8,24].
U UFH ani LMWH nejsou udávány žádné interakce, pouze u nefrakcionovaného heparinu se upozorňuje na inkompatibility s hydrokortizonem, streptomycinem, cefaloridinem, tetracyklinem, prometazinem a chlorpromazinem [11].
Dabigatran-etexilát je substrátem glykoproteinu P (P-gp). Současné podávání s induktory glykoproteinu P (P-gp), např. rifampicin, karbamazepin, fenytoin nebo třezalka tečkovaná, vede ke snížení jeho plazmatické koncentrace. Podávání silných inhibitorů P-gp je kontraindikováno (ketokonazol, cyklosporin, itrakonazol a dronedaron). U slabých až středně silných inhibitorů P-gp je nutná opatrnost (např. amiodaron, posakonazol, chinidin, verapamil, tikagrelor) [8,15]. Souběžná léčba selektivními inhibitory zpětného vychytávání serotoninu (SSRI) nebo serotoninu a noradrenalinu (SNRI) může zvyšovat riziko krvácení [15].
Současné podávání rivaroxabanu s látkami, které jsou silnými inhibitory CYP3A4 i P-gp nebo inhibitory HIV proteázy (ritonavir), může vést ke zvýšenému riziku krvácení. Současné podání rivaroxabanu se silnými induktory CYP3A4 může vést ke snížení jeho plazmatických koncentrací. Silné inhibitory CYP3A4 a P-gp mohou zvýšit, silné induktory CYP3A4 a P-gp zase snížit plazmatické koncentrace apixabanu [16–18].
Laboratorní sledování
Všechna antitrombotika ovlivňují základní koagulační testy a je dobré se v této problematice orientovat. Podávaný lék totiž může být jedinou příčinou prodloužení koagulačních testů a následně zbytečného došetřování (tab. 7). Předejít této situaci se dá tím, že se lék uvede na žádance a současně se udá i čas podání poslední dávky léku. Odběr se také může provést před podáním další dávky, případné prodloužení testů může svědčit pro předávkování [25]. Informace na žádance laboratoři ušetří opakování vyšetření a telefonické informace klinikům.
Table 7. Ovlivnění základních koagulačních testů 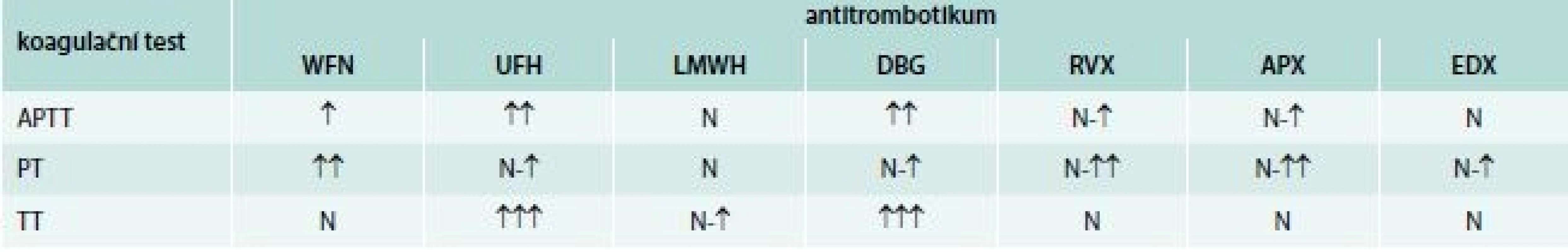
APX – apixaban APTT – parciální tromboplastinový test DBG – dabigatran EDX – edoxaban LMWH – nízkomolekulární hepariny PT – protrombinový test RVX – rivaroxaban TT – trombinový test UFH – nefrakcionovaný heparin WFN – warfarin
↑-↑↑↑ – míra ovlivnění N – žádné ovlivněníPři léčbě mohou být ovlivněny i některé způsoby stanovení hladiny antitrombinu, rezistence k aktivovanému proteinu C, vyšetření lupus antikoagulans.
Mezi základní koagulační testy patří aktivovaný parciální tromboplastinový test (APTT), protrombinový test (PT), trombinový test (TT), fibrinogen. Výsledků protrombinového testu u všech osob, včetně pacientů užívajících LMWH či DOAC, by měly být vydávány buď jako poměr časů = R, nebo pouze čas pacienta. V posledním případě je ale nutné znát hodnotu času normálu. Dříve byly výsledky vydávány také v % nebo jako bezrozměrné číslo (jednalo se o odečet z kalibrační křivky). Tento postup se již nedoporučuje.
Sledování je nutné u UFH, argatrobanu, hirudinu a warfarinu; není obecně požadováno u LMWH a fondaparinuxu [8] a DOAC s výjimkou stavů, kdy je akutní krvácení, nutnost akutního chirurgického zákroku, renální insuficience, podezření na předávkování, ale také třeba při podezření na nespolupráci nemocného, při neobvyklé hmotnosti. U LMWH je doporučováno navíc u těhotných a dětí.
Při podávání UFH je nutné sledovat hodnotu APTT. Jednotlivé reagencie APTT se významně liší citlivostí k heparinu a laboratoř by měla mít definováno, v jakém rozmezí by se terapeutická dávka měla pohybovat. Obecně se udává zvýšení o 1,5–2,5 oproti normálu.
Hirudin v závislosti na dávce ovlivňuje jak APTT, tak PT a TT. Má úzké terapeutické rozmezí, a jeho dávkování je nutné upravovat dle APTT (doporučené rozmezí je poměr R 1,5–2,0 za 4 hod po podání), které dobře koreluje s koncentrací hirudinu, ale křivka je velmi plochá a korelace není lineární. Pro monitorování vyšší dávky hirudinu se doporučuje použití ekarinového testu (ECT), který však v běžné praxi není dostupný.
Léčebný účinek bivalirudinu je monitorován aktivovanou dobou srážení (activated clotting time – ACT) [9].
K monitorování léčby argatrobanem se používá APTT, doporučené terapeutické rozmezí je poměr R 1,5–3,0. Ovlivňuje také PT, což může dělat problémy při současném zavádění antikoagulační léčby antagonisty K vitaminu [10].
Laboratorní monitorování LMWH není nutné, přesto se stále častěji indikuje. Využívá se stanovení anti-Xa (příp. anti-IIa) aktivity chromogenní metodou. Limitací vyšetření je, že naměřená hodnota nás informuje pouze o koncentraci molekul, které jsou schopny anti-Xa (případně anti-IIa) působení, neodráží ostatní účinky LMWH a nekoreluje s rizikem krvácení ani při předávkování. Riziko krvácení se zvyšuje s věkem a závisí na celkovém klinickém stavu nemocného, případně na dávce LMWH [26].
K monitorování hladiny fondaparinuxu lze v případě potřeby použít chromogenní stanovení anti-Xa aktivity stejně jako u LMWH. Pro fondaparinux se musí ale použít specifické kalibrátory [8]. Léčebné rozmezí není pro daný lék jasně definováno.
Pravidelné kontroly protrombinového testu INR (mezinárodní normalizovaný poměr/ international normalized ratio) jsou nezbytností u všech kumarinů. Je zde také prokazatelná závislost rizika krvácení na hodnotě PT INR. INR bylo zavedeno jako standardizace léčby. Jedná se o poměr protrombinového času pacienta k času normálu umocněné na ISI – index senzitivity tromboplastinu [8]. Proto by výsledek PT INR měl být používán pouze u osob, které užívají deriváty kumarinů. U některých jedinců se prodlužuje i APTT, ke sledování léčby však není vhodné. TT není ovlivněn.
I když se rutinní laboratorní sledování u osob užívajících DOAC nepovažuje za nutné, jsou situace, kdy je nezbytné – viz výše uvedené [27].
Vzhledem k relativně krátkému poločasu DOAC je při interpretaci laboratorních výsledků potřeba znát čas, v němž byla podána poslední dávka. Při podezření na předávkování je odběr krve vhodný provést v době minimálního účinku. Pokud ověřujeme vstřebávání preparátu či spolupráci nemocného, je optimální odběr v době maximální koncentrace. Prodloužení základních testů závisí na typu použité reagencie, většina je na léčbu DOAC málo citlivá [25].
Ke stanovení plazmatické hladiny dabigatranu se používá ředěný trombinový čas (dTT – diluted thrombin time, např. Hemoclot® Thrombin Inhibitor Assay). Doporučován je i ECT či ekarinový chromogenní test (ECA – Ecarin Chromogenic Assay), u nás se ale nepoužívají. Nejvyšší hladina se očekává asi za 2 hod po podání léku, minimální za 8–12 hod.
K orientaci o antikoagulačním účinku lze využít APTT. Citlivost testu ale závisí na senzitivitě použité reagencii. Fyziologické APTT v některých případech nevylučuje terapeutickou hladinu [8]. Dvojnásobné prodloužení APTT před podáním další dávky může upozornit na zvýšené riziko krvácení. Stupeň prodloužení ale nekoreluje s koncentrací dabigatranu.
Dabigatran v terapeutických koncentracích většinou PT neovlivňuje, případně jen mírně prodlužuje. Velmi citlivý je trombinový test, který vykazuje na dávce závislou lineární odpověď. Test je využitelný, pokud chceme vyloučit, že dabigatran není v krvi přítomen [25].
Ke stanovení plazmatické hladiny přímých inhibitorů FXa provádíme vyšetření anti-Xa aktivity chromogenní metodou s kalibrátory pro jednotlivé přípravky (rivaroxaban, apixaban, edoxaban). Anti-FXa aktivita koreluje s dávkou léků a koncentrací, není ale indikátorem rizika krvácení.
K orientačnímu posouzení antikoagulace rivaroxabanem lze použít PT [25,27]. Citlivost se opět liší dle použité reagencie. PT je vhodné při podezření na předávkování či kumulaci léku.
Apixaban i edoxaban PT prodlužují, ale tyto změny jsou malé a vysoce variabilní. Nelze je použít ke sledování antikoagulačního účinku.
Hodnota APTT může být u všech xabanů mírně prodloužená, avšak metoda není dostatečně citlivá a její použití proto není vhodné [25].
Antidotum antitrombotik
Látka, která by neutralizovala účinek, je u většiny antitrombotických léků problém.
UFH lze neutralizovat podáním protamin sulfátu, i když tento nemusí stoprocentně fungovat a sám může riziko krvácení zvyšovat. U LMWH protamin z velké části nefunguje a fondaparinux protaminem není neutralizován [26]. V současnosti u něj nemáme účinné antidotum, podobně jako u hirudinu.
Antidotem kumarinů je sám vitamin K, jeho účinek však nastupuje nejdříve za 4 hod, spíše však později. Pro akutní použití je nutné podání koncentrátů protrombinového komplexu [22], čerstvě zmražená plazma nemá dostatečnou koncentraci potřebných koagulačních faktorů.
Fragment humanizované monoklonální protilátky idarucizumab (Praxbind®) se s vysokou afinitou specificky váže na dabigatran a neutralizuje jeho účinek. Vazebná afinita je asi 300krát vyšší než vazebná afinita dabigtranu na trombin. Výsledkem je okamžitá, úplná a přetrvávající (až 12 hod u > 90 % pacientů) reverze antikoagulačního účinku dabigatranu [21,28]. Pro inhibitory faktoru Xa je vyvíjen adnexanet α a je ukončena III. fáze klinické studie (klinického hodnocení). Jedná se o modifikovaný rekombinantní FXa, který není koagulačně aktivní [28].
Ve vývoji je také ciraparantag – malá syntetická molekula, která se nekovalentně váže na UFH, LMWH, fondaparinux, dabigatran i xabany. Jedná se tedy o univerzální antidotum. Přípravek se aktuálně nachází ve II. fázi klinické studie [29].
Závěr
Zavedení DOAC do léčby tromboembolické nemoci v nejširším slova smyslu je velkým přínosem v hledání ideálního antikoagulans (tab. 1).
Rozhodnutí o léčbě u každého nemocného je vždy závislé na posouzení rizika a přínosu různých antitrombotik, případně i kombinací léků. V každém případě je nutné zvážit, který postup je pro nemocného optimální, je vždy nutné brát ohled na věk a komorbidity. Nemocný musí být řádně informován a poučen. Pokud se zvažuje redukce dávek, měla by být jasně zdůvodněna [19] a jak ukazují poslední práce, tento postup není vždy ku prospěchu nemocného [30].
Problematický je výběr antitrombotika u nemocných s poruchou funkce ledvin, protože jediné z antitrombotik, které nejsou ledvinami vylučovány, jsou argatroban a fondaparinux. Všechna antitrombotika jsou metabolizována a/nebo vylučována játry, proto i u těchto osob je nutná opatrnost při jejich podávání.
Jsou skupiny osob, u kterých se ukazuje výhodnost pouze jedné skupiny léků, např. u nemocných s trombózou a nádorovým onemocněním je upřednostňováno podávání LMWH před warfarinem i DOAC [6]. U osob s chlopenními náhradami je nejvhodnější podávání warfarinu, DOAC nejsou doporučována [15–18]. Pro těhotné máme stále k dispozici jen LMWH, případně u pacientek s defektem antitrombinu nebo chlopenní náhradou warfarin v 2. trimestru. Při kojení je možné podávat také jen warfarin, případně LMWH (je sice exkrece do mléka, ale lék je inaktivován v žaludku – kyselé pH).
Veškeré dosud prováděné studie byly designovány tak, že srovnávali DOAC s LMWH, warfarinem nebo placebem. Dosud však neproběhly studie porovnávající DOAC mezi sebou.
Jednou z udávaných výhod DOAC je, že není nutné laboratorní monitorování. Ukazuje se však, že máme skupinu pacientů, u kterých je monitorování hladin léků nezbytné.
Nová antitrombotika byla široce vítaná, dávají nám možnost volby. Jedná se však o zcela nové léky a mohou se lišit farmakokinetika i dynamika u zdravých a u pacientů po operacích, koncentrace léku může být ovlivněna u hmotnostních extrémů [8,15,18]. Výsledky dosavadních studií prezentují velmi dobré výsledky, přesto se ale jedná v podstatě o nové léky – asi nejdůležitější informace přinese čas a registry.
Přestože warfarin vyžaduje pravidelné laboratorní sledování a dobrou spolupráci nemocného, je s ním stále nejvíce zkušeností, podobně jako s LMWH.
MUDr. Miloslava Matýšková
Oddělení klinické hematologie FN Brno, pracoviště Bohunice
Doručeno do redakce 19. 12. 2017
Přijato po recenzi 17. 3. 2018
Sources
- Wardrop D, Keeling D. The story of the discovery of heparin and warfarin. Br J Haematol 2008; 141(6): 757–763. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2008.07119.x>.
- Shampo MA, Kyle RA. J. Erik Jorpes – Pioneer in the Identification and Clinical Applications of Heparin. Mayo Clin Proc 1997; 72(11): 1056. Dostupné z DOI: <http://dx.doi.org/10.1016/S0025–6196(11)63547–7>.
- Bauer KA, Hawkins PCP, Petitou M et al. Fondaparinux, a Synthetic Pentasaccharide: The First in a New Class of Antithrombotic Agents – The Selective Factor Xa Inhibitors. Cardiovasc Drug Rev 2002; 20(1): 37–52.
- Markwardt F. Historical Perspective of the Development of Thrombin Inhibitors. Pathophysiol Haemost Thromb 2002; 32(Suppl 3): S15-S22. Dostupné z DOI: <http://dx.doi.org/10.1159/000069104>.
- Yeh CH, Fredenburgh JC, Weitz JI. Oral direct factor Xa inhibitors. Circ Res 2012; 111(8): 1069–1078. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.112.276741>.
- Kearon C, Akl EA, Ornelas J et al. Antithrombotic Therapy for VTE Disease. CHEST Guideline and Expert Panel Report. Chest 2016; 149(2): 315–352. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chest.2015.11.026>.
- Barnes GD, Ageno W, Ansell J et al. For the subcommittee on the control of anticoagulation. Recommendation on the nomenclature for oral anticoagulants: communication from the SSC of the ISTH. J Thromb Haemost 2015; 13(6): 1154–1156. Dostupné z DOI: <http://dx.doi.org/10.1111/jth.12969>. Erratum in Corrigendum [J Thromb Haemost. 2015].
- Nutescu EA, Burnett A, Fanikos J et al. Pharmacology of anticoagulants used in the treatment of venous thromboembolism. J Thromb Thrombolysis 2016; 41(1): 15–31. Dostupné z DOI: <http://dx.doi.org/10.1007/s11239–015–1314–3>.
- Greinacher A, Warkentin TE. The direct thrombin inhibitor hirudin. Thromb Haemost 2008; 99(5): 819–829. Dostupné z DOI: <http://dx.doi.org/10.1160/TH07–11–0693>.
- Escolar G, Bozzo J, Maragall S. Argatroban: A direct thrombin inhibitor with reliable and predictable anticoagulant actions. Drugs Today 2006; 42(4): 223. Dostupné z DOI: <http://dx.doi.org/10.1358/dot.2006.42.4.953588>.
- Heparin-Leciva. SPC. Dostupné z WWW: <http://www.sukl.cz/modules/medication/detail.php?code=0091915&tab=texts>.
- 12.Warfarin Orion. SPC. Dostupné z WWW: <http://www.sukl.cz/download/spc/SPC3811.pdf>.
- Fraxiparine. SPC. Dostupné z WWW: <http://www.sukl.cz/modules/medication/detail.php?code=0213487&tab=text>.
- Souhrn údajů o přípravku Arixtra. [The European Medicines Agency]. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000403/WC500027746.pdf>.
- Souhrn údajů o přípravku Pradaxa. [The European Medicines Agency]. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000829/WC500041059.pdf>.
- Souhrn údajů o přípravku Xarelto. [The European Medicines Agency]. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000944/WC500057108.pdf>.
- Souhrn údajů o přípravku Eliquis. [The European Medicines Agency]. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_librar/EPAR_-_Product_Information/human/002148/WC500107728.pdf >.
- Souhrn údajů o přípravku Lixiana. [The European Medicines Agency]. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002629/WC500189045.pdf>.
- Kvasnička J, Penka M, Kvasnička T et al. Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem. Vnitř Lék 2015; 61(6): 537–546.
- Robertson L, KestevenP, McCaslin JE. Oral direct thrombin inhibitors or oral factor Xa inhibitors for the treatment of deep vein thrombosis. Cochrane Database Syst Rev 2015; (6): CD010956. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD010956.pub2>.
- Michalcová J, Penka, M, Buliková A et al. Nová – přímá perorální antikoagulancia: aktuální přehled. Vnitř Lék 2016; 62(10): 805–813.
- Fitzmaurice DA, Blann AD, Lip GY. Bleeding risks of antithrombotic therapy. BMJ 2002; 325(7368): 828–831.
- Junqueira DR, Zorzela LM, Perini E. Unfractionated heparin versus low molecular weight heparin for avoiding heparin-induced thrombocytopenia in postoperative patients. Cochrane Database Syst Rev 2017; 4: CD007557. Dostupné z DOI: <http://doi:10.1002/14651858.CD007557.pub3>.
- Matýšková M. Warfarin, potrava a potravinové doplňky. Interní Med 2010; 12(2): 87–91. Dostupné z WWW: <https://www.internimedicina.cz/pdfs/int/2010/02/07.pdf>.
- Samuelson BT, Cuker A, Siegal DM et al. Laboratory assessment of the anticoagulant activity of direct oral anticoagulants. Chest 2017; 151(1): 127–138. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chest.2016.08.1462>.
- Baglin T, Barrowcliffe TW, Cohen A et al. for the British Committee for Standards in Haematology. Guidelines on the use and monitoring of heparin. Br J Haematol 2006; 133(1): 19–34. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2005.05953.x>.
- Salmonson T, Dogné JM, Janssen H et al. Non-vitamin-K oral anticoagulants and laboratory testing: now and in the future. Views from a workshop at the European Medicines Agency (EMA). Eur Heart J Cardiovasc Pharmacother 2017; 3(1): 42–47. Dostupné z DOI: <http://dx.doi.org/10.1093/ehjcvp/pvw032>.
- Hu TY, Vaidya VR, Asirvatham SJ. Reversing anticoagulant effects of novel oral anticoagulants: role of ciraparantag, andexanet alfa, and idarucizumab. Vasc Health Risk Manag 2016; 12 : 35–44. Dostupné z DOI: <http://dx.doi.org/10.2147/VHRM.S89130>.
- Ansell JE, Bakhru SH, Laulicht BE et al. Single-dose ciraparantag safely and completely reverse anticoagulant effects of edoxaban. Thromb Haemost 2017; 117(2): 238–245. Dostupné z DOI: <http://dx.doi.org/10.1160/TH16–03–0224>.
- Nielsen PB, Skjøth F, Søgaard M et al. Effectiveness and safety of reduced dose non-vitamin K antagonist oral anticoagulants and warfarin in patients with atrial fibrillation: propensity weighted nationwide cohort study. BMJ 2017; 356: j510. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.j510>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 5-
All articles in this issue
- Diferenciální diagnostika anémií
- Hemoglobinopatie
- Vzácné anémie ze skupiny vrozených syndromů selhání kostní dřeně
- Aplastická anémie
- Paroxyzmální noční hemoglobinurie
- Autoimunitní hemolytická anémie
- Granulocytopenie
- Diagnostika a léčba imunitní trombocytopenie
- Transplantace hematopoetických kmenových buněk v léčbě nemaligních onemocnění krvetvorby
- Diagnostika poruch hemostázy
- Vrozené a získané krvácivé stavy
- Vyšetřování vrozených trombofilních stavů: kdy, koho, na co, anebo vůbec?
- Antitrombotika dnes
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autoimunitní hemolytická anémie
- Diferenciální diagnostika anémií
- Vrozené a získané krvácivé stavy
- Hemoglobinopatie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

