-
Medical journals
- Career
Skríning tyreopatií v gravidite – odborné usmernenie v praxi
Authors: Patrícia Páleníková 1; Iveta Kalafutová 2; Zdenka Horníková 3; Juraj Payer 1
Authors‘ workplace: V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava, Slovenská republika 1; Endokrinologická ambulancia, Bratislava, Slovenská republika 2; Endokrinologická ambulancia, Topoľčany, Slovenská republika 3
Published in: Vnitř Lék 2017; 63(9): 555-560
Category: Original Contributions
Overview
Tyreopatie môžu nepriaznivo ovplyvňovať koncepciu, udržanie gravidity, zvyšujú riziko komplikácií v gravidite, môžu mať negatívny vplyv na plod. Je preto potrebné včas zachytiť ochorenia štítnej žľazy v populácii žien plánujúcich graviditu, resp. vo včasnom štádiu tehotenstva. V Slovenskej republike je od roku 2009 platné Odborné usmernenie Ministerstva zdravotníctva Slovenskej republiky (OU MZ SR) pre diagnostiku a liečbu autoimunitných ochorení štítnej žľazy u žien v období tehotenstva. V našich súboroch sme u 666 pacientok hodnotili včasnosť realizácie skríningu v časovom rozmedzí rokov 2015–2017, laboratórne parametre štítnej žľazy, počet gravidít a ich komplikácie, potrebu liečby levotyroxínom. Zistili sme, že realizácia skríningu bola posunutá do skoršieho obdobia gravidity (11,4 gestačný týždeň v rokoch 2015/2016 vs 8,2 gestačný týždeň v rokoch 2016/2017), najviac odoslaných pacientok bolo v 1. trimestri gravidity (72 %), pozitivitu autoprotilátok proti tyreoperoxidáze malo 81 % pacientok, klinickú hypotyreózu 10 % pacientok, subklinickú hypotyreózu 90 % pacientok, patológiu v gravidite 13 % pacientok. Liečbu dostávalo 70 % pacientok. Je zjavné, že s odstupom času od zavedenia skríningu stúpa počet skrínovaných pacientok v 1. trimestri (83 % v rokoch 2016/2017). Z výsledkov vidieť i vysoký počet zachytenej pozitivity autoprotilátok. Jedná sa teda o tie pacientky, ktoré by mali byť sledované a v prípade vzostupu hladiny tyreostimulačného hormónu (TSH) nad hornú hranicu normy pre daný trimester aj liečené. Liečba minimalizuje riziko tehotenských komplikácií.
Kľúčové slová:
gravidita – hypotyreóza – skríning – tyroxínÚvod
Subklinická hypotyreóza (SCH) je charakterizovaná hladinami fT4, ktoré sú v normálnom referenčnom laboratórnom rozmedzí, zatiaľ čo hladiny sérového TSH sú mierne zvýšené. Vyskytuje sa u 3–8 % všeobecnej populácie. Je častejšia u žien ako u mužov a jej prevalencia sa zvyšuje s vekom. Najdôležitejším dôsledkom SCH je vysoká pravdepodobnosť progresie do klinickej hypotyreózy. Antityreoidálne protilátky boli detekované u 80 % pacientov so SCH a 80 % pacientov má sérové hladiny TSH menej ako 10 mIU/l [1]. SCH nemusí byť liečená, ak TSH neprekračuje 10 mIU/l alebo nie je prítomnosť tehotenstva. Neexistujú jednotné názory, či mierne abnormality funkcií štítnej žľazy pri subklinickej hypotyreóze u gravidných sú skutočne spojené s neplodnosťou a potratom a či liečba levotyroxínom znižuje tieto príhody. Navyše, definícia subklinickej hypotyreózy sa líši v závislosti od prítomnosti gravidity. Ak pacientka nie je gravidná, definuje SCH hladina tyreostimulačného hormónu (TSH) > 4,5–5,0 mIU/l, v prípade gravidity je to hodnota TSH > 2,5 mIU/l počas 1. trimestra tehotenstva [2]. V Slovenskej republike (SR) je od roku 2009 platné Odborné usmernenie Ministerstva zdravotníctva Slovenskej republiky pre diagnostiku a liečbu autoimunitných ochorení štítnej žľazy u žien v období tehotenstva.
Cieľ práce
Cieľom práce bolo zistiť, ako sa realizuje skríning ochorení štítnej žľazy v gravidite v praxi – či je rozdiel v čase jeho realizácie s odstupom od jeho zavedenia do praxe, nakoľko sa po jeho zavedení realizoval zväčša v 2. trimestri. Koľko zo skrínovaných pacientok má hyper/hypotyreózu, koľko z nich vyžaduje liečbu. Zistiť, aké je percento komplikácií vyskytujúcich sa v gravidite u pacientok s poruchou funkcie štítnej žľazy (ŠŽ).
Súbor
Vyšetrovali sme súbor 666 pacientok od roku 2009 (kedy vstúpilo do platnosti OU MZ) do roku 2017. Súbor bol rozdelený na súbor I a súbor II., podľa toho či boli pacientky novodiagnostikované alebo už bolo ochorenie ich ŠŽ známe. Pacientky boli odoslané gynekológom na endokrinologickú ambulanciu pre patologické hodnoty TSH, resp. protilátky proti tyreoperoxidáze (aTPO). Súbor I. tvorilo 515 pacientok vyšetrených od roku 2009 do roku 2015, tento sme ďalej rozdelili na 2 podsúbory – základné rozdelenie pacientok do podsúborov bolo podľa ne/prítomnosti tyreopatie pred graviditou. Podsúbor novodiagnostikovaných pacientok tvorilo 344 pacientok, podsúbor s už známym ochorením ŠŽ v anamnéze tvorilo 171 pacientok. V súbore II. bolo 151 pacientok vyšetrených v rokoch 2015–2017 a všetky boli novodiagnostikované. Súbor sme rozdelili na 2 podsúbory, v prvom boli pacientky, ktoré boli vyšetrené v od januára roku 2015 do júna roku 2016, v druhom podsúbore pacientky vyšetrené v rokoch od júla roku 2016 do júla roku 2017, aby sme vedeli porovnať realizáciu skríningu v čase. Podrobnejšie charakteristiky súborov sú uvedené v tab. 1 a tab. 2.
Table 1. Charakteristika súboru I 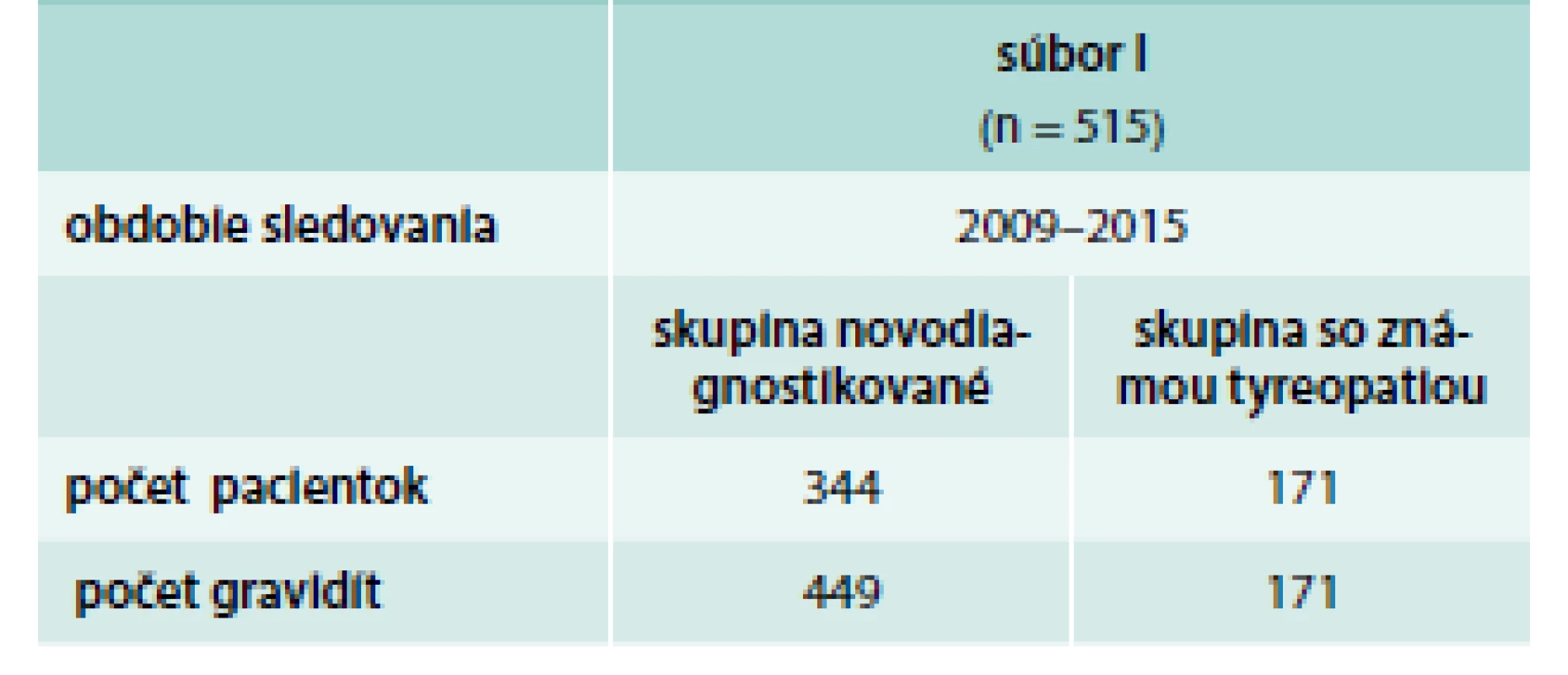
Table 2. Charakteristika súboru II 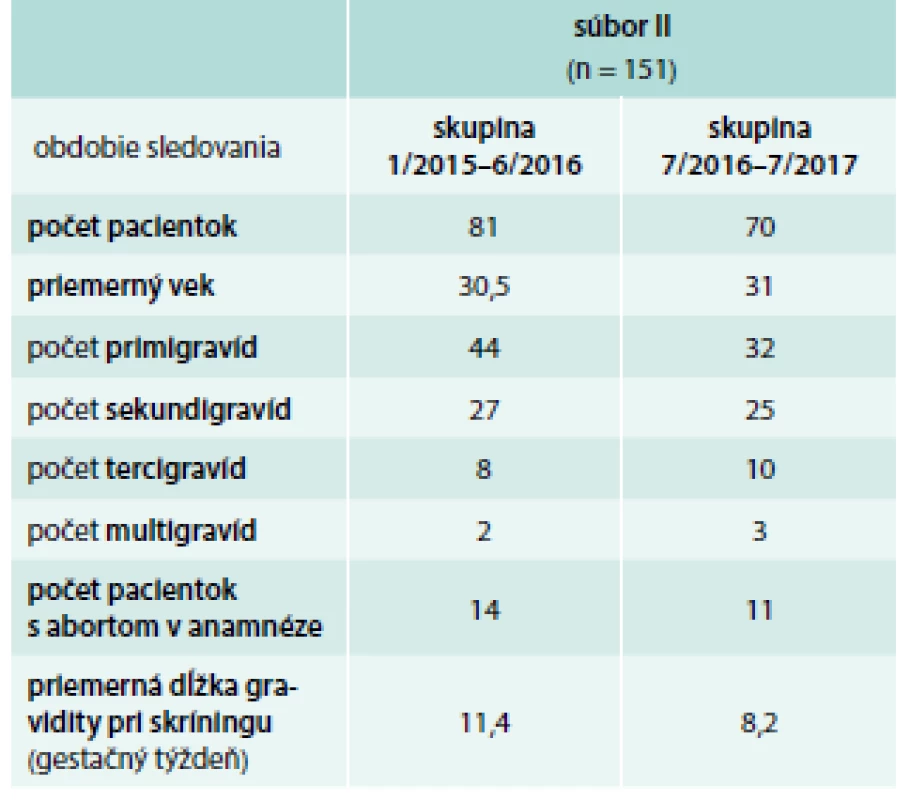
Metodika
Cestou troch endokrinologických ambulancií (klinickej, poliklinickej a rajónnej) sme anamnesticky, klinicky i laboratórne vyšetrovali gravidné pacientky, ktoré boli odoslané gynekológom, pre patologické hodnoty aTPO, resp. TSH. Sledovali sme čas realizácie skríningu. Vyhodnotili sme odobraté hodnoty TSH a voľného tyroxínu (fT4) podľa príslušnej normy k trimestru, v ktorom boli odobraté (tab. 3), v laboratóriu Medirex a.s. bolo TSH stanovované metódou 3. generácie, supersenzitívne, s použitím monoklonálnych protilátok. Tyreoidálnu autoimunitu sme hodnotili podľa detekcie autoprotilátok proti TPO podľa normy (tab. 3). Stanovovanie aTPO a aTSH prebiehalo v laboratóriu Medirex a.s. elektrochemiluminiscenčným imunostanovením (ECLIA) na analyzátoroch Elecsys a Cobase. U pacientok so supresiou TSH sme doplnili aj vyšetrenie aTSH protilátok (protilátky proti TSH receptoru). Pacientky boli vyšetrované počas gravidity v každom trimestri a po ukončení gravidity v 3., 6. a 12. mesiaci. U pacientok sme spracovávali anamnestické údaje o priebehu gravidity, event. komplikáciách počas gravidity, počas pôrodu a v popôrodnom období, ako i prítomnosť závažnej patológie u novorodencov. Výsledky sme spracovali deskriptívnymi štatistickými metódami.
Table 3. Hodnoty aTPO, TSH a fT<sub>4</sub> v trimestroch gravidity 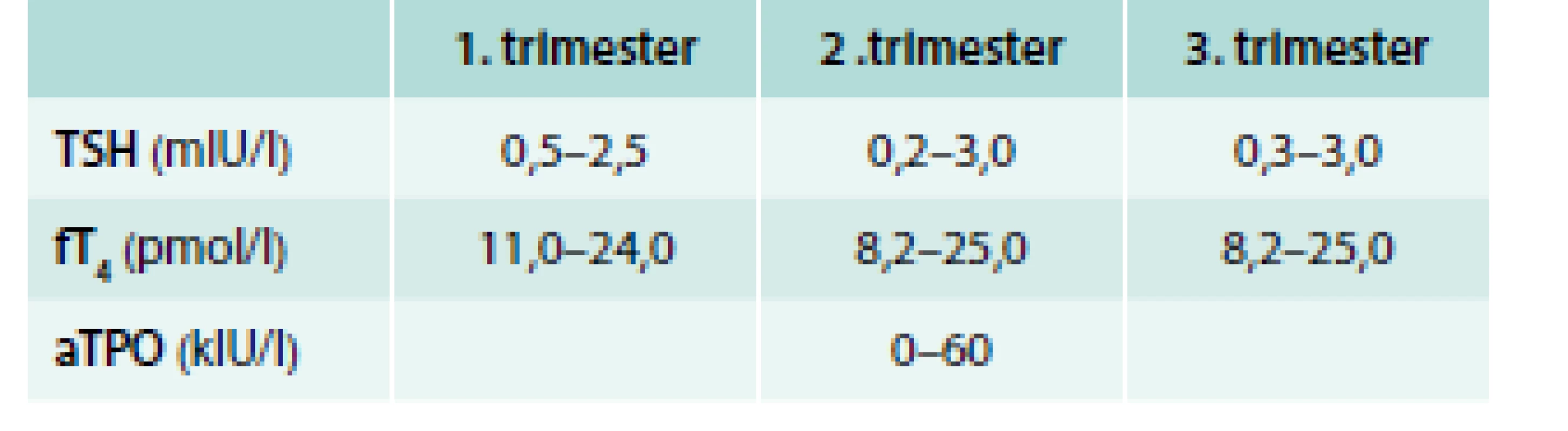
Výsledky
Najviac pacientok bolo skrínovaných v oboch súboroch v 1. trimestri – 61–83 % pacientok, z toho najväčší počet v roku 2017. V 2. trimestri to bolo 15,5–35 % a v 3. trimestri 1,7–4 % pacientok (tab. 4) V podsúbore I – novodiagnostikované pacientky – malo patologické TSH v skríningu takmer 50 % pacientok (89 % malo subklinickú, 11 % klinickú hypotyreózu, tyreotoxikózu malo 30 %, s pozitivitou aTSH Ab bolo 18 % a prechodnú liečbu tyreostatikom vyžadovalo 4,4 %). Len pozitivitu aTPO a TSH v norme malo 51,7 % pacientok, napokon však až 84 % pacientok malo po endokrinologickom vyšetrení pozitívne niektoré z autoprotilátok (tab. 5 a tab. 6). V podsúbore I – so známou tyreopatiou – bolo 22 % pacientok s AIT (autoimunitná tyreoiditída) bez poruchy funkcie dovtedy a bez liečby, 72 % bolo pacientok so známou AIT už liečených pre zvýšené TSH, menej ako 1 % s liečenou tyreotoxikózou, 5 % pacientok len sledovaných pre strumu bez poruchy funkcie (tab. 7). Patológiu v gravidite alebo počas pôrodu hlásilo v skupine A 16,7 % gravidít, v skupine B 21,7 % gravidít (tab. 11).
Table 4. Počet pacientok skrínovaných podľa trimestrov (%) 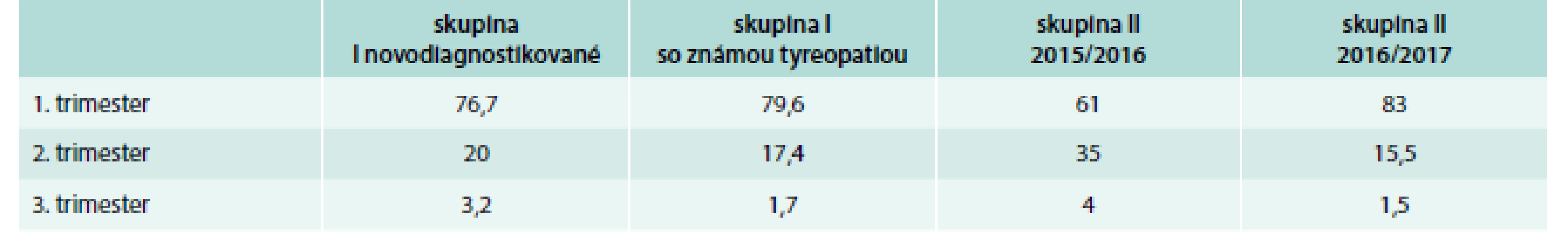
Table 5. Počet pacientok s hypotyreózou (%) – skupina I novodiagnostikované 
Table 6. Počet pacientok s hypertyreózou (%) – skupina I novodiagnostikované 
Table 7. Počet pacientok podľa poruchy funkcie ŠŽ (%) – skupina I so známou tyreopatiou 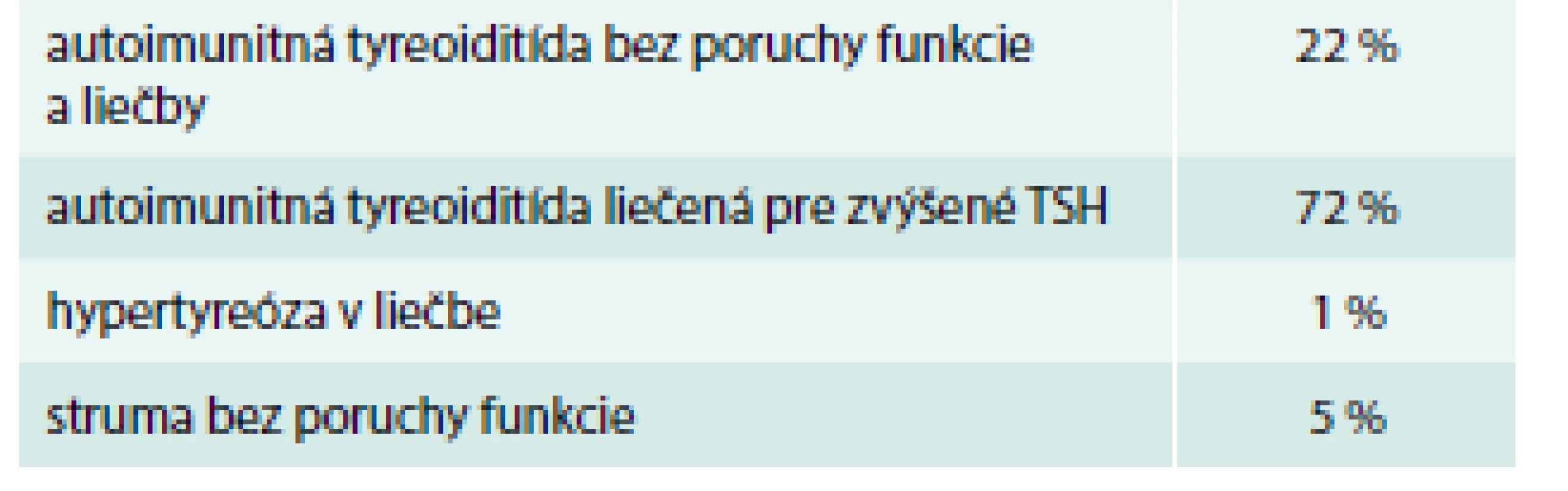
V skupine II – roky 2015/2016 – malo zvýšené TSH 72,5 % pacientok, z toho 96 % subklinickú a 4 % klinickú hypotyreózu, znížené TSH malo 9 % pacientok – všetky v rámci fyziologického zníženia TSH v 1. trimestri, tyreotoxikózu ani pozitivitu aTSH protilátok sme nezaznamenali (tab. 8). TSH v norme malo 18,5 % pacientok, z toho však 66,6 % malo pozitívne aTPO. Celkovo pozitívne aTPO malo 77,7 % pacientok (tab. 9). Patológiu v gravidite udávalo 11,1 % pacientok (najviac predčasné pôrody), tab. 11. Závažnejšiu patológiu u novorodencov sme zaznamenali v 1 prípade – vrodená porucha žlčových ciest s nutnosťou chirurgickej korekcie. Smrť novorodencov sme nezaznamenali.
Table 8. Počet pacientok s hypotyreózou (%) v skupine II 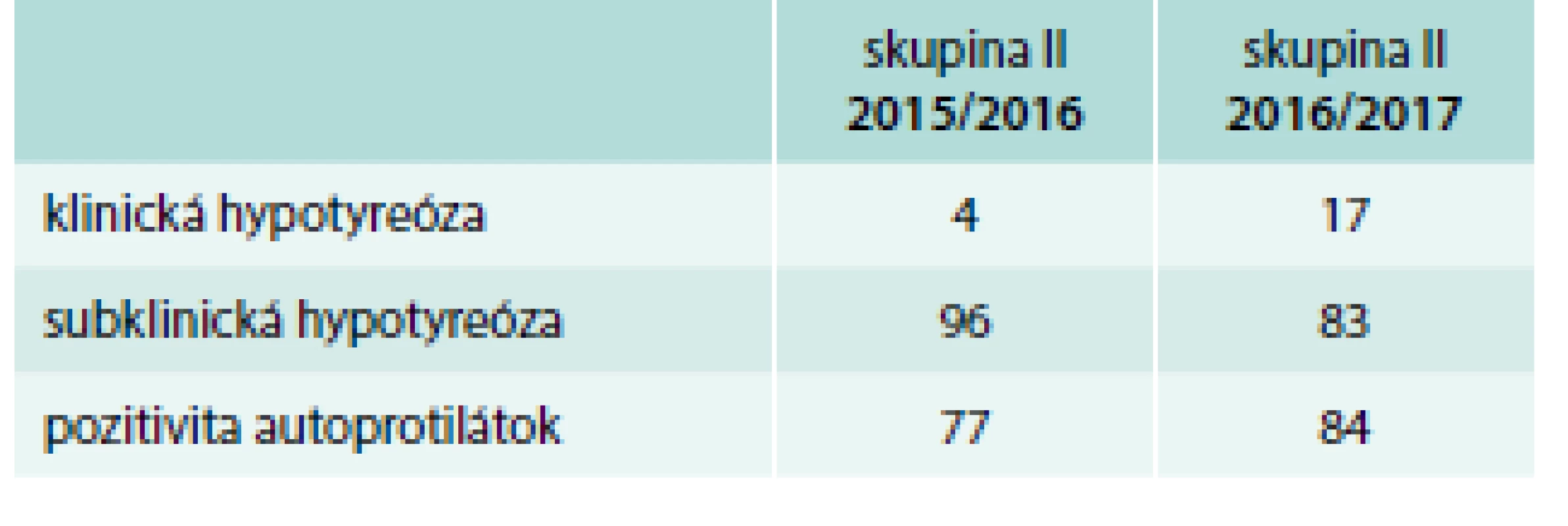
Table 9. Počet pacientok (%) – hodnoty TSH v skupine II 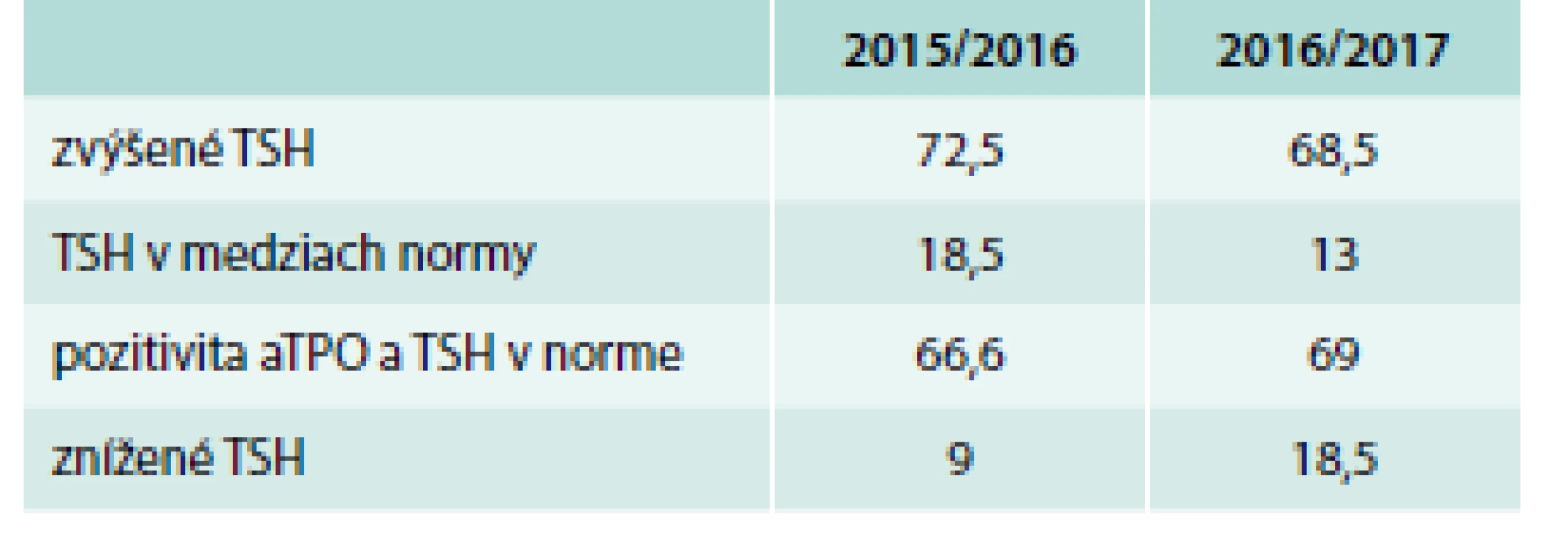
Table 10. Počet pacientok (%) – hodnoty fT<sub>4</sub> v skupine II 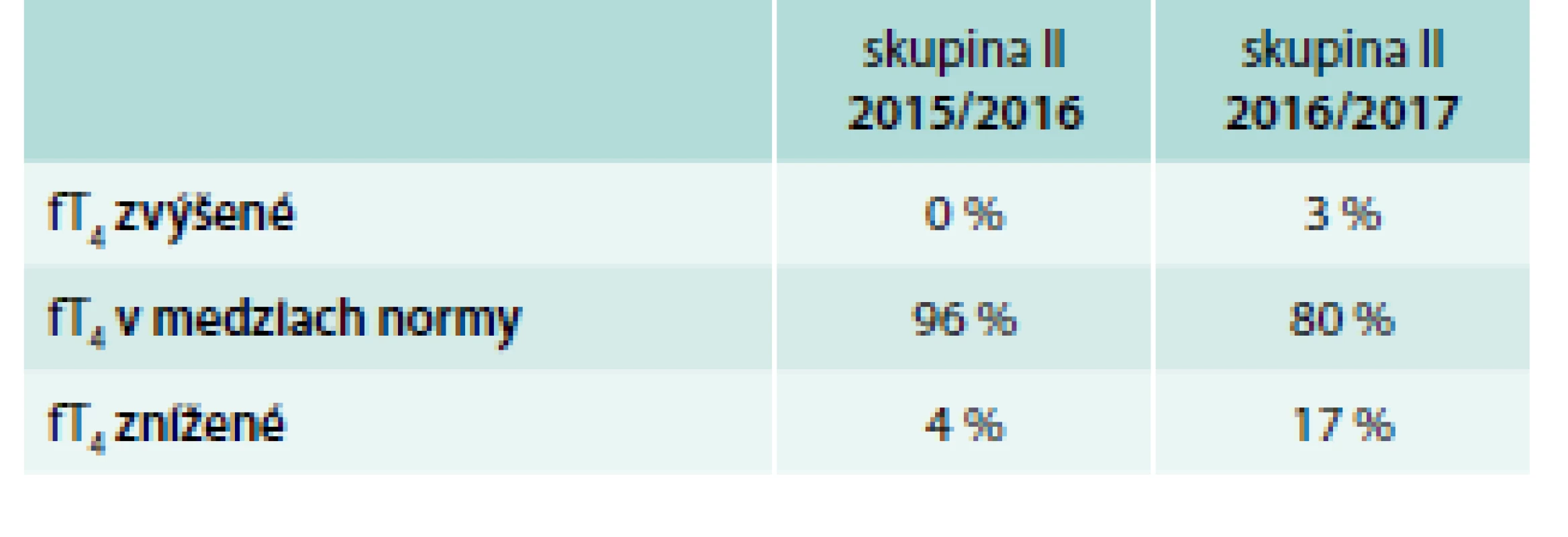
Table 11. Počet pacientok (%) – patológia v gravidite 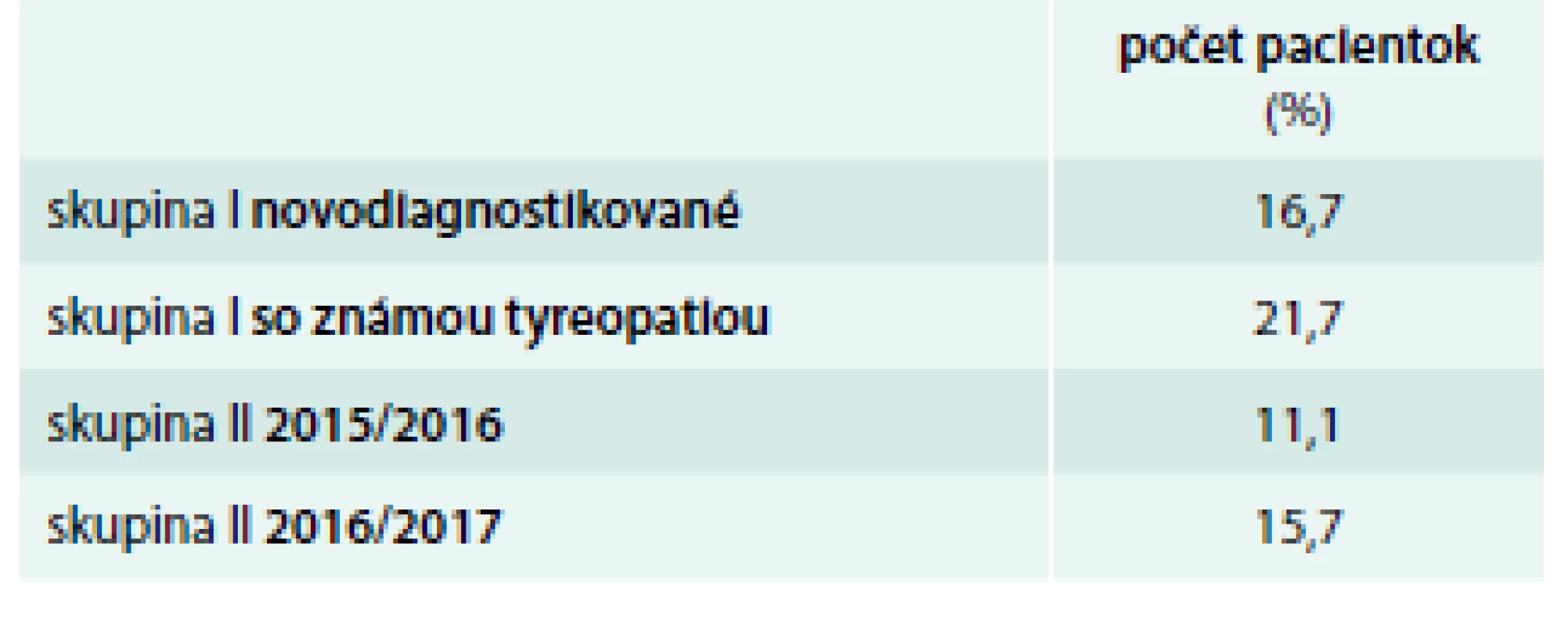
V skupine II – roky 2016/2017 – malo zvýšené TSH 68,5 % pacientok, z toho 83 % subklinickú a 17 % klinickú hypotyreózu, znížené TSH malo 18,5 % pacientok, z toho tyreotoxikózu a pozitivitou aTSH protilátok 15,3 % pacientok. TSH v norme malo 13 % pacientok, z toho však 69 % malo pozitívne aTPO. Celkovo pozitívne aTPO malo 84 % pacientok (tab. 8, 9 a 10). Patológiu v gravidite udávalo 15,7 % pacientok, z toho 18 % abort, 64 % predčasný pôrod, 18 % iné (tab. 11). Závažnú patológiu u novorodencov alebo smrť sme nezaznamenali.
Diskusia
Tyreoidálne hormóny (TH) sú od začiatku prenatálneho vývoja nevyhnutné pre správny vývoj plodu (CNS, pľúca, kosti, postnatálny intelekt) [3]. Produkcia TH štítnou žľazou plodu nastáva asi od 12. gestačného týždňa (GT), dovtedy je plod plne závislý od dodávky TH od matky. V gravidite stúpa potreba TH o 25–50 μg tyroxínu/deň [4]. V gravidite stúpa i potreba dennej dodávky jódu (pre potreby plodu, zvýšenie renálneho klírensu jódu u matky). Zvýšením denného príjmu jódu v gravidite môžeme predchádzať materskej i fetálnej hypotyreóze [5].
Lumen folikulov epitelových buniek štítnej žľazy (ŠŽ) sa po začatí sekrečnej činnosti v 10. gestačnom týždni vyplňuje koloidom. V 11. GT je dokázateľná sekrécia T4 (tyroxín). Od 15.–20.GT sa u plodu výrazne zvyšuje tvorba TSH. Zvýšené množstvo receptorov pre tyreoidálne hormóny vo fetálnom mozgu v 4. mesiaci tak nasleduje zvýšenie tvorby T4. Pre biochemické parametre fetálnej tyreoidálnej činnosti je charakteristické postupne sa zvyšujúca hladina T4, nízka hladina T3 (trijódtyronínu) a vyšší rT3 (reverzný trijódtyronín). Mozog a ostatné fetálne tkanivá závislé na T3 naviac využívajú k vlastnej konverzii T4 na T3 veľmi aktívnu dejodázu 2. typu. Nízke fetálne hladiny T3 sú odrazom nízkeho stupňa vlastnej termogenézy plodu a preferovaného anabolizmu a zaručujú nízku spotrebu kyslíka periférnymi tkanivami, čím tiež chránia vývoj CNS. T3 sa zvyšuje až koncom gestácie zvýšením aktivity dejodázy 1. typu (od 30. GT), kedy je nevyhnutný okrem iného pre zrenie pľúcneho a kostného tkaniva. Funkcia fetálnej štítnej žľazy je riadená autonómne (materský TSH sa neprenáša transplacentárne), ale je závislá na transplacentárnom prívode jodidu. Fetálne sérové hladiny TSH sa začínajú zvyšovať okolo 20. GT, sú sprevádzané progresívnym nárastom T4, čo je dôsledkom postupnej maturácie štítnej žľazy. Koncentrácia TSH sa udržuje až do pôrodu približne na rovnakých hodnotách. U predčasne narodených detí sú hladiny T4 a T3 v pupočníkovej krvi nízke a zostávajú znížené aj počas 1. týždňa života. Nazýva sa to prechodnou hypotyroxinémiou predčasne narodených detí. Môže trvať až 3–8 týždňov, pokiaľ sa hladiny upravia. Príjem jódu počas 1. týždňa po narodení je u týchto detí nedostatočný, pretože nezrelé črevo toleruje len malé množstvo mlieka. Tieto faktory vedú k zvýšenému ohrozeniu predčasne narodených detí psychomotorickými odchýlkami vo vývoji [6–8]. TH pôsobia na vývoj centrálnej nervovej sústavy (CNS) niekoľkými spôsobmi: stimulujú proliferáciu neurónov, pôsobia ako „časový spínač“, t.j. pri určitom stupni vývoja ukončujú proliferáciu a začínajú proces diferenciácie neurónov, riadia migráciu dozrievajúcich neurónov na príslušné miesta CNS (mozgová a mozočková kôra), stimulujú tvorbu a rozvoj axónov a dendritov, zabezpečujú primeranú tvorbu a rozvoj synapsií, majú významný vplyv na procesy myelinizácie ako i na morfologický, biochemický aj funkčný vývoj cytoskeletu CNS [9]. Neuropsychické poškodenie novorodenca, ktoré vzniká pri nedostatku TH v gravidite sa prezentuje širokou škálou a intenzitou klinických príznakov – od ľahkého poklesu IQ detekovateľného iba špeciálnymi testami až po kretenizmus, ktorý má aj charakteristické somatické stigmy [10].
Kontroverzie o potrebe rutinného skríningu tehotných žien
Nepriaznivý vplyv klinickej hypotyreózy v gravidite je dobre dokumentovaný a nie je predmetom diskusie. V porovnaní so zjavnou klinickou hypotyreózou, u ktorej existujú jasné dôkazy o nežiadúcich vplyvoch na graviditu, vplyv SCH (subklinickej hypotyreózy) na tehotenstvo nie je stále úplne jasný [11].
Viaceré štúdie zaznamenali asociáciu SCH s nárastom rizika komplikácií tehotenstva i novorodenca. Patrí sem riziko abortu, predčasného pôrodu, gestačného diabetu, gestačnej hypertenzie, preeklampsie, abrupcie placenty, predčasného roztrhnutia plodových obalov, intrauterinného obmedzenia rastu, nízkej pôrodnej hmotnosti vzhľadom na gestačný vek, nízke Apgarovej skóre, neonatálna smrť [12,13].
Okrem toho vysoké hladiny TSH u žien počas tehotenstva boli spojené so zvýšeným rizikom neurokognitívnych deficitov u potomstva [14]. Ďalšie štúdie však nenašli žiadne nepriaznivé výsledky spojené s SCH [15,16]. Okrem toho je neistý vplyv substitučnej liečby levotyroxínom na zníženie rizika komplikácií u gravidných žien so SCH [11].
Už viac ako dekádu sa preto diskutuje o tom, či by skríning subklinických porúch štítnej žľazy počas tehotenstva mal byť rutinný alebo by mal byť len u rizikových skupín – založený na príznakoch, anamnéze a prítomnosti rizikových faktorov. Tieto údaje prinútili pôrodnícke a endokrinologické profesionálne spoločnosti navrhnúť odporúčania týkajúce sa skríningu ochorení ŠŽ počas tehotenstva, z ktorých niektoré nie sú úplne založené na dostupných dôkazoch.
Prevalencia zjavnej choroby štítnej žľazy sa odhaduje na 1–2 z 1 000 tehotenstiev a historicky sa nepovažovala za dostatočne vysokú, aby ospravedlnila rutinné skríningové vyšetrenie. Pozoruhodné boli výsledky kontrolovanej štúdie antenatálneho skríningu tyreopatií – takmer 22 000 tehotných žien bolo skrínovaných buď s izolovanou vysokou hladinou TSH, alebo s izolovanou nízkou hladinou voľného tyroxínu. Napokon bolo 390 detí žien liečených s každou touto diagnózou porovnávaných so 404 deťmi podobných žien, ktoré neboli počas tehotenstva liečené. Liečba nemala vplyv na priemerné IQ potomstva vo veku 3 rokov alebo na počet detí s IQ < 85. Autori tejto štúdie dospeli k záveru, že prenatálny skríning a liečba počas gravidity u žien so subklinickou dysfunkciou štítnej žľazy neviedli k zlepšeniu kognitívnych funkcií.
Pokračujúca intervenčná štúdia, ktorú uskutočnila sieť národných inštitúcií pre zdravie detí a ľudského rozvoja Eunice Kennedy-Shriver, poskytne ďalšie údaje k tejto dôležitej otázke. Medzitým diskutujúci autori dospeli po dôkladnej revízii aktuálne zverejnenej literatúry k záveru, že v súčasnosti nie je zaručené rutinné vyšetrenie subklinickej dysfunkcie štítnej žľazy počas tehotenstva [17]. Proti rutinnému skríningu hovorí práca Lazarusa [18]. Review od Van den Boogaarda z roku 2011, ktoré zahŕňalo 38 článkov vhodných na metaanalýzu, poukazovalo na nepriaznivé následky spojené so SCH a pozitivitou autoprotilátok [19]. V roku 2013 sa v Cochranovej databáze neidentifikovali žiadne štúdie hodnotiace účinnosť liečby levotyroxínom na materské a neonatálne komplikácie SCH počas tehotenstva [20]. Preto sa uskutočnil systematický prehľad, ktorý zhrnul dôkazy o nepriaznivom klinickom vplyve SCH počas gravidity a o účinku liečby levotyroxínom na zmiernenie komplikácií [21]. V tejto metaanalýze bolo prehodnotených 18 štúdií zahŕňajúcich 3 995 tehotných žien s SCH. Zistilo sa, že tehotné ženy so SCH boli vystavené vyššiemu riziku abortu, abrupcie placenty, úmrtia novorodencov v porovnaní s eutyroidnými gravidnými. Bola identifikovaná len jedna observačná štúdia o účinku levotyroxínu u gravidných žien so SCH, ale táto štúdia mala vysokú mieru skreslenia a priniesla nepresné výsledky. Skríning rizikových skupín by sa mal realizovať u pacientok s anamnézou hypotyreózy, hypertyreózy, postpartálnej tyreoiditídy alebo lobektómie, s pozitívnou rodinnou anamnézou tyreopatií, pri prítomnosti strumy, u pacientok s body mass indexom viac ako 40 kg/m2, vo veku nad 30 rokov, pri prítomnosti diabetes mellitus 1. typu alebo iných autoimunitných ochorení, pri stavoch po iradiácii hlavy alebo krku v minulosti, u infertilných pacientok, anamnéze potratu alebo predčasného pôrodu, anamnéze užívania amiodaronu, lítia, cytokínov [22]. V štúdii na 1 560 tehotných ženách sa vyšetrením len žien s rizikovým profilom nezachytilo 30 % subklinických alebo klinických tyreopatií v gravidite [23]. Následky tyroidálnej dysfunkcie na matku sú nasledujúce: problémy s fertilitou, endometrióza, ovariálne zlyhanie, spontánny potrat, predčasný pôrod, preeklampsia, abrupcia placenty, hypertenzia, popôrodné krvácanie. Následky tyroidálnej dysfunkcie na plod sú tieto: fetálna smrť, intrauterinná retardácia rastu, fetálna hypotyreóza, zvýšené riziko sepsy, respiračného distress syndrómu, zvýšená perinatálna mortalita, kardiomyopatia, znížená pôrodná hmotnosť, neonatálna hypotyreóza, spomalenie neuropsychického vývoja, zhoršená popôrodná adaptácia. Pre tieto skutočnosti odporúča Vila rutinný skríning pre skríningom rizikových skupín [24]. Podobné závery uvádzajú i Límanová [25] a Horáček [26].
V SR je od roku 2009 platné OU MZSR pre diagnostiku a liečbu autoimunitných ochorení ŠŽ u žien v období tehotenstva. Podľa jeho znenia „sa skríning pacientky realizuje v gynekologickej ambulancii pri prvom vyšetrení, pri žiadanom tehotenstve, optimálne do 10. týždňa tehotnosti. V rámci skríningu sa odporúča indikovať vyšetrenie TSH a autoprotilátky proti tyreoperoxidáze (TPOAb). Ak sú výsledky pozitívne, pacientka sa odošle na špecializované endokrinologické pracovisko, na ktorom podľa uváženia endokrinológ indikuje ďalšie vyšetrenie voľného tyroxínu (fT4), voľného trijódtyronínu (fT3), autoprotilátky proti tyreoglobulínu (TGAb) a TSHr Ab. Na endokrinologickom pracovisku sa poučí každá pacientka, ktorá je dispenzarizovaná so známym ochorením štítnej žľazy a ktorá plánuje tehotenstvo, aby po potvrdení tehotenstva absolvovala kontrolné vyšetrenia v endokrinologickej ambulancii“.
Záver
V našej práci sme sa pilotne zamerali na implementáciu záväzných odporúčaní do praxe. Spracovali sme údaje z troch endokrinologických ambulancií (ide o ambulanciu nemocničného zariadenia, poliklinickú ambulanciu a samostatnú endokrinologickú ambulanciu). Dôvodom bolo zistiť eventuálny rozdiel v endokrinologickej konzultácii podľa typu zariadenia. Nenašli sme rozdiely v dostupnosti vyšetrenia medzi jednotlivými typmi ambulantných zariadení. Súčasťou nášho projektu je i hodnotenie gynekologického skríningu (pomer patologických nálezov vs počet vyšetrených gravidných) ako i posúdenie základného statusu novorodenca. Zber týchto dát ešte prebieha. Je zjavné, že s odstupom času od zavedenia skríningu stúpa počet skrínovaných pacientok v 1. trimestri (83 % v rokoch 2016/2017), kedy je dostatok TH najdôležitejší. Z výsledkov vidieť i vysoký počet zachytenej pozitivity autoprotilátok. Jedná sa teda o tie pacientky, ktoré by mali byť sledované a v prípade vzostupu TSH (tyreostimulačný hormón) nad hornú hranicu normy pre daný trimester aj liečené, zároveň sú to pacientky u ktorých je zvýšené riziko rozvinutia funkčnej poruchy ŠŽ, vrátane postpartálnej tyreoiditídy. Takmer 11 % žien malo klinickú hypotyreózu, s jednoznačnou potrebou liečby. Pri neprítomnosti skríningu by ich diagnóza nebola zistená a mohli by sa vyvinúť komplikácie gravidity alebo u plodu. Vzhľadom na uvedené považujeme skríning za opodstatnený, jeho realizácia minimalizuje riziko tehotenských komplikácií a umožňuje včas zachytiť aj klinicky „nemé“ tyreopatie.
MUDr. Patrícia Páleníková, PhD.
patricia.palenikova@gmail.com
V. interná klinika LF UK a UNB,
Nemocnica Ružinov,
Bratislava,
Slovenská republika
www.unb.sk
Doručeno do redakce 31. 7. 2017
Přijato po recenzi 4. 9. 2017
Sources
1. Cooper DS. Subclinical hypothyroidism. N Engl J Med 2001; 345(4): 260–265.
2. Philip S. Should women with subclinical hypothyroidism receive thyroid hormone replacement prior to and during pregnancy? Clinical Thyroidology for the Public 2015; 8(11): 3–4.
3. de Escobar M, Obregón G et al. Role of thyroid hormone during early brain development. Eur J Endocrinol 2004; 151(Suppl 3): U25-U37.
4. Borovský M, Payer J et al. Gynekologická endokrinológia. Herba: Bratislava 2016. ISBN 978–80–89631–57–5.
5. Obregón MJ, Calvo RM et al. Thyroid hormones and fetal development. In: Pinchera A, Mann K, Hostalek U. The Thyroid and Age. Schattauer: Stuttgart 1998 : 49–73. ISBN 978–3794518678.
6. Fisher DA. Hypothyroxinemia in premature infants: is thyroxine treatment necessary? Thyroid 1999; 9(7): 715–720.
7. Glinoer D, Delange F. The potential repercussions of maternal, fetal and neonatal hypothyroxinemia on the progeny. Thyroid 2000; 10(10): 871–887.
8. Williams FL, Visser TJ, Hume R. Transient hypothyroxinaemia in preterm infants. Early Hum Dev 2006; 82(12): 797–802.
9. Lavado-Autric R, Auso E et al. Early maternal hypothyroxinemia alters histogenesis and cerebral cortex cytoarchitecture of the progeny. J Clin Invest 2003; 111(7): 1073–1082.
10. Kasatkina EP, Samsonova LN et al. Gestational hypothyroxinemia and cognitive function in offspring. Neurosci Behav Physiol 2006; 36(6): 619–624.
11. Negro R, Stagnaro-Green A. Diagnosis and management of subclinical hypothyroidism in pregnancy. BMJ 2014; 349: g4929. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.g4929>.
12. Casey BM, Dashe JS, Wells CE et al. Subclinical hypothyroidism and pregnancy outcomes. Obstet Gynecol 2005; 105(2): 239–245.
13. Liu H, Shan Z, Li C et al. Maternal subclinical hypothyroidism, thyroid autoimmunity, and the risk of miscarriage: a prospective cohort study. Thyroid 2014; 24(11): 1642–1649. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2014.0029>.
14. Haddow JE, Palomaki GE, Allan WC et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. New Engl J Med 1999; 341(8): 549–555.
15. Männistö T, Vääräsmäki M, Pouta A et al. Perinatal outcome of children born to mothers with thyroid dysfunction or antibodies: a prospective population-based cohort study. J Clin Endocrinol Metab 2009; 94(3): 772–779. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2008–1520>.
16. Männistö T, Vääräsmäki M, Pouta A et al. Thyroid dysfunction and autoantibodies during pregnancy as predictive factors of pregnancy complications and maternal morbidity in later life. J Clin Endocrinol Metab 2010; 95(3): 1084–1094. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2009–1904>.
17. Casey B, de Veciana M. Thyroid screening in pregnancy. J Obstet Gynecol 2014; 211(4): 351–353.e1. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ajog.2014.08.013>.
18. Lazarus JH, Bestwick JP, Channon S et al. Antenatal Thyroid Screening and Childhood Cognitive Function. N Engl J Med 2012; 366(6): 493–501. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1106104>.
19. Van den Boogaard E, Vissenberg R, Land JA et al. Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Hum Reprod Update 2011; 17(5): 605–619. Dostupné z DOI: <http://dx.doi.org/10.1093/humupd/dmr024>.
20. Reid SM, Middleton P, Cossich MC et al. Interventions for clinical and subclinical hypothyroidism pre-pregnancy and during pregnancy. Cochrane Database Syst Rev 2013; 31(5): CD007752. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD007752.pub3>.
21. Spyridoula M, Naykky M, Ospina S. Subclinical Hypothyroidism in Pregnancy: A Systematic Review and Meta-Analysis. Thyroid 2016; 26(4): 580–590. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2015.0418>.
22. Stagnaro-Green A, Abalovich M, Alexander E et al. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011; 21(10): 1081–125. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2011.0087>.
23. Vaidya B, Anthony S, Bilous M et al. Detection of thyroid dysfunction in early pregnancy: Universal screening or targeted high-risk case finding? J Clin Endocrinol Metab 2007; 92(1): 203–207.
24. Vila L, Velasco I, González S et al Controvesies in endocrinology: On the need for universal thyroid screening in pregnant women. Eur J Endocrinol January 2014; 170(1): R17-R30. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-13–0561>.
25. Límanová Z, Springer D. Současné zkušenosti s vyšetrováním tyreopatií v graviditě – výsledky pilotního projektu. Čas Lék Čes 2011; 150(7): 389–393.
26. Horacek J, Spitalnikova S, Dlabalova B et al. Universal screening detects two-times more thyroid disorders in early pregnancy than targeted high-risk case finding. Eur J Endocrinol 2010; 163(4): 645–650. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-10–0516>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 9-
All articles in this issue
- Onemocnění štítné žlázy v České republice: projekt EUthyroid a vyhodnocení epidemiologických dat VZP za období let 2012–2015
- Skríning tyreopatií v gravidite – odborné usmernenie v praxi
- Chlopenní vady při léčbě hyperprolaktinemie dopaminovými agonisty
- Hypotyreóza u pacientů se srdečním onemocněním
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Diagnostika a manažment metastatického feochromocytómu a paragangliómu
- Kvalita kosti u akromegalikov
- Syndróm neprimeranej antidiurézy (SIAD) a súčasný manažment hyponatriémie
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Primární hyperparatyreóza – nové klinické formy onemocnění
- Efekt antidiabetickej liečby na kosť
- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Primární hyperparatyreóza – nové klinické formy onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

