-
Medical journals
- Career
Onemocnění štítné žlázy v České republice: projekt EUthyroid a vyhodnocení epidemiologických dat VZP za období let 2012–2015
Authors: Radovan Bílek 1; Lenka Horáková 2; Robert Goš 2; Václav Zamrazil 1,3
Authors‘ workplace: Endokrinologický ústav, Praha 1; Ústředí Všeobecné zdravotní pojišťovny, Praha 2; Subkatedra endokrinologie IPVZ, Praha 3
Published in: Vnitř Lék 2017; 63(9): 548-554
Category: Original Contributions
Overview
Endokrinologický ústav Praha se podílí na grantu Evropské komise EUthyroid (Eliminace nedostatku jodu a prevence poruch štítné žlázy v Evropě) společně s dalšími 28 evropskými zeměmi. Úlohou Endokrinologického ústavu je v rámci projektu EUthyroid kromě jiného zajistit přístup k národním registrům tyreoidálních onemocnění. Výsledky, které zde prezentujeme, jsou založeny na údajích Všeobecné zdravotní pojišťovny České republiky (VZP ČR) z let 2012–2015, přičemž v každém roce bylo u VZP registrováno přibližně 6 milionů pojištěnců (poměr muži : ženy = 1 : 1). Tento soubor je dostatečně reprezentativní na to, aby mohl být vztažen na celou Českou republiku. Podle dat VZP se v České republice neustále zvyšuje prevalence tyreopatií, např. podle kódu diagnóz E00–E07 a unikátního rodného čísla vzrostla prevalence tyreopatii z 6,8 % v roce 2012 na 7,5 % v roce 2015. Podle výskytu se jedná především o klinicky se manifestující hypotyreózu (kód E03, zvýšení z 2,8 % v roce 2012 na 3,2 % v roce 2015), v pořadí druhá podle prevalence je netoxická struma (kód E04), která měla v daném období konstantní výskyt 2,5 %, naproti tomu u tyreoiditidy (kód E06) došlo ke zvýšení z 1,8 % v roce 2012 na 2 % v roce 2015. K poklesu prevalence došlo pouze u hypertyreózy (kód E05) z 0,7 % v roce 2012 na 0,6 % v roce 2015. Ostatní tyreopatie měly prevalenci nižší než 1 % a v průběhu let 2012–2015 byly konstantní (jiné poruchy štítné žlázy E07 0,8 %, poruchy štítné žlázy spojené s jodovou karencí E01 0,2 %, E02 0,07 %, E00 0,01 %, karcinom štítné žlázy C73 0,13 %).
Klíčová slova:
EUthyroid – nemoci štítné žlázy v České republice – Všeobecná zdravotní pojišťovna – výskyt tyreopatiíÚvod
V práci je popsán vývoj tyreopatií podle dat České republiky Všeobecné zdravotní pojišťovny (VZP ČR) za období let 2012–2015. Data byla předána Lékařské fakultě univerzity v Greifswaldu v Německu (University Medicine Greifswald, Germany), což je instituce koordinující projekt Evropské komise EUthyroid (Odstranění nedostatku jodu a prevence chorob spojených se štítnou žlázou v Evropě), jehož se Endokrinologický ústav Praha účastní spolu s dalšími 28 evropskými zeměmi, Kanadou a Izraelem. Celkovým cílem projektu EUthyroid je vyhodnotit programy prevence a monitorování jodového deficitu a integrovat znalosti a data z velkého množství národních databází. Aktivity v oblasti monitorování a prevence IDD (iodine deficiency disorders/poruchy způsobené nedostatkem jodu) včetně analýzy efektivity nákladů jsou zaměřeny na organizace odpovědné za existující programy prevence IDD na národní a regionální úrovni. Vývoj tyreopatií v letech 2012–2015 podle dat VZP jsou údaje, které mohou sloužit nejen v České republice při odstraňování příčin vedoucích k onemocnění štítné žlázy, ale jsou velmi cenné i v rámci celoevropské snahy týkající se prevence chorob spojených se štítnou žlázou.
Primární příčinou poruch štítné žlázy je nedostatečné zásobení organizmu jodem a nemoci štítné žlázy jsou hlavní příčinou morbidity v Evropě, zejména u žen. Nedostatek jodu během těhotenství může zvýšit riziko poškození jak v prenatálním životě, tak i u novorozenců a dětí. IDD ovlivňují celý životní cyklus a ženy a děti jsou zvláště zranitelné [1,2]. Česká republika patří mezi regiony s nedostatkem jodu. V některých částech země se až do začátku 20. století vyskytoval endemický kretenizmus. Z našich výsledků [3,4] je ale zřejmé, že podle kritérií Světové zdravotnické organizace (WHO), dětského fondu OSN (UNICEF) a Mezinárodní rady pro kontrolu nemocí způsobených nedostatkem jodu (ICCIDD) [1,5] v České republice není vzhledem k fungování programu jodové profylaxe [6,7] jodový deficit závažným zdravotním problémem od roku 2000. Nicméně problémy se štítnou žlázou a dalšími endokrinopatiemi přetrvávají nejen v České republice, ale i ve všech průmyslově rozvinutých zemích a v zemích, v nichž je pozorováno znečištění životního prostředí. Podle WHO se předpokládá, že přibližně 31 % (1901 milionů) světové populace má nedostatečný příjem jodu, přičemž nejvíce postiženými regiony jsou jihovýchodní Asie a Evropa [1]. Až 350 milionů evropských občanů má poruchy dané jodovým deficitem [8]. V celosvětovém měřítku je Evropa jedním z nejhorších regionů, pokud se jedná o přístup k jodované soli, a značná část Evropanů trpí kvůli výrazné heterogenitě programů sloužících k prevenci a monitorování stavu zásobení jodem v populaci. Podle WHO je účinný evropský monitorovací program zásadním krokem směřujícím k eradikaci IDD s významnými přínosy jak pro evropské občany, tak i pro udržitelnost systémů zdravotní péče [9]. Zatím je k dispozici pouze velmi málo údajů o dopadu deficitu jodu na zdravotní stav obyvatelstva a není vyčíslena ani nákladová efektivita dosavadních národních programů, které řeší problémy s IDD. Odstranění jodového deficitu je přitom významným krokem ke zlepšení veřejného a individuálního zdraví nejen při poruchách štítné žlázy, ale také při poruchách gastrointestinálního traktu, při kardiovaskulárních poruchách a při kognitivních dysfunkcích. Hlavním společenským problémem s nedostatkem jodu je jeho negativní dopad vedoucí k intelektuálnímu deficitu v postižené oblasti. Existují empirické důkazy, že průměrný národní inteligenční kvocient (IQ) a rozdíl mezi bohatými a chudými zeměmi korelují, a tento vztah je podle autorů citované publikace kauzální [10]. Proto je důležitým společenským zájmem poskytnout dostatek jodu nové generaci, a navíc pokud existují nerovnosti v zásobování jodem, zajistit šance na společenský pokrok pro osoby, které jsou ekonomicky znevýhodněny.
Populace VZP ČR a pacienti s onemocněním štítné žlázy
VZP ČR má přibližně 6 000 000 pojištěnců s rovnoměrným zastoupením obou pohlaví. Přesný počet jedinců za období let 2012–2015 dělených podle pohlaví je zaznamenán v tab. 1 spolu s celkovým procentuálním zastoupením tyreopatií podle kódu diagnóz E00–E07. Zprůměrovaná distribuce pojištěnců dělených do jednoletých podskupin podle stáří, pohlaví a unikátního rodného čísla je znázorněna na grafu 1, ze kterého vyplývá, že u mužů až do stáří 85 let a u žen do stáří 90 let každá jednoletá podskupina obsahuje minimálně 10 000 pojištěnců, a soubory je tak možné s dobrou aproximací vztáhnout na celou Českou republiku.
Table 1. Celková populace jedinců registrovaných u VZP ČR v období let 2012–2015 a procento pacientů postižených tyreopatiemi: diagnózy E00 – vrozený syndrom z jodové karence E01 – poruchy štítné žlázy a příbuzné stavy spojené s jodovou karencí E02 – subklinická hypotyreóza z jodové karence E03 – jiná hypotyreóza E04 – jiná netoxická struma E05 – tyreotoxikóza (hypertyreóza) E06 – zánět štítné žlázy – tyroiditida E07 – jiné poruchy štítné žlázy včetně poddiagnóz 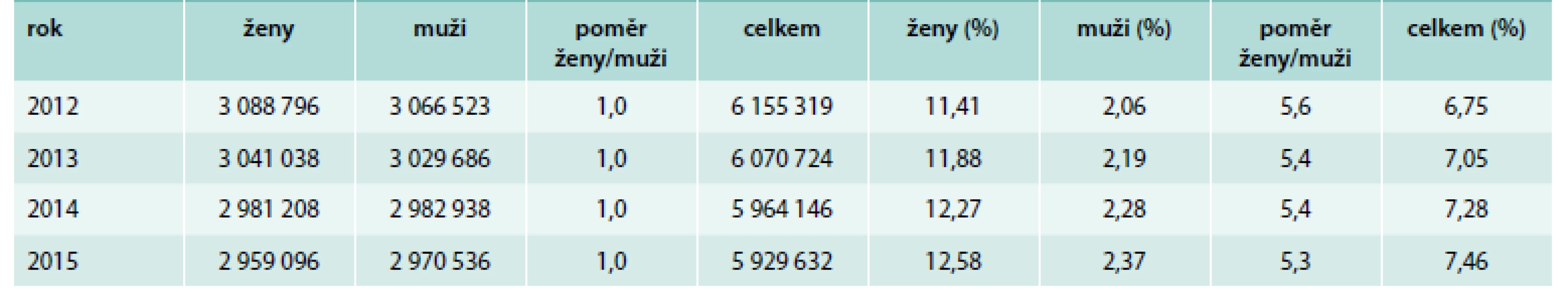
Graph 1. Průměrná roční populace pojištěnců za období 2012–2015 v závislosti na stáří a pohlaví 
(ženy světlou barvou, muži tmavou) Metody
Na grafu 2 a na grafu 3 je černě zakreslena zprůměrovaná křivka distribuce (průměr z hodnot 2012–2015) tyreopatií, která byla vyhlazena 10násobným postupným zprůměrováním 5 sousedních bodů. Tato křivka byla podrobena numerické derivaci, na jejichž základě byly nalezeny bod stáří, ve kterém došlo k nejvyššímu přírůstku daného onemocnění štítné žlázy, a stáří, ve kterém byla maximální prevalence daných tyreopatií. Nejvyšší přírůstek onemocněni a nejvyšší výskyt onemocnění v souvislosti se stářím a pohlavím je uveden u diagnóz E00–E07 a C73 v tab. 2.
Graph 2. Distribuce celkové tyreopatie podle kódu diagnóz E00–E07 včetně jejich poddiagnóz a unikátního rodného čísla za období let 2012–2015 
(nejsvětlejší je rok 2012, nejtmavší je rok 2015) v závislosti na stáří a pohlaví (ženy černošedě, muži zeleně), červenou barvou jsou zakresleny zprůměrované a vyhlazené distribuce tyreopatií s uvedením bodu nejvyššího přírůstku onemocněni a nejvyššího výskytu onemocnění v závislosti na stáří pacientů Graph 3. Distribuce některých četnějších tyreopatií s kódem diagnózy E03 (část A), E04 (část B), E06 (část C), E05 (část D) a s diagnózou C73 – karcinom štítné žlázy (část E) včetně jejich poddiagnóz a unikátního rodného čísla za období let 2012–2015 
(nejsvětlejší je rok 2012, nejtmavší je rok 2015) v zavislosti na stáří a pohlaví (ženy černošedě, muži zeleně), červenou barvou jsou zakresleny zprůměrované a vyhlazené distribuce tyreopatií s uvedením bodu nejvyššího přírůstku onemocněni a nejvyššího výskytu onemocnění v závislosti na stáří pacientů Table 2. Procento pacientů postižených tyreopatiemi podle diagnóz E00–E07 a C73 v celkové populaci jedinců registrovaných u VZP v období let 2012–2015 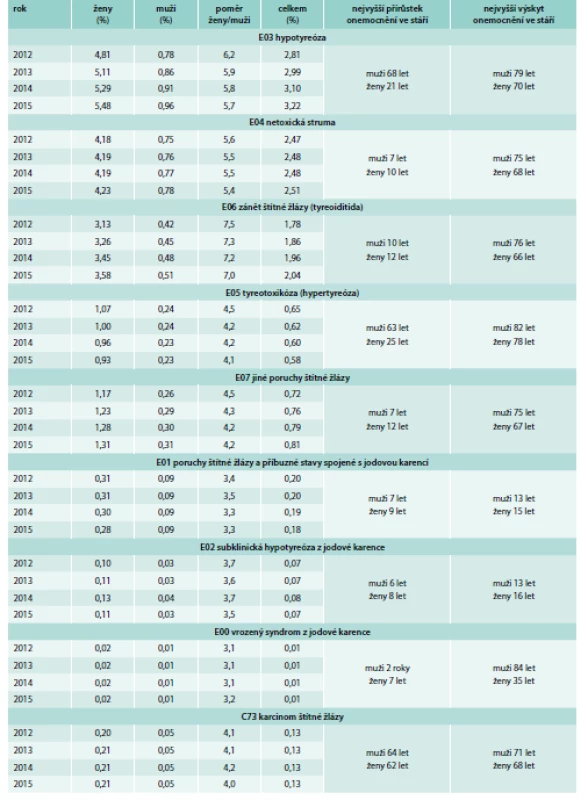
Výsledky
Na grafu 2 je znázorněna distribuce celkové tyreopatie podle kódu diagnóz E00–E07 včetně jejich poddiagnóz [E00 – vrozený syndrom z jodové karence E01 – poruchy štítné žlázy a příbuzné stavy spojené s jodovou karencí E02 – subklinická hypotyreóza z jodové karence E03 – jiná hypotyreóza E04 – jiná netoxická struma E05 – tyreotoxikóza (hypertyreóza) E06 – zánět štítné žlázy – tyreoiditida E07 – jiné poruchy štítné žlázy] a unikátního rodného čísla za období let 2012–2015 v závislosti na stáří a pohlaví. Z grafu 2 a tab. 1 je patrné, že došlo k neustálému zvyšování procenta tyreopatií v populaci, a to z 6,8 % v roce 2012 na 7,5 % v roce 2015. Např. v roce 2015 musela každá 5. žena ve stáří 70 let navštívit lékaře, protože měla problém se štítnou žlázou. U žen byly v průměru tyreopatie 5,4krát častější než u mužů. Na grafu 3A–3E je znázorněna distribuce jednotlivých tyreopatií podle kódu diagnózy E03, E04, E05, E06, C73 (karcinom štítné žlázy) a unikátního rodného čísla za období let 2012–2015 v zavislosti na stáří a pohlaví. Jednotlivé zastoupení tyreopatií v procentech z celkového počtu pojištěnců na základě kódu diagnózy včetně jejích poddiagnóz a unikátního rodného čísla je uvedeno v tab. 2. Z grafu 3 a z tab. 2 je zjevné, že se v období let 2012–2015 neustále zvyšoval počet tyreopatií u diagnóz E03, E04, E06, E07, u diagnóz E01, E02, E00 a C73 byly hodnoty konstantní a pouze u hypertyreózy (E05) došlo k poklesu onemocnění z hodnoty 0,65 % v roce 2012 na 0,58 % v roce 2015. V tab. 2 je také uvedeno, kolikrát je četnější tyreopatie u žen v porovnání s muži. Nejvyšší poměr žena/muž byl nalezen u zánětu štítné žlázy (E06): v průměru bylo toto onemocnění 7,3krát častější u žen než u mužů. Poměrně závažné je zjištění, že nejvyšší nárůst onemocnění byl v prepubertálním až pubertálním věku dětí, jednalo se o diagnózy E04, E06, E07, E01, E02 a E00, a endokrinologové by měli na tuto skutečnost reagovat. Nejvyšší prevalence onemocnění štítné žlázy byla u mužů v průměru ve věku 77 let, u žen ve věku 70 let, výjimkou byly diagnózy E01, E02 a u žen i E00, u nichž byl nejvyšší výskyt onemocnění v mnohem nižším věku odpovídajícím u diagnóz E01 a E02 pubertě.
Diskuse
Zdraví člověka a volně žijících živočichů závisí na schopnosti reprodukce a normálního vývoje. To ale není možné bez zdravého endokrinního systému. Obezita, chemické látky poškozující endokrinní funkci, ekologické, geochemické a radiochemické podmínky společně s genetickými faktory představují významný rizikový faktor rozvoje civilizačních nemocí, jako je diabetes mellitus, metabolický syndrom (intolerance glukózy, rezistence na inzulin), kardiovaskulární poruchy, nemoci související se změnami v metabolizmu lipidů, rakovina, alergické a autoimunitní onemocnění nebo onemocnění týkající se reprodukční funkce v organizmu (steroidní metabolizmus). V posledních desetiletích došlo k nárůstu výskytu onemocnění štítné žlázy a zhruba 2 miliardy lidí na celém světě mají nějaký typ tyreopatií [11]. Jedná se především o nedostatečnou funkci štítné žlázy (hypotyreóza), která je přibližně 6krát častější u žen než u mužů. Nediagnostikované subklinické poruchy štítné žlázy dále zvyšují toto číslo [12].
Je řada příčin, které mohou způsobit nárůst počtu onemocnění spjatých se štítnou žlázou. Tyreopatie jsou ovlivněny genetickými a environmentálními faktory, které kromě pozitivní funkce jodu a selenu zahrnují také negativní vlivy různých endokrinních disruptorů a modulátorů. Geochemické a radiochemické podmínky typické pro daný region nepochybně přispívají k patofyziologii štítné žlázy. Rakovina štítné žlázy má nejvyšší nárůst výskytu ve srovnání s jinými solidními nádory. Její výskyt se více než zdvojnásobil ve srovnání s rokem 1973 [13].
Autoimunitní onemocnění štítné žlázy je nejčastější chorobou specifickou pro štítnou žlázu s celosvětovou prevalencí zhruba 5 % a je způsobeno abnormální interakcí mezi atypickými tyreocyty, abnormálními imunitními buňkami prezentujícími antigen a abnormálními T-lymfocyty [15].
Možný vliv perzistentních organických polutantů je v odborné literatuře diskutován v souvislosti s výskytem těchto nemocí [16]. Např. přítomnost polychlorovaných bifenylů v kontaminovaných oblastech na Slovensku vedla k vyšší prevalenci autoimunitních onemocnění štítné žlázy [17]. Téměř u 800 chemikálií existuje podezření, že jsou schopny interferovat s hormonálními receptory a mohou ovlivnit biosyntézou nebo konverzi hormonů [11]. Jedná se o látky, jako jsou pesticidy, retardéry hoření v různých výrobcích, plastové přísady, kosmetické přípravky, kontraceptiva, látky přidávané do potravin apod.
Další příčinou mohou být nepříznivé geochemické účinky a působení stochastického ozáření obyvatelstva. Kromě jodu je pro normální metabolizmus hormonů štítné žlázy zásadní několik minerálů a stopových prvků, jako je železo (Fe), selen (Se) a zinek (Zn). Nedostatek Fe ovlivňuje organifikaci jodu, a tím i biosyntézu hormonů štítné žlázy snížením aktivity tyreoidální peroxidázy závislé na hemu [18]. Selen je jako součást selenoenzymů dejodáz důležitý pro metabolizmus tyreoidálních hormonů stejně tak jako Zn, který je důležitý pro správnou funkci 1,5‘-dejodázy, enzymu potřebného pro konverzi tyroxinu na trijodtyronin [19]. Mnoho halogenovaných sloučenin soutěží s přirozenými hormony o vazbu na proteiny vázající a přenášející tyreoidální hormony v cirkulaci, jako je TBG (thyroid binding globulin), transtyretin a albumin, i když klinické důsledky nejsou jasné. Chlornan, chlorečnan, bromičnan a disulfidy snižují aktivní transport jodu do štítné žlázy v důsledku kompetitivní inhibice nebo zablokování natrium jodidového symportéru [20]. Zvláště chloristan, který dlouhodobě přetrvává v geologických systémech a v podzemních vodách, může ovlivnit funkci štítné žlázy [21]. Znečištěné životní prostředí a deficit jodu jsou faktory, které mohou být příčinou vzrůstu onemocnění štítné žlázy, i když tento problém je asi komplexnější a bude třeba mu v budoucnosti věnovat náležitou pozornost.
Závěr
Předkládané výsledky z reprezentativního výzkumu onemocnění štítné žlázy v české populaci nejsou příznivé. Ukazují na nárůst celkového počtu tyreopatií u žen i u mužů. Je při tom evidentní, že tyreopatie výrazně ovlivňují zdravotní stav postiženého. Je proto nutné věnovat zvýšenou pozornost výskytu tyreopatií a možnosti jejich prevence, diagnostiky a léčby. V komplexu opatření hraje nesporně významnou úlohu optimální saturace jodem.
Podpořeno MZ ČR-RVO (EÚ, 00023761).
doc. Ing. Radovan Bílek, CSc.
rbilek@endo.cz
Endokrinologický ústav,
Praha
www.endo.cz
Doručeno do redakce 1. 8. 2017
Přijato po recenzi 4. 9. 2017
Sources
1. [WHO, UNICEF, ICCIDD]. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 3rd ed. WHO: Geneva 2007. ISBN 978 92 4 159582 7. Dostupné z WWW: <http://apps.who.int/iris/bitstream/10665/43781/1/9789241595827_eng.pdf>.
2. Bílek R, Kaňová N, Mindžáková V et al. Zásobení jódem u těhotných žen v České republice. Vnitř Lék 2016; 62(Suppl 3): 3S10–3S16.
3. Zamrazil V, Bílek R, Čerovská J et al. The elimination of iodine deficiency in the Czech Republic: the steps toward success. Thyroid 2004; 14(1): 49–56.
4. Bílek R, Bednář J, Zamrazil V. Spectrophotometric determination of urinary iodine by the Sandell-Kolthoff reaction subsequent to dry alkaline ashing. Results from the Czech Republic in the period 1994–2002. Clin Chem Lab Med 2005; 43(6): 573–580.
5. WHO, UNICEF. Iodine status worlwide. In: de Benoist B, Andersson M, Egli I (eds) et al. WHO Global Database on Iodine Deficiency. WHO Department of Nutrition for Health and Development: Geneva 2004. ISBN 92 4 159200 1. Dostupné z WWW: <http://apps.who.int/iris/bitstream/10665/43010/1/9241592001.pdf>
6. Ryšavá L, Kříž J. Řešení jodového deficitu v České republice – historie a současný stav. Vnitř Lék 2016; 62(Suppl 3): 3S103–3S106.
7. Ryšavá L, Kříž J, Kašparová L et al. Zásobení jodem a jodurie obyvatel v České republice v letech 1995–2016. Vnitř Lék 2016; 62(Suppl 3): 3S28–3S32.
8. Lazarus JH. Iodine status in Europe in 2014. Eur Thyroid J 2014; 3(1): 3–6. Dostupné z DOI: <http://dx.doi.org/10.1159/000358873>.
9. WHO. Iodine deficiency in Europe. A continuing public health problem. Andersson M, de Benoist B, Darnton-Hill I (eds) et al. WHO Press: Geneva 2007. ISBN 9789241593960. Dostupné z WWW: <http://www.who.int/iris/handle/10665/43398>.
10. Lynn R, Vanhanen T IQ and the wealth of nations. Praeger 2002. ISBN 978–0275975104.
11. Bergman A, Heindel JJ, Jobling S (eds) et al. [United Nations Environment Programme (UNEPP) and the World Health Organization (WHO)]. State of the science of endocrine disrupting chemicals 2012. WHO Press: Geneva 2013. ISBN 978 92 4 150503 1.
12. McGrogan A, Seaman HE, Wright JW et al. The incidence of autoimmune thyroid disease: a systematic review of the literature. Clin Endocrinol (Oxf) 2008; 69(5): 687–696. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.2008.03338.x>.
13. Cramer JD, Fu P, Harth KC et al. Analysis of the rising incidence of thyroid cancer using the Surveillance, Epidemiology and End Results national cancer data registry. Surgery 2010; 148(6): 1147–1152. Dostupné z DOI: <http://dx.doi.org/10.1016/j.surg.2010.10.016>.
14. Giusti F, Falchetti A, Franceschelli F et al. Thyroid cancer: current molecular perspectives. J Oncol 2010; 2010 : 351679. Dostupné z DOI: <http://dx.doi.org/10.1155/2010/351679>.
15. Klecha AJ, Barreiro AML, Frick L et al. Immune-endocrine interactions in autoimmune thyroid diseases. Neuroimmunomodulation 2008; 15(1): 68–75. Dostupné z DOI: <http://dx.doi.org/10.1159/000135626>.
16. Guarneri F, Benvenga S. Environmental factors and genetic background that interact to cause autoimmune thyroid disease. Curr Opin Endocrinol Diabetes Obes 2007; 14(5): 398–409.
17. Langer P, Kocan A Tajtáková M et al. Increased thyroid volume, prevalence of thyroid antibodies and impaired fasting glucose in young adults from organochlorine cocktail polluted area: outcome of transgenerational transmission? Chemosphere 2008; 73(7): 1145–1150. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chemosphere.2008.06.067>.
18. Zimmermann MB. The Influence of Iron Status on Iodine Utilization and Thyroid Function. Annu Rev Nutr 2006; 26 : 367–389.
19. Kralik A, Eder K, Kirchgessner M. Influence of zinc and selenium deficiency on parameters relating to thyroid hormone metabolism. Horm Metab Res 1996; 28(5): 223–226.
20. Crofton KM. Thyroid disrupting chemicals: mechanisms and mixtures. J Androl 2008; 31(2): 209–223. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2605.2007.00857.x>.
21. Urbansky ET. Perchlorate as an environmental contaminant. Environ Sci Pollut Res Int 2002; 9(3): 187–192.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 9-
All articles in this issue
- Onemocnění štítné žlázy v České republice: projekt EUthyroid a vyhodnocení epidemiologických dat VZP za období let 2012–2015
- Skríning tyreopatií v gravidite – odborné usmernenie v praxi
- Chlopenní vady při léčbě hyperprolaktinemie dopaminovými agonisty
- Hypotyreóza u pacientů se srdečním onemocněním
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Diagnostika a manažment metastatického feochromocytómu a paragangliómu
- Kvalita kosti u akromegalikov
- Syndróm neprimeranej antidiurézy (SIAD) a súčasný manažment hyponatriémie
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Primární hyperparatyreóza – nové klinické formy onemocnění
- Efekt antidiabetickej liečby na kosť
- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Primární hyperparatyreóza – nové klinické formy onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

