-
Medical journals
- Career
Syndróm neprimeranej antidiurézy (SIAD) a súčasný manažment hyponatriémie
Authors: Ivica Lazúrová
Authors‘ workplace: I. interná klinika LF UPJŠ a UNLP, Košice, Slovenská republika
Published in: Vnitř Lék 2017; 63(9): 593-597
Category: Reviews
Overview
Hyponatriémia definovaná hladinou sérového nátria < 135 mmol/l sa považuje za najčastejšiu elektrolytovú poruchu ako u ambulantných, tak aj u hospitalizovaných pacientov. Je spojená s významne vyššou morbiditou, mortalitou a dlhšou dobou hospitalizácie a prejavuje sa širokou škálou príznakov, od miernych až po život ohrozujúce stavy. Najčastejšou formou hypotonickej hyponatriémie je syndróm neprimeranej antidiurézy (SIAD). Článok sa venuje jeho etiológii, diagnostike, diferenciálnej diagnostike a liečbe v zmysle nových európskych odporúčaní.
Kľúčové slová:
diagnostika – hyponatriémia – liečba – syndróm neprimeranej antidiurézy – vazopresínÚvod
Hyponatriémia definovaná hladinou sérového sodíka < 135 mmol/l je najčastejšou elektrolytovou poruchou ako u ambulantných, tak aj u hospitalizovaných pacientov a vyskytuje sa u 15–30 % akútne prijatých pacientov do nemocnice [1]. Je spojená so zvýšenou morbiditou, mortalitou a s dlhšou dobou hospitalizácie [2–4]. Hyponatriémia je primárne poruchou vodnej homeostázy s relatívnym excesom vody v porovnaní s celkovým obsahom nátria a kália. Donedávna sa jej pripisoval menší význam než hypokaliémii, bola často nerozpoznaná a nebola adekvátne liečená, resp. nebola liečená vôbec. Vzhľadom na jej vysokú prevalenciu a nejednotnosť v diagnostickom a terapeutickom prístupe k pacientom bolo nevyhnutné vytvoriť odporúčania pre diagnostiku a liečbu hyponatriémie. Uvedený článok podáva prehľad najnovších poznatkov o diagnostike, diferenciálnej diagnostike a manažmente pacientov v zmysle súčasných európskych guidelines.
Epidemiológia hyponatriémie
V randomizovanej skupine zdravých osôb vo veku nad 70 rokov sa vyskytovala hyponatriémia v 4 %, zatiaľ čo v dánskej štúdii bola prevalencia ešte vyššia (11 %), ak sa použila hranica pre hyponatriémiu 137 mmol/l [5]. U hospitalizovaných chorých je výskyt hyponatriémie ešte vyšší. Mierna hyponatriémia sa detekuje u 20–30 % hospitalizovaných pacientov, prevalencia strednej a závažnej hyponatriémie, tj. SNa < 129 mmol/l, sa udáva u asi 7 % hospitalizovaných [6]. Prevalencia závisí aj od typu oddelenia, z ktorého údaje sa získali. Štúdia u 7 965 chorých s pneumóniou dokumentovala 8% výskyt hyponatriémie, ktorá sa vyvinula počas hospitalizácie. Hannon a Thompson uvádzajú, že až 56 % pacientov so subarachnoidálnym krvácaním malo počas hospitalizácie dokumentovanú hyponatriémiu a u 20 % z nich bol pokles sodíka v sére pod 125 mmol/l [5]. Na I. internej klinike UNLP v Košiciach sme v neselektovanom súbore hospitalizovaných pacientov našli stredne závažnú a závažnú hyponatriémiu s hodnotou SNa < 130 mmol/l u 6,6 %, čo je v súlade s publikovanými údajmi [7].
Viacero štúdií sa v posledných rokoch zaoberalo aj mortalitou pacientov s hyponatriémiou. Mnohí autori dokumentovali signifikantne vyššiu mortalitu u hyponatriemických chorých v porovnaní s normonatriemickými. Riziko mortality pritom stúpalo s poklesom sérového nátria a u pacientov s hladinou SNa < 115 mmol/l bola mortalita až 50 % [3,4]. Ďalšie štúdie sa zaoberali nemocničnou mortalitou a dokumentovali, že asi 20 % chorých s SNa < 125 mmol/l zomrelo počas hospitalizácie v nemocnici a 45 % týchto pacientov zomrelo do 6 mesiacov od prepustenia [8].
Iní autori sa zaoberali aj mortalitou hyponatriemických chorých v závislosti na liečbe hyponatriémie. Väčšina z týchto štúdií potvrdila, že neliečení chorí mali signifikantne vyššiu mortalitu v porovnaní s pacientmi, u ktorých bola hyponatriémia korigovaná [9]. Najčastejšou príčinou hyponatriémie vo väčšine štúdií bol syndróm neprimeranej sekrécie vazopresínu (syndrome of inappropriate antidiuretic hormone secretion – SIADH). V štúdiách u kriticky chorých pacientov prijímaných na jednotku intenzívnej starostlivosti bol SIADH zistený u 36,25 %, pričom vedúcou príčinou bola pneumónia. Hyponatriemickí pacienti vykazovali vyššiu mortalitu, dlhšiu dobu hospitalizácie a dlhšiu umelú ventiláciu [4].
Typy hyponatriémie
Pseudohyponatriémia
Pseudohyponatriémia je laboratórnym artefaktom a vyskytuje sa pri výrazne vyšších hladinách lipidov a bielkovín v krvi. Vyskytuje sa zriedkavo a závisí od metodiky stanovovania SNa.
Nehypotonická hyponatriémia
U väčšiny pacientov s hyponatriémiou je sérum hypotonické, tj. osmolalita séra je nízka. Za určitých podmienok však sérum obsahuje iné osmoticky aktívne látky, ktoré vedú k vyššej osmolalite, a tým, že ťahajú vodu do intravaskulárneho priestoru, vedú k poklesu SNa. Príkladom je hyperglykémia, podanie manitolu alebo glycínu, čo vedie k hyponatriémii, ale pri normálnej (izotonická hyponatriémia), alebo zvýšenej osmolalite séra (hypertonická hyponatriémia) [1].
Hypotonická hyponatriémia
- so zníženým extracelulárnym objemom krvi (ECV) – táto hyponatriémia je spôsobená renálnymi alebo nerenálnymi stratami sodíka (vomitus, diarea, nadmerné potenie a pod), renálne straty sodíka sú najčastejšie spôsobené diuretikami, chorobou obličiek (salt-losing nephropathy), resp. adrenokortikálnou insuficienciou Cerebral Salt Wasting (CSW) je syndróm spojený s excesívnymi renálnymi stratami sodíka u pacientov s intrakraniálnymi léziami, napr. subarachnoidálnym krvácaním a pod. Títo pacienti majú vysoké hladiny BNP v sére, čím sa vysvetľuje patogenéza syndrómu [10]. CSW je veľmi zriedkavý a obvykle sa za ním skrýva iná príčina hyponatriémie a soľných strát, napr. adrenokortikálna insuficiencia [11].
- so zvýšeným ECV – vyskytuje sa pri zlyhaní obličiek, srdca, cirhóze pečene a nefrotickom syndróme, približne 20–30 % pacientov so zlyhaním srdca NYHA triedy III a IV má hyponatriémiu [12], v tomto prípade je hyponatriémia ukazovateľom závažnosti srdcového zlyhania a zlej prognózy, či je príčinou závažnosti alebo len markerom, nie je celkom jasné
- s normálnym ECV (euvolemická hyponatriémia), najčastejšou nozologickou jednotkou je syndróm neprimeranej antidiurézy (SIAD)
Syndróm neprimeranej antidiurézy (SIAD)
V roku 1957 Schwartz et al publikovali prvý dôkaz SIADH u pacienta s bronchogénnym karcinómom a následne bol tento syndróm popísaný u viacerých chorôb, hlavne mozgových a pľúcnych. Syndróm neprimeranej sekrécie vazopresínu (syndrome of inappropriate antidiuretic hormone secretion – SIADH) je najčastejšou príčinou euvolemickej hyponatriémie [1]. Vzhľadom na to, že pribudli nové poznatky v etiológii a patogenéze syndrómu, súčasné guidelines odporúčajú používať termín syndróm neprimeranej antidiurézy (syndrome of inappropriate antidiuresis – SIAD). SIAD je charakterizovaný vzhľadom na osmotický a objemový stav organizmu zvýšenou sekréciou vazopresínu. Tá pretrváva aj napriek výraznému zníženiu osmolality séra a pri pokračujúcom príjme hypotonických tekutín má za následok nadmernú retenciu vody, čo sa prejaví klinicky dilučnou hyponatriémiou a zvýšenou nátriurézou (UNaV > 30 mmol/l) u klinicky euvolemických pacientov. V tab. 1 sú uvedené hlavné znaky a diagnostické kritériá SIADH/SIAD. Aj napriek tomu, že u chorého so SIAD klinicky nezistíme expanziu objemu ECV, retencia vody vedie k zvýšeniu sekrécie atriálneho nátriuretického peptidu (ANP), čo sa prejaví nadmernou exkréciou sodíka (sodium escape) a osmolalitou moču > 100 mOsm/kg [5]. V prípade euvolemickej hyponatriémie je dôležité odlíšiť deficit ACTH (sekundárny hypokorticizmus), ktorý sa manifestuje iba deficitom glukokortikoidov, ale nie deficitom aldosterónu. Keďže kortizol je potrebný pre exkréciu voľnej vody, deficit glukokortikoidov je teda spojený s retenciou voľnej vody a vývojom hyponatriémie s obrazom podobným SIAD. Pacienti s deficitom ACTH, resp. kortizolu, majú zvýšené hladiny vazopresínu v plazme v dôsledku aktivácie CRH, s následnou retenciou voľnej vody. Liečba glukokortikoidmi vedie k supresii AVP sekrécie s exkréciou voľnej vody a k úprave sérového sodíka [13]. K hyponatriémii vedie zriedkavo aj primárna hypotyreóza, preto je potrebné u každého pacienta s euvolemickou hyponatriémiou stanoviť hladinu TSH.
Table 1. Hlavné diagnostické kritériá SIAD [5] ![Hlavné diagnostické kritériá SIAD [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c93fb87ce33e59d059f03f61317e6b0b.png)
Príčiny SIAD
Najčastejšie príčiny SIAD sú uvedené v tab. 2 [1].
Table 2. Najčastejšie príčiny SIAD. 
Doplnené podľa [1] Diagnostika SIAD
Je dôležité si uvedomiť, že diagnostika a diferenciálna diagnostika SIAD je veľmi ťažká a žiadna klasifikácia hyponatriémie nie je schopná zahrnúť všetky možnosti, stavy a typy, s ktorými sa môžeme stretnúť v klinickej praxi. Odhad objemu ECV na základe klinického vyšetrenia je veľmi nepresný a má veľmi nízku senzitivitu a špecificitu [1]. Naviac diagnóza SIAD je aj napriek splneniu diagnostických kritérií diagnózou per exclusionem, tj. je potrebné vylúčiť všetky ostatné možné príčiny euvolemickej hyponatriémie. Základným kritériom je zníženie sérovej osmolality < 275–280 mOsm/kg, resp. zníženie koncentrácie sodíka v sére < 135 mmol/l. V dôsledku zvýšenej exkrécie sodíka obličkami (koncentrácia Na v moči stúpa na > 30 mmol/l) stúpa osmolalita moču > 100 mOsm/kg. Stanovenie hladiny vazopresínu (AVP, ADH) nepatrí medzi diagnostické kritériá SIAD, a teda nie je nevyhnutné pre jeho diagnózu, za určitých okolností ale môže byť koncentrácia vazopresínu v krvi nápomocná. Pri stanovení AVP v plazme však narážame na viaceré preanalytické a analytické problémy (nestabilita, nízka koncentrácia, krátky biologický polčas, väzba na trombocyty). Potenciálnu alternatívu poskytuje meranie koncentrácie kopeptínu, ktorý je na rozdiel od AVP stabilný. Jeho zvýšenú koncentráciu pozorujeme pri deplécii sodíka, SIAD a objemovej expanzii [15,16].
Klinický obraz a dôsledky SIAD
Pokiaľ je u pacienta zachovaná regulácia príjmu tekutín aktiváciou a inhibíciou pocitu smädu, nemusí viesť hypervazopresinizmus ku žiadnym klinickým abnormalitám. Za normálnych okolností pri poklese osmolality dochádza k prirodzenému útlmu pocitu smädu. V prípade pacientov, ktorých vek alebo zdravotný stav neumožňuje prirodzenú reguláciu príjmu tekutín pocitom smädu (dojčatá, pacienti vo vysokom veku, závažné stavy s poruchami vedomia, resp. pacienti v bezvedomí) môže dôjsť ku klinickej manifestácii SIAD. Hlavným klinickým dôsledkom hyponatriémie pri SIAD je edém mozgu, ktorý sa prejaví rôznou neurologickou symptomatológiou podľa jeho závažnosti. Pri miernom stupni hyponatriémie obvykle nepozorujeme žiadne symptómy. Pri hodnotách v rozmedzí 125–130 mmol/l máva pacient anorexiu, nauzeu, vomitus a bolesti brucha. Pri výraznejšom znížení SNa na 115–125 mmol/l sa môže vyskytnúť agitovanosť, konfúzie, halucinácie a ďalšie príznaky neurologického charakteru. Hladina SNa < 115 mmol/l predstavuje emergentnú situáciu, pri ktorej dochádza ku kŕčom a rozvoju kómy [17].
Výskyt klinických príznakov obvykle závisí aj od rýchlosti poklesu hyponatriémie. Akútna hyponatriémia sa zaraďuje medzi urgentné stavy s vysokou morbiditou a mortalitou. Jej najčastejšie príčiny sú uvedené v tab. 3. V prípade dlhšie trvajúcej hyponatriémie (> 48 hod), mozgové bunky produkciou osmoticky aktívnych, tzv. idiogénnych molekúl edém mozgu zredukujú. Z tohto dôvodu pacienti chronickú hyponatriémiu dobre tolerujú a príznaky sa u nich začnú objavovať až pri poklese koncentrácie SNa < 115 mmol/l. Dochádza teda k adaptácii mozgu na zníženú osmolalitu. Ani chronická hyponatriémia však nie je bez rizika. Práce z posledných rokov dokumentovali, že postmenopauzálne pacientky s hyponatriémiou majú 4-krát častejšie riziko pádov, a teda aj fraktúr, pretože sa u nich pozorujú abnormality chôdze a držania tela. Taktiež sa uvádzajú aj poruchy kognitívnych funkcií a všeobecne vyššia mortalita oproti normonatriemickej populácii [18].
Table 3. Najčastejšie príčiny akútnej hyponatriémie. 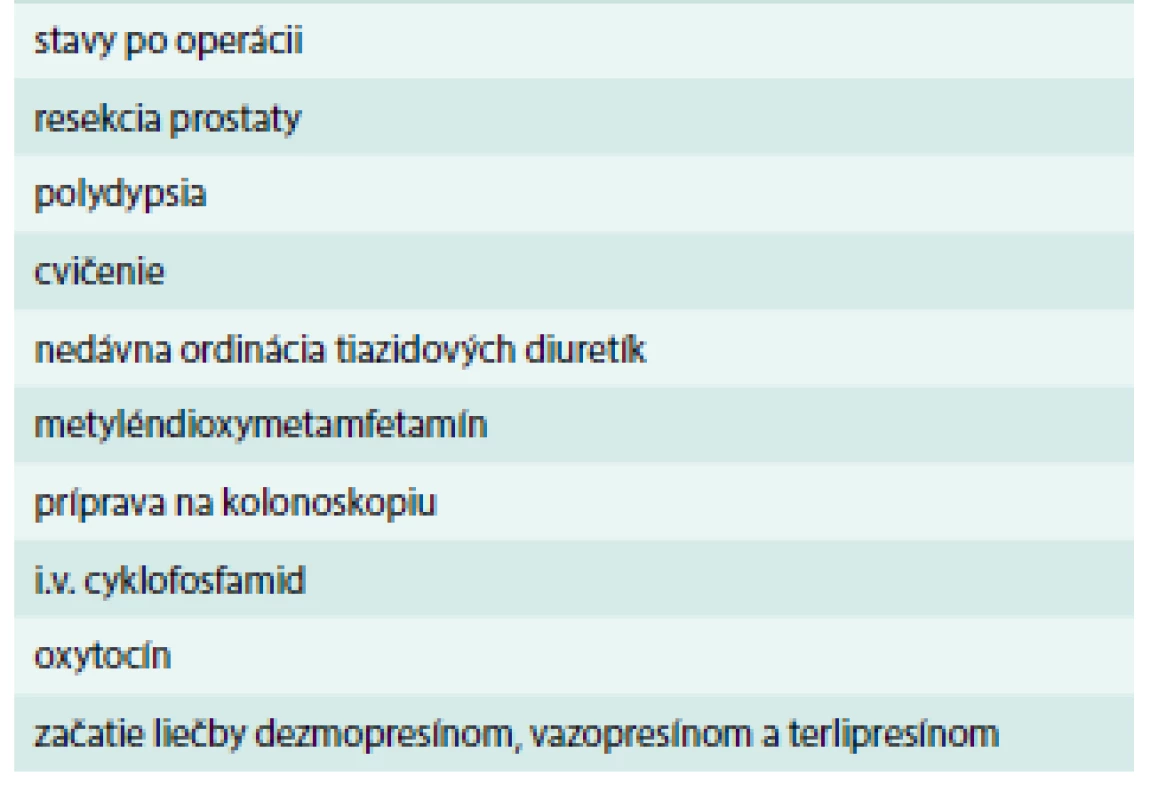
Upravené podľa [1] Diferenciálna diagnostika SIAD
Tiazidmi indukovaná hyponatriémia
V diferenciálnej diagnostike SIAD je potrebné vylúčiť hyponatriémiu navodenú tiazidovými diuretikami (thiazide associated hyponatremia – TAH). Jej incidencia je pomerne vysoká a rastie s vekom. V štúdii Claytona et al z celkového počtu tiazidmi liečených pacientov malo hyponatriémiu 14 %, pričom vek nad 70 rokov bol asociovaný so 4-násobne vyšším rizikom hyponatriémie [19]. Rizikovými faktormi pre vývoj hyponatriémie po tiazidoch sú okrem vyššieho veku aj prítomnosť komorbidít, nižšie hladiny SNa pri zahájení liečby, hypokaliémia, nižšia hmotnosť, zvýšený príjem vody, ženské pohlavie, diabetes melllitus a súčasné užívanie liekov ovplyvňujúcich vodnú homeostázu ako aj kálium šetriacich diuretík a nesteroidových antireumatík [20].
Patofyziologickým podkladom tiazidmi indukovanej hyponatriémie je zníženie reabsorpcie NaCl v distálnom tubule obličiek a teda inhibícia dilúcie moču. Kľučkové diuretiká, tj. furosemid, neporušujú zrieďovaciu schopnosť a obvykle nie sú spojené so znížením natriémie.
Laboratórne charakteristiky TAH sú podobné ako pri SIAD, čo sa niekedy uvádza ako SIAD-like syndróm. Je prítomná hyponatriémia a hypoosmolarita séra, častejšie však v tomto prípade býva prítomná aj hypokaliémia [21]. V rámci diferenciálnej diagnostiky je potrebné vyšetriť aj ureu, kreatinín, kyselinu močovú a TSH. Nižšie hladiny kyseliny močovej a vyššia frakčná exkrécia urátov (> 12 %) favorizujú SIAD, avšak tieto abnormity sa môžu vyskytnúť aj pri TAH. Určitou pomôckou môže byť aj vyššia exkrécia kália v moči, ktorá je častá pri TAH, resp. pokles natriurézy < 20 mmol/l po vynechaní diuretík [1].
Hyponatriémia starších odpovedajúca na mineralokortikoidy
Hyponatriémia starších odpovedajúca na mineralokortikoidy (mineralocorticoid responsive hyponatremia of the elderly – MRHE) bola prvýkrát popísaná japonskými autormi Ishikawa et al v roku 1987. Ide o miernu hypovolemickú hyponatriémiu spôsobenú renálnymi stratami sodíka. Vekom podmienené zníženie reabsorpcie sodíka v proximálnom renálnom tubule a hyporeaktivita renín-angiotenzínového systému (RAS) vedú ku trvale vyššej exkrécii nátria. V dôsledku hypovolémie sa zvyšuje sekrécia AVP a vzniká hyponatriémia s obrazom SIAD. Na rozdiel od SIAD pacienti sú hypovolemickí, aj keď len mierne, a táto hypovolémia nemusí byť klinicky detekovateľná. Tento typ hyponatriémie dobre reaguje na pridanie malej dávky mineralokortikoidov (fludrokortizón) [22].
Liečba hyponatriémie pri SIAD
Liečba hyponatriémie závisí od viacerých faktorov, najmä je potrebné rozlíšiť, či ide o akútnu alebo chronickú hyponatriémiu. Na základe európskych odporúčaní, v prípade akútnej a závažnej hyponatriémie je potrebné ihneď začať liečbu infúziou hypertonického roztoku NaCl [1]. Odporúča sa podať 150 ml 3% NaCl v priebehu 20 min a ak sa hladina SNa nezvýši o 5 mmol/l, tak infúziu možno zopakovať. Ak sa klinický stav pacienta nezlepší, pokračuje sa v infúzii NaCl v dávke 2 ml/kg hmotnosti. Ak sa klinický stav pacienta zlepšuje, odporúča sa prerušiť infúziu hypertonického roztoku NaCl a buď sa natriémia udržiava infúziou fyziologického roztoku, alebo sa už pokračuje iba s kauzálnou liečbou, ak je známa príčina. Uvádza sa, že vzostup natriémie o 5 mmol/l by mal byť dostatočný na zmiernenie alebo ústup symptómov mozgového edému. Ak po vzostupe natriémie o 10 mmol/l sa klinický stav nelepší, treba uvažovať o inej príčine poruchy vedomia pacienta. Ak je akútna hyponatriémia bez klinických príznakov, odporúča sa kauzálna liečba, reštrikcia tekutín a prechodné podanie 3% NaCl [1,23].
Pri chronickej hyponatriémii s miernymi príznakmi je základnou liečbou odstránenie príčiny hyponatriémie (ak je to možné) a reštrikcia tekutín. Ak je hyponatriémia závažná, taktiež sa odporúča podať 150 ml 3% NaCl, avšak je potrebné sa vyhnúť vzostupu SNa o >10 mmol/l počas prvých 24 hod, a o > 8 mmol/l počas každých ďalších 24 hod, pretože hrozí vznik osmotického demyelinizačného syndrómu s vysokou mortalitou. Riziko myelinolýzy výrazne stúpa u alkoholikov, podvyživených jedincov a mladých štíhlych žien [24]. Podľa súčasných guidelines sa pri liečbe chronickej hyponatriémie neodporúča podávať dimetylchlórtetracyklín a ani lítium, pretože ich podávanie môže viesť k závažnej nefrotoxicite. Napriek tomu pri liečbe SIAD sa preferuje podávanie osmotických solútov, napr. perorálne podávanie urey. Je však limitované jej výrazne horkou chuťou. Podľa dostupných údajov dlhodobá liečba hyponatriémie ureou bola efektívna a chránila pred myelinolýzou. V súčasnosti stále chýbajú klinické štúdie s použitím urey a doposiaľ publikovaných niekoľko prác má značné metodologické limitácie [25].
V posledných 10 rokoch bolo publikovaných viacero štúdií s použitím antagonistov AVP receptorov – tzv. vaptánov. Označujú sa tiež ako akvaretiká, pretože zabraňujú reabsorpcii vody v renálnych tubuloch, pričom neovplyvňujú exkréciu solútov Na a K. Ako prvé boli uvedené do praxe blokátory V1/V2 receptorov – konivaptan, neskoršie sa začali používať len V2 antagonisty, napr. tolvaptan, mozavaptan, lixivaptan, satavaptan, ktoré vo viacerých štúdiách zvýšili natriémiu a boli efektívne pri liečbe SIAD [26]. Systematický prehľad a zároveň potvrdenie účinnosti vaptánov pri liečbe euvolemickej hyponatriémie priniesli metaanalýzy [27] a na základe ich záverov skupina autorov tvoriaca guidelines neodporučila použitie vaptánov v liečbe SIAD. Dôvodom je negatívny pomer riziko vs benefit. Za najväčšie riziko sa považuje riziko rýchlej korekcie hyponatriémie, ale nemožno neprehliadnuť ani ďalšie negatívne účinky vaptánov, napr. hepatotoxicitu. Z tohto dôvodu vaptány stále nie sú odporúčané v bežnej liečbe hyponatriémie pri SIAD [1].
Pri akútnej hyponatriémii indukovanej tiazidmi je liečba rovnaká ako pri SIAD, tj. je potrebné začať infúziou 3% NaCl, alebo 2 ml/kg hmotnosti a pokračovať ďalšej podľa odporúčaní, ktoré sú uvedené vyššie. Cieľom je vzostup SNa o 4–6 mmol/l počas prvých 6 hod. Rýchlejšia korekcia sa neodporúča pre riziko osmotického demyelinizačného syndrómu. Pri chronickej hyponatriémii je prvým krokom prerušenie liečby tiazidmi a reštrikcia príjmu vody na maximálne 1 l denne. Pri prejavoch hypovolémie sa odporúča podanie 0,9% NaCl a zároveň je potrebná korekcia hypokaliémie. V liečbe TAH sa podanie vaptánov neodporúča [1].
prof. MUDr. Ivica Lazúrová, DrSc., FRCP
ivica.lazurova@upjs.sk
I. interná klinika LF UPJŠ a UNLP,
Košice,
Slovenská republika
www.upjs.sk
Doručeno do redakce 25. 7. 2017
Přijato po recenzi 4. 9. 2017
Sources
1. Spasovski G, Vanholder R, Allolio B et al. Clinical practice guidelines on diagnosis and treatment of hyponatremia. Eur J Endocrinol 2014; 170(3): G1-G47. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-13–1020>.
2. Sajadieh A, Binici Z, Mouridsen MR et al. Mild hyponatremia carriers a poor prognosis in community subjects. Am J Med 2009; 122(7): 679–686. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2008.11.033>.
3. Gill G, Huda B, Boyd A et al. Characteristics and mortality of severe hyponatremia – a hospital based study. Clin Endocrinol 2006; 65(2): 246–249.
4. Basu A, Ryder RE The syndrome of inappropriate antidiuresis is associated with excess long-term mortality: a retrospective cohort analyses. J Clin Pathol 2014; 67(9): 802–806.
5. Hannon MJ, Thompson CJ. The syndrome of inappropriate antidiuretic hormone: prevelance, causes and consequences. Eur J Endocrinol 2010; 162(Suppl 1): S5-S12. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-09–1063>.
6. Shapiro DS, Sonnenblick M, Galperin I et al. Severe hyponatremia in elderly hospitalized patients: prevalence, aetiology and outcome. Intern Med J 2010; 40(8): 574–580. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1445–5994.2010.02217.x>.
7. Rudnay M, Lazúrová I. Prevalencia hyponatriémie u pacientov na internom oddelení. Vnitř Lék 2013; 59(10): 876–879.
8. Clayton JA, Le Jeune IR, Hall IP. Severe hyponatremia in medical in-patients: etiology, assessment and outcome. QJM 2006; 99(8): 505–511.
9. Tzoulis P, Carr H, Bagkeris E et al. Improving care and outcomes of inpatients with syndrome of inappropriate antidiuresis (SIAD): a prospective intervention study of intensive endocrine input v.s. routine care. Endocrine 2017; 55(2): 539–546. Dostupné z DOI: <http://dx.doi.org/10.1007/s12020–016–1161–9>.
10. Oh JY, Shin JI. Syndrome of inappropriate antidiuretic hormone secretion and cerebral/renal salt wasting syndrome: similarities and differences. Front Pediatr 2015; 2 : 146. Dostupné z DOI: <http://dx.doi.org/10.3389/fped.2014.00146>.
11. Nakajima H, Okada H, Hirose K et al. Cerebral salt-wasting syndrome and inappropriate antidiuretic hormone syndrome after subarachnoid hemorrhaging. Intern Med 2017; 56(6): 677–680. Dostupné z DOI: <http://dx.doi.org/10.2169/internalmedicine.56.6843>.
12. Gheorgiade M, Abraham WT, Albert NM et al. Relationship between admission serum sodium concentration and clinical outcomes in patients hospitalized for heart failure: an analysis from the OPTIMIZE-HF registry. Eur Heart J 2007; 28(8): 980–988.
13. Faustini-Fustini M, Anagni M. Beyond semantics: defining hyponatremia in secondary adrenal insufficiency. J Endocrinol Invest 2006; 29(3): 267–269.
14. Inoue K, Nakayama T, Kamisawa A et al. Syndrome of inappropriate antidiuretic hormone accompanied by bilateral hypothalamic and anterior thalamic lesions with serum antiaquaporin 4 antibody. BMJ Case Rep 2017 Apr; 2017. pii: bcr-2017–219721. Dostupné z DOI: <http://dx.doi.org/10.1136/bcr-2017–219721>.
15. Fenske W, Stork S, Blechschmidt A et al. Copeptin in the differential diagnosis of hyponatremia. J Clin Endocrinol Metab 2009; 94(1): 123–129. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2008–1426>.
16. Cohen DM, Ellison DH. Evaluating hyponatremia. JAMA 2015; 313(12): 1260–1261. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2014.13967>.
17. Lazúrová I. Syndróm neprimeranej sekrécie vazopresínu. Interná Med 2015; 15(7–8): 347–349.
18. Verbalis JG, Barsony J, Sugimura Y et al. Hyponatremia-induced osteoporosis. J Bone Miner Res 2010; 25(3): 554–563. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.090827>.
19. Clayton JA, Rodgers S, Blakey J et al. Thiazide diuretic prescription and electrolyte abnormalities in primary care. Br J Clin Pharmacol 2006; 61(1): 87–95.
20. Liamis G, Filippatos TD, Elisaf MS. Thiazide-associated hyponatremia in the elderly: what the clinician need to know. J Geriatr Cardiol 2016; 13(2): 175–182. Dostupné z DOI: <http://dx.doi.org/10.11909/j.issn.1671–5411.2016.02.001>.
21. Burst V, Grundmann F, Kubacki T et al. Thiazide-associated hyponatremia, report of the hyponatremia registry: an observational multicenter international study. Am J Nephrol 2017; 45(5): 420–430. Dostupné z DOI: <http://dx.doi.org/10.1159/000471493>.
22. Katayama K, Tokuda Y. Mineralocorticoid responsive hyponatremia of the elderly: A systematic review. Medicine 2017; 96(27): e7154. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0000000000007154>.
23. Sherlock M, Thompson CJ. The syndrome of inappropriate antidiuretic hormone: current and future management options. Eur J Endocrinol 2010; 162(Suppl 1): S13-S18. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-09–1057>.
24. Sterns RH, Capuccio JD, Silver SM et al. Neurologic sequalae after treatment of severe hyponatriemia: a multicenter perspective. J Am Soc Nephrol 1994; 4(8): 1522–1530.
25. De Sola-Morales O, Riera M. Urea for management of the syndrome of inappropriate secretion of ADH: a systematic review. Endocrinol Nutr 2014; 61(9): 486–492. Dostupné z DOI: <http://dx.doi.org/10.1016/j.endonu.2014.04.006>.
26. Schrier RW, Gross P, Gheorghiade M et al. Tolvaptan, a selective oral vasopressin V2-receptor antagonist, for hyponatremia. New Engl J Med 2006; 355(20): 2099–2112.
27. Rozen-Zvi B, Yahav D, Gheorghiade M et al. Vasopressin receptor antagonists for the treatment of hyponatremia: systematic review and meta-analysis. Am J Kidney Dis 2010; 56(2): 325–337. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2010.01.013>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 9-
All articles in this issue
- Onemocnění štítné žlázy v České republice: projekt EUthyroid a vyhodnocení epidemiologických dat VZP za období let 2012–2015
- Skríning tyreopatií v gravidite – odborné usmernenie v praxi
- Chlopenní vady při léčbě hyperprolaktinemie dopaminovými agonisty
- Hypotyreóza u pacientů se srdečním onemocněním
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Diagnostika a manažment metastatického feochromocytómu a paragangliómu
- Kvalita kosti u akromegalikov
- Syndróm neprimeranej antidiurézy (SIAD) a súčasný manažment hyponatriémie
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Primární hyperparatyreóza – nové klinické formy onemocnění
- Efekt antidiabetickej liečby na kosť
- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Primární hyperparatyreóza – nové klinické formy onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

