-
Medical journals
- Career
Diagnostika a manažment metastatického feochromocytómu a paragangliómu
Authors: Ivana Jochmanová; Ivica Lazúrová
Authors‘ workplace: I. interná klinika LF UPJŠ a UNLP, Košice, Slovenská republika
Published in: Vnitř Lék 2017; 63(9): 580-588
Category: Reviews
Overview
Feochromocytóm (FEO) a paraganglióm (PGL) sú zriedkavé katecholamíny produkujúce neuroendokrinné tumory vychádzajúce z drene nadobličky alebo z extraadrenálnych sympatikových a parasympatikových ganglií. Vo väčšine prípadov FEO/PGL ide o benígne tumory, avšak metastatické ochorenie nie je výnimkou, predovšetkým u pacientov so špecifickým genetickým pozadím. Aj keď FEO/PGL boli popísané už pred viac ako storočím, diagnostika a liečba metastatického ochorenia sú stále problematické. Pokrok v porozumení molekulárnym a metabolickým zmenám asociovaným s tumorigenézou nás vedie bližšie k identifikácii podstaty týchto tumorov. Nové poznatky umožnili vyvinúť presnejšie diagnostické metódy a identifikovať molekulárne terapeutické ciele, ktoré by mali prispieť k zlepšeniu starostlivosti o pacientov s metastatickým FEO/PGL.
Kľúčové slová:
diagnostika – feochromocytóm – liečba – manažment – paragangliómÚvod
Feochromocytóm (FEO) a paraganglióm (PGL) sú zriedkavé neuroendokrinné katecholamíny produkujúce tumory vychádzajúce z drene nadobličky (FEO) alebo z extraadrenálnych sympatikových a parasympatikových ganglií (PGL). Obyčajne sa prezentujú ako benígne tumory, avšak metastatické ochorenie nie je výnimočné, predovšetkým u pacientov so špecifickým genetickým pozadím [1]. Diagnostika a liečba FEO/PGL sú stále výzvou – u viac ako 50 % pacientov nebývajú rozpoznané [2] a doteraz nedokážeme účinne liečiť metastatické ochorenie. Súčasný výskum priniesol nové poznatky o patofyziológii FEO/PGL, a umožnil tak vývoj nových diagnostických metód, ako aj potenciálnych liečebných modalít.
Diagnostika FEO/PGL
Náročná diagnostika FEO/PGL vyplýva z ich veľmi variabilnej prezentácie. FEO/PGL sa prezentujú rôznymi nešpecifickými symptómami, ktoré sú dôsledkom hemodynamických a metabolických účinkov cirkulujúcich katecholamínov a iných amínov či neuropeptidov produkovaných nádorom [3,4]. Symptómy sú častejšie u pacientov s FEO/PGL produkujúcimi adrenalín než tými, ktoré secernujú noradrenalín. Dopamín produkujúce FEO/PGL sa prejavujú menej typickými symptómami, napr. hypotenziou, hnačkami a hmotnostným úbytkom. Závažnosť symptómov nie vždy koreluje s plazmatickými hladinami katecholamínov [3]. Okolo 8–13 % pacientov nemá žiadne symptómy – zvyčajne ide o malé tumory (< 5 mm) alebo o dediferencované tumory bez katecholamíny syntetizujúcich enzýmov. Frekvencia symptómov u pacientov s FEO/PGL je tiež veľmi variabilná. Niektorí pacienti sú symptomatickí kontinuálne, u iných sa príznaky objavujú v atakoch v rôznych intervaloch. Klasické symptómy FEO/PGL zahŕňajú bolesti hlavy, excesívne potenie a palpitácie. 90 % pacientov máva trvalú alebo paroxyzmálnu hypertenziu [4–6]. Medzi ďalšie symptómy patria flushing, bledosť, nauzea a vomitus, úzkosť, panické ataky, dyspnoe, hmotnostný úbytok, intolerancia tepla či generalizovaná slabosť [3,5]. Menej časté sú horúčka neznámeho pôvodu, zápcha (katecholamínmi indukované zníženie intestinálnej motility) a cholecystolitáza. Nadprodukcia adrenalínu vedie k rozvoju hyperglykémie s nízkymi hladinami inzulínu počas epizód hypertenzie. FEO/PGL môžu podmieňovať rozvoj inzulínovej rezistencie a diabetes mellitus [3,7]. Zriedkavo môžu FEO/PGL produkovať vazoaktívny intestinálny peptid, čo sa prejavuje vodnatými hnačkami, hypokalémiou a achlórhydriou [3,8].
Pacienti môžu mať ťažkosti vyplývajúce z útlaku orgánov a tkanív tumorom. Tumory v oblasti hlavy a krku môžu napr. spôsobovať dysfágiu, dysfóniu, tinnitus či obrnu kraniálnych nervov [9].
Je zrejmé, že FEO/PGL vedú k závažnej morbidite a mortalite. Preto je nevyhnutné včasné rozpoznanie symptómov a adekvátna diferenciálna diagnostika. Pátranie po FEO/PGL by rozhodne malo byť súčasťou skríningu a diagnostického procesu u pacientov s rodinnou anamnézou FEO/PGL alebo niektorých hereditárnych nádorových syndrómov, u pacientov s kombináciou hypertenzie, tachykardie, potenia a bledosti, paroxyzmálnymi symptómami, alebo rezistentnou hypertenziou. Na FEO/PGL treba myslieť aj u pacientov s rozvojom hypertenzie a ďalších symptómov v spojení s vyšetrením, anestéziou, chirurgickým zákrokom, užitím niektorých liekov, jedla alebo nápojov a tiež u pacientov s adrenálnymi incidentalómami [3,10].
Biochemická diagnostika FEO/PGL
Základným biochemickým vyšetrením je stanovenie koncentrácie katecholamínov (adrenalín, noradrenalín) a ich metabolitov – metanefrínov (metanefrín, normetanefrín) v krvi alebo v moči. Stanovenie len katecholamínov je nedostatočné, pretože FEO/PGL často secernujú katecholamíny epizodicky a ich hladiny tak môžu byť normálne. Asi 30 % FEO/PGL nesecernuje katecholamíny v dostatočne vysokých množstvách aj napriek tomu, že ich syntetizujú [11]. Na druhej strane, vysoká koncentrácia katecholamínov nie je špecifická len pre FEO/PGL a môže byť prítomná pri mnohých iných ochoreniach [11]. Žiaduce je stanovenie voľných plazmatických alebo frakcionovaných močových metanefrínov (O–metylované metabolity katecholamínov), pretože sú bunkami FEO/PGL produkované kontinuálne a ich produkcia nezávisí od uvoľňovania katecholamínov z bunky [12–14].
Pri interpretácii výsledkov je nutné rozlišovať medzi miernym a výrazným zvýšením hladín katecholamínov alebo metanefrínov. U pacientov s biochemicky aktívnym tumorom je zvýšenie obyčajne 2-násobné až 4-násobné voči hornému limitu normálu. Mierne zvýšenie katecholamínov je väčšinou dôsledkom interferujúcich liekov (tab. 1), nevhodného odberu krvi, alebo nevhodnej manipulácie so vzorkou [4]. Ak je problematické rozlíšiť zvýšenie katecholamínov v dôsledku aktivácie sympatika od zvýšenia v dôsledku produkcie tumorom, je vhodné urobiť klonidínový supresný test. Chýbanie supresie plazmatického normetanefrínu podporuje prítomnosť FEO/PGL [15]. Spoľahlivosť testu môže narušiť užívanie tricyklických antidepresív a diuretík [3].
Tab. Lieky, ktoré môžu spôsobiť falošne pozitívne zvýšenie plazmatických a močových katecholamínov alebo metanefrínov. 
A – adrenalín NA – noradrenalín MN – metanefrín NMN – normetanefrín +++ – výrazné zvýšenie ++ – stredné zvýšenie + – mierne zvýšenie – – minimálne alebo žiadne zvýšenie ? – údaje neznáme Upravené podľa [24] Vzácne FEO/PGL produkujú len dopamín a nie je možné ich odhaliť stanovením katecholamínov/metanefrínov. Preto je v rámci biochemickej diagnostiky vhodné vyšetrenie koncentrácie dopamínu v plazme. Stanovenie dopamínu v moči nie je prínosné, keďže odráža jeho produkciu v renálnych tubuloch [16]. Prínosným je aj stanovenie plazmatickej hladiny metoxytyramínu, ktorý je biomarkerom dopamín produkujúcich tumorov a môže tiež indikovať malignitu [11,17]. Meranie tohto biomarkera je však v súčasnosti možné len v niekoľkých výskumných centrách.
Pre ďalšie smerovanie diagnostiky a terapie je dôležité posúdenie biochemického fenotypu FEO/PGL. Tri základné biochemické fenotypy zahŕňajú adrenergný (adrenalín/metanefrín), noradrenergný (noradrenalín/normetanefrín) a dopamínergný (dopamín/metoxytyramín). Časté sú zmiešané fenotypy, pri ktorých sa FEO/PGL považujú za adrenergné, ak secernujú metanefrín a normetanefrín a za dopaminergné, ak secernujú normetanefrín a metoxytyramín. Adrenalín/metanefrín pochádza takmer výlučne (99 %) z nadobličky, a teda pri adrenergnom biochemickom fenotype ide takmer vždy o FEO [18].
Nešpecifickým biomarkerom endokrinných nádorov je chromogranín A, ktorého hladiny bývajú zvýšené u 91 % pacientov s FEO/PGL [19]. Stanovenie chromogranínu A spolu s hladinami katecholamínov môže uľahčiť diagnózu FEO/PGL. Chromogranín A je navyše veľmi nápomocný pri diagnostike biochemicky nemých tumorov a pri monitorovaní ochorenia [20]. Zriedkavo môžu FEO/PGL okrem katecholamínov produkovať aj iné hormóny, napr. adrenokortikotropný hormón alebo kortizol. V týchto prípadoch je prítomný aj klinický obraz Cushingovho syndrómu [21].
Lokalizácia FEO/PGL
Lokalizáciu FEO/PGL iniciujeme len vtedy, keď je prítomnosť tumoru silne podporená biochemickými testami alebo je tumor vysoko pravdepodobný (pacienti s genetickou predispozíciou alebo s anamnézou FEO/PGL) [14,22]. Na lokalizáciu a konfirmáciu FEO/PGL je najlepšie použiť kombináciu anatomických (výpočtová tomografia – CT, magnetická rezonancia – MR) a funkčných (metódy nukleárnej medicíny) zobrazovacích metód [14]. Funkčné zobrazovacie metódy bývajú užitočné pri detekcii tak primárnych, ako aj metastatických lézií, ktoré nemusia byť zachytené na anatomickom zobrazení [5]. Ultrasonografické zobrazenie nie je vhodné, ale je možné ho použiť u detí a tehotných žien, ak nie je dostupná MR.
Na základe biochemického fenotypu je možné pátranie po FEO/PGL pomocou zobrazovacích metód primárne zamerať na konkrétne oblasti tela. Pri zvýšenom metanefríne/adrenalíne zobrazovanie iniciálne sústreďujeme na nadobličky, keďže adrenergný fenotyp je väčšinou spojený s adrenálnymi tumormi. Pri normálnom náleze na nadobličkách je potrebné zobrazenie ďalších častí tela: abdomenu, panvy, hrudníka a krku. Pri noradrenergnom fenotype sa odporúča začať so zobrazením abdominálnej a pelvickej oblasti a pri negatívnom náleze pokračovať zobrazením hrudníka a hlavy/krku. Osobná anamnéza a fyzikálne vyšetrenie tiež môžu pomôcť odhadnúť lokalizáciu tumoru. Hypertenzia po mikcii napr. svedčí o PGL močového mechúra [23].
Zobrazovacie metódy sú nevyhnutnosťou pri skríningu pacientov so známou genetickou predispozíciou na FEO/PGL a pri monitorovaní pacientov s anamnézou FEO/PGL.
Genetické testovanie
Okrem diagnostiky a primeranej liečby je potrebné zvážiť aj genetické testovanie, predovšetkým u pacientov s predpokladanou hereditárnou formou ochorenia a ich prvostupňových príbuzných. V prípade identifikácie génovej mutácie predisponujúcej na vznik FEO/PGL je potrebný pravidelný skríning a sledovanie nositeľov mutácie, a to aj v prípadoch, keď ochorenie nie je zjavné. Jednotlivé génové mutácie bývajú spojené so špecifickým klinickým a biochemickým fenotypom. Skorá identifikácia génovej mutácie tiež umožňuje predvídať priebeh ochorenia, riziko metastáz, dedičnosti a umožňuje voľbu vhodnej terapeutickej stratégie. Pri diagnostike FEO/PGL a posudzovaní možnej prítomnosti génovej mutácie sú nevyhnutnosťou podrobná osobná a rodinná anamnéza, precízne klinické a biochemické vyšetrenie, ako aj využitie zobrazovacích metód. Posudzujeme najmä lokalizáciu tumoru, biochemický fenotyp, vek pacienta a prítomnosť nádorov iných než FEO/PGL Algoritmus smerovania genetického testovania u pacientov s FEO/PGL uvádza schéma 1 [5,8,18].
Schéma 1. Algoritmus na smerovanie genetického testovania u pacientov s FEO/PGL. 
DA – dopamín FH – gén kódujúci fumaráthydratázu HIF2A – gén kódujúci hypoxiou indukovateľný faktor 2α MAX – gén kódujúci MYC–asociovaný faktor X MN – metanefrín MTY – metoxytyramín NF1 – gén kódujúci neurofibromín 1 NMN – normetanefrín RET – RET protoonkogén SDHx – gény kódujúce podjednotky sukcinátdehydrogenázového komplexu SDHA, -B, -C, -D – gén kódujúci podjednotky A, B, C, D sukcinátdehydrogenázového komplexu TMEM127 – gén kódujúci transmembránový proteín 127 VHL – gén kódujúci von Hippelov-Lindauov proteín Upravené podľa [5,8,18] Manažment pacientov s FEO/PGL
Manažment pacientov s FEO/PGL si vyžaduje úzku spoluprácu viacerých špecialistov, vrátane endokrinológa, internistu, rádiológa, anestéziológa, chirurga a onkológa [4]. Jedinou kuratívnou liečbou FEO/PGL je v súčasnosti chirurgické odstránenie tumoru. Optimálnou liečbou a prevenciou komplikácií FEO/PGL je teda čo najskoršia, ideálne kompletná, resekcia tumoru. V prípade metastatického ochorenia je možný debulking alebo odstránenie extenzívnych metastáz, čo môže viesť k dlhodobej remisii alebo k paliácii symptómov spojených s excesom katecholamínov alebo tlakom tumoróznej masy [24]. Ďalšími možnosťami liečby sú systémová chemoterapia a rádioterapia, aj keď tieto majú len paliatívny charakter.
Medikamentózna liečba v manažmente pacientov s FEO/PGL
Ihneď po stanovení diagnózy by mali byť všetci pacienti s biochemicky aktívnym FEO/PGL nastavení na adekvátnu liečbu blokátormi adrenoceptorov. Cieľom liečby je kontrola symptómov a redukcia rizika hypertenzných kríz a orgánového poškodenia účinkami uvoľnených katecholamínov. Zatiaľ neexistuje konsenzus ohľadom predoperačného manažmentu pacientov, avšak odporúčanými liekmi sú antagonisty α-adrenoceptorov, blokátory kalciového kanála a blokátory angiotenzínových receptorov [22] v dávkach uvedených v tab. 2.
Table 1. Lieky vhodné na manžment symptómov a blokádu pred chirurgickým zákrokom u pacientov s FEO/PGL. 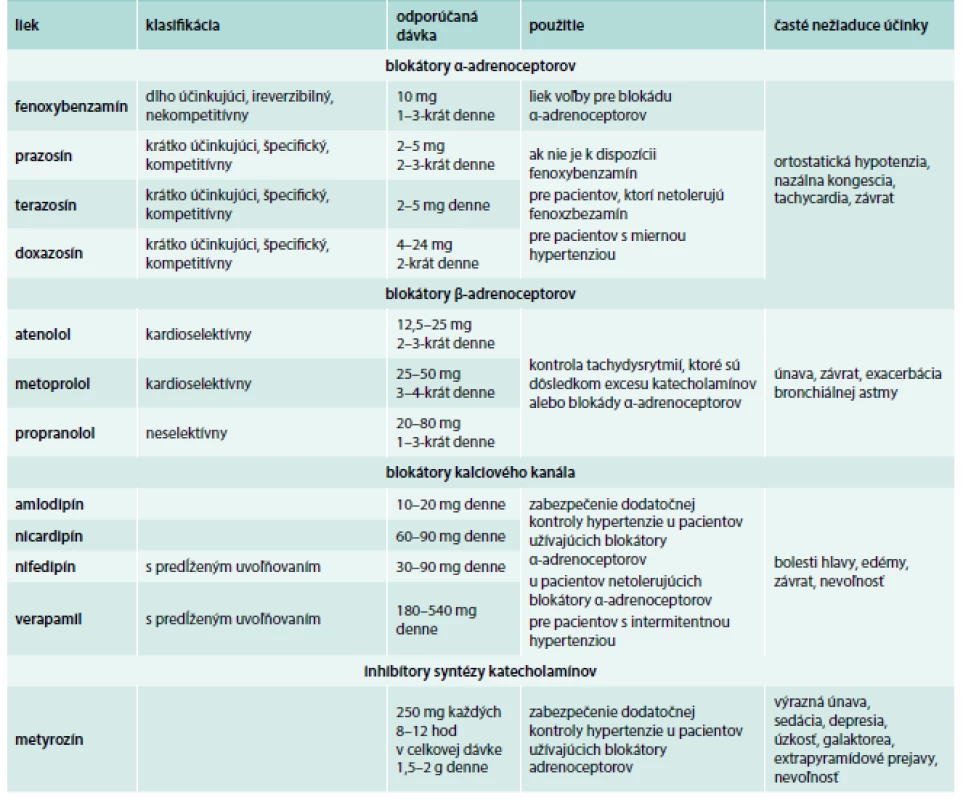
Upravené podľa [8] Predoperačná blokáda by mala byť začatá 7–14 dní pred plánovaným chirurgickým zákrokom s cieľom dosiahnuť adekvátnu kontrolu krvného tlaku, srdcovej frekvencie a obnovu normovolémie a predísť chirurgickým zákrokom indukovanej „katecholamínovej búrke“ a jej následkom [14,22]. Predoperačná príprava by mala zahŕňať aj diétu s vysokým obsahom sodíka a vysoký príjem tekutín. Táto príprava napomáha obnoviť normovolémiu a predísť závažnej hypotenzii po odstránení tumoru [22].
V manažmente hypertenznej krízy je najvhodnejšie použiť intravenózne (i.v.) fentolamín (5 mg každé 2 min do normalizácie krvného tlaku) alebo nitroprusid sodný v kontinuálnej infúzii. Niekedy je možné podať perorálne alebo sublingválne 10 mg nifedipínu. V prípade tachykardie je možné použiť betablokátory, avšak vždy až po začatí liečby blokátormi α-adrenoceptorov. U pacientov s FEO/PGL by sme sa mali vyhnúť podaniu niektorých liekov, pretože môžu precipitovať epizódy hypertenzie (tab. 3).
Table 2. Lieky kontraindikované u pacientov so známym alebo suspektným FEO/PGL. 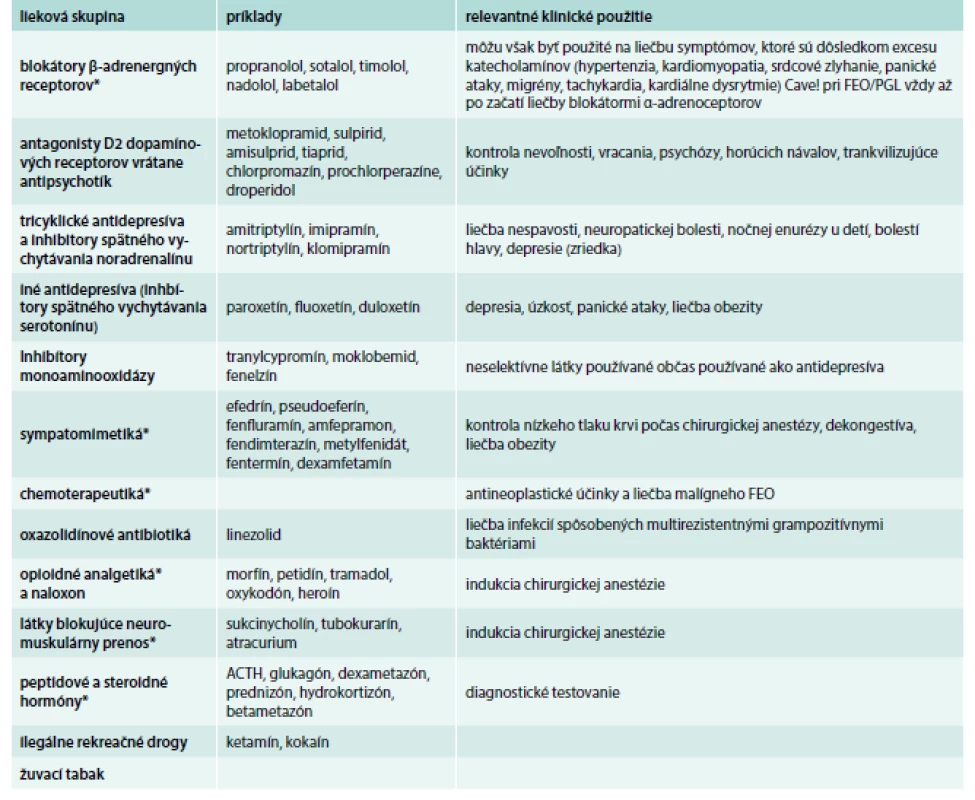
* tieto lieky majú terapeutické alebo diagnostické využitie pri FEO/PGL, ale obyčajne až po začatí liečby vhodnými antihypertenzívami (napr. blokátormi α-adrenoceptorov) Upravené podľa [8] Manažment pacientov s metastatickým FEO/PGL
Pri FEO/PGL zatiaľ nie sú známe celulárne alebo molekulárne markery malignity. Metastatický FEO/PGL je definovaný ako prítomnosť metastáz v tkanivách, v ktorých sa za normálnych okolností nevyskytujú chromafinné bunky. Metastázy sa môžu šíriť hematogénnou alebo lymfogénnou cestou a najčastejšie bývajú prítomné v lymfatických uzlinách a kostiach. V prípade nálezu PGL v pečeni a v pľúcach ide často o primárne tumory [25]. Metastatické ochorenie sa u pacientov s FEO/PGL vyskytuje s frekvenciou 1–34 % v závislosti od genetického pozadia. Metastázy sa častejšie vyskytujú u pacientov s PGL ako u FEO (asi 25 % vs 10 %) [26]. Pacientov s FEO/PGL je potrebné dlhodobo sledovať nezávisle od genetického pozadia, pretože metastázy sa môžu objaviť aj viac ako 20 rokov po prvotnej prezentácii ochorenia.
Klinická manifestácia metastatického FEO/PGL je podobná ako u benígnych tumorov. Pacienti sa navyše môžu sťažovať na symptómy spôsobené lokálnou inváziou tumoru. Niektorí pacienti majú len minimálne alebo žiadne symptómy aj napriek vysokým hladinám katecholamínov, pravdepodobne v dôsledku desenzitácie adrenoceptorov nepretržite vysokými koncentráciami katecholamínov.
Metastatické tumory secernujú prevažne noradrenalín a obyčajne aj dopamín a jeho metabolit metoxytyramín [1]. Na lokalizáciu metastatického FEO/PGL je vhodnejšie použiť 18F-FDG PET (18F-fluorodeoxyglukózovú pozitrónovú emisná tomografiu) ako špecifické pozitrón-emitujúce substancie alebo 123I-MIBG (123I-metaiodobenzylguanidín) scintigrafiu kvôli dediferenciácii tumoru a strate expresie membránových a vezikulárnych transportných systémov [23].
Manažment metastatického FEO/PGL je náročný a vyžaduje multidisciplinárny prístup. V súčasnosti neexistuje účinná liečba metastatického FEO/PGL. Cieľom terapeutických zásahov je pokus o definitívne vyliečenie limitovaného ochorenia a paliácia pokročilého ochorenia. U pacientov s pomaly progredujúcim ochorením je možné aplikovať „wait and watch“ (čakať a sledovať) stratégiu, pričom je pacientov potrebné pravidelne sledovať za použitia biochemických a zobrazovacích metód. Každý terapeutický krok by mal byť prísne individualizovaný a prispôsobený potrebám pacienta a stanoveným terapeutickým cieľom. Aktívna terapeutická intervencia je nutná v prípade nekontrolovaných symptómov spôsobených hormónmi, veľkosťou tumoru, alebo rozsahom nádorového bujnenia podľa RECIST kritérií (7 a viac kostných metastáz, náhrada > 50 % pečeňového parenchýmu tumorom, početné pľúcne noduly > 2 cm, alebo signifikantná rádiologická progresia). Okrem farmakoterapie hypertenzie a ďalších symptómov a chirurgického debulkingu súčasné dostupné metódy liečby FEO/PGL zahŕňajú lokálnu ablačnú liečbu, rádioterapiu a chemoterapiu. Vo vývoji sú nové cielené molekulárne postupy [8].
Rádiofrekvenčná ablácia a externá rádioterapia
Perkutánna rádiofrekvenčná ablácia (RFA) je bezpečná liečebná modalita, ktorej cieľom je inhibícia a kontrola rastu nádoru. Používa sa v rámci manažmentu bolestivých metastáz a symptómov spojených s nadprodukciou katecholamínov. Účinnosť RFA bola preukázaná pri liečbe kostných a pečeňových lézií [27,28].
Externú rádioterapiu je možné použiť ako adjuvantnú liečbu pri chemoterapii a systémovú rádioterapiu na lokálnu kontrolu objemných metastáz. Pomocou externej rádioterapie je možné dosiahnuť symptomatickú kontrolu ochorenia u pacientov s limitovaným rozsahom metastáz. U neresekabilných PGL v oblasti hlavy a krku predstavuje externá rádioterapia liečbu prvej voľby. V týchto prípadoch alternatívy zahŕňajú použitie tradičnej frakcionovanej externej rádioterapie alebo rádiochirurgiu s použitím gama noža, lineárneho akcelerátora, alebo cyber noža [28].
Cielená rádioterapia
Pacienti s inoperabilným metastatickým ochorením, ktorých tumory vychytávajú 123I-MIBG, sú vhodnými kandidátmi na systémovú cielenú rádioterapiu s použitím 131I-MIBG. Liečba môže byť podaná v jednej dávke (50–900 mCi) alebo vo viacerých dávkach (100–300 mCi) v 3-mesačných až 9-mesačných intervaloch v totálnej dávke maximálne 1 000 mCi [29]. Vyššie dávky sú spojené so závažnou hematologickou a nehematologickou toxicitou. U približne 30 % pacientov dochádza k parciálnej odpovedi (< 50 % redukcia tumoróznej masy). Úplná odpoveď býva len u 18 % pacientov. Napriek tomu u väčšiny pacientov dochádza k symptomatickému a biochemickému zlepšeniu [29].
Pred začatím 131I-MIBG terapie je potrebné zabezpečiť, aby pacienti neužívali anithypertenzíva a iné lieky, ktoré interferujú s vychytávaním 131I-MIBG, napr. nifedipín, atenolol, tricyklické antidepresíva, sympatomimetiká, antipsychotiká, stimulanty centrálneho nervového systému, antihistaminiká so sedatívnym účinkom, či systémové a lokálne dekongestíva. Okrem toho musia pacienti 24–48 hod pred začatím a 10–15 dní po terapii užívať preparáty jódu (Lugolov roztok, jodid draselný) alebo chloristan draselný ako prevenciu akumulácie rádiojódu v štítnej žľaze. Kvôli hematologickej, hepatálnej a renálnej toxicite nie je 131I-MIBG terapia vhodná pre pacientov s významne narušenou funkciou pečene, obličiek alebo hemopoézy [23,29].
Keďže pomerne veľký počet FEO/PGL exprimuje somatostatínové receptory, nové sľubné metódy cielenej rádioterapie predstavujú rádionuklidmi značené DOTA peptidy (DOTATATE, DOTATOC, DOTANOC), ktorých cieľom sú somatostatínové receptory. Tieto metódy využívajú dlhoúčinkujúci somatostatínový analóg (TATE, TOC, NOC) s naviazaným rádionuklidom značeným DOTA. Uvedené postupy je možné použiť u pacientov s pozitívnym nálezom na Octreoskene alebo 68Ga-DOTATATE PET/CT [8].
Systémová chemoterapia
Systémová chemoterapia sa odporúča pre rýchlo progredujúce inoperabilné metastatické ochorenie a tiež pre pacientov s vysokou nádorovou záťažou alebo početnými kostnými metastázami. V týchto prípadoch je chemoterapia paliatívnou liečbou s cieľom zlepšenia kvality života pacienta. Chemoterapiu je tiež možné použiť ako neoadjuvantnú liečbu pred chirurgickým odstránením veľkých tumorov.
Zatiaľ neexistuje chemoterapeutikum alebo ich kombinácia s preukázateľným dlhodobým účinkom v liečbe metastatického FEO/PGL, avšak niektoré z používaných liečiv môžu stabilizovať ochorenie na niekoľko rokov. Najčastejšie sa v liečbe metastatického FEO/PGL používa kombinácia cyklofosfamidu, vinkristínu a dakarbazínu (CVD), ktorá vedie k úplnej alebo čiastočnej odpovedi u 57 % pacientov. U 79 % liečených pacientov bola zaznamenaná úplná alebo čiastočná biochemická odpoveď a pacienti vykazovali objektívne zlepšenie výkonového statusu a klinického nálezu. Efektivita CVD chemoterapie býva evidentná po 1–3 mesiacoch liečby a býva účinná predovšetkým u pacientov s mutáciami v SDHB géne. Bolo tiež publikovaných niekoľko prípadov úspešnej liečby metastatického FEO/PGL inými chemoterapeutikami a ich kombináciami, vrátane temozolomidu, cyklofosfamidu s metotrexátom, talidomidom, ifosfamidom, etoposidom, carboplatinou, alebo doxorubicínom, či cisplatiny s 5-fluorouracilom [8].
Cielená molekulová terapia
Identifikácia génov predisponujúcich pre vznik FEO/PGL umožnila pochopenie niektorých patofyziologických mechanizmov podieľajúcich sa na tumorigenéze. To viedlo k odhaleniu dysfunkčných signálnych ciest a k identifikácii možných nových terapeutických cieľov.
Signálna cesta hypoxiou indukovateľných faktorov (HIF) je jednou z kľúčových signálnych ciest aktivovaných v niektorých FEO/PGL, konkrétne ide o tumory vychádzajúce z mutácií v génoch kódujúcich enzýmy Krebsovho cyklu a HIF2α alebo v iných génoch regulujúcich signálnu cestu HIF. Dôsledkom je zmena energetického metabolizmu bunky z oxidatívnej fosforylácie na tzv. aeróbnu glykolýzu (Warburgov efekt). Okrem toho bola vo FEO/PGL zistená zvýšená expresia komponentov signálnej cesty hypoxia-angiogenéza, napr. vaskulárnych endoteliálnych rastových faktorov (VEGF – vascular endothelial growth factors). Po glukóze je druhým najdôležitejším nutrientom v bunkách glutamín. V nádorových bunkách bolo zistené tiež zvýšenie vychytávania glutamínu a glutaminolýzy. Okrem uvedených procesov dochádza k aktivácii mnohých ďalších signálnych ciest a procesov podporujúcich tumorigenézu. Jednou zo sľubných terapeutických stratégií je teda inhibícia alebo modifikácia metabolických procesov a enzýmov podieľajúcich sa na preprogramovaní bunkového metabolizmu. Medzi potenciálne molekulové/metabolické terapeutické ciele vo FEO/PGL patria napr. inhibícia signálnej cesty HIF, inhibícia vychytávania glukózy a glykolytických enzýmov, inhibícia vychytávania glutamínu a glutaminolýzy, inhibícia syntézy mastných kyselín a lipidov, obnovenie enzymatickej aktivity nefunkčných enzýmov Krebsovho cyklu, či doplnenie chýbajúcich substrátov. Niekoľko takýchto látok je v súčasnosti vo vývoji alebo sú vo fáze klinických skúšok [30].
Záver
Aj napriek výraznému pokroku v diagnostike a liečbe nádorových ochorení je manažment pacientov s metastatickou formou FEO/PGL veľmi náročný. Jedinou definitívnou liečbou ochorenia je v súčasnosti len kompletné odstránenie tumoru, čo však často nie je možné. Liečba metastatického ochorenia si vyžaduje vysoko individualizovaný prístup a spoluprácu odborníkov z viacerých oblastí s cieľom redukcie a stabilizácie metastatickej záťaže. Schematické znázornenie manažmentu pacientov s metastatickým FEO/PGL uvádza schéma 2. Súčasný výskum prináša stále viac poznatkov o patogenéze FEO/PGL, ktoré umožňujú vývoj nových liečebných postupov. Neustále vzdelávanie lekárov je nevyhnutnou súčasťou zlepšovania zdravotnej starostlivosti (nielen) o pacientov s FEO/PGL.
Schéma 2. Algoritmus manažmentu pacientov s metastatickým FEO/PGL. 
CVD – cykolofosfamid, vinkristín, dakarbazín FEO – feochromocytóm, 123I-/131I-MIBG – 123I-/131I-metaiodobenzylguanidín PGL – paraganglióm RFA – rádiofrekvenčná ablácia SDHB – gén kódujúci B podjednotku sukcinátdehydrogenázového komplexu Upravené podľa [8] MUDr. Ivana Jochmanová
ivana.jochmanova@gmail.com
I. interná klinika LF UPJŠ a UNLP,
Košice,
Slovenská republika
www.unlp.sk
Doručeno do redakce 28. 7. 2017
Přijato po recenzi 4. 9. 2017
Sources
1. Eisenhofer G, Lenders JW, Siegert G et al. Plasma methoxytyramine: a novel biomarker of metastatic pheochromocytoma and paraganglioma in relation to established risk factors of tumour size, location and SDHB mutation status. Eur J Cancer 2012; 48(11): 1739–1749. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ejca.2011.07.016>.
2. McNeil AR, Blok BH, Koelmeyer TD et al. Phaeochromocytomas discovered during coronial autopsies in Sydney, Melbourne and Auckland. Aust N Z J Med 2000; 30(6): 648–652.
3. Pacak K, Lenders JWM, Eisenhofer G. Pheochromocytoma. Diagnosis, Localization, and Treatment. Willey-Blackwell: Malden (MA) 2007. ISBN 978–1405149501.
4. Lenders JW, Eisenhofer G, Mannelli M et al. Phaeochromocytoma. Lancet 2005; 366(9486): 665–675.
5. Martucci VL, Pacak K. Pheochromocytoma and paraganglioma: diagnosis, genetics, management, and treatment. Curr Probl Cancer 2014; 38(1): 7–41. Dostupné z DOI: <http://dx.doi.org/10.1016/j.currproblcancer.2014.01.001>.
6. Zelinka T, Strauch B, Petrak O et al. Increased blood pressure variability in pheochromocytoma compared to essential hypertension patients. J Hypertens 2005; 23(11): 2033–2039.
7. Adlan MA, Bondugulapati LN, Premawardhana LD. Glucose intolerance and diabetes mellitus in endocrine disorders – two case reports and a review. Curr Diabetes Rev 2010; 6(5): 266–273.
8. Jochmanova I, Pacak K. Pheochromocytoma/Paraganglioma: Update on Diagnosis and Management. In: Levine AC (ed). Adrenal Disorders: Physiology, Pathophysiology and Treatment. Humana Press 2018: in press. ISBN 978–3319624693.
9. Callender GG, Rich T, Lee JE et al. Pheochromocytoma. In: Yao JC, Hoff PM, Hoff AO (eds). Neuroendocrine tumors. Humana Press: New York (NY) 2011, 221–243. ISBN 978–1603279963.
10. Brouwers FM, Lenders JW, Eisenhofer G et al. Pheochromocytoma as an endocrine emergency. Rev Endocr Metab Disord 2003; 4(2): 121–128.
11. Eisenhofer G, Lenders JW, Pacak K. Biochemical diagnosis of pheochromocytoma. Front Horm Res 2004; 31 : 76–106.
12. Eisenhofer G. Peitzsch M. Laboratory evaluation of pheochromocytoma and paraganglioma. Clin Chem 201; 60(12): 1486–1499. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2014.224832>.
13. Lenders JW, Pacak K, Walther MM et al. Biochemical diagnosis of pheochromocytoma: which test is best? JAMA 2002; 287(11): 1427–1434.
14. Pacak K, Eisenhofer G, Ahlman H et al. Pheochromocytoma: recommendations for clinical practice from the First International Symposium. October 2005. Nat Clin Pract Endocrinol Metab 2007; 3(2): 92–102.
15. Eisenhofer G, Goldstein DS, Walther MM et al. Biochemical diagnosis of pheochromocytoma: how to distinguish true - from false-positive test results. J Clin Endocrinol Metab 2003; 88(6): 2656–2666.
16. Hodin R, Lubitz C, Phitayakorn R et al. Diagnosis and management of pheochromocytoma. Curr Probl Surg 2014; 51(4): 151–187. Dostupné z DOI: <http://dx.doi.org/10.1067/j.cpsurg.2013.12.001>.
17. Eisenhofer G, Goldstein DS, Sullivan P et al. Biochemical and clinical manifestations of dopamine-producing paragangliomas: utility of plasma methoxytyramine. J Clin Endocrinol Metab 2005; 90(4): 2068–2075.
18. Jochmanová I, Pacak K. Feochromocytóm a paraganglióm: klinicko-genetické aspekty. Interná medicína 2015; 15(2): 74–77.
19. Eiden LE, Iacangelo A, Hsu CM et al. Chromogranin A synthesis and secretion in chromaffin cells. J Neurochem 1987; 49(1): 65–74.
20. d‘Herbomez M, Do Cao C, Vezzosi D et al. Chromogranin A assay in clinical practice. Ann Endocrinol (Paris) 2010; 71(4): 274–280. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ando.2010.04.004>.
21. Nijhoff MF, Dekkers OM, Vleming LJ et al. ACTH-producing pheochromocytoma: clinical considerations and concise review of the literature. Eur J Intern Med 2009; 20(7): 682–685. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ejim.2009.08.002>.
22. Lenders JW, Duh QY, Eisenhofer G et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014; 99(6): 1915–1942. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–1498>.
23. Pacak K, Timmers HJLM, Eisenhofer G. Pheochromocytoma. In: Jameson JL, DeGroot LJ, De Kretser DM et al (eds). Endocrinology: Adult & pediatric. 2 voll. 7th ed. Elsevier/Saunders: Philadelphia (PA) 2016 : 1902–1930. ISBN 978–0–323–18907–1.
24. Plouin PF, Fitzgerald P, Rich T et al. Metastatic Pheochromocytoma and Paraganglioma: Focus on Therapeutics. Horm Metab Res 2012; 44(5): 390–399. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0031–1299707>.
25. Lloyd RV, Osamura RY, Kloppel G (eds) et al. WHO Classification of Tumours of Endocrine Organs. 4th ed. Vol. 10. WHO/IARC Classification of Tumours. WHO Press 2017. ISBN 978–92–832–4493–6.
26. Eisenhofer G, Bornstein SR, Brouwers FM et al. Malignant pheochromocytoma: current status and initiatives for future progress. Endocr Relat Cancer 2004; 11(3): 423–436.
27. McBrideJF, Atwell TD, Charboneau WJ et al. Minimally invasive treatment of metastatic pheochromocytoma and paraganglioma: efficacy and safety of radiofrequency ablation and cryoablation therapy. J Vasc Interv Radiol 2011; 22(9): 1263–1270. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jvir.2011.06.016>.
28. Jochmanova I, Wolf KI, King KS et al. SDHB-related pheochromocytoma and paraganglioma penetrance and genotype-phenotype correlations. J Cancer Res Clin Oncol 2017; 143(8): 1421–1435. Dostupné z DOI: <http://dx.doi.org/10.1007/s00432–017–2397–3>.
29. Carrasquillo JA, Pandit-Taskar N, Chen CC. I-131 Metaiodobenzylguanidine Therapy of Pheochromocytoma and Paraganglioma. Semin Nucl Med 2016; 46(3): 203–214. Dostupné z DOI: <http://dx.doi.org/10.1053/j.semnuclmed.2016.01.011>.
30. Jochmanova I, Pacak K. Pheochromoctyoma: The First Metabolic Endocrine Cancer. Clin Cancer Res 2016; 22(20): 5001–5011.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 9-
All articles in this issue
- Onemocnění štítné žlázy v České republice: projekt EUthyroid a vyhodnocení epidemiologických dat VZP za období let 2012–2015
- Skríning tyreopatií v gravidite – odborné usmernenie v praxi
- Chlopenní vady při léčbě hyperprolaktinemie dopaminovými agonisty
- Hypotyreóza u pacientů se srdečním onemocněním
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Diagnostika a manažment metastatického feochromocytómu a paragangliómu
- Kvalita kosti u akromegalikov
- Syndróm neprimeranej antidiurézy (SIAD) a súčasný manažment hyponatriémie
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Primární hyperparatyreóza – nové klinické formy onemocnění
- Efekt antidiabetickej liečby na kosť
- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Primární hyperparatyreóza – nové klinické formy onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

