-
Medical journals
- Career
Syndrom diabetické nohy: význam MR spektroskopie lýtkových svalů pro hodnocení končetinové ischemie a efektu revaskularizace
Authors: Andrea Němcová 1; Michal Dubský 1; Alexandra Jirkovská 1; Petr Šedivý 2; Miloslav Drobný 2; Milan Hájek 2; Monika Dezortová 2; Robert Bém 1; Vladimíra Fejfarová 1; Anna Pyšná 1
Authors‘ workplace: Centrum diabetologie IKEM, Praha 1; Oddělení výpočetní tomografie, magnetické rezonance a klinické a experimentální spektroskopie Pracoviště radiodiagnostiky a intervenční radiologie IKEM, Praha 2
Published in: Vnitř Lék 2017; 63(4): 236-241
Category: Original Contributions
Overview
Úvod:
Standardní metodou pro posouzení efektu revaskularizace u pacientů se syndromem diabetické nohy (SDN) a kritickou končetinovou ischemií (critical limb ischemia – CLI) je měření transkutánní tenze kyslíku (TcPO2). 31P MR spektroskopie (MRS) je metoda umožňující hodnotit energetický metabolizmus svalu, který může být u pacientů s diabetem a jeho komplikacemi porušený.
Cílem naší studie bylo porovnat MRS lýtkových svalů u pacientů se SDN a CLI se zdravými dobrovolníky a posoudit přínos této metody při hodnocení efektu revaskularizace.Metodika:
Do studie bylo zařazeno 34 pacientů se SDN a CLI, z nichž 27 podstoupilo v období let 2013–2016 na našem pracovišti revaskularizační výkon. Autologní buněčnou terapií (autologous cell therapy – ACT) bylo léčeno 15 pacientů, perkutánní transluminální angioplastika (PTA) byla provedena u 12 pacientů. Do kontrolní skupiny bylo zařazeno 19 zdravých osob. Referenční metodou pro posouzení končetinové ischemie a efektu revaskularizace bylo měření TcPO2. MRS byla provedena za použití celotělového 3T MRS systému 1 den před a 3 měsíce po revaskularizaci. Pacienti byli vyšetřeni v poloze na zádech s cívkou fixovanou pod m. gastrocnemius. MRS parametry byly stanoveny během klidové a zátěžové fáze. Klidové MRS parametry oxidativního metabolizmu (fosfokreatin – PCr, anorganický fosfát – Pi, fosfodiestery – PDE a adenozintrifosfát – ATP), zátěžové MRS parametry (recovery time PCr – τPCr a mitochondriální kapacita – Qmax) a pH byly porovnány mezi pacienty a zdravými kontrolami. Tytéž parametry byly porovnány u pacientů před revaskularizací a 3 měsíce po revaskularizaci.Výsledky:
Pacienti se SDN a CLI měli signifikantně nižší PCr/Pi (p < 0,001), signifikantně vyšší Pi a pH (p < 0,01), signifikantně nižší Qmax a prodloužený τPCr (p < 0,001) ve srovnání se zdravými kontrolami. Efekt revaskularizace byl potvrzen signifikantním zlepšením hodnot TcPO2 po 3 měsících (z 26,4 ± 11,7 na 39,7 ± 17,7 mm Hg, p < 0,005), avšak klidové MRS parametry se po revaskularizaci signifikantně nezměnily, pouze v individuálních případech došlo ke zlepšení zátěžových MRS parametrů. Nepozorovali jsme korelaci mezi změnami MRS parametrů a vzestupem TcPO2 po revaskularizaci.Závěr:
Výsledky naší pilotní studie ukazují porušený energetický metabolizmus lýtkových svalů u pacientů se SDN a CLI ve srovnání se zdravými kontrolami. V individuálních případech jsme po revaskularizaci pozorovali zlepšení zátěžových MRS parametrů. Přínos MRS lýtkových svalů pro hodnocení efektu revaskularizace je nutno ověřit na větším počtu pacientů během dlouhodobějšího sledování.Klíčová slova:
buněčná terapie – kritická končetinová ischemie – MR spektroskopie – syndrom diabetické nohyÚvod
Kritická končetinová ischemie (critical limb ischemia – CLI) je definována jako přetrvávající klidová bolest s přítomností ulcerace nebo gangrény v důsledku objektivně prokázané okluze tepen dolních končetin [1]. CLI je spojena s vysokým rizikem amputace končetiny i celkové mortality [2]. Diagnostika a terapie CLI u pacientů s diabetem je obtížná, protože často chybějí typické symptomy, jako je klidová bolest nebo klaudikace v důsledku periferní neuropatie a lokalizace postižení cév, které je u diabetiků převážně infrapopliteální [3]. Standardními léčebnými metodami CLI jsou chirurgická revaskularizace bypassem nebo perkutánní transluminální angioplastika (PTA) [4]. Pacienti s tzv. no-option CLI, kteří nejsou vhodní k standardní léčbě kvůli závažnému, technicky neřešitelnému cévnímu postižení nebo kvůli vysokému operačnímu riziku, mohou profitovat z léčby autologními kmenovými buňkami (autologous cell therapy – ACT) [5].
Standardní metodou pro hodnocení závažnosti ischemie a efektu revaskularizace je měření transkutánní tenze kyslíku (TcPO2), což je neinvazivní vyšetření odrážející tkáňovou perfuzi a oxygenaci [4,6]. Perspektivní metodou při hodnocení efektu revaskularizace je 31P MR spektroskopie (MRS) lýtkových svalů, která poskytuje informaci o změnách energetického svalového metabolizmu zahrnujícího mitochondriální oxidativní fosforylaci, anaerobní glykolýzu a kreatinkinázovou aktivitu (graf 1).
Graph 1. Kinetika fosfokreatinu během klidu, zátěže a recovery fáze 
Principem 31P MRS je měření koncentrace metabolitů – fosfokreatinu (PCr), anorganického fosfátu (Pi), fosfodiesterů (PDE) a adenozintrifosfátu (ATP), které charakterizují svalový metabolizmus především v klidu, a stanovení zátěžových MRS parametrů (poklesu PCr, mitochondriální kapacity – Qmax, recovery time PCr – τPCr a změny pH), které popisují změny v energetickém metabolizmu při svalové činnosti [7].
Metabolické parametry získané z 31P MRS lýtkových svalů závisí na dodávce kyslíku do svalu, na celkové velikosti zátěže, na počtu mitochondrií a rychlosti enzymatických pochodů v nich probíhajících. Porušené cévní zásobení dolních končetin limituje oxidativní svalový metabolizmus a vede k acidóze v důsledku anaerobní glykolýzy. U pacientů se symptomatickou ischemickou chorobou dolních končetin (ICHDK) byl pozorován prodloužený recovery time PCr, který je známkou zpožděného obnovení zásob energeticky bohatého fosfokreatinu [8,9]. Je známo, že rovněž diabetes a jeho komplikace (zejména neuropatie, mikroangiopatie a makroangiopatie) negativně ovlivňují svalový metabolizmus; pacienti s diabetem mají např. sníženou mitochondriální kapacitu [10,11]. Přítomnost diabetu a aterosklerózy je také spojena s vyšším výskytem poškození mitochondriální DNA [12].
Cílem naší studie bylo porovnat parametry MRS lýtkových svalů mezi pacienty se syndromem diabetické nohy (SDN) a CLI a zdravými kontrolami a posoudit přínos této metody při hodnocení efektu revaskularizace.
Metody
Do studie bylo konsekutivně zařazeno 34 pacientů se SDN a CLI, z nichž 27 podstoupilo revaskularizační výkon na našem pracovišti (ACT bylo léčeno 15 pacientů, u 12 bylo provedeno PTA) v období od ledna roku 2013 do ledna toku 2017 (tab. 1). Do kontrolní skupiny bylo zařazeno 19 zdravých dobrovolníků bez diabetu (průměrný věk 57,6 ± 9,9 let).
Table 1. Základní charakteristika pacientů se SDN a CLI 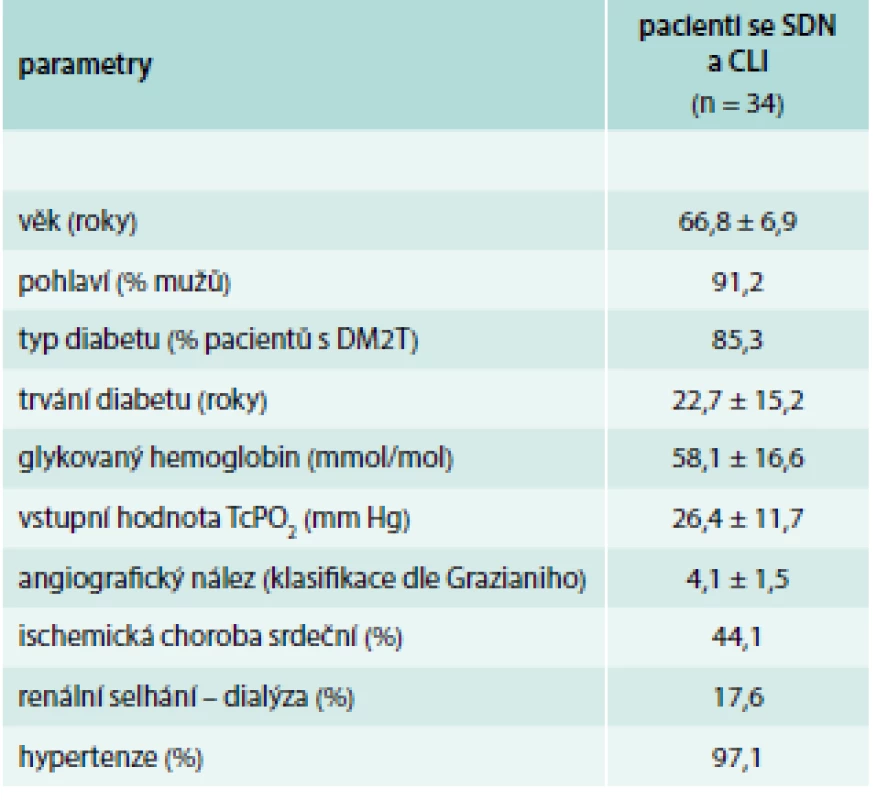
CLI byla definována hodnotou TcPO2 < 30 mm Hg, angiograficky prokázanou významnou infrapopliteální stenózou, přítomností nehojících se defektů nebo ischemické bolesti v souladu s kritérii pro CLI TASC II [13]. Závažnost angiografických nálezů byla hodnocena pomocí Grazianiho klasifikace [14]. Pacienti léčení ACT podstoupili vyšetřovací protokol zahrnující podrobné onkologické a hematologické vyšetření popsané v naší předchozí studii [15]. Vyřazovacími kritérii pro buněčnou léčbu byla přítomnost zhoubného nádoru, těžké hematologické abnormality, hluboká žilní trombóza v posledních 6 měsících, neléčená proliferativní retinopatie, výrazný otok končetiny nebo závažná infekce nohy s vysokým rizikem amputace.
Studie byla schválena lokální etickou komisí (Etická komise IKEM a Thomayerovy nemocnice) a všichni pacienti podepsali informovaný souhlas se zařazením do studie.
MR spektroskopie
MRS vyšetření byla provedena 1 den před revaskularizací a 3 měsíce po ní za použití celotělového 3T MR systému (TRIO, Siemens, Erlangen, Německo) vybaveného pedálním ergometrem, s 1H/31P cívkou (Rapid Biomedical, Německo). Pacienti i zdraví dobrovolníci byli vyšetřeni v poloze na zádech s cívkou fixovanou pod m. gastrocnemius. MRS vyšetření bylo rozděleno na fázi klidovou (2 min), fázi zátěžovou (6 min) a recovery fázi (6 min). Během zátěžové fáze vyšetřovaný subjekt prováděl plantární flexi 1krát za 2 s se standardizovanou zátěží 7,3 kg.
Analýza 31P MR spekter
Metodika je podrobně popsána v předchozí studii [16]. Ve stručnosti, MRS parametry charakterizující metabolizmus lýtkového svalu v klidu byly definovány jako poměry intenzity signálu PCr, Pi, PDE a ATP k celkové sumě intenzit signálu fosforových metabolitů ve 31P MR spektru. Dále byla stanovena hodnota pH na základě chemického posunu PCr a Pi. Zátěžové MRS parametry (pokles PCr, mitochondriální kapacita Qmax, recovery time PCr) a pH na konci zátěže byly vypočítány ze spekter změřených na konci zátěže a v recovery fázi.
Klinický efekt revaskularizace byl ověřen měřením TcPO2 standardizovanou metodou na přístroji TCM400 (Radiometer Medical ApS, Aarhus, Dánsko).
Statistická analýza
Pro statistickou analýzu byly použity Studentův t-test, Mannův-Whitneyho U test a ANOVA test. Za statisticky signifikantní byly považovány hodnoty p < 0,05.
Výsledky
Hodnoty klidových MRS parametrů u pacientů se SDN a CLI před revaskularizací ve srovnání se zdravými kontrolami znázorňuje tab. 2. Pacienti se SDN a CLI měli v klidu před léčbou zejména signifikantně nižší poměr PCr/Pi (p < 0,001) ve srovnání se zdravými dobrovolníky; tento výsledek ukazuje na významné poškození klidového metabolizmu svalových buněk u pacientů se SDN a CLI. Dále jsme u těchto pacientů pozorovali signifikantně vyšší pH (p = 0,005) v porovnání se zdravými kontrolami.
Table 2. Porovnání parametrů MRS lýtkových svalů mezi pacienty se SDN a CLI a zdravými dobrovolníky – v klidu 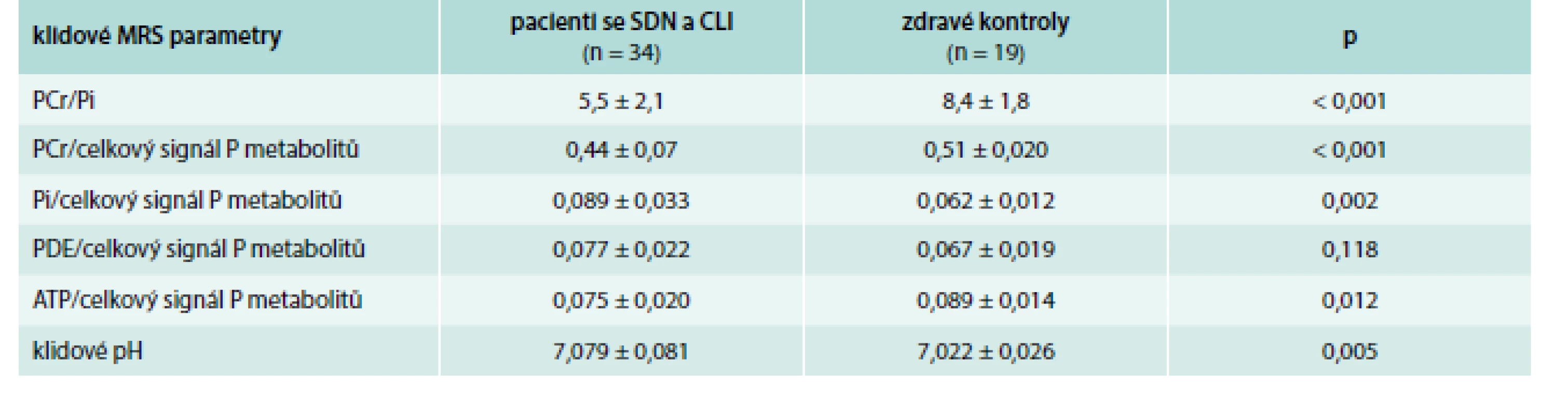
Počet pacientů s hodnotitelným zátěžovým MRS vyšetřením byl redukován z důvodu obtíží při cvičení kvůli přítomnosti rozsáhlých defektů, nízkých amputací nebo rychlé únavě. U podskupiny pacientů, kteří byli schopni cvičit, jsme pozorovali signifikantně menší mitochondriální kapacitu a prolongovaný návrat PCr k výchozím klidovým hodnotám (tab. 3) ve srovnání se zdravými kontrolami.
Table 3. Porovnání parametrů MRS lýtkových svalů mezi pacienty se SDN a CLI a zdravými dobrovolníky – při zátěži 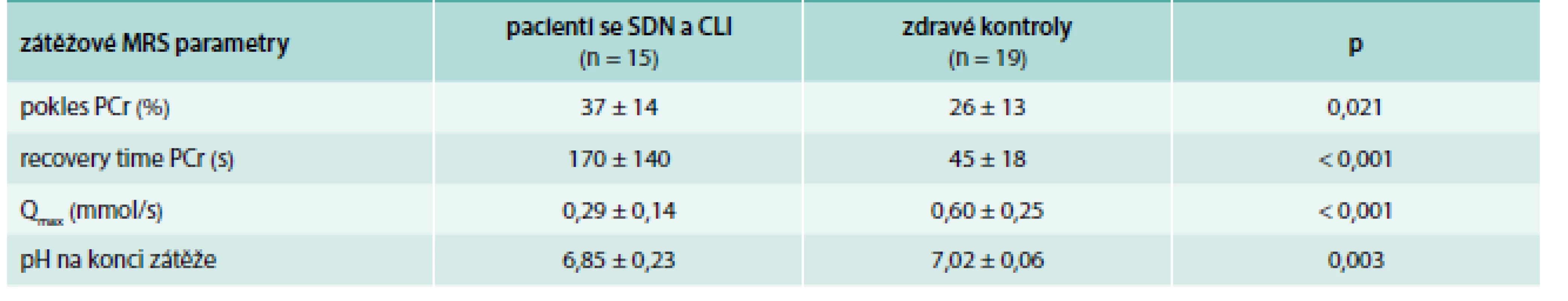
Klidové MRS parametry se však u pacientů se SDN a CLI před a po revaskularizaci signifikantně nezměnily (tab. 4). V individuálních případech došlo po revaskularizaci ke zlepšení zátěžových MRS parametrů (Qmax, τPCr), jak je zřejmé z grafu 2.
Table 4. Porovnání parametrů MRS lýtkových svalů u pacientů se SDN a CLI před a po revaskularizaci 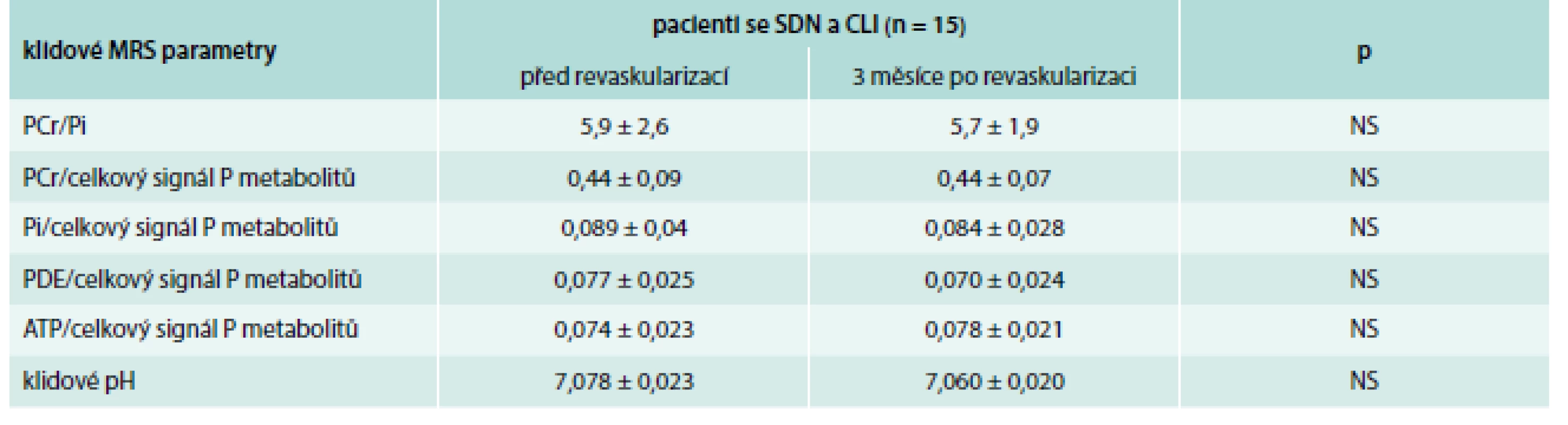
Graph 2. Změny zátěžových parametrů MRS lýtkových svalů u pacienta po revaskularizaci. 
Po revaskularizaci došlo u pacienta k rychlejšímu návratu PCr k výchozím hodnotám (recovery fáze je proložena exponenciální křivkou, ze které se určuje recovery time PCr) Efekt revaskularizace byl potvrzen signifikantním vzestupem hodnot TcPO2 3 měsíce po revaskularizaci (z 26,4 ± 11,7 na 39,7 ± 17,7 mm Hg, p < 0,005), nepozorovali jsme však korelaci mezi MRS parametry a hodnotami TcPO2.
Diskuse
Výsledky naší pilotní studie ukazují porušený energetický metabolizmus lýtkových svalů u pacientů se SDN a CLI ve srovnání se zdravými kontrolami již v klidové fázi. Pacienti se SDN a CLI měli signifikantně nižší poměr fosfokreatinu k anorganickému fosfátu ve srovnání se zdravými kontrolami. Tyto změny v parametrech klidového metabolizmu u pacientů s diabetem jsou obdobné jako u nálezů pacientů s onemocněními svalů, např. myopatiemi nebo dystrofiemi; u chlapců s Duchenneovou svalovou dystrofií byl rovněž pozorován nižší poměr PCr/Pi ve srovnání se zdravými kontrolami [17]. Diabetes může vést ke snížení mitochondriální kapacity, snížené kapilarizaci, svalové atrofii, chronickému prozánětlivému stavu a vyššímu oxidativnímu stresu [18]. Navíc se může uplatňovat i negativní vliv dlouhodobého odlehčení končetiny, které je součástí léčby syndromu diabetické nohy. Pacienti s dlouhodobě se nehojícím defektem minimálně zatěžují končetinu, což může vést ke svalové atrofii a změněné aktivitě mitochondrií.
Chronická hypoperfuze končetin u ICHDK se také podílí na získané svalové myopatii, která je charakterizovaná nedostatečnou funkcí mitochondriálních enzymů, vyšším výskytem mutací mitochondriální DNA, zvýšeným oxidativním stresem a porušenou regulací mitochondriální respirace [19,20].
Na začátku zátěže není počáteční rychlost oxidativního ani anaerobního metabolizmu schopna pokrýt zvýšené energetické nároky svalu vzniklé v důsledku úbytku adenozintrifosfátu (ATP), který je štěpen ATPázou v myofibrilách a jenž slouží jako zdroj energie pro svalovou kontrakci. Proto dochází k hydrolýze fosfokreatinu (PCr), který představuje bezprostředně využitelnou energetickou rezervu svalu. Tato počáteční fáze je na začátku cvičení charakterizována progresivním poklesem zásob PCr. Svalová zátěž zároveň vede ke zvýšení krevního průtoku na úrovni mikrocirkulace za účelem dostatečného zásobení svalu kyslíkem a dochází k nahrazení anaerobní glykolýzy, která v mezidobí vyrovnávala pokles PCr. Jakmile zásobení kyslíkem stoupne, nastává aerobní fáze charakterizovaná tvorbou ATP oxidativní fosforylací, která probíhá v mitochondriích. V této fázi hydrolýza PCr dospěje do ustáleného stavu graf 1 [21,22].
Rychlost a míra poklesu PCr je závislá na velikosti zátěže, ekonomice kontrakcí (efektivitě spotřeby ATP) a odráží úvodní část kyslíkového deficitu. Pro hodnocení oxidativních možností svalu je však nejdůležitější vývoj PCr po skončení zátěže, protože v této fázi tvoří sval ATP pouze pomocí oxidativní fosforylace. Recovery time PCr charakterizuje čas, který je potřeba k obnově původních klidových zásob fosfokreatinu (resyntéza PCr je odrazem refosforylace PCr, respektive tvorby ATP).
Při hodnocení zátěžových MRS parametrů jsme u pacientů se SDN a CLI pozorovali prodloužený recovery time PCr a významně sníženou mitochondriální kapacitu ve srovnání se zdravými kontrolami. Produkce ATP v buňkách je nedostatečná a návrat PCr k výchozímu stavu je u pacientů se SDN a CLI prodloužen. Snížená mitochondriální kapacita je odrazem porušené funkce mitochondrií, resp. aktivity jejich enzymů a nedostatečného zásobení svalu kyslíkem, které se při zátěži ještě zdůrazní. Předchozí studie MRS lýtkových svalů prokázaly, že obnovení zásob PCr u pacientů s ICHDK je po svalovém cvičení prodlouženo ve srovnání se zdravými kontrolami [8,23], což je v souladu s našimi výsledky. Greiner et al studovali energetický metabolizmus lýtkových svalů u zdravých dobrovolníků a jeho změnu při simulaci stenózy za použití manžety během cvičení s postupně se zvyšující zátěží. Výsledky jeho studie ukázaly, že omezený krevní průtok v důsledku periferní stenózy vedl během cvičení k prodloužení recovery time PCr, poklesu PCr a pH a vzestupu Pi [21]. Jedním z možných vysvětlení je mitochondriální dysfunkce u pacientů s ICHDK v důsledku chronické ischemie a nedostatečného zásobení kyslíkem z důvodu sníženého prokrvení končetin.
Efekt revaskularizace byl v naší studii potvrzen signifikantním zvýšením hodnot TcPO2, se kterými však sledované MRS parametry nekorelovaly. Nepozorovali jsme signifikantní rozdíly klidových MRS parametrů před a po revaskularizaci, a to ani ve skupině léčené ACT, ani v PTA skupině. Pouze v individuálních případech jsme zaznamenali zlepšení zátěžových MRS parametrů po revaskularizaci podobně jako v předchozí studii [24], ovšem pouze několik pacientů bylo schopno cvičení; tento nález je třeba ověřit na větším počtu pacientů. Tyto výsledky svědčí pro přetrvávající porušený svalový energetický metabolizmus v důsledku přítomnosti myopatie u diabetiků, který poměrně časně po revaskularizaci nereflektuje aktuální změny mikrocirkulace a makrocirkulace.
Diskutabilním nálezem je vyšší klidové pH u pacientů se SDN a CLI ve srovnání se zdravými kontrolami. Intracelulární pH odráží množství hydrolyzovaného ATP v myofibrilách během svalové zátěže a stupeň ATP syntézy v mitochondriích. Možným vysvětlením pro nález paradoxně vyššího klidového pH u pacientů se SDN a CLI je adaptační mechanizmus, kterým se sval „brání“ proti většímu okyselení při zátěži. Další možnou příčinou vedoucí k vyššímu klidovému pH je poškození buněk – intracelulární pH je nižší než pH extracelulárního prostředí, při destrukci buněk u pacientů se SDN a CLI může být tedy pH měřené v celém objemu tkáně vyšší. Přítomnost edému se rovněž může podílet na vyšším pH v důsledku měření vyššího fosforového signálu z intersticiálního prostředí, v němž je fyziologicky vyšší pH než intracelulárně. Na konci cvičení však měli pacienti se SDN a CLI signifikantně nižší pH než zdravé kontroly, což odpovídá našemu předpokladu vlivu ischemie a diabetu na zátěž u těchto pacientů [25]. Pokles pH během cvičení je důsledkem hydrolýzy fosfokreatinu, vzestupu anorganického fosfátu a nedostatečné tvorby ATP během glykolýzy. Acidóza může navíc prodlužovat recovery time PCr, který je odrazem refosforylace PCr, a také může redukovat mitochondriální kapacitu (Qmax), protože vodíkové ionty při nižším pH inhibují oxidativní fosforylaci [26].
Hlavní limitací naší studie byl relativně malý soubor pacientů a krátká doba sledování. Výraznou limitací je rovněž omezená schopnost cvičení pacientů se SDN a CLI a obtížná standardizace zátěže ovlivňující interpretaci zátěžových MRS parametrů. Je možné, že efekt revaskularizace by se projevil v MRS parametrech až v delším časovém odstupu od výkonu, kdy může dojít k reparaci funkce mitochondrií [24].
Závěr
V naší studii jsme prokázali význam MRS lýtkových svalů při hodnocení končetinové ischemie a svalového energetického metabolizmu u pacientů se SDN a CLI ve srovnání se zdravými kontrolami. V této pilotní studii jsme však nezaznamenali signifikantní změnu MRS parametrů po revaskularizaci. Přínos MRS v hodnocení efektu revaskularizace je nutné ověřit v dlouhodobějších studiích vzhledem k možnosti přetrvávání myopatických změn ovlivňujících svalový energetický metabolizmus.
Podpořeno Grantovou agenturou Univerzity Karlovy v Praze, projekt č. 16415, a MZO 00023001
MUDr. Andrea Němcová
andrea.nemc@gmail.com
Centrum diabetologie IKEM, Praha
www.ikem.cz
Doručeno do redakce 6. 3. 2017
Přijato po recenzi 29. 3. 2017
Sources
1. Hinchliffe RJ, Brownrigg JR, Apelqvist J et al. IWGDF guidance on the diagnosis, prognosis and management of peripheral artery disease in patients with foot ulcers in diabetes. Diabetes Metab Res Rev 2016; 32(Suppl 1): 37–44. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.2698>.
2. Dua A, Desai SS, Kumar N et al. Epidemiology and treatment strategies of iliac vein thrombophlebitis. Vascular 2015; 23(6): 599–601. Dostupné z DOI: <http://dx.doi.org/10.1177/1708538114565693>.
3. Brownrigg JR, Schaper NC, Hinchliffe RJ. Diagnosis and assessment of peripheral arterial disease in the diabetic foot. Diabet Med 2015; 32(6): 738–747. Dostupné z DOI: <http://dx.doi.org/10.1111/dme.12749>.
4. Benitez E, Sumpio BJ, Chin J et al. Contemporary assessment of foot perfusion in patients with critical limb ischemia. Semin Vasc Surg 2014; 27(1): 3–15. Dostupné z DOI: <http://dx.doi.org/10.1053/j.semvascsurg.2014.12.001>.
5. Liu Y, Xu Y, Fang F et al. Therapeutic Efficacy of Stem Cell-based Therapy in Peripheral Arterial Disease: A Meta-Analysis. PLoS One 2015; 10(4): e0125032. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0125032>.
6. Tomesova J, Gruberova J, Broz P et al. Methods of skin microcirculation assessment. Vnitř Lék 2013; 59(10): 895–902.
7. Prompers JJ, Jeneson JA, Drost MR et al. Dynamic MRS and MRI of skeletal muscle function and biomechanics. NMR Biomed 2006; 19(7): 927–953.
8. Isbell DC, Berr SS, Toledano AY et al. Delayed calf muscle phosphocreatine recovery after exercise identifies peripheral arterial disease. J Am Coll Cardiol 2006; 47(11): 2289–2295.
9. Greiner A, Esterhammer R, Messner H et al. High-energy phosphate metabolism during incremental calf exercise in patients with unilaterally symptomatic peripheral arterial disease measured by phosphor 31 magnetic resonance spectroscopy. J Vasc Surg 2006; 43(5): 978–986.
10. Cree-Green M, Newcomer BR, Brown MS et al. Delayed skeletal muscle mitochondrial ADP recovery in youth with type 1 diabetes relates to muscle insulin resistance. Diabetes 2015; 64(2): 383–392. Dostupné z DOI: <http://dx.doi.org/10.2337/db14–0765>.
11. Petersen KF, Dufour S, Befroy D et al. Impaired mitochondrial activity in the insulin-resistant offspring of patients with type 2 diabetes. N Engl J Med 2004; 350(7): 664–671.
12. Fetterman JL, Holbrook M, Westbrook DG et al. Mitochondrial DNA damage and vascular function in patients with diabetes mellitus and atherosclerotic cardiovascular disease. Cardiovasc Diabetol 2016; 15 : 53. Dostupné z DOI: <http://dx.doi.org/10.1186/s12933–016–0372-y>.
13. Norgren L, Hiatt WR, Dormandy JA et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg 2007; 33(Suppl 1): S1-S75.
14. Graziani L, Silvestro A, Bertone V et al. Vascular involvement in diabetic subjects with ischemic foot ulcer: a new morphologic categorization of disease severity. Eur J Vasc Endovasc Surg 2007; 33(4): 453–460.
15. Dubsky M, Jirkovska A, Bem R et al. Comparison of the effect of stem cell therapy and percutaneous transluminal angioplasty on diabetic foot disease in patients with critical limb ischemia. Cytotherapy 2014; 16(12): 1733–1738. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcyt.2014.08.010>.
16. Sedivy P, Kipfelsberger MC, Dezortova M et al. Dynamic 31P MR spectroscopy of plantar flexion: influence of ergometer design, magnetic field strength (3 and 7 T), and RF-coil design. Med Phys 2015; 42(4): 1678–1689. Dostupné z DOI: <http://dx.doi.org/10.1118/1.4914448>.
17. Torriani M, Townsend E, Thomas BJ et al. Lower leg muscle involvement in Duchenne muscular dystrophy: an MR imaging and spectroscopy study. Skeletal Radiol 2012; 41(4): 437–445. Dostupné z DOI: <http://dx.doi.org/10.1007/s00256–011–1240–1>.
18. D‘Souza DM, Al-Sajee D, Hawke TJ. Diabetic myopathy: impact of diabetes mellitus on skeletal muscle progenitor cells. Front Physiol 2013; 4 : 379. Dostupné z DOI: <http://dx.doi.org/10.3389/fphys.2013.00379>.
19. Brass EP, Hiatt WR. Acquired skeletal muscle metabolic myopathy in atherosclerotic peripheral arterial disease. Vasc Med 2000; 5(1): 55–59.
20. Pipinos II, Judge AR, Selsby JT et al. The myopathy of peripheral arterial occlusive disease: part 1. Functional and histomorphological changes and evidence for mitochondrial dysfunction. Vasc Endovascular Surg 2007; 41(6): 481–489. Dostupné z DOI: <http://dx.doi.org/10.1177/1538574407311106>.
21. Greiner A, Esterhammer R, Bammer D et al. High-energy phosphate metabolism in the calf muscle of healthy humans during incremental calf exercise with and without moderate cuff stenosis. Eur J Appl Physiol 2007; 99(5): 519–531.
22. Schocke MF, Esterhammer R, Kammerlander C et al. High-energy phosphate metabolism during incremental calf exercise in humans measured by 31 phosphorus magnetic resonance spectroscopy (31P MRS). Magn Reson Imaging 2004; 22(1): 109–115.
23. Tecilazich F, Dinh T, Lyons TE et al. Postexercise phosphocreatine recovery, an index of mitochondrial oxidative phosphorylation, is reduced in diabetic patients with lower extremity complications. J Vasc Surg 2013; 57(4): 997–1005. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jvs.2012.10.011>.
24. West AM, Anderson JD, Epstein FH et al. Percutaneous intervention in peripheral artery disease improves calf muscle phosphocreatine recovery kinetics: a pilot study. Vasc Med 2012; 17(1): 3–9. Dostupné z DOI: <http://dx.doi.org/10.1177/1358863X11431837>.
25. Jirkovska A. Diabetic foot syndrome from the perspective of internist educated in podiatry. Vnitř Lék 2016; 62(Suppl 4): 42–47.
26. Jubrias SA, Crowther GJ, Shankland EG et al. Acidosis inhibits oxidative phosphorylation in contracting human skeletal muscle in vivo. J Physiol 2003; 553(Pt 2): 589–599.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 4-
All articles in this issue
- Syndrom diabetické nohy: význam MR spektroskopie lýtkových svalů pro hodnocení končetinové ischemie a efektu revaskularizace
- Kontroverze okolo QALY
-
Význam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část II - Novinky v léčbě srdečního selhání
- AT1 blokátory – srovnatelnost kardioprotektivity s inhibitory ACE
- Jak (s)tvořit spolupracujícího pacienta pro antihypertenzní a hypolipidemickou léčbu
- Relabující autoimunitní pankreatitida 1. typu: kazuistika
- Histiocytóza z indeterminovaných buněk – vymizení kožní infiltrace po ozáření elektronovým svazkem a aplikace 2-chlorodeoxyadenozinu: kazuistika
- Antikoagulační terapie dabigatranem vs rivaroxabanem u seniorů ve věku nad 65 let: porovnání dat „head to head“
- Gender and Coronary Artery Disease – a challenge for the 21st century
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Relabující autoimunitní pankreatitida 1. typu: kazuistika
- Kontroverze okolo QALY
- Novinky v léčbě srdečního selhání
- AT1 blokátory – srovnatelnost kardioprotektivity s inhibitory ACE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

