-
Medical journals
- Career
Strategie léčby diabetu 2. typu při selhání léčby metforminem používané českými lékaři nebo v České republice
Authors: Štěpán Svačina 1; Petra Ovesná 2; Matyáš Kuhn 2; Martina Nováčková 2
Authors‘ workplace: III. interní klinika 1. LF UK a VFN Praha 1; Institut biostatistiky a analýz, s. r. o., Brno 2
Published in: Vnitř Lék 2017; 63(10): 647-657
Category: Original Contributions
Overview
Úvod:
Diabetes mellitus 2. typu (DM2T) představuje při rostoucí prevalenci a zvyšujícím se výskytu chronických komplikací závažný zdravotní problém. Nová ADA/EASD doporučení, stejně jako doporučení České diabetologické společnosti České lékařské společnosti J. E. Purkyně, zdůrazňují individuální přístup k léčbě diabetiků 2. typu. Cílem léčby je dosažení a udržení optimální kompenzace diabetu, prevence a léčba akutních a chronických komplikací a snížení mortality. V současné době se léčba diabetu zahajuje, kromě dietních a režimových opatření, metforminem. Vzhledem k progresivnímu charakteru onemocnění je nutné obvykle léčbu brzy intenzifikovat přidáním dalších antidiabetik.Cíl:
Studie byla zaměřena právě na průzkum užití léčebného algoritmu DM2T v ČR u pacientů nedostatečně kompenzovaných monoterapií metforminem. Sekundárními cíli bylo popsat úroveň kompenzace diabetu v čase a vývoj složek metabolického syndromu u sledovaných léčebných kombinací.Metodika a výsledky:
Na souboru 1 516 pacientů bylo zjištěno, že nejčastějšími antidiabetiky přidanými k metforminu, byly glifloziny a gliptiny, které byly podány u 33 %, resp. 28 % pacientů ihned při vstupu do studie a jejich zastoupení dále narůstalo. Medián HbA1c byl při vstupu 65 mmol/mol, nejvyššího poklesu bylo dosaženo u pacientů léčených inkretinovými analogy v kombinaci s metforminem, z nichž 89 % mělo po 12 měsících léčby hodnoty HbA1c < 60 mmol/mol.Závěr:
Studie ukázala, že léky volené u nás v léčbě diabetu 2. typu ve 2. kroku po metforminu jsou velmi účinné nejen na kompenzaci diabetu, ale i na snížení hmotnosti a příznivě ovlivňují i krevní tlak a lipidy. Léčba kombinací metforminu s glifloziny, gliptiny či inkretinovými analogy je nejúčinnější léčbou při nedostatečném efektu metforminu.Klíčová slova:
diabetes mellitus 2. typu – glifloziny – gliptiny – inkretinová analoga – selhání léčby metforminemÚvod
Diabetes mellitus 2. typu (DM2T) je komplexní metabolická porucha, při níž není organizmus schopen v důsledku relativního nedostatku inzulinu, v pozdějších stadiích po vyčerpání B-buněk pankreatu i absolutního nedostatku, zpracovávat glukózu tak jako za fyziologických podmínek a také v důsledku současné periferní inzulinové rezistence [1]. DM2T je ve velkém procentu spojen s přítomností obezity (viscerální), arteriální hypertenze, dyslipidemie a hyperurikemie.
Prevalence i incidence diabetu 2. typu celosvětově narůstá, což souvisí s nárůstem obezity a změnou životního stylu. Diabetes 2. typu zůstává hlavní příčinou kardiovaskulárních poruch, slepoty, renálního selhání, amputací a hospitalizací obecně. Je však také asociován se zvýšeným rizikem vzniku malignit, psychických poruch, poruch kognitivních funkcí, chronických jaterních onemocnění a dalších postižení, často život ohrožujících [2]. Efektivní léčba diabetu je tedy velmi důležitá.
Více než polovina případů mortality a velká část případů morbidity diabetiků souvisí s kardiovaskulárními onemocněními. Za hlavní příčinu mikrovaskulárních poruch u pacientů s DM2T je považována chronická hyperglykemie. Hyperglykemie se měří pomocí glykovaného hemoglobinu (HbA1c). Hlavním cílem terapie je tedy snížení HbA1c a dosažení jeho hodnoty < 53 mmol/mol [3]. Ta obvykle zajišťuje také prevenci kardiovaskulárních komplikací a brání rovněž progresi poškození ledvin [4,5].
Možnosti léčby
Léčba se standardně zahajuje úpravou životního stylu zahrnující zařazení pravidelné fyzické aktivity [6] a úpravu jídelníčku, vždy na míru danému pacientovi [7], čímž lze u pacientů s mírnou hyperglykemií dosáhnout kontroly hladiny glukózy. U pacientů s vyšší hladinou HbA1c nebo u těch, u kterých nelze očekávat pozitivní efekt změny životního stylu, by měla být zahájena farmakoterapie bezprostředně po stanovení diagnózy, přičemž později může být tato léčba modifikována [2].
V současné době je ke klinickému použití registrována řada antidiabetik, která efektivně snižují hladiny krevního cukru a HbA1c a která se navzájem odlišují např. svým bezpečnostním profilem. Terapie diabetu 2. typu se nejčastěji zahajuje monoterapií metforminem s postupnou eskalací dávky. Metformin funguje zejména na principu snížení inzulinové rezistence, a tak přispívá ke snížení zejména glykemie nalačno. Vzhledem k účinnému působení na hladinu glukózy, bezpečnosti, ceně a skutečnosti, že nezpůsobuje nárůst hmotnosti pacienta, a také vzhledem k příznivému ovlivňování kardiovaskulárních parametrů je metformin lékem první volby při léčbě diabetu 2. typu. Vzhledem k progresivnímu charakteru onemocnění je však nutné léčbu brzy intenzifikovat přidáním dalších antidiabetik (deriváty sulfonylurey, glinidy, glitazony, inhibitory střevních α-glukozidáz, gliptiny, inkretinová analoga, glifloziny, inzulin).
Deriváty sulfonylurey
Nejstarší perorálně užívanou skupinou léků jsou deriváty sulfonylurey, které stimulují sekreci inzulinu, a tak působí především na snížení postprandiální glykemie. Jejich nevýhodou je riziko hypoglykemií a nárůst hmotnosti pacienta. Stejný mechanizmus účinku mají rovněž glinidy.
Glitazony
Glitazony (thiazolidindiony – TZD) zvyšují inzulinovou senzitivitu působením na jaderné receptory. Užívají se rovněž v kombinaci s metforminem. Nezvyšují riziko hypoglykemií, avšak jejich nežádoucím účinkem je zvýšený výskyt srdečního selhání [8], nárůst hmotnosti a zvýšené riziko zlomenin, převážně u žen [9].
Inzuliny
Léčba inzulinem u diabetiků 2. typu má svá specifika vzhledem k postupné supresi sekrece inzulinu B-buňkami, a tedy potřebě několikanásobně zvýšenému dávkování inzulinu. Zároveň je třeba mít na zřeteli anabolický efekt inzulinu, který vede k nárůstu hmotnosti, což je zrovna u DM2T obzvlášť nevhodné. Také inzulinoterapie se kombinuje s léčbou metforminem [13].
Glifloziny
Glifloziny inhibují transportér SGLT2 v proximálním tubulu nefronu, čímž blokují zpětné vstřebávání glukózy a zvyšují glykosurii [10]. Dochází tedy k posunu ledvinného prahu pro glukózu a snížení glykemie, v kterékoli fázi onemocnění. Zvýšené ztráty glukózy vedou k úbytku energie a snížení hmotnosti pacienta, jejich další výhodou je snížení systolického a diastolického tlaku.
Inkretiny
Mezi nejmodernější patří inkretinová terapie. Funguje na principu zvýšení sekrece inzulinu, inhibuje glukagon. Působí jen při hyperglykemii, při normoglykemii se její efekt neuplatňuje, nemá tedy na rozdíl od sulfonylurey výskyt hypoglykemií. Existují 2 formy podávání. Perorální inhibitory dipeptidyl-peptidázy-4 (Dipeptidyl Peptidase 4 – DPP4) blokující enzym, který inaktivuje endogenní inkretiny, jsou méně účinné než analoga inkretinů, ale jsou levnější a aplikovatelné perorálně. Druhým typem jsou injekčně aplikovaná inkretinová analoga, jedním z několika u nás užívaných je GLP1, jehož nezanedbatelným efektem je také pokles hmotnosti. Inkretiny jsou tedy obzvlášť vhodné v kombinaci s metforminem k léčbě obézních diabetiků. Jsou velice účinné, bezpečné, ale drahé [11,12].
Doporučení
V případě nedostatečné kompenzace diabetu monoterapií metforminem během asi 3–6 měsíců léčby doporučuje Americká diabetická asociace (American Diabetes Association – ADA), Evropská asociace pro výzkum diabetu (European Association for the Study of Diabetes – EASD) i Česká diabetologická společnost (ČDS) České lékařské společnosti J. E. Purkyně zahájit terapii kombinací metforminu s dalším lékem [2,14,15]. Evropská ani americká doporučení nedefinují pořadí preferencí jednotlivých léčiv. Obecně lze konstatovat, že užití léků z jakékoli skupiny musí vyhovovat ve smyslu snižování hladiny glukózy, eliminaci rizika vedlejších účinků, využití „vedlejších“ benefitů léčby, ceny a dalších praktických aspektů, jako je četnost a způsob podávání či požadovaná četnost kontroly hladiny glukózy [14]. Shrnutí těchto informací uvádí tab. 1. ČDS při volbě farmak doporučuje dávat přednost bezpečným antidiabetikům s nízkým rizikem hypoglykemií (metformin, gliptiny, agonisté GLP1 receptorů, glifloziny) [15].
Table 1. Přehled základních vlastností metforminu a jeho kombinací s dalšími antidiabetiky. 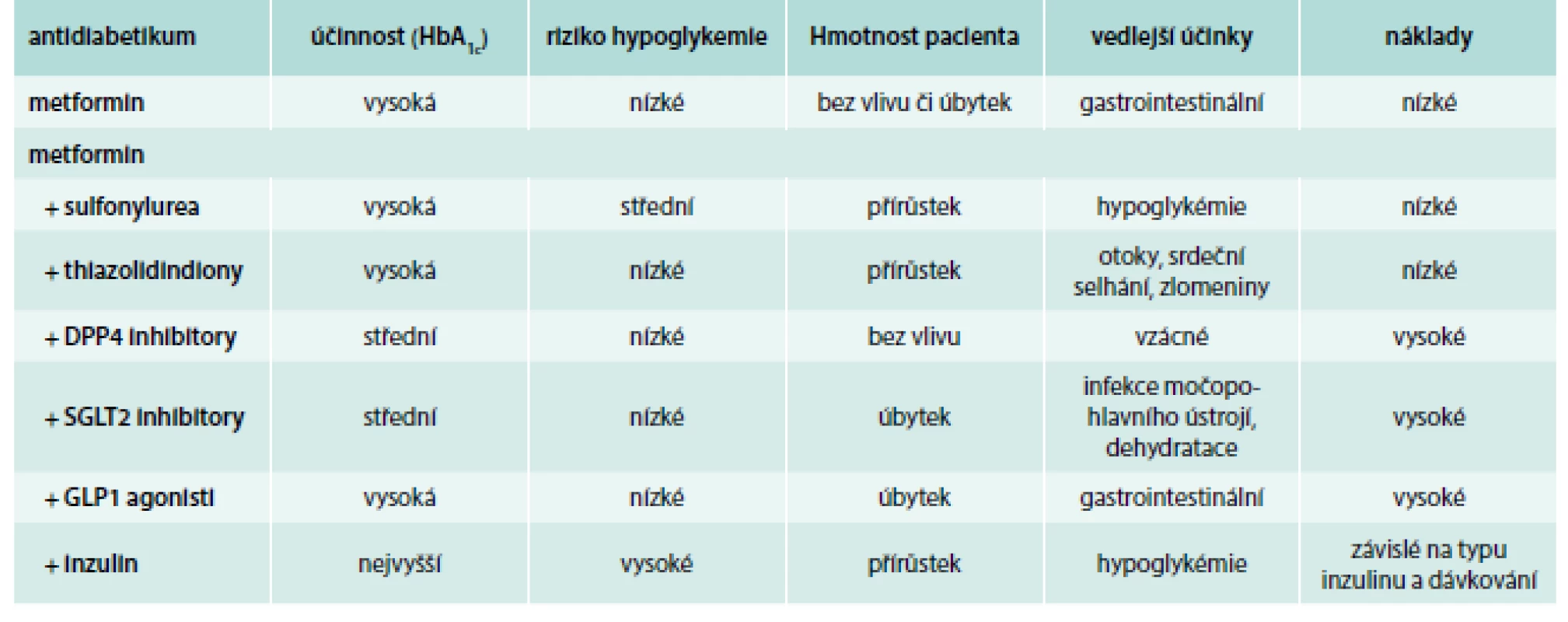
Upraveno podle [14] Ve srovnání s dlouhodobě používanými perorálními antidiabetiky, jako je metformin nebo deriváty sulfonylurey, existuje zatím poměrně málo dat o skupině léků, které byly uvedeny na trh v posledních letech (DPP4 inhibitory, GLP1 agonisté, SGLT2 inhibitory).
V současnosti stále chybí dostatek údajů k pochopení charakteristiky pacienta, u nějž selhává antidiabetická léčby v první linii léčby. Pro dosažení požadované kompenzace glykemie, zlepšení kvality života pacientů a pochopení dosud nenaplněných potřeb pacientů s DM2T, u nichž je nutná změna první linie léčby, je nezbytné porozumět léčebné strategii, kterou je třeba u těchto pacientů volit.
Design, sledovaná populace, metody
Za účelem získání dostatečných dat pro vyhodnocení studie byl proveden multicentrický retrospektivně-prospektivní průzkum léčby DM2T. Do studie bylo zapojeno 122 ambulantních lékařů z České republiky se specializací internista diabetolog. Údaje o pacientech byly sbírány v elektronické databázi v období od 1. 11. 2015 do 31. 3. 2017. Při vstupu byly zaznamenány sledované parametry u pacientů léčených metforminem v monoterapii minimálně po dobu 3 měsíců, u kterých nebyl DM2T dostatečně kompenzován, a bylo nutné upravit dosavadní léčbu. Pacienti byli sledováni každé 3 měsíce po dobu 1 roku.
Pacienti zařazení do studie museli splnit všechna vstupní kritéria, kterými byly: věk alespoň 18 let a diagnóza DM2T dle ČDS České lékařské společnosti J. E. Purkyně [16], tj.
- přítomnost klinické symptomatologie provázené náhodnou glykemií > 11,0 mmol/l a následně glykemií v žilní plazmě nalačno ≥ 7,0 mmol/l (stačí jedno stanovení)
- při nepřítomnosti klinických projevů a nálezu glykemie v žilní plazmě nalačno ≥ 7,0 mmol/l po 8hodinovém lačnění (ověřit alespoň 2krát)
- nález glykemie v žilní plazmě za 2 hod při oGTT > 11,0 mmol/l
- PPG + klinické příznaky DM ≥ 11,1 mmol/l; monoterapie metforminem minimálně 3 měsíce a HbA1c > 53 mmol/mol
Naopak vyloučeni byli pacienti s kterýmkoli z kritérií: nesouhlas pacienta se zařazením do studie, diabetes mellitus 1. typu, gravidita, klinicky významné nedostatečně kompenzované onemocnění štítné žlázy, závažné onemocnění jater či ledvin, onkologické onemocnění, medikace kortikosteroidy nebo antipsychotiky nebo jakákoliv jiná medikace pro DM2T odlišná od metforminu při vstupu do studie nebo v minulosti.
Za účelem studie byla sbírána retrospektivně-prospektivní data, charakter sledování byl čistě observační, neintervenční, volba léčivého přípravku tak byla plně v kompetenci ošetřujícího lékaře. Výsledky tak popisují běžnou klinickou praxi. V rámci studie nebyl sledován konkrétní léčivý přípravek ani nebyla podporována či upřednostňována preskripce žádného léčivého přípravku.
Primárním cílem studie bylo získat informace o postupech léčby DM2T u pacientů nedostatečně kompenzovaných monoterapií metforminem.
Sekundárními cíli bylo popsat, jakým způsobem ovlivňují jednotlivé lékové skupiny přidané k metforminu hladinu HbA1c a dalších složek metabolického syndromu, jako jsou BMI, hmotnost, krevní tlak a hladina lipidů.
S ohledem na charakter studie byly použity metody deskriptivní statistiky běžně používané v epidemiologických studiích. Při analýze demografických údajů a základních charakteristik pacientů byla data popsána v případě kategorických proměnných jejich absolutními a relativními četnostmi, v případě spojitých proměnných pak mediánem a 5.–95. percentilem vzhledem k nenormálnímu rozložení dat.
Statistické testování zastoupení medikace v po sobě následujících kontrolách bylo provedeno párovým McNemarovým testem. Pokud bylo zapotřebí mnohonásobné testování (testováno několik kontrolních návštěv, přičemž v každém testováno několik různých léčiv), byly výsledky testů korigovány Bonferroniho korekcí.
Testování bylo provedeno na hladině významnosti α = 0,05, všechny testy byly vedeny jako oboustranné. Analýzy byly provedeny ve statistickém softwaru SAS software, verze 9.4.
Data vstupující do analýzy byla validována pomocí vstupních a vylučovacích kritérií. Všichni pacienti museli mít zaznamenanou vstupní návštěvu. Do analýzy byly dále zařazeny pouze návštěvy pacientů, které byly v rozmezí 3 měsíce ± 14 dnů od návštěvy předchozí. Počty pacientů v hodnocených časových oknech tedy nejsou shodné, vždy zahrnují pacienty splňující podmínky pro analýzu v daném měsíci.
Výsledky
V rámci studie byly sesbírány údaje o celkem 1 646 pacientech, z nichž 130 pacientů nesplňovalo vstupní kritéria. Analýze tedy bylo podrobeno 1 516 pacientů (schéma). Po vyřazení pacientů, kteří již ukončili léčbu metforminem a/nebo k dané návštěvě nedošlo v termínu 3 měsíce ± 14 dnů od návštěvy předchozí, bylo při hodnocení kontrolních návštěv po 3 měsících analyzováno 967 pacientů, po 6 měsících 955 pacientů, po 9 měsících 891 pacientů a po 12 měsících 829 pacientů.
Schéma. Struktura pacientů ve studii 
Vstupní údaje
Z hodnocených 1 516 pacientů tvořily 642 (42,3 %) ženy a 874 (57,7 %) muži. Věk pacientů byl v mediánu 61 let (5.–95. percentil: 42–76 let). Medián doby trvání DM2T byl při vstupu 5,1 let, avšak variabilita byla velmi velká (5.–95. percentil: 0,6–17,3 let). Další charakteristiky souboru pacientů jsou uvedeny v tab. 2. Medián HbA1c při vstupním vyšetření při monoterapii metforminem činil 65 mmol/mol (5.–95. percentil 56–90 mmol/mol); medián glykemie na lačno (FPG) byl 8,5 mmol/l a postprandiální glykemie (PPG) 11,0 mmol/l. Další laboratorní hodnoty pacientů při vstupu jsou sumarizovány v tab. 3.
Table 2. Demografické údaje a charakteristiky pacientů při vstupu do studie (medián, 5.–95. percentil) 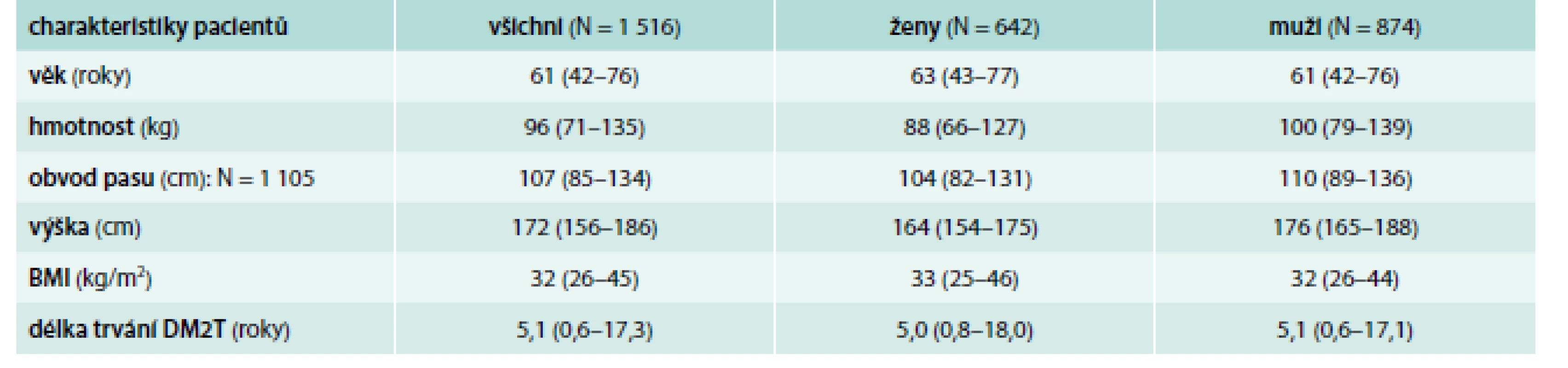
Table 3. Laboratorní hodnoty při vstupu 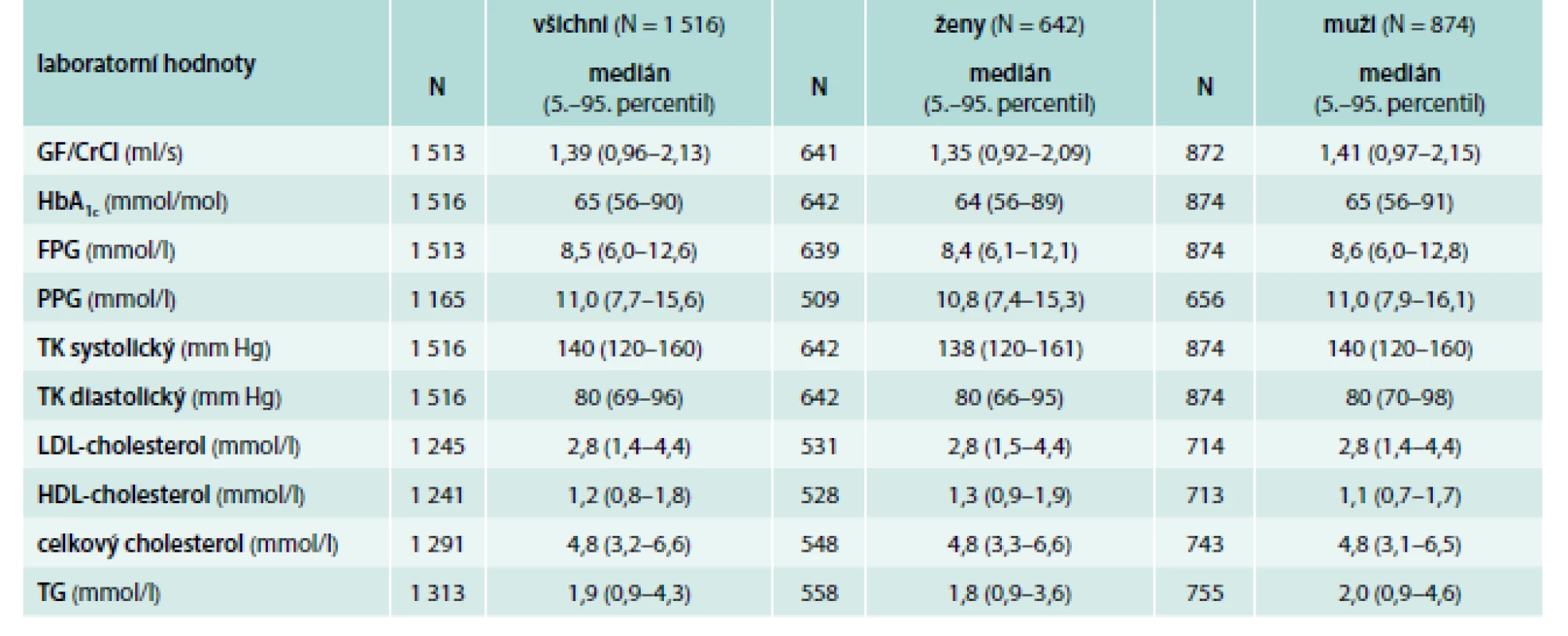
Mezi další sledované parametry patřily komorbidity. Z celého souboru bylo 620 (40,9 %) pacientů bez komorbidit, naopak téměř polovina pacientů měla 2 či více komorbidit při přidání dalšího antidiabetika k metforminu. Celkem bylo zaznamenáno 2 070 komorbidit u 896 pacientů. Mezi nejčastěji přítomné komorbidity při vstupu patřila hypertenze u 49,9 % pacientů, dyslipidemie u 38,8 % a obezita u 30,9 % pacientů. Jen 21 (1 %) komorbidit souviselo s léčbou DM2T metforminem. Zaznamenané komorbidity při vstupu jsou v tab. 4.
Table 4. Počty a typy komorbidit (vstup) 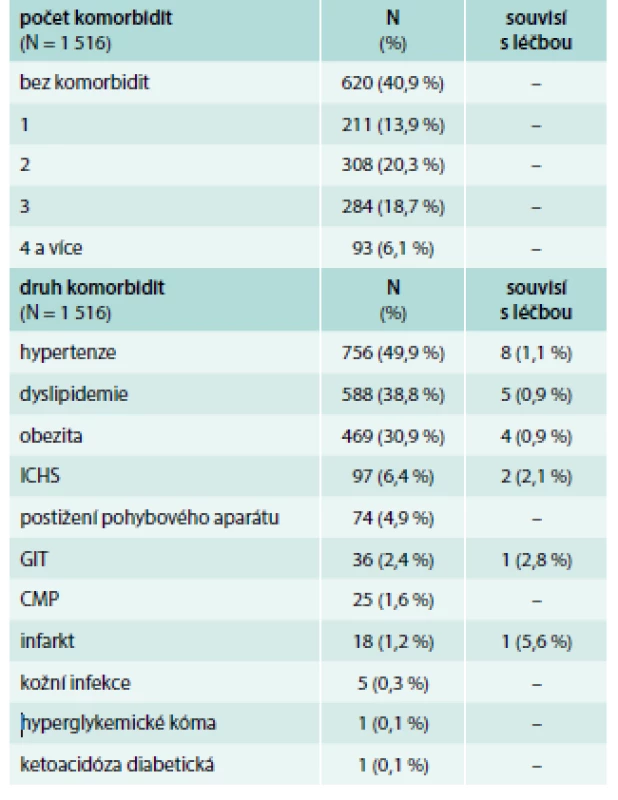
Během 12měsíčního sledování pacientů léčených kombinací metforminu a dalšího antidiabetika se vyskytlo 83 nových komorbidit (zejména hypertenze a dyslipidemie), přičemž pouze jedna – kožní infekce – souvisela s léčbou.
Primárním cílem bylo získat informace o postupech léčby DM2T u pacientů nedostatečně kompenzovaných monoterapií metforminem. Počet nekompenzovaných (HbA1c ≥ 60 mmol/mol) pacientů při vstupu byl 1 262 (83,2 %), zbylých 254 (16,8 %) pacientů bylo částečně kompenzovaných (HbA1c 53–59 mmol/mol), graf 1. Medián délky léčby metforminem v době vstupu činil 3,8 let a podobně jako u délky trvání DM2T byl rozptyl velmi široký: 5.–95. percentil 5 měsíců až 12 let; medián denní dávky metforminu byl 2 000 mg (1 000–4 000 mg).
Graph 1. Pohled na kompenzaci pacientů 
Po vstupu zahájilo 1 110 (73,2 %) pacientů užívat kromě metforminu další léčbu a 406 (26,8 %) pacientů užívalo dál pouze metformin. Po 3 měsících bylo na monoterapii metforminem pouze 18,6 % pacientů a po 12 měsících klesl počet pacientů užívajících pouze metformin na 14,2 %. Zřejmý je významný pokles pacientů s monoterapií metforminem kromě vstupu ještě po 3 měsících a statisticky významný je rovněž pokles po 9 měsících sledování v rámci studie.
Z nejčastěji užívaných přidaných léčiv to byly glifloziny a gliptiny, které byly podávány u 33 %, resp. 28 % pacientů hned při vstupní návštěvě a po 12 měsících dosáhly četnosti 39 %, resp. 35 %. Zastoupení pacientů léčených dalšími sledovanými skupinami (deriváty sulfonylurey, inkretinová mimetika, inzulin, glinidy, inhibitory střevních α-glukosidáz, glitazony či jiná léčba) v průběhu 12 měsíců sledování narůstala, avšak stále se držela pod 10 %. Veškerá léčba při vstupu a následujících návštěvách po 3 měsících je uvedena v tab. 5 a na grafu 2.
Table 5. Další léčba DM2 při neuspokojivé kompenzaci metforminem 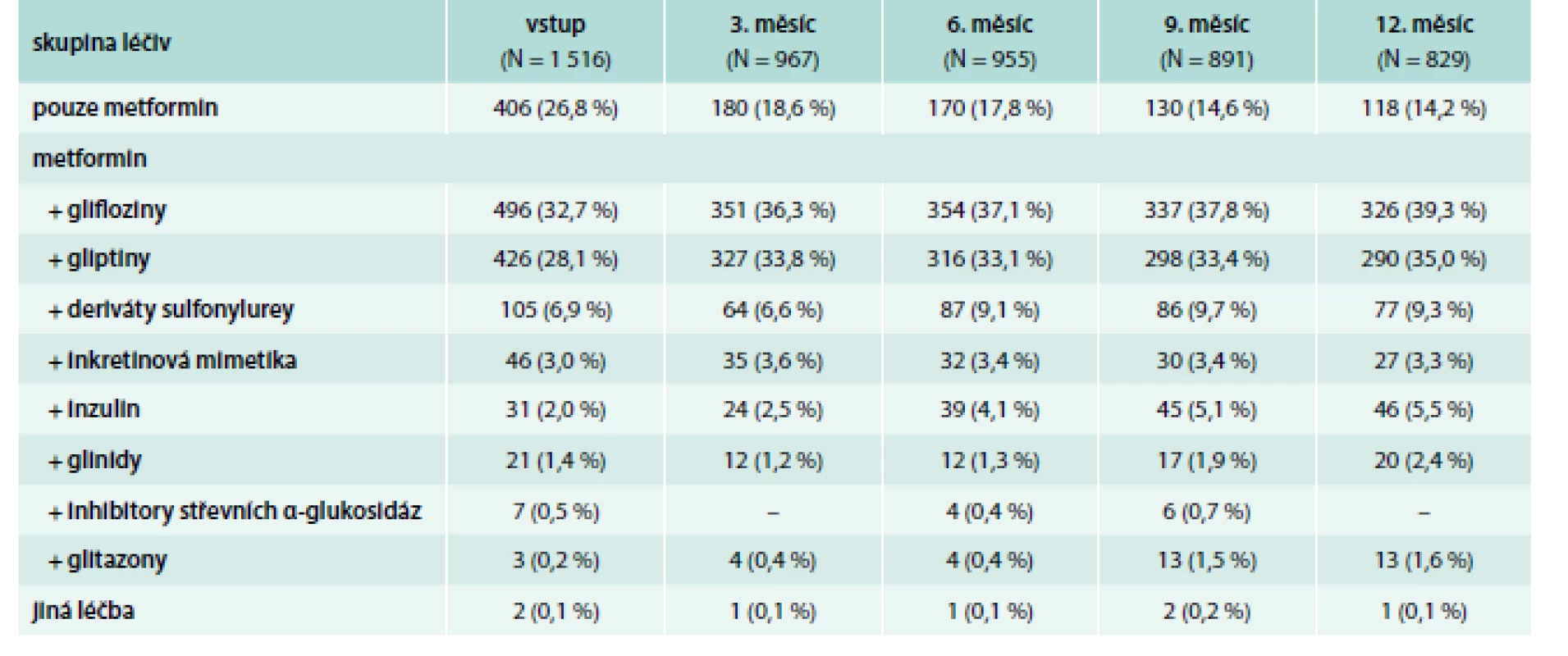
Graph 2. Léčba při vstupu a následujících návštěvách 
Sekundárními cíli projektu bylo zjistit, jakým způsobem ovlivňují jednotlivé lékové skupiny přidané k metforminu úroveň kompenzace diabetu a dalších složek metabolického syndromu. Sledovány byly hladina HbA1c, BMI, hmotnost, systolický a diastolický tlak, hladina lipidů (HDL-cholesterol, LDL-cholesterol a TG).
HbA1c
Hodnocena byla jak samotná hladina HbA1c, tak podíl pacientů dosahujících hladiny HbA1c < 60 mmol/mol. U všech použitých léčiv byl dle očekávání sledován pozitivní efekt na hladinu HbA1c, a to již po 3 měsících přidání další léčby do kombinace k metforminu. V případě gliptinů a gliflozinů docházelo k významnému poklesu HbA1c i v 6. měsíci na rozdíl od ostatních léčiv, jejichž nejúčinnější fáze nastala během prvních 3 měsíců léčby a hladina se dále držela na přibližně stejné úrovni.
Glinidy byly podávány pacientům s nejnižšími hodnotami HbA1c (medián 59 mmol/mol, 5.–95. percentil 54–80 mmol/mol). Naopak inzulin a glifloziny byly podávány pacientům s nejvyššími hladinami HbA1c – medián 76 mmol/mol (55–112), resp. 68 mmol/mol (59–93) a docházelo u nich také k nejprudšímu poklesu HbA1c.
Za léčbu nejúčinněji snižující HbA1c, z pohledu podílu kompenzovaných pacientů, lze na základě dat v této studii považovat inkretinová mimetika, kterými bylo dosaženo alespoň částečné kompenzace diabetu, tj. hladiny HbA1c < 60 mmol/mol u 89 % pacientů po 12 měsících léčby, medián HbA1c byl 47 mmol/mol (41–71). Jako úspěšné se jevilo i pokračování léčby samotným metforminem a úprava jeho dávkování – po 12 měsících bylo dosaženo kompenzace u 89 % pacientů, medián HbA1c byl však vyšší než v případě inkretinových analog – 52 (41–64) mmol/mol. Pacienti léčení inzulinem a také deriváty sulfonylurey byli po 12 měsících kompenzováni nejhůře – medián 58, resp. 55 mmol/mol, podíl pacientů s HbA1c < 60 mmol/mol byl 65 %, resp. 68 % po 12 měsících léčby. V případě inzulinu lze však tento výsledek považovat za úspěšný, jelikož inzulin byl volen u nejhůře kompenzovaných diabetiků (medián 76 mmol/mol při zahájení léčby) a absolutní pokles glykemie je tak srovnatelný s inkretiny. Glifloziny byly úspěšně kompenzovány tři čtvrtiny pacientů. Vývoj HbA1c u nejčetnějších léčebných kombinací je znázorněn na grafu 3, tab. 6 pak uvádí podíl pacientů s hodnotami HbA1c < 60 mmol/mol v jednotlivých měsících.
Graph 3. Vývoj HbA<sub>1c</sub> u nejčetnějších léčebných kombinací 
Table 6. Počty pacientů dosahujících hladiny HbA1c < 60 mmol/mol (6,0 %) během ročního sledování 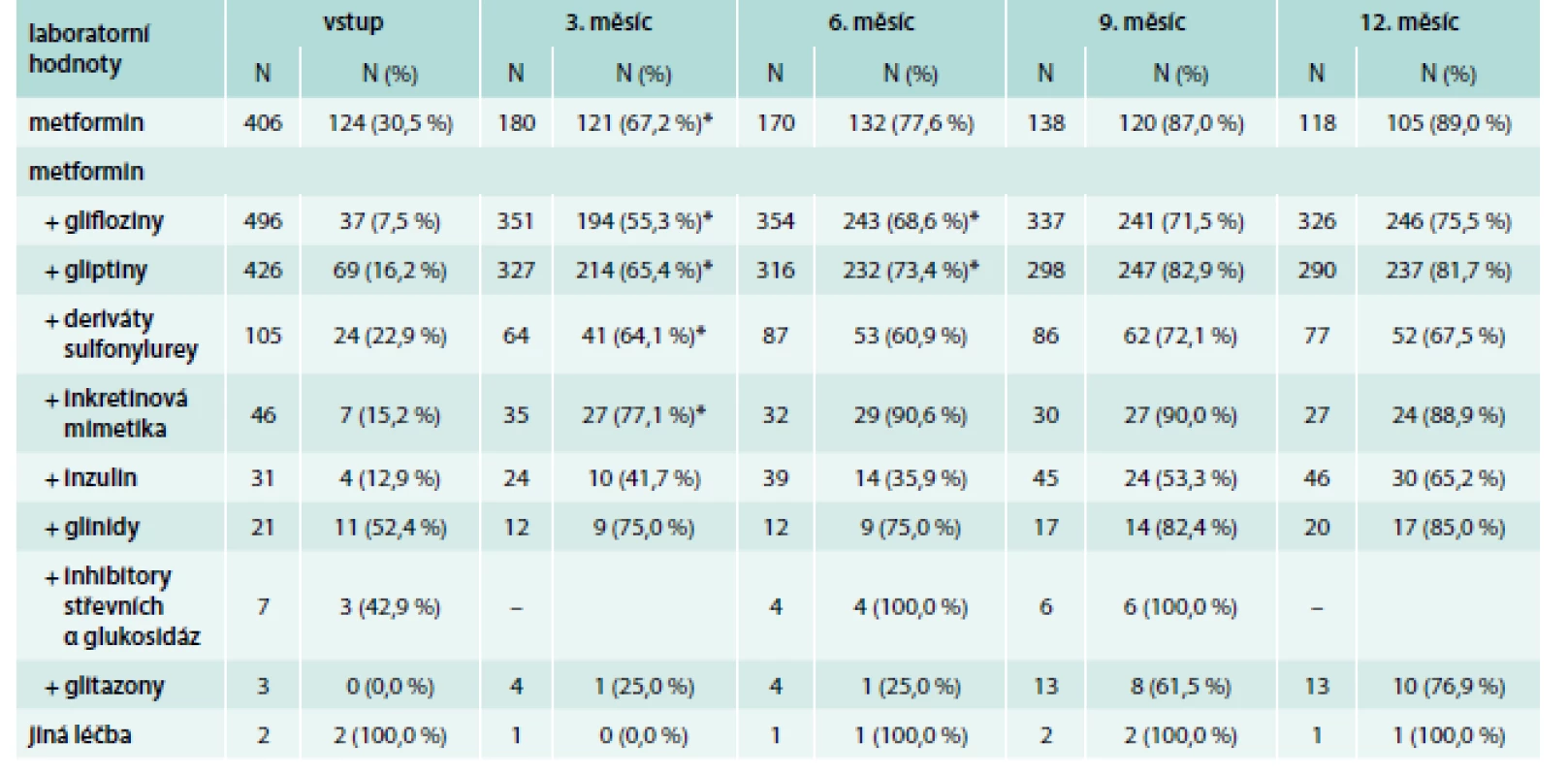
* statisticky významně odlišné hodnoty oproti předešlé návštěvě BMI a hmotnost
Pacienti užívající glifloziny měli v téměř 80 % nižší BMI již po 3 měsících od vstupní návštěvy. Pacienti užívající pouze metformin nebo v kombinaci s gliptiny měli nižší BMI oproti vstupní kontrole u 50 % z nich po 3 měsících; v dalších kontrolách dochází ke snížení oproti hodnotám při vstupní kontrole zhruba u 60 % pacientů. Naopak zvýšení BMI bylo zaznamenáno u gliflozinů pouze u 9–13 % pacientů v dalších návštěvách, kdežto u gliptinů a pouze metforminu to bylo u zhruba čtvrtiny pacientů. Vývoj BMI dle typů léčby je uveden v tab. 7 a na grafu 4.
Table 7. Vstupní BMI a dále vývoj BMI po 3 a 11 měsících; snížení/zvýšení udává podíl pacientů, u kterých došlo ke snížení/zvýšení BMI ve srovnání se vstupní návštěvou 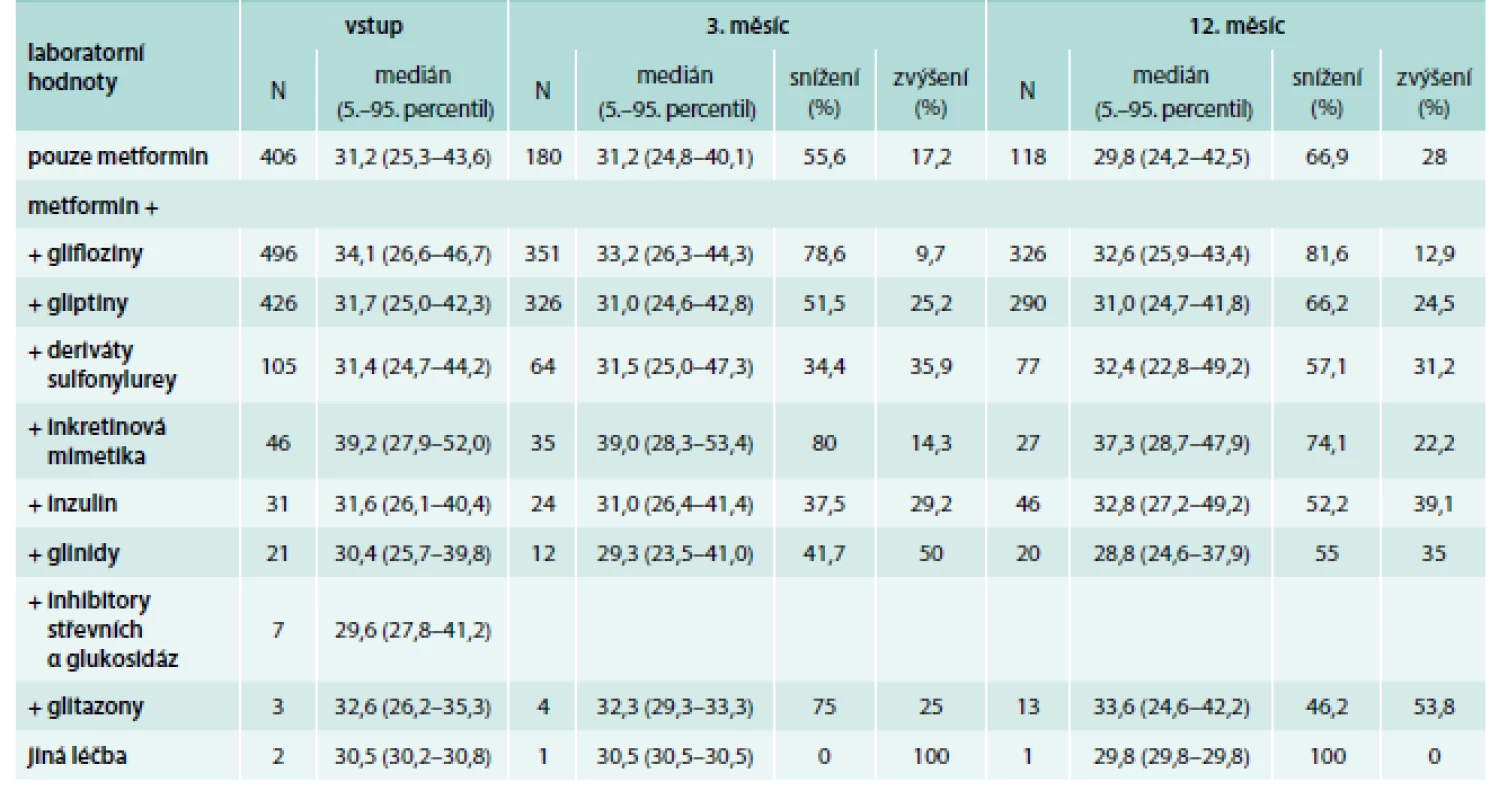
Graph 4. Vývoj BMI dle typů léčby 
Hmotnost přibližně kopírovala výsledky BMI, což bylo při neměnné výšce očekávatelné. U žen docházelo k mírně vyššímu úbytku hmotnosti ve srovnání s muži (graf 5).
Krevní tlak
Ke snížení systolického i diastolického krevního tkaku (TK) docházelo obdobně u pacientů na monoterapii metforminem jako u pacientů v kombinaci s jiným antidiabetikem (60–70 %). Pouze u pacientů užívajících inkretinová mimetika bylo zaznamenáno snížení tlaku častěji (asi 80 %).
Lipidy
Z lipidů byly vyhodnoceny 4 laboratorní parametry, a to LDL-cholesterol, HDL-cholesterol a TG. U pacientů užívajících pouze metformin či metformin v kombinaci s inkretinovými mimetiky docházelo ke snížení LDL-cholesterolu nejúčinněji – až o 74 %, resp. 71 % vzhledem k vstupní návštěvě. Podobně zvýšení HDL-cholesterolu bylo nejvýraznější u pacientů s touto kombinací léčiv a také u pacientů na inzulinu. Nejvyšší pokles cholesterolu byl zaznamenán při monoterapii metforminem a při léčbě deriváty sulfonylurey v kombinaci s metforminem (snížení cholesterolu u 67 % pacientů).
Z pohledu poklesu TG se jevila jako nejúčinnější opět kombinace metforminu s inkretinovými mimetiky, naopak u pacientů užívajících deriváty sulfonylurey s metforminem došlo ke zvýšení TG u poloviny pacientů.
Kromě inkretinových mimetik se taktéž glifloziny a gliptiny v kombinaci s metforminem jevily jako úspěšné v úpravě lipidového spektra.
Diskuse
Studie byla zaměřena na získání informací o další léčbě diabetu 2. typu v České republice při neúspěšné kompenzaci léčbou metforminem. Zařazeni byli dospělí pacienti s hladinou HbA1c > 53 mmol/mol po alespoň 3měsíční monoterapii metforminem.
Jaké antidiabetikum volit ve 2. kroku po metforminu je předmětem diskusí. Algoritmy se liší a pravděpodobně se volba liší i v jednotlivých zemích v důsledku lokálně působících faktorů např. ceny či preskripčních omezení. Tato studie tak významně přispívá k posouzení volby antidiabetik v České republice.
V posledních letech vydaly EASD a ADA postupně 2 algoritmy volby antidiabetik u diabetu 2. typu [2,14]. První algoritmus dával možnost ve 2. kroku po metforminu volit z 5 skupin antidiabetik a druhý dokonce ze 6 skupin. V posledních desetiletích se v České republice léčil diabetes 2. typu podle potřeby léky, které zlepšují převážně inzulinovou senzitivitu (metformin a thiazolidindiony), léky ovlivňujícími inzulinovou sekreci (zejména deriváty sulfonylurey) a třetí možností byla substituce vyhasínající endogenní sekrece inzulinu podáváním inzulinu. Dnes víme, že patogeneze diabetu 2. typu je složitější a snažíme se ovlivnit tzv. de Fronzův oktet popsaný již před 8 lety [16]. Nejkomplexněji do těchto poruch zasahuje tzv. inkretinová léčba a léčba glifloziny [17].
Přes užívaná pomocná kritéria nebyl v druhém kroku dosud zvýhodňován žádný z 6 postupů. Až nyní EASD, ECS i ČDS v doporučeném postupu konstatovaly, že glifloziny zvýhodňuje jejich pozitivní kardiovaskulární efekt. Americká společnost klinických endokrinologů (ACCE) publikovala doporučení léčebného schématu, ve kterém jsou již léky uvedeny v určitém pořadí, a lék, který je v tomto schématu ve výčtu uveden výše v pořadí má preferenci před léky uvedenými v pořadí níže. Toto schéma mírně preferuje v druhém kroku léčby inkretinová analoga [18]. Zmíněné schéma stejně jako doprovodné texty k doporučeným postupům EASD připouštějí při vysoké hodnotě glykovaného hemoglobinu zahájit léčbu diabetu dvojkombinací či trojkombinací léků.
Z této naší studie vyplývá, že naši lékaři volí ve 2. kroku zejména moderní tabletové formy antidiabetik glifloziny a gliptiny a dosahují jimi velmi dobrých výsledků. Léčba inkretinovými analogy je sice nejen podle algoritmu ACCE nejefektivnější, ale i podle zde publikovaných výsledků nejúčinnější, avšak naši lékaři ji užívají méně. Důvodem je injekční podání těchto léků. Inzulin a thiazolidindiony volí naši lékaři málo, ale postupně je přidávají. Nechávají si je pravděpodobně až do dalších kroků léčby.
Podobně designovaná studie nám není známa, a i kdyby by byla v zahraničí nalezena, stejně budou její výsledky ovlivněny lokálními českými omezeními. V této studii bylo prioritní zaznamenání českých zkušeností. Nejrozumnější je srovnání s preskripčními daty za období od poloviny roku 2016 do poloviny roku 2017, která udávají preskripci biguanidů u nás 42 % denních dávek (tedy pacientů), sulfonylurey 34 %, DPP4 inhibitorů 16 %, SGLT2 inhibitorů 4 %, glitazonů 2 %, GLP1 analogů 1 % a glinidů taktéž 1 %. Je třeba vzít v úvahu, že tato data jsou ovlivněna praktickými lékaři, jejichž preskripční možnosti jsou omezeny na metformin a sulfonylureu. Z uvedeného je tedy zřejmé, že ambulantní diabetologové zahrnutí do naší studie předpisovali mnohem častěji moderní léky, zejména glifloziny a GLP1 analoga, než je to v průměru v Česku běžné. Tomu odpovídají i výsledky sekundárních cílů, které byly interpretovány spíše z pohledu jednotlivých antidiabetik, a nikoli celku.
Jedná se o data z reálné praxe, a proto nejde při vyhodnocení primárních a sekundárních cílů jen o prvotní rozhodnutí lékaře při volbě antidiabetika, ale i změnu preskripce podle efektu poprvé zvolených léků.
Obecně lze říci, že přidání další medikace k metforminu, případně úprava dávky u samotného metforminu, se u většiny pacientů projevily ve snížení HbA1c již během 3 měsíců. Během dalšího sledování bylo snížení HbA1c dosaženo u dalších asi 10–15 % pacientů. Výjimkou je léčba inkretinovými mimetiky, při které bylo snížení HbA1c dosaženo u více než 80 % pacientů již při 1. kontrolní návštěvě a po 12 měsících bylo kompenzace dosaženo u téměř 90 % pacientů.
Druhá část studie se zabývala sledováním hmotnosti a dalších složek metabolického syndromu. Je známo, že nová antidiabetika gliptiny, glifloziny a inkretinová analoga ovlivňují složky metabolického syndromu příznivě. Je známo, že tento efekt je největší u inkretinových analog, což bylo potvrzeno našimi výsledky. Je překvapivé, že hmotnost a další složky metabolického syndromu se vyvíjejí převážně příznivě i po léčbě inzulinem a staršími antidiabetiky včetně derivátů sulfonylurey, i když méně příznivě než po výše zmíněných antidiabeticích nové generace. To může být dáno tím, že pacientům byly přidávány další léky jako antihypertenziva a hypolipidemika nebo léky s placebo efektem, ale také edukací a motivací pacientů ve studii. To samozřejmě nezpochybňuje vynikající komplexní efekt nových antidiabetik na složky metabolického syndromu, zejména gliflozinů, gliptinů a inkretinových analog prokázaný studií.
Na datech z této studie bylo potvrzeno doporučení EASD [14] nepodávat deriváty sulfonylurey, inzulin a thiazolidindiony jako prevenci hmotnostního přírůstku. U pacientů s tímto typem léčby narostla tělesná hmotnost nejvíce.
Další zajímavou skutečností je, že mezi hodnotami 53 a 60 mmol/mol HbA1c bylo jen 16 % pacientů. Obava pojišťoven z vysokých nákladů, kdyby bylo sníženo preskripční omezení pro nová antidiabetika z 6 na 5,3 %, je tedy asi zbytečná.
Ve studii bylo minimálně pacientů v sekundární prevenci kardiovaskulárních komplikací. V poslední době je pod vlivem nových studií [19–21] tendence indikovat nová antidiabetika až v sekundární prevenci. Tato studie ukazuje jejich vysokou účinnost již u pacientů s relativně kratším trváním diabetu a bez komplikací tedy v primární prevenci. Jde o účinek nejen na kompenzaci diabetu, ale i na složky metabolického syndromu.
Vzhledem k charakteru projektu, tj. neintervenční sledování pacientů v rámci reálné klinické praxe, nebylo kontrolováno náhodné indikování pacientů k jednotlivým typům léčby. Naopak způsob léčby byl zcela v režii ošetřujícího lékaře. Primární cílem byl právě popis léčebných strategií v reálné klinické praxi.
Při hodnocení sekundárních cílů může mít tento postup vliv na interpretaci výsledků, jelikož k léčbě určitou skupinou léků mohou být indikování pacienti s odlišnými vstupními hodnotami než k léčbě jiné. V designu studie nebylo plánováno toto potenciální zkreslení korigovat v rámci statistického hodnocení.
Jelikož ne všichni pacienti měli návštěvy ve všech sledovaných časových obdobích, prezentováni jsou vždy pacienti s validní návštěvou v daném měsíci. Statistické srovnávání bylo provedeno pouze na pacientech s vyplněným a validním FUP (do 3 měsíců ± 14 dní od minulé kontroly), a ne na všech pacientech. (FUP/follow-up patients - Následné kontroly/návštěvy po vstupu do studie, tedy od začátku sledování pacienta - kontrola po 3., 6., 9., 12. měsíci od začátku sledování). Ke kontrole, zda nedocházelo k systematickému vyloučení skupiny pacientů v rámci jednotlivých léčiv, byly srovnány relativní četnosti pacientů, kteří měli validní FUP kontroly, a relativní četnosti u všech pacientů. Tyto hodnoty se výrazně nelišily.
Závěr
Studie ukázala, že léky volené v České republice v léčbě diabetu 2. typu ve 2. kroku po metforminu jsou velmi účinné nejen na kompenzaci diabetu, ale i na snížení hmotnosti a příznivé ovlivnění krevního tlaku a hladiny lipidů. Bylo dobře dokumentováno, že léčba přidáním gliflozinů, gliptinů či inkretinových analog je nejúčinnější léčbou při nedostatečném efektu metforminu. Je dobře, že právě jednoduchou tabletovou léčbu glifloziny a gliptiny volí naši lékaři nejčastěji.
Studie proběhla za finanční podpory společnosti AstraZeneca Czech Republic s. r. o., která však neměla žádný vliv na provádění studie, nábor pacientů ani jejich léčbu. Autoři studie děkují společnosti AstraZeneca za podporu a také všem lékařům zapojeným do studie za jejich přispění.
Mgr. Martina Nováčková
novackova@biostatistika.cz
Institut biostatistiky a analýzy, s.r.o.
Brno
www.biostatistika.cz
Doručeno do redakce 5. 8. 2017
Přijato po recenzi 24. 9. 2017
Sources
1. Češka R, Tesař V, Dítě P (eds) et al. Interna. Triton: Praha 2010. ISBN 978–80–7387–423–0.
2. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycaemia in type 2 diabetes: a patient-centered approach. Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2012; 55(6): 1577–1596. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–012–2534–0>. Erratum in Diabetologia 2013; 56(3): 680.
3. Stratton IM, Adler AI, Neil HA et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000; 321(7258): 405–412.
4. American Diabetes Association. Standards of medical care in diabetes – 2011. Diabetes Care 2011; 34(Suppl 1): S11-S61. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11-S011>
5. Rosolová H, Pelikánová T, Moťovská Z. Doporučené postupy ESC týkající se diabetu, prediabetu a kardiovaskulárních onemocnění, vytvořené ve spolupráci s EASD, publikováno online 13. 3. 2014. Dostupné z WWW: <http://www.kardio-cz.cz/doporucene-postupy-ceske-kardiologicke-spolecnosti-460/>.
6. Boule NG, Haddad E, Kenny GP et al. Effects of exercise on glycemic control and body mass in type 2 diabetes mellitus: a meta-analysis of controlled clinical trials. JAMA 2011; 286(10): 1218–1227.
7. Bantle JP, Wylie-Rosett J, Albright AL et al. Nutrition recommendations and interventions for diabetes: a position statement of the American Diabetes Association. Diabetes Care 2008; 31(Suppl 1): S61-S78. Dostupné z DOI: <http://dx.doi.org/10.2337/dc08-S061>. Erratum in Diabetes Care 2010; 33(8): 1911.
8. Nissen SE, Wolski K. Rosiglitazone revisited: an updated meta-analysis of risk for myocardial infarction and cardiovascular mortality. Arch Intern Med 2010; 170(14): 1191–1201. Dostupné z DOI: <http://dx.doi.org/10.1001/archinternmed.2010.207>.
9. Colhoun HM, Livingstone SJ, Looker HC et al. [Scottish Diabetes Research Network Epidemiology Group]. Hospitalised hip fracture risk with rosiglitazone and pioglitazone use compared with other glucose-lowering drugs. Diabetologia 2012; 55(11): 2929–2937. Dostupné z DOI: http://dx.doi.org/10.1007/s00125–012–2668–0>.
10. Jabbour S. Primary care physicians and insulin initiation: multiple barriers, lack of knowledge or both? Int J Clin Pract 2008; 62(6): 845–847. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1742–1241.2008.01757.x>.
11. Vasilakou D, Karagiannis T, Athanasiadou E et al. Sodium-glucose cotransporter 2 inhibitors for type 2 diabetes: a systematic review and meta-analysis. Ann Intern Med 2013; 159(4): 262–274. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–159–4-201308200–00007>.
12. Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidylpeptidase-4 inhibitors in type 2 diabetes. Lancet 2006; 368(9548): 1696–1705.
13. Deacon CF. Dipeptidyl peptidase-4 inhibitors in the treatment of type 2 diabetes: a comparative review. Diabetes Obes Metab 2011; 13(1): 7–18. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1463–1326.2010.01306.x>.
14. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach update to a position statement of the American diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015; 38(1): 140–149. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–2441>.
15. Škrha J, Pelikánová T, Kvapil M. [Česká diabetologická společnost]. Doporučený postup péče o diabetes mellitus 2. typu. Doporučení české diabetologické společnosti ČSL JEP. Datum revize 1. 1. 2017. Dostupné z WWW: <http://www.diab.cz/standardy>.
16. De Fronzo RA. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009; 58(4): 773–795. Dostupné z DOI: <http://dx.doi.org/10.2337/db09–9028>.
17. Svačina Š. Antidiabetika – historie, současnost a perspektivy. Axonite: Praha 2016. ISBN 978–80–88046–08–0.
18. Garber AJ, Abrahamson MJ, Barzilay JI et al. Consensus Statement By The American Association Of Clinical Endocrinologists And American College Of Endocrinology On The Comprehensive Type 2 Diabetes Management Algorithm – 2016 Executive Summary. Endocr Pract 2016; 22(1): 84–113. Dostupné z DOI: <http://dx.doi.org/10.4158/EP151126.CS>.
19. Zinman B, Wanner C, Lachin JM et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373(22): 2117–2128. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1504720>.
20. Wanner C, Inzucchi SE, Lachin JM et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016; 375(4): 323–334. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1515920>.
21. Buse JB. [LEADER Steering Committee]. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375(18): 1798–1799. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc1611289>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 10-
All articles in this issue
- Adherence k léčbě non-vitamin K perorálními antikoagulancii u nevalvulární fibrilace síní: přehled literatury
- Chirurgická léčba aneuryzmatu aortálního kořene: srovnání Bentallovy operace a reimplantace aortální chlopně podle Davida
- Strategie léčby diabetu 2. typu při selhání léčby metforminem používané českými lékaři nebo v České republice
- Problematika sekundárnej osteoporózy pri deficite rastového hormónu v dospelosti
- Lze zlepšit komplianci pacientů k dlouhodobé terapii statiny?
- COSYREL – účinná fixní kombinace pro léčbu hypertenze, stabilní ICHS a srdečního selhání
- Přínos nových inhibitorů angiogeneze (bevacizumab a aflibercept) pro léčbu mnohočetné angiomatózy: kazuistika
- Endokrinní orbitopatie: aktuální pohled klinického endokrinologa
- Rychlejší aspart (Faster Insulin Aspart) – nový prandiální inzulinový analog
- Adaptační změny po střevní resekci
- Osteoartróza jako součást metabolického syndromu?
- Metabolický syndrom a postavení polypilu v prevenci jeho komplikací
- Diabetes mellitus a poruchy kognice z pohledu diabetologa
- Nové možnosti ovlivnění progrese diabetického onemocnění ledvin
- Pohybová aktivita – svatý grál moderní medicíny?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- COSYREL – účinná fixní kombinace pro léčbu hypertenze, stabilní ICHS a srdečního selhání
- Chirurgická léčba aneuryzmatu aortálního kořene: srovnání Bentallovy operace a reimplantace aortální chlopně podle Davida
- Pohybová aktivita – svatý grál moderní medicíny?
- Endokrinní orbitopatie: aktuální pohled klinického endokrinologa
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


