-
Medical journals
- Career
Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
Authors: Zdeněk Adam 1; Jiří Mašlaň 2; Leoš Křen 3; Roman Kodet 4; Renata Koukalová 5; Zdeněk Řehák 5; Libor Červinek 1; Luděk Pour 1; Marta Krejčí 1; Viera Sandecká 1; Zdeněk Král 1; Jiří Mayer 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 1; Oddělení patologie Nemocnice Třebíč 2; Ústav patologie LF MU a FN Brno, pracoviště Bohunice 3; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha 4; Oddělení nukleární medicíny – centrum PET a Regionální centrum aplikované molekulární onkologie (RECAMO) Masarykova onkologického ústavu Brno 5
Published in: Vnitř Lék 2016; 62(6): 491-499
Category: Case Reports
Overview
Sinusová histiocytóza s masivní lymfadenopatií (Rosaiova-Dorfmanova nemoc) je velmi vzácná choroba řazená do skupiny histiocytóz (přesněji histiocytóz z non-Langerhansových buněk). Pro Rosaiovu-Dorfmanovu nemoc je charakteristická přítomnost atypických histiocytárních buněk v sinusech lymfatických uzlin či v lymfatické extranodální tkáni, pohlcujících lymfocyty a plazmocyty. U pohlcených buněk nedochází k porušení jejich struktury a funkce a pohlcené buňky mohou histiocyty opustit jako viabilní buňky. Tento jev se označuje jako emperipolesis, zatímco pohlcování buněk s jejich destrukcí se nazývá fagocytóza. V našem textu popisujeme pacientku s touto chorobou lokalizovanou typicky v krčních uzlinách, ale i v uzlinách mediastina. Současně s lymfadenopatií se objevily kožní změny, které byly klinicky i histologicky charakterizovány jako ekzémdermatitida. Současně s lymfadenopatií začaly také silné bolesti hlavy, kterými pacientka nikdy dříve netrpěla. V rámci léčby první linie byl podán prednison, ale tato léčba byla bez efektu. Pro léčbu druhé linie byl použit 2-chlorodeoxyadenozin v dávce 5 mg/m2 s. c. 5 dní po sobě v měsíčních intervalech. Celkem byly podány 4 cykly této léčby. Léčba byla tolerována bez jakýchkoliv projevů toxicity. Již po 1. cyklu zcela vymizely kožní změny a také zcela vymizely bolesti hlavy. K vyhodnocení efektu léčby bylo použito PET/CT vyšetření s 18F-fluorodeoxyglukózou (FDG-PET/CT). Po 4 cyklech léčby se uzliny v mediastinu zmenšily na fyziologickou velikost a akumulace fluorodeoxyglukózy v nich byla hodnocena jako fyziologická. Lymfadenopatie v oblasti krku se také vlivem léčby výrazně zmenšila o 50–75 % a zmenšila se i akumulace fluorodeoxyglukózy, ale ne do normy. Efekt léčby tedy hodnotíme jako parciální remisi s úplným vymizením kožních změn a bolestí hlavy. Příčina ekzému a bolestí hlavy nebyla objasněna, ale z časové souvislosti jejich vzniku a vymizení po aplikaci 2-chlorodeoxyadenozinu je pravděpodobná příčinná souvislost s Rosaiovou-Dorfmanovou nemocí.
Klíčová slova:
Castlemanova choroba – lenalidomid – Rosaiova-Dorfmanova choroba – rituximab – sinusová lymfadenopatie s masivní lymfadenopatií – talidomid – 2-chlorodeoxyadenozinÚvod
Co vede ke zvětšení uzlin a k patologickým infiltrátům? Na tuto otázku běžně odpovíme, že příčinou je buď infekce, nebo maligní choroba hematologického původu či metastázy solidních tumorů. A v naprosté většině případů tomu tak je. Jen zcela výjimečně se setkáme s případem, v němž příčinou lymfadenopatie není ani infekce ani klonální proliferace maligních buněk. Tyto případy souvisejí obecně s nějakou formou alterace imunity, která způsobí reaktivní proliferaci některého typu buněk podílejících se na imunitní odpovědi. Tyto buňky jsou pak podkladem patologické lymfadenopatie.
Cesta ke stanovení diagnózy vede přes chirurgické vynětí zvětšených uzlin a jejich mikroskopické vyšetření. A tak to bylo i u této pacientky s velkými nebolestivými uzlinami na krku. Žádná z typických infekcí, které způsobují lymfadenopatii, nebyla prokázána, a proto byla uzlina operačně vyjmuta a provedeno histologické vyšetření. Výsledek byl překvapující: Rosaiova-Dorfmanova choroba. Zvětšené uzliny pacientce způsobovaly mechanické potíže při otáčení hlavy, takže bylo třeba zahájit léčbu. Co zvolit jako léčbu první a další linie? To rozebíráme v následujícím textu.
Popis průběhu nemoci
Žena, narozená roku 1959, neprodělala ve svém životě žádné závažné choroby. Poprvé si všimla zvětšených lymfatických uzlin na krku v linii kývače v říjnu roku 2014, tedy ve věku 56 let. Uzliny měly tendenci k pomalému zvětšování, bolestivé nebyly. Vznik krční lymfadenopatie nebyl provázen žádnými systémovými projevy typu febrilií či subfebrilií, úbytkem hmotnosti nebo nočním pocením. Pacientka měla pouze pocit, že je unavenější než dříve a že hůře toleruje jakoukoliv zátěž. Za pár týdnů poté, co zpozorovala zvětšené uzliny na krku, ji začaly trápit kožní změny, které dermatologové zhodnotili jako ekzém. Ke konci roku 2014, tedy řádově týdny poté, co si uvědomila přítomnost zvětšených uzlin na krku, začaly bolesti hlavy. Pacientka přitom nikdy dříve bolesti hlavy nemívala, takže zde je nápadná časová souvislost.
Lékaři na hematologickém oddělení nemocnice v Třebíči při první návštěvě nemocné pečlivě vyšetřili všechny běžné infekční příčiny lymfadenopatie, a když žádnou infekci neprokázali, odeslali pacientku k vynětí patologicky zvětšené uzliny pro histologické vyšetření.
První histologické vyšetření bylo provedeno na oddělení patologie nemocnice v Třebíči, posléze byla uzlina konzultována s Ústavem patologie FN Brno. Závěr histologického hodnocení v Třebíči i v Brně byl shodný: Rosaiova-Dorfmanova choroba – vzácná jednotka ze skupiny histiocytóz z non-Langerhansových buněk. Vzhledem k tomu, že šlo o první případ této nemoci na našem pracovišti za posledních 25 let, požádali jsme o potvrzení diagnózy prof. MUDr. Kodeta z FN v Motole, který publikoval popis případu Rosaiovy-Dorfmanovy choroby již dříve. Závěr prof. Kodeta jen potvrdil diagnózu stanovenou v Třebíči a potvrzenou v Brně: typické morfologické známky Rosaiovy-Dorfmanovy choroby. Ve všech odběrech ze zvětšených uzlin byla přítomna sinusová histiocytóza s inkluzemi (emperipolesis) preferenčně lymfocytů. Histiocytární ložiska byla nejen ve splavech, ale také v parakortexu. Splavy byly zaplaveny histiocyty napříč všemi odběry. V parakortexu byly místy i shluky naznačeně epiteloidních struktur. Imunohistochemicky byly prokázány následující znaky: CD68 a CD163 byly masivně, i když variabilně v histiocytech pozitivní. Barvení na CD1a antigen bylo negativní (jen nevýznamná příměs CD1a pozitivních buněk). Průkaz proteinu S-100 byl variabilně pozitivní ve všech histiocytech (obr. 1).
Image 1. Zřetelná tzv. emperipoléza: přítomnost intaktních lymfocytů v cytoplazmě sinusových histiocytů. Histologický preparát, barvení hematoxylin-eozin, zvětšení 200krát 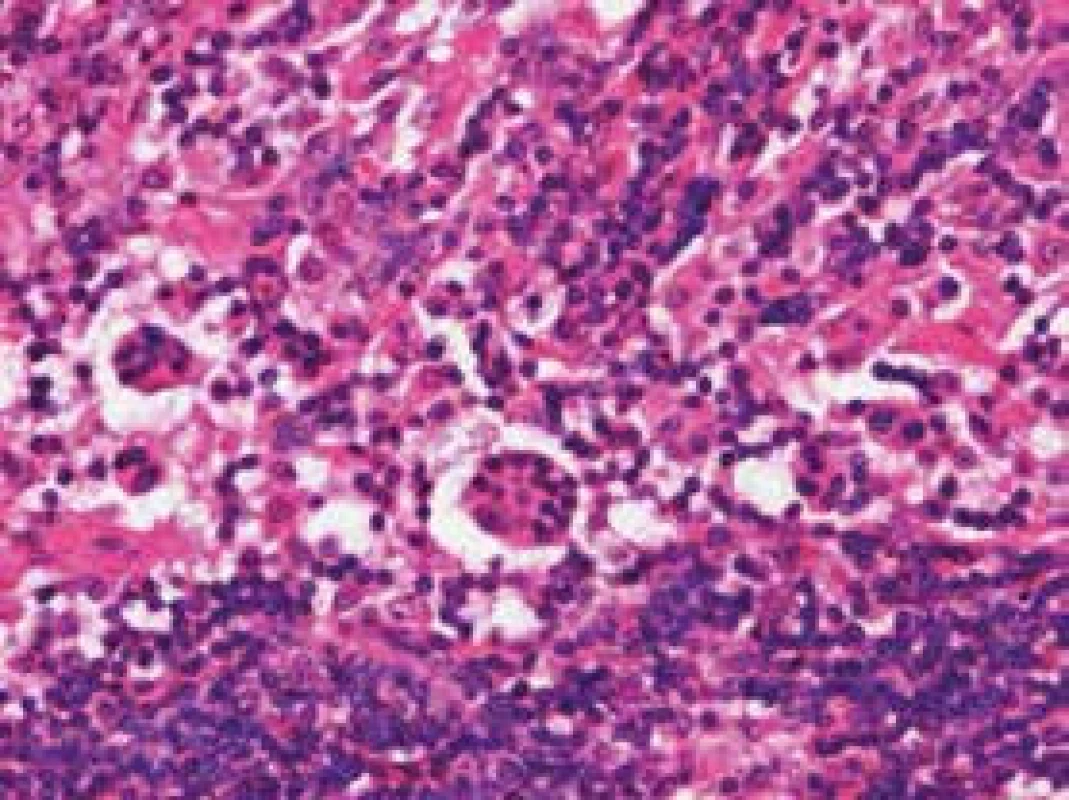
Později byl odebrán i vzorek kůže k histologickému vyšetření, ale v kůži byly změny hodnoceny jako ekzémdermatitida. V kostní dřeni byl při cytologickém hodnocení nález nenápadný, ojediněle byla popsána hemofagocytóza.
Při prvním vyšetření na našem pracovišti jsme hmatali vlevo i vpravo na krku uzliny průměru 3 cm, které byly poměrně četné a spojovaly se do paketů. Lymfadenopatie byla pod úhlem čelisti a pokračovala podél obou kývačů až do nadklíčkové oblasti. V podpaží a v třísle nebyly hmatné žádné zvětšené uzliny.
V laboratorních odběrech nebyly žádné nápadné patologické změny. Krevní obraz byl početně v normě, pouze absolutní počet lymfocytů byl snížen na 0,6 × 109/l, ostatní parametry krevního obrazu byly v normě, hemoglobin 142 g/l, trombocyty 275 × 109/l, celkový počet leukocytů byl 7,71 × 109/l a 87 % z toho byly neutrofilní granulocyty. Vyšetření koncentrace imunoglobulinů prokázalo nepatrně vyšší koncentraci IgG 17,7 g/l (norma do 16 g/l), tedy mírné polyklonální zmnožení imunoglobulinů.
Pro stanovení rozsahu nemoci bylo použito vyšetření celotělovou výpočetní tomografií – pozitronovou emisní tomografií s 18F-fluorodeoxyglukózou (FDG-PET/CT). Při CT zobrazení byly popsány submandibulárně zvětšené lymfatické uzliny velikosti 16–17 mm oboustranně a dále četné zvětšené krční lymfatické uzliny v celé délce krku, které splývaly do paketů, vlevo 26 mm v příčném řezu. Další lymfatické uzliny byly v oblasti jugula, paket průměru 3 cm.
V mediastinu byly taktéž popsány zvětšené uzliny paratracheálně, při konvexitě aortálního oblouku a v zadním mediastinu o průměru 16 mm.
V PET obraze byly patrné pakety zvětšených, metabolicky aktivních uzlin, intenzivně akumulujících 18F-fluorodeoxyglukózu. Nejvyšší intenzitu akumulace 18F-fluorodeoxyglukózy vykazovaly uzliny na krku oboustranně (SUVmax 9,8). Menší uzliny s patologickou akumulací 18F-fluorodeoxyglukózy byly detekovány v mediastinu (obr. 2).
Image 2. Vlevo sumované obrázky (tzv. MIP), vpravo fúzované FDG-PET/CT koronární řezy (krk) a axiální řezy (mediastinum). 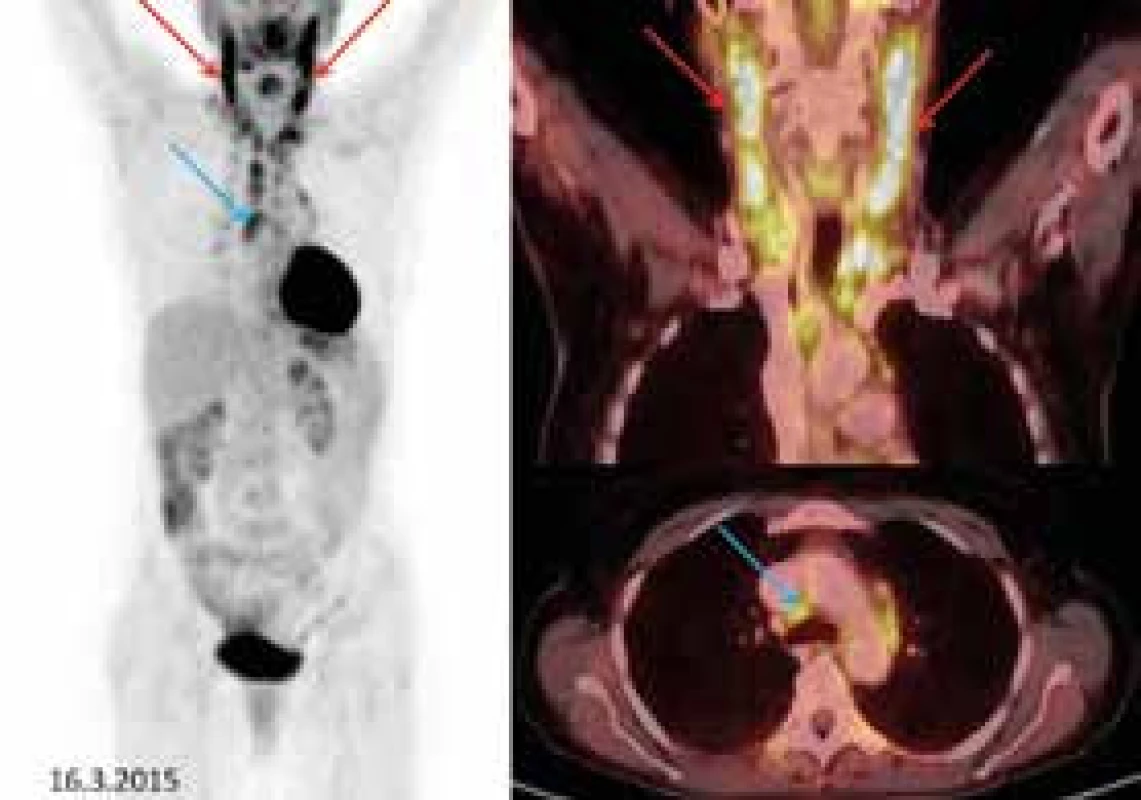
Patologickým nálezem je zvýšená akumulace 18fluorodeoxyglukózy (FDG) v četných, místy zvětšených uzlinách: na krku bilaterálně (červené šipky) – nález je výraznější vlevo, uzliny zde splývají v pakety, v obou nadklíčcích a v mediastinu (modré šipky) Pro bolesti hlavy bylo provedeno vyšetření hlavy zobrazením magnetickou rezonancí (magnetic resonance imaging – MRI), které neodhalilo žádné ložisko v mozku ani na meningách, které by způsobovalo bolesti hlavy. Vyšetření krční páteře metodou MRI se z kapacitních důvodů nepodařilo v době potíží zorganizovat, i když jsme si byli vědomi, že bolesti mohly být způsobeny expanzí v oblasti krčního spinálního prostoru.
Zvětšené uzliny pacientku mechanicky obtěžovaly, a mimoto jsme měli podezření na souvislost kožních změn a bolestí hlavy s tímto onemocněním, protože všechny tyto problémy vznikly současně. Šlo tedy o symptomatickou formu nemoci se známkami progrese. V rámci léčby první linie jsme paní podali prednison v počáteční dávce 1 mg/kg hmotnosti. Tato dávka byla plánována na prvních 14 dní, poté jsme ji chtěli každý další týden o 10 mg snížit. Po 3 týdnech jsme však konstatovali, že tato léčba nevede k žádné léčebné odezvě.
Pro léčbu druhé linie jsme po prostudování dostupné literatury o léčbě této nemoci zvolili podkožní aplikace 2-chlorodeoxyadenozinu. Tento lék se standardně používá pro léčbu vlasatobuněčné leukemie, je však také velmi účinným lékem pro pacienty s histiocytózou z Langerhansových buněk.
Dávka použitého 2-chlorodeoxyadenozinu byla stejná, jakou používáme pro léčbu histiocytózy z Langerhansových buněk nebo vlasatobuněčné leukemie, 5 mg/m2, podávaná 1.–5. den v měsíčních intervalech. Pro léčbu jsme použili preparát Litak (účinná látka 2-chlorodeoxyadenozin – kladribin) s možností podkožní aplikace.
Pacientce jsme podali celkem 4 cykly této léčby. Efekt 2-chlorodeoxyadenozinu na tuto nemoc jsme sledovali pomocí FDG-PET/CT vyšetření, jak dokladují obr. 2 a obr. 3. Po 4 cyklech došlo k výraznému zmenšení velikosti uzlin, v mediastinu již zvětšené uzliny nebyly detekovány. Patologická akumulace fluorodeoxyglukózy v mediastinu zcela vymizela. Na krku se uzliny taktéž výrazně zmenšily a zmenšila se i akumulace fluorodeoxyglukózy v nich, ale ne do normy, uzliny stále zůstávají mírně zvětšené, i když jsou podstatně menší než před léčbou.
Image 3. Vlevo sumované obrázky (tzv. MIP), vpravo fúzované FDG-PET/CT koronární řezy (krk) a axiální řezy (mediastinum). 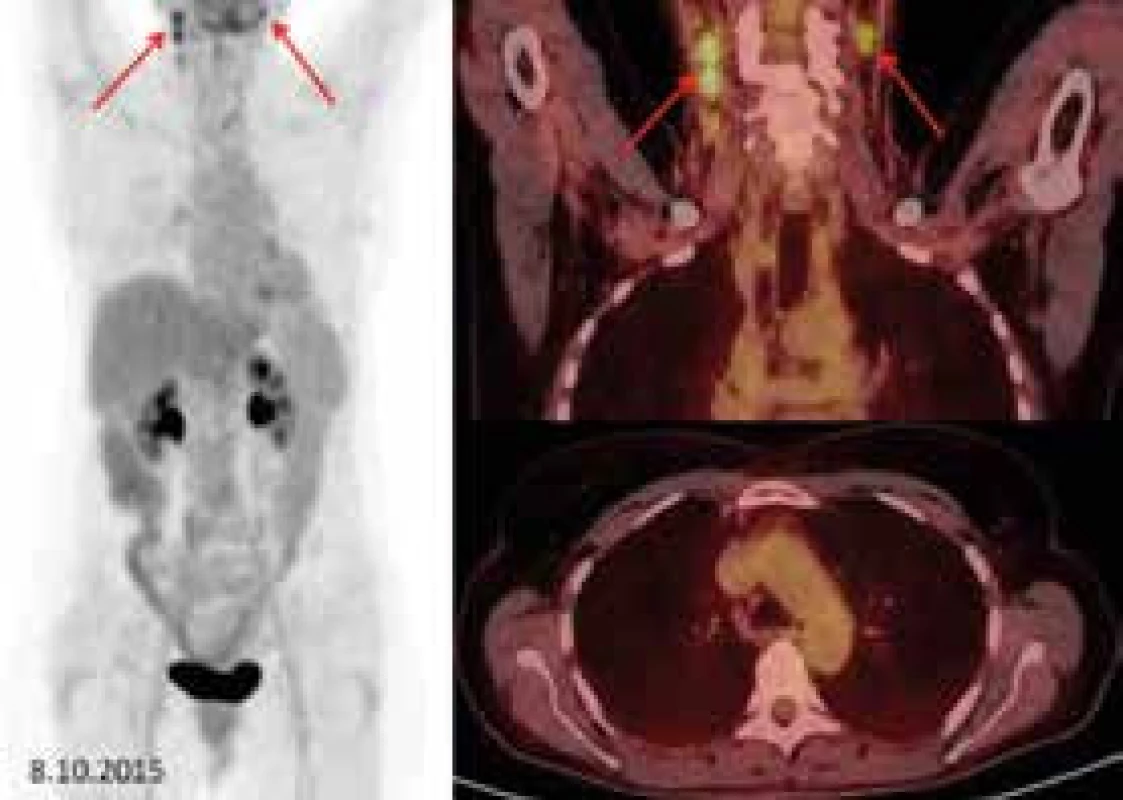
Po léčbě dochází k výrazné regresi počtu, velikosti a metabolické aktivity uzlin. Přetrvávají jen nevýrazná rezidua postižení v podobě jednotlivých patologických uzlin na krku bilaterálně (červené šipky) 4 cykly navodily výrazné zmenšení lymfadenopatie na krku o 50–75 % původní velikosti a úplné vymizení lymfadenopatie v mediastinu, tedy parciální remisi. Po aplikaci prvních 5 podkožních injekcí vymizely kožní změny a již se více neobjevily a vymizely i bolesti hlavy.
V současné době se pacientka neléčí, je však pravidelně sledována.
Diskuse
Definice nemoci
Sinusová histiocytóza s masivní lymfadenopatií je jako samostatná nozologická jednotka známá již 46 let, poprvé byla popsána Rosaiem a Dorfmanem v roce 1969, a tak nese jejich jméno [1]. Nemoc postihuje častěji mladší věkové kategorie, děti, adolescenty a mladé dospělé, starší dospělé osoby pak jen výjimečně [2]. V mezinárodním registru této nemoci, který založili Rosai a Dorfman, bylo v roce 2004 nahlášeno jen 423 případů, takže tato nemoc je podstatně vzácnější než histiocytóza z Langerhansových buněk, a v české a slovenské literatuře jsou proto pouze 4 publikace zmiňující tuto chorobu [3–6].
Rosaiova-Dorfmanova choroba (Rosai-Dorfman disease) je některými autory řazena do skupiny zvané atypical cellular disorders [7]. Tento termín nemá ustálený český překlad, a tak jej necháme v původní podobě. Pro tuto skupinu nemocí je charakteristická porucha imunity obecně, u jednotlivých chorob pak zásadní narušení funkce určité buněčné populace, která se podílí na imunitní odezvě. Výsledný klinický obraz chorob ze skupiny atypical cellular disordes je podobný, vznikne lymfadenopatie, kožní morfy (ekzantémy), výjimečně i osteolytická kostní ložiska a případná infiltrace prakticky kteréhokoliv orgánu či tkáně [7].
Do kategorie atypical cellular disorders mimo Rosaiovu-Dorfmanovu chorobu jednoznačně patří všechny formy Castlemanovy nemoci, tedy i Castlemanova choroba s rysy POEMS syndromu. Někteří autoři sem přiřazují také histiocytózu z Langerhansových buněk [7]. Jednoznačně lze do této skupiny přiřadit jen izolovanou plicní formu histiocytózy z Langerhansových buněk, protože tato forma má prokázanou reaktivní, tedy nemaligní etiologii. U generalizovaných forem histiocytózy z Langerhansových buněk se stále diskutuje, zda se jedná o neoplastickou etiologii s klonální proliferací, nebo o etiologii reaktivní [8]. Domníváme se, že jiné než plicní formy histiocytózy z Langerhansových buněk budou mít spíše maligní etiologii.
Termín Rosaiova-Dorfmanova choroba se používá pro nemaligní proliferaci histiocytárních buněk se schopností pohlcovat lymfocyty a plazmocyty [1]. Tento jev pohlcování jedné buňky jinou buňkou, aniž by docházelo k destrukci pohlcené buňky, se nazývá emperipolesis. Podobný proces, při němž jsou ale pohlcené buňky intracelulárně ničeny lysosomálními enzymy makrofágů, se nazývá fagocytóza. Pohlcování hematopoetických buněk (erytroblastů, myeloidních buněk, neutrofilů) je vzácně pozorováno u některých krevních chorob, ale není pro tyto choroby diagnostické s výjimkou hemofagocytujících histiocytóz, které mají obvykle dramatický průběh. Naproti tomu přítomnost atypických histiocytárních buněk v sinusech lymfatických uzlin či v lymfatické extranodální tkáni, pohlcujících lymfocyty a plazmocyty, jsou charakteristickým znakem Rosaiovy-Dorfmanovy choroby [1,2].
Patologické histiocyty v tomto případě obsahují také protein S-100, katepsin, CD68, CD163 a ojediněle dokonce antigen CD1a+, podobně jako Langerhansovy buňky, ale na rozdíl od nich neobsahují Birbeckova granula. Původ patologických histiocytů této choroby není stanoven, nejspíše však odpovídá aktivovaným makrofágům, byť na druhé straně je zde hodně podobných znaků s Langerhansovými buňkami [1,8].
Etiologie
Etiologie této nemoci zůstává zatím zahalena tajemstvím. Rosaiova-Dorfmanova nemoc není řazena mezi maligní nemoci s typickou klonální maligní proliferací transformovaných buněk. Vzhledem k tomu, že u většiny pacientů před stanovením diagnózy Rosaiovy-Dorfmanovy nemoci byly pozorovány různé infekce, zvažovala se v předchozích letech infekční příčina. Pátralo se po možné souvislosti s nějakou infekcí, jako je viróza Epsteina-Barrové, infekce lidským herpetickým virem 6, parvovirem B-19 a polyoma virem [9,10].
Jasnou souvislost s uvedenými virovými infekcemi se však nepodařilo prokázat. Nicméně byla prokázána alterace imunity předcházející Rosaiovu-Dorfmanovu nemoc. Tato alterace imunity je příčinou jevu emperipolesis a příčinou této nemoci. Alterace imunity, která umožní vznik této nemoci, je také příčinou četných infekcí před stanovením diagnózy Rosaiovy-Dorfmanovy choroby. Hypotézu alterované imunity jako předchozí podmínky vzniku nemoci podporuje relativně častý současný výskyt Rosaiovy-Dorfmanovy nemoci a některé ze skupiny autoimunitních chorob. Z nich je nejčastěji diagnostikována autoimunitní hemolytická anémie. V menší frekvenci byly zaznamenány další autoimunitní choroby typu revmatoidní artritidy, glomerulonefritidy, astmatu. Také diabetes mellitus se vyskytuje častěji než v průměrné populaci [11–16].
Foukar ve své analýze zemřelých pacientů s Rosaiovou-Dorfmanovou nemocí zjistil, že 70 % zemřelých mělo prokázanou alteraci imunity a pouze u 12 % zemřelých nebyla známa alterace imunity [17]. Takže míra alterace imunity u pacienta s Rosaiovou-Dorfmanovou nemocí souvisí s jeho prognózou.
Alterace imunity u pacientů s Rosaiovou-Dorfmanovou nemocí způsobuje také vyšší výskyt maligních krevních chorob ve srovnání s průměrnou, stejně starou populací. Relativně často je popisován současný výskyt Rosaiovy-Dorfmanovy nemoci a histiocytózy z Langerhansových buněk. To lze interpretovat jako možnou společnou příčinnou souvislost anebo jako společný původ buněk Rosaiovy-Dorfmanovy nemoci a histiocytózy z Langerhansových buněk v monocyto-makrofágové linii [18,20,21]. Dále byl zjištěn zvýšený výskyt lymfomů u pacientů s Rosaiovou-Dorfmanovou nemocí [22–25].
Příznaky nemoci
Vzniku lymfadenopatie mohou předcházet nespecifické teploty, někdy potíže odpovídající faryngitidě čili nachlazení, pocity patologické únavy, noční poty a úbytek hmotnosti, tedy klasické B symptomy, jak je známe u lymfomů. U popisované pacientky to byla jen patologická únava, která předcházela erupci uzlin na krku.
Klinický průběh bývá velmi divergentní, na jedné straně se popisují spontánní remise, na druhé straně jsou popsány případy s dokumentovanou progresí, kdy nemoc přestala reagovat na podávanou léčbu [26–28].
Laboratorní nálezy u pacientů s Rosaiovou-Dorfmanovou nemocí nejsou nijak typické. V některých případech bývá přítomna nezávažná anémie a zvýšená sedimentace. Polyklonální zmnožení imunoglobulinů bývá nalézáno až u 90 % vyšetřených. Naše pacientka měla jen mírně zvýšenou koncentraci imunoglobulinů typu IgG nad horní fyziologickou hranici.
Nejčastějším klinickým příznakem je nebolestivá krční a submandibulární lymfadenopatie. Méně často bývají také zvětšené uzliny v mediastinu či v břišní dutině [28]. V námi popsaném případě byla metodou FDG-PET/CT prokázána jak krční, tak i mediastinální lymfadenopatie. V literatuře lze ale najít také popisy mimouzlinového postižení. Mimouzlinové manifestace provázejí asi 43 % případů Rosaiovy-Dorfmanovy choroby. Nejčastěji bývá touto chorobou postižena kůže. Kožní forma nabývá forem od jedné papuly až po mnohočetné noduly a plaky [28,29].
V oblasti hlavy byla nemoc popsána na víčkách, v orbitě, v centrálním nervovém systému a případně na meningách, imitujících meningiom či vícečetné meningiomy [30,31].
Dále byla ložiska této choroby popsána v prsou, v ledvině, ve štítné žláze, varlatech, v horní či dolní části respiračního traktu. Infiltrace ledvin, dolní části respiračního traktu mají obvykle nejméně příznivý průběh ze všech lokalizací [32–36]. Někdy jsou přítomna i osteolytická ložiska této nemoci [37].
Při agresivnější formě této nemoci se současně s postižením uzlin objevují stejné změny v jiných orgánech a tkáních, takže klinický nález je velmi podobný lymfomu [38].
Lze tedy shrnout, že nemoc sice dominantně postihuje uzliny, ale výjimečně může postihnout kterýkoliv orgán a tkáň, tedy podobně jako je tomu u lymfomů. Přehled možných manifestací nemoci uvádí McClain v tab. 1.
Vývoj nemoci se klasicky hodnotí klinicky a dále pomocí klasických zobrazovacích metod, jako je ultrasonografie, CT a MRI a nejnověji pomocí FDG-PET/CT, protože patologické masy Rosaiovy-Dorfmanovy nemoci zvýšeně akumulují 18F-fluorodeoxyglukózu [39–44].
Table 1. Lokalizace Rosaiovy-Dorfmanovy nemoci. Upraveno podle [7,28] ![Lokalizace Rosaiovy-Dorfmanovy nemoci. Upraveno podle [7,28]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b62ceb3dcd047cd44e37c4e46350aaab.jpg)
Léčba
Vzhledem k velmi nízké incidenci této nemoci neexistují klinické studie, které by ověřovaly a srovnávaly léčebné postupy. K dispozici pro rozhodování o léčbě jsou pouze popisy jednotlivých případů či menších skupinek pacientů. Dle informací dostupných v roce 2015 lze léčbu rozdělit na intervenci imunosupresivní a cytostatickou a na intervenci imunomodulačními léky. V podstatě lze říci, že jak se v proudu času od prvního popisu této nemoci dostávaly do praxe nové léky, tak byly také testovány u této nemoci. První léčebné pokusy obsahovaly prednison, cyklofosfamid, antimetabolity, vinka alkaloidy a další cytostatika. Prvním imunomodulačním lékem použitým u této nemoci byl talidomid, následoval lenalidomid a na otestování v této indikaci čeká pomalidomid. Do imunomodulační léčby můžeme v tomto případně zařadit i interferon α a rituximab.
Prednison a radioterapie
Literatura popisuje u limitovaného postižení často parciální efekt prednisonu, nikoliv však kompletní vymizení nemoci [45]. K tomu v některých, ale ne ve všech případech, došlo až po přidání radioterapie. Zvláště u kožních lokalizovaných forem byla radioterapie přínosná [46–48].
Chemoterapie
Léky ze skupiny cytostatik se zřejmě liší v možnosti ovlivnit tuto chorobu.
Běžná kombinace antracyklinů + cyklofosfamidu + vinkristinu, tak jak se podává u lymfomů, měla dle popisů Maia jen omezený přínos [45].
Poměrně často byly podávány kombinace antimetabolitů (metotrexátu, 6-merkaptopurinu, thioquaninu) a vinblastinu, tedy podobné kombinace, jaké jsou používány pro léčbu histiocytózy z Langerhansových buněk. Tyto antimetabolity se podávají po více měsíců a dle sdělení v odborné literatuře vedou k regresi nemoci, ale samozřejmě ne ve všech případech [49]. Dlouhodobá perorální léčba antimetabolity a případně vinka alkaloidy představuje jednu z léčebných možností.
2-chlorodexyadenozin
Původ fagocytujících buněk Rosaiovy-Dorfmanovy nemoci, podobně jako buněk histiocytózy z Langerhansových buněk, je v prekurzoru odvozeném z monocyto-makrofágové linie. Buňky monocyto-makrofágové linie a klidové lymfocyty jsou velmi senzitivní na působení 2-chlorodeoxyadenozinu [50]. 2-chlorodeoxyadenozin má výrazný negativní vliv na viabilitu a funkci monocytů, snižuje produkci interleukinu 6 monocyty, který pravděpodobně hraje důležitou roli u Rosaiovy-Dorfmanovy nemoci [51]. To je teoretické vysvětlení, proč se 2-chlorodeoxyadenozin používá se značným úspěchem u Langerhansovy histiocytózy a u dalších histiocytárních chorob a proč také vede k regresi Rosaiovy-Dorfmanovy nemoci. V literatuře lze nalézti zatím jen 4 publikace, které popisují léčbu tímto lékem a ve všech případech bylo dosaženo remise nemoci [52–55].
Clofarabin, purinové analogum 2. generace, bylo nedávno testováno u skupiny 18 pacientů s různými histocytárními chorobami a v této skupině byly také 3 pacienti s Rosaiovou-Dorfmanovou nemocí. Clofarabin dosáhl léčebné odezvy u všech 3 nemocných, ale u 2 nemoc po několika měsících recidivovala. Pouze u 1 nemocného bylo dosaženo dlouhodobé léčebné odezvy, která při zveřejnění této publikace trvala 17 měsíců, zatímco u 2 došlo za několik měsíců od přerušení léčby k recidivě nemoci [56].
IMIDs
IMIDs je anglická zkratka pro immunomodulatory drugs, neboli pro léky modulující imunitní odezvu. Prvním lékem z této skupiny byl talidomid. V 60. letech 20. století byl podáván proti nevolnosti v graviditě s následnými značnými teratogenními účinky. Po 40 letech se přišlo na to, že má léčebný efekt u mnohočetného myelomu, ale také u mnoha dalších chorob. Efekt léků ze skupiny IMIDs není zcela objasněn, jsou známy pouze dílčí účinky. Jedním z těchto účinků je modulace imunitní odezvy. Bylo prokázáno, že Rosaiova-Dorfmanova nemoc je provázená zvýšenými hladinami TNFα a interleukinu 6. Léky ze skupiny IMIDs snižují expresi TNFα a snižují hladiny interleukinu 6. Dále je u Rosaiovy-Dorfmanovy nemoci zvýšená hladina cytokinu macrophage colony stimulating factor (M-CSF), což je jedna ze zvažovaných příčin jevu emperipolesis, a je také zvýšena hladina interleukinu 10. IMIDs mají potenciál snižovat hladiny těchto cytokinů. Proto jsou používány také u této nemoci, velmi často dosahují léčebné odezvy, ale ne ve všech případech [57–63], podobně jako u Castlemanovy nemoci, u níž také vedou k léčebné odezvě, ne však ve všech případech, což potvrzují i naše zkušenosti s léčbu Castlemanovy choroby.
Účinek lenalidomidu zmiňuje v roce 2015 pouze 1 publikace s pozitivním výsledkem. Bylo dosaženo léčebné odezvy u pacienta nereagujícího na předchozí léčbu [64].
Interferon α
Interferon α byl testován u této nemoci v 90. letech minulého století, kdy panovalo nadšení z interferonu α. Léčebné výsledky byly rozporuplné, v některých případech nastala regrese, v jiných zůstalo podávání bez léčebné odezvy. Novější publikace popisující efekt interferonu α se objevily až po uvedení pegylovaného interferonu do klinické praxe [65–72]. Z publikovaných dat vyplývá, že u některých pacientů vedla léčba interferonem α k remisi, zatímco u jiných nemoc na tuto léčbu nereagovala. Léčbu interferonem α lze u těchto pacientů otestovat a dlouhodoběji má smysl ji podávat pouze při zřetelné léčebné odezvě. Nicméně nežádoucí účinky dlouhodobé léčby interferonem α nejsou dle našich zkušeností zanedbatelné, a proto jsme léčbu interferonem α u naší pacientky nezvažovali.
Rituximab
Podání rituximabu lze v tomto případě včlenit do imunomodulační kategorie léčby. Lék je namířen proti antigenu CD20 na B-lymfocytech a jeho podání vede k jejich apoptotické smrti. Redukce počtu CD20 lymfocytů ovlivňuje také imunitní odezvu. Dle mála publikovaných dat dosáhl rituximab regrese této histiocytární choroby. Účinnost rituximabu nelze vysvětlit účinkem na patologickou histiocytární populaci, proto je nutné připustit dosažení léčebné odezvy zásahem do patologické imunitní odezvy, která tuto nemoc způsobuje [73–75]. Rituximab tedy překvapivě patří k účinným lékům pro tuto nemoc, podobně jako patří k účinným lékům pro multicentrickou formu Castlemanovy nemoci.
Imatinib
Imatinib, standardní lék pro chronickou myeloidní leukemii, byl použit s úspěchem pro léčbu jednoho případu Rosaiovy-Dorfmanovy nemoci. Výsledkem byla remise trvající déle než 9 měsíců. Autoři vysvětlovali účinnost zvýšenou expresí receptoru plateled derived growth factor (PDGFR) α a β v histiocytárních buňkách léčeného pacienta [76].
U dalšího pacienta, u něhož byl imatinib také testován, se léčebný efekt nedostavil [77]. Imatinib tedy není u této nemoci běžně používán.
Závěr
Z uvedeného přehledu informací o léčbě této nemoci jsme pro naši pacientku vybrali 2-chlorodeoxyadenozin (kladribin). Výběr léku ovlivnily naše předchozí excelentní zkušenosti s tímto lékem u pacientů s histiocytózou z Langerhansových buněk. Hematologové znají tento lék z léčby vlasatobuněčné leukemie, u níž se používá jako lék první linie. Používán byl také u B chronické lymfocytární leukemie (B-CLL) a u folikulárního lymfomu. 2-chlorodeoxyadenozin u těchto diagnóz někdy vedl k závažné cytopenii, obzvláště pokud byl použit v kombinaci s alkylačními cytostatiky. Ale u všech těchto chorob (u vlasatobuněčné leukemie, u chronické B lymfocytární leukemie a u generalizované formy folikulárního lymfomu), u nichž byly popisovány cytopenie po aplikaci 2-chlorodeoxyadenozinu, byla vždy přítomna infiltrace kostní dřeně maligními buňkami. Proto je reziduální fyziologická krvetvorba zranitelnější cytostatickou léčbou než v případech pacientů s nemocemi, které neinfiltrují kostní dřeň. U našich pacientů s histiocytózou z Langerhansových buněk a u Erdheimovy-Chesterovy choroby léčených 2-chlorodeoxyadenozinem nebyla kostní dřeň postižena a nebyla postižena ani u naší pacientky s Rosaiovou-Dorfmanovou nemocí. Proto zřejmě 2-chlorodeoxyadenozin v popisovaném případě nezpůsoboval žádnou cytopenii a neměl ani žádné další nežádoucí účinky. Proto si myslíme, že je 2-chlorodeoxyadenozin v monoterapii optimálním lékem pro iniciální léčbu Rosaiovy-Dorfmanovy nemoci. Při jeho neúčinnosti bychom teprve pak volili jiný léčebný způsob, zřejmě léky ze skupiny IMIDs, nebo rituximab.
Děkujeme MUDr. Haně Burkoňové, revizní lékařce VZP ČR, a kolektivu pracovníků OKRZP Ústředí VZP ČR, kteří posuzovali celou problematiku, za povolení úhrady léčby velmi vzácné Rosaiovy-Dorfmanovy nemoci, pro kterou neexistují oficiální léčebná doporučení.
Práce byla vytvořena v rámci podpory následujících grantových aktivit: AZV 15–29508A-MZ ČR-RVO (FNBr, 65269705) a 23/14/NAP a dále MZ ČR-RVO MOÚ 00209805 a také MŠMT-NPU-I-LO1413 a také MUNI/A/1180/2014,2015 a 2016.
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 23. 11. 2015
Přijato po recenzi 16. 2. 2016
Sources
1. Rosai J, Dorfman RF. Sinus histiocytosis with massive lymphadenopathy. A newly recognized benign clinicopathological entity. Arch Pathol 1969; 87(1): 63–70.
2. La Barge DV, Salzman KL, Harnsberger HR et al. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease): imaging manifestations in the head and neck. AJR Am J Roentgenol 2008; 191(6): W299-W306. Dostupné z DOI: http://dx.doi.org/10.2214/AJR.08.1114.
3. Mazánek J, Povýšil C. Rosai-Dorfmanova nemoc v oblasti hlavy a krku. Choroby hlavy a krku; 2006; 15(1) a 2005; 14(3–4): 39–43.
4. Lim KS. A case of cutaneous Rosai-Dorfman Disease presenting as breast nodules. Čs Derm 2006; 81(1): 44–45.
5. Jabali Y, Smrčka V, Přádná J. Rosai-Dorfman disease – successful long-term results by combination chemotherapy with prednisone, 6-mercaptopurine, methotrexate, and vinblastine – a case report. Internat J Surgl Pathol 2005; 13(3): 285–289.
6. Kodetová D, Kodet R, Syrůček M et al. Sinusová histiocytóza s masivní lymfadenopatií – diseminovaná forma syndromu Rosai-Dorfman. Česk Patol 1996; 32(2): 53–59.
7. McClain KL, Natkunam Y, Swerdlow SH. Atypical cellular disorders. Hematology Am Soc Hematol Educ Program 2004; 283–296.
8. Picarsic J, Jaffe R. Nosology and Pathology of Langerhans Cell Histiocytosis. Hematol Oncol Clin North Am 2015; 29(5): 799–823.
9. Sarwal R, Tu E, Mendelblatt FI et al. Atypical ocular presentations of Rosai-Dorfman disease. Ocul Immunol Inflamm 2008; 16(1): 9–15.
10. Al-Daraji W, Anandan A, Klassen-Fischer M et al. Soft tissue Rosai-Dorfman disease: 29 new lesions in 18 patients, with detection of polyomavirus antigen in 3 abdominal cases. Ann Diagn Pathol 2010; 14(5): 309–316.
11. Kaur PP, Birbe RC, DeHoratius RJ. Rosai-Dorfman disease in a patient with systemic lupus erythematosus. J Rheumatol 2005; 32(5): 951–953.
12. Alqanatish JT, Houghton K, Bond M et al. Rituximab treatment in a child with Rosai-Dorfman disease and systemic lupus erythematosus. J Rheumatol 2010; 37(8): 1783–1784.
13. Salim A, Williamson M, Barker F et al. Steroid responsive cutaneous Rosai-Dorfman disease associated with uveitis and hypothyroidism. Clin Exp Dermatol 2002; 27(4): 277–279.
14. Grabczynska SA, Toh CT, Francis N et al. Rosai-Dorfman disease complicated by autoimmune haemolytic anaemia: case report and review of a multisystem disease with cutaneous infiltrates. Br J Dermatol 2001; 145(2): 323–326.
15. Venkataraman G, McClain KL, Pittaluga S et al. Development of disseminated histiocytic sarcoma in a patient with autoimmune lymphoproliferative syndrome and associated Rosai-Dorfman disease. Am J Surg Pathol 2010; 34(4): 589–594.
16. Drosos AA, Georgiadis AN, Metafratzi ZM et al. Sinus histocytosis with massive lymphadenopathy (Rosai-Dorfman disease) in a patient with primary Sjogren’s syndrome. Scand J Rheumatol 2004; 33(2): 119–122.
17. Sachdev R, Shyama J. Co-existent Langerhans cell histiocytosis and Rosai-Dorfman disease: a diagnostic rarity. Cytopathology 2008; 19(1): 55–58.
18. Wang KH, Cheng CJ, Hu CH et al. Coexistence of localized Langerhans cell histiocytosis and cutaneous Rosai-Dorfman disease. Brit J Dermatol 2002; 147(4): 770–774.
19. O’Malley DP, Duong A, Barry TS et al. Co-occurrence of Langerhans cell histiocytosis and Rosai-Dorfman disease: possible relationship of two histiocytic disorders in rare cases. Mod Pathol 2010; 23(12): 1616–1623.
20. Llamas-Velasco M, Cannata J, Dominguez I al. Coexistence of Langerhans cell histiocytosis, Rosai-Dorfman disease and splenic lymphoma with fatal outcome after rapid development of histiocytic sarcoma of the liver. J Cutan Pathol 2012; 39(12): 1125–1130.
21. Pang CS, Grier DD, Beaty MW. Concomitant occurrence of sinus histiocytosis with massive lymphadenopathy and nodal marginal zone lymphoma. Arch Pathol Lab Med 2011; 135(3): 390–393.
22. Moore JC, Zhao X, Nelson EL. Concomitant sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease) and diffuse large B-cell lymphoma: a case report. J Med Case Rep 2008; 2 : 70. Dostupné z DOI: <http://dx.doi.org/10.1186/1752–1947–2-70>.
23. Akria L, Sonkin V, Braester A et al. Rare coexistence of Rosai-Dorfman disease and nodal marginal zone lymphoma complicated by severe life-threatening autoimmune hemolytic anemia. Leuk Lymphoma 2013; 54(7): 1553–1556.
24. Di Tommaso L, Rahal D, Bossi P et al. Hepatic Rosai-Dorfman disease with coincidental lymphoma: report of a case. Int J Surg Pathol 2010; 18(6): 540–543.
25. Noguchi S Yatera K, Shimajiri S et al. Intrathoracic Rosai Dorfman disease with spontaneous remission: a clinical report and review of the literature. Tohoku J Exp Med 2012; 227(3): 231–325.
26. Foucar E, Rosai J, Dorfman RF. Sinus histiocytosis with massive lymfadenopathy. An analysis of 14 death occuring in patient registry. Cancer 1984 : 54(9): 1834–1840.
27. Noguchi S, Yatera K, Shimajiri S et al. Intrathoracic Rosai-Dorfman disease with spontaneous remission: a clinical report and a review of the literature. Tohoku J Exp Med 2012; 227(3): 231–325.
28. Foucar E, Rosai J, Dorfman R. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease): review of the entity. Semin Diagn Patho 1990; 7(1): 19–73.
29. Wang KH, Chen WY, Liu HN et al. Cutaneous Rosai-Dorfman disease: clinicopathological profiles, spectrum and evolution of 21 lesions in six patients. Br J Dermatol 2006; 154(2): 277–286.
30. Beros V, Houra K, Rotim K et al. Isolated cerebellar intraparenchymal Rosai-Dorfman disease – case report and review of literature. Br J Neurosurg 2011; 25(2): 292–296.
31. Catalucci A, Lanni G, Ventura L et al. A rare case intracranial Rosai Dorfman disease mimicking multiple meningiomas. Neuroradiol 2012; 25(5): 569–574.
32. Green I, Dorfman RF, Rosai J. Breast involvement by extranodal Rosai-Dorfman disease: report of seven cases. Am J Surg Pathol 1997; 21(6): 664–668.
33. Abdollahi A, Ardalan FA, Ayati M. Extranodal Rosai-Dorfman disease of the kidney. Ann Saudi Med 2009; 29(1): 55–57.
34. Chhabra S, Agarwal R, Garg S et al. Extra-nodal Rosai-Dorfman disease: a case report with thyroid involvement. Diagn Cytopathol 2012; 40(5): 447–449.
35. Del Gobbo A, Moltrasio F, Young RH et al. Involvement of the testis and related structures by Rosai-Dorfman disease: report of 2 new cases and review of the literature. Am J Surg Pathol 2013; 37(12): 1871–1875.
36. Zhu F, Zhang JT, Xing XW et al. Rosai-Dorfman disease: a retrospective analysis of 13 cases. Am J Med Sci 2013; 345(3): 200–210.
37. Demico EG, Rosenberg AE, Björnsson J et al. Primary Rosai-Dorfman disease of bone: a clinicopathologic study of 15 cases. Am J Surg Pathol 2010; 34(9): 1324–1333.
38. Shiran MS, Tan CG, Kinali MS et al. Multifocal nodal and extanodal Rosai Dorfman disease initially diagnosed as histiocytic lymphoma. Malays J Pathol 2008; 30(1): 63–65.
39. Albano D, Bosio G, Bertagna F. 18F-FDG PET/CT Follow-up of Rosai-Dorfman Disease. Clin Nucl Med 2015; 40(8): e420-e422. Dostupné z DOI: http://dx.doi.org/10.1097/RLU.0000000000000853.
40. Karunanithi S, Singh H, Sharma P et al. 18F-FDG PET/CT imaging features of Rosai Dorfman disease: a rare cause of massive generalized lymphadenopathy. Clin Nucl Med 2014; 39(3): 268–289.
41. Deshayes E, Le Berre JP, Jouanneau E et al. 18F-FDG PET/CT findings in a patient with isolated intracranial Rosai-Dorfman disease. Clin Nucl Med 2013; 38(1): e50-e52. Dostupné z DOI: http://dx.doi.org/10.1097/RLU.0b013e31825ae73b.
42. Tsang JS, Anthony MP, Wong MP et al. The use of FDG-PET/CT in extranodal Rosai-Dorfman disease of bone. Skeletal Radiol 2012; 41(6): 715–717.
43. Raslan OA, Schellingerhout D, Fuller GN et al. Rosai-Dorfman disease in neuroradiology: imaging findings in a series of 10 patients. AJR Am J Roentgenol 2011; 196(2): W187-W193.
44. Hock AT, Long MT, Sittampalam K et al. Rosai-Dorfman disease: FDG PET/CT findings in a patient presenting with pyrexia and cervical adenopathy. Clin Nucl Med 2010; 35(8): 576–578.
45. Maia RC, Meis E, Romano S et al. Rosai Dorfman disease: a report of 8 cases in a tertiary care center and review of the literature. Brazil J Med Biolog Research 2015; 48(1): 6–12.
46. Ocheni S, Ibegbulam OG, Okafor OC et al. Usefulness of oral corticosteroid in Rosai-Dorfman disease. Eur J Cancer Care (Engl) 2007; 16(3): 286–288.
47. Oka M, Kamo T, Goto N et al. Successful treatment of Rosai-Dorfman disease with low-dose oral corticosteroid. J Dermatol 2009; 36(4): 237–240.
48. Maklad AM, Bayoumi Y, Tunio M et al. Steroid-resistant extranodal rosai-dorfman disease of cheek mass and ptosis treated with radiation therapy. Case Rep Hematol 2013; 2013 : 428297. Dostupné z DOI: http://dx.doi.org/10.1155/2013/428297.
49. Horneff G, Jurgens H, Hort W et al. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease): response to methotrexate and mercaptopurine. Med Pediatr Oncol 1996; 27(3): 187–192.
50. Guchelaar H, Richel DS, Schaafsma MR. Clinical and toxicological aspect of the antineoplastic drug cladribine: a review. Ann Hematom 1994; 69(5): 223–230.
51. Carrera CJ, Terai C, Lotz M et al. Potent toxicity of 2-chlorodeoxyadenosine toward human monocytes in vitro and in vivo. A novel approach to immunosupressive therapy. J Clin. Incest 1990; 86(5): 1480–1488.
52. Konca C, Ozkurt ZN, Deger M et al. Extranodal multifocal Rosai-Dorfman disease: response to 2-chlorodeoxyadenosine treatment. Int J Hematol 2009; 89(1): 58–62.
53. Aouba A, Terrier B, Vasiliu V et al. Dramatic clinical efficacy of cladribine in Rosai-Dorfman disease and evolution of the cytokine profile: towards a new therapeutic approach. Haematologica 2006; 91(12 Suppl): ECR52.
54. Tasso M, Esquembre C, Blanco E et al. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease) treated with 2-chlorodeoxyadenosine. Pediatr Blood Cancer 2006; 47(5): 612–615.
55. Sasaki K, Pemmaraju N, Westin JR et al. A single case of Rosai-dorfman disease marked by pathologic fractures, kidney failure, and liver cirrhosis treated with single-agent cladribine. Front Oncol 2014; 4 : 297. Dostupné z DOI: http://dx.doi.org/10.3389/fonc.2014.00297.
56. Simko SJ, Tran HD, Jones J et al. Clofarabine salvage therapy in refractory multifocal histiocytic disorders, including Langerhans cell histiocytosis, juvenile xanthogranuloma and Rosai-Dorfman disease. Pediatr Blood Cancer 2014; 61(3): 479–487.
57. Nadal M, Kervarrec T, Machet MC et a. Cutaneous Rosai-Dorfman disease located on the breast: Rapid effectiveness of methotrexate after failure of topical Corticosteroids, acitretin and thalidomide. Acta Derm Venereol 2015; 95(6): 758–759.
58. Wang F, Zhou H, Luo DQ et al. Dermatoscopic findings in cutaneous Rosai-Dorfman disease and response to low-dose thalidomide. J Dtsch Dermatol Ges 2014; 12(4): 350–352.
59. Li X, Hong Y, An Q et al. Successful treatment of Rosai-Dorfman disease with low-dose oral thalidomide. JAMA Dermatol 2013; 149(8): 992–993.
60. Du J, Ding X, Cai L et al. Rosai-Dorfman disease: three difficult-to-diagnose cases. Eur J Dermatol 2010; 20(5): 650–651.
61. Merola JF, Pulitzer M, Rosenman K et al. Cutaneous Rosai-Dorfman disease. Dermatol Online J 2008; 14(5): 8.
62. Lu CI, Kuo TT, Wong WR et al. Clinical and histopathologic spectrum of cutaneous Rosai-Dorfman disease in Taiwan. J Amer Acad Dermatol 2004; 51(6): 931–939.
63. Tjiu JW, Hsiao CH, Tsai TF. Cutaneous Rosai-Dorfman disease: remission with thalidomide treatment. Brit J Dermatol 2003; 148(5): 1060–1061.
64. Rubinstein M, Assal A, Scherba M et al. Lenalidomide in the treatment of Rosai Dorfman Disease – a first in use report. Am J Hematol 2016; 91(2): E1. Dostupné z DOI: http://dx.doi.org/10.1002/ajh.24225.
65. Alliot C, Capiod JC, Claisse JF et al. Sinus histiocytosis of the Rosai-Dorfman type following Hodgkin disease: efficacy of interferon-alpha. Presse Med 1996; 25(4): 171.
66. Le Guenno G, Galicier L, Fieschi C et al. Dramatic efficiency of pegylated interferon in sinus histiocytosis with massive lymphadenopathy. Brit J Dermatol 2011; 164(1): 213–215.
67. Löhr HF, Gödderz W, Wölfe T et al. Long-term survival in a patient with Rosai-Dorfman disease treated with interferon-alpha. Eur J Cancer 1995; 31A(13–14): 2427–2428.
68. Palomera L, Domingo JM, Olave T et al. Sinus histiocytosis with massive lymphadenopathy: complete response to low-dose interferon-alpha. J Clin Oncol 1997; 15(5): 2176.
69. Palomera L, M Domingo J, Soria J et al. Long term survival in a patient with aggressive Rosai-Dorfman disease treated with interferon alpha. Med Clin (Barc) 2001; 116(20): 797–798.
70. Pulsoni A, Anghel G, Falcucci P et al. Treatment of sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease): report of a case and literature review. Amer J Hematom 2002; 69(1): 67–71.
71. Silvers AR, Som PM, Meyer RJ. Egg shell nodal calcification in a patient with sinus histiocytosis with massive lymphadenopathy treated with interferon. AJNR Amer J Neuroradiol 1996; 17(2): 361–363.
72. Xia JX, Jin XH, Mou Y et al. Combined treatment for cutaneous Rosai-Dorfman disease: a report of 2 cases. Int J Clin Exp Med 2013; 6(9): 822–827.
73. Alqanatish JT, Houghton K, Bond M et al. Rituximab treatment in a child with rosai-dorfman disease and systemic lupus erythematosus. J Rheumatol 2010; 37(8): 1783–1784.
74. Pagel JM, Lionberger J, Gopal AK et al. Therapeutic use of Rituximab for sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease). Am J Hematol 2007; 82(12): 1121–1122.
75. Petschner F, Walker UA, Schmitt-Gräff A et al. “Catastrophic systemic lupus erythematosus” with Rosai-Dorfman sinus histiocytosis. Successful treatment with anti-CD20/rituximab. Dtsch Med Wochenschr 2001; 126(37): 998–1001.
76. Utikal J, Ugurel S, Kurzen H et al. Imatinib as a treatment option for systemic non-Langerhans cell histiocytoses. Arch Dermatol 2007; 143(6): 736–740.
77. Gebhardt C, Averbeck M, Paasch U et al. A case of cutaneous Rosai-Dorfman disease refractory to imatinib therapy. Arch Dermatol 2009; 145(5): 571–574.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 6-
All articles in this issue
- Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péče
- Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
- Dlouhodobá léčba tromboembolické nemoci u pacientů se zhoubným nádorem
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typu
- Akútne príčiny náhlych úmrtí u pacientov so závažnou hypoglykémiou
- Kardiomyopatie v MR obraze
- Studie HOPE-3: statiny snižují kardiovaskulární příhody u pacientů s intermediárním rizikem ICHS
- mikroRNA a vnitřní lékařství: od patofyziologie k novým diagnostickým a terapeutickým postupům
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Kardiomyopatie v MR obraze
- Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péče
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

