-
Medical journals
- Career
Kardiomyopatie v MR obraze
Authors: Lenka Křivková 1; Věra Feitová 1,2; Jiří Vaníček 1,2
Authors‘ workplace: Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně 1; Mezinárodní centrum klinického výzkumu FN u sv. Anny v Brně 2
Published in: Vnitř Lék 2016; 62(6): 467-473
Category: Reviews
Overview
Cieľom tejto práce je poskytnúť súhrn základných informácií o najčastejších typoch kardiomyopatií, a hlavne o možnosti ich diagnostiky pomocou vyšetrenia srdca magnetickou rezonanciou (MR). Kardiomyopatie mávajú v MR obrazoch zväčša typické znaky, avšak ich diagnostika nemusí byť vždy jednoznačná. Sledovaním štrukturálnych zmien myokardu je možné stanoviť rozsah postihnutia a odhadnúť prognózu. MR vyšetrenie poskytuje vďaka pokročilým zobrazovacím technikám široké spektrum informácií o štruktúre i funkcii myokardu a nie je limitované akustickým oknom ako v prípade echokardiografie. V diagnostike kardiomyopatií má čoraz dôležitejšiu rolu a získava si u kardiológov svoje miesto i obľubu v diagnostickom algoritme.
Kľúčové slová:
amyloidóza – hypertrofia myokardu – kardiomyopatie – magnetická rezonancia srdcaÚvod
Kardiomyopatie sú podľa definície Európskej kardiologickej spoločnosti poruchy myokardu, pri ktorých je srdečný sval štrukturálne a funkčne abnormálny, a to pri absencii postihnutia koronárnych tepien, arteriálnej hypertenzie, chlopňovej chyby a vrodenej srdcovej chyby, ktoré by boli tak významné, aby mohli viesť k danej abnormalite myokardu [1]. Vyšetrenie srdca magnetickou rezonanciou je bezpečná metóda, ktorá poskytuje široké spektrum informácií o vyšetrovanom orgáne a spomedzi bežne dostupných zobrazovacích metód vyšetrovania srdca, ako napríklad echokardiografie, výpočtovej tomografie, selektívnej koronarografie či ventrikulografie, ako jediná prináša informácie o štruktúre myokardu, podľa ktorých je možné určiť závažnosť postihnutia, odhadnúť jeho prognózu a eventuálne stanoviť terapiu. Vyšetrenie delíme podľa typu sekvencie a zobrazenia na tieto oblasti – morfologické a funkčné zobrazovanie srdca, meranie a kvantifikácia tokov v hlavných cievach a chlopniach, zobrazovanie perfúzie myokardu, koronárneho riečiska a zobrazovanie časného a neskorého sýtenia. Základné typy kardiomyopatií sú hypertrofická kardiomyopatia (HCM), dilatačná kardiomyopatia (DCM), reštriktívna kardiomyopatia (RCM), arytmogénna kardiomyopatia pravej komory (ACM) a skupina neklasifikovaných kardiomyopatií, do ktorej okrem iného patrí nonkompaktná kardiomyopatia (LVNC) a tako-tsubo kardiomyopatia [1].
Hypertrofická kardiomyopatia
Charakteristickým rysom HCM je zväčšenie šírky steny komory alebo hmotnosti myokardu za neprítomnosti hypertenzie alebo chlopňovej chyby, schopnej tento stav spôsobiť. Prevalencia tohto ochorenia v populácii je 1 : 500 [2–4]. Najčastejším príznakom HCM býva námahová dušnosť, angína pectoris, presynkopa alebo synkopa. Námahová dušnosť je vysvetľovaná diastolickou dysfunkciou ľavej komory (LK), ischémiou myokardu, vznikom mitrálnej insuficiencie a fibriláciou siení [2,5]. Asi u 5 % chorých sa vyvinie systolická dysfunkcia so srdečným zlyhaním [2]. HCM môže mať neobštruktívnu a obštruktívnu formu. Obštrukcia najčastejšie vzniká subaortálne vo výtokovom trakte LK (left ventricular outflow tract – LVOT) v dôsledku hypertrofie bazálneho segmentu interventrikulárneho septa. Ďalej môže byť obštrukcia lokalizovaná midventrikulárne alebo apikálne. Vyskytuje sa v kľude alebo pri záťaži [2]. Postihuje až 70 % pacientov s HCM [6]. Morfologicky je pre HCM typická asymetrická hypertrofia steny LK, ktorej šírka v enddiastole presahuje 15 mm, avšak môže dosahovať šírku až 50 mm a môže postihovať aj papilárne svaly. V 70 % asymetrická hypertrofia postihuje hlavne bazálne segmenty interventrikulárneho septa a prednej steny LK, u 5 % pacientov môže mať charakter koncentrickej hypertrofie, izolovaná apikálna forma HCM sa častejšie vyskytuje v japonskej populácii [3], ďalej môže byť postihnutá aj stena pravej komory (PK), avšak tento obraz nie je častý [7]. Štúdia Spirita et al z roku 2000 uvádza, že miera hypertrofie priamo úmerná riziku rozvoja náhlej srdcovej smrti a je to silný, nezávislý prediktor prognózy [8].
Zobrazovacie metódy sú základom pre stanovenie diagnózy a slúžia k stratifikácii rizika náhlej srdcovej smrti. Výhodou MR vyšetrenia oproti echokardiografii je presnejšia detekcia kontúr endokardu a epikardu, hlavne v oblasti srdcového hrotu, anterolaterálnej steny LK a voľnej steny PK. Je presnejšia k stanoveniu asymetrickej hypertrofie steny komôr (obr. 1A, 1B, 1C), ktorá môže byť asymetrická nielen intersegmentálne, ale aj intrasegmentálne [9]. Podľa štúdie Rickersa et al z roku 2005 je MR vyšetrenie v porovnaní s echokardiografickým vyšetrením presnejšie v stanovení šírky extrémne hypertrofovanej steny LK a stanoveniu šírky anterolaterálnej steny LK [10]. Dynamické MR sekvencie v zobrazení „bright blood“, čiže zobrazenie „svetlou krvou“, v krátkej ose od srdcovej bázy až po hrot sa používajú k stanoveniu šírky steny LK, k stanoveniu hmotnosti myokardu, ku kvantifikácii kontraktility komory, čiže ejekčnej frakcie (EF) a ďalších objemových parametrov a k zhodnoteniu segmentálnej kontraktility. Hodnota EF v prípade HCM môže byť v norme alebo zvýšená, avšak s progresiou fibrózy sa znižuje [5]. Ďalej je možné na dynamických sekvenciách so zameraním na LVOT zhodnotiť prítomnosť intraventrikulárnej obštrukcie. Ak je prítomná, vzniká v systole na týchto sekvenciách tzv. signal void, čiže artefakt vznikajúci kvôli akcelerácii a turbulentnému toku krvi za stenózou, ktorý sa zobrazí na dynamických sekvenciách s „bielou krvou“ ako tmavý „jet“. Ďalšou sekvenciou, pomocou ktorej je možné detegovať intraventrikulárnu obštrukciu a dokonca merať gradienty v mieste maximálnej obštrukcie, je metóda fázového kontrastu. Okrem merania gradientov v mieste obštrukcie, môžeme pomocou tejto metódy merať prietok a smer toku na chlopniach, avšak echokardiografia je v tomto prípade metódou voľby. Obrovským prínosom MR vyšetrenia je zobrazenie postkontrastného sýtenia čiže fibrózy a iných štrukturálnych zmien myokardu na T1 vážených obrazoch (v.o.) po aplikácii gadolíniovej kontrastnej látky s odloženým skenovaním (tzv. LGE). Typicky LGE v prípade fibrózy u HCM vyzerá ako hypersignálne fokusy v stene komory LK lokalizované intramurálne [3,11] (obr. 1D), môžu sa objaviť aj v stene PK, ak je postihnutá [3,7]. Typicky sa nachádza v segmentoch najviac postihnutých hypertrofiou, software moderných prístrojov umožňuje i kvantifikáciu rozsahu fibrózy vyjadrenej či už v gramoch alebo v percentuálnom pomere k celkovej mase myokardu LK [9]. Bola dokázaná korelácia medzi mierou fibrózy, rozvojom dilatácie LK a výskytom náhlej srdcovej smrti [12] a tiež korelácia s výskytom komorových tachyarytmií [13,14].
Obr. 1A, 1B, 1C, 1D. Hypertrofická kardiomyopatia 
T1 v.o. v zobrazení DB (dark blood), čiže zobrazenie s tmavou krvou v 4CH (štvordutinová projekcia) a v SA projekcii (projekcia v krátkej ose): obraz asymetrickej hypertrofie LK v stredom a apikálnom segmente (A, B). T1 v.o. v zobrazení DB v SA projekcii: asymetrická hypertrofia LK, najvýraznejšia v septe (C). 2D segmented IR turboFLASH sekvencie (postkontrastné sekvencie k hodnoteniu LGE) v SA projekcii: šípky ukazujú intramurálny LGE lokalizovaný anteroseptálne a v prednej stene stredného segmentu (D) – typický obraz fibróznych zmien v rámci HCM. Archív KZM FN u sv. Anny v Brně. Dilatačná kardiomyopatia
Dilatačná kardiomyopatia (DCM) je charakterizovaná dilatáciou LK alebo oboch srdcových komôr spojený s poruchou kontraktilnej funkcie [9]. V klinickom obraze dominuje obraz ľavostranného srdcového zlyhania, pravostranné srdcové zlyhanie sa vyskytuje až u ťažších prípadov. K ďalším príznakom patria ventrikulárne arytmie, prevodné poruchy, náhla srdcová smrť, synkopy a zvýšené riziko tromboembolizmu [3]. V mikroskopickom obraze vidieť intersticiálnu fibrózu, apoptózu kardiomyocytov s hypertrofiou a elongáciou zachovaných kardiomyocytov. Tieto histologické zmeny spôsobujú excentrickú hypertrofiu [3]. Príčina DCM je v 50 % neznáma, predpokladá sa uplatnenie infekčných a imunologických mechanizmov. Druhá polovica predstavuje široké spektrum stavov ako myokarditída, hypertenzia, ischemické postihnutie, peripartálna kardiomyopatia a toxické poškodenie (alkohol, drogy, chemoterapeutiká) [3,15,16]. Niektorí autori udávajú, že v 20–35 % je jej výskyt familiárny [3].
MR vyšetrením zhodnotíme veľkosť srdcových oddielov, funkciu chlopní, šírku stien komôr a ich systolickú funkciu, štrukturálne zmeny myokardu, možnú prítomnosť intraventrikulárnych trombov, najčastejšie uložených v hrote. Funkčné štúdie na dynamických sekvenciách odhalia zväčšený enddiastolický a endsystolický objem komôr (obr. 2A, 2B) a zníženú EF komôr na podklade hypokontraktility myokardu, ktorá býva častejšie globálneho charakteru. Dilatované môžu byť aj siene. V súvislosti s dilatáciou oddielov môže byť prítomná insuficiencia chlopní. Použitím kontrastnej látky zhodnotíme štrukturálne zmeny myokardu a odlíšime pacientov s DCM od pacientov s dysfunkciou LK pre ischemické zmeny. Na odložených postkontrastných T1 vážených obrazoch (v.o.) môžu byť prítomné hyperintenzity, ktoré odpovedajú nekróze a fibróze. Sú najčastejšie pruhovité, lokalizované intramurálne alebo subepikardiálne, čím sa odlišujú od postischemických zmien (obr. 2C) [3,16,17]. Štúdia McCrohona et al z roku 2003 sledovala skupinu pacientov s diagnózou DCM s negatívnym koronarogramom, bez anamnézy infarktu myokardu, a zistila, že v súbore sledovaných pacientov u 59 % pacientov nie je LGE prítomný, u 28 % pacientov je LGE lokalizovaný intramurálne, čiže jednoznačne odlíšiteľný od postischemických zmien. U zostávajúcich 13 % bol LGE v lokalizácii typickej pre postischemické zmeny, čiže subendokardiálne alebo transmurálne, z čoho vyplýva, že časť pacientov so stanovenou diagnózou DCM v skutočnosti má systolickú dysfunkciu LK na podklade prekonaného infarktu myokardu [18]. Preukázanie fibrózy nemá len diagnostický, ale aj prognostický význam. Štúdia Assomulla et al z roku 2006 preukázala horšiu prognózu pacientov s DCM s intramurálnou fibrózou, ich častejšie rehospitalizácie a zvýšené riziko náhlej srdcovej smrti alebo komorových tachykardií, bez ohľadu na systolickú funkciu komôr [19].
Obr. 2A, 2B, 2C. Dilatačná kardiomyopatia 
TrueFISP (True fast imaging with steady state precession – tzv. dynamická sekvencia) sekvencia v 4CH a SA projekcii v enddiastole: obraz dilatovanej LK (A,B). 2D segmented IR turboFLASH sekvencie v SA projekcii u rovnakého pacienta: šípka ukazuje pruhovitý LGE lokalizovaným intramurálne v septe a inferoseptálne (C) – typický obraz fibrózy v rámci DCM. Archív KZM FN u sv. Anny v Brně. Reštriktívna kardiomyopatia
Reštriktívna kardiomyopatia (RCM) je definovaná ako ochorenie myokardu s reštriktívnou poruchou plnenia komôr, s normálnymi alebo zníženými komorovými objemami [1] a s disproporčným zväčšením siení kvôli zvýšeným plniacim tlakom komôr [3]. Je to heterogénna skupina ochorení, ktorá sa delí na infiltratívne ochorenia a ochorenia s patologickým ukladaním látok, ako je amyloidóza, sarkoidóza, hemochromatóza, glykogenózy, mukopolysacharidózy a sfingolipidózy a na neinfiltratívne kardiomyopatie, ako je endomyokardiálna fibróza, systémová sklerodermia a poradiačné postihnutie [9]. Klinický obraz je veľmi podobný obrazu konštriktívnej perikarditídy (edémy, dyspepsie, námahová dušnost, únava) [20]. Hlavnou úlohou zobrazovacích metód u pacientov s klinickým obrazom reštriktívneho ochorenia je odlíšenie RCM od konštriktívnej perikarditídy, čo je zásadné pre terapiu [3]. Zatiaľ čo terapia konštriktívnej perikaditídy spočíva v chirurgickej resekcii perikardu, terapia RCM býva konzervatívna [21]. Typickým znakom konštriktívnej perikarditídy v MR obraze je zhrubnutie perikardu a abnormálny pohyb medzikomorového septa počas respiračného cyklu na podklade komorovej interdependencie – počas inspíria sa septum vyklenuje do LK, v exspíriu je tomu naopak [9]. Najčastejšou príčinou RCM, s ktorou sa v našej praxi stretávame, je amyloidóza. Je to ochorenie spojené s extracelulárnym ukladaním proteínových vlákien rôzneho zloženia a uniformných vlastností [9]. Medzi najčastejšie typy patrí AL-amyloidóza (depozitá tzv. ľahkých reťazcov) a TTR-amyloidóza (amyloidóza spojená s tvorbou transthyretínu), ktorá má 2 formy – hereditárnu a senilnú [3,22]. Infiltrácia srdca amyloidom je príčinou smrti v približne polovici prípadov AL-amyloidózy [23]. Depozitá amyloidu sa vyskytujú v myokarde, chlopniach a v stenách koronárnych ciev [3]. Infiltrácia srdca amyloidom vedie k postupnému zhoršeniu diastolickej funkcie LK – pri plne vyjadrenom srdcovom postihnutí je prítomný obraz RCM [24]. Prognóza je zlá, terapia, ktorá závisí na type uloženého amyloidu, je veľmi obmedzená a neuspokojivá [22].
Na dynamických sekvenciách MR vyšetrenia zistíme normálne alebo znížené objemové parametre komôr, srdcové siene sú často objemnejšie pre diastolickú dysfunkciu, alebo pre insuficienciu chlopní [3]. Infiltrácia myokardu amyloidom spôsobuje hypertrofiu myokardu, niekedy asymetrickú, a tým môže imitovať HCM [3]. Kľúčovou sekvenciou MR vyšetrenia k potvrdeniu infiltrácie srdca amyloidom je hodnotenie LGE. Vogelsberg et al popísali v štúdii z roku 2008 typický obraz sýtenia myokardu oboch komôr, vrátane papilárnych svalov, prípadne siení, s maximom v subendokardiálnej oblasti (obr. 3). Tento charakteristický obraz dosahuje 80% senzitivity a 94% špecificity pre diagnostiku srdcovej amyloidózy [25].
Image 1. Amyloidóza 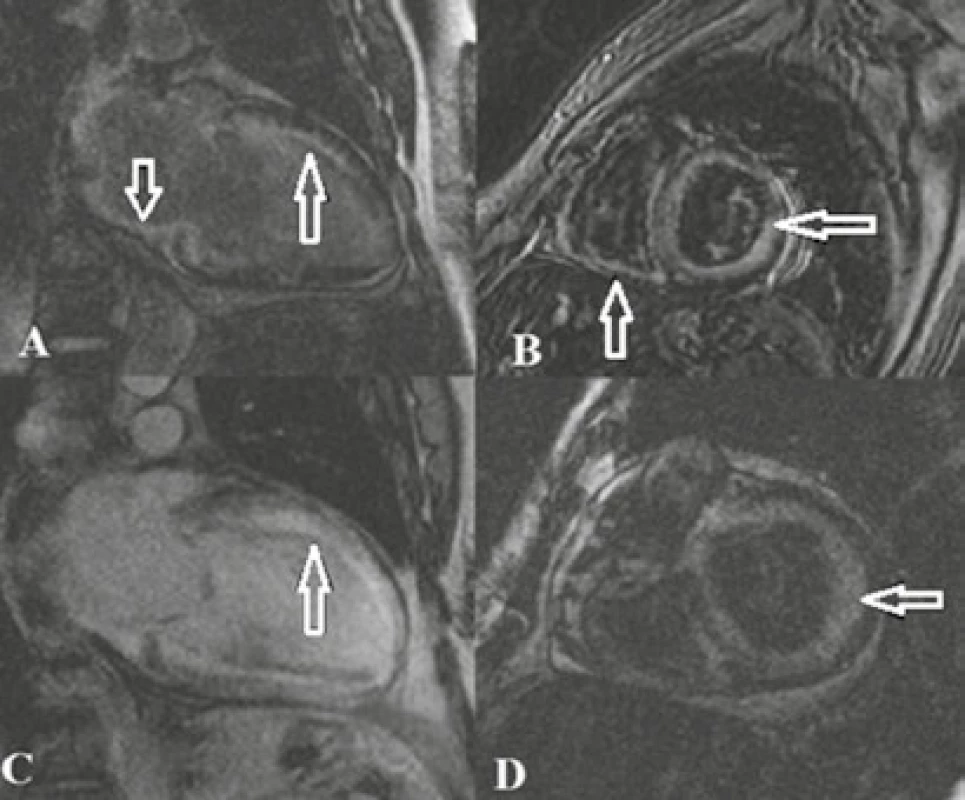
2D segmented IR turboFLASH sekvencie v projekcii 2CHLV (dvojdutinová projekcia v dlhej ose zobrazujúca ľavostranné srdcové oddiely) (A, C) a SA projekcia (B, D): šípky na snímkach ukazujú obraz difúzneho LGE myokardu siení i komôr so subendokardiálnou distribúciou – typický obraz amyloidózy srdca. Archív KZM FN u sv. Anny v Brně. Arytmogénna kardiomyopatia pravej komory
Arytmogénna kardiomyopatia pravej komory (ACM) je geneticky determinované ochorenie [26] charakterizované štrukturálnymi a funkčnými zmenami myokardu PK na podklade náhrady myokardu fibrolipomatóznym tkanivom, ktoré je „elektricky nestále“ a má sklony k ventrikulárnym arytmiám až ku vzniku náhlej srdcovej smrti [3]. Klinický obraz máva progresívny charakter, vychádza zo štrukturálnych a funkčných zmien. V počiatočnej fáze sa objavujú jemné štrukturálne zmeny, ktoré takmer výlučne postihujú voľnú stenu PK (tzv. trojuholník dysplázie, ktorý je vymedzený vtokovým i výtokovým traktom a apexom) [3,26]. V neskorších fázach sa objavuje zoslabenie steny s poruchou kontraktility ako napr. akinézou, dyskinézou alebo s fokálnymi aneuryzmami. S progresiou ochorenia môže dôjsť k postihnutiu septa a myokardu LK [3]. Postihnutie LK je chápané ako presah štrukturálnej prestavby z pravej na ľavú komoru. Izolované postihnutie LK je veľmi vzácne a nie je úplne jasné, či sa jedná o rovnakú diagnostickú jednotku. Prvé príznaky sa väčšinou objavujú v mladom veku, často u atlétov [27]. Zo začiatku sa môžu objavovať ojedinelé komorové arytmie, ale prvým prejavom ochorenia môže byť až náhla srdcová smrť. S postupnou progresiou štrukturálnych zmien sa zvyšuje výskyt symptomatických arytmií a progreduje kardiálna insuficiencia, ktorá je najskôr pravostranná, neskôr biventrikulárna [26,28].
K diagnostike ACM sa používajú tzv. malé a veľké kritériá, ktoré zahŕňajú štrukturálne, histologické, elektrokardiografické, arytmologické a genetické faktory [3,26]. K potvrdeniu ACM sú nutné 2 veľké kritériá, alebo 1 veľké a 2 malé kritériá, alebo 4 malé kritériá z rôznych skupín [26]. MR vyšetrenie v tejto indikácii patrí medzi štandardné vyšetrenia pre svoju dominanciu vo všetkých bodoch diagnostických kritérií určených pre zobrazovacie metódy [9]. Protokol MR vyšetrenia z tejto indikácie musí obsahovať dynamické sekvencie k stanoveniu veľkosti PK, jej objemových parametrov, k zhodnoteniu globálnej i segmentálnej systolickej funkcie. Ďalej sú to natívne T1 v.o. k zhodnoteniu lipomatóznej infiltrácie steny a postkontrastné T1 v.o. k zhodnoteniu fibrózy. Oficiálne MRI diagnostické kritéria ACM sú uvedené v tab. 1.
K signifikantným nálezom pre diagnostiku tohto ochorenia patrí:
- detekcia tukovej infiltrácie: tukové tkanivo je hypersignálne na natívnych T1 v.o. a dobre kontrastuje so signálom okolitého myokardu. MR zobrazenie voľnej steny PK môže odhaliť tukovú infiltráciu myokardu, avšak jej preukázanie nie je radené medzi oficiálne diagnostické kritéria, pretože samotná tuková infiltrácia nie je špecifická a vyskytuje sa napríklad u obéznych pacientov (obr. 4) [3].
- detekcia fibrózy: fibróza myokardu PK je ďalším znakom ACM. Detekcia fibrózy a jej rozsah na postkontrastných T1 v.o. sú dôležité pre stanovenie diagnózy. Niekoľko štúdií sledovalo úlohu kontrastného MR vyšetrenia u pacientov s podozrením na ACM a nález LGE, predstavujúci fibrózu PK, koreloval s histologickými nálezmi, avšak samotná fibróza myokardu nie je špecifická pre ACM (napr. sa môže jednať fibrózu po infarkte myokardu, po myokarditíde, DCM) [3].
- detekcia hypertrofie steny PK alebo jej zoslabenia: štrukturálne zmeny myokardu môžu viesť k jej výraznejšiemu zosilneniu a k zhrubnutiu jej trabekulizácie. V neskorších štádiách fibrózy dochádza k strate kardiomyocytov, čím stena PK zoslabuje a jej šírka je výrazne redukovaná [3].
- zhodnotenie segmentálnej a globálnej systolickej funkcie PK: detailné zhodnotenie vplyvu štrukturálnych zmien myokardu na kontraktilitu umožňujú dynamické sekvencie. Akinéza, dyskinéza, asynchronia kontrakcie a fokálne aneuryzmy steny PK [3], alebo zníženie jej globálnej systolickej funkcie sa radí k oficiálnym diagnostickým MRI kritériám (tab. 1).
Je nutné si uvedomiť, že jednoznačná diagnostika ACM zo samostatného MR vyšetrenia, bez znalosti anamnézy pacienta a sledovania ostatných veľkých a malých kritérií, nie je možná.
Image 2. Arytmogénna dysplázia pravej komory 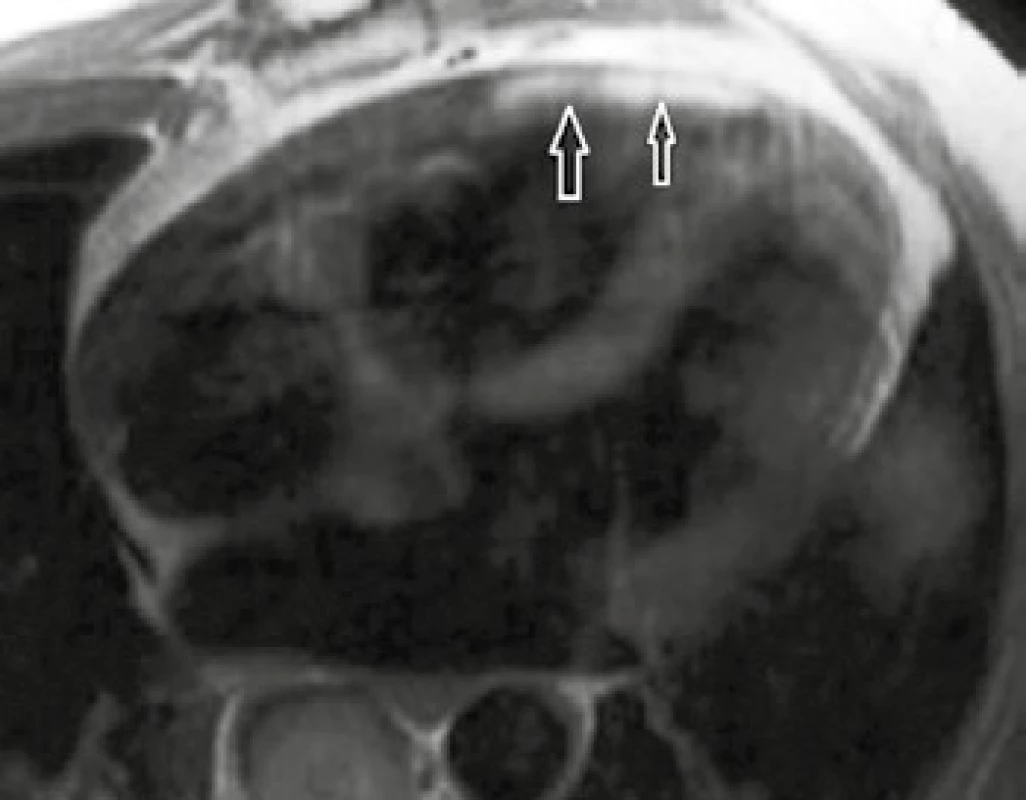
T1 v.o. v zobrazení DB v 4CH projekcii: na snímke šípky ukazujú na pruhovitú oblasť vyššieho signálu voľnej steny PK odpovedajúci jej tukovej infiltrácii. Archív KZM FN u sv. Anny v Brně. Table 1. MR kritériá pre diagnostiku ACM. Upravené podľa [26]. ![MR kritériá pre diagnostiku ACM. Upravené podľa [26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/53abef75fbc4cb47a37f774443b8985d.jpg)
Nonkompaktná kardiomyopatia
Nonkompaktná kardiomyopatia (LVNC), nazývaná aj špongiózny myokard [3], je geneticky determinované ochorenie charakterizované výraznou trabekulizáciou luminálnej strany steny srdcovej komory (tzv. nekompaktná vrstva). Iba menšia časť je tvorená kompaktnou, teda morfologicky normálnou vrstvou myokardu, ktorá tvorí vonkajšiu časť steny komory [29]. Nekompaktná vrstva je široká, medzi trabekulami sú hlboké recesy, ktoré komunikujú s dutinou komory [30] (obr. 5). Za vznik toho ochorenia sa považuje zástava endomyokardiálnej morfogenézy (zástava kompakcie myokardu), ktorá prebieha v 5.–8. týždni fetálneho vývoja [3,31]. Najčastejšie postihuje apikálny a stredný segment dolnej a laterálnej steny LK, výnimočne sa môže nekompaktný myokard vyskytovať i v PK [3]. Toto ochorenie môže mať izolovanú formu, alebo sa môže vyskytovať s ďalšou vrodenou srdcovou chybou, pacientov ohrozuje vznikom srdcového zlyhávania, malígnymi arytmiami a tromboembolizmom [3,9,32].
Image 3. Nonkompaktná kardiomyopatia 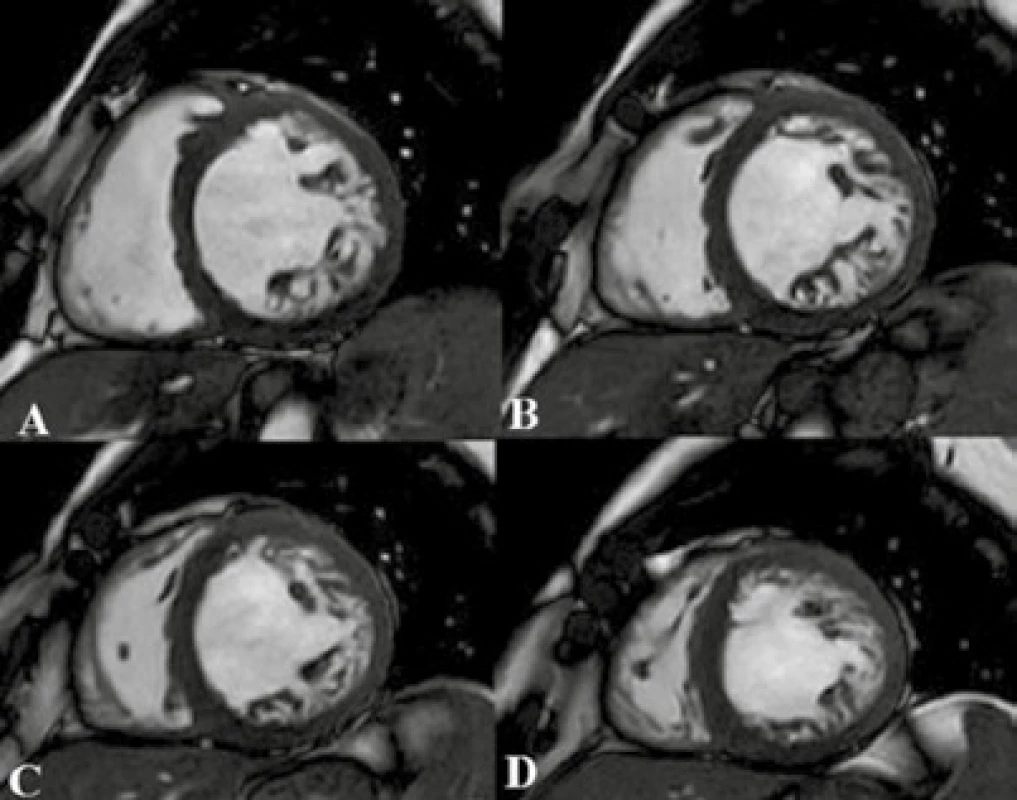
TrueFISP sekvencia v SA projekcii stredných segmentov (A–D): na snímkach je vidieť výraznějšia trabekulizácia laterálnej steny LK – obraz LVNC. Archív KZM FN u sv. Anny v Brně. Diagnostika je možná pomocou echokardiografie a MR vyšetrenia. MR má oproti echokardiografii výhodu v kvalitnejšom zobrazení hrotu a apikálnych segmentov. Lokalizáciu a rozsah zhrubnutej trabekulizácie, šírku kompaktnej a nekompaktnej vrstvy ako aj systolickú funkciu komôr zhodnotíme na dynamických sekvenciách v rôznych projekciách. Stanovením diagnostických kritérií pre LVNC sa zaoberala štúdia Petersena et al z roku 2005, v ktorej porovnávali šírku nekompaktnej a kompaktnej vrstvy v diastole. Za patognomický pomer šírky nekompaktnej/kompaktnej vrstvy stanovili hodnotu ≥ 2,3 so senzitivitou 86 % a špecificitou 99 % pre diagnózu LVNC [33]. Štúdia Jacquiera et al z roku 2010 sa zaoberala kvantifikáciou nekompaktnej vrstvy, ktorá bola vypočítaná rozdielom celkovej hmotnosti myokardu a hmotnosti kompaktnej vrstvy. Hodnota nekompaktnej vrstvy myokardu presahujúca 20 % predikuje diagnózu LVNC so 91,6% senzitivitou a 86,5% špecificitou [30]. Na postkontrastných T1 v.o. môžeme odhaliť fibrózne zmeny, ktoré ale nemusia byť prítomné, ďalej môžeme zhodnotiť prítomnosť intraventrikulárnych trombov.
Tako-tsubo kardiomyopatia
Jedná sa o reverzibilnú kardiomyopatiu často vyvolanú stresovou situáciou, charakterizovanú náhle vzniknutými bolesťami na hrudi, ktoré sú sprevádzané zmenami EKG krivky, negatívnym koronarogramom a prechodnou poruchou kinetiky stredných a apikálnych segmentov LK [3,9]. Jej výskyt je v skupine pacientov s podozrením na infarkt myokardu s eleváciou ST segmentu odhadovaný na 2–3 %. Ochorenie postihuje častejšie postmenopauzálne ženy, priemerný vek je 62–75 rokov [34].
MR vyšetrenie zahrňuje dynamické sekvencie na zobrazenie poruchy kinetiky LK, pre ktorú je typické balónovité vyklenutie hrotu v systolickej fáze, tzv. apical ballooning. Ten vzniká na podklade hypokontraktility stredných a apikálnych segmentov (obr. 6, 7) [3]. Ak je prítomná hyperkontraktilita bazálnych segmentov, u časti pacientov môžeme preukázať obštrukciu LVOT [9]. Ďalšou dôležitou sekvenciou sú T2 v.o. s potlačením tuku na zhodnotenie edému, ktorý, ak je prítomný, býva lokalizovaný v apikálnych segmentoch. K odlíšeniu tako-tsubo kardiomyopatie od akútnej myokarditídy a akútneho infarktu myokardu, pre ktoré je edém typický, sú potrebné postkontrastné T1 v.o. na zhodnotenie LGE. Vo väčšine prípadov tako-tsubo kardiomyopatie by nemal byť LGE prítomný (obr. 7) [3], avšak štúdia Narusea et al z roku 2011 odhalila, že v malej časti sledovaných pacientov sa môže v subakútnej fáze prechodný LGE v hypokinetických segmentoch objaviť. Podľa tejto štúdie mal LGE formu drobných okrskov s transmurálnou distribúciou. V tejto skupine pacientov bol častejší výskyt kardiogenného šoku a normalizácia EKG nálezu trvala dlhšie [35].
Hoci môže mať tako-tsubo kardiomyopatia v akútnej fáze búrlivý klinický priebeh, jej prognóza je priaznivá. Funkcia LK sa obnovuje behom niekoľkých týždňov a väčšina pacientov je pri dimisii asymptomatická [36].
Image 4. Tako-tsubo kardiomyopatia 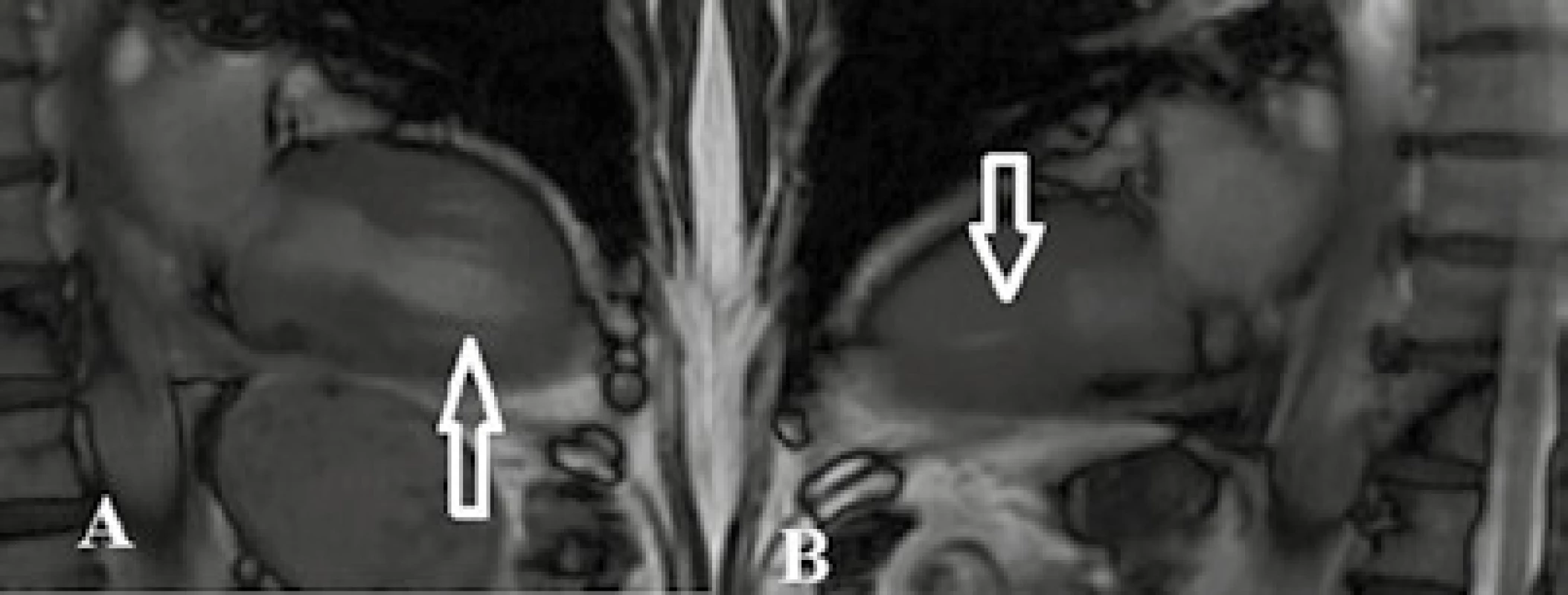
TrueFISP sekvencia v endsystolickej fáze v 2CHLV projekcii. Snímka pacientky s hypokontraktilitou LK v stredných a apikálnych segmentoch až s naznačeným „apical ballooning“ (šípka) (A). Snímka tej istej pacientky po 4 mesiacoch s primeranou kontraktilitou (B) – tako-tsubo kardiomyopatia. Archív KZM FN u sv. Anny v Brně. Image 5. Tako-tsubo kardiomyopatia 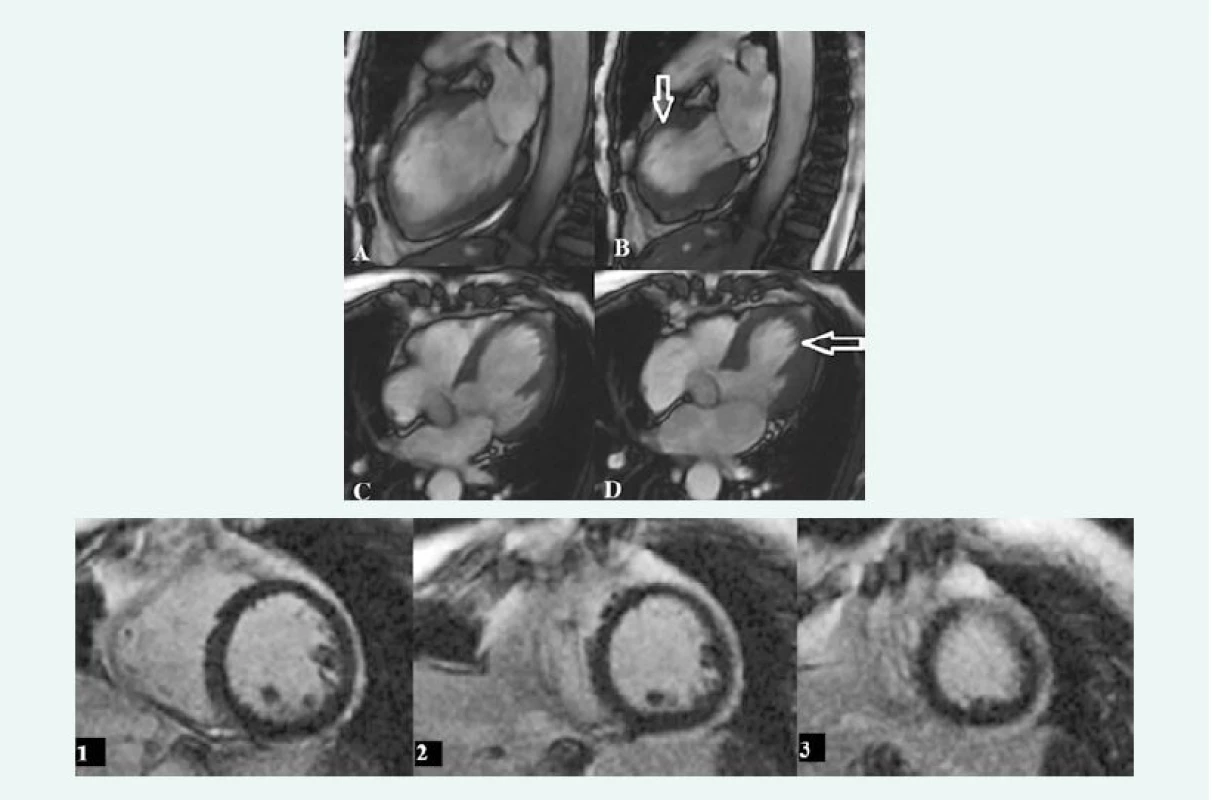
TrueFISP sekvencie v endsystolickej a endsystolickej fáze v 2CHLV projekcii (A, B) a 4CH projekcii (C, D): na snímkach je vidieť hypokontraktilita stredných a apikálnych segmentov až s obrazom „apical ballooning“ v endsystolickej fáze (šípky). Snímky 1–3 zobrazujú postkontrastné skeny v SA projekcii u toho istého pacienta, bez prítomného LGE – obraz tako-tsubo kardiomyopatie. Archív KZM FN u sv. Anny v Brně. Záver
Kardiomyopatie sú ochorenia myokardu s častým výskytom v populácii. MR obraz v prípade diagnózy kardiomyopatie musí byť vždy korelovaný s klinickým obrazom, rodinnou anamnézou a ďalšími vyšetrovacími metódami, ako je koronarografia, echokardiografia, genetické vyšetrenie a pod. V prípade hodnotenia LGE by nemala, až na výnimky, diferenciálna diagnostika ischemického a neischemického postihnutia myokardu robiť problémy. Vo všeobecnosti platí, že v diagnostike kardiomyopatií má MR obraz vysokú senzitivitu, ale nižšiu špecificitu. Významným prínosom je stratifikácia rizika výskytu komplikácií, ako napr. náhlej srdcovej smrti, a sledovanie efektivity liečby kardiomyopatií, ak je vôbec možná.
Podpořeno z Evropského regionálního rozvojového fondu – Projekt FNUSA-ICRC (CZ.1.05/1.1.00/02.0123), Evropského sociálního fondu a státního rozpočtu České republiky.
MUDr. Lenka Křivková
krivkova@fnusa.cz
Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 4. 9. 2015
Přijato po recenzi 7. 4. 2016
Sources
1. Elliott P, Andersson B, Arbustini E et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2008; 29(2): 270–276.
2. Brtko M, Šťástek J, Vojáček J et al. Hypertrofická kardiomyopatie: současné možnosti léčby. Interv Akut Kardiol 2008; 7(3): 100–105.
3. Bogaert J, Dymarkowski S (eds) et al. Clinical cardiac MRI. 2nd ed. Springer: Beriln 2012 : 1–28; 284–312. ISBN 978–3642230349.
4. Maron BJ. Hypertrophic Cardiomyopathy: A Systematic Review. JAMA 2002; 287(10): 1308–1320.
5. Wigle DE, Rakowski H, Kimball BP et al. Hypertrophic Cardiomyopathy Clinical Spectrum and Treatment. Circulation 1995; 92(7): 1680–1692.
6. Maron MS, Olivotto I, Zenovich AG et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outfl ow tract obstruction. Circulation 2006; 114(21): 2232–2239.
7. Maron MS, Hauser TH, Dobrow E et al. Right Ventricular Involvement in Hypertrophic Cardiomyopathy. Am J Cardiol 2007; 100(8): 1293–1298.
8. Spirito P, Bellone P, Harris KM et al. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N Engl J Med. 2000; 342(24): 1778–1785.
9. Pleva M, Ouředníček P. MRI srdce : praktické využití z pohledu kardiologa. Grada: Praha 2012 : 47–49; 67–82. 978–80–247–3931–1.
10. Rickers C, Wilke NM, Jerosch-Herold M et al. Utility of Cardiac Magnetic Resonance Imaging in the Diagnosis of Hypertrophic Cardiomyopathy. Circulation 2005; 112(6): 855–861.
11. Aquaro GD, Positano V, Pingitore A et al. Quantitative analysis of late gadolinium enhancement in hypertrophic cardiomyopathy. J Cardiovasc Magn Reson 2010; 12 : 21. Dostupné z DOI: <http://dx.doi.org/10.1186/1532–429X-12–21>.
12. Green JJ, Berger JS, Kramer CM et al. Prognostic value of late gadolinium enhancement in clinical outcomes for hypertrophic cardiomyopathy. JACC Cardiovasc Imaging 2012; 5(4): 370–377.
13. Appelbaum E, Maron BJ, Adabaq S et al. Intermediate-signal-intensity late gadolinium enhancement predicts ventricular tachyarrhythmias in patients with hypertrophic cardiomyopathy. Circ Cardiovasc Imaging 2012; 5(1): 78–85.
14. Adabag AS, Maron BJ, Appelbaum E et al. Occurrence and Frequency of Arrhythmias in Hypertrophic Cardiomyopathy in Relation to Delayed Enhancement on Cardiovascular Magnetic Resonance. J Am Coll Cardiol 2008; 51(14): 1369–1374.
15. Kasper EK, Agema WR, Hutchins GM et al. The causes of dilated cardiomyopathy: A clinicopathologic review of 673 consecutive patients. J Am Coll Cardiol 1994; 23(3): 586–590.
16. Francone M. Role of Cardiac Magnetic Resonance in the Evaluation of Dilated cardiomyopathy: Diagnostic Contribution and Prognostic Significance. ISRN Radiology 2014 : 365404. Dostupné z DOI: http://dx.doi.org/10.1155/2014/365404.
17. Karamitsos TD, Francis JM, Myerson S et al. CMR in Heart Failure. J Am Coll Cardiol 2009; 54(15): 1407–1424.
18. McCrohon JA, Moon JCC, Prasad SK et al. Differentiation of heart failure related to dilated cardiomyopathy and coronary artery disease using gadolinium-enhanced cardiovascular magnetic resonance. Circulation 2003; 108(1): 54–59.
19. Assomull RG, Prasad SK, Lyne J et al. Cardiovascular Magnetic Resonance, Fibrosis, and Prognosis in Dilated Cardiomyopathy. J Am Coll Cardiol 2006; 48(10): 1977–1985.
20. Riedel M. Konstriktivní perikarditida. Kardiologická revue 2003; 5(2): 69–75.
21. Hancock EW Differential diagnosis of restrictive cardiomyopathy and constrictive pericarditis. Heart 2001; 86(3): 343–349.
22. Banypersad SM, Moon JC, Whelan C. Updates in Cardiac Amyloidosis: A Review. J Am Heart Assoc 2012; 1(2): e000364. Dostupné z DOI: http://dx.doi.org/10.1161/JAHA.111.000364.
23. Maceira AM, Jayshree J, Prasad SK et al. Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation 2005; 111(2): 186–193.
24. Kuchynka P, Paleček T, Šimek S et al. Izolovaná forma srdeční amyloidózy v podobě počínající infiltrativní kardiomyopatie bez restriktivní fyziologie. Vnitř Lék 2008; 54(10): 1010–1013.
25. Vogelsberg H, Mahrholdt H, Deluigi CC et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008; 51(10): 1022–1030.
26. Marcus FI, McKenna WJ, Sherrill D et al. Diagnosis of Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia. Proposed Modification of the Task Force Criteria. Circulation 2010; 121(13): 1533–1541.
27. Neužil P, Syrůček M, Balák J et al. Izolovaná arytmogenní kardiomyopatie levé komory se známkami tukové přestavby. Praktický lékař 2007; 87(8): 496–500.
28. Haman L. Arytmogenní kardiomyopatie pravé komory. Intervenční a akutní kardiologie 2014; 13(2): 87–91.
29. 29.Vondrak K. Izolovaná nonkompaktní kardiomyopatie: souhrnný článek s kazuistickým příkladem. Vnitř Lék 2014; 60(2): 164–170.
30. Jacquier A, Thuny F, Jop B et al. Measurement of trabeculated left ventricular mass using cardiac magnetic resonance imaging in the diagnosis of left ventricular non-compaction. Eur Heart J 2010; 31(9): 1098–1104.
31. Weiford BC, Subbarao VD, Mulhern KM. Noncompaction of the Ventricular Myocardium. Circulation 2004; 109(24): 2965–2971.
32. Virtová R, Kubánek M, Šramko M et al. Isolated non-compaction cardiomyopathy: A review. Cor et Vasa 2013; 55(3): e236-e241. Dostupné z WWW: http://www.sciencedirect.com/science/article/pii/S001086501200118X.
33. Petersen SE, Selvanayagam JB, Wiesmann F et al. Left Ventricular Non-Compaction Insights From Cardiovascular Magnetic Resonance Imaging. J Am Coll Cardiol 2005; 46(1): 101–105.
34. Aschermann M, Aschermann O. Tako tsubo kardiomyopatie. Vnitř Lék 2009; 55(9): 792–796.
35. Naruse Y, Sato A, Kasahara K et al. The clinical impact of late gadolinium enhancement in Takotsubo cardiomyopathy: serial analysis of cardiovascular magnetic resonance images. J Cardiovasc Magn Reson 2011; 13 : 67–76. Dostupné z DOI: <http://dx.doi.org/10.1186/1532–429X-13–67>.
36. Vopelková J, Veselka J. Tako-tsubo syndrom – nový přírůstek do rodiny akutních stavů v kardiologii: aktuální sdělení. Vnitř Lék 2006; 52(11): 1066–1068.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 6-
All articles in this issue
- Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péče
- Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
- Dlouhodobá léčba tromboembolické nemoci u pacientů se zhoubným nádorem
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typu
- Akútne príčiny náhlych úmrtí u pacientov so závažnou hypoglykémiou
- Kardiomyopatie v MR obraze
- Studie HOPE-3: statiny snižují kardiovaskulární příhody u pacientů s intermediárním rizikem ICHS
- mikroRNA a vnitřní lékařství: od patofyziologie k novým diagnostickým a terapeutickým postupům
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Kardiomyopatie v MR obraze
- Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péče
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

