-
Medical journals
- Career
Význam vyšetrovania alanínaminotransferázy u darcov krvi pre redukciu rizika prenosu hepatitíd B a C hemoterapiou
: Katarína Kusendová 1; Peter Gavorník 2,3; Peter Sabaka 2; Klára Sviteková 1
: Národná transfúzna služba SR Bratislava, Slovenská republika 1; II. interná klinika LF UK a UN Bratislava, Slovenská republika 2; Prvé angiologické pracovisko (PAP) LF UK a UN Bratislava, Slovenská republika 3
: Vnitř Lék 2016; 62(1): 9-16
: Original Contributions
Úvod:
Cieľom retrospektívnej observačnej prierezovej štúdie bolo zhodnotiť prínos testovania alanínaminotransferázy (ALT) u darcov krvi a jej komponentov v prevencii prenosu hepatitíd B a C hemoterapiou v kontexte súčasných skríningových metód.Metódy:
Vyhodnotené boli odbery s eleváciou ALT nad stanovený limit (muži 80 IU/l, ženy 64 IU/l, spektrofotometrický UV test, KUADROTM, BPC BioSed Srt, Castelnuovo di Porto Roma, Italia) alebo reaktivitou niektorého z virologických parametrov hepatitíd HBsAg, anti-HBc, anti-HCV (chemiluminiscenčná metóda, ARCHITECT i2000TM, Illinois, USA). Darcovia boli konfirmačne pretestovaní. Na základe definitívneho virologického statusu boli odbery rozdelené na skupiny so spoločnými biologickými vlastnosťami a štatisticky vyhodnotené v programoch Graph Pad Prism 6.05 a Microsoft Excel 2003.Výsledky:
Zo 61 214 odberov sa elevácia ALT vyskytla u 420 odberov (0,69 %), aktívna HBV infekcia u 25 (0,04 %), aktívna HCV infekcia u 5 darcov krvi (0,01 %). Súčasná elevácia ALT a potvrdená HBV infekcia sa vyskytla u jedného darcu (0,002 %), rovnako ako HCV (0,002 %). Hodnoty ALT v skupine s jej eleváciou bez prítomnosti HBV alebo HCV infekcie boli vyššie ako v skupinách s aktívnymi hepatitídami B a C (p < 0,05). Nezachytili sme darcu krvi v sérologickom okne anti-HCV s eleváciou ALT. Elevácia ALT vykazovala nízku špecificitu (69,14 %) aj senzitivitu (6,45 %) pre aktívne hepatitídy. Nedokázali sme kladnú koreláciu medzi ALT a S/CO (signal-to-cut-off) anti-HBc (Spearman r = -0,565, p < 0,0001), ALT a S/CO anti-HCV (Spearman r = -0,1046, p = 0,0022), výsledok pri ALT a S/CO HBsAg nedosiahol štatistickú významnosť (Spearman r = -0,00968, p = 0,77). Kladná ale štatisticky nevýznamná korelácia ALT a anti-HCV bola zaznamenaná v skupine 5 darcov s aktívnou HCV infekciou (Spearman r = 0,4, p = 0,51). Skríningová schéma pre záchyt HCV infekcie anti-HCV + ALT bola na 1 odber o 0,18 € drahšia ako schéma anti-HCV + HCV RNA pre veľký počet znehodnotených odberov s izolovanou eleváciou ALT (825 TU v hodnote 41 388,89 €).Záver:
Elevácia ALT u darcov nebola patognomická pre hepatitídy B a C. Skríningová schéma HCV v zložení anti-HCV + HCV RNA (metóda testovania nukleových kyselín, COBAS AmpliScreen HCV 2.0TM, ROCHE Diagnostics, Hague Road, Indianapolis, USA) je viac cost-efektívna ako anti-HCV + ALT.Kľúčové slová:
alanínaminotransferáza – hemovigilancia – hepatitída B – hepatitída C – skríningÚvod
Hemoterapia prináša so sebou riziko prenosu infekčných hepatitíd B a C napriek implementácii nových skríningových testov detegujúcich protilátky, antigény alebo nukleové kyseliny vírusov. Infekcia vírusom hepatitídy C (HCV) tvorila pred identifikáciou vírusu 90 % potransfúznych hepatitíd. V roku 1986 Americká asociácia krvných bánk odporučila testovanie alanínaminotransferázy ako nešpecifického markera diagnostiky jej pôvodcu, pričom v niektorých krajinách (vrátane Slovenska) sa testoval ešte skôr v 80. rokoch 20. storočia. Opatrenie znížilo výskyt potransfúznych hepatitíd non-A, non-B o 50 % [1]. Po objavení vírusu HCV a skríningu anti-HCV protilátok riziko potransfúznych HCV infekcií kleslo na 1 : 100 000, testovanie HCV RNA redukuje riziko na 1 : 2 000 000 podaných transfúzií [2]. Podľa odporúčaní Svetovej zdravotníckej organizácie (WHO) k povinným markerom skríningu HCV v transfúznej medicíne patria anti-HCV protilátky, k nepovinným HCV RNA alebo HCV antigén spolu s anti-HCV [2–4]. Nepovinné testy HCV RNA alebo HCV antigén sa na Slovensku v rámci skríningu nepoužívajú vzhľadom na ich vysokú cenu [5,6]. Anti-HCV je protilátka namierená proti štruktúram HCV a v sére hostiteľa sa objaví najskôr od 8.–10. týždňa po infekcii, 98 % populácie vytvorí anti-HCV protilátku do 180 dní a asi 2 % populácie ju môžu vytvoriť ešte neskôr. Prvým cirkulujúcim markerom je HCV RNA, objavuje sa na 7. deň po expozícii. Antigén HCV Ag sa objavuje v sére rovnako alebo do 20 dní neskôr ako HCV RNA [3,7]. Vzhľadom na sérologický profil HCV infekcie predchádza objavenie HCV RNA zvýšenie hodnoty ALT asi o 4 týždne, ale elevácia ALT predchádza objaveniu anti-HCV protilátok o minimálne o 3 týždne, alebo o dlhší čas, ak dôjde k neskoršej tvorbe anti-HCV protilátky [4]. V prípade použitia skríningovej schémy iba s anti-HCV protilátkou prínos ALT pre hemovigilanciu spočíva v skrátení sérologického okna anti-HCV minimálne o 3 týždne. V prípade skríningovej schémy anti-HCV spolu s HCV RNA predchádza objavenie virémie eleváciu ALT zhruba o 4 týždne [4]. Skríning ALT v takomto prípade už neprináša benefit v oblasti hemovigilancie a možno ho zrušiť [1,2,8–13]. Pri skríningu vírusu hepatitídy B (HBV) u darcov krvi je podľa WHO povinným markerom povrchový antigén vírusu hepatitídy B (HBsAg). Testovanie protilátok proti jadrovému antigénu HBV (anti-HBc) a HBV DNA nie je povinné, ale použitie jednotlivých testov spolu s HBsAg zvyšuje bezpečnosť hemoterapie [3–6,14]. V Národnej transfúznej službe (NTS) skríning HBV pozostáva z HBsAg a anti-HBc. Objavenie HBsAg v sére sa vyskytuje spolu s HBV DNA – 2–4 týždne od expozície, elevácia ALT nastáva po 5–16 týždňoch. Vyšetrenie ALT v skríningu HBV nie je prínosné, ani odporúčané [3,4,15]. Hodnoty ALT môžu byť ovplyvnené vekom, pohlavím, rasou, hmotnosťou, požitím potravy, hepatotoxických látok a fyzickou námahou. Viac ako 10-násobné zvýšené hodnoty ALT korelujú s rozsahom poškodenia pečene. Vo väčšine prípadov býva u darcov krvi zvýšenie aktivity ALT spôsobené nešpecifickými, z titulu hemovigilancie nezávažnými faktormi s dominanciou obezity, nealkoholovej steatózy pečene a abúzu alkoholu [11,13]. Pre potreby transfuziológie sa akceptuje hodnota do 2-násobku horného limitu referenčných hodnôt [5,6]. Skríning ALT generuje množstvo nešpecifických elevácii, čo má za následok znehodnocovanie transfúznych prípravkov, vyraďovanie darcov a predražovanie skríningovej schémy HCV s použitím anti-HCV protilátok v kombinácii s ALT. V štúdii hodnotíme význam ALT pri skríningu hepatitíd B a C a porovnávame náklady skríningových schém HCV infekcie anti-HCV + ALT vs anti-HCV + HCV RNA.
Súbor a metódy
Participanti
Do štúdie boli zaradené odbery, ktorých darcovia spĺňali aktuálne platné kritériá pre odber krvi a jej komponentov a po poučení podpísali informovaný súhlas. Odbery celej krvi (n = 57 665), produktívna trombocytaferéza (n = 3 477), produktívna erytrocytaferéza (n = 39), produktívna granulocytaferéza (n = 30) a produktívna plazmaferéza (n = 3) v období od septembra roku 2010 do decembra roku 2012 boli vykonané na pracoviskách Národnej transfúznej služby (NTS) Bratislava Ružinov a Kramáre, na výjazdoch mobilnej odberovej jednotky NTS Bratislava a odberovom centre NTS v Dunajskej Strede. Do štúdie neboli zaradení darcovia-pacienti, ktorí absolvovali autológny odber celej krvi alebo autológnu produktívnu trombocytaferézu za účelom prípravy amniovej záplaty (amniopatch) na intraamniové podanie trombokoncentrátu s kryoprecipitátom pri predčasnej ruptúre plodových obalov v 2. trimestri gravidity.
Design štúdie
Zo 61 214 odberov bolo vyhodnotených 853 s eleváciou ALT nad limit hodnôt stanovených v NTS (ALT ≥ 80 IU/l muži, ≥ 64 IU/l ženy, spektrofotometrický UV test, KUADRO, ALT 60 IU/l = 1 μkat/l) alebo reaktivitou niektorého z virologických parametrov hepatitíd HBsAg, anti-HBc, anti-HCV (S/CO ≥ 1, chemiluminiscenčná metóda, ARCHITECT i2000). Darcovia boli konfirmačne pretestovaní (tab. 1) a retrospektívne vyhľadaní v informačnom systéme ISTO 3300 s odstupom 8 mesiacov od zaradenia posledných odberov do štúdie. Na základe definitívneho virologického statusu boli odbery rozdelené na skupiny so spoločnými biologickými vlastnosťami (tab. 2) a štatisticky vyhodnotené v programoch Graph Pad Prism 6.05 a Microsoft Excel 2003. Cena skríningu anti-HCV + ALT bola vypočítaná ako súčet nákladov na skríningové testy anti-HCV a ALT v NTS a hodnoty znehodnotených transfúznych liekov pre reaktívne výsledky anti-HCV a eleváciu ALT. Analogicky bola vyrátaná cena skríningu anti-HCV + HCV RNA. Skríning HCV RNA v NTS nerealizujeme, preto sme jeho cenu a hodnotu transfúznych liekov znehodnotených pre jeho reaktivitu vyrátali z externých zdrojov [16–18]. Cost-efektivita oboch schém bola prepočítaná a porovnaná pre jeden odber v súbore a pre všetky odbery z roku 2014.
1. Schémy konfirmácie odberov s reaktivitou virologických parametrov hepatitíd B a C a eleváciou ALT 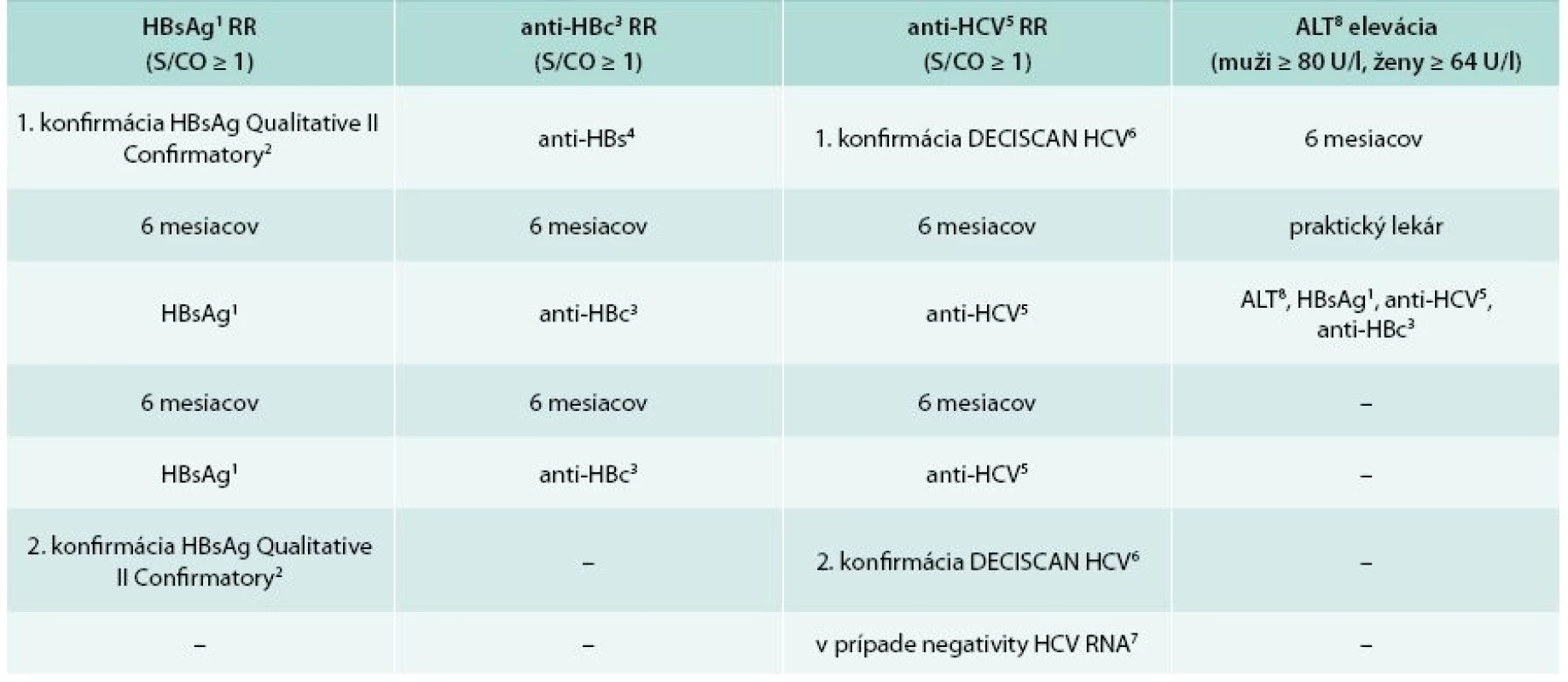
RR – opakovane reaktívny metódy: 1 – chemiluminiscenčná metóda, ARCHITECT HBsAg Qualitative II, ARCHITECT i2000TM, Illinois, USA 2 – chemiluminiscenčná metóda, ARCHITECT HBsAg Qualitative II Confirmatory V.1, ARCHITECT i2000TM, Illinois, USA 3 – chemiluminiscenčná metóda, ARCHITECT anti-HBc II, ARCHITECT i2000TM, Illinois, USA 4 – hemiluminiscenčná metóda, ARCHITECT anti-HBs, ARCHITECT i2000TM, Illinois, USA 5 – chemiluminiscenčná metóda, ARCHITECT anti-HCV, ARCHITECT i2000TM, Illinois, USA 6 – imunoblottingový test, Deciscan HCV PLUS, Bio-Rad Laboratories, Corporate Offices. 1000 Alfred Nobel Drive Hercules, California, USA 7 – metóda testovania nukleových kyselín, COBAS AmpliPrep/COBAS TaqMan HCV, v2.0TM, ROCHE Diagnostics, Hague Road, Indianapolis, USA 8 – spektrofotometrický UV test, KUADROTM, BPC BioSed Srt, Castelnuovo di Porto Roma, Italy 2. Skupiny odberov so spoločnými biologickými vlastnosťami 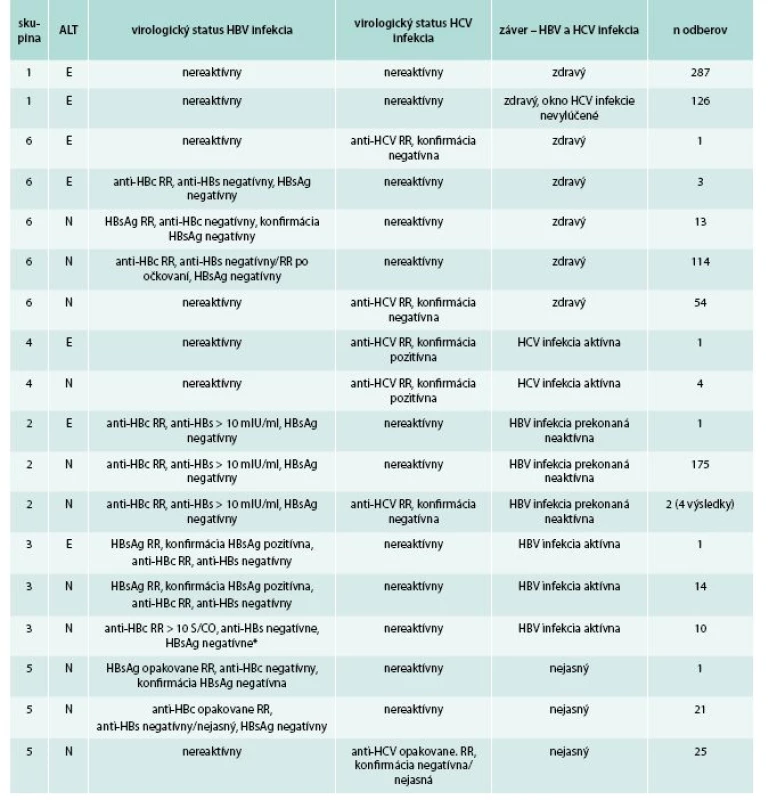
*V súbore sme zachytili 10 darcov s „anti-HBc only“ HBV infekciou. Nakoľko sme v štúdii nestanovovali HBV DNA, nie je možné zhodnotiť prítomnosť okultnej hepatitídy B (OBI) v tomto súbore. Ščepkinová et al sledovali prítomnosť HBV DNA v sére darcov po dobu 4 rokov v rôznych regiónoch SR u 126 darcov s „anti-HBc only“ HBV infekciou, pričom u žiadneho nebola HBV DNA dokázaná a výskyt OBI sa nepotvrdil [37]. ALT: E – elevácia, N – norma RR – opakovane reaktívny skupiny: 1 – elevácia ALT a nereaktívne virologické parametre 2 – prekonaná HBV neaktívna 3 – aktívna HBV infekcia 4 – aktívna HCV infekcia 5 – nejasní 6 – zdraví Štatistické metódy
Na zhodnotenie distribúcie parametrov bol použitý D´Agostinov-Pearsonov a Kolmogorovov-Smirnovov test. Hodnoty ALT v súbore a jeho skupinách nevykazovali normálnu distribúciu a boli uvedené ako aritmetický priemer, medián ± štandardná chyba, ktorá je pri nerovnomernej distribúcii dát výhodnejšia. Smerodajnú odchýlku sme z tohto dôvodu nestanovovali. Hodnoty ALT medzi skupinami boli porovnané neparametrickým Kruskalovým-Wallisovým testom. Stanovili sme typ závislosti a koreláciu medzi hodnotami ALT a hodnotami S/CO virologických parametrov (HBsAg, anti-HBc, anti-HCV) vyjadrenú neparametrickým Spearmanovým korelačným koeficientom. Za štatisticky významné boli považované výsledky s p-hodnotou ≤ 0,05.
Výsledky
Elevácia hodnoty ALT v súbore
Elevácia ALT sa vyskytla u 420 odberov (0,69 %). Z toho u 413 išlo o izolovanú eleváciu ALT bez reaktivity virologických parametrov hepatitíd (0,67 %). V 7 odberoch bola prítomná elevácia ALT a prvotná reaktivita niektorého virologického parametra hepatitíd (0,01 %), z toho potvrdená aktívna HBV infekcia so súčasnou eleváciou ALT sa vyskytla v 1 odbere (0,002 %), rovnako ako HCV infekcia – 1 odber (0,002 %). Hodnoty ALT v skupine s jej eleváciou bez prítomnosti HBV alebo HCV infekcie [102,2 (93) ± 1,6 U/l] boli štatisticky významne vyššie ako v skupinách s aktívnou HBV [35,00 (32) ± 3,106 U/l] a HCV infekciou [44,00 (26) ± 15,49 U/l], p < 0,05. Výskyt sérologického okna anti-HCV sme vylúčili u 287 darcov s izolovanou eleváciou ALT.
Prevalencia hepatitíd B a C
Prvotný záchyt HBsAg antigénu bol v 29 odberoch (0,05 %), potvrdil sa spolu s anti-HBc protilátkou v 15 odberoch s aktívnou HBV infekciou (0,02 %). Prvotný výskyt protilátky anti-HBc (bez HBsAg) bol v 326 odberoch (0,53 %), potvrdená bola v 188 odberoch (0,3 %) – 10 odberov s aktívnou („anti-HBc only“) a 178 odberov s prekonanou HBV infekciou. Aktívna HBV infekcia sa v súbore vyskytla v 25 odberoch (0,04 %). Prvotný záchyt anti-HCV protilátky bol v 87 odberoch (0,14 %), z čoho u 5 s aktívnou HCV infekciou (0,01 %) bol potvrdený. K nepotvrdeným odberom patria nešpecificky reaktívne, stavy po očkovaní, nejasné výsledky.
Špecificita a senzitivita ALT pre aktívne hepatitídy
Senzitivita elevácie ALT pre aktívne hepatitídy HBV a HCV spolu bola 6,45 %, špecificita 69,14 %, pozitívna prediktívna hodnota 0,69 %, negatívna prediktívna hodnota bola 95,58 %. Výpočet bol limitovaný nezarátaním darcov 126 odberov s eleváciou ALT bez reaktivity virologických parametrov, ktorí sa nedostavili na pretestovanie a nemožno u nich vylúčiť diagnostické okno anti-HCV.
Korelácia
Medzi všetkými korelovanými dátami bol lineárny typ závislosti. Nedokázali sme kladnú koreláciu v súbore ani v jednotlivých skupinách medzi ALT a hodnotou S/CO anti-HBc (Spearman r = -0,565, p < 0,0001) (graf 1), ALT a S/CO anti-HCV (Spearman r = -0,1046, p = 0,0022), graf 2, výsledok pri ALT a S/CO HBsAg nedosiahol štatistickú významnosť (Spearman r = -0,00968, p = 0,77). Kladná ale štatisticky nevýznamná korelácia ALT a S/CO anti-HCV bola zaznamenaná v skupine 5 odberov s aktívnou HCV infekciou (Spearman r = 0,4, p = 0,51).
1. Lineárna závislosť a korelácia hodnôt ALT a S/CO anti-HBc (n = 853) 
2. Lineárna závislosť a korelácia hodnôt ALT a S/CO anti-HCV (n = 853) 
Porovnanie nákladov skríningových schém HCV infekcie
Food and Drug Administration (FDA – Úrad pre kontrolu potravín a liekov USA) odporúča na skríning HCV RNA u darcov krvi test COBAS AmpliScreen HCV 2.0TM (ROCHE Diagnostics, Hague Road, Indianapolis, USA), ktorým je možné testovať minipooly po 24 vzoriek [17]. Saudskoarabská štúdia vyčíslila náklady na jednu vzorku vyšetrenú týmto testom na 1,8 € [16]. Podľa údajov FDA by sa v našom súbore 61 214 odberov nachádzalo 82 s izolovanou HCV RNA reaktivitou [18]. Hodnotu transfúznych liekov vyrobených z jedného odberu sme vypočítali ako podiel ceny všetkých transfúznych liekov znehodnotených pre anti-HCV reaktivitu (10 558,94 €) a počtu odberov znehodnotených pre anti-HCV reaktivitu (87), pričom predstavovala 121 €. V prípade 82 odberov s izolovanou HCV RNA reaktivitou by ich hodnota predstavovala 9 922 € (0,16 € na jeden odber). Túto hodnotu sme použili pre náš výpočet. Súčasná schéma anti-HCV + ALT bola v prepočte na 1 odber o 0,18 € drahšia ako anti-HCV + HCV RNA pre veľký počet znehodnotených odberov s izolovanou eleváciou ALT (825 TU v hodnote 41 388,89 €), tab. 3.
3. Porovnanie nákladov pri súčasnej a navrhovanej skríningovej schéme HCV infekcie v Národnej transfúznej službe (NTS) 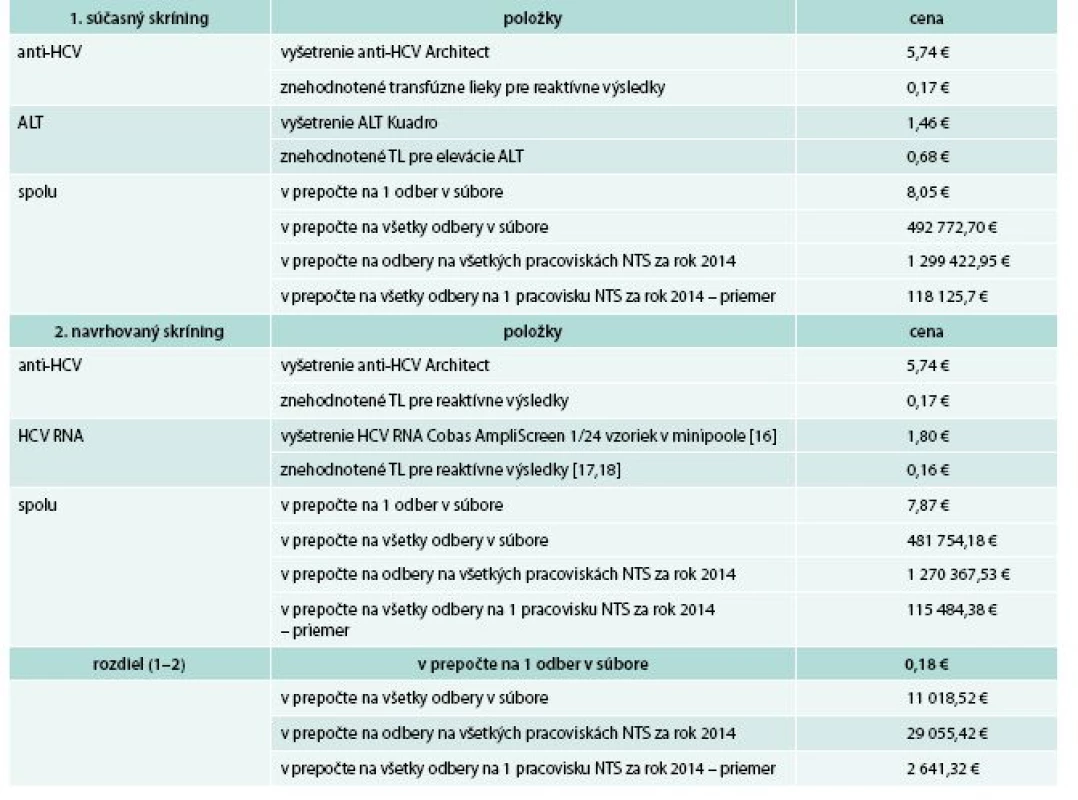
Diskusia
Elevácia hodnoty ALT v súbore
Prevalencia elevácie ALT v našom súbore (0,69 %) je výrazne nižšia ako v iných štúdiách, v ktorých u darcov krvi dosahuje 14,5 % a 5,1 % [19,20]. Výsledky nie sú celkom porovnateľné, pretože ide o etnologicky odlišné skupiny a inú metodiku skríningu. Napriek tomu nízka prevalencia elevácie ALT v našom súbore svedčí o správnom výbere darcov a dobrom stave darcovskej populácie z titulu rizikových faktorov zvýšenej hodnoty ALT. Zo 61 214 odberov sme zaznamenali eleváciu ALT a aktívnu hepatitídu u 2 darcov krvi. Hodnoty ALT pri týchto odberoch dosahovali 103 U/l a 81 U/l, nepresahovali 10-násobok hornej hranice referenčných hodnôt, čo by bolo typické pre akútnu fázu hepatitíd. Obe infekcie sú pravdepodobne chronické a zachytiteľné sérologickými testami. Vysoké hodnoty ALT sme nezaznamenali ani v prípade ostatných 418 odberov s eleváciou [102,2 (93) ± 1,6 U/l], najvyššia dosiahnutá hodnota bola 390 U/l. Darca spätne udával užívanie voľnopredajných anabolických steroidov, po poučení a kontrole bola u neho zaznamenaná normálna hodnota ALT aj virologických parametrov. Elevovaná hodnota ALT v našom darcovskom súbore nie je patognomická pre odbery s reaktivitou hepatitíd B a C, ani pre odbery s potvrdenou aktívnou infekciou, čo potvrdzujú aj práce viacerých autorov [8,9,11–13,15]. Hlavným prínosom skríningu ALT spolu s anti-HCV protilátkami je skrátenie sérologického okna HCV infekcie o približne 3 týždne. V súbore sme zaznamenali 413 odberov s eleváciou ALT bez reaktivity virologických parametrov, ktorých darcovia sa mohli nachádzať v sérologickom okne anti-HCV. Na pretestovanie pol roka po elevácii sa dostavili darcovia 287 odberov. Z nich sa v žiadnom odbere nevyskytla reaktivita anti-HCV (ani iných virologických parametrov), čím sme u nich vylúčili možnosť anti-HCV okna. Podľa Buscha et al bola v USA v roku 1995 pravdepodobnosť prenosu HCV infekcie v anti-HCV sérologickom okne transfúziou pri 3 z 1 000 000 odberov [8]. Alter uvádza prevalenciu anti-HCV protilátky v populácii USA v tom istom roku 1,8 % [21]. V našom súbore je prevalencia anti-HCV výrazne nižšia (0,01 %) a prenos HCV v sérologickom okne ešte menej pravdepodobný.
Prevalencia hepatitíd B a C
Prevalencia markerov HBV infekcie v bežnej slovenskej populácii dosahuje pri HBsAg 1,2 % a anti-HBc 10,7 % [22]. Romano et al zaznamenali u talianskych darcov prevalenciu HBsAg 0,33 % a anti-HBc 8,62 % [23]. Hennig et al uvádzajú v nemeckej darcovskej populácii výskyt HBsAg 0,11 % a anti-HBc 1,52 % [24]. V našom súbore je výskyt markerov HBV ešte nižší (0,02 % a 0,3 %), čo svedčí o kvalitnom výbere darcov a účinnosti opatrení na zvyšovanie hemovigilancie. Prevalencia HCV infekcie v našom súbore bola nižšia (0,14 %, 0,01 %) ako v staršej košickej štúdii. V rokoch 1993–1998 tu bolo vyšetrených 7 458 darcov s prvotným záchytom anti-HCV u 1,65 % a potvrdeným výskytom anti-HCV u 0,33 % [25]. Kalibatas et al uvádza prevalenciu anti-HCV u litovských darcov 0,53 %, u darcov v Európe sa udáva od 0,1 % do 0,6 % [26,27]. Nakoľko populácia darcov je výberová, neobsahuje skupiny obyvateľstva s vysokým rizikom infekčných hepatitíd, výskyt HBV a HCV infekcií je v nej nižší ako v bežnej populácii. V rokoch 1997–2002 bola prevalencia anti-HCV 1,52 %, HCV RNA sa potvrdila u 0,67 % vzoriek [27]. Opačný extrém predstavuje populácia užívateľov drog, kde bol záchyt anti-HCV v rokoch 2004–2008 v rozmedzí 34–78 % a HCV RNA 17–71 % [28].
Korelácia
Cieľom výpočtu korelácie ALT a S/CO HBsAg, anti-HBc a anti-HCV bolo stanoviť mieru, akou sa infekcia hepatitídami B a C podieľa na elevácii ALT. Hodnota S/CO je priamo úmerná výške titra protilátok alebo antigénu, stopercentná pozitívna prediktívna hodnota pre hepatitídu sa však pozorovala až od vyšších hodnôt, ako je cut-off stanovený pre potreby transfúznej medicíny (t.j. S/CO ≥ 1)[29–31]. Nízke hodnoty S/CO bývajú často nešpecificky reaktívne a konfirmáciou sa infekcia nepotvrdí. Z toho dôvodu by bolo vhodnejšie stanovovať koreláciu ALT s HBV DNA a HCV RNA, čo nebolo z ekonomických a technických dôvodov možné. V štúdiách stanovujúcich takúto koreláciu u darcov krvi však nebola potvrdená, rovnako ako tomu nebolo ani v našom súbore s hodnotami S/CO [32–35]. Infekcia HBV a HCV nie je príčinou elevácie ALT v našom ani iných darcovských súboroch. Odlišná situácia je u pacientov s potvrdenou HBV alebo HCV infekciou, kde hodnoty HBV DNA, HCV RNA (aj S/CO) korelujú s ALT [29,33–36]. Rovnako v našom súbore sme pozorovali kladnú koreláciu anti-HCV s ALT miernej tesnosti v skupine 5 darcov krvi s potvrdenou HCV infekciou, výsledok však nedosiahol štatistickú významnosť.
Záver
Elevácia ALT darcovskom súbore nebola patognomická pre hepatitídy B a C. Skríningová schéma HCV v zložení anti-HCV + HCV RNA je viac cost-efektívna ako anti-HCV + ALT. Pri použití špecifického a bezpečnejšieho skríningu HCV infekcie prostredníctvom anti-HCV + HCV RNA je parameter ALT obsolétny a mal by byť presunutý do ročnej preventívnej prehliadky darcov krvi u všeobecného lekára. K elevácii ALT by sa touto cestou pristupovalo ako k informácii o zdravotnom stave darcu, pričom so záverečným nálezom by sa hlásil na pracovisku NTS.
MUDr. Katarína Kusendová
kusendova.k@gmail.com
Národná transfúzna služba SR, Bratislava, Slovenská republika
www.ntssr.sk
Doručeno do redakce 17. 4. 2015
Přijato po recenzi 15. 8. 2015
Sources
1. Quaranta J, Reboulot B, Cassuto J. Hepatitídy. SOFA: Bratislava 1995. ISBN 8085752419.
2. Brecher ME (ed). AABB Technical Manual. 15th ed. American Association of Blood Banks: Bethesda, Md 2005. ISBN 9781563951961.
3. WHO. Screening Donated Blood for Transfusion-Transmissible Infections-Recommendations. World Health Organization: Geneva 2010. ISBN 978–9241547888.
4. Wedemeyer H, Pawlotsky JM, McHutchison J. Acute viral hepatitis. Chronic viral and autoimmune hepatitis. In: Goldman L, Schafer AI. Goldman´s Cecil medicine. 24th ed. Elsevier Saunders: Philadelphia 2012 : 966–978. ISBN 978–1437716047.
5. Národná transfúzna služba SR pracovisko Bratislava. Organizačná norma 21. Opatrenia na zabránenie prenosu infekcie krvou. Verzia číslo: 0, výtlačok číslo 5, platnosť od 2008.
6. Fábryová V, Cupaníková D, Grmanová Ľ et al. Imunohematológia a transfúzna medicína pre prax. Grada Slovakia: Bratislava 2012. ISBN ISBN 978–80–247–4391–2.
7. Biceroglu SU, Turhan A, Doskaya AD et al. Probable hepatitis C virus transmission from a seronegative blood donor via cellular blood products. Blood Transfusion 2014; 12(Suppl 1): S69-S70.
8. Busch MP, Korelitz JJ, Kleinman SH et al. Declining value of alanine aminotransferase in screening of blood donors to prevent postttransfusion hepatitis B and C virus infection. The Retrovirus Epidemiology Donor Study. Transfusion 1995; 35(11): 903–910.
9. Torezan-Filho MA, Alves VA, Neta CA et al. Clinical significance of elevated alanine aminotransferase in blood donors: a follow-up study. Liver Int 2004; 24(6): 575–581.
10. McCullough J. Transfusion Medicine. 3rd ed. Blackwell Publishing: Oxford 2011. ISBN 978–1-4443–3705–1.
11. Rossini A, Gazzola GB, Ravaggi A et al. Long-term follow-up of an infectivity in blood donors with hepatitis C antibodies and persistently normal alanine aminotransferase levels. Transfusion 1995; 35(2): 108–111.
12. Barna TK, Ozsvár Z, Szendrényi V et al. Hepatitis C virus antibody in the serum of blood donors. Orv Hetil 1996; 137(10): 507–511.
13. Gonḉales Júnior FL, Stucchi RS, Papaiordanou PM et al. Elevated alanine aminotransferase (ALT) in blood donors: an assessment of the main associated conditions and its relationship to the development of hepatitis C. Rev Inst Med Trop Sao Paulo 1998; 40(4): 219–224.
14. Ščepkinová E, Sviteková K. Príčiny. nešpecifickej (falošnej) reaktivity screeningového vyšetrenia protilátok proti core-antigénu vírusu hepatitídy B (anti-HBc). Interná medicína 2011; 11(Suppl): 26.
15. Ren FR, Wang JX, Huang Y et al. Hepatitis B virus nucleic acid testing in Chinese blood donors with normal and elevated alanine aminotransferase. Transfusion 2011; 51(12): 2588–2595.
16. Bamaga MS, Bokhari FF, Aboud AM et al. Nucleic acid amplification technology screening for hepatitis C virus and human immunodeficiency virus for blood donations. Saudi Med J 2006; 27(6): 781–787.
17. Roche Molecular Systems. Cobas AmpliScreen HCV Test, verzia 2.0. Roche: Indianapolis 2007. Dostupné z WWW: <http://molecular.roche.com/assays/Pages/COBASAmpliScreenHCVTestv20.aspx>.
18. FDA. Vaccines, Blood and Biologics. Dostupné z WWW: <http://www.fda.gov/BiologicsBloodVaccines/BloodBloodProducts/ApprovedProducts/LicensedProductsBLAs/BloodDonorScreening/InfectiousDisease/ucm126581.htm>. Citované 18.2.2015.
19. Papatheodoridis GV, Goulis J, Christodoulou D et al. High prevalence of elevated liver enzymes in blood donors: association with male gender and central adiposity. Eur J Gastroenterol Hepatol 2007; 19(4): 281–287.
20. Pourshams A, Malekzadeh R, Monavvari A et al. Prevalence and etiology of persistently elevated alanine aminotransferase levels in healthy Iranian blood donors. J Gastroenterol Hepatol 2005; 20(2): 229–233.
21. Alter MJ. Epidemiology of Hepatitis C. Hepatology 1997; 26: (3 Suppl 1): S62-S65.
22. Sláčiková M. Aktuálna problematika vírusovej hepatitídy typu A a typu B. Via pract 2006; 3(7–8): 351–355.
23. Romano L, Velati C, Cambié G et al. Hepatitis B virus infection among first-time blood donors in Italy: prevalence and correlates between serological pattern and occult infection. Blood Transfusion 2013; 11(2): 281–288.
24. Hennig H, Puchta I, Luhm J et al. Frequency and load of hepatitis B virus DNA in first-time blood donors with antibodies to hepatitis B core antigen. Blood 2002; 100(7): 2637–2641.
25. Hugecová D, Schréter I, Adamkovičová E et al. Hepatitis C Virus Infection and Blood Donors in Eastern Slovakia. Xl. International Congress of Liver Diseases. Basel. Falk Symposium No 115 1999 : 94 (abstract).
26. Kalibatas V, Kalibatiene L. The results of nucleic acid testing in remunerated and non-remunerated blood donors in Lithuania. Blood Transfusion 2014; 12(Suppl 1): S58-S62.
27. Kristian P, Mikas J, Schréter I. Epidemiológia hepatitídy C. Trendy v hepatológii 2010; 2(1): 12–17.
28. Gazdíková K, Gazdík F, Kajaba I et al. Vývoj séroprevalencie hepatitídy C v rizikovej skupine drogovo závislých jedincov v rokoch 2004–2008 na Slovensku. Vnitř Lék 2012; 58(3): 179–182.
29. Seo YS, Jung ES, Kim JH et al. Significance of Anti-HCV Signal-to-Cutoff Ratio in Predicting Hepatitis C Viremia. Korean J Intern Med 2009; 24(4): 302–308.
30. Rodella A, Galli C, Terlenghi L et al. Quantitative analysis of HBsAg, IgM anti-HBc and anti-HBc avidity in acute and chronic hepatitis B. J Clin Virol 2006; 37(3): 206–212.
31. Galli C, Orlandini E, Penzo L et al. What is the role of serology for the study of chronic hepatitis B virus infection in the age of molecular biology? J Med Virol 2008; 80(6): 974–979.
32. Behzad-Behbahani A, Mafi-Nejad A, Tabei SZ et al. Anti-HBc & HBV-DNA detection in blood donors negative for hepatitis B virus surface antigen in reducing risk of transfusion associated HBV infection. Indian J Med Res 2006; 123(1): 37–42.
33. Nabuco LC, Villela-Nogueira CA, Perez RM et al. HBV-DNA levels in HBsAg-positive blood donors and its relationship with liver histology. J Clin Gastroenterol 2007; 41(2): 194–198.
34. Muñoz-Gómez R, García-Monzón C, García-Buey L et al. Hepatitis C virus infection in Spanish volunteer blood donors: HCV RNA analysis and liver disease. Eur J Gastroenterol Hepatol 1996; 8(3): 273–277.
35. Ali N, Moiz B, Moatter T et al. Correlation of hepatitis C RNA and serum alanine aminotransferase in hepatitis B and C seronegative healthy blood donors. Indian J Pathol Microbiol 2010; 53(3): 480–485.
36. Balk M, Saydam G, Cengiz D et al. The Utility of anti-HCV S/CO Ratio, HCV-RNA and ALT Test in Predicting Viremia in anti-HCV Positive Patients. Turk J Biochem 2007; 32(2): 51–54.
37. Ščepkinová E, Gašparovič JJ. Eliminácia rizika prenosu vírusu hepatitídy B transfúziou vo fáze možnej okultnej HBV infekcie. Transfuze a hematologie dnes 2014; 20(2): 67–74.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 1-
All articles in this issue
- Significance of alanine aminotransferase screening in blood donors for risk reduction of hepatitis B and C transmission by haemotherapy
- “3P (Patient-Pulse-Prognosis) in heart failure” survey: focus on heart rate
- Changes in the prognosis and treatment of Waldenström macroglobulinemia. Literature overview and own experience
- Gene mutations connected to Waldenstöm macroglobulinemia
- The SPRINT Research. A Randomized Trial of Intensive versus Standard Blood-Pressure Control
- Rare diagnostics of infective endocarditis after kidney transplantation
- A rare case of mobile atherosclerotic plaque with a high embolic potential in the femoral artery
- Dangerous cucumbers – Leyll’s syndrome
- Toxic epidermal necrolysis
- EASD Postgraduate Course of Clinical Diabetes and its Complications, Prague 2015
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Toxic epidermal necrolysis
- Changes in the prognosis and treatment of Waldenström macroglobulinemia. Literature overview and own experience
- Significance of alanine aminotransferase screening in blood donors for risk reduction of hepatitis B and C transmission by haemotherapy
- Gene mutations connected to Waldenstöm macroglobulinemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

