-
Medical journals
- Career
Nebezpečné okurky – Leyllův syndrom
: Ján Csomor 1; Bohuš Bunganič 1; Sergey Zakharov 2; Igor Pafčuga 3; Pavel Sedloň 1; Petr Urbánek 1
: Interní klinika 1. LF UK a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 1; Toxikologické informační středisko Kliniky pracovního lékařství 1. LF UK a VFN Praha 2; Klinika popáleninové medicíny 3. LF UK a FN Královské Vinohrady Praha 3
: Vnitř Lék 2016; 62(1): 57-61
: Case Reports
Lyellův syndrom (syndrom toxické epidermální nekrolýzy) je raritně se vyskytující onemocnění, které poprvé popsal skotský lékař Alan Lyell v roce 1956. Je charakterizováno rozsáhlou kožní a slizniční nekrolýzou postihující minimálně 30 % tělesného povrchu a systémovými projevy. Podle četnosti výskytu se jedná o extrémně vzácnou nozologickou jednotku s incidencí 0,5–1,5/1 milion obyvatel a rok. Leyllův syndrom je považován za toxoalergickou reakci, spouštěčem je nejčastěji některé léčivo. Syndrom je spojen s vysokou letalitou (knižně udávanou v rozmezí 30–90 %). Neodkladná lokální i celková léčba na jednotkách intenzivní péče nebo na specializovaném pracovišti může zlepšit celkově špatnou prognózu pacientů. V naší kazuistice popisujeme vzácný případ pacienta s rozvojem Lyellova syndromu po práci s běžným fungicidním prostředkem, který je častou součástí vybavení zahrádkářů a zemědělců.
Klíčová slova:
bis-dithiokarbamidany – Leyllův syndrom – toxická epidermální nekrolýzaÚvod
Syndrom toxické epidermální nekrolýzy (TEN) je vzácný toxoalergický inzult kůže a sliznic s jejich akutní nekrózou. Incidence se celosvětově udává v rozmezí 0,5–1,5 případů na 1 milion obyvatel za rok [1,15,16]. V České republice je ročně hlášeno 10–15 případů tohoto onemocnění [2]. Za rizikový faktor se považuje HIV pozitivita, která incidenci TEN v USA zvyšuje na 1 případ na 1 000 pacientů za rok [3]. Leyllův syndrom častěji postihuje ženy a maximum případů se vyskytuje ve středním věku v 5.–7. decenniu [1–3,15].
Etiopatogeneze TEN dodnes není zcela jasná. Jde patrně o autoimunní hypersenzitivní reakci organizmu s rozsáhlým kožním a slizničním postižením. Spouštěčem onemocnění je nejčastěji léčivo (až v 90 %) [1,3,16,17]. Typicky jde o antibiotika, dále i nesteroidní antirevmatika, alopurinol, antiepileptika, kortikoidy nebo antidepresiva. Proto je pečlivá farmakologická anamnéza posledních dnů před rozvojem onemocnění nezbytná. U malého procenta pacientů zůstává spouštěcí faktor neznámý [3,10,17,20].
Rozsah postižení kůže a sliznic u pacientů s Leyllovým syndromem kolísá, avšak postiženo je minimálně 30 % kožního povrchu. V případě menšího rozsahu mluvíme o Stevensově-Johnsonově syndromu, který je považován za nozologickou jednotku s obdobnou patogenezou, nicméně s menším rozsahem nekrolýzy kůže a dominantním postižením sliznic [1,19].
Diagnózu pacienta lze zpravidla určit dle klinického nálezu, potvrdit ji může kožní biopsie s typickou exfoliací v dermo-epidermální junkci [4]. Včasná diagnóza a léčba na specializovaném oddělení (nejčastěji oddělení pro léčbu popálenin nebo jednotky intenzivní péče) může zlepšit prognózu pacientů. Nejdůležitějšími opatřeními jsou izolace pacienta v samostatném boxu, pravidelné převazy za přísně aseptických podmínek, redukce nadbytečné medikace (která může být spouštěčem onemocnění), dostatečná hydratace, alimentace a rychlé rozpoznání bakteriální superinfekce kůže s cílenou ATB léčbou dle výsledků kultivace [5,11,15,21,22].
Prognóza pacientů s TEN je velice nepříznivá. Celosvětově v literatuře kolísá udávaná letalita v rozmezí od 30 do 90 % [1,3,16]. Pro posouzení prognózy je používán systém SCORTEN – SCORe of Toxic Epidermal Necrosis (tab. 1) [6]. Nejtěžšími, až fatálními komplikacemi jsou v úvodu šokový stav a v dalším průběhu zejména infekce při ztrátě bariérové funkce kůže, která může progredovat do generalizované infekce – sepse [5].
1. Systém SCORTEN a jeho interpretace. 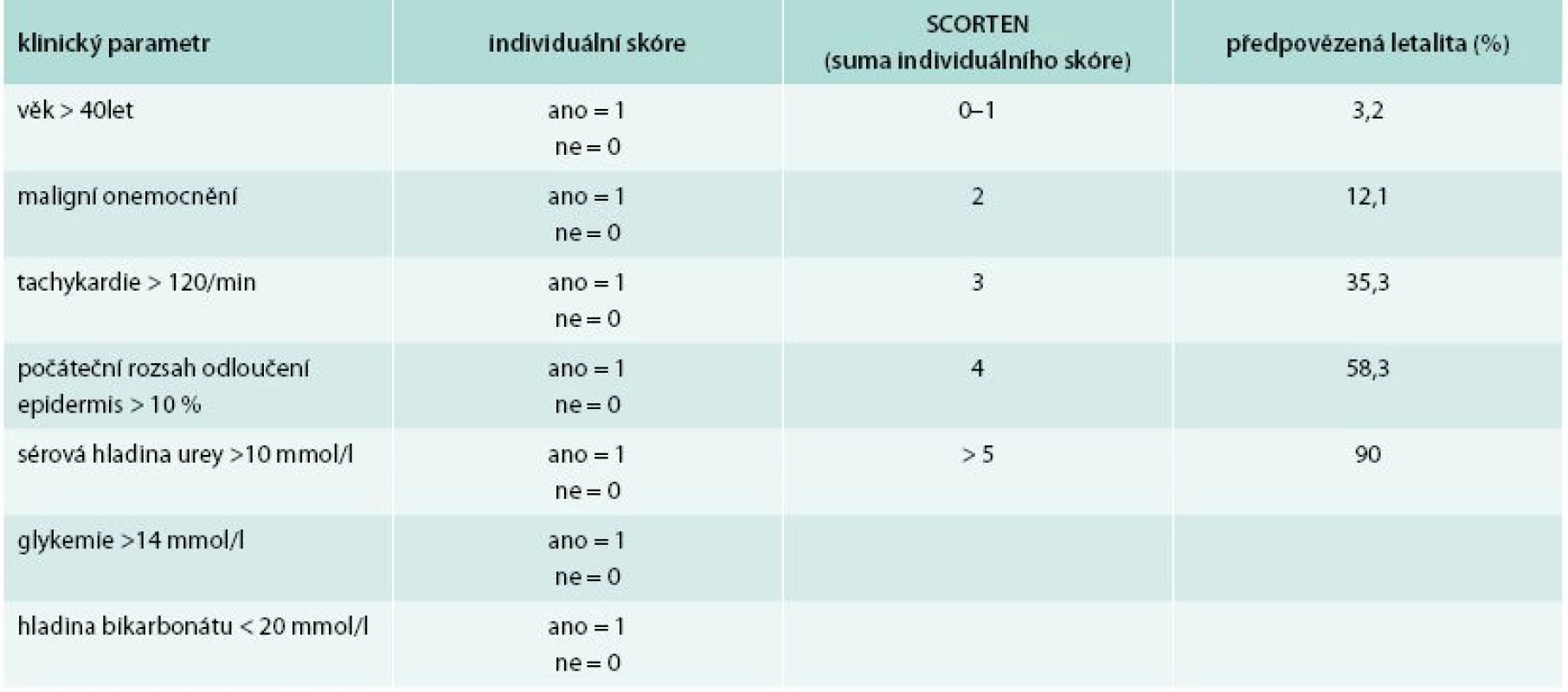
Upraveno podle [6] Popis případu
48letý pacient bez komorbidit nebo pravidelného užívání léků byl přivezen rychlou záchrannou službou na oddělení Emergency Ústřední vojenské nemocnice (ÚVN) v Praze dne 2. 8. 2012. Důvodem byla generalizovaná kožní a slizniční reakce spojená s horečkou. Tyto příznaky se rozvíjely již během 3 dnů před přijetím do ÚVN. Prvním symptomem bylo svědění kůže. Postupně se rozvinul otok rtů a jazyka, následovaný odlučováním sliznice a krvácením z dutiny ústní, nejdříve při čištění zubů, v dalších hodinách i spontánně. Na kůži se reakce projevila v oblasti genitálu (odlučování kůže a sliznice v oblasti glans penis), ale postupně docházelo k šíření na další části kůže. Od prvního dne se přidala horečka do 40 °C. V té chvíli byl pacient vyšetřen praktickou lékařkou, která pro výše uvedené potíže indikovala preventivně antibiotickou léčbu (amoxicillin). Stav se progresivně zhoršoval, 3. den od začátku obtíží byla kožní reakce již generalizovaná. V tomto stavu byl pacient přivezen do nemocnice.
V anamnéze pacient udával 5 dní před přijetím a tedy 2 dny před začátkem rozvoje příznaků postřikování okurek na zahrádce fungicidním přípravkem Acrobat MZ obsahujícím bis-dithiokarbamidany. Tento přípravek byl pacientem použit poprvé, při ředění bylo postupováno přísně dle návodu. Práce byla vykonávána asi půl hodiny a i přes teplé a slunečné počasí byl pacient oblečen do dlouhého trika, kalhot a použil i ochranné rukavice. Žádné léky v předchorobí neužíval.
V době příjezdu na oddělení Emergency ÚVN byl pacient febrilní, tachykardický a dehydratován patrně při vysokých ztrátách tekutiny kůží. Zde byl ihned vyšetřen internistou, dermatologem a otorinolaryngologem. V objektivním nálezu dominovala nekrotická odlučující se sliznice rtů a dutiny ústní, hypofaryngu, hrtanu, epiglottis a edém měkkých tkání obličeje (obr. 1). Epidermolýza byla patrna na dlaních, ploskách obou nohou, na genitálu. Splývající buly byly na končetinách (obr. 2 a obr. 3) a také po stranách těla a na zádech. Dermatolog dále shledal morbiliformní exantém trupu, zad a končetin. V laboratoři byla vstupně elevace zánětlivých parametrů (C-reaktivní protein 206 mg/l, prokalcitonin 2,5 µg/l), zvýšení renálních katabolitů při dehydrataci, mírná trombocytopenie (93 × 109/l) a posun v diferenciálu bílých krvinek (neutrofily 5,34 × 109/l, lymfocyty 0,64 × 109/l). Na základě klinického obrazu a laboratorních nálezů byl pacient indikován k přijetí na JIP Interní kliniky, zejména pro možnost důsledné monitorace vitálních funkcí, riziko respiračního selhání při nálezu v oblasti hrtanu a epiglottis, možnost samostatného boxu a aseptického přístupu při kožních převazech a zavedení veškerých nutných invazivních vstupů. Vstupní SCORTEN score 3 bodů predikovalo u pacienta mortalitu kolem 35 %.
1. Postižení obličeje, rtů a dutiny ústní. 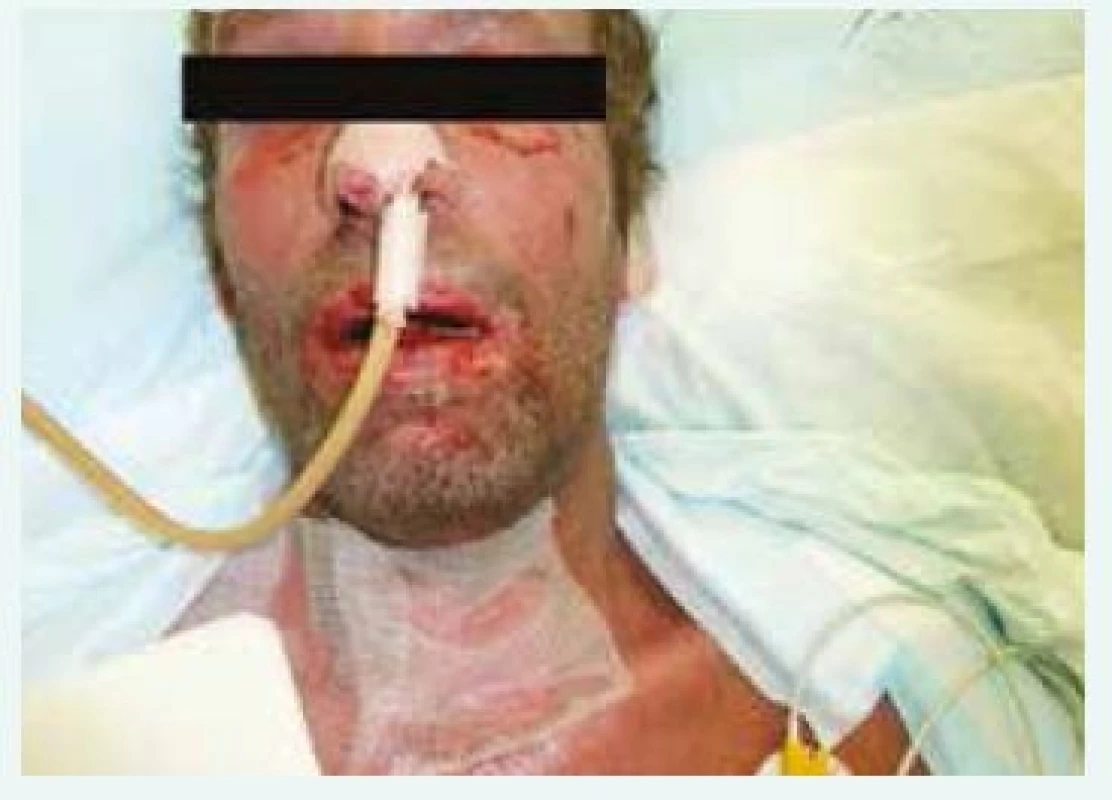
Fotografie z archivu autora 2. a obr. 3. Splývající buly a počínající epidermolýza levé ruky a nohy vstupně. 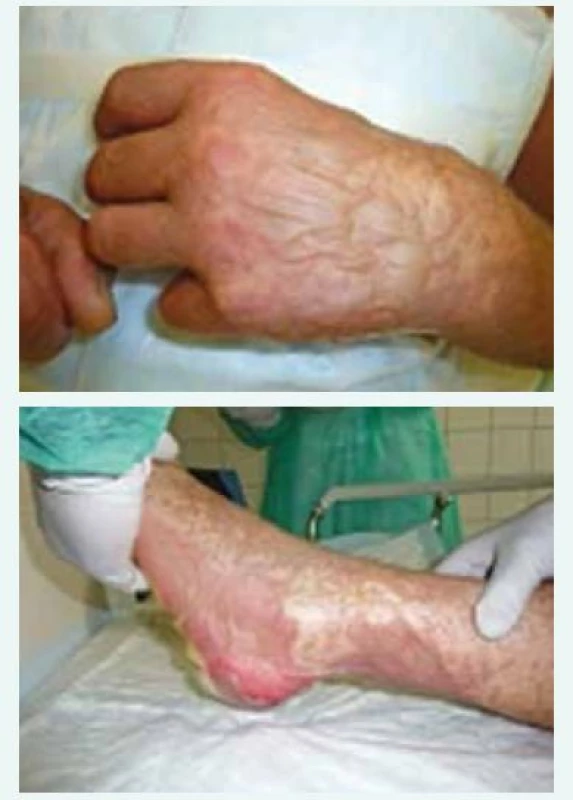
Fotografie z archivu autora Léčba pacienta byla na JIP Interní kliniky od prvního momentu koordinována ve spolupráci s dermatology, otorinolaryngology, oftalmology a mikrobiology. Kontaktována byla i Klinika popáleninové medicíny FN Královské Vinohrady Praha. Po přijetí byl zaveden centrální žilní katétr, močový katétr a nazogastrická sonda. Neprodleně byla zahájena masivní rehydratace. Pro riziko progrese otoku horních cest dýchacích a respiračního selhání jsme podávali kortikoterapii ve vysokých dávkách (denně Solumedrol 250 mg i.v.), pokračovali jsme také v aplikaci širokospektrých antibiotik (amoxicilin v dávce 1,2 g po 8 hod i.v.). Dále byla podávána antihistaminika, antipyretika, analgetika, preventivně omeprazol. V dalších dnech hospitalizace byly substituovány minerály pro rozvrat vnitřního prostředí (hypokalemie 3,7 mmol/l, hypokalcemie 1,8 mmol/l a hypofosfatemie 0,5 mmol/l) a již od 2. dne jsme zahájili enterální výživu cestou nazogastrické sondy při nemožnosti perorálního příjmu. Dominujícím opatřením byly pravidelné, prakticky celotělové, několikahodinové převazy kůže se snahou o dodržení aseptického prostředí. Epidermis se cárovitě odlučovala, rozsah exfoliace byl nestejný. Pod snesenou kůží byla již v momentu odlučování patrná reepitelizace a tvorba nové nezralé světlerůžové kůže (obr. 4 a obr. 5). Na končetinách došlo ke kompletní epidermolýze.
3. a obr. 5. Rozsáhlá nekrolýza kůže trupu se spontánním odlučováním. 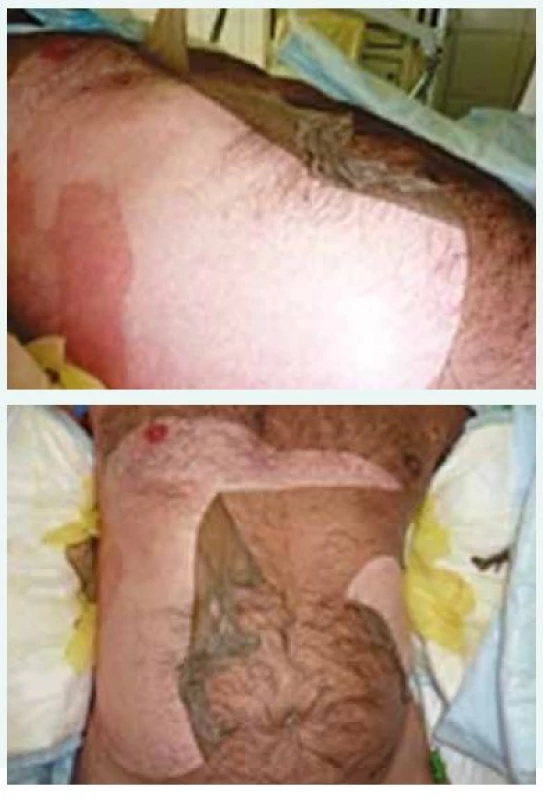
Fotografie z archivu autora Po dohodě s lékaři Kliniky popáleninové medicíny FN Královské Vinohrady Praha, kam jsme zaslali obrazovou dokumentaci a laboratorní výsledky, byla od 5. dne redukována léčba, 6. den ukončena antibiotická terapie, postupně snižována a 8. den úplně vysazena kortikoterapie. Až do 11. dne jsme pokračovali v každodenních převazech po premedikaci opiátovými analgetiky s pravidelným provedením kožních stěrů.
Přes veškerou péči došlo v 2. týdnu hospitalizace (10. den pobytu na JIP) u pacienta ke zhoršení stavu s recidivou febrilií a vzestupem zánětlivých parametrů. Nově vytvořená kůže byla zarudlá, hyperemická a kontaktně krvácející. Z kožních stěrů byly pozitivní mikrobiologické nálezy. Opakovaně byl kultivován Acinetobacter spp. a dále Escherichia coli a Enterococcus feacalis. Cíleně dle citlivosti zjištěných mikrobů byla proto nasazena léčba meropenemem. Po 11 dnech hospitalizace byl indikován překlad pacienta na JIP Kliniky popáleninové medicíny FN Královské Vinohrady Praha. Na specializovaném pracovišti pokračovala komplexní péče o pacienta, zejména pravidelné celotělové převazy za aseptických podmínek na operačním sále v celkové anestezii. Cílená antibiotická terapie vedla opět k poklesu teplot i parametrů zánětu. Pozornost byla věnována i udržení vnitřního prostředí a enterální výživě. Stav pacienta se postupně stabilizoval. Došlo k postupné reepitelizaci a obnově kožního krytu v celém rozsahu a k odlučování nehtů všech prstů. Provést autotransplantaci dermoepidermálními štěpy nebylo nutno. Hospitalizace byla komplikována močovou infekcí Escherichia coli v 2. týdnu, s dobrou reakcí na nitrofurantoin. Nicméně recidivovala pod obrazem levostranné pyelonefritidy o týdne později. Tato komplikace byla zvládnuta dalším podáním antibiotik (kombinace meropenem a amikacin). Na zavedené léčbě byl již v dalších dnech pacient stabilní, afebrilní, s regresí zánětlivých parametrů. Začal přijímat perorálně tekutiny i jídlo. Úspěšně zvládl i časně zahájenou rehabilitaci po kritickém stavu.
Po 31 dnech na Klinice popáleninové medicíny, a tedy po 42 dnech celkové hospitalizace byl pacient propuštěn do domácí péče. Kožní kryt se v dalších týdnech zhojil v plném rozsahu, trvalým následkem onemocnění zůstalo poškození nehtů (obr. 6 a obr. 7) a slzných kanálků.
4. a obr. 7. Trvalé poškození nehtů s odstupem 2 let. 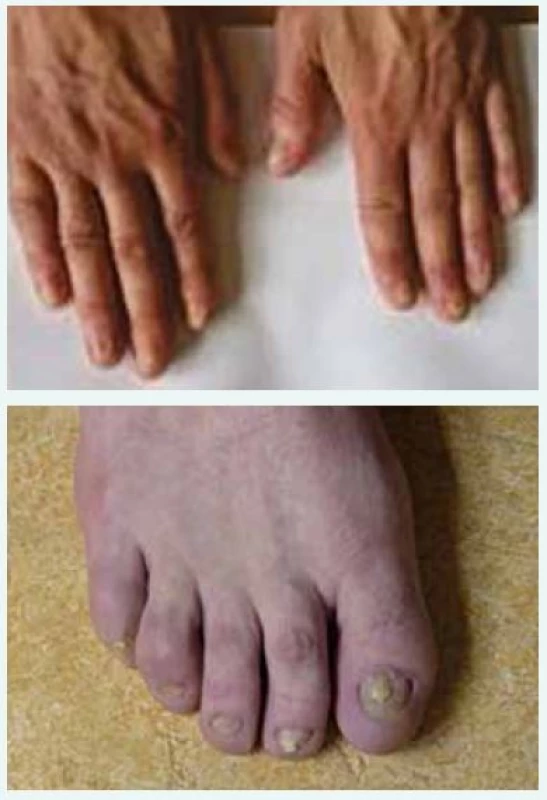
Fotografie z archivu autora Diskuse
Ve výše popsaném případě se domníváme, že Leyllův syndrom byl důsledkem práce pacienta s fungicidním přípravkem obsahujícím bis-dithiokarbamidany. Bis-dithiokarbamidany jsou jako kombinovaný fungicidní preparát celosvětově užívané při pěstování mnohých plodin. Je popisovaná jejich lehká toxicita na sliznice dutiny ústní a dýchacích cest, spojivky a kůži, zpravidla probíhající jako konjunktivitida nebo dermatitida. Život ohrožující stav ve formě Leyllova syndromu zatím v českém písemnictví po požití bis-dithiokarbamidanů popsán nebyl [7,8].
Leyllův syndrom je vzácné a závažné onemocnění. Na naší klinice nebyl za posledních 10 let jiný případ zaznamenán. Vzhledem k nízké incidenci onemocnění není dodnes terapie standardizovaná. Za nejdůležitější je považována izolace pacienta v aseptickém prostření a pravidelné převazy postižených části kůže zkušeným personálem a zároveň vysazení veškerých léků, které by mohly spouštět nebo potencovat probíhající reakci [1,10,17,21,22].
Paušální a širokospektrá antibiotická prevence infekce rané plochy není dnes celosvětově v odborné literatuře doporučována, jelikož antibiotika jsou statisticky nejčastějším spouštěčem onemocnění. Proto jsme i u našeho pacienta 6. den hospitalizace po normalizaci C-reaktivního proteinu a prokalcitoninu aminopeniciliny vysadili. Pravidelné stěry z kůže jsou nutností a antibiotická léčba by měla být indikována pouze cíleně dle kultivací v případě prokázané infekce [1,3,9,17,18,21]. Nejvíc diskutovaným lékem v terapii TEN jsou kortikosteroidy. Jejich efekt v léčbě je nejednoznačný. V protipólu protizánětlivého a imunosupresivního účinku je zvýšené riziko infekce, zpomalení hojení ran a především popsaná skutečnost, že kortikosteroidy můžou být (i když raritně) spouštěčem Leyllova syndromu [3,9,17]. Proto nejsou aktuálně kortikosteroidy v léčbě jednoznačně doporučovány a v případě jejich nasazení je vhodné postupně dávku snižovat [1,9,18,21]. Takto jsme postupovali i my u našeho pacienta, vzhledem k tomu, že iniciálně byly nasazeny pro postižení horních cest dýchacích s rizikem rozvoje otoku epiglottis. V posledních letech se u TEN dále zkouší podávání imunoglobulinů [11,18,22] a cyklosporinu [2,19,21,22]. Ojediněle byla použita i plazmaferéza [11,12]. Účinky těchto postupů jsou zatím hodnoceny jako pozitivní, nicméně dodnes nebyl pozitivní efekt potvrzen principy medicíny založené na důkazech [13,14,21].
Závěr
Se syndromem toxické epidermální nekrolýzy se na interní ambulanci, oddělení nebo klinice potkáváme v praxi extrémně zřídka. Protože se nejčastěji jedná o polékovou reakci a onemocnění se vyznačuje vysokou mortalitou, je nutné na Leyllův syndrom myslet při prezentaci pacienta s těžší kožní reakcí. Bohužel ani ve 21. století nejsou dostupná jednoznačná doporučení či standardy léčby a péče o tyto nemocné, kteří jsou často v bezprostředním ohrožení života. Klíčovým řešením je proto včasná diagnostika Lyellova syndromu a velmi těsná spolupráce specialistů více oborů (intezivista, dermatolog, specialista popáleninové medicíny). Pouze takto rozsáhlá spolupráce může vést k úspěšné léčbě syndromu s vysokou letalitou.
MUDr. Ján Csomor
jan.csomor@uvn.cz
Interní klinika 1. LF UK a ÚVN, Praha
www.uvn.cz
Doručeno do redakce 24. 6. 2015
Přijato po recenzi 23. 9. 2015
Sources
1. Mockenhaupt M. The current understanding of Stevens-Johnson syndrome and toxic epidermal necrolysis. Expert Rev Clin Immunol 2011; 7(6): 803–813.
2. Nešpor D, Lipový B, Gregorová N. Cyklosporin A v terapii toxické epidermální nekrolýzy. Dermatol praxi 2011; 5(3): 156–159.
3. Cohen V, Stuart Bronze M (ed). Toxic Epidermal Necrolysis. Dostupné z WWW: <http://emedicine.medscape.com/article/229698-overview#showall>.
4. Beneš J et al. Infekční lékařství. Galén: Praha 2009. ISBN 978–80–7262–644–1.
5. Osthaus WA. Leyll - Syndrom. In: Haverkamp W, Herth F, Messmann H. Internistische Intensivmedizin: Methoden – Diagnose – Therapie. Thieme Georg Verlag: Stuttgart 2008. ISBN 978–3131406217.
6. Bastuji-Garin S, Fouchard N, Bertocchi M et al. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol 2000; 115(2): 149–153.
7. Babini G. A case of erythroderma caused by zinc dithiocarbamate. Arch Ital Dermatol Venereol Sessuol 1966; 34 : 230–238.
8. Piraccini BM, Cameli N, Peluso AM et al. A case of allergic contact dermatitis due to the pesticide maneb. Contact Dermatitis 1991; 24(5): 381.
9. Ellender RP, Peters CW, Albritton HL et al. Clinical considerations for epidermal necrolysis. Oschner J 2014; 14(3): 413–417.
10. Roujeau JC, Kelly JP, Naldi L et al. Medication Use and the Risk of Stevens-Johnsons Syndrome or Toxic Epidermal Necrolysis. N Engl J Med 1995; 333(24): 1600–1607.
11. Napoli B, D’Arpa N, Masellis M. The Treatment of Lyell’s Syndrome: our Experience. Ann Burns Fire Disasters 2006; 19(1): 33–35.
12. Egan CA, Grant WJ, Morris SE et al. Plasmapheresis as an adjunct treatment in toxic epidermal necrolysis. J Am Acad Dermatol 1999; 40(3): 458–461.
13. Schneck J, Fagot JP, Sekula P et al. Effects of treatment on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis: A retrospective study on patients included in the prospective EuroSCAR Study. J Am Acad Dermatol 2008; 58(1): 33–40.
14. Lissia M, Mulas P, Bulla A et al. Toxic epidermal necrolysis (Lyell´s disease). Burns 2010; 36(2): 152–163.
15. Darlenski R, Kazandjieva J, Tsankov N. Systemic drug reactions with skin involvement: Stevens-Johnson syndrome, toxic epidermal necrolysis, and DRESS. Clin Dermatol 2015; 33(5): 538–541.
16. Hinc-Kasprzyk J, Polak-Krzemińska A, Ożóg-Zabolska I. Toxic epidermal necrolysis. Anaesthesiol Intensive Ther 2015; 47(3): 257–262.
17. Paulmann M, Mockenhaupt M. Severe drug-induced skin reactions: clinical features, diagnosis, etiology, and therapy. J Dtsch Dermatol Ges 2015; 13(7): 625–645.
18. Sun J, Liu J, Gong QL et al. Stevens-Johnsons Syndrome and toxic epidermal necrolysis: a multi-aspect comparative 7-year study from the People’s Republic of China. Drug Des Devel Ther 2014; 8 : 2539–2547. Dostupné z DOI: <http://dx.doi.org/10.2147/DDDT.S71736>.
19. Vokurka J, Fassmann A, Zgažarová S et al. Stevens-Johnsonův syndrom a jeho projevy v ústní dutině. Prakt zub Lék 2010; 58(3): 39–44.
20. Matějovič M. Lyellův syndrom. Anest Intenziv Med 2013; 24(1): 42.
21. Šuca H, Tokarik M, Pafčuga I et al. Toxická epidermální nekrolýza – naše zkušenosti s celkovou i lokální léčbou. Hojení ran 2011; 5(2): 22–24.
22. Lipový B, Říhová H, Gregorová N et al. Toxická epidermální nekrolýza: přehled možností terapie. Hojení ran 2011; 5(4): 6–12.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 1-
All articles in this issue
- Significance of alanine aminotransferase screening in blood donors for risk reduction of hepatitis B and C transmission by haemotherapy
- “3P (Patient-Pulse-Prognosis) in heart failure” survey: focus on heart rate
- Changes in the prognosis and treatment of Waldenström macroglobulinemia. Literature overview and own experience
- Gene mutations connected to Waldenstöm macroglobulinemia
- The SPRINT Research. A Randomized Trial of Intensive versus Standard Blood-Pressure Control
- Rare diagnostics of infective endocarditis after kidney transplantation
- A rare case of mobile atherosclerotic plaque with a high embolic potential in the femoral artery
- Dangerous cucumbers – Leyll’s syndrome
- Toxic epidermal necrolysis
- EASD Postgraduate Course of Clinical Diabetes and its Complications, Prague 2015
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Toxic epidermal necrolysis
- Changes in the prognosis and treatment of Waldenström macroglobulinemia. Literature overview and own experience
- Significance of alanine aminotransferase screening in blood donors for risk reduction of hepatitis B and C transmission by haemotherapy
- Gene mutations connected to Waldenstöm macroglobulinemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

