-
Medical journals
- Career
Diagnostika syndrómu polycystických ovárií
: Ivica Lazúrová; Jana Figurová; Zora Lazúrová
: I. interná klinika LF UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednostka prof. MUDr. Ivica Lazúrová, DrSc., FRCP
: Vnitř Lék 2015; 61(Suppl 5): 40-44
: Reviews
Syndróm polycystických ovárií (PCOS) je najčastejšou endokrinopatiou u žien fertilného veku a najčastejšou príčinou porúch menštruačného cyklu. Je charakterizovaný hyperandrogénnym stavom (klinickým alebo biochemickým) a ovariálnou dysfunkciou (anovuláciou alebo ultrasonografickým nálezom polycystických ovárií), čo sú zároveň kritériá pre jeho diagnózu podľa Androgen Excess and PCOS Society. Syndróm má mnohopočetné fenotypové prejavy, medzi ktoré patrí okrem uvedených charakteristík aj metabolický syndróm, predovšetkým obezita a inzulínová rezistencia. Diagnóza PCOS je v klinickej praxi pomerne náročná a stále platí, že je diagnózou per exclusionem, po vylúčení iných príčin hyperandrogénneho stavu a chronickej oligo-anovulácie. Vyžaduje si úzku spoluprácu gynekológa, endokrinológa a z hľadiska častých metabolických komplikácií aj internistu, diabetológa a prípadne aj kardiológa.
Kľúčové slová:
AES kritériá – diagnóza – diferenciálna diagnóza – syndróm polycystických ováriíÚvod
Syndróm polycystických ovárií (polycystic ovary syndrome – PCOS) je jednou z najčastejšie sa vyskytujúcich endokrinopatií u žien reprodukčného veku a zároveň vedúcou príčinou infertility, s maximom výskytu medzi 20. a 30. rokom života. Podľa typu aplikovaných diagnostických kritérií sa uvádza, že touto endokrinopatiou je postihnutých 5–18 % žien fertilného veku [1].
Okrem chronickej oligo-anovulácie s následnými poruchami fertility, hyperandrogenémie a kožných hyperandrogénnych prejavov trpia tieto ženy aj početnými metabolickými komplikáciami a zvýšenou prevalenciou kardiovaskulárnych (KVS) rizikových faktorov – viscerálnou obezitou, dyslipidémiou, inzulínovou rezistenciou (IR), porušenou glukózovou toleranciou (PGT), zvýšenou prevalenciou diabetes mellitus 2. typu (DM2T) a vyššou kardiovaskulárnou morbiditou [2]. Etiológia a patogenéza syndrómu dodnes nie je známa a jej presnejšie pochopenie by mohlo prispieť k lepšiemu manažmentu pacientiek s touto frekventnou endokrinopatiou.
PCOS je veľmi heterogénny a komplexný endokrinný stav, pre ktorý je typické to, že nemá jeden patomechanizmus, má veľmi vysokú variabilitu fenotypového prejavu a poruchy sekrécie sa netýkajú jedného hormónu, ale viacerých. Z tohto dôvodu aj diagnostika syndrómu je náročná a stále nie sú jednoznačne akceptované diagnostické kritériá. Ukázala to práca austrálskych autorov, v ktorej kritériá používané gynekológmi pri diagnostike PCOS sa značne odlišovali od kritérií, ktoré používali endokrinológovia [3].
Definícia PCOS
PCOS nie je jednoznačne definované ochorenie, ale je to syndromologická diagnostická jednotka, ktorá zahŕňa heterogénnu skupinu pacientiek. Najstaršia definícia PCOS, podľa tzv. NIH kritérií (The National Institutes of Health), definovala chorobu ako prítomnosť hyperandrogénneho stavu a chronickej anovulácie. V roku 1993 Rotterdamské kritériá upravili túto fenotypovú definíciu v zmysle platnosti 2 z nasledujúcich 3 kritérií: hyperandrogenizmus, chronická anovulácia a ultrasonografický obraz polycystických ovárií. Avšak na základe týchto kritérií sa za PCOS považoval aj fenotyp bez hyperandrogénneho stavu. Preto v roku 2006 Androgen Excess Society (AES) publikovala, že hyperandrogénny stav – klinický alebo biochemický, je nevyhnutnou podmienkou syndrómu, t.j. sine qua non pre PCOS. Táto definícia bola ďalej upravovaná a posledné kritériá pre diagnózu PCOS boli zverejnené v roku 2009. Podľa týchto kritérií, sú na diagnózu PCOS potrebné 2 podmienky, resp. kritériá:
- hyperandrogénny stav (klinický a/alebo biochemický)
- ovariálna dysfunkcia (chronická anovulácia a/alebo polycystická morfológia ovárií) [4]
Je však potrebné zdôrazniť, že diagnóza PCOS je stále diagnózou per exclusionem, po vylúčení iných príčin hyperandrogénneho stavu.
K základným charakteristikám ochorenia patria aj v rôznej miere vyjadrené metabolické abnormality – obezita, inzulínová rezistencia, hyperinzulinémia, zvýšené riziko rozvoja porušenej glukózovej tolerancie (PGT) a DM2T [2,5]. Tieto metabolické abnormality však žiadne z diagnostických kritérií nezahŕňa. Vzájomná kombinácia a miera závažnosti laboratórnych, klinických a metabolických prejavov je veľmi variabilná a môže sa meniť v priebehu rokov i u jednej pacientky. V mladšom veku sú v popredí klinického obrazu reprodukčné abnormality, so stúpajúcim vekom žien s PCOS sa pozoruje tendencia k zvýrazneniu metabolických abnormalít (tab. 1) [4].
1. Diagnostické kritéria pre PCOS. 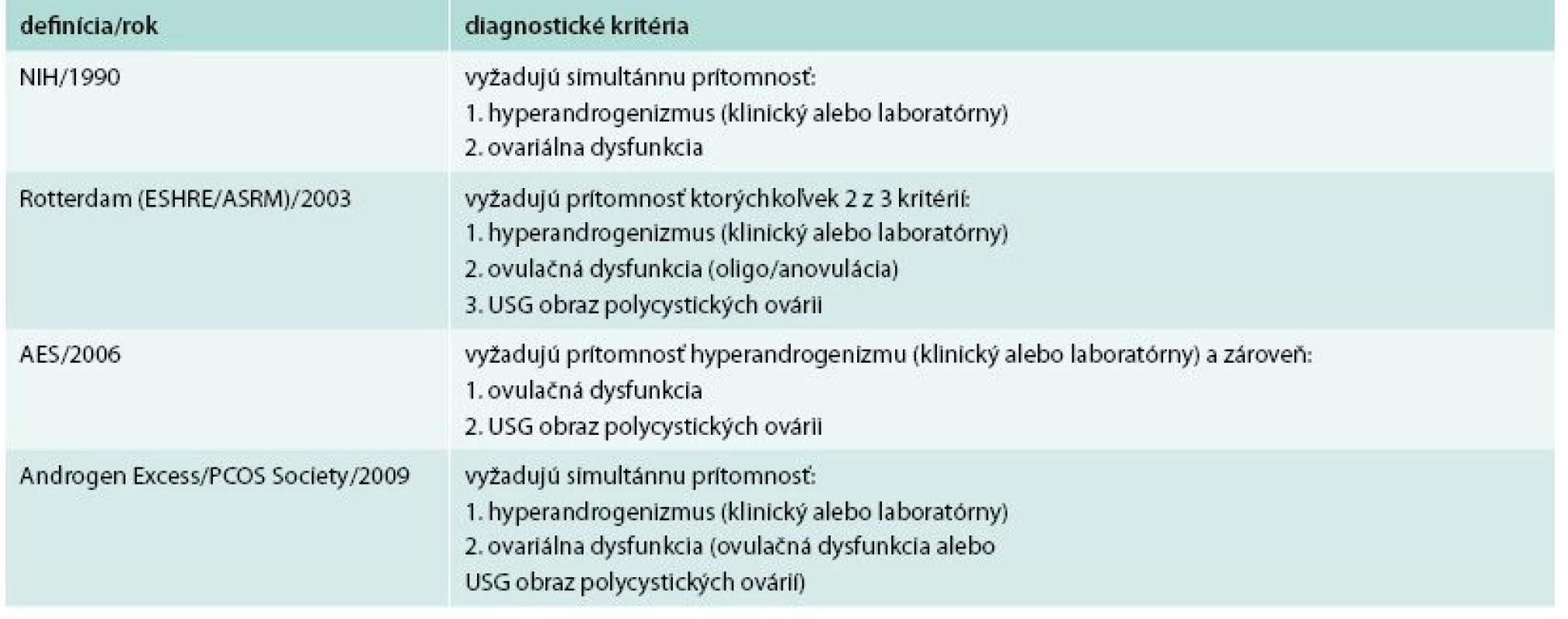
USG – ultrasonografický Upravené podľa [20] Prevalencia PCOS
Prevalencia PCOS závisí od použitých kritérií pre diagnózu ochorenia. Na základe pôvodných NIH kritérií sa uvádzala prevalencia 6–8 % žien v reprodukčnom veku. Rotterdamské kritériá zvýšili prevalenciu syndrómu až na 15–25 %. Podľa súčasných odporúčaní sa prevalencia pohybuje medzi 10–15 %. Znižuje sa s vekom, kedy typické prejavy PCOS ustupujú do úzadia a začínajú prevládať metabolické príznaky [6,7].
Diagnostika a fenotypové prejavy PCOS
Pacientky, ktoré by mali byť vyšetrované pre podozrenie na PCOS, predstavujú skupinu žien fertilného veku s dlhotrvajúcimi poruchami menštruačného cyklu (MC) a ovulácie, s kožnými prejavmi hyperandrogenizmu (hirzutizmus, akné a alopécia), ako aj žien s náhodne zistenou prítomnosťou polycystických ovárií (PCO) pri gynekologickom ultrasonografickom (USG) vyšetrení. Vo zvýšenom riziku pre PCOS sú aj ženy fertilného veku s inzulínovou rezistenciou, obezitou a metabolickými abnormalitami. Diagnostika PCOS potom pozostáva z dvoch základných krokov, a to objektivizácie prítomnosti znakov charakteristických pre PCOS podľa odporúčaných diagnostických kritérií a vylúčenia iných príčin hyperandrogenizmu a porúch ovulácie a MC [4].
Hyperandrogénny stav
Hyperandrogenizmus môže byť vyjadrený laboratórne ako hyperandrogenémia, t.j. zvýšenie hladín cirkulujúcich endogénnych androgénov v krvi nad hornú hranicu ich referenčného rozmedzia vo vybranej fáze MC alebo jeho klinickými prejavmi (akné, hirzutizmus, androgénna alopécia). Väčšina žien s PCOS má klinické aj laboratórne znaky hyperandrogenizmu.
Laboratórny hyperandrogenizmus
Zvýšená hladina androgénov sa vyskytuje u 60–80 % žien s PCOS a predstavuje najvýznamnejší laboratórny nález pri tomto syndróme. Hlavné androgény, ktoré je potrebné stanoviť u žien s podozrením na PCOS, sú celkový testosterón (TST), voľný testosterón (fTST), androstendión (ASD), dehydroepiandrosterón (DHEA) a jeho metabolit DHEAS.
Celkový TST je transportovaný vo väzbe na SHBG (sex hormone-binding globulin) alebo inými bielkovinami plazmy a jeho sérové hodnoty nekorelujú s jeho biologickou aktivitou v cieľových tkanivách. Za túto je zodpovedná jeho voľná frakcia – fTST, ktorého stanovenie sa preto považuje za najužitočnejší a najsenzitívnejší marker v diagnostike hyperandrogenémie. Laboratórne stanovenia fTST však majú veľké limitácie. Rádioimunoanalytické (RIA) metódy sa považujú za nepresné. Naopak za optimálne metódy stanovenia testosterónu sa považujú metóda rovnovážnej dialýzy alebo kvapalinovej chromatografie. Tieto metódy stanovenia však nie sú bežne dostupné a veľký problém predstavuje aj ich vysoká cena. Preto v praxi sa odporúča stanovenie fTST výpočtom, a to ako pomer celkový TST/SHBG × 100. Stanovenie fTST odporúčanou metodikou alebo vypočítaná hodnota voľného indexu androgénov (FAI) sú potom považované za dostatočne senzitívne na posúdenie hyperandrogenémie [4].
Ďalším androgénom, ktorý môže byť nápomocný v diagnostike PCOS, je androstendión, produkovaný v kôre nadobličky a v tekálnych bunkách ovária. Jeho supranormálne hodnoty spolu s eleváciou ďalších androgénov sa popisujú asi u 18 % žien s PCOS. Cirkulujúce hladiny DHEA majú limitovanú diagnostickú hodnotu pre jeho nízke koncentrácie a diurnálnu variabilitu. Väčší význam má stanovenie jeho metabolitu DHEAS, ktorý je považovaný za marker adrenálnej nadprodukcie androgénov. Jeho zvýšené hodnoty sa popisujú u 25–35 % žien s PCOS žien a sú asociované s eleváciou ostatných androgénov [7]. U 10 % žien s PCOS žien je prítomná izolovaná elevácia DHEAS, jeho význam je však sporný.
Klinický hyperandrogenizmus
Klinicky sa hyperandrogenémia u ženy môže prejaviť ako hirzutizmus, akné alebo androgénna alopécia.
Hirzutizmus je definovaný ako nadmerný rast terminálneho vlasu u žien vyskytujúci sa v typicky mužskej distribúcii – nad hornou perou, na brade a lícach, periareolárne a v strednej časti sterna, pozdĺž linea alba a v dolnej časti brucha, v krížovej oblasti a na chrbte, na ramenách a na stehnách. Hirzutizmus je považovaný za najdôležitejší a najčastejší prejav hyperandrogenizmu u žien s PCOS a je prítomný približne v 65–75 %. Jeho prevalencia však varíruje podľa rasy a etnickej príslušnosti a ovplyvňuje ju aj kontroverzné hodnotenie stupňa hirzutizmu, ktoré je veľmi subjektívne a bez jednoznačne stanovených cut-off hodnôt pre jeho definíciu [4]. K hodnoteniu stupňa a rozsahu hirzutizmu sa používajú tzv. vizuálne skórovacie systémy. Najčastejšie využívaným je modifikované skóre pôvodne navrhnuté Ferimmanom a Gallweyovou (mFG skóre), ktoré vzniká súčtom bodov pridelených podľa intenzity rastu terminálneho vlasu v 9 preddefinovaných oblastiach tela. Za hirzutizmus je najčastejšie považovaná hodnota mFG skóre ≥ 6, iní zas uprednostňujú hodnotu mFG skóre ≥ 8. Stupeň hirzutizmu najlepšie koreluje s koncentráciou fTST a považuje sa za najdôležitejší prediktor zníženej kvality života u žien s PCOS [8,9].
Akné sa vyskytuje asi u 15–25 % pacientiek s PCOS , avšak jeho prevalencia je vysoká aj v bežnej populácii. Stupeň klinickej manifestácie akné nekoreluje s hladinami androgénov, tá je závislá od individuálnej vnímavosti pilosebaceálnej jednotky kože [10]. Samostatná prítomnosť akné je preto nedostatočný ukazovateľ hyperandrogenizmu u oligomenoroických žien [11].
Androgénna alopécia je difúzne preriedenie vlasov v oblasti kapilícia u žien. Udáva sa, že postihuje okolo 22 % žien s PCOS a naopak, že ženy s PCOS môžu tvoriť 10–40 % pacientok s androgénnou alopéciou. Jej korelácia s hyperandrogenémiou je rovnako ako pri akné slabá. Preto sa viacerí autori zhodli, že hoci má mnoho žien s PCOS klinický prejav hyperandrogenémie vo forme akné a androgénnej alopécie, neodporúčajú tieto znaky používať ako relevantný klinický prejav hyperandrogenémie v diagnostike PCOS [4].
Podľa posledných AES Task Force kritérií pre diagnostiku PCOS sa za najspoľahlivejšie ukazovatele hyperandrogenizmu majú považovať prítomnosť hirzutizmu a elevácia fTST [7].
Poruchy ovariálnych funkcií
Chronická anovulácia
Najčastejší príznak, ktorý sa vyskytuje u väčšiny PCOS žien, je chronická oligoovulácia až anovulácia. Jej definícia je založená na vylúčení iných príčin chronickej anovulácie, ako je napr. hyperprolaktinémia, ovariálne zlyhanie a ďalšie, stanovení hladín progesterónu obvykle 8–12 dní pred očakávaným menštruačným krvácaním alebo chýbaní corpus luteum pri USG vyšetrení v 3 po sebe idúcich cykloch. Ovulácia je potvrdená prítomnosťou corpus luteum sonograficky alebo hladinou progesterónu 10 nmol/l, resp. 5 ng/ml a viac. Avšak nesprávne načasovanie merania progesterónu môže poskytnúť nepravdivé údaje o ovulácii alebo anovulácii.
Anamnéza prítomnosti oligomenoroe nie je spoľahlivým kritériom pre hodnotenie anovulačných cyklov, keďže ovulačná dysfunkcia môže byť prítomná aj u žien s pravidelným menštruačným cyklom. Preto anamnéza pravidelného cyklu nie je dostatočná na preukázanie ovulačných alebo anovulačných cyklov. Azziz et al vo svojej práci uvádzajú, že až 20–30 % pacientiek s oligoovuláciou alebo anovuláciou a PCOS majú v anamnéze pravidelný MC [12]. Tento stav označujeme ako tzv. subklinickú oligo-anovuláciu. Prítomnosť pravidelného MC u žien s PCOS teda nevylučuje ovulačnú dysfunkciu.
Závažnosť poruchy MC koreluje aj so stupňom endokrinných a metabolických abnormalít. Eumenoroické pacientky mali signifikantne lepšie metabolické parametre, t.j. BMI, inzulinémiu nalačno, index inzulínovej rezistencie HOMA v porovnaní s pacientkami s oligomenoreou/amenoreou. Rovnako aj hormonálne ukazovatele (TST, LH, FSH, voľný index androgénov – FAI) vykazovali signifikantné rozdiely medzi pacientkami s pravidelným MC v porovnaní s oligo/amenoroickými ženami [13].
Klinicky zjavné poruchy MC u žien s PCOS vo fertilnom veku sú prítomné v 75–85 %, prevalencia porúch MC sa mení s vekom a má klesajúcu tendenciu smerom k obdobiu nástupu menopauzy [7].
Polycystické ováriá – polycystická ovariálna morfológia (PCOM)
USG diagnostické kritéria polycystických ovárií boli donedávna definované prítomnosťou 12 alebo viacerých folikulov v ováriu o priemere 2–9 mm, uložených typicky subkapsulárne alebo zväčšenie objemu ovária nad 10 cm3 podľa vzorca 0,5 × dĺžka × šírka × hrúbka ovária v cm. Morfológiu ovárií pre potreby diagnostiky PCO sa odporúča hodnotiť USG vyšetrením vaginálnou sondou vo včasnej folikulárnej fáze MC (3.–5. deň) [14]. Nález morfológie PCO pri USG vyšetrení nie je univerzálnym znakom PCOS, avšak je prítomný až u 70–90 % žien s PCOS.
Meranie objemu ovária a počtu folikulov je však veľmi subjektívna metóda a vyžaduje si veľké skúsenosti sonografistu. Použitím nových USG technológií sa dá napočítať aj v bežnom ováriu viac folikulov, než bolo pôvodné kritérium. Preto v roku 2014 boli publikované nové odporúčania, podľa ktorých množstvo folikulov ≥ 25 je typických pre PCO morfológiu, avšak iba za použitia nových prístrojov s 8 MHz sondou. V prípade, že tieto nové USG technológie nie sú dostupné, potom sa odporúča použiť skôr stanovenie objemu ovária, čo je citlivejšia metóda než klasická metóda merania počtu folikulov [15]. Už prítomnosť jedného ovária s mnohopočetnými cystami je dostačujúca pre diagnózu PCO [16].
PCO morfológia môže byť ovplyvnená viacerými faktormi. V prvom rade je to užívanie orálnych kontraceptív. Tieto vplývajú na ovariálnu morfológiu, a preto na jej korektné zhodnotenie by kontraceptíva mali byť vysadené po dobu minimálne 3 mesiacov. Ďalším faktorom, ktorý výrazne ovplyvňuje počet folikulov, je vek. Je známe, že asi 40 % adolescentiek má obraz typický pre PCO, avšak tento obraz s vekom regreduje. Taktiež približne 20 % žien v reprodukčnom veku má PCOM, ale bez iných klinických a laboratórnych príznakov PCOS. Tieto údaje teda dokazujú, že prítomnosť polycystických ovárií pri USG vyšetrení, teda PCOM nestačí na definíciu PCOS. Dokonca prítomnosť PCOM nemusí vôbec ovplyvniť fertilitu u žien a taktiež nie je známy vzťah PCOM k metabolickým parametrom, čo si vyžaduje ďalšie štúdie.
Ostatné laboratórne nálezy
Abnormálna sekrécia gonadotropínov pri PCOS bola historicky najstaršou známou endokrinnou abnormalitou. Pri PCOS nachádzame vo folikulárnej fáze MC zvýšené sérové koncentrácie LH, pomer LH/FSH je zvyčajne vyšší ako 2–3. Tieto zmeny však nie sú univerzálne, ich prítomnosť podporuje diagnózu PCOS, ale vzhľadom k ich nízkej špecificite nie sú považované za diagnostické kritérium. Zvýšená koncentrácia LH sa popisuje u približne 60–70 % žien s PCOS, avšak pomer LH/FSH je zvýšený až u 95 % žien s PCOS.
U žien s PCOS sa ďalej popisujú normálne hodnoty sérového estradiolu a zvýšené koncentrácie estrónov, ktoré pochádzajú z aromatizácie zvýšených androgénov [4].
Hyperinzulinémia, ktorá je odozvou na IR v periférnych tkanivách, zvyšuje produkciu androgénov v ováriách a nadobličkách a znižuje produkciu SHBG v pečeni. Nízka hladina SHBG je ďalším charakteristickým laboratórnym nálezom pri PCOS. Produkcia SHBG v pečeni je ovplyvnená pôsobením inzulínu, estrogénov a androgénov. V klinických štúdiách bola opakovane dokumentovaná negatívna korelácia medzi inzulinémiou a hladinami SHBG. Nízke hladiny SHBG vedú k zvýšeniu fTST a FAI v plazme, a tým aj k zvýšeniu jeho androgenného účinku [17].
V poslednom období sa začalo v laboratórnej diagnostike ovariálnej dysfunkcie a poruchy folikulogenézy pri PCOS do klinickej praxe aplikovať stanovenie anti-Mülleriánskeho hormónu (AMH). AMH je glykoproteín, ktorý patrí do skupiny rastových faktorov, je produkovaný bunkami granulózy primárnych – preantrálnych a malých antrálnych folikulov ovária. AMH za fyziologických okolností bráni inhibíciou selekcie viacerých primordiálnych folikulov, spomalením ich rastu a ich atréziou strate oocytárnej rezervy. Považuje sa za marker ovariálnej rezervy a jeho koncentrácia u žien klesá s vekom [18]. Zvýšené sérové hodnoty a expresia AMH u žien s PCOS reflektujú poruchu folikulogenézy so zástavou vývoja folikulov, ktorá je kľúčová v patogenéze ovulačnej dysfunkcie pri PCOS. Stanovenie AMH má vysoký diagnostický potenciál a malo byť zaradené do diagnostického algoritmu predovšetkým v prípadoch chýbajúceho hyperandrogenizmu alebo jednoznačných porúch ovulácie alebo keď sa nedarí spoľahlivo USG vizualizovať počet antrálnych folikulov [19]. Ak nie je k dispozícii hodnoverný nález USG, tak hodnota AMH u žien s hyperandrogenizmom a oligo-anovuláciou môže podporiť diagnózu PCOS.
Diferenciálna diagnostika PCOS
Ako už bolo uvedené, PCOS je diagnostikovaný per exclusionem, po vylúčení iných príčin hyperandrogénneho stavu a oligo-anovulácie.
Spomedzi množstva ochorení, ktoré môže viesť k oligoovulácii/anovulácii, je treba predovšetkým vylúčiť choroby štítnej žľazy a hyperprolaktinémiu. Avšak hyperandrogénny stav v týchto prípadoch je veľmi zriedkavý. Je známe, že mierna hyperprolaktinémia je veľmi častým laboratórnym nálezom u PCOS žien, jej klinický význam však nie je celkom jasný.
Z hyperandrogénnych stavov je potrebné vylúčiť neklasické formy kongenitálnej adrenálnej hyperplázie, najmä deficit 21-hydroxylázy, prípadne deficit 3β-hydroxysteroiddehydrogenázy. Klinické prejavy sú podobné ako pri PCOS, preto rutinný skríning deficitu 21-hydroxylázy vzhľadom na jeho relatívnu častosť sa odporúča u všetkých žien s podozrením na PCOS.
Nízky výskyt hyperkortizolizmu v klinickej praxi a obzvlášť u žien s podozrením na PCOS neindikuje jeho rutinný skríning u hyperandrogenemických žien. U žien s hyperandrogénnym stavom však treba vylúčiť HAIR-AN syndróm, ktorý sa vyskytuje u 3 % žien s uvedenou symptomatológiou. Je charakterizovaný závažnou inzulínovou rezistenciou, prítomnosťou acanthosis nigricans a rôznymi stupňami lipodystrofie, čo samozrejme môže byť prítomné aj pri PCOS. Preto odlíšenie týchto dvoch nozologických jednotiek je obvykle veľmi ťažké. U žien s hirzutizmom je treba oddiferencovať aj tzv. idiopatický hirzutizmus, t.j. hirzutizmus bez PCO morfológie a bez chronickej anovulácie. Vyskytuje sa asi u 5–7 % hirzutických žien, u ktorých reprodukčné funkcie nie sú porušené [20].
Záver
Diagnóza PCOS je v klinickej praxi pomerne náročná a stále platí, že je diagnózou per exclusionem, po vylúčení iných príčin hyperandrogénneho stavu a chronickej oligo-anovulácie. Vyžaduje si úzku spoluprácu gynekológa, endokrinológa a z hľadiska častých metabolických komplikácií aj internistu, diabetológa a prípadne aj kardiológa.
prof. MUDr. Ivica Lazúrová, DrSc., FRCP
ivica.lazurova@upjs.sk
I. interná klinika LF UPJŠ a UN L. Pasteura, Košice, Slovenská republika
www.fnlp.sk
Doručeno do redakce 16. 8. 2015
Přijato po recenzi 30. 9. 2015
Sources
1. March WA, Moor VM, Wilson KJ et al. The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria. Hum Reprod 2010; 25(2): 544–551.
2. Alexander CJ, Tangchitnob EP, Lepor NE. Polycystic ovary syndrome: a major unrecognized cardiovascular risk factor in women. Rev Obstet Gynecol 2009 Fall; 2(4): 232–239.
3. Cussons AJ, Stuckey BG, Walsh JP et al. Polycystic ovarian syndrome: marked differences between endocrinologists and gynaecologists in diagnosis and management. Clin Endocrinol (Oxf) 2005; 62(3): 289–295.
4. Azziz R, Carmina E, Dewailly D et al. The Androgen Excess and PCOS Society criteria for polycystic ovary syndrome: the complete task force report. Fertil Steril 2009; 91(2): 456–488.
5. Alvarez-Blasco F, Botella-Carretero JI, San Millan JL et al. Prevalence and characteristics of the polycystic ovary syndrome in overweight and obese women. Arch Intern Med 2006; 166(19): 2081–2086.
6. Yildiz BO, Bozdag G, Yapici Z et al. Prevalence, phenotype and cardiometabolic risk of polycystic ovary syndrome under different diagnostic criteria. Hum Reprod 2012; 27(10): 3067–3073.
7. Conway G, Dewailly D, Diamanti-Kandarakis E et al. The polycystic ovary syndrome: a position statement from the European Society of Endocrinology. Eur J Endocrinol 2014; 171(1): 1–29.
8. Cibula D, Hill M, Starka L et al. The best correlation of the new index of hyperandrogenism with the grade of increased hair. Eur J Endocrinol 2000; 143(3): 405–408.
9. Yildiz BO, Boulour S, Woods K et al. Visually scoring hirsutism. Hum Reprod Update 2010; 16(1): 51–64.
10. Cibula D, Hill M, Vohradnikova O et al. The role of androgens in determining acne severity in adult women. Br J Dermatol 2000; 143(2): 399–404.
11. Haciveliglou S, Gungor AN, Gencer M et al. Acne severity and the Global Acne Grading system in polycystic ovary syndrome. Int J Gynaecol Obstet 2013; 123(1): 33–36.
12. Azziz R, Woods KS, Reyna R et al. The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol Metab 2004; 89(6): 2745–2749.
13. Strowitzki T, Capp E, Von Eye Corleta H. The degree of cycle irregularity correlates with the grade of endocrine and metabolic disorders in PCOS patients. Eur J Gynecol Reprod Biol 2010; 149(2): 178–181.
14. Sanchez LA, Perez M, Centeno I et al. Determining the time androgens and sex hormone binding globulin take to return to baseline after discontinuation of oral contraceptives in women with polycystic ovary syndrome: a prospective study. Fertil Steril 2007; 87(3): 712–714.
15. Dewailly D, Lujan ME, Carmina E et al. Definition and significance of polycystic ovarian morphology: a task force report from the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update 2014; 20(3): 334–352.
16. Jonard S, Robert Y, Cortet-Rudelli C et al. Ultrasound examination of polycystic ovaries: is it worth counting the follicles? Hum Reprod 2003; 18(3): 598–603.
17. Laven JS, Imani B, Eijkemans MJ et al. New approaches to PCOS and other forms of anovulatory infertility. Obstet Gynecol Surv 2002; 57(11): 755–767.
18. Homburg R, Crawford G. The role of AMH in anovulation associated with polycystic ovary syndrome: a hypothesis. Hum Reprod 2014; 29(6): 1117–1121.
19. Casadei L, Madrigale A, Puca F et al. The role of serum anti-Müllerian hormone (AMH) in the hormonal diagnosis of polycystic ovary syndrome. Gynecol Endocrinol 2013; 29(6): 545–550.
20. Livadas S, Diamanti-Kandarakis E. Polycystic ovary syndrome: Definition, Phenotypes and Diagnostic Approach. In: Macut D, Pfeifer M, Yildiz BO et al. Polycystic ovary syndrome. Novel Insights into Causes and Therapy: 40. Karger; Basel 2012 : 1–21. ISBN 978–3318022384.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue Suppl 5-
All articles in this issue
- Epidemiologic data of hyperuricaemia prevalence in the conditions of primary care in Slovakia
- Management of treatment in patients with neuroendocrine neoplasmas of digestive tract
- Specifics of using ambulatory blood pressure monitoring in the elderly
- Arterial hypertension – multicirculus vitiosus vasorum
- Hormonal changes in inflammatory bowel disease
- Diagnostics of polycystic ovary syndrome
- Non usual cases of hypoglycaemia – hypoglycaemia factitia
- Is iron important in heart failure?
- Novel diagnostic and therapeutic procedures in diabetic nephropathy
- Are we to pay attention to factor XII deficiency?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Are we to pay attention to factor XII deficiency?
- Diagnostics of polycystic ovary syndrome
- Arterial hypertension – multicirculus vitiosus vasorum
- Hormonal changes in inflammatory bowel disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

