-
Medical journals
- Career
Izolovaná nonkompaktní kardiomyopatie: souhrnný článek s kazuistickým příkladem
Authors: Karel Vondrák
Authors‘ workplace: Kardiocentrum, III. interní kardiologická klinika 3. LF UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Published in: Vnitř Lék 2014; 60(2): 164-170
Category: Case Report
Overview
Izolovaná komorová nonkompaktní kardiomyopatie (IVNC) je vzácné geneticky determinované onemocnění charakterizované velmi výraznou trabekularizací luminální strany stěny srdeční komory s hlubokými recesy. Patogeneticky dochází in utero k zastavení konsolidace původní neuspořádané sítě myokardiálních trabekul. IVNC se klinicky projevuje trias: srdeční selhání, tromboembolické komplikace a arytmie. Průběh onemocnění je variabilní, s pacienty, u nichž se jedná pouze o náhodný echokardiografický nález, až po případy těžkého srdečního selhání a náhlé srdeční smrti. Tento článek předkládá přehled problematiky v současné době a na závěr uvádí krátkou kazuistiku nemocné s IVNC.
Klíčová slova:
arytmie – echokardiografie – nonkompaktní kardiomyopatie – srdeční selhání – tromboembolické komplikaceÚvod
Izolovaná komorová nonkompaktní kardiomyopatie (IVNC) je geneticky determinované onemocnění charakterizované velmi výraznou trabekularizací luminální strany stěny srdeční komory. Pouze menší část je tvořena kompaktní, tedy morfologicky normální vrstvou myokardu tvořící vnější část stěny komory [1]. Jedná se o vzácné onemocnění. Udávaná prevalence je však jistě ovlivněna častými diagnostickými rozpaky, které vedou k chybnému zařazení nemoci. Na prevalenci se jistě podílí i všeobecně horší informovanost o tomto druhu kardiomyopatie.
Tento článek si klade za cíl přiblížit nejnovější informace o tomto onemocnění a zároveň ilustruje krátkou kazuistiku 50leté pacientky.
Historie
V roce 1975 publikoval J. Dušek poznatky o perzistujícím spongiózním myokardu u 5 novorozenců [2]. Engeberding v roce 1984 poprvé popsal přetrvávající sinusoidy v dutině levé komory srdeční při echokardiografickém vyšetření u 33leté pacientky [3]. Následně byly podobné struktury popsány přibližně s ročními odstupy u dvou 21letých pacientů. První z nich měl anamnézu srdečního selhání již v 15. roce věku [4]. U druhého pacienta byly sekčně poprvé prokázány perzistující embryonální sinusoidy ve ztluštělém myokardu [5]. V roce 1990 ve studii 8 případů pediatrických pacientů Chin navrhl termín izolovaná nonkompaktní kardiomyopatie [6]. V roce 1997 Ritter publikoval dalších 17 případů IVNC z téměř 40 000 echokardiograficky vyšetřených pacientů v průběhu 10 let [7].
Patogeneze
V časném embryonálním vývoji je myokard popisován jako neuspořádaná síť myokardiálních trabekul, mezi nimiž se nacházejí hluboké recesy. Během 5.–8. týdne intrauterinního vývoje dochází ke konzolidaci této sítě směrem od srdečních bází k apexu a od epikardu k endokardu. Vzhledem k tomu leží nejčastěji postižené segmenty levé komory apikálně a v dalších přilehlých lokalizacích. Intertrabekulární recesy jsou přeměněny v kapiláry myokardu a vytvářejí se koronární arterie [8,9]. Konzolidace levé komory je úplnější, zatímco v pravé komoře četnější trabekuly přetrvávají do dospělosti fyziologicky. Dle teorie je rozvoj IVNC způsoben zastavením intrauterinní fáze konzolidace myokardu [10]. Tato teorie je podporována zřejmou podobností mezi embryonálně se vyvíjecím myokardem a myokardem postiženým IVNC [6,9]. Existují však také práce, které tuto teorii zpochybňují [11].
Genetika
IVNC je heterogenně geneticky determinované onemocnění, což ztěžuje jednoznačné objasnění průběhu její patogeneze. Familiární forma tvoří asi 2/3 případů IVNC, sporadické formy jsou vzácnější [12]. Nejčastěji jsou za vznik onemocnění odpovědné mutace genů pro sarkomerické proteiny, např. genu pro těžký řetězec srdečního β-myozinu (MYH7), srdečního troponinu T (TNNT2), srdečního α-aktinu (ACTC1) [13], srdečního myozin vázajícího proteinu C (MYBPC3) a α-tropomyozinu (TPM1) [14].
Mezi další mutace genů asociované s IVNC patří např. mutace genu pro mitochondriální protein tafazzin (TAZ G4.5), která je uváděna i v souvislosti s Barthovým syndromem (X-gonozomálně dědičná porucha u mužů spojená s dilatační kardiomyopatií, laktátovou acidózou, neutropenií a poruchami mitochondriálního metabolizmu) [15]. Dále lze zmínit mutace proteinů Z-disků (Cypher/ZASP) [16], α-dystrobrevinu (DTNA) [17], proteinů jaderné membrány (laminin A/C) [18] aj. Uvedené mutace mohou být rovněž asociovány s jinými typy kardiomyopatií, např. apikální formou hypertrofické kardiomyopatie s mutací ACTC1 [19] a hypertrofickou, dilatační i restriktivní kardiomyopatií s MYH7 [20]. Lze tak spekulovat, že všechny hereditární kardiomyopatie jsou vzájemně příbuzná onemocnění lišící se pouze fenotypicky [12].
Podle doporučení Heart Failure Society of America [21] je vhodné provedení klinického (echokardiografického) screeningu příbuzných 1. stupně u pacienta s diagnostikovanou IVNC a odebrání podrobné rodinné anamnézy u příbuzných ve 3 generacích.
Epidemiologie
Významným problémem pro získání relevantních epidemiologických dat je zřejmá velká sporadičnost onemocnění, nejistě definovaná diagnostická kritéria a malá informovanost o tomto druhu kardiomyopatie kardiology. Udávaná prevalence onemocnění v jednotlivých souborech pacientů je velmi závislá na charakteristikách studované populace a vzájemně se řádově liší od 0,014 % [22] po 0,26 % [23]. Vzhledem k tomu, že studie byly vesměs prováděny retrospektivně na populaci odesílané k echokardiografickému vyšetření, bude zřejmě prevalence v obecné populaci nižší [24].
Častěji jsou postiženi muži (asi 2/3) [25,26]. Bhatia [25] udává střední věk pacientů s prvně diagnostikovanou IVNC 41 let. Diagnóza IVNC byla v několika případech stanovena již in utero, existují však i případy pacientů s určením diagnózy až po 90. roce věku [27,28].
Klinický obraz
Pro IVNC je typická trias: srdeční selhání, arytmie, tromboembolické komplikace [7]. Dušnost při srdečním selhání je nejčastějším prvním symptomem pacientů, který vede posléze k diagnóze IVNC. Srdeční selhání při systolické dysfunkci levé komory je zároveň nejčastějším důvodem následných hospitalizací. Dalšími uváděnými symptomy jsou bolesti na hrudi, palpitace, synkopy a presynkopy [25].
Specifickou skupinu pacientů s IVNC představují pediatričtí pacienti. U nich je nonkompaktní kardiomyopatie často spojována s faciálním dysmorfizmem, neuromuskulárními onemocněními a s vrozenými vývojovými vadami srdce [29,30]. Nejedná se tedy de facto o izolovanou nonkompaktní kardiomyopatii. Pro případ současného nálezu vrozené srdeční vady a nonkompaktní vrstvy myokardu se vžil termín levokomorová nonkompaktní kardiomyopatie (LVNC).
Velká část pacientů s IVNC může být samozřejmě zcela asymptomatická a onemocnění je u nich diagnostikováno na základě nepřímých patologických nálezů (EKG) či při kardiologické kontrole z jiné příčiny.
Diagnostika
Diagnostickou metodou první volby je echokardiografické vyšetření. Jeho hlavním úskalím je rozlišení IVNC od celé řady jiných patologií, které mohou obraz IVNC imitovat a mezi něž patří hypertrofická kardiomyopatie, především její apikální forma, nástěnný trombus v levé komoře, endokardiální fibroelastóza či tumory. Dále je nutné odlišit IVNC od zdravého myokardu s menším počtem prominujících trabekul. První pokus o stanovení jasných echokardiografických kritérií, která by odlišila IVNC, učinil v roce 1990 Chin et al [6]. V roce 2001 definovali Jenni et al [1] kritéria na základě studie 34 pacientů publikované Öchslinem et al [22]. Další používaná kritéria popsali v roce 2002 Stöllberger et al [31]. Uvedená echokardiografická kritéria jsou shrnuta v tab. (s. 166).
Table 1. Echokardiografická kritéria pro diagnostiku IVNC 
Dle práce provedené Kohli et al [32] jsou však i tato uvedená diagnostická kritéria pro IVNC málo specifická a vedou k nadhodnocení prevalence onemocnění. Finsterer a Stölberger [33] proto navrhují kombinovat kritéria užitá ve studii Öchslinem (poměr kompaktní a nonkompaktní vrstvy alespoň 1 : 2 a průkaz perfuze intertrabekulárních recesů barevným dopplerovským mapováním) s kritérii dle Stöllbergera (tab.). Při splnění všech bodů obou kritérií lze označit diagnózu IVNC za jistou. Při splnění kritérií dle definice pouze jednoho z autorů je diagnóza označena jako pravděpodobná. Jako možnou lze konečně diagnózu označit, pokud je počet prominujících trabekul nižší než 4, nebo pokud je poměr mezi nonkompaktní a kompaktní vrstvou nižší než 2.
Velmi spolehlivou metodou ke stanovení diagnózy IVNC se zdá být MRI srdce. Petersonem udávaný poměr nonkompaktní a kompaktní vrstvy alespoň 2,3 : 1 ke stanovení diagnózy IVNC znamenal senzitivitu 86 % při 99% specificitě [34]. Jacquier et al [35] stanovili kritéria pro diagnózu IVNC pomocí stanovení poměru mezi hmotou nonkompaktní vrstvy k hmotě celé levé komory, nonkompaktní vrstva musí tvořit 20 % a více hmoty levé komory.
Při CT vyšetření srdce stejně jako při ventrikulografii může být rovněž zjištěna houbovitá struktura stěny levé komory srdeční, což upozorní na možnost onemocnění. Tyto metody jsou však častěji využívány k vyloučení jiné srdeční patologie [24].
EKG je pro diagnostiku IVNC nespecifické. Křivka může být zcela normální. Často je přítomen blok Tawarova raménka. Z arytmií nalézáme AV blokády různého stupně, fibrilaci síní, běhy nesetrvalé i setrvalé komorové tachykardie [25], nebo může být IVNC diagnostikována na základě vyšetření po resuscitaci pro komorovou fibrilaci jako v případě níže uvedené kazuistiky. Obecně lze říci, že komorové arytmie jako komplikace IVNC jsou přítomny u dospělých. U dětí bývají naproti tomu popisovány spíše supraventrikulární arytmie, specifický pro populaci dětských pacientů je potom syndrom preexcitace [24,36].
Průběh onemocnění
Bhatia et al [25] provedli v roce 2011 metaanalýzu 5 studií [22,37–40] se shodnými či velmi podobnými diagnostickými kritérii provedených mezi léty 1984–2006. Soubor zahrnoval celkem 241 pacientů. Průměrný věk při stanovení diagnózy byl 41 let s 65% podílem mužů. Průměrná doba sledování byla 39 měsíců. V průběhu sledování byla nejčastější příčinou morbidity hospitalizace pro srdeční selhání (38 %). Tromboembolická komplikace byla zaznamenána u 8 % pacientů. Celkový počet případů je však vyšší, neboť někteří pacienti měli tyto komplikace opakovaně. Užívání antikoagulační terapie nebylo ve sledovaných studiích vždy specifikováno.
Celkem 26 % pacientů podstoupilo implantaci ICD z primárně nebo sekundárně preventivních důvodů. U 12 % z nich byla pomocí ICD správně detekována a terminována komorová arytmie. V novějších pracích [41] je adekvátní terapie výbojem ICD uváděna až ve 33 %. Celkem 15 % pacientů ze souboru podstoupilo transplantaci srdce.
Celková mortalita byla 14 %, 7,6 % pacientů zemřelo náhlou srdeční smrtí a 5,2 % zemřelo v důsledku terminálního srdečního selhání. Úmrtí v důsledku systémové embolizace zaznamenáno nebylo, 1 pacient zemřel následkem plicní embolie.
Ve stejném roce publikovali Habib et al multicentrickou studii se 105 pacienty [26]. Střední věk pacientů při stanovení diagnózy byl 45 let, opět s dvoutřetinovou převahou mužů. Výrazně nejčastějším prvním symptomem byla dušnost (78 % pacientů), 17 % pacientů bylo při stanovení diagnózy asymptomatických. Sníženou systolickou funkci levé komory srdeční mělo vstupně dle echokardiografického vyšetření 84 % nemocných, z toho těžkou systolickou dysfunkci 46 % pacientů.
V průběhu sledování (průměrně 2,33 roku) bylo nejčastější komplikací opět srdeční selhání (31 %), tromboembolická nemoc (včetně přítomnosti neembolizujícího trombu v levé komoře) byla zaznamenána v 11 %, závažná komorová arytmie v 7 % případů. ICD byl implantován 28 % pacientů. Mortalita představovala 11 % nemocných, v 8 % případů podstoupili pacienti transplantaci srdce.
Habib et al stanovili rovněž prediktory úmrtí či srdeční transplantace. Jsou mezi nimi srdeční selhání vyšší třídy (NYHA III-IV), vysoké plnící tlaky v levé komoře srdeční a hospitalizace pro srdeční selhání. Rovněž pacienti se vstupně sníženou ejekční frakcí levé komory srdeční měli horší prognózu. Naproti tomu u pacientů, u nichž bylo onemocnění zachyceno náhodně či pomocí screeningu, byla prognóza výrazně lepší.
Terapie
V současné době neexistuje specifická terapie IVNC. Léčebný postup volíme podle komplikujících faktorů. U pacientů se srdečním selháním se terapie řídí obecnými doporučenými postupy [42]. U pacientů s těžkou systolickou dysfunkcí levé komory srdeční je indikována implantace ICD v rámci primární prevence náhlé srdeční smrti. V rámci sekundární prevence je implantace ICD pochopitelně indikována u pacientů s významnou komorovou arytmií. Při současných známkách komorové dyssynchronie je indikovaná biventrikulární kardiostimulace. Farmakoterapie zahrnuje betablokátory, inhibitory ACE, ev. diuretika a antagonistu aldosteronu.
Vzhledem k tromboembolickým komplikacím je indikována rovněž antikoagulační terapie. Její nasazení je doporučeno u pacientů se současně přítomnou fibrilací síní, anamnézou tromboembolického onemocnění, či přítomností trombu v srdečních oddílech. Paušální nasazování antikoagulační terapie u ostatních pacientů s IVNC doporučeno není.
Kazuistika
Závěrem prezentujeme krátkou kazuistiku 50leté ženy anamnesticky bez předchozího kardiálního či jiného interního onemocnění, bez jasných známek srdečního selhávání či jiných kardiálních symptomů v předchorobí. Pacientka byla po kardiopulmonální resuscitaci v terénu pro komorovou fibrilaci přijata za umělé plicní ventilace na koronární jednotku. Vstupně bylo provedeno echokardiografické vyšetření, které prokázalo těžkou systolickou dysfunkci (ejekční frakce 25 %) při difuzní hypokinezi lehce dilatované (58 mm) levé komory srdeční. Při vyšetření byla přítomna výrazná trabekularizace apikálně, laterálně a inferoposteriorně. Pravá komora měla dobrou systolickou funkci (obr. 1 a 2). Známky plicní hypertenze nebyly přítomny. Pro přítomnost kompletního bloku levého Tawarova raménka nejasného stáří byla provedena urgentní koronarografie s normálním nálezem na věnčitých tepnách, při ventrikulografii (obr. 3) byl popsán nehomogenní obraz levé komory srdeční. V souvislosti s uvedenými nálezy byla vyslovena suspekce na izolovanou nonkompaktní kardiomyopatii. Při další echokardiografické kontrole byla aplikována kritéria dle Jenni, která nález splňovala (kritéria dle Stöllbergera aplikována nebyla). Následně byla diagnóza verifikována magnetickou rezonancí (obr. 4–7), která prokázala současné postižení i pravé komory srdeční.
Obr. 1. Parasternální projekce na krátkou osu Patrná je výrazná nonkompaktní část svaloviny spodní a boční stěny. 
Obr. 2. Lehce atypická parasternální projekce na dlouhou osu Zachycena je nonkompaktní svalovina spodní stěny. Obr. 1. a obr. 2. Echokardiografický obraz INVC u 50leté pacientky (kazuistika) 
Image 1. Ventrikulografie zachycující nehomogenní obraz stěn levé komory srdeční 
Image 2. Zobrazení magnetickou rezonancí Rozvláknění spodní stěny po aplikaci kontrastní látky. 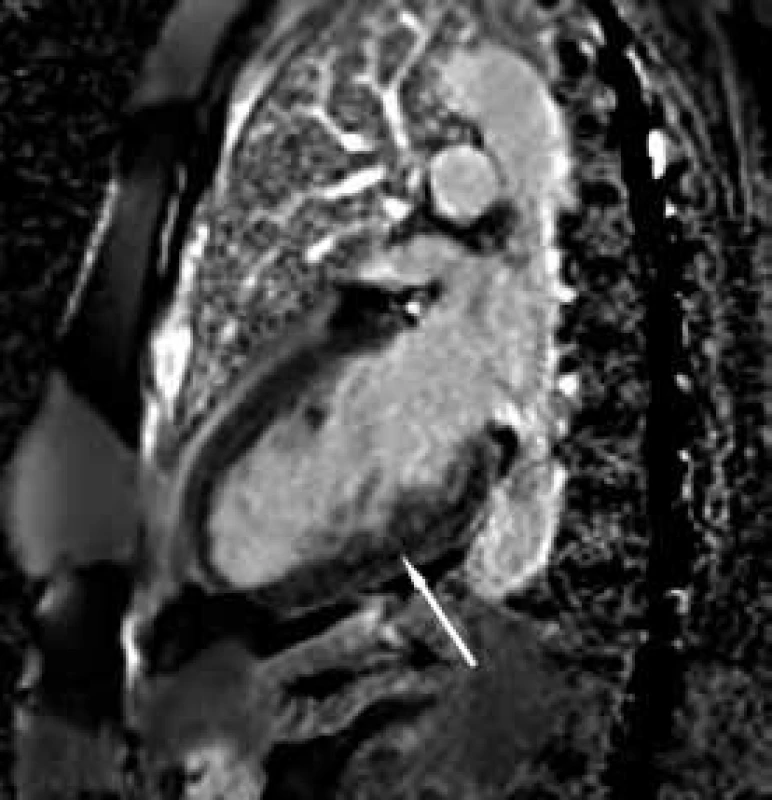
Image 3. Zobrazení magnetickou rezonancí Laterální stěna LK po aplikaci kontrastní látky. 
Image 4. Zobrazení magnetickou rezonancí Laterální stěna LK po aplikaci kontrastní látky. 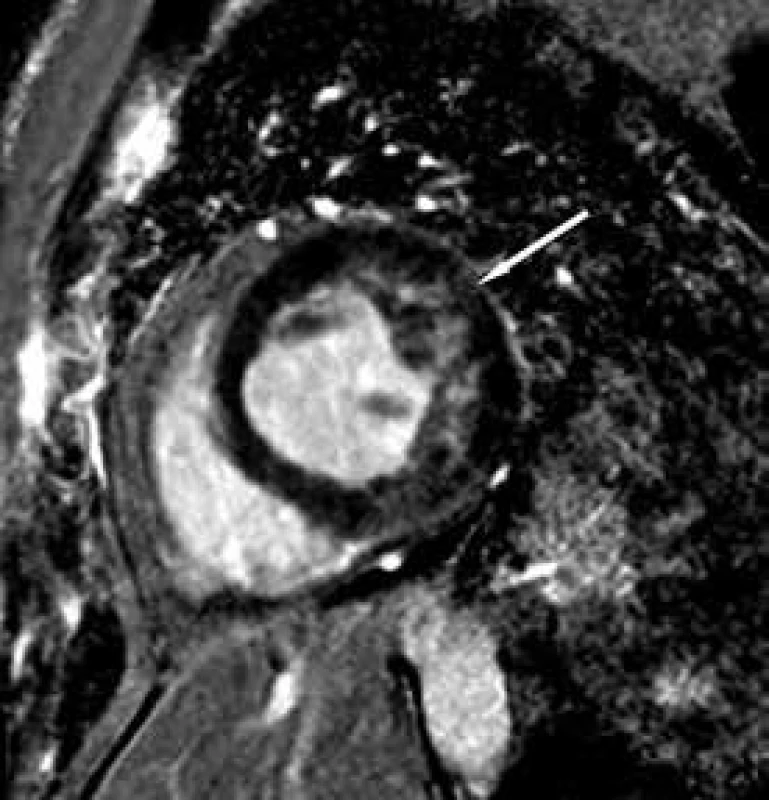
Image 5. Zobrazení magnetickou rezonancí Rozvláknění laterální stěny LK nativní vyšetření. 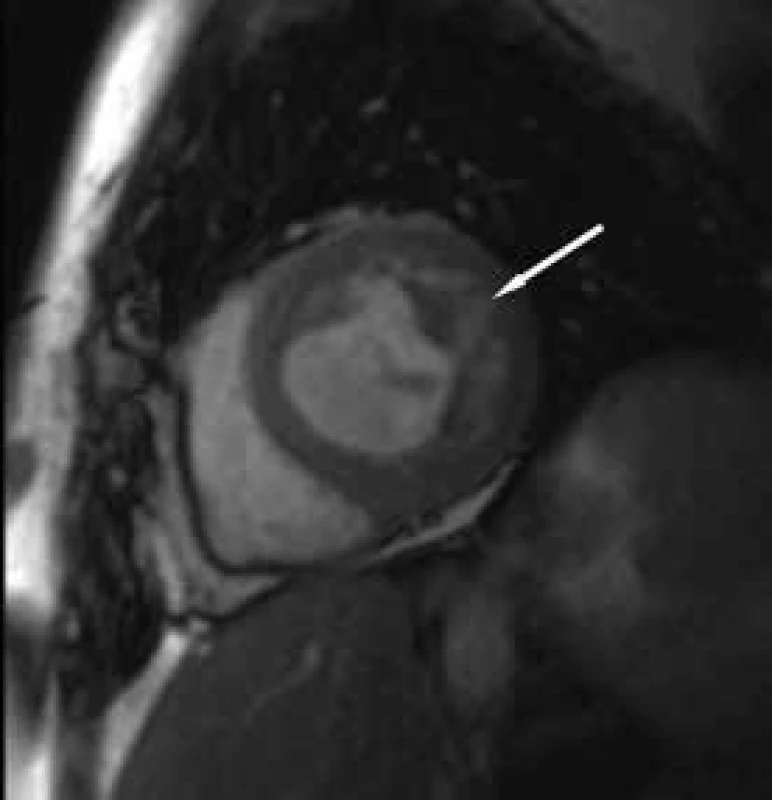
U pacientky byla zahájena terapie srdečního selhání a perorální antikoagulace (metoprolol, spironolakton, furosemid, perindopril, warfarin). Extubace proběhla bez komplikací. Následně byl ze sekundárně preventivních důvodů a při komorové dyssynchronii s blokem levého Tawarova raménka (šíře QRS komplexu 155 ms) implantován ICD s možností biventrikulární stimulace. Výkon byl při zavádění pravokomorové elektrody komplikován 4 recidivami fibrilace komor. Vzhledem k výše popsaným recidivám komorové fibrilace byla dále nasazena antiarytmická terapie amiodaronem. Pacientka byla poté v celkově uspokojivém stavu dimitována. V průběhu tříměsíčního sledování došlo k jedné rehospitalizaci pro inadekvátní výboje ICD při recidivující supraventrikulární tachykardii. Screening rodiny nebyl proveden, neboť jediná žijící příbuzná pacientky 1. stupně byla její 80letá matka.
Závěr
Diagnostika IVNC je zejména vzhledem k nejasnostem v echokardiografickém hodnocení obtížná. Jelikož je však terapie zahajována vždy až při prvních symptomech, neohrožují diagnostické rozpaky asymptomatické pacienty. Nicméně již při podezření by měl být pacient trvale klinicky a echokardiograficky sledován a měl by být proveden screening dle doporučení popsaných výše. U symptomatických pacientů je vzhledem k progresi onemocnění jistě namístě intenzivní terapie srdečního selhání s využitím jak farmakologické a přístrojové terapie, tak eventuální včasné zařazení nemocných na čekací listinu k srdeční transplantaci.
Za poskytnutí snímků magnetické rezonance děkuji MUDr. Daně Kautznerové, Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha, přednosta prof. MUDr. Jan Peregrin, CSc.
MUDr. Karel Vondrák
k.vondrak@gmail.com
III. interní kardiologická klinika FN KV a 3. LF UK, Praha
www.fnkv.cz/iii-interni-kardiologicka-klinika-uvod.php
Doručeno do redakce: 9. 7. 2013
Přijato po recenzi: 13. 9. 2013
Sources
1. Jenni R, Oechslin E, Schneider J et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart 2001; 86(6): 666–671.
2. Dusek J, Ostadal B, Duskova M Postnatal persistence of spongy myocardium with embryonic blood supply. Archives of Pathology 1975; 99(6): 312–317.
3. Engberding R, Bender F. Echocardiographic detection of persistent myocardial sinusoids. Z Kardiol 1984; 73(12): 786–788.
4. Goebel N, Jenni R, Grüntzig AR. Persistierende myokardiale Sinusoide. Rofo1985; 142(6): 692–693.
5. Jenni R, Goebel N, Tartini R et al. Persisting myocardial sinusoids of both ventricles as an isolated anomaly: echocardiographic, angiographic, and pathologic anatomical findings. Cardiovasc Intervent Radiol 1986; 9(3): 127–131.
6. Chin TK, Perloff JK, Williams RG et al. Isolated noncompaction of left ventricular myocardium: a study of eight cases. Circulation 1990; 82(2): 507–513.
7. Ritter M, Oechslin E, Sütsch G et al. Isolated noncompaction of the myocardium in adults. Mayo Clin Proc 1997; 72(1): 26–31.
8. Sedmera D, Pexieder T, Vuillemin M et al. Developmental patterning of the myocardium. Anat Rec. 2000; 258(4): 319–337.
9. Freedom RM, Yoo SJ, Perrin D et al. The morphological spectrum of ventricular noncompaction. Cardiol Young 2005; 15(4): 345–364.
10. Sarma RJ, Chana A, Elkayam U. Left ventricular noncompaction. Prog Cardiovasc Dis 2010; 52(4): 264–273.
11. Bleyl SB, Mumford BR, Brown-Harrison MC et al. Xq28-linked noncompaction of the left ventricular myocardium: prenatal diagnosis and pathologic analysis of affected individuals. Am J Med Genet 1997; 72(3): 257–265.
12. Hoedemaekers YM, Caliskan C, Michels M et al. The importance of genetic counceling, DNA diagnostics and cardiologic family screening in left ventricular noncompaction cardiomyopathy. Circulation Cardiovascular Genetics 2010; 3(3): 232–239.
13. Klaassen S, Probst S, Oechslin E et al. Mutations of sarcomere genes in left ventricular noncompaction. Circulation 2008; 117(22): 2893–2901.
14. Probst S, Oechslin E, Schuler P et al. Sarcomere gene mutations in isolated left ventricular noncompaction cardiomyopathy do not predict clinical phenotype. Circ Cardiovasc Genet 2011; 4(4): 367–374
15. Ichida F, Tsubata S, Bowle KR et al. Novel gene mutations in patients with left ventricular noncompaction and Barth syndrome. Circulation 2001; 103(9): 1256–1263.
16. Vatta M, Mohapatra B, Jimenez S et al. Mutations in cypher/ZASP in patients with dilated cardiomyopathy and left ventricular noncompaction. J Am Coll Cardiol 2003; 42(11): 2014–2027.
17. Kenton AB, Sanchez X, Coveler KJ et al. Isolated left ventricular noncompation is rarely caused by mutations in G4.5, alfa-dystrobrevin and FK binding protein-12. Mol Genet Metab 2004; 82(2): 162–166.
18. Hermida-Prieto M, Monserat L, Castro-Beiras A et al. Familial dilated cardiomyopathy and isolated left ventricular noncompaction associated with lamin A/C gene mutations. Am J Cardiol 2004; 94(1): 50–54.
19. Monserat L, Hermida-Prieto M, Fernandez X et al. Mutation in alfa-cardiac actin gene associated with apical hypertrophic cardiomyopathy, left ventricular non-compaction and septal defects. Eur Heart J 2007; 28(16): 1953–1961.
20. Hoedemaekers YM , Caliskan K, Majoor-Krauker D et al. Cardiac beta-myosin heavy chain defects in two families with noncompaction cardiomyopathy: linking noncompaction to hypertrophic, restrictive and dilated cardio-myopathies. Eur Heart J 2007; 28(22): 2732–2737.
21. Hershberger RE, Lindenfeld J, Nestrkni L et al. Genetic evaluation of cardiomyopathy – a Heart Failure Society of America practice guideline. J Card Fail 2009; 15(2): 83–97.
22. Oechslin EN, Attenhofer J, Rojas JR et al. Long-term follow-up of 34 adults with isolated left ventricular noncompaction: a distinct cardiomyopathy with poor prognosis. J Am Coll Cardiol 2000; 36(2): 493–500.
23. Sandhu R, Finkelhor RS, Gunawardena DR et al. Prevalence and characteristics of left ventricular noncompaction in a community hospital cohort of patients with systolic dysfunction. Echocardiography 2008; 25(1): 8–12.
24. Jenni R, Oechslin EN, van der Loo B. Isolated ventricular non-compaction of the myocardium in adults. Heart 2007; 93(1): 11–15.
25. Bhatia NL, Tajik AJ, Wilansky S et al. Isolated Noncompaction of the Left Ventricular Myocardium in Adults: A Systematic Overview. J Card Fail 2011; 17(9): 771–778.
26. Habib G, Charron P, Eicher JC et al. Isolated left ventricular non-compaction in adults: clinical and echocardiographic features in 105 patients. Results from a French registry. Eur J Heart Fail 2011; 13(2): 177–185.
27. McCaffrey F. Around Pediheart: noncompaction of the left ventricle. Pediatr Cardiol 2001; 22(5): 399.
28. Sato Y, Matsumoto N, Matsuo S et al. Isolated noncompaction of the ventricular myocardium in a 94-year-old patient: depiction at echocardiography and magnetic resonance imaging. Int J Cardiol 2007; 119(1): e32-e34.
29. Finsterer J, Stöllberger C, Blazek G. Neuromuscular implications in left ventricular hypertrabeculation/noncompaction. Int J Cardiol 2006; 110(3): 288–300.
30. Stöllberger C, Winkler-Dworak M, Blazek G et al. Prognosis of left ventricular hypertrabeculation/noncompaction is dependent on cardiac and neuromuscular comorbidity. Int J Cardiol 2007; 121(2): 189–193.
31. Stöllberger C, Finsterer J, Blazek G. Left ventricular hypertrabeculation/noncompaction and association with additional cardiac abnormalities and neuromuscular disorders. Am J Cardiol 2002; 90(8): 899–902.
32. Kohli S, Pantazis A, Shah J et al. Diagnosis of left-ventricular noncompaction in patients with left-ventricular systolic dysfunction: time for a reappraisal of diagnostic criteria? Eur Heart J 2008; 29(1): 89–95.
33. Finsterer J, Stöllberger C. Letter to the Editor: Definite, probable, or possible left ventricular hypertrabeculation/noncompaction. Int J Cardiol 2008; 123 : 175–176.
34. Petersen S, Selvanayagam JB, Wiesmann F et al. Left ventricular noncompaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol 2005; 46(1): 101–105.
35. Jacquier A, Thuny F, Jop B et al. Measurement of trabeculated left ventricular mass using cardiac magnetic resonance imaging in the diagnosis of left ventricular noncompaction. Eur Heart J 2010; 31(9): 1098–1104.
36. Ergul Y, Nisli K, Demirel A et al. Left ventricular non-compaction in children and adolescents: clinical features, treatment and follow-up. Cardiol J 2011; 18(2): 176–184.
37. Aras D, Tufekcioglu O, Ergun K et al. Clinical features of isolated ventricular noncompaction in adults long-term clinical course, echocardiographic properties, and predictors of left ventricular failure. J Card Fail 2006; 12(9): 726–733.
38. Murphy RT, Thaman R, Blanes JG et al. Natural history and familial characteristics of isolated left ventricular non-compaction. Eur Heart J 2005; 26(2): 187–192.
39. Lofiego C, Biagini E, Ferlito M et al. Paradoxical contributions of noncompacted and compacted segments to global left ventricular dysfunction in isolated left ventricular noncompaction. Am J Cardiol 2006; 97(5): 738–741.
40. Stanton C, Bruce C, Connolly H et al. Isolated left ventricular noncompaction syndrome. Am J Cardiol 2009; 104(8): 1135–1138.
41. Kobza R, Steffel J, Erne P et al. Implantable cardioverter-defibrillator and cardiac resynchronizatiopn therapy in patients with left ventricular noncompaction. Heart Rhythm 2010; 7(11): 1545–1549.
42. McMurray JJ, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33(14): 1787–1847.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 2-
All articles in this issue
- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Orální infekce a revmatická onemocnění
- Renální denervace pro léčbu arteriální hypertenze – nezodpovězené otázky
- Léčba Waldenströmovy makroglobulinemie v roce 2013
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
- Izolovaná nonkompaktní kardiomyopatie: souhrnný článek s kazuistickým příkladem
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- Hodnocení diastolické funkce levé komory pomocí radionuklidové ventrikulografie u pacientů s chronickým srdečním selháním a sníženou ejekční frakcí
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

