-
Medical journals
- Career
Terapeutické monitorování vankomycinu v rutinní klinické praxi
Authors: Ivana Kacířová 1,2; Milan Grundmann 1
Authors‘ workplace: Ústav klinické farmakologie LF OU Ostrava, přednosta doc. MUDr. Milan Grundmann, CSc. 1; Oddělení klinické farmakologie Ústavu laboratorní diagnostiky FN Ostrava, primářka MUDr. Ivana Kacířová, Ph. D. 2
Published in: Vnitř Lék 2014; 60(10): 846-851
Category: Reviews
Overview
Terapeutické monitorování hladin léčiv (therapeutic drug monitoring – TDM) je specifická metoda oboru klinické farmakologie pro monitorování terapie pomocí měření koncentrace léčiva v séru s následnou interpretací a akceptací klinikem. Použití TDM vede k optimalizaci individuálního dávkování vankomycinu u jednotlivých pacientů, a tím ke zkrácení doby hospitalizace a prevenci výskytu nežádoucích účinků. Minimální údolní sérová koncentrace vankomycinu by měla být vždy udržována nad 10 mg/l k zabránění vývoje rezistence, neměla by však přesáhnout 20 mg/l vzhledem k riziku nefrotoxicity. U závažných infekcí je doporučováno rozmezí 15–20 mg/l, a také u patogenů s MIC ≤ 1 mg/l by měla údolní koncentrace dosáhnout alespoň 15 mg/l k dosažení cílového poměru AUC24/MIC ≥ 400 (plocha pod křivkou/minimální inhibiční koncentrace). Pro léčbu méně závažných infekčních stavů by měla být dostatečná údolní koncentrace 10–15 mg/l. Při aplikaci v kontinuální infuzi u kriticky nemocných jsou doporučovány koncentrace v ustáleném stavu v rozmezí 15–25 mg/l.
Klíčová slova:
terapeutické monitorování – údolní koncentrace – vankomycinÚvod
Terapeutické monitorování hladin léčiv (therapeutic drug monitoring – TDM) je specifická metoda oboru klinické farmakologie pro monitorování terapie pomocí měření koncentrace léčiva v séru (plazmě, krvi). Jejím základním předpokladem je existence úzkého vztahu mezi koncentrací léčiva a jeho farmakologickým efektem.
Praktické provedení TDM má 3 základní části:
- analýza léčiv podle zásad GLP (good laboratory practice) s použitím různých analytických metod; klinik odebere pacientovi krev a s vyplněnou žádankou posílá materiál k laboratornímu vyšetření
- interpretace stanovené hladiny léčiva s farmakokinetickou analýzou; klinický farmakolog (případně klinický farmaceut) na základě GCP (good clinical practice) doporučí ev. úpravu dávky nebo dávkového intervalu klinikovi
- zpětná vazba s klinikem, která má zásadní význam, poněvadž jeho akceptace doporučení zajistí změnu dávkování, a tím i racionální farmakoterapii.
Použití TDM vede ke snížení množství hospitalizací, zkrácení doby hospitalizace, snížení morbidity a mortality, snížení pracovní neschopnosti, snížení nákladů na zdravotní péči a ke zvýšení kvality života pacienta. TDM je i dobrým ukazatelem interdisciplinární spolupráce 3 různých oborů (analytik, klinický farmakolog nebo farmaceut, klinik). Při nesprávném používání TDM, pokud klinik nevyužije dané doporučení a výsledek založí do chorobopisu, se jedná pouze o „sbírání známek“, dochází ke zbytečným odběrům krve a zvyšování nákladů [1].
Vankomycin
Vankomycin je glykopeptidové baktericidní antibiotikum používané zejména k léčbě meticilin-rezistentních stafylokokových infekcí (MRSA). Kromě úzkého spektra účinku se vyznačuje úzkým terapeutickým rozmezím. Příliš nízká dávka je nejen neúčinná, ale výrazně zvyšuje riziko vzniku rezistence mikroorganizmů vůči antibiotiku. Naopak příliš vysoká dávka může vést k nefrotoxicitě nebo ototoxicitě, zejména v kombinaci s další nefrotoxickou medikací, jako jsou např. aminoglykosidy. Přestože jsou uváděna různá doporučení k úpravě dávkování vankomycinu, široká intraindividuální a interindividuální variabilita farmakokinetiky vankomycinu dokazuje potřebu terapeutického monitorování hladin u každého jednotlivého pacienta [2]. Optimalizace terapie vankomycinem pomocí TDM je proto celosvětově doporučována. Ve skupině pacientů léčených vankomycinem za pomoci TDM byl již také prokázán dosažený vyšší podíl terapeutické úspěšnosti a nižší podíl nefrotoxicity v porovnání se skupinou léčenou bez použití TDM [3].
Podle názoru většiny kliniků má stanovení peakové (horní) koncentrace pouze malý význam vzhledem k farmakodynamickým (časová závislost) a farmakokinetickým (multiexponenciální pokles) vlastnostem vankomycinu. Určitá nejednotnost však panuje v oblasti údolní (minimální) koncentrace. Dřívější doporučované rozmezí 5–10 mg/l bylo založeno na údajích o účinnosti získaných in vitro a předčasných obav z nefrotoxicity. Novější data však svědčí o tom, že nefrotoxicita je při použití vankomycinu v monoterapii výjimečná a že údolní koncentrace ≥ 15 mg/l mohou být bezpečné a dokonce žádoucí. Naopak, údolní koncentrace 5–10 mg/l mohou být nedostatečné k dosažení adekvátní penetrace vankomycinu do cílových tkání a k usmrcení více odolných druhů, a proto by mohlo dojít k selhání léčby u infekcí způsobených MRSA kmeny, které vykazují heterorezistenci ke glykopeptidům [4].
Vankomycin a Staphylococcus aureus
Co se týká účinku vankomycinu proti Staphylococcus aureus, je jako nejvhodnější ukazatel účinnosti v léčbě MRSA infekce u dospělých uváděn poměr AUC24 (plocha pod křivkou za 24 hod) a minimální inhibiční koncentrace (MIC), tj. AUC24/MIC [5]. Na základě údajů získaných in vitro ze zvířecích a omezených lidských modelů byl zaveden jako farmakokineticko-farmakodynamický cíl AUC24/MIC ≥ 400. K dosažení této hodnoty jsou vyžadovány vyšší dávky a vyšší údolní sérová koncentrace vankomycinu. Přestože je podávání vankomycinu spojeno s některými nežádoucími účinky, převáží potenciální přínos vyšších dávek riziko těchto převážně reverzibilních nežádoucích účinků [6]. V běžné klinické praxi není rutinní stanovení AUC doporučováno, jako náhrada se používá stanovení údolní koncentrace [7]. To je významné zejména při léčbě MRSA kmenů, u kterých se MIC pohybuje v rozmezí 0,25–2 mg/l [8]. Patel et al [9] uvádějí, že v případě dosažení údolní koncentrace vankomycinu v rozmezí 15–20 mg/l byla pozorována pravděpodobnost dosažení poměru AUC24/MIC ≥ 400 ve 100 % případů při MIC 0,5 a 1 mg/l. Jestliže byla tato analýza omezena na pacienty s údolní koncentrací 10–15 mg/l, pak byla pozorovaná pravděpodobnost dosažení cílové hodnoty ve 100 % případů pouze u MIC 0,5 mg/l a variabilní u simulovaného režimu při MIC 1 mg/l. Z toho vyplývá, že údolní koncentrace vankomycinu v rozmezí 10–15 mg/l při MIC 1 mg/l dostatečně nezajistí žádaný poměr AUC24/MIC ≥ 400. V nedávné době publikovaná práce uvádí, že u pacientů s MRSA bakteremií a údolní koncentrací vankomycinu < 10 mg/l je 16krát větší pravděpodobnost nedostatečného klinického výsledku léčby [10]. Bylo také prokázáno, že expozice Staphyloccocus aureus údolním sérovým koncentracím < 10 mg/l může vést k produkci kmenů, které mají podobné vlastnosti jako VISA (vancomycin-intermediately susceptible Staphylococcus aureus). Proto je doporučováno, aby údolní sérová koncentrace vankomycinu byla vždy udržována ≥ 10 mg/l ke zlepšení klinického výsledku léčby MRSA infekce a k zabránění vývoje rezistence. Údolní koncentrace > 20 mg/l by neměla být dosažena vzhledem k riziku nefrotoxicity [6,7,11]. K potenciálnímu zlepšení penetrace do cílových tkání, ke zvýšení pravděpodobnosti dosažení optimální cílové sérové koncentrace a ke zlepšení klinického výsledku léčby komplikovaných infekcí byla proto doporučena údolní koncentrace vankomycinu 15–20 mg/l v případě závažných infekcí, jako je sepse, infekční endokarditida, osteomyelitida, meningitida, nozokomiální pneumonie způsobená Staphylococcus aureus a závažné MRSA infekce kůže a měkkých tkání [6,12]. Údolní koncentrace v tomto rozmezí by měly u většiny pacientů zajistit AUC24/MIC ≥ 400 při MIC ≤ 1 mg/l. Při MIC ≤ 2 mg/l stanovuje pokračování terapie vankomycinem reakce pacienta, v případě kladné klinické a mikrobiologické odezvy se může v terapii vankomycinem pokračovat s pečlivou monitorací klinického stavu. Jestliže klinická nebo mikrobiologická odezva není uspokojivá i přes adekvátní vyčištění rány a odstranění jiného zdroje infekce, je doporučena změna terapie. V případě MIC > 2 mg/l (např. vancomycin-intermediate Staphyloccocus aureus [VISA] nebo vancomycin-resistant Staphyloccus aureus [VRSA]) by mělo být rovnou nasazeno alternativní antibiotikum [12], protože cílový poměr AUC24/MIC ≥ 400 nemůže být s konvenčním dávkováním vankomycinu u pacientů s normální renální funkcí dosažen. Pokud je vankomycin aplikován v kontinuální infuzi, cílové průměrné koncentrace v ustáleném stavu (steady-state) by měly dosahovat hodnot 15–25 mg/l [4].
Využití TDM k úpravě dávkování vankomycinu
Nutno podotknout, že dostupné nomogramy k úpravě dávkování vankomycinu nezaručují dosažení těchto cílových hodnot. Doporučována je individuální farmakokinetická úprava a ověření dosažení cílové sérové koncentrace pomocí terapeutického monitorování [6]. TDM by mělo být prováděno v případě předpokládané aplikace vankomycinu déle než 3 dny, v případě užití intenzivního dávkování, při vysokém riziku nefrotoxicity, u závažných infekcí, nestabilních (zhoršujících nebo zlepšujících se) renálních funkcí, hemodialýzy, obezity, nízké tělesné hmotnosti a za zvláštních podmínek způsobujících kolísání distribučního objemu. Vzhledem k tomu, že vankomycin je indikován při léčbě těžkých, potenciálně život ohrožujících infekcích trvajících déle než 3 dny u pacientů, jejichž zdravotní stav je často ovlivněn dalšími komplikacemi, nelze než doporučit monitorování hladin u každého pacienta. Vzorek pro údolní koncentraci by měl být odebrán během 30 min před aplikací dávky, případná peaková (horní) koncentrace by měla být stanovena po dokončení tkáňové distribuce a vzorek by měl být odebrán 1–2 hodiny po ukončení infuze z jiného místa než byla infuze aplikována [7]. Sérová koncentrace po podání jen zřídka dosahuje koncentrací spojených s toxicitou [6], její stanovení je však doporučováno v případě farmakokinetického modelování [13]. V současnosti není shoda v tom, zda monitorování z důvodu ototoxicity je schopno předcházet výskytu tohoto nežádoucího účinku. Mělo by však být zvažováno v případě současného užívání dalších ototoxických léčiv, jako jsou aminoglykosidy [7].
Terapeutické rozmezí vankomycinu
Údolní koncentrace by měla být stanovena dle amerických guidelines před další dávkou při dosažení ustáleného stavu (přibližně po 4. dávce), dle australských doporučení by měl být odběr proveden již po 1. dávce (v případě glomerulární filtrace < 10 ml/min až za 48 hod po 1. dávce) [6,11]. V současnosti se však stále více ukazuje potřeba dosažení terapeutických koncentrací vankomycinu v co nejkratší době po nasazení ke zvýšení pravděpodobnosti účinnosti léčby, zejména u kriticky nemocných pacientů. Z tohoto důvodu je navrhováno použití vyšší úvodní dávky [14] a stanovení hladiny vankomycinu již krátce po 1. dávce [15]. U pacientů s uspokojivou klinickou odezvou, stabilními renálními funkcemi a údolní koncentrací v požadovaném terapeutickém rozmezí není potřeba dále opakovat monitorování častěji než 2krát týdně. Častější frekvence nebo i každodenní monitorace je vhodná u pacientů hemodynamicky nestabilních, s proměnlivou renální funkcí, dialyzovaných nebo s nedostatečnou klinickou odezvou [11,15–17]. Nejvýznamnějším ukazatelem clearance vankomycinu je glomerulární filtrace a z tohoto důvodu by změny hodnot sérového kreatininu měly být indikací k monitoraci hladin vankomycinu vedoucí k případné úpravě dávkování [11].
Souhrnem lze říci, že současná doporučení navrhují cílovou údolní koncentraci vankomycinu v rozmezí 15–20 mg/l jako indikátor účinnosti v léčbě závažných grampozitivních infekcí, pro léčbu méně závažných infekčních stavů (infekce močového ústrojí, mírné až středně závažné infekce kůže nebo měkkých tkání) je dostatečná údolní koncentrace 10–15 mg/l s menším rizikem nefrotoxicity, která je závislá na dosažené údolní koncentraci. Tyto údaje podporují pečlivé terapeutické monitorování koncentrací vankomycinu a také monitorování renálních funkcí, zejména při koncentracích 15–20 mg/l [18].
Image 1. Doporučení zvýšení dávky 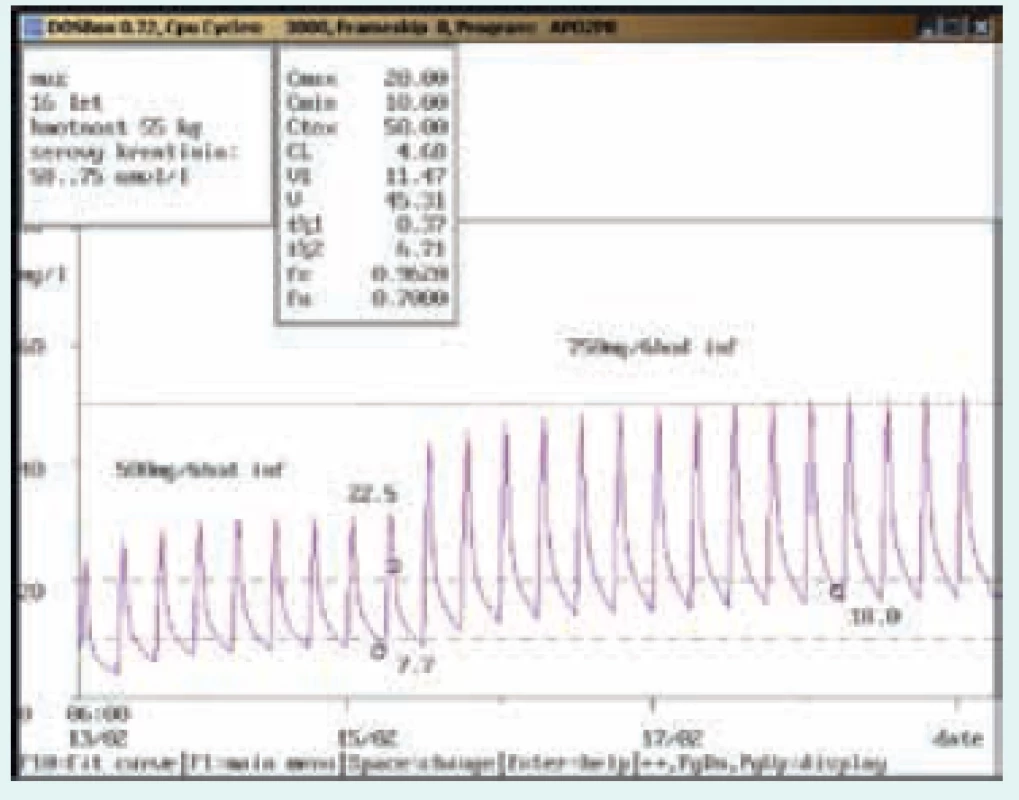
16letý muž, 55 kg, vstupní sérový kreatinin 58 μmol/l. Diagnóza: febrilní neutropenie; při dávce 500 mg/6 hod v infúzi byla údolní koncentrace pod dolní hranicí terapeutického rozmezí (7,7 mg/l), po navýšení na 750 mg/6 hod v infúzi dosáhla terapeutického rozmezí (18,0 mg/l). Image 2. Doporučení snížení dávky 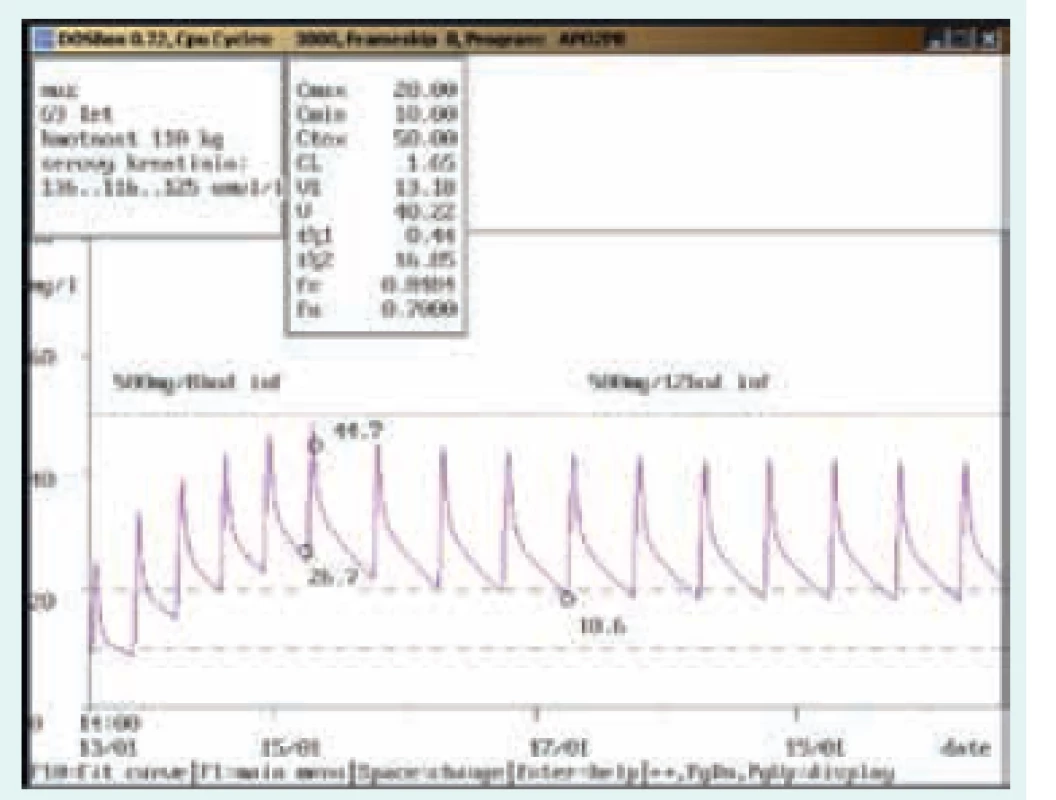
69letý muž, 110 kg, vstupní sérový kreatinin 136 μmol/l. Diagnóza: bronchopneumonie; při dávce 500 mg/8 hod v infuzi 3. den po nasazení naměřena údolní koncentrace nad horní hranicí terapeutického rozmezí (26,7 mg/l), po snížení na 500 mg/12 hod v infuzi došlo k adekvátnímu poklesu (18,6 mg/l). Image 3. Doporučení přechodného vysazení a následného snížení dávky 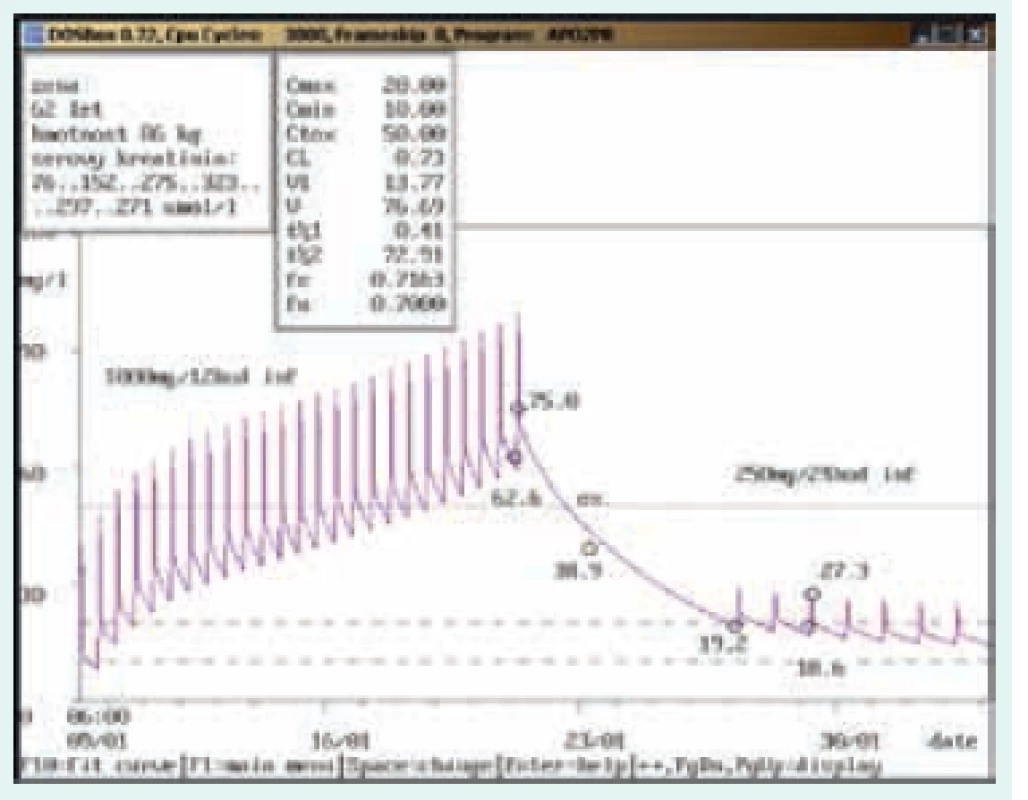
62letá žena, 86 kg, vstupní sérový kreatinin 76 μmol/l. Diagnóza: infekční endokarditida; po nasazení v dávce 1 000 mg/12 hod v infuzi byla 1. kontrola provedena až 13. den, kdy došlo k dosažení údolní koncentrace 62,6 mg/l a současně k nárůstu sérového kreatininu na 323 μmol/l. Po 6denním vysazení dosáhla údolní koncentrace terapeutického rozmezí (19,2 mg/l) a po nasazení v dávce 250 mg/24 hod v infuzi byla kontrolní hladina naměřena v terapeutickém rozmezí (18,6 mg/l), současně docházelo k postupnému snižování sérového kreatininu. Potřeba terapeutického monitorování hladin je uváděna také v Souhrnu údajů o přípravku (SPC) Státního ústavu pro kontrolu léčiv (SÚKL) ČR u jednotlivých přípravků obsahujících vankomycin u různých výrobců různě [19], jak citujeme níže:
- SPC výrobce 1. „Je třeba pravidelně monitorovat hladiny vankomycinu v séru a dodržovat tyto hodnoty: Cmax 30–40 mg/l; Cmin 5–10 mg/l; Css (průměrná hladina v krvi za rovnovážného stavu) 15 mg/l.“
- SPC výrobce 2. „Spodní koncentrace měřené okamžitě před další dávkou mají být 5–10 mg/l. Ototoxicita se vyskytuje při hladinách léku v séru 80–100 mg/l, vyskytuje se však zřídka, pokud jsou hladiny v séru udržovány na hodnotě 30 mg/l nebo nižší.“
- SPC výrobce 3. „Koncentrace vankomycinu v séru se má sledovat od 2. dne léčby bezprostředně před podáním příští dávky a 1 hod po infuzi. Terapeutické hladiny vankomycinu v krvi mají být 1 hodinu po ukončení infuze 30–40 mg/l (maximum 50 mg/l), minimální hladina (krátce před dalším podáním) v rozmezí 5–10 mg/l nebo podle národních doporučení. Normálně mají být koncentrace sledovány 2krát nebo 3krát týdně.“
Obr. 4.1. Navýšení dávky při aplikaci v kontinuální infuzi 
48letý muž, 70 kg, vstupní sérový kreatinin 58 μmol/l. Diagnóza: popáleniny 2.–3. stupně na 37 % těla se šokovým stavem a následnou oboustrannou bronchopneumonií; nasazen vankomycin 2 000 mg/24 hod v kontinuální infuzi, s údolní koncentrací v ustáleném stavu pod dolní hranicí terapeutického rozmezí (9,6 mg/l), po úpravě na 4 500 mg/24 hod v kontinuální infuzi dosaženo optimální koncentrace (20,2 mg/l). Obr. 4.2. Navýšení dávky při aplikaci v kontinuální infuzi 
55letá žena, 70 kg, vstupní sérový kreatinin 38 μmol/l. Diagnóza: popáleniny 2.–3. stupně na 41 % těla se šokovým stavem a následnou sepsí; nasazen vankomycin 1 000 mg/24 hod v kontinuální infuzi, s údolní koncentrací v ustáleném stavu pod dolní hranicí terapeutického rozmezí (5,3 mg/l), po úpravě na 2 500 mg/24 hod v kontinuální infuzi dosaženo optimální koncentrace (19,8 mg/l); případ je velice obdobný jako na obr. 4.1, přesto však k dosažení téměř shodné koncentrace je zapotřebí rozdílných dávek (4 500 mg/24 hod vs 2 500 mg/24 hod). Protože se liší terapeutická rozmezí uváděná v odborných světových periodicích a v SPC (v nichž jsou výrazně nižší), upravili jsme na našem pracovišti (Oddělení klinické farmakologie FN Ostrava) terapeutická rozmezí nově doporučovanými vyššími hodnotami:
- před podáním: 10–15 mg/l (15–20 mg/l v případě závažné infekce)
- po podání: ≤ 50 mg/l
- při aplikaci v kontinuální infuzi: 15–20 mg/l (20–25 mg/l v případě závažné infekce)
Nástrojem ke zjištění adekvátní dávky vankomycinu a vodítkem v TDM je vhodný software pro farmakokinetické modelování využívající Bayesianský algoritmus, který zahrnuje jak populační farmakokinetické parametry, tak vlastní pacientská data k individualizaci dávkového doporučení [20]. Zde není třeba čekat na dosažení ustáleného stavu a odběr s interpretací lze provést i po 1. dávce, což je výhodné zejména u kriticky nemocných nebo akutně dialyzovaných pacientů [15–17]. Pro správnou interpretaci naměřených hladin vankomycinu potřebujeme vyplněnou specializovanou žádanku a vhodný počítačový program pro farmakokinetickou analýzu. Používají se různé software, v ČR je nejužívanější MW-Pharm 3.30 a vyšší. Žádanka by měla obsahovat tyto údaje: dávková anamnéza, trvání terapie, čas podání a časy odběrů, pacientův stav (věk, váha, výška, renální funkce) a celková léková anamnéza. Vzhledem k tomu, že se koncentrace vankomycinu v krvi po aplikaci mění v souvislosti s časem, který uplyne od jeho podání, je nezbytné na žádanku uvádět skutečné odběrové časy pro možnost správné interpretace výsledných koncentrací. Pokud je odběr proveden i mimo doporučované odběrové časy a je na žádance správně uveden, software provede farmakokinetickou analýzu a umožní nalézt optimální dávkování. Odběry nesmí být provedeny ze stejného místa, v němž byl vankomycin aplikován (zejména u centrálního žilního katétru), protože u takto chybného odběru jsou naměřené koncentrace falešně vysoké a nehodnotitelné.
Image 4. Úprava dávkování při chronické dialýze 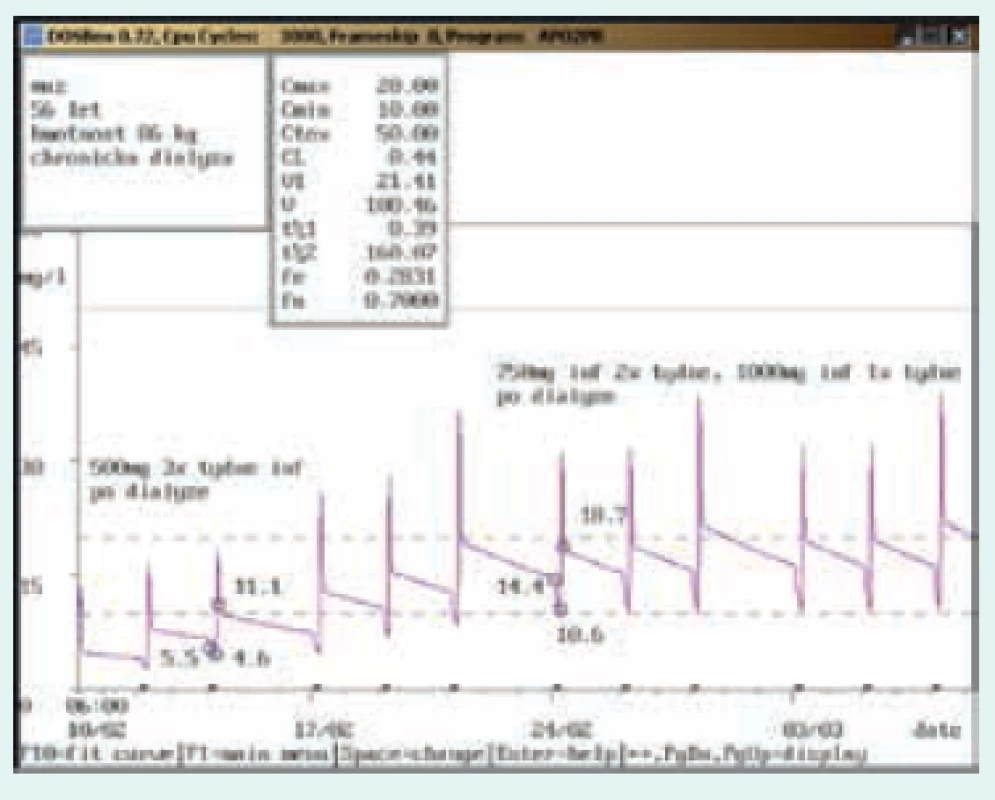
56letý muž, 86 kg, chronická dialýza 3krát týdně. Diagnóza: sepse; při dávkování 500 mg 3krát týdně infuzně dosahovala koncentrace před dialýzou hodnot pod dolní hranicí terapeutického rozmezí (5,5 mg/l), po úpravě na 750 mg infuzně 2krát týdně a 1 000 mg infuzně 1krát týdně (před delší pauzou) byla stanovena koncentrace před dialýzou v terapeutickém rozmezí (14,4 mg/l). Image 5. Úprava dávkování při použití kontinuální venovenózní hemofiltrace (CVVH) 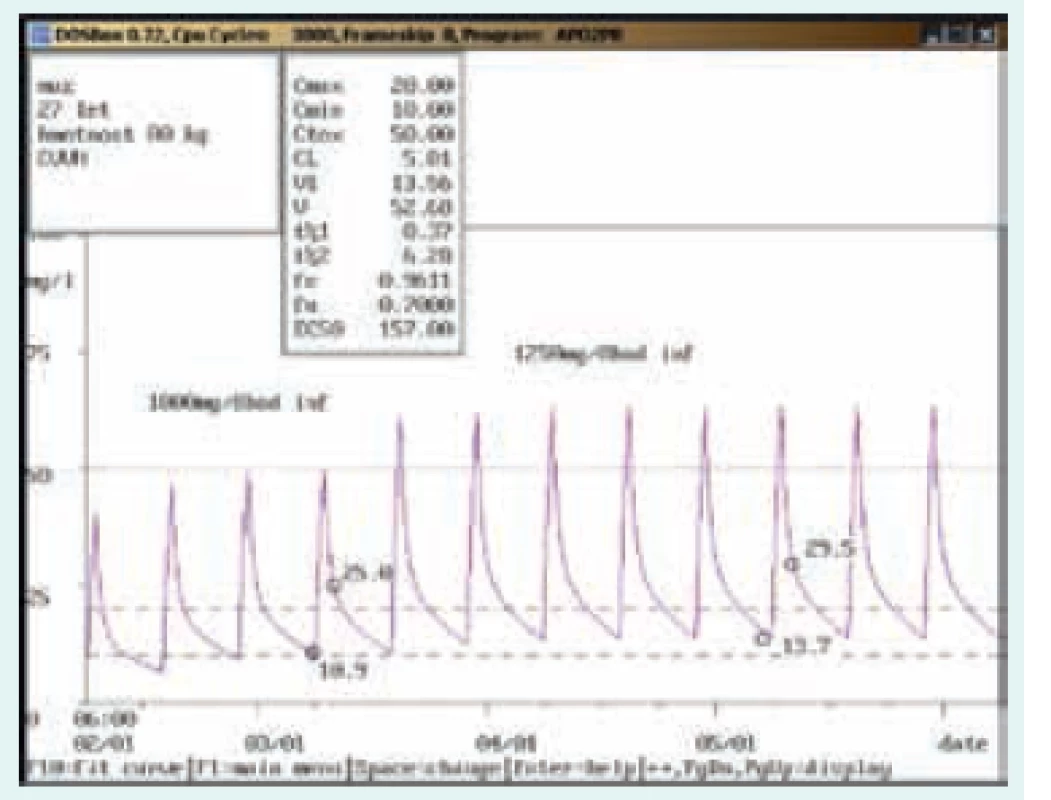
27letý muž, 80 kg. Diagnóza: infekční endokarditida, bronchopneumonie, multiorgánové selhání s aplikací CVVH; při aplikaci 1 000 mg/8 hod v infuzi dosahovala údolní koncentrace dolní hranice terapeutického rozmezí (10,9 mg/l), vzhledem k závažnosti klinického stavu byla dávka zvýšena na 1 250 mg/8 hod v infuzi. Kontrolní odběr ukázal dosažení údolní koncentrace v terapeutickém rozmezí (lehce pod dolní hranicí požadovaného optima pro závažné infekce 15–20 mg/l), vzhledem k postupné úpravě zánětlivých parametrů již byla dávka ponechána. Dávkování je zde při akutním multiorgánovém selhání s použitím CVVH zcela odlišné než při chronickém renálním selhání s pravidelnou chronickou dialýzou (obr. 5). Na obr. 1–8 prezentujeme některé případy z rutinní praxe Oddělení klinické farmakologie FN Ostrava, kde je vankomycin měřen fluorescenční polarizační imunoanalýzou (FPIA) a dávka upravována pomocí farmakokinetického programu MW-Pharm, verze 3.30 (obr. 1–8).
Image 6. Chybně provedený odběr 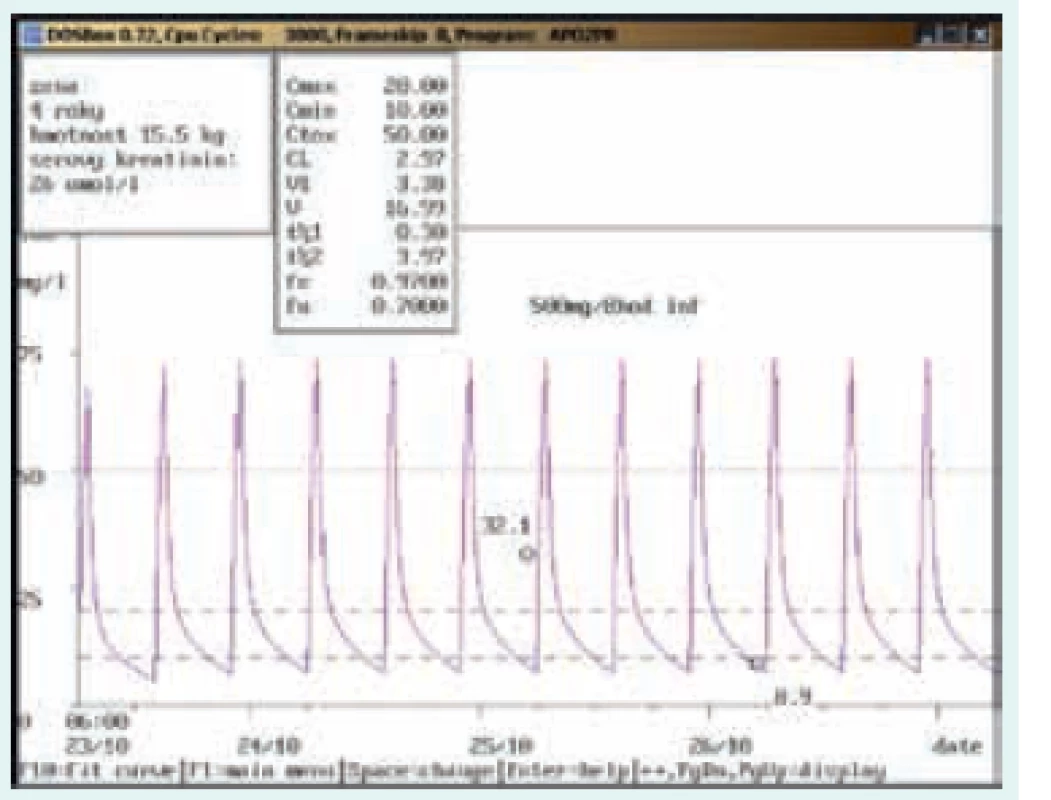
4letá dívka, 15,5 kg, vstupní sérový kreatinin 26 μmol/l. Diagnóza: katétrová sepse; při dávce 500 mg/8 hod v infuzi stanovena údolní koncentrace vysoce nad terapeutickým rozmezím (32,1 mg/l), odběr však zřejmě proveden z kanyly zavedené do periferní žíly, kde byl vankomycin také aplikován. Kontrolní odběr další den z jiného odběrového místa ve stejný odběrový čas prokázal nadhodnocení při nesprávně provedeném odběru (údolní koncentrace 8,9 mg/l). Image 7. Neakceptování doporučení klinického farmakologa ošetřujícím lékařem 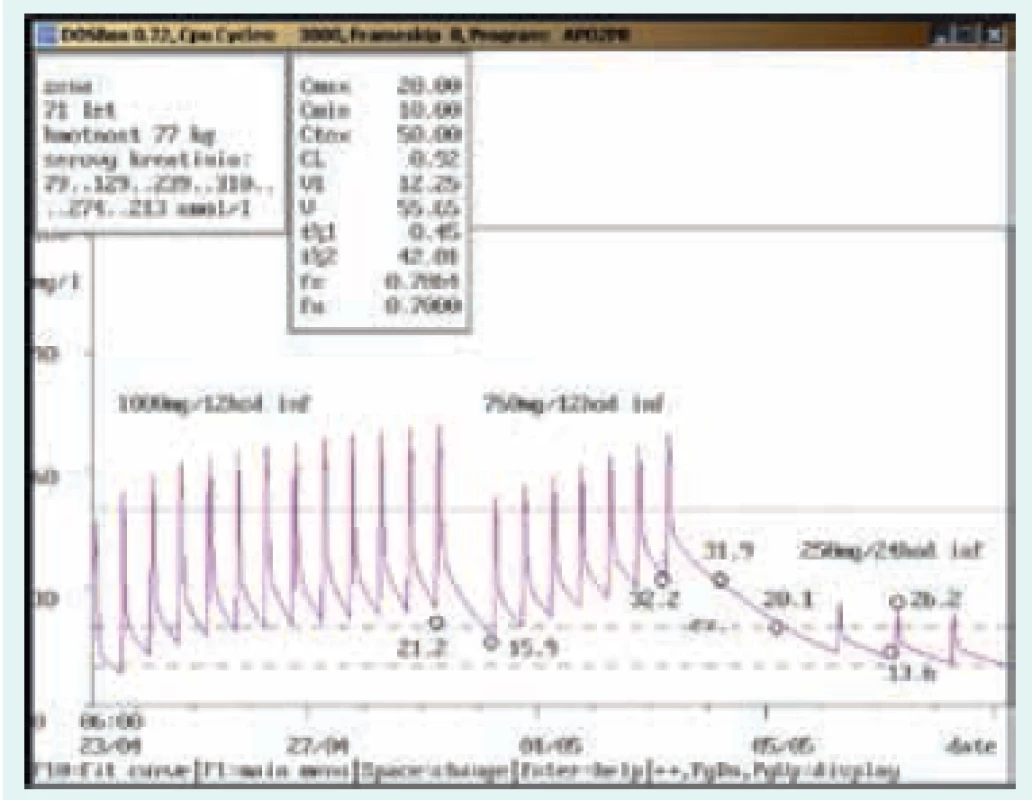
71letá žena, 77 kg, vstupní kreatinin 79 μmol/l. Diagnóza: infekční endokarditida; po nasazení v dávce 1 000 mg/12 hod v infuzi byl 1. odběr proveden až po týdenní aplikaci s naměřenou údolní koncentrací nad terapeutickým rozmezím (21,2 mg/l) a s elevací sérového kreatininu, doporučeno proto snížení dávky na 750 mg/24 hod v infuzi, toto doporučení však nebylo akceptováno a byla aplikována dávka dvojnásobná, tj. 750 mg/12 hod infuzi. Při další kontrole dosáhla údolní koncentrace hodnoty 32,2 mg/l, vankomycin byl na 3 dny vysazen a dále snížen na 250 mg/24 hod v infuzi s následnou údolní koncentrací v terapeutickém rozmezí (13,6 mg/l). Sérový kreatinin po dosažení hodnoty 310 μmol/l pomalu klesal. Závěr
Minimální údolní sérová koncentrace vankomycinu by měla být vždy udržována nad 10 mg/l, neměla by však přesáhnout 20 mg/l. U závažných infekcí je doporučováno rozmezí 15–20 mg/l, a také u patogenů s MIC ≤1 mg/l by měla údolní koncentrace dosáhnout alespoň 15 mg/l k dosažení cílového poměru AUC24/MIC ≥ 400. Pro léčbu méně závažných infekčních stavů by však měla být dostatečná údolní koncentrace nižší (10–15 mg/l). Při aplikaci v kontinuální infuzi jsou doporučovány koncentrace v ustáleném stavu v rozmezí 15–25 mg/l. Zásadní pro dosažení cílových hladin a optimální úpravu dávkování u individuálního pacienta je správně prováděné terapeutické monitorování hladin vankomycinu s erudovanou interpretací naměřených koncentrací pomocí vhodného software, který umožní adekvátní úpravu dávkování již po 1. dávce bez čekání na ustálený stav zejména u kriticky nemocných, spolu s pravidelnou monitorací renálních funkcí.
MUDr. Ivana Kacířová, Ph.D.
ivana.kacirova@fno.cz
Oddělení klinické farmakologie Ústavu laboratorní diagnostiky FN, Ostrava
www.fno.cz/oddeleni-klinicke-farmakologie
Doručeno do redakce 7. 5. 2014
Přijato po recenzi 17. 6. 2014
Sources
1. Grundmann M, Kacířová. Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv. Čas Lék Čes 2010; 149(10): 482–487.
2. Thomson AH, Staatz CE, Tobin CM et al. Development and evaluation of vancomycin dosage guidelines designed to achieve new target concentrations. J Antimicrob Chemother 2009; 63(5): 1050–1057.
3. Ye ZK, Tang HL, Zhai SD. Benefits of therapeutic drug monitoring of vancomycin: a systematic review and meta-analysis. PLoS One 2013; 8(10): e77169. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0077169>.
4. Helgason KO, Thomson AH, Ferguson C A review of vancomycin therapeutic drug monitoring recommendations in Scotland. J Antimicrob Chemother 2008; 61(6): 1398–1399.
5. Moise-Broder PA, Forrest A, Birmingham MC et al. Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections. Clin Pharmacokinet 2004; 43(13): 925–942.
6. Rybak MJ, Lomaestro BM, Rotschafer JC et al. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the infectious diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis 2009; 49(3): 325–327.
7. Matsumoto K, Takesue Y, Ohmagari N et al. Practice guidelines for therapeutic drug monitoring of vancomycin: a consensus review of the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring. J Infect Chemother 2013; 19(3): 365–380.
8. McKenzie C. Antibiotic dosing in critical illness. J Antimicrob Chemother 2011; 66(Suppl 2): ii25-ii31.
9. Patel N, Pai MP, Rodvold KA et al. Vancomycin: we can’t get there from here. Clin Infect Dis 2011; 52 : 969–974.
10. Albur MS, Bowker K, Weir I et al. Factors influencing the clinical outcome of methicillin-resistant Staphylococcus aureus bacteraemia. Eur J Clin Microbiol Infect Dis 2012; 31(3): 295–301.
11. Martin JH, Norris R, Barras M et al. Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists. Clin Biochem Rev 2010; 31(1): 21–24.
12. Liu C, Bayer A, Cosgrove SE et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: Executive summary. Clin Infect Dis 2011; 52(3): 285–292.
13. Begg EJ, Barclay ML, Kirkpatrick CM. The therapeutic monitoring of antimicrobial agents. Br J Clin Pharmacol 2001; 52(Suppl 1): 35S-43S.
14. Li J, Udy AA, Kirkpatrick CM et al. Improving vancomycin prescription in critical illness through a drug use evaluation process: a weight-based dosing intervention study. Int J Antimicrob Agents 2012; 39(1): 69–72.
15. Petejová N, Martínek A, Zahálková J et al. Vancomycin pharmacokinetics during high-volume continuous venovenous hemofiltration in critically ill septic patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2014; 158(1): 65–72.
16. Petejová N, Martínek A, Zahálková J et al. Vancomycin removal during low-flux and high-flux extended daily hemodialysis in critically ill septic patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2012; 156(4): 342–347.
17. Petejová N, Martínek A, Zahálková J et al. Vliv kontinuální a intermitentní náhrady renálních funkcí na antibiotickou léčbu u kriticky nemocných v sepsi – praktický pohled na léčbu vankomycinem a gentamicinem. Vnitř Lék 2012; 58(6): 448–454.
18. Horey A, Mergenhagen KA, Mattappallil A. The Relationship of nephrotoxicity to vancomycin trough serum concentrations in a veteran's population: a retrospective analysis. Ann Pharmacother 2012; 46(11): 1477–1483.
19. Státní ústav pro kontrolu léčiv (SÚKL). Dostupné z WWW: <http://www.sukl.cz>.
20. Nunn MO, Corallo CE, Aubron C et al. Vancomycin dosing: assessment of time to therapeutic concentration and predictive accuracy of pharmacokinetic modeling software. Ann Pharmacother 2011; 45(6): 757–763.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 10-
All articles in this issue
- Infekční endokarditidy v okrese Tábor v letech 2009–2013
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let
- Uživatelské výstupy z národního registru katetrových implantací aortální chlopně (Czech TAVI Registry): možnosti analytických výstupů založených na databázovém systému TrialDB2
- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Plicní hypertenze – patofyziologické mechanizmy
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Asociace aterotrombózy a trombofilie – genetické aspekty
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Dna a kardiovaskulární riziko
- Jak se mění možnosti léčby obézních diabetiků 2. typu
- Léčba bortezomibem u pacientů s onemocněním z depozice lehkých řetězců imunoglobulinu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Dna a kardiovaskulární riziko
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

