-
Medical journals
- Career
Současný pohled na dnu, její diagnostiku a léčbu
Authors: P. Němec
Authors‘ workplace: Revmatologická ambulance II. interní kliniky Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc.
Published in: Vnitř Lék 2012; 58(12): 928-937
Category: Review
Overview
Dna představuje heterogenní skupinu metabolických onemocnění, pro kterou je charakteristická tvorba a ukládání depozit krystalů natrium urátu v různých tkáních. Jako dnavá artritida je označován klinický revmatologický syndrom, který vzniká u jedinců s hyperurikemií a představuje zánětlivé postižení pohybového aparátu spojené s přítomností krystalů natrium urátu. Hyperurikemie, tedy patologické zvýšení hladiny kyseliny močové v séru, představuje nejvýznamnější rizikový faktor pro vznik dnavé artritidy. Příčinou hyperurikemie může být zvýšená produkce kyseliny močové a/nebo její snížené vylučování z organizmu. Časnou manifestací dnavé artritidy je akutní dnavá artritida. Pokud dojde z důvodu depozice krystalů natrium urátu v tkáních k destrukci struktur pohybového aparátu, označujeme tento stav jako chronickou tofózní dnavou artritidu. Nezbytnou podmínkou pro úspěšnou léčbu chronické tofózní dny je udržení hladiny kyseliny močové v séru pod hodnotou 360 μmol/l, rozpuštění usazenin natrium urátu v tkáních a zabránění jejich tvorbě. V léčbě chronické hyperurikemie se kromě nefarmakologických opatření používají i léky snižující hladinu kyseliny močové, zejména inhibitory enzymu xantinoxidáza nebo urikosurika. Hyperurikemie je významným rizikovým faktorem nejen pro rozvoj chronické tofózní dny a poškození ledvin, ale některá data hovoří o riziku ve vztahu ke kardiovaskulárním onemocněním.
Klíčová slova:
dna – hyperurikemie – kyselina močová – terapieÚvod
Dna představuje heterogenní skupinu metabolických onemocnění, pro kterou je charakteristická tvorba a ukládání depozit krystalů natrium urátu v různých tkáních. Jako dnavou artritidu označujeme klinický revmatologický syndrom, který vzniká u jedinců s hyperurikemií a představuje zánětlivé postižení pohybového aparátu spojené s přítomností krystalů natrium urátu. Hyperurikemie je patologické zvýšení hladiny kyseliny močové v séru.
Dnavou artritidou trpí až 5 milionů obyvatel Evropské unie a přibližně 8,3 milionu obyvatel Spojených států amerických. Dnavá artritida je nejčastější artritidou mužů starších 40 let a postihuje přibližně 1–2 % dospělých ve vyspělých zemích [1–4]. Přitom dostupná data naznačují, že incidence dnavé artritidy narostla od 70. let minulého století více než dvojnásobně [5]. Jako nejčastější faktory vedoucí k nárůstu výskytu dnavé artritidy bývají uváděny vyšší průměrný věk, častější onemocnění ledvin, narůstající prevalence obezity, změna stravovacích návyků nebo extenzivní používání některých léků (diuretik). Muži bývají dnavou artritidou postiženi 4–9krát častěji než ženy. Avšak v kategorii osob starších 65 let může být poměr postižených žen a mužů téměř vyrovnaný. Prevalence onemocnění narůstá s věkem, např. ve Velké Británii trpí dnavou artritidou přes 7 % mužů starších 65 let a téměř 3 % žen starších 85 let [2]. I přes poměrně jasný klinický obraz onemocnění a rozšiřující se znalosti o patogenezi onemocnění bývá dnavá artritida často diagnostikována chybně nebo pozdě v průběhu onemocnění a léčba často nebývá vedená optimálně, což může vyústit v poškození struktury postižených kloubů vedoucí k významné disabilitě a ke zhoršení kvality života nemocných.
Hyperurikemie
Nejvýznamnějším ovlivnitelným rizikovým faktorem vývoje dnavé artritidy je hyperurikemie. Její prevalence v populaci je nejčastěji udávána mezi 4–40 % [6]. Kyselina močová je u člověka konečným produktem metabolizmu purinových nukleotidů. Puriny jsou organické aromatické heterocyklické sloučeniny tvořené pyrimidinovým kruhem vázaným na imidazolový kruh. Adenosin je postupně metabolizován na hypoxantin, který je konvertován na xantin enzymem xantinoxidáza (XO). Guanin je metabolizován přímo na xantin. Xantin je následně pomocí XO metabolizován na finální produkt – kyselinu močovou.
Příčinou hyperurikemie může být zvýšený příjem purinů potravou, závislý na množství a skladbě stravy a konzumaci alkoholu. V této souvislosti se v poslední době mluví o zvýšené konzumaci fruktózou slazených nápojů. Metabolizmus fruktózy v jaterní buňce zvyšuje degradaci ATP na AMP, který je dále metabolizován až na kyselinu močovou. Údaje z USA ukazují na souvislost mezi nadměrnou konzumací fruktózou slazených nápojů a nárůstem prevalence poruchy glukózové tolerance, obezity a metabolického syndromu vůbec [7].
Další příčinou hyperurikemie může být zvýšená produkce kyseliny močové v důsledku známého vrozeného metabolického defektu [např. deficit hypoxantin guanin fosforibosyltransferázy (Lesch-Nyhanův syndrom), zvýšená aktivita fosforibosylpyrofosfát syntetázy apod.] nebo v důsledku zvýšeného buněčného obratu (karcinomy, myeloproliferativní onemocnění, hemolytická anemie, psoriáza, chemoterapie, radioterapie).
Často je však příčina nadprodukce kyseliny močové neznámá. Protože produkce kyseliny močové je závislá na velikosti plochy povrchu těla, bývá hyperurikemie častěji prokazována u obézních jedinců. Snížené vylučování urátů z organizmu ledvinami je vůbec nejčastější příčinou hyperurikemie (90 %). Může být hereditární nebo je důsledkem poklesu renálních funkcí (chronická renální insuficience, laktátová acidóza) nebo užívání některých léků (kličková diuretika, tacrolimus, cyklosporin A).
V roce 2002 Enomoto et al. jako první identifikovali specifickou molekulu zajišťující transport kyseliny močové v ledvinných tubulech označenou URAT 1 (SLC22A12) [8]. Tento objev odstartoval vlnu zájmu o transportní molekuly, zajišťující transport organických anionů v ledvinných tubulech. Postupně byly identifikovány další molekuly zajišťující transport kyseliny močové (reabsorpci, sekreci) v ledvinných tubulech. Mezi tyto molekuly patří zejména GLUT9 (SLC2A9), dále OATv1, MRP4, SMCT1, SMCT2, OAT10, BCRP a PDZK1 [9]. Imunogenetické studie následně pomohly identifikovat několik genetických variant (jednonukleotidových záměn) ve struktuře 10 genů kódujících tyto transportní molekuly, které mohou mít funkční důsledky v ovlivnění míry renální exkrece kyseliny močové.
Hyperurikemie bývá často provázena výskytem onemocnění, která jsou součástí metabolického syndromu. Metabolický syndrom je soubor typických rizikových faktorů, které se často vyskytují společně a vznikají velmi pravděpodobně na podkladě inzulinové rezistence [10]. Přítomnost metabolického syndromu představuje na jedné straně zvýšené riziko pro rozvoj předčasné aterosklerózy a následně kardiovaskulárních onemocnění a na straně druhé riziko pro vznik diabetes mellitus 2. typu a některých častých nádorů. Metabolický syndrom se tedy řadí mezi rizika pro rozvoj nemocí, které jsou nejčastějšími příčinami úmrtí v naší populaci. V České republice trpí metabolickým syndromem přibližně 25 % populace v produktivním věku, u seniorů se metabolický syndrom vyskytuje až u 40 % jedinců. Není zcela jasné, zda hyperurikemie je příčinou nebo následkem zmíněných onemocnění, avšak ze studií na zvířecím modelu vyplývá, že hyperurikemie samotná hraje významnou roli ve vývoji hypertenze a kardiovaskulárních onemocnění [11]. Hyperurikemie se tak stává významným rizikovým faktorem nejen pro vývoj dnavé artritidy, ale i dalších onemocnění spojených se zvýšenou mortalitou. V této souvislosti je vhodné zmínit výsledky prospektivní observační studie, která prokázala, že hyperurikemie u dospívajících a mladých dospělých predikuje budoucí vývoj hypertenze [12]. V placebem kontrolované studii u mladistvých s hypertenzí a hyperurikemií vedla terapie alopurinolem k významnému poklesu krevního tlaku. Některé práce rovněž naznačily, že terapie alopurinolem může u pacientů s chronickým onemocněním ledvin zpomalit progresi poškození ledvinných funkcí [13,14].
Dnavá artritida
V důsledku hromadění urátů v různých strukturách pohybového aparátu (kloubní pouzdro, šlachová pochva, vazy, chrupavka, kost) může dojít k manifestaci dnavé artritidy. Hladina nasycení natrium urátu v biologickém roztoku při 37 °C je přibližně 380 μmol/l. Jestliže koncentrace kyseliny močové přesáhne tuto hranici, významně se zvyšuje riziko tvorby a usazování krystalů natrium urátu v tkáních. Přesto pouze u malé části jedinců s hyperurikemií dochází k manifestaci dnavé artritidy. Ultrasonografické studie prokazují, že okolo 20–25 % asymptomatických pacientů s hyperurikemií má depozita natrium urátu v kloubech a šlachách na dolních končetinách [15]. Krystaly natrium urátu mohou být prokazovány v synoviální tekutině asymptomatických kloubů. Přítomnost krystalů natrium urátu v kloubním prostředí je tedy nezbytnou, ale jak se ukazuje, ne dostatečnou podmínkou vývoje dnavé artritidy. Tvorba a ukládání krystalů natrium urátu je proces dlouhodobý, trvající měsíce a roky. Je ovlivňována faktory, jako je stupeň hydratace struktur pohybového aparátu, pH, koncentrací kationů nebo přítomnost proteinů extracelulární matrix, jako jsou proteoglykany, kolagen a chondroitin sulfát [16]. Zdá se, že významným faktorem spouštějícím akutní ataku dny je náhlý pokles hladiny kyseliny močové u jedinců s již vytvořenými urátovými depozity. Uvolněné krystaly natrium urátu aktivují prostřednictvím toll-like receptorů polymerní proteinový komplex (tzv. inflammasome) v cytoplazmě zánětlivých buněk, což vede k produkci zánětlivých cytokinů, zejména interleukinu-1β (IL-1β) a dalších zánětlivých mediátorů [17]. Výsledky recentně publikované studie prokázaly, že vysokopurinová dieta není spojena pouze s rizikem hyperurikemie, ale rovněž významně zvyšuje riziko opakovaných záchvatů akutní dny [18]. Je nepravděpodobné, že by akutní krystalizace natrium urátu vedla ke spuštění akutního záchvatu dny. Autoři práce předpokládají, že by spouštěčem akutního záchvatu mohly být i jiné složky vysokopurinové diety, zejména volné mastné kyseliny.
V průběhu dnavé artritidy rozlišujeme 4 stadia nemoci (asymptomatická hyperurikemie, akutní dnavá artritida, interkritické období, chronická dnavá artritida). Časnou manifestací dny jsou záchvaty akutní dnavé artritidy (obr. 1). Dominantně bývají postiženy klouby dolních končetin (metatarzofalangeální klouby, nárt, hlezenní a kolenní klouby), ale rovněž klouby na horních končetinách (klouby rukou, zápěstí, lokty). 85–90 % primárních záchvatů dny představuje monoartritida, nejčastěji (50–60 %) postihující metatarzofalangeální kloub palce nohy (podagra). Těmito typickými příznaky dny bývají postiženi zejména muži po 40. roce života. Potíže vznikají náhle v průběhu 2. poloviny noci. Postižený klouby je bolestivý, výrazně oteklý, kůže v okolí kloubu je až lividně zbarvená, napjatá a horká, následně se může olupovat. Artritidu často doprovází celková nevůle, schvácenost, tachykardie, subfebrilie až horečka. Zánět obvykle odeznívá během 1–2 týdnů.
Image 1. Akutní dnavá artritida prvního metatarzofalangeálního kloubu nohy (podagra). 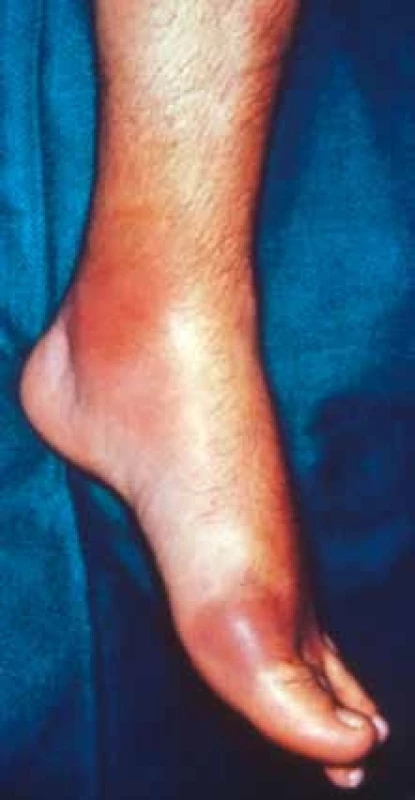
V poslední době však přibývá pacientů, kteří mají první projevy dny až ve stáří, po 65. roce života [19]. V této věkové kategorii pozorujeme vyrovnaný poměr mezi postižením mužů a žen, častěji polyartikulární postižení s dominantním postižením drobných kloubů rukou. V anamnéze těchto pacientů častěji nacházíme používání diuretik či renální insuficienci. Naopak méně častá jsou asociovaná onemocnění, jako je obezita, hypertenze nebo dyslipidemie.
Asymptomatické období mezi jednotlivými záchvaty akutní dnavé artritidy označujeme jako interkritické období. Pokud dojde z důvodu depozice krystalů natrium urátu v tkáních k destrukci struktur pohybového aparátu, označujeme tento stav jako chronickou tofózní dnavou artritidu (5–10 % pacientů) (obr. 2). Je charakterizována přítomností dnavých tofů vyskytujících se v měkkých tkáních nebo v kostech. V měkkých tkáních tofy nejčastěji nalézáme ve strukturách pohybového aparátu (chrupavka, kloubní pouzdro, šlachy, vazy), ale i mimo pohybový aparát (ušní boltce, ulnární hrana předloktí, okolí kloubů palců nohou, kloubů rukou, na loktech). Na RTG snímcích jsou patrny dnavé tofy v subchondrální kosti, kde vytváří cystická, jakoby průbojníkem vyražená projasnění kostní struktury. Současně dochází u nemocných s chronickou dnou k rozvoji sekundární osteoartrózy postižených kloubů. Poškození kloubních struktur vede k významnému narušení jejich funkce a přispívá k poklesu kvality života nemocných s chronickou tofózní dnou.
Image 2. Chronická tofózní dnavá artritida. 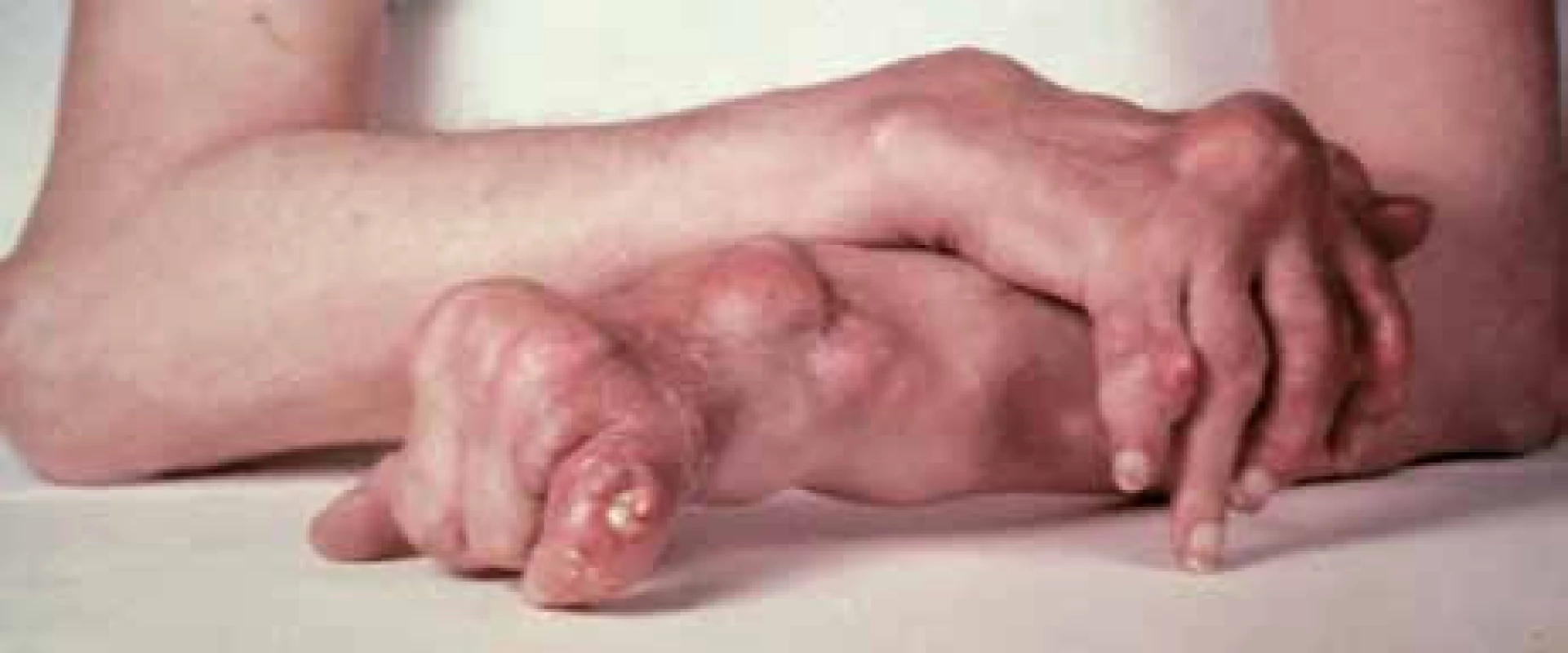
Postižení ledvin u dny
U většiny pacientů s asymptomatickou hyperurikemií nedochází ani po dlouhé době k vytvoření ledvinných kamenů. Riziko vývoje poškození ledvin se zdá být nízké, i když je sérová hladina kyseliny močové výrazně zvýšená [20]. Toto pozorování pravděpodobně koresponduje s relativně málo častým rozvojem významného ledvinného postižení u pacientů s dnou včetně pacientů na hypourikemické terapii. Rovněž vývoj progresivního renálního selhání je výjimečný, jestliže se dna objeví až po manifestaci klinicky významného postižení ledvin.
V rámci dny rozlišujeme akutní a chronické formy ledvinného poškození. K vývoji akutní urátové nefropatie může dojít u jedinců s masivní nadprodukcí kyseliny močové. Nejčastěji se jedná o endogenní nadprodukci v důsledku enzymatického defektu, zvýšeného buněčného obratu při malignitách, při protinádorové terapii, při masivní destrukcí tkání nebo při rabdomyolýze. Za těchto situací dochází k masivní tvorbě urátových krystalů v ledvinných tubulech distálního nefronu, ale i v ledvinných papilách a ureterech. Narůstající intratubulární tlak vede k poklesu glomerulární filtrace. Při exogenní nadprodukci kyseliny močové, spojené s nadměrným přísunem purinů potravou, častěji dochází k tvorbě ledvinných kamenů a manifestaci dny než k vývoji akutního renálního selhání. V případě chronických forem ledvinného poškození se vede polemika, zda chronické změny, jakými je např. intersticiální nefritida nebo průkaz urátových depozit v ledvinném parenchymu, jsou důsledkem nebo spíše příčinou chronické hyperurikemie. Urátová depozita byla opakovaně prokázána v ledvinném parenchymu pacientů s chronickým renálním selháním, ale bez anamnézy dny. Výskyt hyperurikemie u jedinců s neléčenou esenciální hypertenzí je nízký, ale její výskyt se zdvojnásobuje, jsou-li pacienti léčeni, a to zejména diuretiky. Dominující příčinou snížení urátové clearence pak může u těchto jedinců být rozvoj renálního vaskulárního postižení. Narůstající sérová hladina kyseliny močové by tak mohla sloužit spíše jako indikátor vaskulárního postižení než jako jeho spouštěč.
Diagnostika a klasifikace dny
Pro diagnózu dnavé artritidy byla vyvinuta četná klasifikační a diagnostická kritéria. Nejčastěji se používají klasifikační kritéria American College of Rheumatology (ACR) pro akutní dnavou artritidu [21] (tab. 1). Jasným potvrzením diagnózy je průkaz krystalů natrium urátu ve výpotku nebo dnavém tofu nejčastěji v polarizačním mikroskopu, případně v elektronovém mikroskopu nebo chemicky murexidovou reakcí. Není-li výpotek nebo aspirát z dnavého tofu dostupný, je možné diagnostikovat dnavou artritidu při přítomnosti 6 z 12 klinických kritérií uvedených v tab. 1. Samotný průkaz hyperurikemie není dostačující pro diagnózu dnavé artritidy. Až při 50 % akutních záchvatů dnavé artritidy může být změřena normální nebo jen lehce zvýšená hladina kyseliny močové v séru. Sérová hladina kyseliny močové kolísá, proto se doporučuje provádět odběr krve 2krát v průběhu jednoho týdne, nejlépe 2 týdny po vzniku akutní dnavé artritidy. Před odběrem krve by pacient neměl mít větší fyzickou zátěž, měl by mít normální stravu bez zvýšeného obsahu purinů, neměl by konzumovat alkohol a měly by mu být, pokud to situace umožňuje, přechodně vysazeny léky ovlivňující tvorbu urátů (diuretika, salicyláty).
Table 1. Klasifikační kritéria ACR pro akutní dnavou artritidu [21]. ![Klasifikační kritéria ACR pro akutní dnavou artritidu [21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cd775cef331832679f038c5e90d3ccba.png)
V roce 2006 vytvořila skupina expertu Evropské ligy proti revmatismu (EULAR) na principech medicíny založené na důkazech 10 klíčových doporučení pro diagnostiku dnavé artritidy zahrnující klinické charakteristiky onemocnění, biochemické vyšetření, průkaz krystalů, radiografické vyšetření, rizikové faktory a komorbidity [1] (tab. 2).
Table 2. Doporučení EULAR pro diagnostiku dnavé artritidy. 
Z hlediska etiologie hyperurikemie rozdělujeme dnu na primární a sekundární. Jednotlivé příčiny primární a sekundární dny jsou uvedeny v následující tab. 3.
Table 3. Klasifikace hyperurikemie a dnavé artritidy. 
Terapie dnavé artritidy
Terapii dnavé artritidy lze rozdělit do několika stadií:
- léčbu akutního dnavého záchvatu,
- snížení urikemie v interkritickém období se snahou o rozpuštění urátů z tkáňových depozit u chronické dnavé artritidy,
- prevence dalších záchvatů dnavé artritidy.
Kombinovat lze nefarmakologickou a farmakologickou léčbu. Stejná pracovní skupina EULAR, která vytvořila doporučení pro diagnostiku dnavé artritidy, publikovala v roce 2006 12 doporučení týkajících se léčby dny [22] (tab. 4).
Table 4. Doporučení EULAR pro léčbu dnavé artritidy. 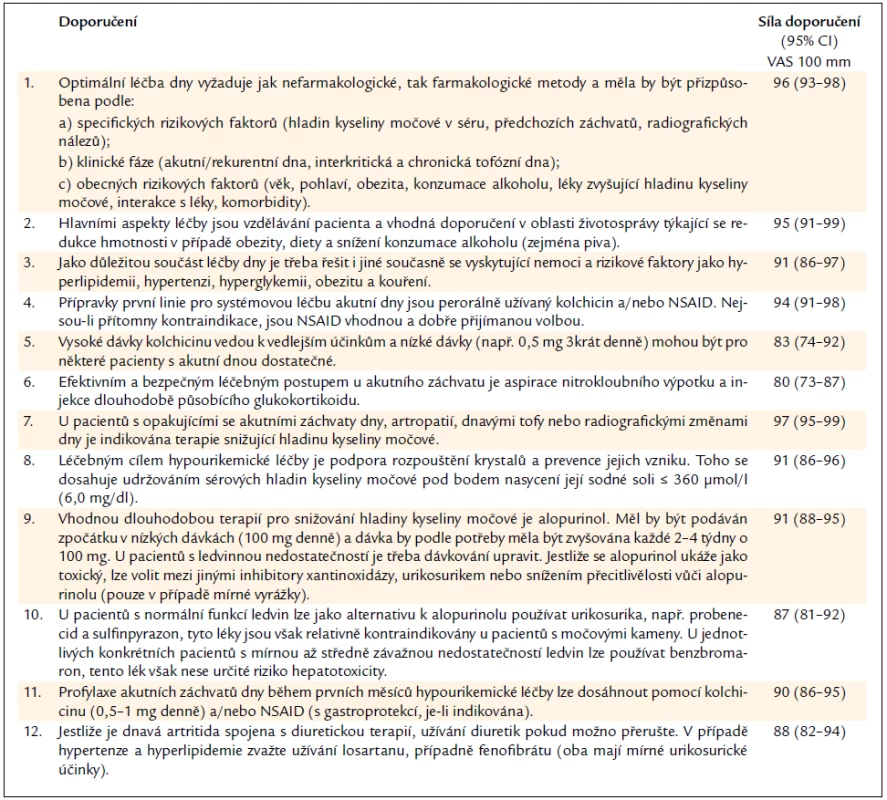
Terapie akutní dnavé artritidy
Léčba akutní dnavé artritidy by měla být včasná a razantní. Důvodem je intenzita zánětu v prvních hodinách, výrazná symptomatologie a časová omezenost akutního záchvatu. K terapii akutní dnavé artritidy se používají nesteroidní antiflogistika (NSAID), kolchicin, případně lokálně a celkově aplikované glukokortikoidy [23]. Zapomínat by se nemělo ani na lokální aplikaci chladu.
Lékem první volby jsou NSAID. Až u 90 % pacientů vedou k ukončení záchvatu během 5–8 dnů. Byla provedena řada srovnávacích studií mezi jednotlivými NSAID, které většinou prokázaly srovnatelnou účinnost jednotlivých léků. Dlouhodobě nejužívanějším NSAID se stal indometacin, který má ve formě čípků rychlý nástup léčebného účinku. Doporučovaná dávka je 4krát 50 mg v prvních 2 dnech záchvatu, poté 3krát 50 mg během 3. a 4. dne s následnou redukcí na 1–3krát 50 mg denně až do odeznění symptomů [24]. K léčbě akutního záchvatu dnavé artritidy je však prakticky možno použít jakékoli NSAID, včetně COX-2 specifických léků [25,26]. Výhodné je používat NSAID s rychlým nástupem účinku. Využít je možné i parenterální aplikaci. V úvodu léčby je často nutné použít maximální dávky (např. ibuprofen 3krát 800 mg, diklofenak 3krát 50–75 mg, celecoxib 2krát 400 mg, etoricoxib 1krát 120 mg). Při výběru preparátu je nutné respektovat rizikové faktory, zejména riziko NSAID indukované gastropatie a rovněž kardiovaskulární a renální riziko. U pacientů s rizikem NSAID indukované gastropatie (gastrointestinální vředy a krvácení v anamnéze, věk nad 65 roků, současné používání antikoagulancií a glukokortikoidů) je možné jako alternativu použít kolchicin nebo lze NSAID kombinovat s inhibitorem protonové pumpy, misoprotolem nebo lze použít COX-2 specifická NSAID [27–29].
Alternativou zejména u pacientů, u kterých jsou NSAID kontraindikována, je použití kolchicinu. Kolchicin je přírodní alkaloid pocházející z rostliny Ocún podzimní (Colchicum autumnale). Použití kolchicinu bylo zaznamenáno již ve starém Řecku. Působí silně protizánětlivě, aniž by zasahoval do metabolizmu kyseliny močové. Kolchicin je mitotický jed, který se váže na tubulinové struktury polymorfonukleárů a paralyzuje tak jejich funkce. Ovlivňuje zejména jejich schopnost fagocytózy, motilitu, adhezivitu nebo produkci prostaglandinů. Dobře se vstřebává po perorálním podání, maximální koncentrace v plazmě dosahuje za 2 hod a jeho plazmatický poločas jsou 4 hod. Kolchicin je v České republice dostupný v tabletách síly 0,5 mg. Jeho efekt je poměrně specifický pro dnavou artritidu, a proto může být použit v případech diagnostické nejistoty jako terapeutický test. Kolchicin je účinnější při podání v intervalu do 48 hod od vzniku artritidy. Doporučované dávkování je 1 mg v úvodu a poté v 2hodinových intervalech 0,5 mg do celkové maximální dávky 5–6 mg první den. Pokud nedojde k ústupu symptomů dnavé artritidy, opakuje se tento postup v následujících dnech až do celkové dávky 12 mg. Problémem je toxicita kolchicinu, manifestující se zejména v podobě průjmů objevujících se často před nástupem jeho léčebného účinku. Alternativou dle doporučení EULAR může být podání kolchicinu v nízkodávkovém režimu 0,5 mg 3krát denně [22]. Tento režim byl testován v jedné dvojitě zaslepené, randomizované studii, která srovnávala účinnosti léčby nízkou dávkou kolchicinu 1,8 mg podané během 1 hod a vysokou dávkou kolchicinu 4,8 mg podané během 6 hod. Ke srovnání byla použita jednorázová dávka kolchicinu 0,6 mg a placebo. Kolchicin v nízké dávce dosahoval stejných plazmatických hladin a stejné účinnosti jako vyšší dávky kolchicinu [19].
Další možností léčby je lokální nebo systémové podání glukokortikoidů. Intraartikulární aplikace depotního glukokortikoidu je účinná. V klinických studiích však byla účinnost tohoto způsoby léčby zkoumána málo. Intraartikulární podání vede většinou k odeznění záchvatu během 12–24 hod. Výhodná může být u pacientů s monoartritidou nebo oligoartritidou. U pacientů s polyartritidou je možná lokální aplikace glukokortikoidů v případě nedostatečné účinnosti NSAID a/nebo kolchicinu nebo v případě jejich kontraindikací. Před lokální aplikací glukokortikoidů je nutné vyloučit septickou artritidu.
Celkové podání glukokortikoidů u akutní dny je možné zejména u polyartikulární formy v případě neúspěchu nebo kontraindikace léčby NSAID a/nebo kolchicinem. Doporučovaná dávka prednisonu je 30 mg 1.–3. den s postupnou redukcí dávky a ukončením léčby během 1–2 týdnů. Zlepšení je patrné obvykle za 12–48 hodin. Doporučení k celkovému podání glukokortikoidů není jednoznačné. Diskutovaným problémem je vyšší výskyt nových záchvatů dny při rychlém snižování dávky glukokortikoidu mechanizmem tzv. rebound fenoménu.
Součástí léčby akutní dnavé artritidy je i doporučení klidového režimu a včasná aplikace chladu na postižený kloub. Moderní formou je lokální kryoterapie při použití speciálních aplikátorů.
Terapie v interkritickém období a terapie chronické tofózní dny
Jak již bylo uvedeno, zásadním rizikovým faktorem pro vznik dnavé artritidy je zvýšení sérové hladiny kyseliny močové nad úroveň nasycení její sodné soli v biologickém roztoku, tedy nad hladinu přibližně 380 μmol/l. Proto je dle citovaných doporučení EULAR hypourikemická léčba indikována s cílem podpořit rozpouštění krystalů natrium urátu a prevence jejich vzniku. Podle citovaných doporučení může být tohoto cíle dosaženo pouze tehdy, pokud je sérová hladina kyseliny močové snížena pod hodnotu 360 μmol/l [22]. Léčba hyperurikemie by měla být komplexní a měla by zahrnovat jak léčbu nefarmakologickou, tak léčbu farmakologickou.
Nefarmakologická léčba
V řadě případů je příčina hyperurikemie korigovatelná. Důležitou součástí léčby jsou proto režimová opatření. K významným nezávislým rizikovým faktorům hyperurikemie patří centrální obezita a konzumace alkoholu. Z potravin je riziková zejména konzumace masa a mořských plodů. K režimovým opatřením proto řadíme redukci hmotnosti a omezení příjmu potravin s vysokým obsahem purinů. Dieta s nízkým obsahem purinů je schopna snížit sérovou hladinu kyseliny močové o 10–15 %. Dále je doporučeno omezit příjem alkoholu, případně úplná abstinence. K více rizikovým patří zejména konzumace piva a tvrdého alkoholu, naopak minimální vliv má pití vína. Důležité je dbát na dostatečný příjem tekutin, který zajistí přiměřený objem moči. Součástí léčby hyperurikemie by měla být i správná korekce hypertenze a dyslipidemie. V neposlední řadě je nutné myslet na racionální farmakoterapii léky, které mohou zvyšovat hladinu kyseliny močové.
Farmakologická léčba
Indikace k zahájení hypourikemické léčby shrnuje tab. 5. Hypourikemická léčba by neměla být zahájena, upravována nebo ukončována v průběhu akutního dnavého záchvatu. Důvodem je mobilizace depozit natrium urátu, která by mohla být příčinou zhoršení projevů akutní dny.
Table 5. Indikace k zahájení hypourikemické léčby. 
Alopurinol
Základním lékem určeným k léčbě hyperurikemie je alopurinol [23]. K léčbě hyperurikemie spojené s dnou byl schválen americkou Food and Drug Administration (FDA) již v roce 1965. Alopurinol a jeho hlavní aktivní metabolit oxipurinol je purinový inhibitor enzymu XO, který inhibuje redukovanou formu tohoto enzymu. Z gastrointestinálního traktu se vstřebává přibližně 70–90 % podané dávky. Maximální plazmatické koncentrace je dosaženo během 0,5–2 hod. Plazmatický poločas kolísá mezi 1 a 3 hod. Alopurinol je metabolizován převážně v játrech na oxipurinol, jehož eliminační poločas je 12–27 hod v případě normální renální funkce, prodlužuje se však u pacientů s ledvinnou nedostatečností. Alopurinol ani oxipurinol se nevážou na plazmatické bílkoviny. Přibližně 10 % denní dávky je vyloučeno glomerulární filtrací jako nezměněný alopurinol a přibližně 70 % jako oxipurinol, zbývajících 20 % denní dávky je vyloučeno v nezměněné formě stolicí. U pacientů s renální insuficiencí se clearance alopurinolu i jeho aktivního metabolitu snižuje, což může vést ke zvýšení jejich plazmatických hladin a zvýšení rizika toxicity, proto je u pacientů s renální insuficiencí nutná adekvátní redukce dávky. Indikací k léčbě alopurinolem je primární hyperurikemie spojená s dnavou artritidou, prevence a léčba urátové nefropatie, sekundární hyperurikemie spojená s hematologickými onemocněními a dále profylaxe a léčba hyperurikemie spojené se zvýšeným rozpadem buněk po radioterapii a/nebo chemoterapii leukemie, lymfomu a jiných maligních onemocnění. Konečně je indikací k použití alopurinolu i profylaxe a prevence urátové litiázy a kalciumoxalátové litiázy spojené s hyperurikosurií.
Úvodní doporučená dávka alopurinolu je 100 mg 1krát denně. Při nedostatečném efektu lze za kontroly hladiny kyseliny močové v séru dávku postupně zvyšovat o 100 mg každé 1–3 týdny až do dosažení požadovaného účinku. Obvyklá udržovací dávka je 200–600 mg denně. Někdy může být nutné dávku zvýšit až na 800 mg. Denní dávky vyšší než 300 mg by měly být podávány rozděleně ve 2–4 dílčích dávkách. U pacientů s renální insuficiencí by měla být dávka snížena na 100 mg denně. Rovněž lze zvážit prodloužení dávkovacího intervalu. Doporučuje se monitorovat plazmatické hladiny alopurinolu, kdy by jeho plazmatické hladiny neměly přesáhnout 100 µmol/l (15,2 mg/l). U osob vyššího věku není nutná úprava dávky, pokud tyto osoby současně nemají sníženou funkci ledvin. Při terapii alopurinolem je nutné počítat s jeho toxicitou (5 %), zejména s projevy gastrointestinální intolerance (nauzea a zvracení), hepatotoxicitou, útlumem kostní dřeně, bolestí hlavy nebo hypersenzitivní reakcí.
Při terapii alopurinolem je nutné myslet na jeho lékové interakce. Při současném podávání spolu s perorálními antikoagulancii a teofylinem může být ovlivněn jejich jaterní metabolizmus. Inhibice XO může vést k nárůstu plazmatické koncentrace 6-merkaptopurinu nebo azatioprinu.
Febuxostat
V případech, kdy léčba alopurinolem nevede k dosažení cílové hladiny kyseliny močové v séru ≤ 360 μmol/l, u nemocných, u kterých je léčba alopurinolem spojena s výskytem nežádoucích příhod, nebo v případech, kdy je léčba alopurinolem kontraindikována, může být použit alternativní lék druhé volby. Tímto lékem může být febuxostat, který byl v letošním roce uveden na český trh. Febuxostat je 2-arylthiazolový derivát, který dosahuje svého terapeutického účinku selektivní inhibicí enzymu XO [30]. Febuxostat je silný, nepurinový selektivní inhibitor XO. Inhibuje jak oxidované, tak redukované formy XO [31]. Při terapeutických koncentracích febuxostat neinhibuje další enzymy účastnící se metabolizmu purinů a pyrimidinů. Rychle a dobře se vstřebává z gastrointestinálního traktu, přičemž resorpce není významně ovlivněna současným užitím se stravou [32]. Maximální plazmatické koncentrace dosahuje za 1–1,5 hod. Silně se váže na plazmatické bílkoviny, zejména na albumin. Jeho zdánlivý eliminační poločas je přibližně 5–8 hod. Febuxostat se metabolizuje v játrech konjugací v enzymatickém systému uridin difosfátglukuronosyltransferázy (UDPGT) a oxidací v systému cytochromu P450, jehož aktivitu neovlivňuje. Eliminace z organizmu se poté děje jak játry, tak ledvinami. Farmakokinetika febuxostatu není významně ovlivněna poklesem ledvinných nebo jaterních funkcí. U pacientů s mírnou nebo středně závažnou renální insuficiencí a mírným nebo středně závažným poklesem jaterních funkcí není nutná úprava dávky. Úprava dávky není rovněž nutná u osob vyššího věku.
V rozsáhlém klinickém výzkumu se febuxostat ukázal být účinnější ve srovnání s alopurinolem 300 mg, resp. 100 mg denně ve snížení sérové hladiny kyseliny močové pod doporučovaných 360 μmol/l [33–35]. Dlouhodobá léčba febuxostatem vedla k redukci počtu záchvatů akutní dny a redukci velikosti a počtu dnavých tofů [35–38].
Doporučená denní dávka febuxostatu je 80 mg v jedné denní dávce podávané nezávisle na příjmu stravy. Pokud po 2–4 týdnech léčby přetrvávají zvýšené sérové hladiny kyseliny močové > 360 μmol/l, může být dávka zvýšena na 120 mg 1krát denně. V České republice je však zatím registrována pouze 80mg forma febuxostatu. Nástup účinku je dostatečně rychlý, aby umožnil opakované testování hladiny kyseliny močové v séru již po 2 týdnech od zahájení léčby. Vzhledem k chybějícím zkušenostem s použitím u dětí a dospívajících není febuxostat u těchto skupin pacientů doporučen. Rovněž u pacientů po orgánové transplantaci není použití febuxostatu z důvodu nedostatku zkušeností doporučeno.
Tolerance febuxostatu je obvykle dobrá. Poruchy jaterních testů se objevují u 3–5 % pacientů. Alergické reakce jsou poměrně vzácné. V klinických studiích byl pozorován nevýznamně vyšší výskyt kardiovaskulárních příhod po febuxostatu. Informace týkající se tohoto zvýšeného rizika však vyžadují další doplnění o data z nových studií, dlouhodobých extenzí či o data z registrů. Nicméně v současné době není doporučeno zahajovat terapii febuxostatem u pacientů s ischemickou chorobou srdeční nebo městnavým srdečním selháním. Pamatovat je rovněž nutné na lékové interakce febuxostatu, zejména s 6-merkaptopurinem, azatioprinem nebo s teofylinem.
Urikosurika
Další alternativní léčbu hyperurikemie, zejména u pacientů, u kterých předpokládáme poruchu eliminace kyseliny močové ledvinami, představují urikosurika, léky zvyšující renální exkreci kyseliny močové [23]. Většinou zabraňují její zpětné resorpci v ledvinných tubulech. Tyto léky však v současné době nejsou v České republice registrovány. Je možné je získat pouze formou mimořádného dovozu. Jedná se o probenecid, sulfinpyrazon a benzbromaron. Je možné je použít u pacientů bez ledvinného postižení a při nesnášenlivosti inhibitorů XO. Urikosurika jsou indikována zejména u pacientů se sníženou exkrecí kyseliny močové ledvinami (méně než 1,8 mmol/24 hod). U osob s normální exkrecí kyseliny močové bez renálního postižení mohou být podávána jak urikosurika, tak inhibitory XO. Urikosurika jsou kontraindikována u pacientů s výraznou nadprodukcí kyseliny močové (více než 4,2 mmol/24 hod). Benzbromaron je účinnější než alopurinol i u pacientů s mírným ledvinným postižením, jeho použití je však limitováno jeho hepatotoxicitou.
U pacientů, kteří mají současně hypertenzi a/nebo hyperlipidemii, je možné zvážit podání antihypertenziva losartanu, případně hypolipidemika fenofibrátu, které mají rovněž urikosurické účinky.
Léčba asymptomatické hyperurikemie
Otevřenou otázkou zůstává léčba asymptomatické hyperurikemie, která v populaci postihuje přibližně 12–15 % jedinců. Jednoznačná doporučení, zda léčit asymptomatickou hyperurikemii inhibitory XO nebo urikosuriky, neexistují. Podle výsledků některých studií by hyperurikemie mohla představovat nezávislý rizikový faktor vývoje hypertenze a ischemické choroby srdeční. Na druhé straně jsou k dispozici data, která poukazují na možný pozitivní vliv kyseliny močové např. na endoteliální funkce nebo na její roli antioxidantu [39,40]. Léčbu asymptomatické hyperurikemie lze proto doporučit pouze v případech, kdy je urikemie opakovaně vyšší než 600 μmol/l, a to zejména u pacientů s vysokým rizikem komplikací (nefrolitiáza, postižení ledvin, dnavé tofy).
Nové léčebné možnosti
Mezi nové možnosti léčby hyperurikemie patří použití pegylované urikázy (peglotikázy). Na rozdíl od mnoha savců nemá člověk ve výbavě enzym urikázu, která štěpí kyselinu močovou na lépe rozpustný alantoin. Peglotikáza má za sebou úspěšné klinické testování fáze 2 a 3, které prokázalo její vysoký potenciál ve snížení sérové hladiny kyseliny močové a redukci dnavých tofů během poměrně krátké doby [19]. V USA byla zaregistrována v roce 2010 pro léčbu dospělých pacientů s dnou, kteří jsou refrakterní na konveční způsoby léčby. Podává se intravenózně v dávce 8 mg každé 2 týdny. Z důvodu zvýšeného rizika dnavých záchvatů v úvodu léčby je nutné profylaktické podávání kolchicinu.
Poznání role IL-1β v patogenezi akutní dny vedlo k pokusům s použitím canakinumabu, plně humánní monoklonální protilátky proti IL-1β. Canakinumab v klinické studii prokázal lepší profylaxi dnavých záchvatů ve srovnání s kolchicinem [19].
Profylaxe akutních dnavých záchvatů
V úvodu léčby lékem snižujícím sérovou hladinu kyseliny močové se mohou častěji objevit záchvaty akutní dny v důsledku změny sérových hladin kyseliny močové, způsobené mobilizací urátů z tkáňových depozit. Při zahájení léčby léky snižujícími sérovou hladinu kyseliny močové je proto doporučena profylaxe záchvatů akutní dny kolchicinem v dávce 0,5–1,0 mg denně po dobu minimálně 6 měsíců. Při intoleranci kolchicinu se jako alternativa doporučují NSAID (např. indometacin 25 mg denně, diklofenak 25 mg denně), nicméně tento postup nemá oporu v klinických studiích. Případný záchvat akutní dny by měl být léčen dle doporučení v závislosti na individuálním stavu nemocného.
doc. MUDr. Petr Němec, Ph.D.
www.fnusa.cz
e-mail: petr.nemec@fnusa.cz
Doručeno do redakce: 14. 8. 2012
Přijato po recenzi: 17. 9. 2012
Sources
1. Zhang W, Doherty M, Pascual E et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65 : 1301–1311.
2. Mikuls TR, Farrar JT, Bilker WB et al. Gout epidemiology: results from the UK General Practice Research Database, 1990–1999. Ann Rheum Dis 2005; 64 : 267–272.
3. Annemans L, Spaepen E, Gaskin M et al. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005. Ann Rheum Dis 2008; 67 : 960–966.
4. Alamanos Y, Drosos AA. Epidemiology of adult rheumatoid arthritis. Autoimmun Rev 2005; 4 : 130–136.
5. Arromdee E, Michet CJ, Crowson CS, O‘Fallon WM, Gabriel SE. Epidemiology of gout: is the incidence rising? J Rheumatol 2002; 29 : 2403–2406.
6. Pavelka K. Dna (arthritis urica). In: Pavelka K, Rovenský J. Klinická revmatologie. Praha: Galen 2003 : 347–358.
7. Nakagawa T, Hu H, Zharikov S et al. A causal role for uric acid in fruktose-induced metabolit syndrome. Am J Physiol Renal Physiol 2006; 290: F625–F631.
8. Enomoto A, Kimura H, Chairoungdua A et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels. Nature 2002; 417 : 447–452.
9. Anzai N, Jutabha P, Amonpatumrat-Takahashi S, Sakurai H. Recent advances in renal urate transport: characterization of candidate transporters indicated by genome-wide association studies. Clin Exp Nephrol 2012; 16 : 89–95.
10. Souček M. Metabolický syndrom. Vnitř Lék 2009; 55 : 618–621.
11. Mazzali M, Hughes J, Kim YG et al. Elevated uric acid increases blood pressure in the rat by a novel crystal-independent mechanism. Hypertension 2001; 38 : 1101–1106.
12. Feig DI, Soletsky B, Johnson RJ. Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. JAMA 2008; 300 : 924–932.
13. Siu YP, Leung KT, Tong MK, Kwan TH. Use of allopurinol in slowing the progression of renal disease through its ability to lower serum uric acid level. Am J Kidney Dis 2006; 47 : 51–59.
14. Menè P, Punzo G. Uric acid: bystander or culprit in hypertension and progressive renal disease? J Hypertens 2008; 26 : 2085–2092.
15. Puig JG, de Miguel E, Castillo MC et al. Symptomatic hyperuricemia: impact of ultrasonography. Nucleosides Nucleotides Nucleic Acids. 2008; 27 : 592–595.
16. Richette P, Bardin T. Gout. Lancet 2010; 375 : 318–328.
17. Žurek M. Patogeneze, diagnostika a léčba dny. Vnitř Lék 2006; 52 : 736–741.
18. Zhang Y, Chen C, Choi H et al. Purine-rich foods intake and recurrent gout attacks. Ann Rheum Dis 2012; 71 : 1448–1453.
19. Pavelka K. Doporučení České revmatologické společnosti pro léčbu dnavé artritidy. Čes revmatol 2012; 20 : 82–92.
20. Steele TH. Hyperuricemic nephropathies. Nephron 1999; 81: (Suppl. 1): 45–49.
21. Wallace SL, Robinson H, Masi AT et al. Preliminary criteria for the classification of the acute arthritis of primary gout. Arthritis Rheum 1977; 20 : 895–900.
22. Zhang W, Doherty M, Bardin T et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65 : 1312–1324.
23. Pavelka K. Terapie dny. In: Pavelka K et al. Farmakoterapie revmatických onemocnění. Praha: Grada Publishing 2005 : 345–351.
24. Emmerson BT. Regimen of indomethacin therapy in acute gouty arthritis. Br Med J 1967; 2 : 272–274.
25. Arnold MH, Preston SJ, Buchanan WW. Comparison of the natural history of untreated acute gouty arthritis vs acute gouty arthritis treated with non-steroidal-anti-inflammatory drugs. Br J Clin Pharmacol 1988; 26 : 488–489.
26. Martínez RV, Reval M, Campos MD et al. Involvement of peripheral cyclooxygenase-1 and cyclooxygenase-2 in inflammatory pain. J Pharm Pharmacol 2002; 54 : 405–412.
27. Yeomans ND, Tulassay Z, Juhász L et al. A comparison of omeprazole with ranitidine for ulcers associated with nonsteroidal antiinflammatory drugs. Acid Suppression Trial: Ranitidine versus Omeprazole for NSAID-associated Ulcer Treatment (ASTRONAUT) Study Group. N Engl J Med 1998; 338 : 719–726.
28. Silverstein FE, Graham DY, Senior JR et al. Misoprostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving nonsteroidal anti-inflammatory drugs. A randomized, double-blind, placebo-controlled trial. Ann Intern Med 1995; 123 : 241–249.
29. Hawkey C, Laine L, Simon T et al. Comparison of the effect of rofecoxib (a cyclooxygenase 2 inhibitor), ibuprofen, and placebo on the gastroduodenal mucosa of patients with osteoarthritis: a randomized, double-blind, placebo--controlled trial. The Rofecoxib Osteoarthritis Endoscopy Multinational Study Group. Arthritis Rheum 2000; 43 : 370–377.
30. Okamoto K, Eger BT, Nishino T et al. An extremely potent inhibitor of xanthine oxidoreductase. Crystal structure of the enzyme-inhibitor complex and mechanism of inhibition. J Biol Chem 2003; 278 : 1848–1855.
31. Okamoto K, Nishino T. Crystal structures of mammalian xanthine oxidoreductase bound with various inhibitors: allopurinol, febuxostat, and FYX-051. J Nippon Med Sch 2008; 75 : 2–3.
32. SPC Adenuric
33. Khosravan R, Kukulka MJ, Wu JT, Joseph--Ridge N, Vernillet L. The effect of age and gender on pharmacokinetics, pharmacodynamics, and safety of febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase. J Clin Pharmacol 2008; 48 : 1014–1024.
34. Schumacher HR Jr, Becker MA, Wortmann RL et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum 2008; 59 : 1540–1548.
35. Becker MA, Schumacher HR Jr, Wortmann RL et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005; 353 : 2450–2461.
36. Becker MA, Schumacher HR, MacDonald PA, Lloyd E, Lademacher C. Clinical efficacy and safety of successful long term urate lowering with febuxostat or allopurinol in subjects with gout. J Rheumatol 2009; 36 : 1273–1282.
37. Schumacher HR Jr, Becker MA, Lloyd E, MacDonald PA, Lademacher C. Febuxostat in the treatment of gout: 5-year findings of the FOCUS efficacy and safety study. Rheumatology (Oxford) 2009; 48 : 188–194.
38. Becker MA, Schumacher HR Jr, Wortmann RL et al. Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebo-controlled, doseresponse clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum 2005; 52 : 916–923.
39. Warring WS, McKnight JA, Webb DJ, Maxwell SR. Uric acid restores endothelial function in patient with type 1 diabetes and regular smoker. Diabetes 2006; 55 : 3127–3132.
40. Waring WS, Convery A, Mishra V et al. Uric acid reduces exercise-induced oxidative stress in healthy adults. Clin Sci (Lond) 2003; 105 : 425–430.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 12-
All articles in this issue
- Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin
- Je protidoštičková liečba vždy účinná?
- Naše zkušenosti s léčbou primárních lymfomů centrálního nervového systému
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Primární řasinky buněk kardiovaskulárního aparátu
- Změny na úrovni populace zaměřené na podporu kardiovaskulárního zdraví
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Toxická hepatitída po Polygonum multiflorum
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Je protidoštičková liečba vždy účinná?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

