-
Medical journals
- Career
Nová antitrombotika v prevenci žilní tromboembolie a nové protidestičkové léky
Authors: J. Malý 1; M. Pecka 1; R. Malý 2
Authors‘ workplace: II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 1; I. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jan Vojáček, DrSc., FESC, FACC 2
Published in: Vnitř Lék 2011; 57(9): 733-739
Category: 65th birthday Mudr. Jany Laciné and and 60th birthday Milana Tržila
Overview
V první části uvádíme stručný přehled nových antitrombotik, která by měla nahradit v řadě indikací kumariny a heparin. V tomto přehledu informujeme o pentasacharidech, přímých inhibitorech trombinu a přímých inhibitorech faktoru Xa. Druhá část je věnována vysvětlení významu působků ovlivňujících aktivace krevních destiček, neboť nové léky s protidestičkovým účinkem působí blokováním těchto základních reakcí. Především inhibice agregace destiček stimulované ADP je směrem, kterým se ubírá moderní protidestičková terapie, snižující riziko arteriálních okluzí.
Klíčová slova:
fondaparinux – dabigatran – rivaroxaban – protidestičkové lékyÚvod
Historie léčebného ovlivnění žilní a arteriální trombózy je velmi stará. Od objevení aspirinu uplynulo více než 100 let a heparin byl objeven před 95 lety. Kumariny známe více než 50 let. 90. léta minulého století přinesla do prevence a léčby nízkomolekulární hepariny a pentasacharidy. Farmakologické možnosti profylaxe tromboembolické nemoci (TEN) se v posledních 10 letech výrazně rozšířily. Přes objevení nových léků a průkaz jejich účinnosti v profylaxi TEN nebylo dosud nalezeno „ideální“ antitrombotikum (tab. 1). V této stati přinášíme stručný přehled poznatků o pentasacharidech, přímých inhibitorech trombinu a přímých inhibitorech faktoru Xa. V přehledu protidestičkových léků zmiňujeme především thienopyridiny a léky ovlivňující ADP. Současné trendy v profylaxi v nových indikacích počítají s novými, moderními antitrombotiky.
Table 1. Vlastnosti „ideálního“ antitrombotika. 
Fondaparinux
Fondaparinux patří mezi syntetické pentasacharidy, jež jsou uměle připravenou specifickou sekvencí, kterou se přirozené glykosaminoglykany váží na antitrombin. Je to syntetický a selektivní inhibitor aktivovaného faktoru X. Selektivní vazbou na antitrombin zesiluje (asi 300krát) přirozenou neutralizaci faktoru Xa antitrombinem. Neutralizace faktoru Xa inhibuje jak tvorbu trombinu, tak vznik trombu. Fondaparinux nedeaktivuje trombin a nemá žádný vliv na destičky. Pro svou malou molekulu tlumí tedy pouze faktor Xa, a představuje tak poměrně bezpečný a navíc zcela homogenní glykosaminoglykan. Po subkutánním podání se kompletně a rychle vstřebává (absolutní biologická dostupnost je 100 %) [1].
V roce 2000 byly prezentovány výsledky 4 velkých prospektivních multicentrických studií (EPHESUS, PENTHIFRA, PENTAMAKS, PENTATHLON), srovnávajících efekt pentasacharidu oproti enoxaparinu ve skupinách pacientů s elektivními ortopedickými výkony. Celkově bylo vyhodnoceno téměř 7 000 nemocných. Pentasacharid v dávce 2,5 mg denně podávaný pooperačně byl v prevenci žilní tromboembolické nemoci účinnější než enoxaparin (o.d. RRR = 56 %) u nemocných se závažnými ortopedickými operacemi v oblasti dolních končetin. Při sledování krvácivých komplikací byl pentasacharid shledán stejně bezpečným jako enoxaparin [2,3]. Ve studii FLEXTRA bylo ověřováno, zda je oddálené podání fondaparinuxu po ortopedické operaci účinné a bezpečné u nemocných s elektivními náhradami kyčelního a kolenního kloubu. Prokázalo se, že účinnost fondaparinuxu není snížena oddálením podání léku následujícího dne po operaci [4]. Pentasacharidy byly zkoušeny i v ostatních indikacích, které dříve představovaly domény klasických glykosaminoglykanů: prevence a léčba žilní tromboembolie u interních, onkologických i obecně chirurgických pacientů, pacienti s kardiochirurgickými výkony, chronická hemodialýza aj. V chirurgii to byly studie PEGASUS a APOLLO. Ve studii PEGASUS byl podáván fondaparinux 2,5 mg jednou denně proti dalteparinu 2 500 j. před operací i po ní a stejná dávka fondaparinuxu proti vyšší dávce dalteparinu 5 000 j. před operací i po ní [5].
Léčba tromboembolické nemoci byla ověřena ve studiích MATISSE-PE, MATISSE-DVT, které prokázaly, že fondaparinux je bezpečný a účinný jako LMWH v léčbě hluboké žilní trombózy (DVT). Léčebná dávka je 7,5 mg s.c. denně. Dále je účinný při podávání 1krát denně s.c. a výhodný pro domácí léčbu DVT. Byla prokázána jeho bezpečnost a účinnost v počáteční léčbě plicní embolie (PE). Pro počáteční fáze PE je účinný při podávání 1krát denně s.c. a výhodný i pro domácí léčbu stabilních PE. Dále studie prokázala, že fondaparinux je bezpečný a účinný i pro nemocné nad 100 kg hmotnosti [6]. Pentasacharidy mohou být slibnými léky u heparinem indukované trombocytopenie, protože nevykazují zkříženou reaktivitu s jinými glykosaminoglykany. Mohou být přemosťujícím lékem před podáním specifické terapie.
Dabigatran etexilát
Dabigatran etexilát je představitelem nové generace perorálních antikoagulancií patřících mezi tzv. přímé inhibitory trombinu. Dabigatran má nízký potenciál lékových interakcí, je bez interakce s potravinami, navíc bez nutnosti pravidelných kontrol nebo úprav dávky [7]. Nově publikované příznivé výsledky studií u pacientů s akutní žilní tromboembolickou nemocí (RE-COVER) a nemocných s fibrilací síní ohrožených cévní mozkovou příhodou (RE-LY) přinesly další důkazy o účinnosti a bezpečnosti dabigatranu [8,9]. Dabigatran je v současné době indikován v prevenci žilní tromboembolické nemoci po náhradě kolenního kloubu (po dobu 10 dní) a kyčelního kloubu (28–35 dní) v doporučované dávce 220 mg jednou denně. Nově byl schválen i pro prevenci tromboembolie u nemocných s fibrilací síní.
Po perorálním podání je dabigatran etexilát rychle a úplně konvertován na dabigatran, který je účinnou formou v plazmě. Hydrolytické štěpení proléčiva dabigatran etexilátu na aktivní dabigatran, které je katalyzováno esterázou, představuje hlavní metabolickou reakci. Na rozdíl od antagonistů vitaminu K (warfarin), které působí variabilně přes různé koagulační faktory, dabigatran dosahuje jako přímý inhibitor trombinu silných antitrombotických účinků specifickou blokádou aktivity trombinu (volného i vázaného v trombech), který je klíčovým enzymem v procesu tvorby trombu. Dabigatran, podávaný v jedné denní dávce (220 mg), v prevenci TEN po elektivních náhradách kolenního a kyčelního kloubu se v žádném sledovaném ukazateli účinnosti a bezpečnosti nelišil od efektu referenčního nízkomolekulárního heparinu enoxaparinu. Potenciál dabigatranu je možné vidět zejména jako alternativu heparinů a pentasacharidů v krátkodobé i prodloužené profylaxi TEN po velkých ortopedických operacích, kdy bude výhodou možnost perorální aplikace. Výhodou dabigatranu je absence monitorování antikoagulačního efektu, jeho nevýhodou je zejména nedostupnost specifického antidota a vyšší cena [10,11].
Monitorování antikoagulačního účinku
Vzhledem k předvídatelnému farmakologickému profilu dabigatranu s fixním dávkováním není nutná laboratorní kontrola léčby, testy pro kvantitativní stanovení efektu dabigatranu (trombinový čas, haemoclot thrombin inhibitor test a ekarinový koagulační čas) jsou dostatečně senzitivní. V akutních situacích jsou aPTT (aktivovaný parciální tromboplastinový test) a trombinový čas nejčastěji dostupnými metodami pro monitorování antikoagulačního efektu dabigatranu, ale aPTT je méně senzitivní v supraterapeutických koncentracích dabigatranu. Jsou dostupná jen limitovaná klinická data o využití ACT (activated clotting time). Protrombinový čas (INR) je málo senzitivní test, a nemůže být tedy pro sledování působení dabigatranu doporučován [12].
U pacientů, kteří současně užívají dabigatran a amiodaron, je nutné snížit dávky dabigatranu na 150 mg denně. Není dostupné žádné specifické antidotum dabigatranu. V případě krvácivých komplikací musí být léčba přerušena a zjištěn zdroj krvácení. Protože se dabigatran vylučuje převážně renálně, musí být udržována adekvátní diuréza. Při vážném a život ohrožujícím krvácení je doporučeno zvážit podání krevních převodů, živočišného uhlí (pokud byl dabigatran podán do 2 hod), koncentrátu protrombinového komplexu, popř. je indikován rekombinantní faktor VIIa (rF VIIa ). Dabigatran je dialyzovatelný, proto lze tedy provádět hemodialýzu nebo hemofiltraci přes živočišné uhlí [13].
Účinnost a bezpečnost dabigatranu ve srovnání se stávající standardní léčbou je hodnocena v rámci rozsáhlého programu RE-VOLUTION u více než 38 000 pacientů a jeho součástí jsou studie zaměřené na následující problematiku:
- primární prevence žilní tromboembolické nemoci (TEN): studie RE-NOVATE, RE-NOVATE II, RE-MODEL a RE-MOBILIZE;
- akutní léčba TEN: studie RE-COVER a RE-COVER II;
- prevence cévní mozkové příhody a systémové embolizace u pacientů s fibrilací síní: studie RE-LY;
- sekundární prevence akutního koronárního syndromu: RE-DEEM (studie fáze II);
- sekundární prevence žilní trombózy a plicní embolie: studie RE-MEDY a RE-SONATE [14,15].
Rivaroxaban
Rivaroxaban je selektivní inhibitor Xa, který má rychlý nástup účinku (3 hod) a poločas účinku 9 hod. Váže se přímo na koagulační faktor Xa, a to prostřednictvím interakce mezi jeho centrálním oxazolidinonovým centrem a chlorothiofenovou a morfolinovou doménou. Rivaroxaban má duální vylučování. Vylučuje se z 65 % ledvinami a z 35 % biliární stolicí. Biologický poločas rivaroxabanu je při ustáleném stavu udáván v rozmezí mezi 5,7–9,2 hod, u seniorů pak 9–13 hod. K jeho výhodám patří to, že má minimální interakci s cytochromem P450, což vede k menší interakci s léky, které s cytochromem P450 vstupují do kontaktu. Ovlivňuje tromboplastinový test (INR) a méně také aktivovaný parciální tromboplastinový test (aPTT). Lze jej monitorovat také pomocí stanovení anti-Xa.
Farmakologicky je důležité, že inhibice faktoru Xa rivaroxabanem účinně předchází „explozi“ tvorby trombinu, tím předchází další potenciaci generace trombinu mechanizmem pozitivní zpětné vazby. Inhibice molekuly faktoru Xa může předejít aktivaci až 1 000 molekul trombinu. Inhibice trombinu interferuje s proteiny C a S1, dochází k depleci přirozených antikoagulancií. Přítomnost vyšších koncentrací trombinu je u nemocných sledována řadou nepříznivých okolností. Přetrvávající tvorba trombinu během léčby pacientů s AKS heparinem je asociována s recidivou koronárních příhod. Je známo, že přímé inhibitory trombinu na zvířecích modelech zhoršují DIC ve srovnání s přímými inhibitory faktoru Xa. Naopak přímé inhibitory faktoru Xa umožňují vznik malého množství trombinu, což vede k aktivaci proteinu C jako přirozeného inhibitoru koagulace [16].
Přímý inhibitor faktoru Xa rivaroxaban prošel čtyřmi studiemi, které srovnávaly perorálně podávaný rivaroxaban s enoxaparinem v prevenci žilní tromboembolické nemoci u nemocných s elektivními závažnými ortopedickými výkony. U ortopedických nemocných byly uskutečněny studie RECORD 1–4 u více než 11 000 nemocných, kteří dostávali 10 mg rivaroxabanu jednou denně ve srovnání s enoxaparinem, přičemž RECORD 1 a 2 srovnával rivaroxaban a enoxaparin u elektivních náhrad kyčelního kloubu a RECORD 3 a 4 u elektivních náhrad kolenního kloubu. Všechny studie měly podobný profil:
- a) potvrzení či vyloučení hluboké žilní trombózy zobrazovacími metodami;
- b) sledování četnosti nefatální symptomatické žilní trombózy na dolních končetinách po elektivních ortopedických výkonech;
- c) sledování četnosti nefatální symptomatické plicní embolie po elektivních ortopedických výkonech;
- d) sledování mortality ve skupinách léčených nemocných [17–20].
Dále byly uskutečněny 2 studie fáze II zaměřené k léčbě tromboembolické nemoci – studie EINSTEIN DVT a EINSTEIN PE, které srovnávaly rivaroxaban a enoxaparin současně s warfarinem u nemocných s prokázanou hlubokou žilní trombózou a prokázanou nemasivní plicní embolii. Studie měly okolo 3 000 nemocných a srovnávaly účinek rivaroxabanu 15 mg 2krát denně po dobu 21 dnů a dále s podáváním rivaroxabanu 20 mg 1krát denně 3, 6, resp. 12 měsíců, proti podávání enoxaparinu 2krát denně, nejméně 5 dnů, s následným podáváním warfarinu, u kterého bylo dávkování nastaveno na INR 2–3. Warfarin se podával po stejnou dobu jako rivaroxaban [21,22]. S rivaroxabanem byla recentně dokončena studie ROCKET AF, do níž bylo zařazeno 14 269 nemocných s fibrilací síní, a sledoval se účinek 20 mg rivaroxabanu 1krát denně proti warfarinu nastavěnému na INR 2,5 [23].
Ve studii RECORD 1 bylo analyzováno přes 4 400 nemocných, kteří byli randomizováni do 2 větví. První skupina nemocných s náhradou kyčelního kloubu užívala 10 mg rivaroxabanu p.o. 6–8 hod po operaci a druhá skupina 40 mg enoxaparinu s.c. 12 hod před operací pro prevenci tromboembolické nemoci. Rivaroxaban byl podáván 5 týdnů a enoxaparin rovněž 5 týdnů. Výsledky ukázaly dramatické snížení četnosti žilních tromboembolizmů u nemocných, kteří užívali 5 týdnů rivaroxaban. Primárním cílem studie bylo prokázat rozdíl v četnosti žilního tromboembolizmu. Ve skupině s rivaroxabanem mělo tromboembolickou komplikaci 13 nemocných a ve skupině s enoxaparinem 50 nemocných. Podání rivaroxabanu představovalo snížení relativního rizika o 70 % [19,20].
Nové protidestičkové léky
V první části bychom chtěli vysvětlit význam působků ovlivňujících aktivace krevních destiček, neboť nové léky s protidestičkovým účinkem působí blokováním těchto základních reakcí. Především inhibice agregace destiček stimulované ADP je směrem, kterým se ubírá moderní protidestičková terapie, snižující riziko arteriálních okluzí.
Aktivace krevních destiček je složitý regulovaný proces. Dochází k ní 2 cestami:
- a) aktivací adherovaných destiček,
- b) aktivací klidových destiček v plazmě pomocí induktorů.
Aktivaci destičky je možné chápat jako proces, který probíhá v těchto fázích: nejprve dojde k ligand-receptorové interakci, následuje přenos (transdukce) signálu do nitra krevní destičky a konečně specifická odpověď stimulované krevní destičky. Při aktivaci krevní destičky dochází uvnitř buňky k přesunům nitrobuněčného vápníku. Koncentrace volných vápenatých iontů uvnitř buňky výrazně stoupá, potom dochází ke změnám membránové struktury, při kterých jde o fenomén flip-flop přetočením membrány a poškození membrány s následnou tvorbou membránových mikročástic. Tyto děje vedou k odhalení membránových fosfolipidů vnitřních struktur membrány (PS – fosfatidylserin, PE – fosfatidyletanolamin).
Ke zvýšení koncentrace intracelulárních Ca iontů dochází 3 cestami:
- uvolněním rezervního poolu intracelulárního Ca2+ z denzního tubulárního systému,
- uvolněním rezervního poolu buněčného Ca2+ z mitochondrií,
- otevřením membránových výměníků – influx Ca2+ do buňky.
Vlivem metabolických změn v krevní destičce dojde k přetočení její membrány.
Následuje kontrakce kontraktilních proteinů, změna tvaru a tvorba pseudopodií (obvykle 5–6 výběžků), což vyžaduje přísun energie a mobilizaci Ca iontů. Změny tvaru destičky lze laboratorně sledovat imunofluorescenčními metodami nebo pomocí elektronového mikroskopu. Během sledu dalších změn dochází ke stabilizaci monomerů aktinu β4 thymosinem a následně jsou proteinem ARP 2,3 či profilinem polymerovány a opatřeny ochrannou čepičkou. Po stimulaci destiček a po uvolnění Ca2+ dojde ke konformační změně receptorového komplexu Gp IIb/IIIa a tím se vytvoří podmínky pro vazbu fibrinogenu.
Glykoproteinový komplex (GP) se řadí k destičkovým adhezivním integrinovým receptorům. Skládá se z domény intracelulární a domény extracelulární, která je tvořena 2 řetězci (α IIb a β3), a dále z transmembránové části. Ligandy pro GP IIb/IIIa jsou některé bílkoviny (fibrinogen, vWF, vitronectin a fibronektin). Na membráně klidových destiček je αIIbβ3 ve skloněné konformaci a místo, na které se váže ligand, není přístupné. Následná aktivace destičky agonisty vybudí intracelulární signál. Při konformační změně dochází k ovlivnění membránové fluidity a to vyvolá intracelulární signál prostřednictvím p 38 a TCP-1, který způsobí změnu tvaru destičky a sekreci obsahu granulí. Konformační změna integrinu αIIbβ3 vyvolá uvolnění obsahu α granulí přes kanálkový systém. Následuje uvolnění obsahu denzních granulí, uvolní se ADP a současně je zahájena syntéza tromboxanu A2 (TXA2). Prostagladiny se tvoří v procesech, při kterých dochází k uvolnění kyseliny arachidonové z membránových fosfolipidů deacylací fosfolipázami (PLA2). Uvolněný TXA2 působí jako aktivátor dalších destiček tím, že se váže na své specifické receptory na membráně destičky. Naopak prostacyklin (PGI2), produkovaný převážně endoteliálními buňkami, má efekt antiagregační a vazodilatační. Oba působky (ADP a TXA2) vyvolají další aktivaci ještě neovlivněných destiček, která vede k agregaci a jejich hromadění v místě poškození. Zvýšená nebo snížená funkce trombocytů může vést ke vratným nebo nevratným změnám ve formaci krevních destiček. Tyto změny jsou závislé na indukčním podnětu, který uvnitř trombocytu vyvolá následné metabolické procesy a odpovídající fyziologické děje [24,25].
Tab. 2 ukazuje, jaké jsou v současné době možnosti ovlivnění funkce krevních destiček, a tab. 3 ukazuje současné prostředky užívané v prevenci a léčbě arteriálních trombóz.
Table 2. Léčebné možnosti ovlivnění destičkových funkcí. 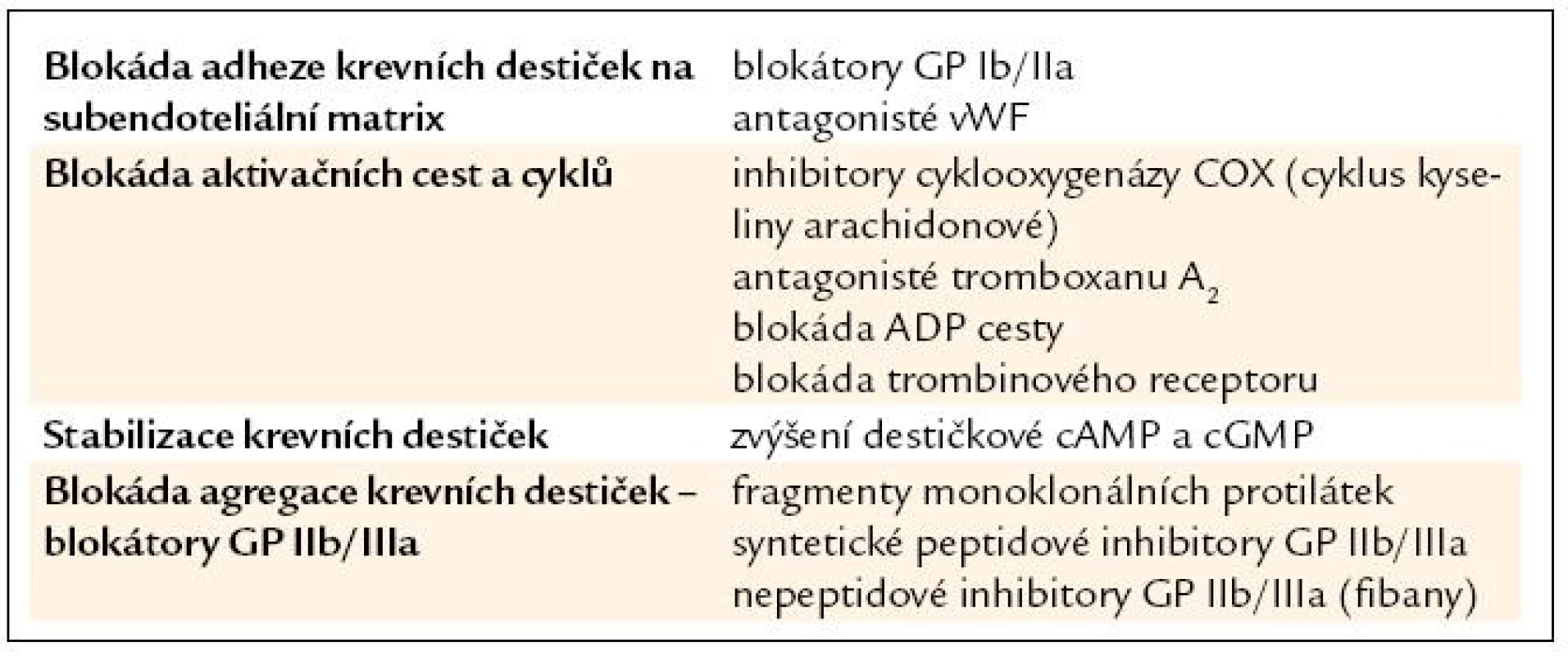
Table 3. Současné prostředky užívané v prevenci a léčbě arteriálních trombóz. 
K inhibici aktivačních cest a cyklů máme tato prostředky:
- inhibitory cyklu kyseliny arachi-donové:
- současná inhibice tromboxansyntetázy a blokace receptorů pro TXA2,
- inhibice cyklooxygenázy-1;
- inhibitory receptorů induktorů agregace krevních
destiček: selektivní
inhibitory (inhibují 1 receptor):
- blokátory receptoru pro ADP,
- blokátory receptoru pro trombin.
Komplexní inhibitory (inhibují více receptorů najednou).
První a druhá generace thienopyridinů
Thienopyridiny blokují ADP a nepřímo inhibují vazbu na fibrinogen pomocí receptoru GP Ib/IIIa, ale na samotný receptor GP IIb/IIIa přímo nepůsobí. Výsledkem je inhibice ADP indukované agregace trombocytů, která tlumí efektivně agregaci vyvolanou ADP z 50–60 % a plně se projevuje po 4–6 dnech. Thienopyridiny blokují uvolňování ADP z denzních granulí destiček, tím blokují sekundární agregaci vyvolanou Ca ionty a serotoninem a působky uvolněnými z velmi denzních granulí (α) (trombospodin a fibrinogen) [26].
Ticlopidin a Clopidogrel (II. generace thienopyridinů)
Oba léky jsou tzv. pro léčiva. K jejich efektu je nutná aktivace cytochromu (CYP) P-450. Jsou metabolizovány na aktivní metabolity, kdy se uvolní tiolová skupina. Vlastní receptor je tímto tiolem navázán. Díky této kovalentní vazbě je účinek dlouhodobý, trvající řádově týden. Po aktivaci se vážou na receptor P2Y12, který se na rozdíl od P2Y1 účastní pozdějších fází aktivace trombocytu a exprese GP receptoru IIb/IIIa a tím blokují agregaci indukovanou ADP. Dochází tak k nepřímému ovlivnění vazby fibrinogenu na GP IIb/IIIa. Thienopyridiny neovlivňují agregaci provokovanou kolagenem a trombinem a neovlivňují syntézu prostaglandinů. Díky relativně pomalé biotransformaci v játrech je nástup účinku thienopyridinů opožděn. Při srovnání s ASA jsou thienopyridiny účinnější (CAPRIE), nicméně většího účinku dosáhneme jejich kombinací (CURE). Vzájemné srovnání ticlopidinu a clopidogrelu ukazuje větší bezpečnost clopidogrelu (zejména ve výskytu neutropenií a trombotické trombocytopenické purpury). V současnosti je ticlopidin prakticky nahrazen clopidogrelem.
Novinkou je zjištění, že podobně jako na ASA, je známa rezistence na clopidogrel. Ta je definována výrazně sníženou inhibiční odpovědí na agregaci destiček indukovanou ADP.
Příčinou rezistence na clopidogrel je genetická varianta CYP2C19*2 a tato varianta je pokynem ke zvýšení dávky clopidogrelu [24].
Prasugrel (III. generace thienopyridinů)
Prasugrel je rovněž pro léčivo a k jeho konverzi na aktivní metabolit je také potřeba CYP 450. Tato závislost je však nižší než u clopidogrelu. Jeho hlavní výhodou je rychlejší nástup účinku díky rychlejší konverzi na aktivní metabolit. Vazba na receptor není kovalentní, ale pouze kompetitivní, efekt je tak krátkodobější a dá se snáze předpovídat. Aktivní metabolit se objevuje v cirkulaci již za 15 min. Prasugrel má nízkou interindividuální variabilitu v inhibici P2Y12. Jeho výhodou je nízká rezistence. Inhibiční efekt lze sledovat laboratorně in vitro testy (VASP, agregometrie).
Klinický význam prasugrelu dokumentují studie. Ve studii PRINCIPLE-TIMI 44 se prasugrel ukázal jako lepší než clopidogrel u nemocných s katetrizačními intervencemi v koronárním řečišti. Významnější inhibice agregace destiček je výhodná při posuzování rizika arteriální trombózy, na druhé straně je významnějším rizikem pro krvácivé komplikace. To prokázala studie TRITON-TIMI 38, ve které bylo u nemocných s ICHS po perkutánních koronaroplastikách, ve srovnání s clopidogrelem, více krvácení po prasugrelu (obr. 1) [27].
Image 1. Clopidogrel a Prasugrel, chemická struktura. 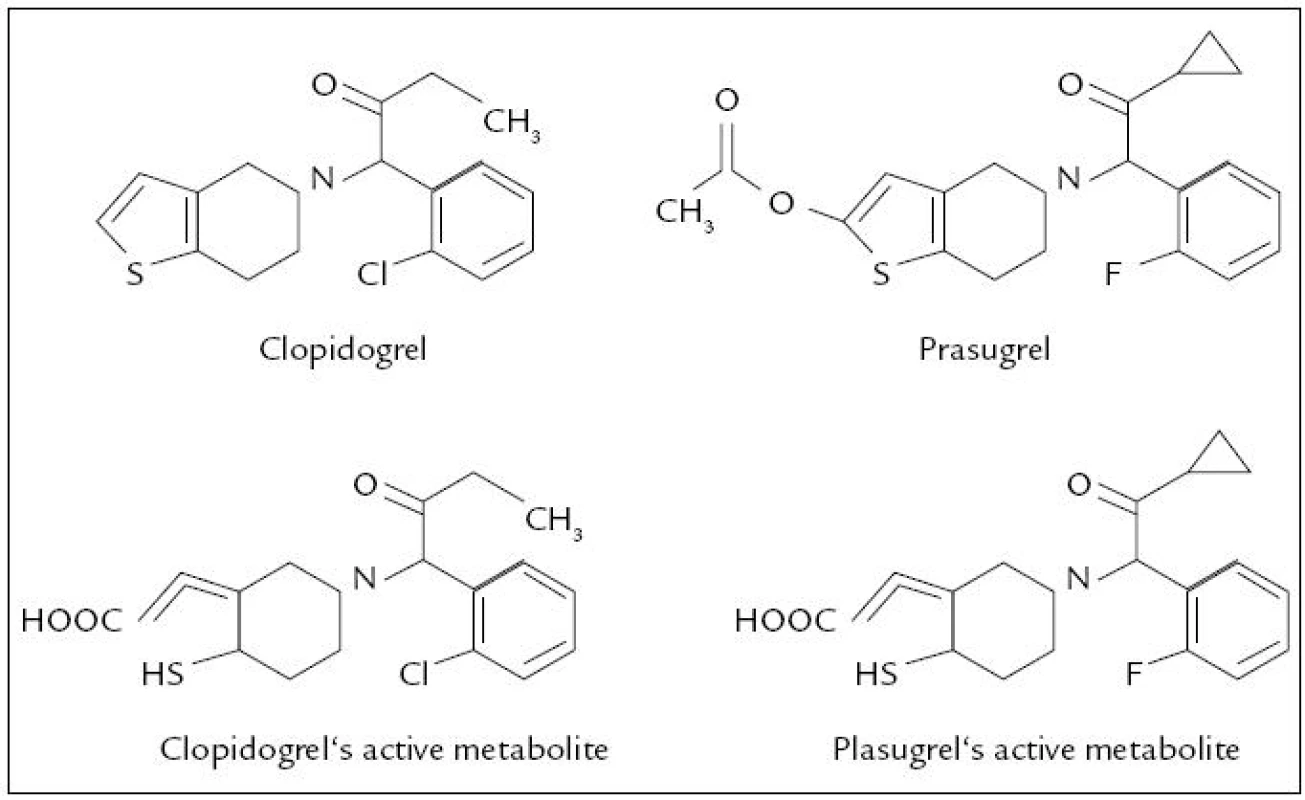
Cangrelor a Ticagrelor
Příkladem blokátoru ADP receptorů II. generace je cangrelor a ticagrelor.
Cangrelor (AR-C69931MX) je přímý antagonista P2Y12, nepotřebuje změnu na aktivní metabolit a při i.v. podání má poločas 3–6 min. Cangrelor se zkouší hlavně u nemocných s PCI. Ve studiích CHAMPION PCI, CHAMPION PLATFORM a BRIDGE non inferiorita bylo demonstrováno, že účinnost cangreloru (za použití standardních ostatních léčebných postupů) je výhodnější než použití standardní léčby PCU, při použití kompozitu úmrtí na všechny stavy, srdečního infarktu a ischemie vyvolané revaskularizací. Obě studie byly ukončeny předčasně pro klinickou neefektivitu cangreloru. Cangrelor je pozorován ve studiích sledujících přemostění mezi thienopyridiny a revaskularizací [28].
Ticagrelor (AZD6140) je perorální, selektivní antagonista P2Y12. Chemicky jde ocyclopentyl-triazolo-pyrimidin. Je zajímavé, že jde o reverzibilní inhibitor ADP P2Y12 receptoru, který je metabolicky aktivní. Potřebná dávka je 180 mg a maximální koncentrace v plazmě dosahuje za 1–3 hod. Eliminace je od 6 do 13 hod.
Srovnání ticagreloru s clopidogrelem. Ve studii DISPERSE bylo 200 nemocných s ICHS léčeno aspirinem a ticagrelorem v různých dávkách a srovnáváno s kombinací ASA a clopidogrel. Byla prokázána rychlejší inhibice destičkových funkcí ve skupině s ticagrelorem. A nebyly výraznější krvácivé komplikace.
Studie DISPERSE-2 ukázala, že ticagrelor inhibuje destičkové funkce v závislosti na dávce. Studie PLATO srovnávala ticagrelor s clopidogrelem u nemocných s koronárními syndromy a následnými koronárními intervencemi. Prokázala v primárním endpointu (kompozit úmrtí na cévní onemocnění, srdeční infarkt a iktus), že ticagrelor je lepší než clopidogrel, ale má zároveň mírně zvýšení riziko krvácení [29] (obr. 2).
Image 2. Cangrelor a Ticagrelor, chemická struktura. 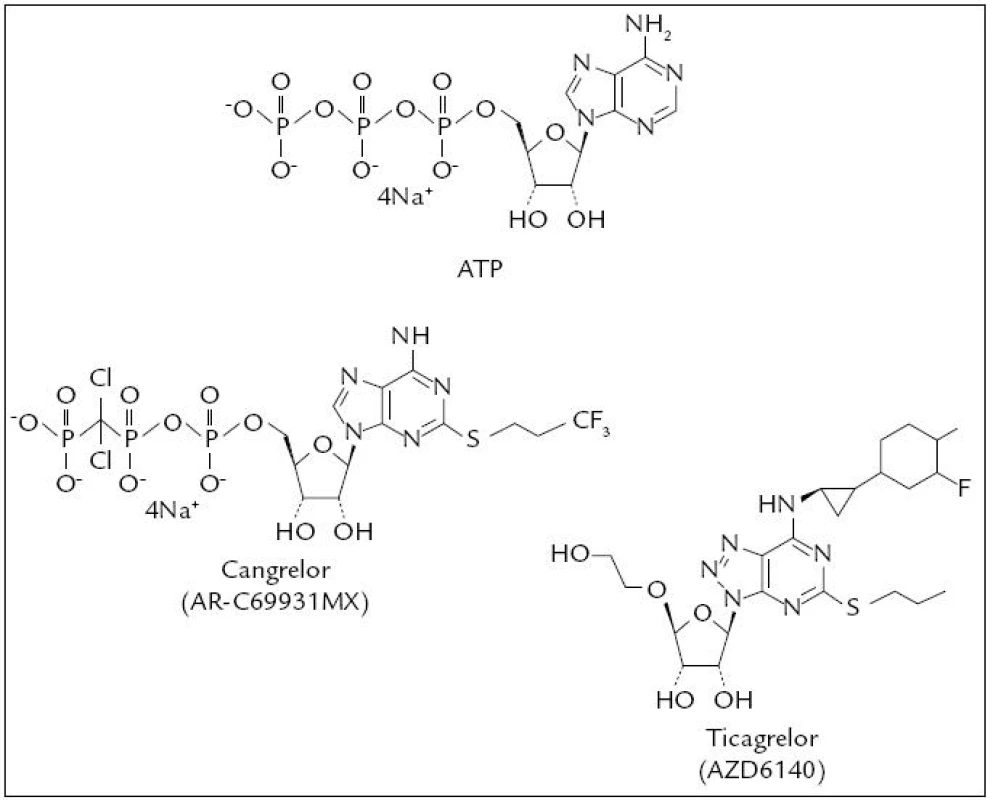
Elinogrel (PRT060128 or PRT128) je přímý reverzibilní inhibitor P2Y12, který je v intravenózní i perorální formě. Dobře se absorbuje a jeho plazmatický poločas je 12 hod. Kompletní inhibice P2Y12 se objevuje již při dávce 20 mg. Elinogrel je studován v klinických studiích fáze II. ERASE-MI, NCT00546260, ve kterých je sledována tolerance perorálního podání u nemocných se srdečním infarktem, a INOVATE-PCI, NCT00751231, kde se sleduje perorální a intravenózní elinogrel vs clopidogrel u nemocných s neurgentní PCI [28].
Další protidestičkové léky jsou ve studiích fáze I. Jde o nové léky:
- Thromboxane receptor antagonist: S18886,
- Thrombin receptor antagonists: E555 and SCH-530348,
- Nitric oxide-releasing aspirin: NCX-4016,
- Platelet adhesion antagonists: ARC1779 – antagonist of vWF, the ligand for receptor GP Ib,
- inhibitor trombinem indukovaná agregace – voraxapar,
- inhibitor kolagenem a ristocetinem aktivovaných destiček (DZ-697b) [28].
prof. MUDr. Jaroslav Malý, CSc.
www.fnhk.cz
e-mail: maly@lfhk.cuni.czDoručeno do redakce: 15. 5. 2011
Sources
1. Walenga JM, Jeske WP, Bara L et al. Biochemical and pharmacologic rationale for the development of a synthetic heparin pentasaccharide. Thromb Res 1997; 86 : 1–36.
2. Turpie AG, Bauer KA, Eriksson BI et al. Fondaparinux vs enoxaparin for the prevention of venous thromboembolism in major orthopedic surgery: a meta-analysis of 4 randomized double-blind studies. Arch Intern Med 2002; 162 : 1833–1840.
3. Singelyn FJ, Verheyen CC, Piovella F et al. EXPERT Study Investigators. The safety and efficacy of extended thromboprophylaxis with fondaparinux after major orthopedic surgery of the lower limb with or without a neuraxial or deep peripheral nerve catheter: the EXPERT Study. Anesth Analg 2007; 105 : 1540–1547.
4. Colwell CW Jr, Kwong LM, Turpie AG et al. Flexibility in administration of fondaparinux for prevention of symptomatic venous thromboembolism in orthopaedic surgery. J Arthroplasty 2006; 21 : 36–45.
5. Agnelli G, Bergqvist D, Cohen AT et al. PEGASUS investigators. Randomized clinical trial of postoperative fondaparinux versus perioperative dalteparin for prevention of venous thromboembolism in high-risk abdominal surgery. Br J Surg 2005; 92 : 1212–1220.
6. Büller HR, Davidson BL, Decousus H et al. Matisse Investigators. Fondaparinux or enoxaparin for the initial treatment of symptomatic deep venous thrombosis: a randomized trial. Ann Intern Med 2004; 140 : 867–873.
7. Gustafsson D. Oral direct thrombin inhibitors in clinical development. J Intern Med 2003; 254 : 322–334.
8. Schulman S, Kearon C, Kakkar AK et al. RE-COVER Study Group. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009; 361 : 2342–2352.
9. Connolly SJ, Ezekowitz MD, Yusuf S et al. RE-LY Steering Committee and Investigators: Dabigatran versus Warfarin in Patients with Atrial Fibrillation. N Engl J Med 2009; 361 : 1139–1151.
10. Karetová D, Bultas J. Nová antikoagulancia v prevenci a léčbě kardiovaskulárních chorob. Postgrad Med 2010; 1 : 72–77.
11. Ruff CT, Giugliano RP. New oral antithrombotic strategies. Hot Topics Cardiol 2009; 18 : 7–14.
12. van Ryn J, Stangier J, Haertter S et al. Dabigatran etexilate – a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost 2010; 103 : 1116–1127.
13. Stangier J, Stähle H, Rathgen K et al. Pharmacokinetics and pharmacodynamics of the direct oral thrombin inhibitor dabigatran in healthy elderly subjects. Clin Pharmacokinet 2008; 47 : 47–59.
14. Eriksson BI, Dahl OE, Rosencher N et al. RE-MODEL Study Group. Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial. J Thromb Haemost 2007; 5 : 2178–2185.
15. Eriksson BI, Dahl OE, Rosencher N et al. RE-NOVATE Study Group. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomised, double-blind, non-inferiority trial. Lancet 2007; 370 : 946–956.
16. Lohrmann J, Becker RC. New anticoagulants – the path from discovery to clinical practice. N Engl J Med 2008; 358 : 2827–2829.
17. Eriksson BI, Borris LC, Friedman RJ et al. RECORD1 Study Group. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358 : 2765–2775.
18. Lassen MR, Ageno W, Borris LC et al. RECORD3 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008; 358 : 2776–2786.
19. Kakkar AK, Brenner B, Dahl OE et al. RECORD 2 investigators. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomized controlled trial. Lancet 2008; 372 : 31–39.
20. Turpie AGG, Lassen MR, Davidson BL et al. RECORD4 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD4): a randomised trial. Lancet 2009; 373 : 1673–1680.
21. Darius H. Oral rivaroxaban versus standard therapy for the acute and treatment ofsymptomatic deep vein thrombosis. The EINSTEIN DVT study. http://www.escardio.org/congresses/esc-2010/congress-reports/Documents/Tuesday/EINSTEIN-DVTdiscussant-slides-Darius.pdf.
22. Buller HR. Once-Daily Oral Rivaroxaban Versus Placebo in the Long-Term Prevention of Recurrent Symptomatic Venous thromboembolism. The Einstein-Extension Study. http://ash.confex.com/ash/2009/webprogram/Pap.
23. Mahaffey KW, Fox KAA. ROCKET AF Investigators. Rivaroxaban Once-daily oral direct factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation. https://www.dcri.org/news-publications/.
24. Varon D, Spectre G. Antiplatelet agents. Hematology Am Soc Hematol Educ Program 2009; 1 : 267–272.
25. Broos K, Feys HB, De Meyer SF et al. Platelets at work in primary hemostasis. Blood Rev 2011; 25 : 155–167.
26. Cattaneo M. ADP receptors antagonists. In: Michelson AD (ed.). Platelets. 2nd ed. San Diego, Calif: Academic Press 2006 : 1127–1144.
27. Cattaneo M, Lecchi A. Inhibition of the platelet P2Y12 receptor for adenosine diphosphate potentiates the antiplatelet effect of prostacyclin. J Thromb Haemost 2007; 5 : 577–582.
28. Cattaneo M. New P2Y12 Inhibitors. Circulation 2010; 121 : 171–179.
29. Abergel E, Nikolsky E. Ticagrelor: an investigational oral antiplatelet treatment for reduction of major adverse cardiac events in patients with acute coronary syndrome. Vasc Health Risk Manag 2010; 6 : 963–977.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 9-
All articles in this issue
- Předoperační vyšetření u nemocných před nekardiálním chirurgickým výkonem
- Současný pohled na léčbu hypertenze v těhotenství
- Nová antitrombotika v prevenci žilní tromboembolie a nové protidestičkové léky
- Cílená biologická léčba solidních nádorů
- Proteinurie v ambulantní praxi
- Význam antihypertenzní léčby u subklinického poškození mozku
- Polypragmazie a lékové interakce
- Existuje vztah mezi léčbou diabetu a vznikem nádorů?
- Kombinovaný trénink u mužů s metabolickým syndromem po akutní koronární příhodě
- Diagnostika sekundární hypertenze v ambulantní praxi
- FARIM – FARmakoterapie po Infarktu Myokardu
- Tyreopatie v ambulantní praxi
- Česká angiologie a její proměny
- Dráždivý tračník
- Biologická léčba v dermatologii – psoriáza
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Nemoci jater v interní ambulanci
- Arytmologie dnes: rizika antiarytmické terapie v interní ambulanci
- Terapie stabilní chronické obstrukční plicní nemoci (CHOPN) a její případná kardiovaskulární rizika (základní přehled)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Proteinurie v ambulantní praxi
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Polypragmazie a lékové interakce
- Tyreopatie v ambulantní praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

